-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pětileté výsledky IMRT karcinomu prostaty – kontrola nádoru
Five-Year Results of IMRT for Prostate Cancer – Tumor Control
Background:
Intensity-modulated radiation therapy (IMRT) is the method of choice in external-beam radiotherapy tolocalized prostate cancer. This work analyses five year results of IMRT with a dose of 78/82 Gy.Patients and Methods:
From June 2003 to December 2007, the IMRT technique was employed to treat 233 patients with T1-3 N0 M0 prostate cancer. It was supplemented by hormone therapy especially in high-risk patients. Two IMRT techniques were applied – IMRT with a dose of 78 Gy in 39 fractions to prostate and seminal vesicles (SV) (IMRT 78) and IMRT with simultaneous integrated 82 Gy boost to prostate concurrently with 73,8 Gy in 41 fractions to SV (IMRT SIB 82). The IMRT 78 technique was used in 160 patients (69%). Seventy-three (31%) patients with intermediate (IR) or high-risk (HR) prostate cancer without SV involvement were treated with IMRT SIB 82 technique. The PSA relapse was defined as an increase in PSA of at least 2.0 ng/mL above the nadir or in comparison to the value at the initiation of hormone therapy. Clinical relapse was defined as an occurence of distant metastases and/or local recurrence.Results:
The median follow-up of our patients´ population was 4.3 years (range 0.6–8.9 years). The estimated 5-year PSA relapse-free survival in low-risk (LR), IR and HR patients was 86%, 89% and 83%, respectively (p = NS). In a multivariate analysis, Gleason score (GS) 8–10 was associated with significantly higher risk of PSA relapse (RR 2.76), while higher age at the time of diagnosis significantly decreased the PSA relapse risk (RR 0.94). The estimated 5-year clinical relapse-free survival in LR, IR and HR patients was 100%, 99% and 95%, respectively (p = NS). In a univariate analysis, both GS and PSA had a significant impact on the 5-year clinical relapse-free survival – GS 2–7 97 % vs GS 8–10 88 % (p = 0.03), PSA ≤ 20 98 % vs PSA > 20 85 % (p < 0.01).Conclusion:
Treatment of localized prostate cancer using IMRT with a dose 78/82 Gy yielded an excellent 5-year tumour control with a risk of clinical relapse being less than 5%.Key words:
prostate cancer – radiation therapy – IMRT
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
3. 6. 2013Accepted:
12. 6. 2013
Autoři: Odrážka K.- 1 4; M. Doležel 1,2,5; J. Vaňásek 1; M. Vaculíková 6; M. Zouhar 7; J. Šefrová 8,9; P. Paluska 7; M. Vošmik 7
; T. Kohlová 10; I. Kolářová 1; M. Broďák 11; P. Navrátil 11; P. Prošvic 12; P. Hoffmann 13; A. Hafuda 12
Působiště autorů: Oddělení klinické a radiační onkologie, Multiscan, Pardubická krajská nemocnice, Pardubice 1; 1. LF UK v Praze 2; 3. LF UK v Praze 3; Katedra radiační onkologie IPVZ, Praha 4; LF UP v Olomouci 5; Onkologické oddělení, Oblastní nemocnice Trutnov 6; Klinika onkologie a radioterapie, FN Hradec Králové 7; Onkologická ambulance, Nemocnice Prachatice, a. s. 8; Hospic sv. Jana N. Neumanna, Prachatice 9; Oddělení nukleární medicíny, FN Hradec Králové 10; Urologická klinika, FN Hradec Králové 11; Urologické oddělení, Oblastní nemocnice Náchod 12; Radiologická klinika, FN Hradec Králové 13
Vyšlo v časopise: Klin Onkol 2013; 26(6): 415-420
Kategorie: Původní práce
Souhrn
Východiska:
Radioterapie s modulovanou intenzitou (IMRT) je preferovanou metodou zevní radioterapie lokalizovaného karcinomu prostaty. Vyhodnotili jsme 5leté výsledky IMRT s dávkou 78/82 Gy.Soubor pacientů a metody:
V období červen 2003 až prosinec 2007 jsme IMRT technikou léčili 233 pacientů s karcinomem prostaty T1-3 N0 M0. Hormonální léčba byla podávána především u pacientů s vysokým rizikem. Použili jsme dvě IMRT techniky – IMRT s dávkou 78 Gy/39 frakcí na prostatu a semenné váčky (SV) – IMRT 78 – a IMRT se simultánním integrovaným boostem s dávkou 82 Gy/41 frakcí na prostatu a současně 73,8 Gy/41 frakcí na SV (IMRT SIB 82). Technika IMRT 78 byla použita u 160 pacientů (69 %), technika IMRT SIB 82 u 73 pacientů (31 %) se středním (IR) či vysokým rizikem (HR) bez postižení SV. PSA relaps byl definován jako zvýšení PSA minimálně o 2,0 ng/ml oproti nadiru nebo zahájení hormonální léčby. Klinický relaps byl definován jako přítomnost lokální recidivy a/nebo distančních metastáz.Výsledky:
Medián sledování souboru pacientů byl 4,3 roku (rozmezí 0,6–8,9 roku). Odhadované 5leté přežití bez PSA relapsu u pacientů s nízkým rizikem (LR), IR a HR bylo 86 %, 89 %, resp. 83 % (p = NS). V multivariační analýze je Gleason skóre (GS) 8–10 spojeno s významně vyšším rizikem PSA relapsu (RR 2,76), zatímco vyšší věk v době diagnózy riziko PSA relapsu významně snižuje (RR 0,94). Odhadované 5leté přežití bez klinického relapsu u LR, IR a HR pacientů bylo 100 %, 99 %, resp. 95 % (p = NS). GS a PSA měly v univariační analýze významný vliv na 5leté přežití bez klinického relapsu – GS 2–7 97 % vs GS 8–10 88 % (p = 0,03), PSA ≤ 20 98 % vs PSA > 20 85 % (p < 0,01).Závěr:
Léčba lokalizovaného karcinomu prostaty metodou IMRT 78/82 Gy přinesla u našich pacientů výborné 5leté onkologické výsledky s rizikem klinického relapsu < 5 %.Klíčová slova:
karcinom prostaty – radioterapie – IMRTÚvod
Pokročilé konformní ozařovací techniky – trojrozměrná konformní radioterapie (3D-CRT) a radioterapie s modulovanou intenzitou (intensity modulated radiation therapy – IMRT) jsou v současnosti standardem v zevní radioterapii lokalizovaného karcinomu prostaty. 3D-CRT prokázala v randomizovaných studiích, že eskalace dávky záření přinese vyšší lokální kontrolu nádoru, ovšem za cenu zvýšení toxicity [1–3]. IMRT vykazuje v porovnání s 3D-CRT vyšší míru konformity dávkové distribuce, což se projevuje lepším šetřením zdravých tkání v okolí cílového objemu. Staffurth sumarizoval výsledky studií, které porovnávaly chronickou toxicitu u pacientů léčených IMRT a 3D-CRT a uvádí průměrnou incidenci gastrointestinální (GI) toxicity 2. a vyššího stupně 6 % vs 15 % [4]. Obě metody konformní radioterapie umožňují bezpečnou eskalaci dávky na úroveň 78 Gy, avšak IMRT je v porovnání s 3D-CRT výhodnější, protože významně redukuje především riziko pozdní GI toxicity. V USA se zastoupení IMRT v radioterapii karcinomu prostaty zvýšilo z 1 % v roce 2000 na 70 % v roce 2007 [5]. Retrospektivní data svědčí o proveditelnosti IMRT s ultravysokou dávkou ≥ 81 Gy [6,7]. Nicméně je třeba počítat s nárůstem pozdní genitourinární (GU) toxicity.
Pomocí IMRT lze aplikovat různě velké dávky záření do různých cílových objemů současně – simultánní integrovaný boost (SIB). Otevírá se tak možnost cíleně navýšit dávku v oblastech, kde předpokládáme větší rozsah nádorového postižení (makroskopické postižení) ve srovnání s oblastmi s menším rozsahem nádoru (mikroskopické postižení). Cílovými objemy s diferencovanou dávkou tak mohou být prostata – semenné váčky (SV) nebo intraprostatická léze – zbytek prostaty a SV. Časné výsledky IMRT SIB potvrdily proveditelnost metody a přijatelnou toxicitu [8,9].
Vyhodnotili jsme 5leté výsledky IMRT a IMRT SIB u našich pacientů s lokalizovaným karcinomem prostaty.
Soubor pacientů a metody
Charakteristika souboru
V období od června 2003 do prosince 2007 byli na Klinice onkologie a radioterapie FN Hradec Králové léčeni IMRT technikou 233 pacienti s karcinomem prostaty (tab. 1). Jednalo se o pacienty s lokalizovaným onemocněním, bez klinických či chirurgických známek postižení uzlin, bez klinických známek distančních metastáz – stadium T1-3 N0 (pN0) M0. Technika IMRT SIB s dávkou 82 Gy byla zavedena v roce 2005 a byla používána u pacientů se středním (IR) či vysokým rizikem (HR) bez postižení SV. Hormonální léčba byla podávána u HR pacientů – neoadjuvantní hormonální léčba (LHRH analog + antiandrogen šest měsíců). Pacienti s Gleason skóre (GS) 8–10 dostali navíc adjuvantní hormonální léčbu (LHRH analog 2–3 roky nebo oboustranná orchiektomie). Všichni pacienti podepsali před léčbou informovaný souhlas.
Tab. 1. Charakteristika souboru. 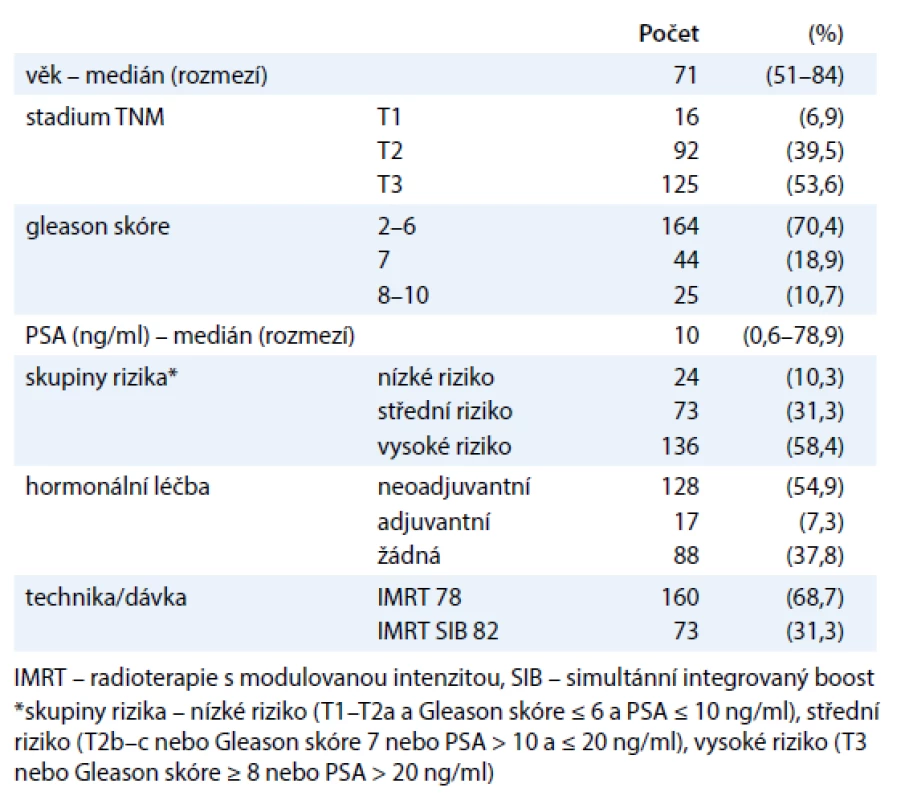
IMRT
Podrobně jsme o plánování IMRT referovali v minulosti [9,10]. Pacienti byli plánováni a léčeni v poloze na zádech s vakuovou podložkou nebo podložkou pod kolena a nohy (Vac-Lok/Dual Leg Positioner Cushion, MED-TEC) k imobilizaci dolních končetin a pánve. Všechny ozařovací plány byly vyhotoveny v 3D plánovacím systému s inverzním plánováním (CadPlan R.6.3.6. s modulem Helios//Eclipse 7.3, Varian). Použili jsme dvě IMRT techniky – IMRT s dávkou 78 Gy (IMRT 78) a IMRT se simultánním integrovaným boostem s dávkou 82/73,8 Gy (IMRT SIB 82). Klinický cílový objem (clinical target volume – CTV) u techniky IMRT 78 zahrnoval prostatu a bázi SV/celé SV při jejich postižení. PTV byl vytvořen přidáním izotropního lemu 10 mm. U techniky IMRT SIB 82 byl CTV1 tvořen prostatou, zatímco CTV2 odpovídal SV. PTV1 a PTV2 byly vytvořeny přidáním izotropního lemu 10 mm. Rektum a močový měchýř (popř. sigma a ileum) byly konturovány v úrovni PTV a 1 cm nad/pod úroveň PTV. Pacienti byli ozařováni technikou pěti koplanárních polí (45°, 100°, 180°, 260°, 315°). Modulované svazky byly ozářeny pomocí MLC metodou „sliding window“. Abychom dosáhli optimální distribuce dávky, použili jsme sadu limitů – maximální dávka 107%; minimálně 95% PTV obdrží 95% předepsané dávky; maximálně 25 % objemu rekta obdrží dávku 70 Gy (Rvol 70 ≤ 25 %), Rvol 75 ≤ 15 % a současně 15 cm3; pro močový měchýř Bvol 70 ≤ 35 %. Předepsaná dávka byla specifikována do izocentra (přibližně střed prostaty). U techniky IMRT 78 byla předepsaná dávka 78 Gy, 39 frakcí, dávka na frakci 2 Gy, jedna frakce denně, pět dní v týdnu. U techniky IMRT SIB 82 byla předepsaná dávka 82 Gy (PTV1), resp. 73,8 Gy (PTV2), 41 frakcí, dávka na frakci 2 Gy, resp. 1,8 Gy, jedna frakce denně, pět dní v týdnu. K ozařování byl použit lineární urychlovač s energií fotonů 6 MV (Clinac 600 C, Varian). Verifikace nastavení byla prováděna 1krát týdně pomocí portálového zobrazení.
Cílové ukazatele a statistika
PSA relaps byl v souladu s ASTRO Phoenix doporučením definován jako zvýšení PSA o 2,0 ng/ml anebo více oproti nadiru. Jako PSA relaps byly klasifikovány následující situace, i když ASTRO Phoenix kritérium nebylo naplněno – zahájení hormonální léčby, lokální recidiva, distanční metastázy. Klinický relaps byl definován jako přítomnost lokální recidivy a/nebo distančních metastáz. Pravděpodobnost PSA relapsu, klinického relapsu a smrti v průběhu času byla odhadována metodou Kaplana a Meiera. Rozdíly mezi podskupinami byly zkoumány pomocí log-rank testu. Pro multivariační analýzu prognostických faktorů byla použita Coxova regrese.
Výsledky
Medián sledování souboru pacientů byl 4,3 roku (rozmezí 0,6–8,9 roku). PSA relaps byl zaznamenán u 32 pacientů – relaps dle ASTRO Phoenix kritérií 24 případy, relaps z důvodu nasazení hormonální léčby osm případů. Klinický relaps jsme diagnostikovali u devíti pacientů – lokální recidiva čtyři případy, distanční metastázy tři případy, lokální recidiva a distanční metastázy dva případy. Zemřeli 23 pacienti, přičemž karcinom prostaty byl příčinou smrti u pěti z nich.
Odhadované 5leté celkové přežití v souboru 233 pacientů bylo 89 %. Odhadované 5leté přežití bez PSA relapsu v celém souboru pacientů bylo 85 % a rozdíly mezi jednotlivými stupni rizika nebyly významné (graf 1). Rozdíly v 5letém přežití bez PSA relapsu v podskupinách pacientů byly následující: T1-2 88 % vs T3 84 % (p = 0,20); GS 2–7 87 % vs GS 8–10 72 % (p = 0,02) (graf 2); PSA ≤ 20 87 % vs PSA > 20 75 % (p = 0,02). Multivariační analýza ukázala, že 5leté přežití bez PSA relapsu významně ovlivňují GS a věk v době stanovení diagnózy (tab. 2). GS 8–10 a nižší věk znamenají vyšší riziko PSA relapsu. Pětileté přežití bez PSA relapsu u pacientů se středním/vysokým rizikem bylo 86 % při dávce 78 Gy, resp. 84 % při dávce 82 Gy (p = 0,87). Omezíme-li porovnání IMRT 78 a IMRT SIB 82 na skupinu se středním rizikem, 5 let bez PSA relapsu bylo 88 % pacientů, resp. 94 % pacientů (p = 0,68).
Graf 1. Přežití bez PSA relapsu. 
Graf 2. Přežití bez PSA relapsu dle GS. 
Tab. 2. Multivariační analýza prognostických faktorů – přežití bez PSA relapsu. 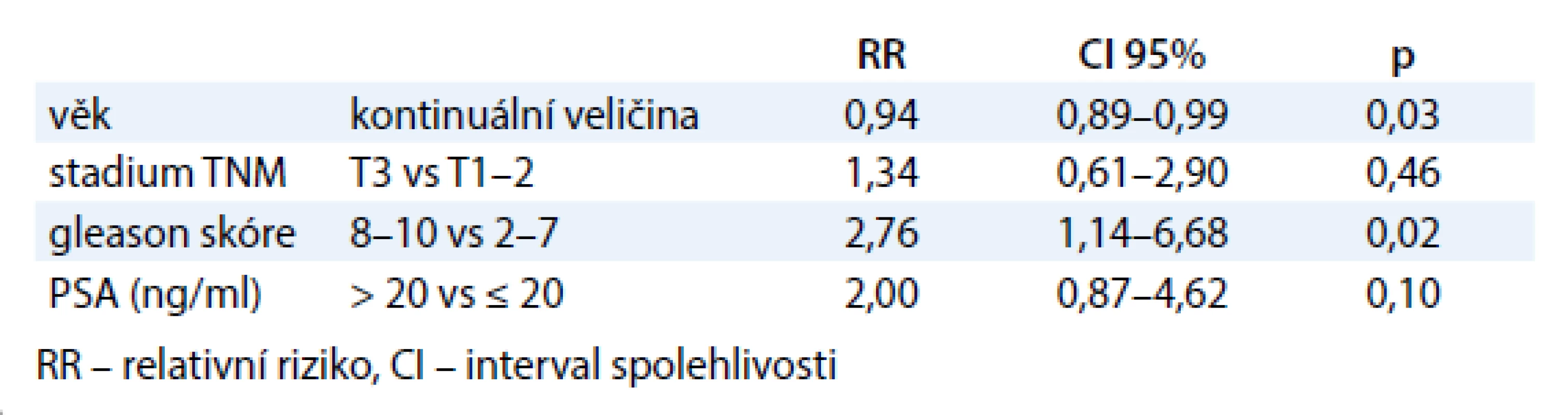
Odhadované 5leté přežití bez klinického relapsu v celém souboru pacientů bylo 96 % a rozdíly mezi jednotlivými stupni rizika nebyly významné (graf 3). Rozdíly v 5letém přežití bez klinického relapsu v podskupinách pacientů byly následující: T1-2 98 % vs T3 95 % (p = 0,11); GS 2–7 97 % vs GS 8–10 88 % (p = 0,03); PSA ≤ 20 98 % vs PSA > 20 85 % (p < 0,01) (graf 4). Pětileté přežití bez klinického relapsu u pacientů se středním/vysokým rizikem bylo 96 % jak při dávce 78 Gy, tak při dávce 82 Gy (p = 0,89).
Graf 3. Přežití bez klinického relapsu. 
Graf 4. Přežití bez klinického relapsu dle PSA. 
Diskuze
Klinický přínos eskalace dávky záření u karcinomu prostaty na úroveň ≥ 75 Gy prokázaly randomizované i retrospektivní studie [2,3,7]. Vyšší dávka je spojená s vyšší biochemickou kontrolou, vyšší lokální kontrolou a nižším rizikem rozvoje distančních metastáz. Thames et al analyzovali vliv celkového času a dávky radioterapie u 4 338 pacientů s karcinomem prostaty [11]. Pokud byla aplikována dávka přesahující 70 Gy, došlo k relativnímu snížení biochemických relapsů o 15 % při navýšení dávky o 6 Gy. Význam eskalace dávky pro lokální kontrolu dokládají výsledky biopsií prostaty 2,5 roku po radioterapii [12]. Ve skupinách pacientů s dávkou < 70,2 Gy, 70,2 Gy, 75,6 Gy a 81 Gy byl výsledek poléčebné biopsie pozitivní v 65 %, 38 %, 27 %, resp. 25 % případů.
Porovnání výsledků radioterapie karcinomu prostaty může být i při srovnatelné dávce záření problematické z důvodu různého zastoupení hormonální léčby, rozdílné definice PSA relapsu či klinického relapsu a různě dlouhé doby sledování. M. D. Anderson randomizovaná studie porovnávala u 301 pacienta dávku 70 Gy a 78 Gy [3]. Pacienti se středním rizikem v rameni 78 Gy měli 5leté přežití bez PSA relapsu přibližně 92 % (odhad z grafu, protože prezentovaná data jsou 8letá). Náš výsledek pro stejnou skupinu pacientů – 89 % – je srovnatelný. Pacienty s vysokým rizikem nelze porovnávat, neboť v referenční randomizované studii nebyla použita hormonální léčba, kdežto naši HR pacienti hormonální léčbu dostávali. V holandské studii bylo 669 pacientů randomizováno mezi dávku 68 Gy a 78 Gy [2]. V rameni 78 Gy bylo 5leté přežití bez PSA relapsu přibližně 69 % (odhad z grafu, protože prezentovaná data jsou 7letá). U našich pacientů jsme dosáhli odhadovaného výsledku 85 % v pěti letech. Nicméně, srovnání je zavádějící přinejmenším ze dvou důvodů – zastoupení pacientů s GS 7–10 bylo v 78 Gy randomizovaném rameni 49 % oproti 30 % v našem souboru, necelá polovina HR pacientů v 78 Gy randomizovaném rameni dostávala hormonální léčbu ve srovnání se 100 % v našem souboru. Porovnání IR pacientů není možné, protože výsledky pro jednotlivé stupně rizika holandská studie neudává. Zelefsky et al referovali o souboru 2 047 pacientů léčených 3D-CRT a IMRT s postupnou eskalací dávky v rozmezí 66 Gy – 86,4 Gy [7]. Hodnotu PSA před léčbou < 10 ng/ml mělo 56 % pacientů, dávku ≥ 75,6 Gy obdrželo 83 % pacientů, neoadjuvantní hormonální léčba byla podávána u 52 % pacientů. Pětileté přežití bez PSA relapsu ve skupině pacientů s dávkou 81 Gy bylo 85 %, což je hodnota identická s výsledkem v souboru našich pacientů.
Vyšší Gleason skóre jako negativní prediktor PSA relapsu i klinického relapsu jsme identifikovali ve shodě s jinými autory [3,13]. Druhým významným negativním prediktorem PSA relapsu byl nízký věk v době diagnózy, což nasvědčuje agresivnějšímu průběhu choroby u mladších pacientů. Naše zjištění koresponduje s údaji Kuban et al, kteří při dávce 78 Gy zaznamenali vyšší mortalitu na karcinom prostaty u mužů mladších 70 let v porovnání s muži staršími (10leté riziko 7 % vs 0 %) [14].
Odhadované 5leté přežití bez klinického relapsu se u našich pacientů pohybovalo od 95 % do 100 % podle stupně rizika. Distanční metastázy se objevily u pěti z devíti pacientů s klinickým relapsem, neboli incidence distančních metastáz v celém souboru pacientů byla 5/233 (2,1 %). Ve zmíněné M. D. Anderson randomizované studii byla incidence distančních metastáz v rameni 78 Gy 1,3 %. Spolehlivé hodnocení a porovnávání rizika klinického relapsu/distančních metastáz je limitováno relativně krátkou dobou sledování našich pacientů.
Neprokázali jsme rozdíly v 5letém přežití bez PSA relapsu mezi skupinami pacientů IMRT 78 a IMRT SIB 82. Vezmeme-li v úvahu počet pacientů v rameni IMRT SIB 82 (n = 73) a rozdíl v dávce mezi oběma skupinami 4 Gy, jiný výsledek ani nelze při době sledování 4,3 roku očekávat. Zelefsky et al prokázali přínos eskalace dávky ze 75,6 Gy na ≥ 81 Gy u HR pacientů, nikoliv u IR pacientů [7]. Relevantní výsledky studií s IMRT SIB na intraprostatickou lézi nejsou zatím k dispozici.
Velmi perspektivní je spojení IMRT a radioterapie řízené obrazem (IGRT). IGRT-IMRT je synonymem pro vysoce přesnou radioterapii, která zaručuje správné pokrytí cílového objemu předepsanou dávkou záření. Na našem pracovišti máme víceleté zkušenosti s adaptivní metodou IGRT [15]. Nicméně v současné době dáváme přednost IGRT s kilovoltážním CT kónickým svazkem (CBCT) při každé frakci radioterapie s bezprostřední korekcí pozice pacienta. Časné výsledky IGRT u karcinomu prostaty jsou povzbudivé jak v redukci GU toxicity, tak v onkologickém výsledku [16].
Závěr
Pětileté onkologické výsledky IMRT u našich pacientů s lokalizovaným karcinomem prostaty jsou velmi dobré. IGRT a SIB na intraprostatickou lézi představují solidní potenciál pro další rozvoj IMRT.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Martin Doležel, Ph.D.
KOC Pardubická krajská nemocnice a. s. α Multiscan s. r. o.
Kyjevská 44
532 03 Pardubice
e-mail: dolezelm@email.cz
Obdrženo: 3. 6. 2013
Přijato: 12. 6. 2013
Zdroje
1. Dearnaley DP, Sydes MR, Grahan JD et al. Escalated-dose versus standard-dose conformal radiotherapy in prostate cancer: first results from the MRC RT01 randomised controlled trial. Lancet Oncol 2007; 8(6): 475–487.
2. Al-Mamgani A, van Putten WL, Heemsbergen WD et al. Update of Dutch multicenter dose-escalation trial of radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 2008; 72(4): 980–988.
3. Kuban DA, Tucker SL, Dong L et al. Long-term results of the M. D. Anderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol Biol Phys 2008; 70(1): 67–74.
4. Staffurth J, Radiotherapy Development Board. A review of the clinical evidence for intensity-modulated radiotherapy. Clin Oncol 2010; 22(8): 643–657.
5. Elliott SP, Adejoro OO, Konety BR et al. Intensity modulated radiation therapy replaces 3-dimensional conformal radiotherapy as prostate cancer treatment. J Urol 2012; 187(4): 1253–1258.
6. Zelefsky MJ, Levin EJ, Hunt M et al. Incidence of late rectal and urinary toxicities after three-dimensional conformal radiotherapy and intensity-modulated radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 2008; 70(4): 1124–1129.
7. Zelefsky MJ, Yamada Y, Fuks Z et al. Long-term results of conformal radiotherapy for prostate cancer: impact of dose escalation on biochemical tumor control and distant metastases-free survival outcomes. Int J Radiat Oncol Biol Phys 2008; 71(4): 1028–1033.
8. Fonteyne V, Villeirs G, Speleers B et al. Intensity-modulated radiotherapy as primary therapy for prostate cancer: report on acute toxicity after dose escalation with simultaneous integrated boost to intraprostatic lesion. Int J Radiat Oncol Biol Phys 2008; 72(3): 799–807.
9. Dolezel M, Odrazka K, Vaculikova M et al. Dose escalation in prostate radiotherapy up to 82 Gy using simultaneous integrated boost: direct comparison of acute and late toxicity with 3D-CRT 74 Gy and IMRT 78 Gy. Strahlenther Onkol 2010; 186(4): 197–202.
10. Odrazka K, Zouhar M, Petera J et al. Comparison of rectal dose-volume constraints for IMRT prostate treatment planning. Phys Med 2005; 21(4): 129–135.
11. Thames HD, Kuban D, Levy LB et al. The role of overall treatment time in the outcome of radiotherapy of prostate cancer: an analysis of biochemical failure in 4839 men treated between 1987 and 1995. Radiother Oncol 2010; 96(1): 6–12.
12. Zelefsky MJ, Reuter VE, Fuks Z et al. Influence of local tumor control on distant metastases and cancer related mortality after external beam radiotherapy for prostate cancer. J Urol 2008; 179(4): 1368–1373.
13. Zelefsky MJ, Pei X, Chou JF et al. Dose escalation for prostate cancer radiotherapy: predictors of long-term biochemical tumor control and distant metastases-free survival outcomes. Eur Urol 2011; 60(6): 1133–1139.
14. Kuban DA, Levy LB, Cheung MR et al. Long-term failure patterns and survival in a randomized dose-escalation trial for prostate cancer. Who dies of disease? Int J Radiat Oncol Biol Phys 2011; 79(5): 1310–1317.
15. Vaňásek J, Odrážka K, Doležel M et al. Adaptivní IG-IMRT karcinomu prostaty. Klin Onkol 2011; 24(5): 361–366.
16. Zelefsky MJ, Kollmeier M, Cox B et al. Improved clinical outcomes with high-dose image guided radiotherapy compared with non-IGRT for the treatment of clinically localized prostate cancer. Int J Radiat Oncol Biol Phys 2012; 84(1): 125–129.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial – vývoj radioterapie
- Kouření a rakovina prsu
- Radiobiologická úskalí nových technik v radioterapii
- Onkogénny potenciál papilomavírusov
- Hodnocení kvality života pacientů na onkologickém oddělení – pilotní studie
- Pětileté výsledky IMRT karcinomu prostaty – toxicita
- Pětileté výsledky IMRT karcinomu prostaty – kontrola nádoru
- Bilaterálne germinatívne nádory testis – dlhoročné skúsenosti
- Informace z České onkologické společnosti
- Studie OPERa
- Syndróm hornej dutej žily v onkológii
- Studie CLARINET – průkaz antiproliferativního účinku lanreotidu
- XOFIGO® (radium‑ 223 dichlorid) v léčbě metastatického kastračně rezistentního karcinomu prostaty
- Zajímavé případy z nutriční péče v onkologii
- Je předoperační scintigrafie skeletu v časném stadiu karcinomu prsu T1N0 indikovaná a smysluplná?
-
Onkologie v obrazech
Pacient s recidivujícím melanomem na pravé tváři
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndróm hornej dutej žily v onkológii
- Je předoperační scintigrafie skeletu v časném stadiu karcinomu prsu T1N0 indikovaná a smysluplná?
- Kouření a rakovina prsu
- Hodnocení kvality života pacientů na onkologickém oddělení – pilotní studie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



