-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Studie OPERa
OPERa Study
Background:
On the whole, most European and international guidelines recommend prophylactic use of granulocyte-colony stimulating factors (G-CSFs) when the risk of chemotherapy-induced febrile neutropenia (FN) in cancer patients exceeds 20%. In patients treated with intermediate-risk chemotherapy regimens the recent EORTC guidelines recommend to consider supplementary patient-related adverse risk factors such as elderly age (≥ 65 years) prior to administrating each cycle of chemotherapy. The primary objective of our study is to describe the most important FN risk factors that underlie the use of pegfilgrastim PP in daily practice in the Czech Republic; secondary endpoints include FN incidence, chemotherapy dose intensity, anti-infective agents administration, hospitalization length and safety of chemotherapy regimens.Patients and methods:
This prospective, multicenter, non-interventional study enrolled patients receiving a chemotherapy with high FN risk (≥ 20% according to EORTC guidelines) based on investigators` assessment. Results:
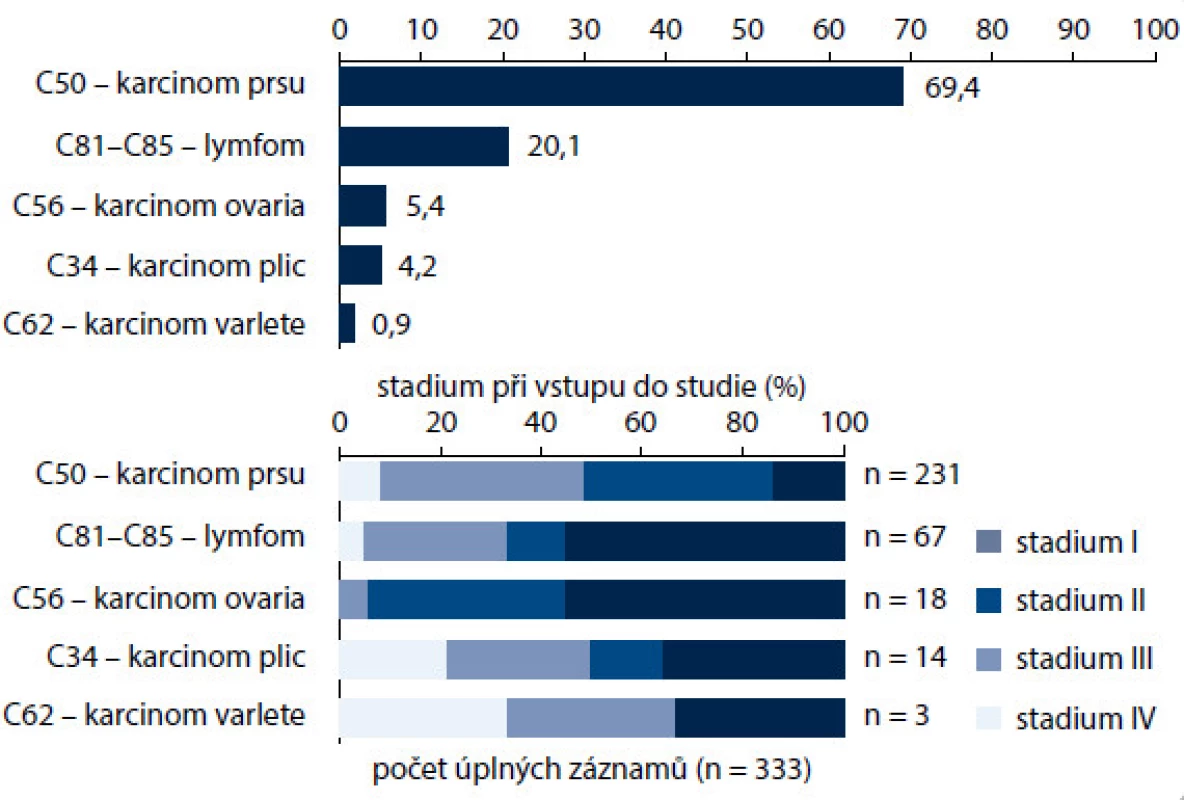
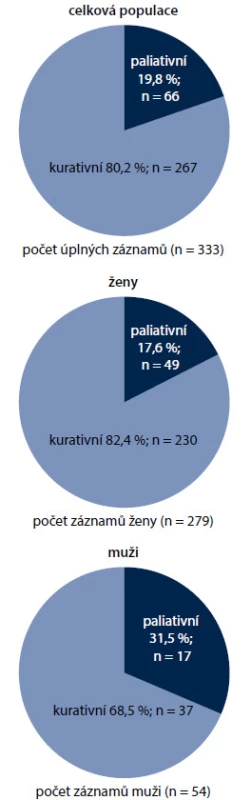
Data were collected on a total of 333 patients treated for breast cancer (69%), lymphoma (20%), ovarian (5%), lung (4%) and testicular cancer (1%). The most frequent indications for G-CSF prophylaxis were myelotoxic chemotherapy regimen (96%), elderly age (36%), advanced stage disease (35%), female gender (30%), cancer type (15%) and previous FN episode (12%). The overall FN incidence was 3% in patients receiving primary pegfilgrastim prophylaxis (n = 210) and 12% in patients with no pegfilgrastim PP (n = 123).Conclusion:
The myelotoxicity of a chemotherapeutic regimen was the most significant FN risk factor identified by the inquired physicians. The second most compelling FN risk factor was elderly age and advanced stage disease. FN incidence in patients who received pegfilgrastim PP was relatively low in comparison to the commonly expected FN incidence in a population of patients receiving a chemotherapy regimen with high risk of FN.Key words:
granulocyte colony-stimulating factor – pegfilgrastim – febrile neutropenia – prophylaxis – chemotherapy
The author declare she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
5. 11. 2013Accepted:
14. 11. 2013
Autoři: P. Tesařová
Působiště autorů: Onkologická klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Klin Onkol 2013; 26(6): 425-433
Kategorie: Původní práce
Souhrn
Východiska:
Většina evropských a světových doporučení se shoduje na užití G-CSF (granulocyty stimulujícího faktoru) v primární profylaxi pacientů léčených chemoterapií, převýší-li celkové riziko febrilní neutropenie (FN) 20 %. U středně rizikových režimů (riziko FN 10–20 %) se doporučuje před každým cyklem chemoterapie opětovně posuzovat individuální rizikové faktory, jež mohou riziko vzniku FN u pacientů zvyšovat v závislosti na rozsahu a typu jejich nemoci a jejich anamnéze. Primárním cílem studie OPERa bylo určit nejdůležitější rizikové faktory FN a užití pegfilgrastimu v primární profylaxi v běžné praxi v ČR. Dalšími sledovanými parametry byla incidence FN, incidence závažné neutropenie, dávková intenzita chemoterapie, podání antiinfektiv, hospitalizace a bezpečnost.Pacienti a metody:
Do prospektivní multicentrické neintervenční studie byli zařazeni pacienti léčení chemoterapeutickými režimy s vysokým rizikem vzniku FN (≥ 20 % dle EORTC).Výsledky:
Do studie bylo zařazeno 333 pacientů s karcinomem prsu (69 %), lymfomem (20 %), karcinomem vaječníků (5 %), karcinomem plic (4 %) a testikulárním karcinomem (1 %). Nejčastějším důvodem pro podání profylaxe FN byla toxicita chemoterapeutického režimu (96 %), vyšší věk (36 %), pokročilost onemocnění (35 %), ženské pohlaví (30 %), typ nádoru (15 %) a předchozí epizoda FN (12 %). Incidence FN pacientů s primární profylaxí pegfilgrastimem činila 3 % (n = 210), ve skupině pacientů bez primární profylaxe pegfilgrastimem činila četnost FN 12 % (n = 123).Závěr:
Při posuzování rizika zvažovali ošetřující lékaři především rizikovost chemoterapeutického režimu, na dalším místě pak věk pacientů a pokročilost onemocnění. Incidence febrilní neutropenie u pacientů, kteří dostávali pegfilgrastim, byla ve studii velmi nízká vzhledem k četnosti FN očekávané u pacientů léčených chemoterapií s vyšším rizikem vzniku FN.Klíčová slova:
granulocyty stimulující růstový faktor – pegfilgrastim – febrilní neutropenie – profylaxe – chemoterapieÚvod
Cytotoxická chemoterapie může způsobit hlubokou a někdy i dlouhotrvající neutropenii, která je důvodem k hospitalizaci nemocného, vyšetřování zdroje infekce, antibiotické, antimykotické nebo antivirové léčbě, neboť teplota může předznamenávat potenciálně velmi závažnou septickou komplikaci ohrožující zdraví a život pacienta [1,2].
Definice febrilní neutropenie (FN) má různé podoby, ale nejčastěji se za febrilní neutropenii považuje stav, kdy dojde k poklesu absolutního počtu neutrofilů (ANC) pod hodnotu < 0,5 109/l spojenému s teplotou přesahující 38 ºC, trvající alespoň 1 hod (definice dle Infectious Diseases Society of America – IDSA), v širším pojetí je tento stav definován jako souběh neutropenie a teploty [3].
Faktor stimulující granulocytové kolonie (G-CSF) mobilizuje periferní granulocyty, zrychluje dozrávání nezralých granulocytových prekurzorů a stimuluje vznik a vývoj nových granulocytů. G-CSF je možné využít v prevenci vzniku FN nebo v její léčbě (dle výsledků studií zkracuje dobu jejího trvání) [4,5].
Metody
Studie OPERa byla multicentrická neintervenční prospektivní studie probíhající ve 13 onkologických a pěti hematologických centrech v České republice od září 2008 do července 2010 s primárním cílem zmapovat reálný odhad rizika febrilní neutropenie vedoucí k podání pegfilgrastimu v primární profylaxi FN. Důvod pro indikaci pegfilgrastimu v primární profylaxi, věk, výkonnostní stav, pohlaví, typ a stadium nádoru i typ chemoterapeutického režimu byl posuzován z hlediska procentuálního zastoupení. Sekundárními cíli bylo potom posoudit incidenci FN a těžké neutropenie (stupně III a IV) a jejich spojení s rizikovými faktory; dávkovou intenzitu a denzitu spojenou s odkladem léčby a redukci dávek chemoterapie v závislosti na typu podaného růstového faktoru (pegfilgrastim vs filgrastim), užití antibiotik, antivirotik a antimykotik, procento hospitalizací pro FN a profil bezpečnosti pegfilgrastimu.
Vstupní a vylučovací kritéria
Pro studii byli vhodní dospělí nemocní léčení chemoterapií pro karcinom prsu, plic, ovaria, varlete nebo lymfom s vysokým rizikem vzniku FN (> 20 % dle doporučení EORTC), kteří byli indikováni k primární profylaxi FN s dobou dožití delší než tři měsíce, s nejméně čtyřmi cykly plánované chemoterapie, ve věku > 18 let, s histologicky potvrzenou diagnózou zhoubného onemocnění a normální funkcí orgánů dovolující podstoupit myelosupresivní chemoterapii.
Pro studii nebyli vhodní pacienti zařazení v jiné klinické studii. Vylučovacím kritériem bylo těhotenství a kojení, stejně jako kontraindikace užití pegfil-grastimu.
Zkoumaným preparátem byl pegfilgrastim, který byl používán v souladu s klinickou praxí a SPC preparátu.
Prospektivní data konsekutivně zařazených pacientů byla zaznamenaná do standardního elektronického formuláře (case report form − CRF) a týkala se plánovaných chemoterapeutických režimů, demografických dat, anamnestických údajů, plánované léčby a její bezpečnosti. Pacienti byli sledováni od zahájení chemoterapie po dobu maximálně osmi chemoterapeutických cyklů a stratifikováni dle pohlaví, věku v době zahájení terapie, diagnózy, stadia onemocnění, chemoterapeutického režimu, linie a záměru léčby (kurativní vs paliativní). Laboratorní hodnoty ani výsledky vyšetření nebyly součástí eCRF. Nežádoucí příhody, které mohly mít dle názoru investigátorů vztah k léčbě pegfilgrastimem, byly pečlivě zaznamenávány.
Statistické hodnocení
V rámci statistického zpracování byly použity standardní metody deskriptivní statistiky − průměr a 95% CI nebo medián doplněný o percentilové rozsahy u spojitých proměnných, procentuální zastoupení a počet případů dané kategorie u kategoriálních proměnných. Statistická signifikance rozdílů mezi pacientskými skupinami byla testována Mannovým-Whitneyovým U testem nebo Kruskal-Wallisovým testem v případě spojitých proměnných a Fisherovým exaktním testem nebo Chí-kvadrát testem v případě kategoriálních proměnných.
Výsledky
Na zařazování do studie se podílelo 18 onkologických a hematologických center v ČR; celkem bylo zařazeno 333 nemocných (obr. 1). Výběr diagnóz ovlivnil i rozložení pohlaví a věku zařazených nemocných. Muži tvořili jen 16,2 %. Průměrný věk žen v době zahájení léčby byl 50,4 roku, muži byly v průměru mladší (46,9 roku). Věková struktura souvisí s nejčastějším výskytem vybraných diagnóz. U žen určuje věkovou strukturu karcinom prsu s nejčastějším výskytem po menopauze, u mužů snižuje věkový průměr diagnóza zhoubného nádoru varlat i lymfomů. Zařazení pacienti byli převážně ve velmi dobrém výkonnostním stavu (PS) dle klasifikace ECOG – PS 0 mělo 55,3 % pacientů, PS 1 se vyskytoval u 36 % pacientů, PS 2 byl zaznamenán u 7,8 % pacientů a PS 3 mělo pouhých 0,9 % pacientů. Ženy byly celkově v lepším výkonnostním stavu, což souvisí s převažující diagnózou karcinomu prsu – pacientky s karcinomem mammy tvořily téměř 70 % všech pacientů ve studii (obr. 2). Pro tuto diagnózu je typické, že i nemocné s pokročilým nádorem jsou v dobrém stavu. Pacientky s karcinomem prsu se také odlišovaly od ostatních pacientů v zastoupení jednotlivých stadií nemoci; stadium IV se vyskytovalo podstatně méně často u pacientek s karcinomem prsu ve srovnání s ostatními diagnózami, především s karcinomem ovarií nebo lymfomy (obr. 2). S kurativním záměrem bylo léčeno 80,2 % všech nemocných (n = 267), což odpovídá doporučením pro prevenci febrilní neutropenie. U mužů ale odpovídalo kurativnímu záměru jen 68,5 % nemocných (n = 37), což jistě souviselo s malým počtem léčených pacientů (n = 54) a profilem převažujících diagnóz u mužů, tedy NHL a karcinomem varlat (obr. 3).
Obr. 1. Zastoupení zdravotnických center v registru. 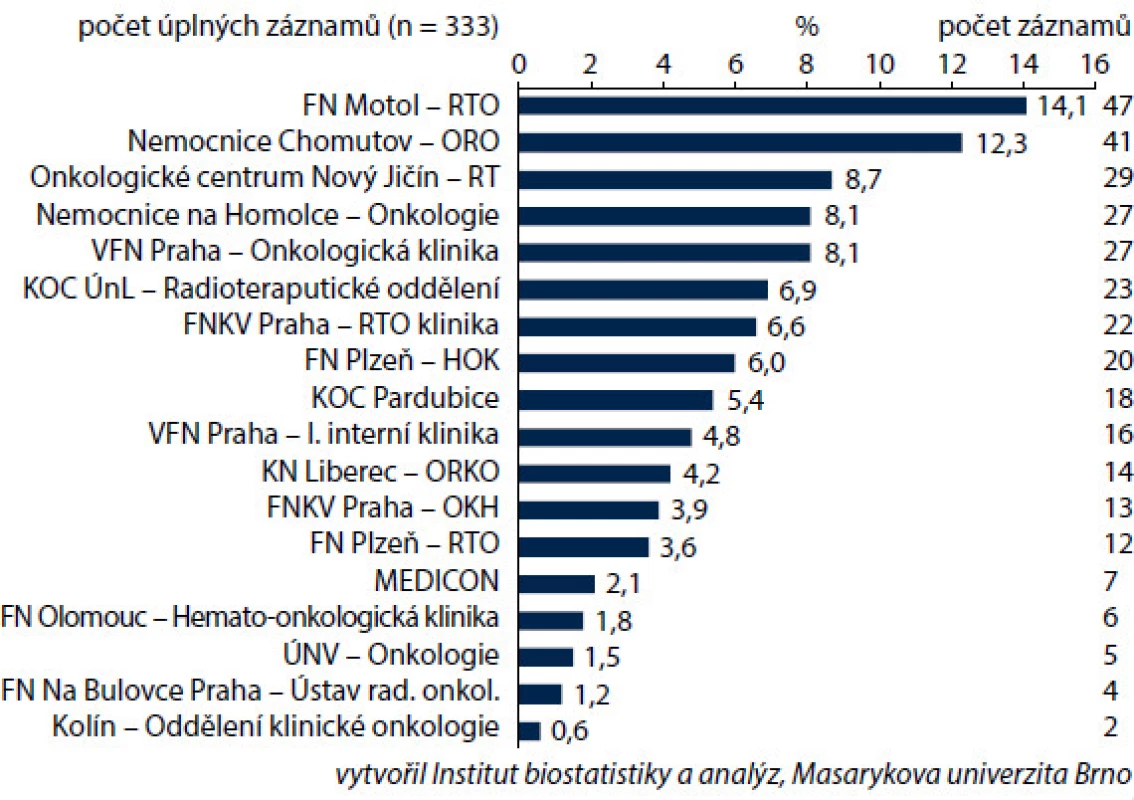
Jen 5,4 % nemocných zahajovalo cytostatickou léčbu redukovanou dávkou chemoterapie proti dávce doporučené Českou onkologickou společností (Modrá kniha, portál DIOS) [6,7]. Hlavním důvodem redukce byl pokročilý věk (44,4 %), na druhém místě zkušenost FN v rámci některého z předchozích chemoterapeutických cyklů (22,2 %), dále toxický chemoterapeutický režim (16,7 %), onemocnění ledvin, jater anebo srdce (11,1 %) a ženské pohlaví (5,6 %). Více než 2krát častěji byly redukovány režimy paliativní (10,6 %) než léčba kurativní (4,1 %) (obr. 4).
Obr. 4. Primární redukce dávky oproti režimu definovanému v zásadách cytostatické léčby (Modrá kniha). 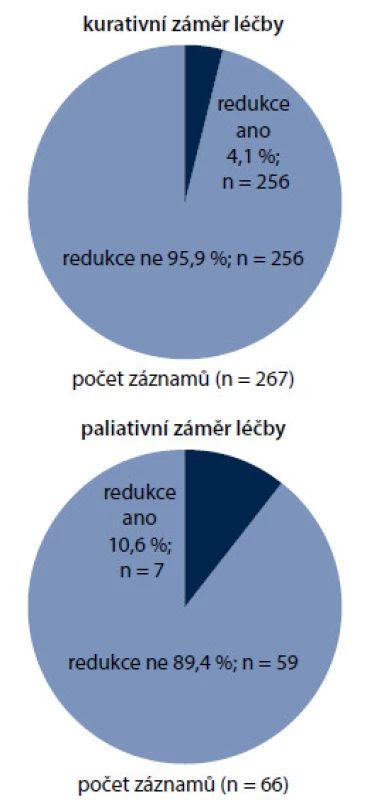
Ošetřující lékaři vyhodnotili riziko FN dle EORTC doporučení u 282 pacientů (84,7 %). Z nich 84,0 % (n = 237) bylo dle úsudku lékaře léčeno chemoterapeutickými režimy s rizikem ≥ 20 %, zbývajících 16 % dostávalo režimy se středním rizikem FN (riziko FN 10−20 %) (obr. 5).
Obr. 5. Vyhodnocení rizika febrilní neutropenie dle EORTC guidelines. 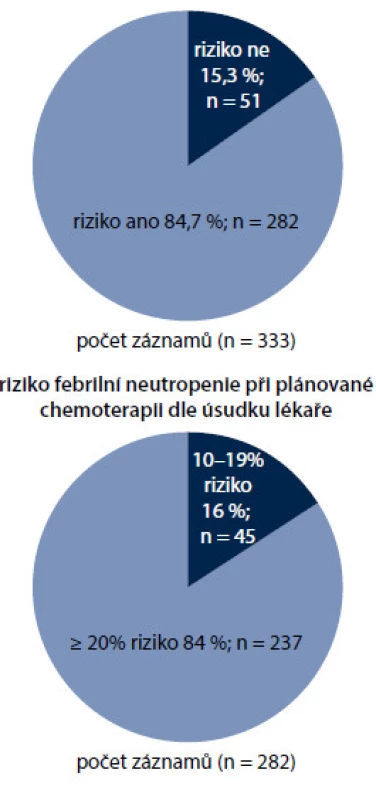
Důvodem pro užití G-CSF (v pořadí dle celkové četnosti výskytu bez ohledu na důležitost) v rámci primární profylaxe byly v převažující míře toxické chemoterapeutické režimy (95,5 %) následované předchozí epizodou febrilní neutropenie (v chemoterapeutickém cyklu předcházejícím podání profylaxe − 12,3 %), pokročilým onemocněním (35,4 %), věkem (35,7 %), ženským pohlavím (29,7 %), typem nádoru (15 %), špatným výživovým stavem (1,8 %), špatným celkovým stavem − PS (3,9 %), anémií (2,7 %) a onemocněním jater, ledvin nebo srdce (3,6 %).
Nejdůležitějším důvodem pro G-CSF profylaxi (první v pořadí důležitosti dle názoru investigátorů) byly toxický režim (86,5 %), předchozí epizoda FN (7,5 %), pokročilá nemoc (3,9 %), věk (1,2 %), ženské pohlaví (0,3 %), typ nádoru (0,3 %) a špatný nutriční stav (0,3 %).
V průběhu všech cyklů byla potvrzena febrilní neutropenie v 6,3 % případů (n = 21), v průběhu prvního cyklu dosáhla incidence FN 4,8 % (n = 16). Podobně byla pozorována nejvyšší četnost neutropenie stupně 3 a 4 v průběhu prvního cyklu (15,9 % v prvním cyklu vs 22,2 % ve všech cyklech).
Pegfilgrastim byl použit v primární profylaxi u 63,1 % pacientů (n = 210), u zbývajících 36,9 % pacientů (n = 123) nebyla primární profylaxe podána nebo byl podán filgrastim.
Hlavním důvodem, který vedl lékaře k aplikaci pegfilgrastimu v primární profylaxi, byla předpokládaná prolongovaná neutropenie ve 42,4 % (n = 89), standardní protokol v rámci chemoterapeutického režimu 23,8 % (n = 50), snadné podávání v 18,1 % (n = 38), očekávaná dobrá snášenlivost v 15,2 % (n = 32) nebo ekonomické důvody v 0,5 % (n = 1).
Diskuze
Primární profylaxí se rozumí použití G-CSF před zahájením prvního cyklu chemoterapie na základě předpokladu vysoké pravděpodobnosti vzniku FN s cílem vyhnout se jejímu vzniku a všem komplikacím s ní souvisejícím [8].
Doporučení pro profylaxi neutropenie od American Society of Clinical Oncology (ASCO) z roku 2006, upravená doporučení European Organisation for Research and Treatment of Cancer (EORTC) z roku 2010, ve stejném roce upravená doporučení Infectious Diseases Society of America (IDSA), doporučení založená na konsenzu National Comprehensive Cancer Network (NCCN) i evropská doporučení European Society of Medical Oncology (ESMO) navrhují primární profylaxi FN u chemoterapeutických režimů s celkovým rizikem FN nad 20 % [3–5,8]. Předchozí doporučení uvádějící hranici 40 % [9] bylo upraveno na novou, 20% hranici vzhledem k výsledkům studií dokumentujících nákladovou efektivitu primární profylaxe [10,11]. Důvodem vysokých nákladů na léčbu FN je především hospitalizace [12].
Zatímco řada klinických studií dokumentuje vliv G-CSF na trvání hospitalizace a spotřebu antibiotik [13–16], výsledky studií a metaanalýz sledujících dopad na krátkodobé a dlouhodobé přežití nejsou zcela jednoznačné [17]. Metaanalýza 148 studií s G-CSF v primární profylaxi (PP) potvrdila příznivý vliv PP na počet infekčních komplikací a teplotu, ale nezaznamenala dopad na krátkodobou úmrtnost ani úmrtnost na infekční komplikace [14], naopak v systematickém přehledu literatury a metaanalýze zahrnující 3 493 pacientů léčených v 17 randomizovaných kontrolovaných studiích došlo nejen k 46% snížení výskytu FN (RR 0,54, 95% CI 0,43−0,67), ale bylo dokumentováno také 45% snížení úmrtnosti na infekce (RR 0,55, 95% CI 0,33−0,90) a 40% snížení úmrtnosti z jiných příčin v průběhu chemoterapie (RR 0,60, 95% CI 0,43−0,87) [13]. Tato metaanalýza nebyla schopná zhodnotit vliv primární profylaxe na bezpříznakové (disease free survival − DFS) ani celkové přežití (overall survival − OS), dokumentovala však statisticky významně vyšší relativní dávkovou intenzitu (RDI) dosaženou u pacientů, u kterých byly podány G-CSF v primární profylaxi, ve srovnání s kontrolní skupinou (95,1 % vs 86,7 %, p < 0,001). Podobně prospektivní studie s 407 pacientkami s časným stadiem karcinomu prsu léčenými adjuvantními chemoterapeutickými režimy obsahujícími kombinaci taxanu a antracyklinů demonstrovala vyšší RDI u pacientek se sekundární profylaxí G-CSF ve srovnání s léčbou bez podpory růstovými faktory [18]. Nejvyšší RDI byla dosažena při profylaxi pegfilgrastimem.
Význam relativní dávkové intenzity podávané chemoterapie pro přežití pacientů byl opakovaně dokumentován ve studiích s dlouhodobým sledováním. Bonadonna ve studii s 386 pacientkami léčenými adjuvantně CMF pro karcinom prsu ukázal přímo úměrný vztah mezi dosaženou RDI a celkovým přežitím pacientek po 20 i 30 letech [19,20]. Podobně prokázala Chirivella v 10letém sledování dopad, že snížení RDI pod 85 % má dopad na zkrácení celkového přežití 793 pacientek s karcinomu prsu při použití modernější chemoterapie na bázi antracyklinů a taxanů (HR = 1,73, 95% CI 1,17–2,55, p = 0,0055) [21]. Obdobné výsledky byly dokumentovány i u pacientů s lymfomy [22–25].
Primární profylaxe by měla být indikovaná u nemocných léčených cytotoxickou chemoterapií s kurativním záměrem (maligní lymfomy, adjuvantní léčba karcinomu prsu, testikulární karcinomy atp.) s cílem snížit pravděpodobnost neutropenie závislou na dávce a typu léčby a snížit incidenci febrilní neutropenie [17,26−28]. Přínos této strategie dokumentuje kontrolovaná studie s 80 nemocnými s ne-hodgkinským lymfomem o vysokém stupni malignity, kteří byli randomizováni k léčbě režimem VAPEC-B samostatně nebo s podporou G-CSF [26]. Použití G-CSF bylo spojeno s nižším výskytem neutropenie stupně 4 (37 % vs 85 %), menším výskytem teploty (22 % vs 44 %) a méně častou redukcí dávky chemoterapie (10 % vs 33 %).
Také vysoce rizikoví pacienti léčení méně toxickým režimem mohou těžit z primární profylaxe G-CSF, např. nemocní starší 65 let [29−31], pacienti s asymptomatickou neutropenií nebo infiltrací kostní dřeně [31,32], velmi pokročilým onemocněním [33], špatným výkonnostním a nutričním stavem [31], poruchou funkce ledvin nebo jater [32], pacienti s rozsáhlým chirurgickým výkonem před chemoterapií u ovariálního karcinomu [34]. K usnadnění rozhodování ohledně primární profylaxe vznikly klinické modely [32]. Také kombinace chemoterapie a radioterapie je spojená s vyšším rizikem FN [35,36], pouze u pacientů léčených konkomitantní chemoradioterapií pro karcinom plic nebo nádory hlavy a krku se podle posledních doporučení snažíme vyhnout podání G-CSF (grade 2C-Oxford centre of evidence based medicine-levels of evidence) [6].
Publikované studie, analýzy a metaanalýzy srovnávající účinnost primární profylaxe pegfilgrastimem a filgrastimem nebo jinými denně podávanými G-CSF ukazují vyšší účinnost pegfilgrastimu. V metaanalýze pěti randomizovaných klinických studií s 617 pacienty s karcinomem prsu nebo s lymfomem bylo riziko febrilní neutropenie o 36 % nižší u pacientů, kterým byl v primární profylaxi podán pegfilgrastim, oproti pacientům s filgrastimem. Metaanalýza neprokázala inferioritu filgrastimu v incidenci febrilní neutropenie po prvním cyklu chemoterapie, v incidenci G4 neutropenie ani obnovy počtu neutrofilů [7].
V naší studii se febrilní neutropenie vyskytovala 4krát častěji u pacientů bez podpory pegfilgrastimem (tato skupina zahrnovala pacienty s primární profylaxí filgrastimem nebo se sekundární profylaxí) než u těch, kterým byl pegfilgrastim podán (12,2 % vs 2,9 %), což koreluje s daty jiných publikovaných studií a metaanalýz. Uvedený výsledek ve studii OPERa však může být zkreslen skutečností, že pacienti bez primární profylaxe měli nižší riziko FN (jen 24,9 % mělo riziko převyšující 20 % na rozdíl od pacientů s PP, kteří měli takto vysoké riziko v 60–79 %). Incidence FN ve studii v průběhu všech cyklů činila 6,3 %, nejčastěji se vyskytovala v průběhu prvního cyklu (4,8 %), což je v souladu s pozorováním z mnoha studií. Skutečnost, že jak febrilní neutropenie, tak neutropenie stupně 3/4 se vyskytují nejčastěji v průběhu prvního cyklu, podtrhuje význam primární profylaxe, tj. podání G-CSF od prvního cyklu chemoterapie. Výsledky španělské observační studie se 735 pacientkami léčenými pro karcinom prsu chemoterapeutickým režimem obsahujícím paklitaxel nebo docetaxel naznačují, že primární profylaxe je účinnější než profylaxe sekundární. Incidence neutropenie stupně 3/4 činila 35,1 % v případě sekundární profylaxe pegfilgrastimem vs 8,1 % u sekundární profylaxe [37].
Sekundární profylaxe byla hodnocena jako podání G-CSF v následujícím cyklu chemoterapie po tom, který byl příčinou febrilní neutropenie nebo těžké neutropenie (neutropenie stupně 3/4), která mohla způsobit opoždění nebo redukci dávky chemoterapie. Febrilní neutropenie znamená totiž automaticky vyšší riziko jejího opakování (k tomu dochází u 50−60 % pacientů) [38−40]. Sekundární profylaxe snižuje toto riziko zhruba na polovinu [41].
Smyslem profylaxe je udržet plán chemoterapie, i když není zcela jasné, kde je hranice indikace k této profylaxi. Použití středně rizikového antracyklinového režimu (FEC100 nebo FEC100-D ± trastuzumab) v neredukované dávce i u pacientek se vstupní hodnotou absolutních neutrofilů pod 1,5 109/l (neutropenie stupně 2) umožnilo zachovat dávkování léčby v plném rozsahu, avšak 24 % cyklů bylo odloženo kvůli neutropenii [42]. Nicméně podle EORTC i ASCO doporučení by měla být sekundární profylaxe G-CSF indikovaná u nemocných s kurativním záměrem léčby, u kterých neutropenie ohrožuje dodržení dávkové intenzity, neboť bylo opakovaně prokázáno, že snížení RDI má dopad na přežití pacientů.
Nejčastějším důvodem profylaxe G-CSF v naší studii byl toxický chemoterapeutický režim (95,5 %), podstatně méně často vedly k rozhodnutí o profylaxi (v sestupném pořadí) věk, pokročilost onemocnění, ženské pohlaví, typ nádoru, předchozí epizoda FN, špatný výkonnostní stav, onemocnění jater, ledvin a srdce, anémie a špatný nutriční stav. Uvedené výsledky dokumentují důraz kladený v praxi při posuzování rizika FN na chemoterapii, ale také podceňování rizikových faktorů ze strany pacienta, které mohou celkové riziko vzniku febrilní neutropenie zvyšovat. Podle současných mezinárodních doporučení by měly být tyto rizikové faktory, a tedy i celkové riziko posuzovány před každým cyklem chemoterapie. Od prvního cyklu chemoterapie dostávalo profylaxi 63,1 % pacientů (obr. 6). Hlavním důvodem byla předpokládaná protrahovaná neutropenie (42,4 %), dále také podání G-CSF jako standardní součásti aplikovaného režimu, lepší snášenlivost nebo pohodlnost podání. Chemoterapii s dávkovou intenzitou pod 95 % dostalo 26,1 % nemocných, RDI pod 80 % byla zaznamenána u 4,8 % pacientů. Pacienti s preventivním podáváním pegfilgrastimu dostali chemoterapii v dávkové intenzitě nad 80 % v 96,2 %, nemocní bez profylaxe pegfilgrastimem v 93,6 %. Skupina pacientů bez profylaxe pegfilgrastimem zahrnovala i pacienty, kteří dostali v primární profylaxi denně aplikovaný filgrastim (obr. 7). Pacienti s hmotností nad 75 kg nebo povrchem těla nad 1,86 m2 měli nižší dávkovou intenzitu léčby, což pravděpodobně souvisí s podvědomým zaokrouhlováním dávky chemoterapie směrem dolů na obvyklé dávky kvůli obavám z toxicity léčby. U pacientek s karcinomem prsu léčených převážně kurativně ovlivnil pegfilgrastim zcela zásadně dávkovou intenzitu. Pacientky léčené bez profylaxe měly dávkovou intenzitu pod 95 % v 25 % případů, pod 80 % v 4,7 %. S pegfilgrastimem jen v 9,8 % pod 95 % a žádná nemocná nebyla léčena s dávkovou intenzitou pod 80 % (obr. 8). Většina režimů byla podávaná v adjuvanci. Ve více než polovině případů se jednalo o režimy na bázi antracyklinů a taxanů. Ještě výraznější byl vliv pegfilgrastimu v profylaxi u pacientů s NHL, kde bez profylaxe všichni nemocní měli intenzitu dávky redukovanou pod 95 %, s profylaxí to bylo jen 57,4 % (obr. 9).
Obr. 6. Pegfilgrastim v primární profylaxi febrilní neuropenie. 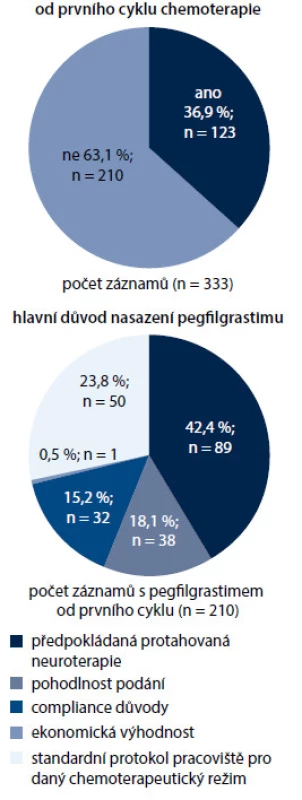
Obr. 7. Dodržování intenzit chemoterapeutických režimů. 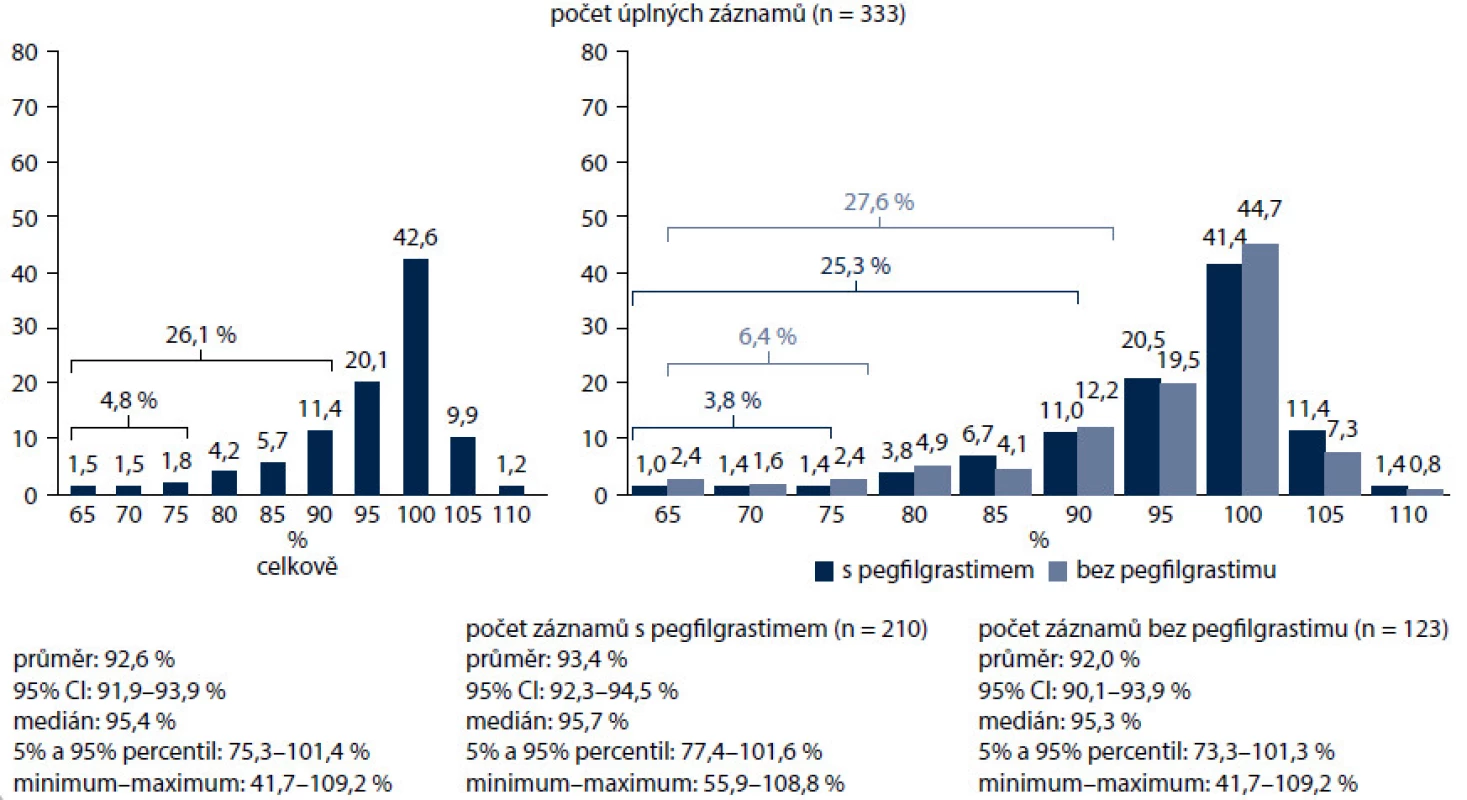
Obr. 8. Diagnóza C50 – dodržování intenzit chemoterapeutických režimů. 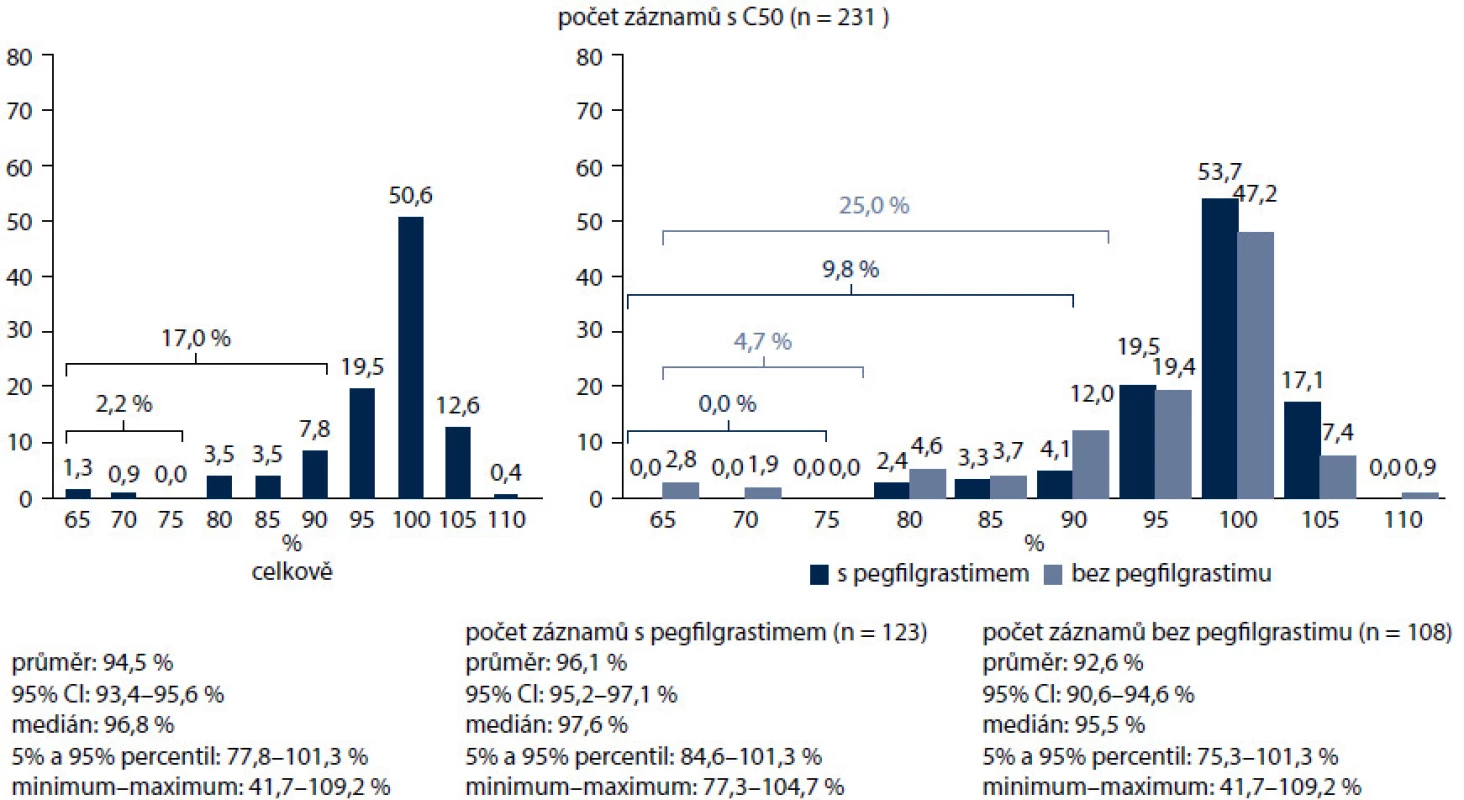
Obr. 9. Diagnóza C81–C85 – dodržování intenzit chemoterapeutických režimů. 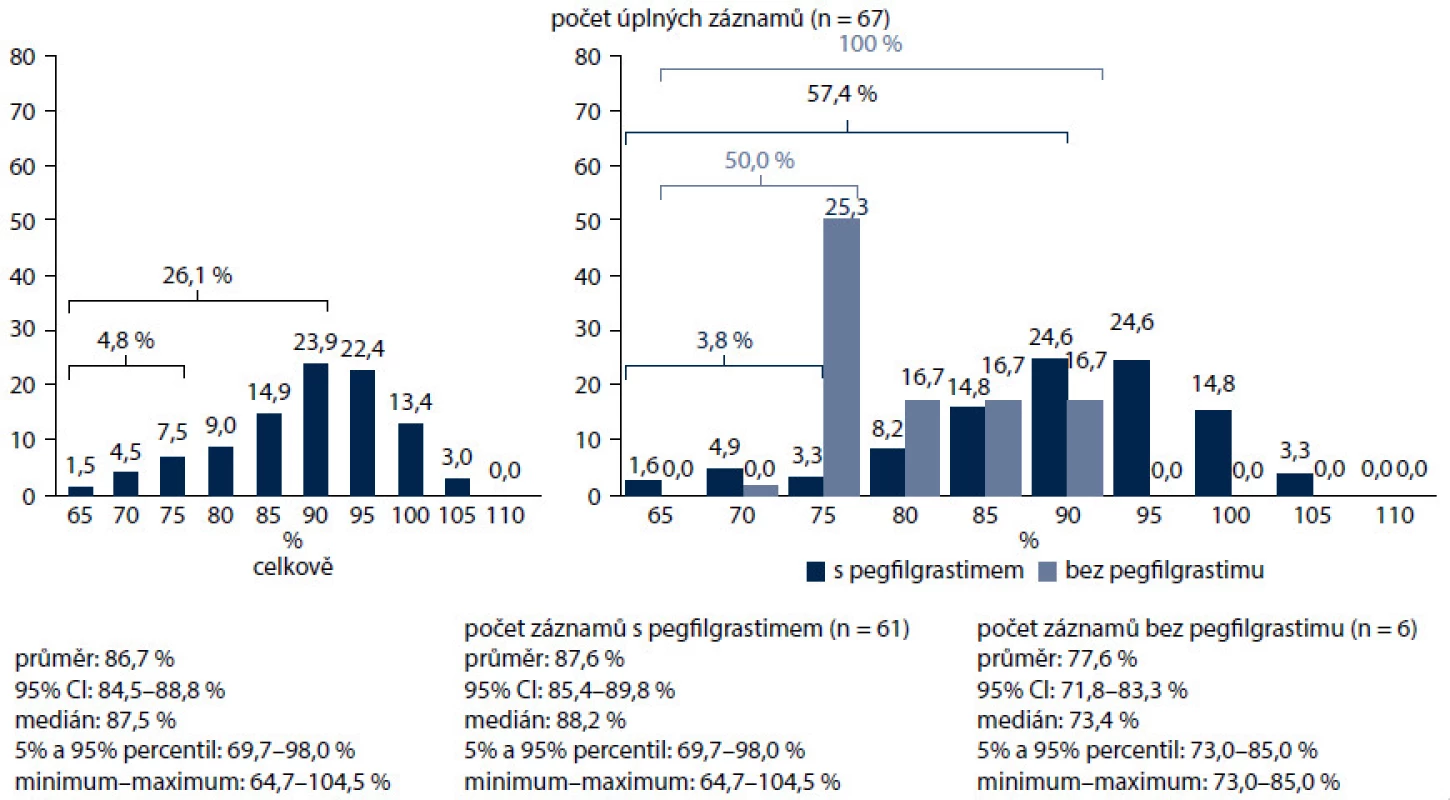
Dvaadvacet procent nemocných mělo i při profylaxi prostou, nekomplikovanou neutropenii III. a IV. stupně, z toho 15,9 % už v prvním cyklu. To jsou pravděpodobně ti nemocní, které pegfilgrastim uchrání od vzniku febrilní neutropenie. Neutropenie se nejčastěji objevovala u pacientů s hematologickými malignitami, což jistě částečně souvisí s premorbidním postižením kostní dřeně či infiltrací kostní dřeně. Nejčastěji se FN objevovala u pacientů s germinálními nádory, které ale byly ve studii zastoupeny v příliš nízkém počtu (n = 3), na druhém místě u lymfomů. U pacientů s NHL se vyskytovala také nejčastěji těžká neutropenie (G3, G4 − 43,3 %) – hlavně u režimů R-CHOP 21 a eskalovaného BEACOPP. Nejčastějšími nežádoucími účinky pegfilgrastimu byly bolesti svalů, kloubů, kostí, leukocytóza, bolesti hlavy a zad (obr. 10). Leukocytóza byla většinou jen mírná nebo středně závažná. Nejčastěji byla zaznamenána u lymfomů. Její výskyt by mohl souviset s fixní dávkou pegfilgrastimu bez ohledu na BSA nemocných a také s citlivostí kostní dřeně k růstovým stimulům pegfilgrastimu u pacientů s lymfomy.
Obr. 10. Toxicita léčby pegfilgrastinem. 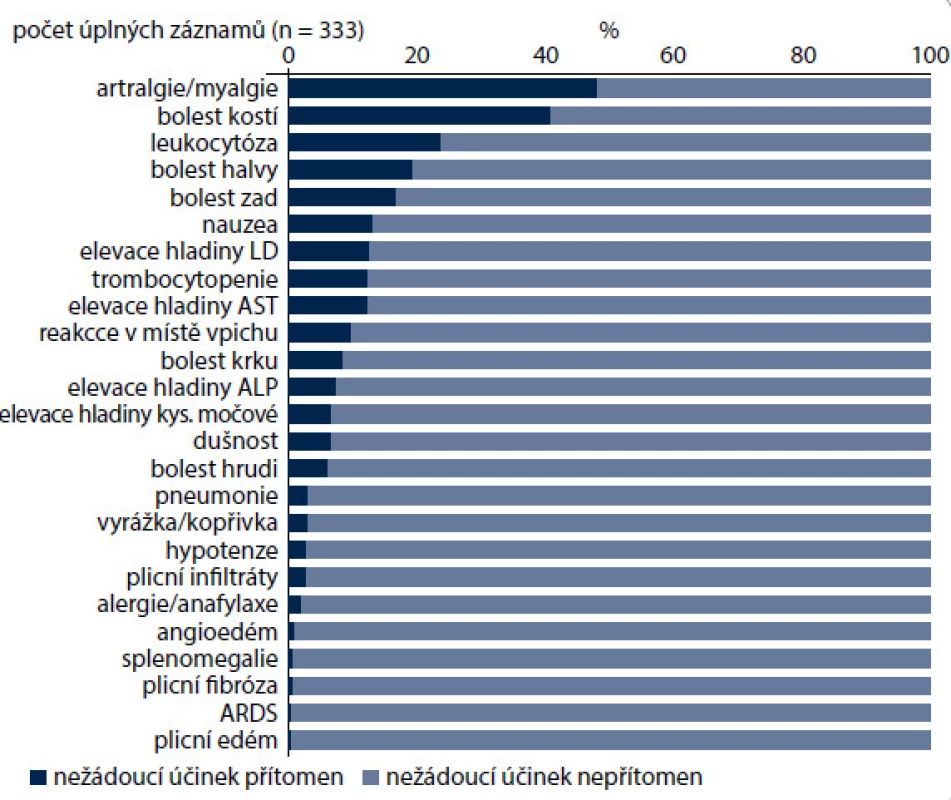
FN ohrožuje pacienta na životě, prodražuje léčbu a snižuje kvalitu života nemocného. Pegfilgrastim je indikován k snížení incidence febrilní neutropenie a hloubky a délky trvání těžké neutropenie u nemocných léčených cytotoxickou chemoterapií. Umožňuje dodržet plánované podání chemoterapie, jejíž poddávkování snižuje účinnost léčby a s ní související dlouhodobé přežívání pacientů.
Riziko febrilní neutropenie je odhadnutelné. Typ chemoterapie se při úvaze o indikaci profylaxe obvykle zvažuje, další faktory související s pacientem samotným či stavem jeho nemoci už méně často. V souladu s ASCO (American Society of Clinical Oncology), ESMO (European Society Medical Oncology), IDSA (Infectious Diseases Society of America) i EORTC (European Organisation for Research and Treatment of Cancer) doporučeními není G-CSF indikován k rutinní primární profylaxi u pacientů s pravděpodobností vzniku febrilní neutropenie nižší než 20 % (grade 1B). Pokud očekáváme febrilní neutropenii s pravděpodobností nad 20 %, potom je primární profylaxe z důvodů zkrácení hospitalizace a snížení spotřeby antibiotik indikovaná (grade 2B) [3,5,8]. V případě středně rizikových chemoterapeutických režimů (očekávané riziko FN se pohybuje mezi 10−20 %) je na uvážení ošetřujícího lékaře, zda je pacient nebo jeho choroba riziková a bude vyžadovat primární profylaxi G-CSF [5]. Obvykle zvažujeme tyto rizikové faktory – věk nad 65 let, špatný celkový stav, předchozí zkušenost s febrilní neutropenií, rozsáhlé ozařované pole, infiltrace kostní dřeně, špatný výživový stav, otevřená rána, nezvládnutá infekce, pokročilý nádor nebo jiné komorbidity (diabetes, plicní nebo srdeční onemocnění atp.) [3–5,8]. Posouzení celkového rizika FN je doporučeno opakovat před každým cyklem chemoterapie [8].
Profylaxe chemoterapií indukované neutropenie a febrilní neutropenie je indikovaná tam, kde by nedodržení dávkové intenzity pro snížení či oddálení dávek chemoterapie ohrozilo její léčebný efekt. Takovýto postup lehce zvyšuje riziko myeloproliferativních nemocí. Jelikož se FN vyskytuje nejčastěji v prvním cyklu chemoterapie, snižuje její incidenci nejúčinněji právě primární profylaxe.
Závěr
Z výstupů studie OPERa vyplývá, že riziko febrilní neutropenie nebylo zhodnoceno v 15,3 % případů. Při posuzování rizika zvažovali ošetřující lékaři především rizikovost chemoterapeutického režimu. Incidence FN pacientů léčených chemoterapií s vyšším rizikem byla ve studii velmi nízká. Nižší byla u pacientů s primární profylaxí pegfilgrastimem ve srovnání s jinými postupy (primární profylaxí filgrastimem nebo sekundární profylaxí). Vyšší účinnost může souviset s dávkováním jednou za cyklus, které zajišťuje dostatečnou hladinu pegfilgrastimu v průběhu potřebné doby díky samoregulační clearance.
Profylaktické podání pegfilgrastimu u nemocných zásadně ovlivňuje dodržení dávkové intenzity a tedy i účinnost léčby, což má zásadní význam především u pacientů léčených s kurativním záměrem. Na řadě pracovišť je profylaxe pegfilgrastimem již součástí chemoterapeutických režimů s rizikem FN nad 20 %.
Studie OPERa byla financována společností Amgen s. r. o.
Poděkování
Brychta M.1, Cinek P.2, Dvořáková D.3, Gruna J.4, Hluší A.5, Hnátková M.6, Holíková M.7, Chodacká M.8, Jarkovský J.9, Kandrnal V.9, Klepetko P.10, Koževnikovová R.11, Móciková H.12, Šafanda M.13, Šedivá M.14, Šulc D.15, Tajblová J.16, Vokurka S.17, Vraštilová P.18, Švomová M.9
1Radioterapeutická a onkologická klinika 3. LF UK a FN Královské Vinohrady, Praha, 2Onkologické oddělení, ÚVN Praha, 3Komplexní onkologické centrum, Multiscan s.r.o., Pardubice, 4Komplexní onkologické centrum, Nový Jičín, 5Hemato-onkologická klinika LF UP a FN Olomouc, 61. interní klinika 1. LF UK a VFN v Praze, 7Komplexní onkologické centrum, Krajská nemocnice Liberec, 8Komplexní onkologické centrum, Nemocnice Chomutov, o.z.,9Institut biostatistiky a analýz MU, Brno, 10Oddělení klinické onkologie, Oblastní nemocnice Kolín a.s., 11Medicon a.s., Praha, 12Oddělení klinické hematologie 3. LF UK a FN Královské Vinohrady, 13Oddělení klinické onkologie, Nemocnice Na Homolce, Praha 14Urologické oddělení FN Brno, 15Komplexní onkologické centrum, Ústí n. Labem, 16Komplexní onkologické centrum, FN Plzeň, 17Hematologicko-onkologické oddělení, FN Plzeň, 18Komplexní onkologické centrum FN v Motole.
Autorka deklaruje, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Petra Tesařová, CSc.
Onkologická klinika 1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
Obdrženo: 5. 11. 2013
Přijato: 14. 11. 2013
Zdroje
1. Caggiano V, Weiss RV, Rickert TS et al. Incidence, cost, and mortality of neutropenia hospitalization associated with chemotherapy. Cancer 2005; 103(9): 1916–1924.
2. Lyman GH, Michels SL, Reynolds MW et al. Risk of mortality in patients with cancer who experience febrile neutropenia. Cancer 2010; 116(23): 5555–5565.
3. Freifeld AG, Bow EJ, Sepkowitz KA et al. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 update by the infectious diseases society of america. Clin Infect Dis 2011; 52(4): e56–e93.
4. Nccn.org [homepage on the Internet]. National Comprehensive Cancer Network (NCCN) guidelines. Available from: http://www.nccn.org.
5. Smith TJ, Khatcheressian J, Lyman GH et al. 2006 update of recommendations for the use of white blood cell growth factors: an evidence-based clinical practice guideline. J Clin Oncol 2006; 24(19): 3187–3205.
6. Uptodate.com [homepage on the Internet]. Available from: http:/www.uptodate.com.
7. Pinto L, Liu Z, Doan Q et al. Comparison of pegfilgrastim with filgrastim on febrile neutropenia, grade IV neutropenia and bone pain: a meta-analysis of randomized controlled trials. Curr Med Res Opin 2007; 23(9): 2283–2295.
8. Aapro MS, Bohlius J, Cameron DA et al. 2010 update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours. Eur J Cancer 2011; 47(1): 8–32.
9. Ozer H, Armitage JO, Bennett CL et al. 2000 update of recommendations for the use of hematopoietic colony-stimulating factors: evidence-based, clinical practice guidelines. American Society of Clinical Oncology Growth Factors Expert Panel. J Clin Oncol 2000; 18(20): 3558–3585.
10. Timmer-Bonte JN, Adang EM, Smit HJ et al. Cost-effectiveness of adding granulocyte colony-stimulating factor to primary prophylaxis with antibiotics in small-cell lung cancer. J Clin Oncol 2006; 24(19): 2991–2997.
11. Vogel CL, Wojtukiewicz MZ, Carroll RR et al. First and subsequent cycle use of pegfilgrastim prevents febrile neutropenia in patients with breast cancer: a multicenter, double-blind, placebo-controlled phase III study. J Clin Oncol 2005; 23(6): 1178–1184.
12. Lathia N, Mittmann N, DeAngelis C et al. Evaluation of direct medical costs of hospitalization for febrile neutropenia. Cancer 2010; 116(3): 742–748.
13. Kuderer NM, Dale DC, Crawford J et al. Impact of primary prophylaxis with granulocyte colony-stimulating factor on febrile neutropenia and mortality in adult cancer patients receiving chemotherapy: a systematic review. J Clin Oncol 2007; 25(21): 3158–3167.
14. Sung L, Nathan PC, Alibhai SM et al. Meta-analysis: effect of prophylactic hematopoietic colony-stimulating factors on mortality and outcomes of infection. Ann Intern Med 2007; 147(6): 400–411.
15. Cooper KL, Madan J, Whyte S et al. Granulocyte colony-stimulating factors for febrile neutropenia prophylaxis following chemotherapy: systematic review and meta-analysis. BMC Cancer 2011; 11 : 404.
16. Bohlius J, Herbst C, Reiser M et al. Granulopoiesis-stimulating factors to prevent adverse effects in the treatment of malignant lymphoma. Cochrane Database Syst Rev 2008; (4): CD003189.
17. Bennett CL, Djulbegovic B, Norris LB et al. Colony-stimulating factors for febrile neutropenia during cancer therapy. N Engl J Med 2013; 368(12): 1131–1139.
18. Leonard RC, Mansi J, Benstead K et al. Secondary PROphylaxis with G-CSF has a major effect on delivered dose intensity: the results of the UK NCRI/Anglo Celtic SPROG trial for adjuvant chemotherapy of breast cancer. EJC Supplements 2009; 7(2): 271.
19. Bonadonna G, Valagussa P, Moliterni A et al. Adjuvant cyclophosphamide, methotrexate, and fluorouracil in node-positive breast cancor: the results of 20 years of follow-up. N Engl J Med 1995; 332(14): 901–906.
20. Bonadonna G, Moliterni A, Zambetti M et al. 30 years’ follow up of randomised studies of adjuvant CMF in operable breast cancer: cohort study. BMJ 2005; 330(7485): 217.
21. Chirivella I, Bermejo B, Insa A et al. Optimal delivery of anthracycline-based chemotherapy in the adjuvant setting improves outcome of breast cancer patient. Breast Cancer Res Threat 2009; 114(3): 479–484.
22. Pettengel R, Schwenkglenks M, Bosly. Association of reduced relative dose intensity and survival in lymphoma patients receiving CHOP-21 chemotherapy. Ann Hematol 2008; 87(5): 429–430.
23. Epelbaum R, Faraggi D, Ben-Arie Y et al. Survival of diffuse large cell lymphoma. A multivariate analysis including dose intensity variables. Cancer 1990; 66(6): 1124–1129.
24. Terada Y, Nakamae H, Moriguchi R et al. The impact of relative dose intensity of rituximab-CHOP on survival in Diffuse Large B-Cell Lymphoma patients. Blood (ASH Annual Meeting Abstracts) 2008; 112: abstr. 4931.
25. Hirakawa T, Yamaguchi H, Gomi S et al. Importance of relative dose intensity for survival in Diffuse Large B-Cell Lymphoma Patients treated with CHOP-Like regimen. Blood (ASH Annual Meeting Abstracts) 2008; 112: abstr. 3605.
26. Pettengell R, Gurney H, Radford JA et al. Granulocyte colony-stimulating factor to prevent dose-limiting neutropenia in non-Hodgkin‘s lymphoma: a randomized controlled trial. Blood 1992; 80(6): 1430–1436.
27. Rivera E, Erder MH, Moore TD et al. Targeted filgrastim support in patients with early-stage breast carcinoma: toward the implementation of a risk model. Cancer 2003; 98(2): 222–228.
28. Fosså SD, Kaye SB, Mead GM et al. Filgrastim during combination chemotherapy of patients with poor-prognosis metastatic germ cell malignancy. European Organization for Research and Treatment of Cancer, Genito-Urinary Group, and the Medical Research Council Testicular Cancer Working Party, Cambridge, United Kingdom. J Clin Oncol 1998; 16(2): 716–724.
29. Aapro M, Schwenkglenks M, Lyman GH et al. Pegfilgrastim primary prophylaxis vs. current practice neutropenia management in elderly breast cancer patients receiving chemotherapy. Crit Rev Oncol Hematol 2010; 74(3): 203–210.
30. Tjan-Heijnen VC, Postmus PE, Ardizzoni A et al. Reduction of chemotherapy-induced febrile leucopenia by prophylactic use of ciprofloxacin and roxithromycin in small-cell lung cancer patients: an EORTC double-blind placebo-controlled phase III study. Ann Oncol 2001; 12(10): 1359–1368.
31. Dranitsaris G, Rayson D, Vincent M et al. Identifying patients at high risk for neutropenic complications during chemotherapy for metastatic breast cancer with doxorubicin or pegylated liposomal doxorubicin: the development of a prediction model. Am J Clin Oncol 2008; 31(4): 369–374.
32. Lyman GH, Kuderer NM, Crawford J et al. Predicting individual risk of neutropenic complications in patients receiving cancer chemotherapy. Cancer 2011; 117(9): 1917–1927.
33. Moreau M, Klastersky J, Schwarzbold A et al. A general chemotherapy myelotoxicity score to predict febrile neutropenia in hematological malignancies. Ann Oncol 2009; 20(3): 513–519.
34. Sharma S, Rezai K, Driscoll D et al. Characterization of neutropenic fever in patients receiving first-line adjuvant chemotherapy for epithelial ovarian cancer. Gynecol Oncol 2006; 103(1): 181–185.
35. Herskovic A, Martz K, al-Sarraf M et al. Combined chemotherapy and radiotherapy compared with radiotherapy alone in patients with cancer of the esophagus. N Engl J Med 1992; 326(24): 1593–1598.
36. Pignon JP, Arriagada R, Ihde DC et al. A meta-analysis of thoracic radiotherapy for small-cell lung cancer. N Engl J Med 1992; 327(23): 1618–1624.
37. Marina J, Carabantes FJ, Escrivá de Romani S et al. Current practice of prophylaxis with granulocyte colony-stimulating factors for preventing chemotherapy-induced neutropenia in breast cancer patients in Spain. Eur J Cancer Supplements 2009 : 7(2): 181.
38. Timmer-Bonte JN, de Boo TM, Smit HJ et al. Prevention of chemotherapy-induced febrile neutropenia by prophylactic antibiotics plus or minus granulocyte colony-stimulating factor in small-cell lung cancer: a Dutch Randomized Phase III Study. J Clin Oncol 2005; 23(31): 7974–7984.
39. Haim N, Shulman K, Goldberg H et al. The safety of full-dose chemotherapy with secondary prophylactic granulocyte colony stimulating factor (G-CSF) following a prior cycle with febrile neutropenia. Med Oncol 2005; 22(3): 229–232.
40. Chouaid C, Bassinet L, Fuhrman C et al. Routine use of granulocyte colony-stimulating factor is not cost-effective and does not increase patient comfort in the treatment of small-cell lung cancer: an analysis using a Markov model. J Clin Oncol 1998; 16(8): 2700–2707.
41. Crawford J, Ozer H, Stoller R et al. Reduction by granulocyte colony-stimulating factor of fever and neutropenia induced by chemotherapy in patients with small-cell lung cancer. N Engl J Med 1991; 325(3): 164–170.
42. Debled M, Houédé N, Madranges N et al. Does chemotherapy-induced neutropaenia result in a postponement of adjuvant or neoadjuvant regimens in breast cancer patients? Results of a retrospective analysis. Br J Cancer 2007; 97(12): 1642–1647.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Editorial – vývoj radioterapie
- Kouření a rakovina prsu
- Radiobiologická úskalí nových technik v radioterapii
- Onkogénny potenciál papilomavírusov
- Hodnocení kvality života pacientů na onkologickém oddělení – pilotní studie
- Pětileté výsledky IMRT karcinomu prostaty – toxicita
- Pětileté výsledky IMRT karcinomu prostaty – kontrola nádoru
- Bilaterálne germinatívne nádory testis – dlhoročné skúsenosti
- Informace z České onkologické společnosti
- Studie OPERa
- Syndróm hornej dutej žily v onkológii
- Studie CLARINET – průkaz antiproliferativního účinku lanreotidu
- XOFIGO® (radium‑ 223 dichlorid) v léčbě metastatického kastračně rezistentního karcinomu prostaty
- Zajímavé případy z nutriční péče v onkologii
- Je předoperační scintigrafie skeletu v časném stadiu karcinomu prsu T1N0 indikovaná a smysluplná?
-
Onkologie v obrazech
Pacient s recidivujícím melanomem na pravé tváři
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndróm hornej dutej žily v onkológii
- Je předoperační scintigrafie skeletu v časném stadiu karcinomu prsu T1N0 indikovaná a smysluplná?
- Kouření a rakovina prsu
- Hodnocení kvality života pacientů na onkologickém oddělení – pilotní studie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy