-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Radiobiologická úskalí nových technik v radioterapii
Radiobiological Pitfalls of New Techniques in Radiotherapy
Radiotherapy techniques in the last decade evolved to the stage where the potential dose distribution significantly differs from earlier practices. Rotational IMRT, robotic radiotherapy or proton radiotherapy enables extremely precise dose delivery totarget volumes, on the other hand, these techniques can yield a number of problems. As for photon radiotherapy, this concerns primarily the effect of large volume irradiation with doses of 0.1−0.5 Gy. In this range, the hypersensitivity to low doses and the bystander effect may play an important role. Proton therapy is upredictable in its radiobiological effect at the end of the Bragg curve and there is also uncertainty about the peak‘s exact location. These effects should be taken into account when choosing among the irradiation techniques or when applying tolerance doses to critical organs in clinical practice, especially in younger patients with long survival expectation.
Key words:
radiobiology – proton beam therapy – by-stander effect – low dose hypersensitivity
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
30. 7. 2013Accepted:
3. 8. 2013
Autoři: J. Kubeš; B. Ondrová; P. Vítek; S. Vinakurau
Působiště autorů: Oddělení protonové terapie, Proton Therapy Center Czech, Praha
Vyšlo v časopise: Klin Onkol 2013; 26(6): 394-398
Kategorie: Přehled
Souhrn
Radioterapeutické techniky se v posledním desetiletí vyvinuly do stadia, ve kterém se dosahuje dávkových distribucí významně se lišících od dřívějších postupů. Rotační IMRT, robotická radioterapie nebo protonová radioterapie umožňují mimořádně přesné dodání dávek do cílových objemů, přinášejí ale nové problémy. Pro fotonovou radioterapii se jedná zejména o efekt dávek mezi 0,1−0,5 Gy distribuovaných do velkého objemu. V těchto dávkových oblastech se může uplatňovat hypersenzitivita na nízké dávky a bystander efekt. Protonová terapie má rezervy v radiobiologické účinnosti na distálním konci Braggova peaku a jeho přesné poloze. Tyto jevy je nutno brát v úvahu při volbě ozařovacích technik a klinickém použití tolerančních dávek na kritické orgány, zejména u mladších nemocných s dlouhou předpokládanou dobou přežití.
Klíčová slova:
radiobiologie – protonová radioterapie – by-stander efekt – hypersenzitivita na nízké dávkyÚvod
Kontinuální vývoj v radioterapii dospěl do dalšího stadia. Díky novým technologiím fotonové radioterapie, jako jsou stereotaktické metody (CyberKnife, GammaKnife), či technologiím rotační IMRT a v neposlední řadě díky technologiím částicové radioterapie lze v nebývalé míře redukovat zátěž zdravých tkání. Pro fotony i částice je typický nárůst konformity ozáření, ovšem moderní techniky fotonové terapie výrazně zvyšují integrální dávku v organizmu, tedy objem tkáně, který je zatížen nízkými dávkami. Naproti tomu protonová terapie integrální dávku významně snižuje. Má také vyšší homogenitu než stereotaktické (fotonové) techniky. Hlavní nejistoty protonové terapie spočívají zejména v nejistém stanovení radiobiologické účinnosti. Díky těmto pokrokům vzniká ve fotonové terapii potřeba zabývat se dávkami, které byly a jsou dosud považovány za přijatelné, ale které v dlouhodobém horizontu mohou významně ovlivnit život nemocných. U částicové radioterapie se mění přístupy plánování tak, aby byly brány v úvahu nejistoty s ní spojené.
Radiobiologická východiska
Ionizující záření indukuje poškození DNA, zejména vznik tzv. dvojitých zlomů DNA. Tyto se dosud považují za základní mechanizmus buněčné smrti. V případě záření s vysokým lineárním přenosem energie hrají roli shluky jiných poškození DNA na krátké vzdálenosti, které je pro buňku obtížné reparovat [1]. Tato poškození DNA mohou výjimečně vést k okamžité buněčné smrti, obvykle se ale projeví s odstupem a buňky odumírají apoptózou buď při pokusu o dělení, nebo před ním. Od určité prahové dávky se aktivuje alternativní mechanizmus signalizace k apoptóze vycházející přímo z buněčných membrán, cestou tzv. ceramidové dráhy [2]. Protože se tato dráha aktivuje při dávkách okolo 8 Gy, v klinické praxi se týká zejména stereotaktické radioterapie. Oproti dřívější době se díky novým technologiím dostáváme v klinické praxi do situace, kdy naši pozornost musíme upřít mnohem častěji do oblastí dávek, které nebyly brány v minulosti v úvahu. Na straně nízkých dávek se do centra pozornosti dostává efekt středně nízkých dávek (v oblasti 30−50 % izodózy), které jsou pod uznávanými tolerančními dávkami, hypersenzitivita na nízké dávky (low-dose hypersenzitivity − LDH) a bystander efekt, v oblasti vysokých dávek pak alternativní mechanizmy účinku ionizujícího záření, než je poškození DNA.
Modelování vztahu dávka−odpověď
Vztah mezi dávkou a úmrtím buněk po ozáření popisuje tradiční dvousložkový lineárně kvadratický model, ve kterém po počáteční oblasti raménka následuje strmější odpověď s rostoucí dávkou. Oblast raménka odpovídá stavu reparace části vzniklého poškození DNA a lineární strmější pokles odpovídá saturaci kapacity reparačních enzymů. Tento model však selhává v oblasti nízkých dávek, typicky pod 0,5−0,6 Gy. Do těchto dávek se odpověď na ozáření chová odlišně. V první fázi křivky je odpověď významně strmější, než by model naznačoval. Tato oblast se označuje jako oblast hypersenzitivity na nízké dávky (LDH). Podkladem pro tuto reakci je kombinace absence růstového arestu a chybění reparace [3]. Buňky pokračují k mitóze s nereparovaným poškozením, které se při mitóze projeví apoptózou nebo vznikem mutovaného buněčného klonu. Hypersenzitivita je patrně vázána na fázi buněčného cyklu a projevuje se více u radiorezistentních buněk [4]. V další fázi je odpověď buněk na záření menší, než by se předpokládalo. Tento jev se označuje jako adaptivní odpověď a jeho podkladem je zvýšení kapacity reparačních enzymů v důsledku poškození DNA. Relevantními dávkami pro tuto oblast jsou dávky okolo 0,3−0,6 Gy. Při vyšších dávkách se křivka dávka−odpověď již stává exponenciální − tato oblast odpovídá naplnění kapacit reparačních enzymů, a výsledkem je tedy exponenciální odpověď. Otázkou je vývoj křivky po dávce 6−8 Gy, tedy po spuštění signálů vyvolávajících apoptózu na buněčné membráně. Vývoj křivky dávka–odpověď ukazuje obr. 1.
Obr. 1. Odpověď buněk na ionizující záření. Obr. 1 A. Klasická křivka (plná čára) předpokládá existenci raménka odpovídajícího reparaci ze subletálního poškození. Křivka beroucí v úvahu hypersenzitivitu na nízké dávky (LDH) a adaptivní odpověď (AR) je při nízkých dávkách odlišná (přerušovaně) a v oblasti nízkých dávek klesá výrazně strměji, než klasický model předpokládá. Obr. 1 B. Změna odpovědi proti původnímu modelu. Při nízkých dávkách je odpověď vyšší, než je predikováno, protože nedochází k aktivaci reparačních dějů (oblast hypersenzitivity na nízké dávky, HRS), po aktivaci reparačních enzymů je naopak nižší (oblast adaptivní odpovědi, AR) a až po vyčerpání kapacity reparačních enzymů odpovídá klasickému modelu. SF – frakce přežívajících buněk. 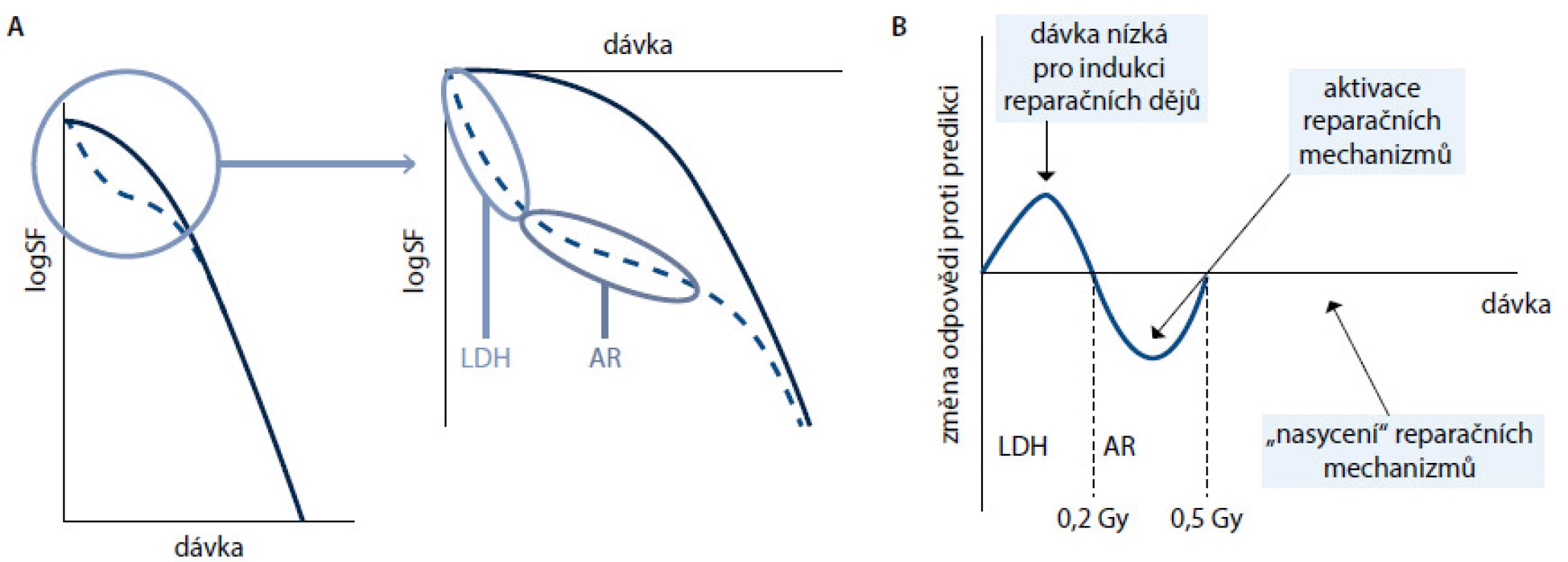
Toleranční dávky nejsou bezpečnými dávkami
Současný koncept tolerančních dávek v radioterapii vznikl již v 80. letech [5] a zásadní revize byla publikována v roce 2010 [6]. Publikované analýzy vycházejí z éry 3D CRT (3D konformní radioterapie), hodnocenými parametry jsou velmi závažné nežádoucí účinky (např. nekróza mozkové tkáně, symptomatická pneumonitida) a počítají s poměrně vysokým rizikem vzniku daného nežádoucího účinku (obvykle mezi 5−20 % v období pěti let od ozáření) [6]. Je nutno si uvědomit, že toleranční dávka je v tomto konceptu pouze dávkou vedoucí k určité pravděpodobnosti výskytu nežádoucího účinku. Hodnota toleranční dávky byla určena na základě vztahu rizika a efektu záření, ale v kontextu existující technologie. Není stanoveno, že toleranční dávky musejí nutně platit i pro nové technologie a dávky akceptované v nedávné minulosti se mohou s rostoucími znalostmi stát dávkami nepřijatelnými. Typickým příkladem je toleranční dávka na plicní tkáň. V současné době široce akceptujeme střední dávku na plíce (Dmean) do 20 Gy jako dávku povolenou. Vycházíme přitom z prací provedených u nemocných s karcinomem plic, tedy se špatnou prognózou a krátkou dobou dožití. Tato dávka však vede u 20−40 % nemocných k těžké radiační pneumonitidě s nutností kortikoterapie a oxygenoterapie [7]. Může být tato toleranční dávka akceptována u jiných diagnóz, kde je doba dožití významně vyšší? Domníváme se, že nikoliv – v takových situacích je nezbytně nutné snížit hranici akceptovatelné dávky na kritický orgán na hodnoty, které nesou riziko vzniku radiační pneumonitidy menší než 5 %, tj. na úrovni střední dávky na plíce < 10 Gy. Jiným příkladem jsou toleranční dávky na mozek. Nyní uváděné dávky, tj. Dmax < 60 Gy, jsou dávkami majícími 3% riziko vzniku nekrózy mozkové tkáně. To je ale již velmi těžký, potenciálně fatální nežádoucí účinek. Z hlediska dlouhodobě přežívajících nemocných ale hrají významnou roli daleko nižší toleranční dávky pro oblasti, jako je hippocampus, limbický okruh nebo vnitřní ucho, jejichž dodržení je nutné pro zachování intelektu, paměti, sluchu a dalších funkcí [8,9]. Nové technologie tak nemohou přejímat toleranční dávky vzniklé v době 2D a 3D radioterapie, ale musejí pracovat s novými, subtilnějšími sadami dávkových limitů a tzv. normal tissue complications probability (NTCP) modely, které berou v úvahu více faktorů než prosté použití tolerančních dávek. Stejně tak je nutno vybrat podskupiny nemocných (zejména těch, u kterých lze předpokládat dlouhodobé přežívání), pro které budou tyto přísnější toleranční dávky aplikovány.
Hypersenzitivita na nízké dávky může ovlivnit NTCP
V oblasti nižších dávek hraje roli hypersenzitivita na nízké dávky. Honoré et al prokázali, že LDH může ovlivnit NTCP. Zdá se, že LDH má největší vliv u orgánů s vysokým objemovým efektem [10]. Data dále naznačují, že LDH je přítomna zejména v buňkách v G2 fázi růstového cyklu, a tak by její vliv na pomalu reagující tkáně mohl být menší. Stále však není jasno v tom, jaký má tento jev vliv při použití moderních radioterapeutických technik.
„Bystander“ efekt
S nízkými dávkami ionizujícího záření souvisí tzv. bystander efekt, který je definován jako efekt ionizujícího záření mimo ozářenou oblast. Díky technologiím experimentálního ozařování pomocí mikropolí je o tomto mechanizmu účinku v současné době známo, že je způsoben ozářením cytoplazmy buněk, na neozářené buňky se šíří intercelulární komunikací [11], k jeho vzniku není nutný přímý kontakt buněk [12] a indukuje poškození DNA v neozářených buňkách [13]. Bystander efekt se chová podle lineárního bezprahového modelu, je tedy přítomen již v oblasti velmi nízkých dávek. Dále je známo, že potomstvo buněk reagujících bystander efektem je zatíženo zvýšeným počtem mutací a chromozomálních aberací [14]. Nutno však uvést, že existují práce neprokazující vliv bystander efektu [15] a indukce bystander efektu je jiná pro záření s nízkým a vysokým lineárním přenosem energie [16]. Potenciálními klinickými důsledky tohoto efektu může být indukce genetické nestability mimo ozářenou oblast, zejména z hlediska možné indukce pozdních nežádoucích účinků radioterapie [17] a sekundárních malignit [18]. Korelace s velikostí ozařované oblasti aktuálně jasná není.
Radiobiologie protonového svazku
Protony se obecně považují za částice s nízkým lineárním přenosem energie (linear energy transfer – LET) a v klinice se jejich fyzikální dávka násobí koeficientem 1,1 (k dosažení stejné radiobiologické účinnosti (RBÚ) jako mají 6MeV fotony). Problémem je to, že na konci jeho dráhy se při zpomalení protonu zvyšuje jeho LET, a tím i RBÚ. Zároveň se příspěvek těchto high-LET („pomalých“) protonů k dávce snižuje proximálně ve směru svazku (vlivem příspěvku protonů s vyšší energií k dávce proximálně v objemu). Hlavní rizikovou oblastí je tedy distální okraj protonového pole. Zvýšení RBÚ lze v současné době modelovat a pohybuje se pro cílový objem (PTV) a kritické orgány v řádu 0,5−5 CGE (0,7−7 %) pro Dmean a Dmax [19]. V praxi se s tímto jevem pracuje tak, že se nedoporučuje lokalizovat distální hranu pole do blízkosti kritického orgánu. Na druhou stranu fyzikální distribuce dávky umožňuje ve většině případů dodržení značné rezervy v dávce na kritické orgány, a tedy i při možném riziku navýšení biologické dávky v oblasti distální hrany nedojde k překročení limitů pro tyto orgány. Přesná poloha Braggova peaku je závislá na množství tkáně, kterou svazek prochází. Proto je v protonové terapii mimořádně důležitý pravidelný „replanning“ s případnou změnou plánu při regresi nádoru či změně objemu tkání.
Další nejistotou je vznik sekundárních neutronů a jejich potenciální vliv na indukci sekundárních malignit. Sekundární neutrony vznikají zejména při použití rozptylových způsobů aplikace protonového svazku, kdy protony procházejí velkým množstvím materiálu v apertuře a kompenzátoru. Tyto neutrony skutečně představují v dlouhodobém horizontu možné riziko. Pro tužkové skenování (pencil beam scanning – PBS) je však situace jiná – protony neprocházejí materiálem a vznik sekundárních neutronů je redukován na hodnoty řádově nižší než pro IMRT [20]. Ve větších vzdálenostech (cca od 25 cm a dále) od okraje pole je i pro starší rozptylovou techniku protonového ozařování ekvivalentní neutronová dávka cca 2–3krát nižší než dávka mimo objem při užití IMRT techniky (energie fotonů 6 MV), pro orgány vzdálené od cílového objemu je tedy výhodnější protonové ozáření jakoukoliv technikou [21]. Produkce sekundárních neutronů není zdaleka zanedbatelná ani u fotonové IMRT užívající energii vyšší než 6 MV. Vypočítaný neutronový dávkový ekvivalent z jedné monitorovací jednotky (MU) při užití IMRT techniky pro léčbu karcinomu prostaty (energie svazku 18 MV) se pohyboval od 7 do 18 µSv. [22]. Protože IMRT vyžaduje 3,5–5krát více MU ve srovnání s konvenční radioterapií, nejsou ani klinické důsledky zcela zanedbatelné. Například pro pacienty s karcinomem prostaty se pohybuje riziko fatální sekundární malignity indukované radioterapií od 1,7 % pro konvenční radioterapii až k 5,1 % při užití IMRT 18 MeV [23]. I z těchto důvodů není IMRT u pediatrických pacientů doporučena k rutinnímu užití, měla by být vyhrazena pro komplikované případy, kdy pro blízkost kritických struktur nelze použít konvenční 3D radioterapii [24].
Klinické důsledky
Klinické důsledky nízkých a velmi nízkých dávek radioterapie na kvalitu života nemocných jsou poměrně dobře dokumentovány. U dětí dávky na hypothalamus nižší než 0,1 Gy na frakci vedou ke kognitivním poruchám [25]. Akutní únava v průběhu radioterapie nádorů hlavy a krku byla statisticky významně horší pro skupinu léčenou IMRT než 3D technikou [26]. Riziko akutní pneumonitidy koreluje s objemem plic ozářeným nízkými dávkami [27]. Při užití IMRT technik v oblasti hrudníku byla pozorována nečekaná toxicita při dodržení běžně užívaných dávkových limitů pro ozáření plic související s rozsahem ozářené plíce. Tento rozsah se v některých případech při IMRT velmi blíží objemům, jaké jsou pozorovány při celotělovém ozařování [28]. Při velkých ozářených objemech plic se zdá být lepším prediktorem závažné pneumonitidy parametr V5 (objem plic ozářený dávkou 5 Gy) než běžněji užívané V20 (objem plic ozářený dávkou 20 Gy) nebo MLD [29]. Pro rozvoj plicní toxicity není tedy důležité pouze to, jak velký objem je ozářen, ale také jak velký objem plic je ozáření ušetřen. Historicky byly za významné pro vznik změn v oční čočce vlivem ionizujícího záření považovány dávky nejméně 0,5–2 Sv (vznik opacit) a 5 Sv pro visus limitující kataraktu. V poslední dekádě se ale ukázalo, že tyto již klinicky významné dávky jsou nižší, pohybují se od 0 do 0,8 Gy, nelze tedy dokonce vyloučit absenci prahové dávky [30,31]. Obdobně je z hlediska sekundárních malignit prokázán vliv i velmi nízkých dávek. U dětí léčených v minulosti zářením pro benigní léze (tinea capitis, hemangiom, zvětšení thymu) bylo zjištěno zvýšení rizika vzniku tumoru štítné žlázy nebo prsu již při dávkách od 0,1 Gy [32].
Dostupné technologie a potenciální radiobiologické důsledky
Z hlediska zátěže středně nízkými dávkami je nutno brát v úvahu dávkovou distribuci a frakcionační režim. Největší objem „nízké dávky“ mimo cílový objem má normofrakcionovaná fotonová radioterapie (oblast 10–30 % izodózy, tj. 0,2–0,6 Gy), zejména rotační IMRT terapie. U stereotaxe je uvedená dávka dodána též do rozsáhlého objemu, vzhledem k velmi krátkým frakcionačním režimům je zátěž násobně nižší než pro normofrakcionované IMRT techniky. Vstupní dávka protonového pole je 30–40 % předepsané dávky (při normofrakcionaci odpovídá dávce 0,4–0,8 Gy), obvykle však v minimálním objemu (ve srovnání s již zmiňovanými IMRT technikami) a s možností volby dráhy dle přítomnosti kritických orgánů.
Shrneme-li výše uvedené, pak se z hlediska ozáření nízkými dávkami jeví jako nejrizikovější techniky IMRT, případně rotační terapie používané v normofrakcionovaných režimech, u kterých je region dávek na 0,2–0,6 Gy nejvyšší. Protonová terapie naproti tomu s sebou nese nejistotu nejasné RBE v distálním konci Braggova peaku. Je třeba nadále zachovávat opatrnost zejména v těch klinických situacích, kde je předpoklad dlouhodobého přežívání nemocných, a tedy riziko vzniku poškození po více než pěti letech. U protonové terapie je třeba dodržet přísnější limity dávek na kritické orgány, zejména pokud jsou v oblasti distální hrany pole. U rotační fotonové IMRT terapie je třeba kalkulovat s rizikem vlivu hypersenzitivity na nízké dávky, který se může projevit za velmi dlouhou dobu po radioterapii. Proto je použití IMRT technik u dětí nebo u mladých lidí s vysokou šancí na vyléčení předmětem značné diskuze, zejména existuje-li alternativa ve formě protonové radioterapie. V diskuzi o postavení jednotlivých technik v současné léčbě je třeba držet se toho, o co v radioterapii kontinuálně usilujeme – tj. redukovat dávky mimo cílový objem v maximální možné míře, není-li tím narušeno ozáření cílových objemů.
Závěr
Vývoj techniky užívané v radioterapii umožňuje nyní velmi přesnou aplikaci předepsaných dávek záření do cílových objemů. To umožňuje zabývat se efektem malých dávek, zdánlivě nevýznamných, aplikovaných do různých objemů zdravých tkání. Tyto dávky sice vyhovují běžným limitům zátěže různých orgánů, přesto ale významné jsou. Biologický efekt je zásadně závislý na integrálních dávkách, resp. na objemu tkáně ozářené malými dávkami. Je několik dostupných technik přesně cíleného ozařování, které dosahují podobného výsledku v rámci ozařovaného objemu. Mimo ozařovaný objem jsou ale rozdíly zásadní. Kvalitativní úroveň, jíž současná radioterapie dosáhla, vyžaduje zohledňovat i tento aspekt.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jiří Kubeš, Ph.D.
Oddělení protonové terapie
Proton Therapy Center Czech
Budínova 2437/1a
180 00 Praha 8
e-mail: jiri.kubes@ptc.cz
Obdrženo: 30. 7. 2013
Přijato: 3. 8. 2013
Zdroje
1. Goodhead DT. Initial events in the cellular effects of ionizing radiation: clustered damage to DNA. Int J Radiat Biol 1994, 65(1): 7–17.
2. Kolesnick R, Fuks Z. Radiation and ceramide-induced apoptosis. Oncogene 2003; 22(37): 5897–5906.
3. Rothkamm K, Lobrich M. Evidence for lack of DNA double-strand break repair in human cells exposed to very low x-ray doses. Proc Natl Acad Sci USA 2003; 100(9): 5057–5062.
4. Joiner MC, Marples B, Lambin P et al. Low-dose hypersensitivity: current status and possible mechanisms. Int J Radiat Oncol Biol Phys 2001; 49(2): 379–389.
5. Emami B, Lyman J, Brown A et al. Tolerance of normal tissue to therapeutic irradiation. Int J Radiat Oncol Biol Phys 1991; 21(1): 109–122.
6. Marks LB, Yorke ED, Jackson A et al. Use of normal tissue complication probability models in the clinic. Int J Radiat Oncol Biol Phys 2010; 76 (Suppl 3): S10–S19.
7. Tucker SL, Liu HH, Liao Z et al. Analysis of radiation pneumonitis risk using a generalized Lyman model. Int J Radiat Oncol Biol Phys 2008; 72(2): 568–574.
8. Gondi V, Hermann BP, Mehta MP et al. Hippocampal dosimetry predicts neurocognitive function impairment after fractionated stereotactic radiotherapy for benign or low-grade adult brain tumors. Int J Radiat Oncol Biol Phys 2013; 85(2): 348–354.
9. Marsh JC, Godbole R, Diaz AZ et al. Sparing of the hippocampus, limbic circuit and neural stem cell compartment during partial brain radiotherapy for glioma: a dosimetric feasibility study. J Med Imaging Radiat Oncol 2011; 55(4): 442–449.
10. Honoré HB, Bentzen SM. A modelling study of the potential influence of low dose hypersensitivity on radiation treatment planning. Radiother Oncol 2006; 79(1): 115–121.
11. Yang H, Asaad N, Held KD. Medium-mediated intercellular communication is involved in bystander responses of X-ray irradiated normal human fibroblasts. Oncogene 2005; 24(12): 2096–2103.
12. Mothersill C, Seymour CB. Cell-cell contact during gamma irradiation is not required to induce a bystander effect in normal human keratinocytes: evidence for release during irradiation of a signal controllin survival into the medium. Radiat Res 1998; 149(3): 256–262.
13. Iyer R, Lehnert BE. Factors underlying the cell growth-related bystander responses to alpha particles. Cancer Res 2000; 60 : 1290–98.
14. Lorimore SA, Chrystal JA, Robinson JI et al. Chromosomal instability in unirradiated hemaopoietic cells induced by macrophages exposed in vivo to ionizing radiation. Cancer Res 2008; 68(19): 8122–8126.
15. Sowa MB, Goetz W, Baulch JE et al. Lack of evidence for low-LET radiation induced bystander response in normal human fibroblasts and colon carcinoma cells. Int J Radiat Biol 2010; 86(2): 102–113.
16. Baskar R, Balajee AS, Geard CR. Effects of low and high LET radiations on bystander human lung fibroblast cell survival. Int J Radiat Biol 2007; 83(8): 551–559.
17. Morgan GW, Breit SN. Radiation and the lung: a reevaluation of the mechanisms mediating pulmonary injury. Int J Radiat Oncol Biol Phys 1995; 31 : 361–369.
18. Hall EJ, Wuu CS. Radiation-induced second cancers: the impact of 3D-CRT and IMRT. Int J Radiat Oncol Biol Phys 2003; 56(1): 83–88.
19. Frese MC, Wilkens JJ, Huber PE et al. Application of constant vs variable relative biological effectiveness in treatment planning of intensity-modulated proton therapy. Int J Radiation Oncology Biol Phys 2011; 79(1): 80–88.
20. Hall EJ. Intensity-modulated radiation therapy, protons, and the risk of second cancers. Int J Radiat Oncol Biol Phys 2006; 65(1): 1–7.
21. Athar BS, Bednarz B, Seco J et al. Comparison of out-of-field photon doses in 6 MV IMRT and neutron doses in proton therapy for adult and pediatric patients. Phys Med Biol 2010; 55(10): 2879–2891.
22. Kry SF, Salehpour M, Followill DS et al. Out-of-field photon and neutron dose equivalents from step-and-shoot intensity-modulated radiation therapy. Int J Radiation Oncology Biol Phys 2005; 62(4): 1204–1216.
23. Kry SF, Salehpour M, Followill DS et al. The calculated risk of fatal secondary malignancies from intensity-modulated radiation therapy. Int J Radiation Oncology Biol Phys 2005; 62(4): 1195–1203.
24. Sterzing F, Stoiber EM, Nill S et al. Intensity modulated radiotherapy (IMRT) in the treatment of children and adolescents – a single institution‘s experience and a review of the literature. Radiat Oncol 2009; 4 : 37.
25. Hall P, Adami HO, Trichopoulos D et al. Effect of low doses of ionising radiation in infancy on cognitive function in adulthood: Swedish population based cohort study. BMJ 2004; 328(7430): 19.
26. Gulliford SL, Miah AB, Brennan S et al. Dosimetric explanations of fatigue in head and neck radiotherapy: an analysis from the PARSPORT Phase III trial. Radiother Oncol 2012; 104(2): 205–212.
27. Shen WB, Zhu SC, Gao HM et al. Low dose volume histogram analysis of the lungs in prediction of acute radiation pneumonitis in patients with esophageal cancer treated with three-dimensional conformal radiotherapy. Zhonghua Zhong Liu Za Zhi 2013; 35(1): 45–49.
28. Allen AM, Czerminska M, Jänne PA et al. Fatal pneumonitis associated with intensity-modulated radiation therapy for mesothelioma. Int J Radiat Oncol Biol Phys 2006; 65(3): 640–645.
29. Yorke ED, Jackson A, Rosenzweig KE et al. Correlation of dosimetric factors and radiation pneumonitis for non–small cell lung cancer patients in a recently completed dose escalation study. Int J Radiat Oncol Biol Phys 2005; 63(3): 672–682.
30. Shore RE, Neriishi K, Nakashima E. Epidemiological studies of cataract risk at low to moderate radiation doses: (not) seeing is believing. Radiat Res 2010; 174(6): 889–894.
31. Behrens R, Dietze G. Monitoring the eye lens: which dose quantity is adequate? Phys Med Biol 2010; 55(14): 4047–4062.
32. Kleinerman RA. Cancer risks following diagnosis and therapeutic radiation exposure in children. Pediatr Radiol 2006; 36 (Suppl 14): 121–125.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial – vývoj radioterapie
- Kouření a rakovina prsu
- Radiobiologická úskalí nových technik v radioterapii
- Onkogénny potenciál papilomavírusov
- Hodnocení kvality života pacientů na onkologickém oddělení – pilotní studie
- Pětileté výsledky IMRT karcinomu prostaty – toxicita
- Pětileté výsledky IMRT karcinomu prostaty – kontrola nádoru
- Bilaterálne germinatívne nádory testis – dlhoročné skúsenosti
- Informace z České onkologické společnosti
- Studie OPERa
- Syndróm hornej dutej žily v onkológii
- Studie CLARINET – průkaz antiproliferativního účinku lanreotidu
- XOFIGO® (radium‑ 223 dichlorid) v léčbě metastatického kastračně rezistentního karcinomu prostaty
- Zajímavé případy z nutriční péče v onkologii
- Je předoperační scintigrafie skeletu v časném stadiu karcinomu prsu T1N0 indikovaná a smysluplná?
-
Onkologie v obrazech
Pacient s recidivujícím melanomem na pravé tváři
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndróm hornej dutej žily v onkológii
- Je předoperační scintigrafie skeletu v časném stadiu karcinomu prsu T1N0 indikovaná a smysluplná?
- Kouření a rakovina prsu
- Hodnocení kvality života pacientů na onkologickém oddělení – pilotní studie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



