-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kouření a rakovina prsu
Smoking and Breast Cancer
Background:
Investigation of the relationship between smoking and breast cancer risk did not show a consensus in results – some studies described smoking as a risk factor, while others found its effects protective.Purpose:
The newest studies explain these differences by the genetic polymorphism. Cigarette smoke contains at least 20 chemical carcinogens, which are deposited and metabolically activated in the breast and surrounding adipose tissues. The substances are further detected in the nipple discharge or as smoking ‑ specific DNA adducts in breast tissue. Several studies postulate significantly higher risk of breast cancer among women who started smoking at an early age and/ or before their first delivery. Some studies from Japan, China, California have shown that long‑term exposure to passive smoking could significantly increase the risk of breast cancer in never smokers, while other scientist reject the evidence of this association as inconsistent. A possible protective effect of smoking on the incidence of breast cancer is explained by antiestrogenic activity of smoking, namely nicotine.Conclusion:
Smoking may play a role in the breast cancer incidence. Due to a wide spectrum of harmful effects of smoking, and with regards to the worse prognosis of breast cancer among smoking patients, the common recommendations for cancer prevention are similarly plausible in case of breast cancer – no ‑ smoking, no alcohol, fruit and vegetable consumption, physical activity and body weightcontrol.Key words:
smoking – breast neoplasms – epidemiologic studies
The author declare she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
17. 6. 2013Accepted:
27. 6. 2013
Autori: D. Hrubá
Pôsobisko autorov: Ústav preventivního lékařství LF MU, Brno
Vyšlo v časopise: Klin Onkol 2013; 26(6): 389-393
Kategória: Přehled
Súhrn
Východiska:
Při studiu vztahů mezi kouřením a rakovinou prsu dosud nebyly nalezeny jednoznačné výsledky – některé studie konstatovaly, že kouření je faktorem rizikovým, zatímco jiné shledaly jeho účinky protektivní.Cíl:
Novější studie nabízejí vysvětlení těchto rozdílů genetickým polymorfizmem. Cigaretový kouř obsahuje minimálně 20 chemických karcinogenů, jejichž cílovým orgánem je prsní žláza a okolní tuková tkáň, v níž se metabolicky aktivují a ukládají. Tyto látky a jejich metabolity se vyskytují v sekretu z prsní žlázy i jako specifické addukty DNA ve tkáni prsu. Mnohé studie shodně popisují signifikantní zvýšení rizika rakoviny prsu u kuřaček, které začaly kouřit v mladém věku a/ nebo před prvním těhotenstvím. Statisticky významné zvýšení rizika rakoviny prsu u žen dlouhodobě exponovaných pasivnímu kouření potvrdily prospektivní longidutinální studie z Japonska, Číny, Kalifornie, mnozí odborníci však tyto výsledky zpochybňují. Případný protektivní vliv kouření na incidenci zhoubných nádorů prsu je přisuzován antiestrogenním účinkům kouření, resp. nikotinu.Závěr:
Kouření pravděpodobně má rizikovou roli v iniciaci nádorů prsu. Vzhledem k širokému spektru škodlivých účinků kouření i k horší prognóze vývoje rakoviny prsu u kuřaček jsou preferována všeobecně známá doporučení i pro prevenci rakoviny prsu – nekouřit, nepít alkohol, konzumovat ovoce a zeleninu, být fyzicky aktivní, udržovat správnou hmotnost.Klíčová slova:
kouření – nádory prsu – epidemiologické studieÚvod
Studiem souvislostí kouření s výskytem rakoviny prsu u žen se zabývalo více než 130 epidemiologických studií, jejichž výsledky byly publikovány v odborných časopisech [1]. Další výzkumné práce s touto tematikou se týkaly studia výskytu chemických karcinogenů v cigaretovém kouři a mechanizmů jejich účinků na onkologické změny v prsní tkáni. Podle experimentálních toxikologických výsledků na hlodavcích obsahuje cigaretový kouř minimálně 20 chemických karcinogenů, vesměs lipofilních, jejichž cílovým orgánem je prsní žláza a okolní tuková tkáň [1 – 5]. Metabolickými přeměnami některých chemických látek v tabákovém kouři (především polycyklických aromatických uhlovodíků) [6] mohou vzniknout metabolity s vyšší mutagenní aktivitou. Jejich výskyt v sekretu z prsní bradavky [7] a markery mutagenní aktivity na DNA prsní tkáně [8 – 10] byly jednoznačně prokázány. Riziko rakoviny prsu v postmenopauze ovlivňuje i modifikace genotypu N ‑ acetyltransferázy 2 (NAT2), enzymu, který se účastní na metabolizmu aromatických aminů obsažených v cigaretovém kouři [11 – 13].
Přes tento významný vědecký zájem nebyly v epidemiologických studiích dosud nalezeny jednoznačně souhlasné výsledky – některé studie konstatovaly, že kouření je faktorem rizikovým, zatímco jiné shledaly jeho účinky protektivní. Za nejzávažnější námitku pro možnou kauzalitu kouření v iniciaci nádorů prsu je pokládán fakt, že nebyl nalezen vztah mezi délkou a intenzitou kouření a incidencí rakoviny prsu [3,14].
Protektivní účinky kouření
Případný protektivní vliv kouření na incidenci zhoubných nádorů prsu (a endometria) je přisuzován antiestrogenním účinkům kouření, resp. nikotinu. Hypotéza o antiestrogenním účinku kouření vychází z epidemiologických studií, při nichž bylo zjištěno, že:
- u kouřících žen nastává menopauza o několik let dříve, zatímco u bývalých kuřaček je průměrný věk menopauzy blízký věku nekuřaček [15];
- u kuřaček bývá častěji diagnostikována neplodnost na podkladě hormonální dysbalance [16,17];
- a snížena kostní denzita s časnějším nástupem osteoporózy [18];
- kouřící ženy v premenstruálním věku mají nižší hladiny estradiolu v séru [19];
- kuřačky mají nižší riziko rakoviny endometria [20];
- u aktivních kuřaček je častější nález snížené mamografické denzity [20];
- výraznější snížení mamografické denzity se vyskytuje u silných kuřaček a u žen, které začaly kouřit před dosažením 18. roku věku, a nulipar [20];
- účinky kouření na snížení denzity prsní tkáně ovšem naopak nepotvrdila studie Roubidoux et al [21].
Inverzní vztahy mezi percentuální mamografickou denzitou nebo celkovou plochou prsní tkáně a 4 – 6násobně zvýšeným rizikem zhoubných nádorů prsu popsali Boydová et al [22].
Antiestrogenní působení cigaretového kouře může probíhat různými mechanizmy, např.:
- kouřením indukovaná zvýšená aktivita mikrozomálního enzymu CYP 1A1 vyvolává vznik metabolitu 2 – hydroxyestronu, který má antiestrogenní účinky [23];
- u kuřaček jsou snížené hladiny růstového faktoru IGF‑1, jejichž hodnoty obecně pozitivně korelují s mamografickou denzitou [24];
- hodnoty mamografické denzity negativně korelují s tělesnou hmotností [22], která bývá u kuřaček nižší.
Antiestrogenní působení cigaretového kouře bylo prokázáno i u experimentálních zvířat, u nichž byly rovněž zjištěny ovariální i extraovariální mechanizmy, kterými se tento efekt uplatňuje [15]. Nicméně tuto hypotézu významně zpochybnila novější analýza 13 publikovaných studií, která zjistila, že silné kuřačky v postmenopauzálním věku měly signifikantně zvýšené hladiny cirkulujících estrogenů a androgenů [25].
Kouření jako rizikový faktor
Velké rozdíly mezi výsledky epidemiologických studií zaměřených na sledování souvislostí mezi kouřením a rakovinou prsu jsou popsány v přehledové studii Nagaty et al z Japonska [26]. Ve třech kohortových a osmi případových studiích publikovaných v letech 1966 – 2005 se relativní riziko incidence nebo úmrtnosti na rakovinu prsu u japonských kuřaček pohybovalo v rozpětí 0,71–6,26, častěji byly souvislosti pozitivní. S poukazem na rozporuplnou biologickou vysvětlitelnost vlivů kouření na tento typ zhoubného bujení autoři nakonec uzavírají, že i přes nejednotnost nálezů kouření pravděpodobně riziko rakoviny prsu zvyšuje.
K rizikovým faktorům nádorů prsu se řadí pozitivní rodinná anamnéza, konzumace alkoholu, dlouhodobé užívání hormonálních kontraceptiv, nadváha/ obezita. Některé z těchto rizik, zejména konzum alkoholu, se častěji vyskytují u kouřících žen [27 – 30]. Proto jsou významné takové epidemiologické studie, které tyto matoucí faktory sledují a ve výsledcích zohledňují. Jedna z nejnovějších studií hodnotících vztah kouření a ostatních rizikových faktorů k výskytu rakoviny prsu u žen předkládá jednak výsledky z vlastní kohortové studie Gaudeta et al CPS II Nutrition Cohort (American Cancer Society‘s Cancer Prevention Study II), započaté v roce 1992 jako podskupina původní CPS I, zahájené v roce 1982, a současně i meta‑analytické zpracování 32 starších publikací, s nimiž byly výsledky CPS II porovnávány v diskuzi [1]. Kohortová studie zahrnovala téměř 73 400 žen, z nichž 3 721 onemocnělo invazivním nádorem prsu. Jak stávající, tak i bývalé kuřačky měly signifikantně zvýšené riziko v porovnání s nekuřačkami (1,24; 95% CI 1,07 – 1,42; resp. 1,13; 95% CI 1,06 – 1,21). Velikost rizika nebyla ovlivněna ani intenzitou kouření (počet cigaret/ den) ani délkou doby kouření (v letech) a nezměnila se ani po standardizaci konzumace alkoholu, užívání hormonálních kontraceptiv nebo vlivem pozitivní rodinné anamnézy. Kouřící pacientky s estrogen ‑ receptor pozitivním typem nádoru měly sice riziko vyšší než kuřačky s estrogen ‑ receptor negativním typem, ale rozdíly nebyly statisticky významné.
Meta‑analytická část publikace stejných autorů zahrnovala soubor 991 100 žen z 15 kohortových studií, v němž bylo diagnostikováno 31 198 případů rakoviny prsu. Zvýšené riziko u stávajících kuřaček potvrdilo 12 z 15 kohortových studií (1,12; 95% CI 1,08 – 1,18) a 13 z 15 studií u bývalých kuřaček (1,09; 95% CI 1,04 – 1,18).
Ačkoliv vztahy mezi aktivním kouřením a iniciací nádorů prsu jsou mnohem volnější než u jiných typů karcinomů, jsou konzistentní u prospektivních kohortových studií [12,31 – 33]. Longitudinální studie Murina a Inciardiho v Kalifornii [34] a Fentimana et al v Londýně [35] také popsaly horší prognózu vývoje rakoviny prsu u kouřících žen – u kuřaček byl častější výskyt metastáz do plic [34] a po zahájení léčby měly kratší dobu přežití [35].
Také u žen, které přestaly kouřit, je riziko bývalého kuřáctví ve vztahu k rakovině prsu patrné – bylo popsáno ve 13 z 15 hodnocených studií [12,32,33,36 – 39].
V českém písemnictví byly po roce 2000 publikovány dvě studie – Dítětová [40] vztah mezi výskytem nádorů prsu u 227 žen a kouřením ani konzumací alkoholu nenašla, zatímco oba tyto faktory se v obdobně početné studii (n případů = 212) Rameše et al [41] ukázaly být jako protektivní. U aktivních kuřaček byl OR 0,61 (95% CI 0,38 – 0,97, p = 0,03), u pasivních, doma exponovaných kuřaček OR 0,57 (95% CI 0,35 – 0,93, p = 0,02) a obdobné hodnoty byly i u nekouřících pacientek exponovaných pasivnímu kouření v zaměstnání.
Vliv věku
Mnohé studie se zabývaly zjišťováním věku začátků kouření a popisují signifikantní zvýšení rizika rakoviny prsu u kuřaček, které začaly kouřit v mladém věku, resp. před prvním otěhotněním (tab. 1).
Tab. 1. Relativní riziko rakoviny prsu u kouřících žen podle začátků jejich kouření. 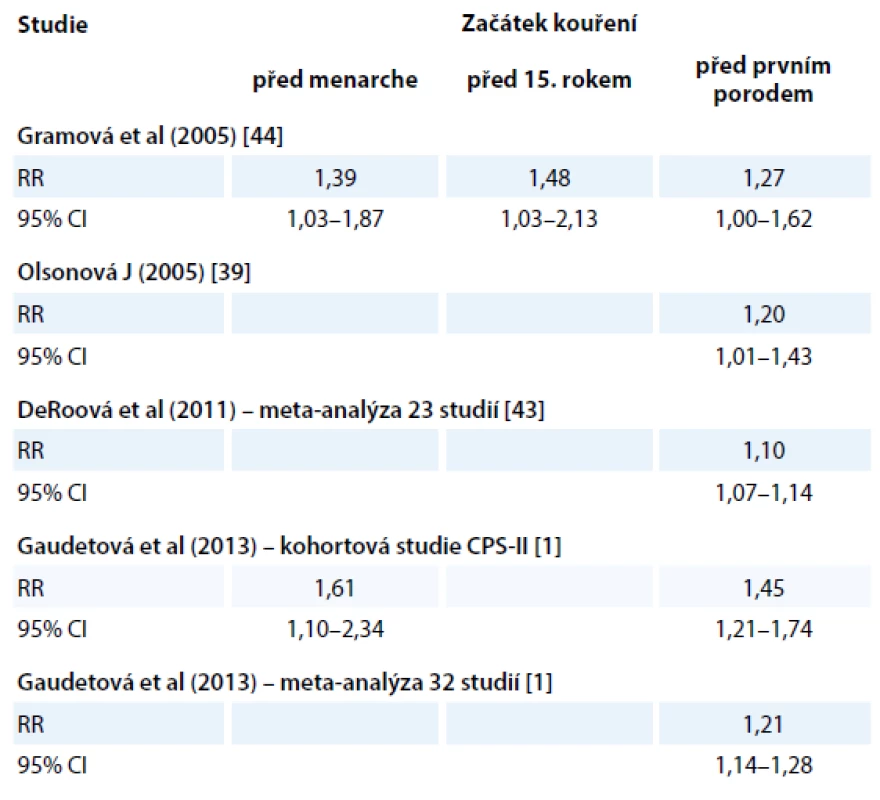
Tyto nálezy jsou vysvětlovány tak, že v prsní tkáni mladých a dosud netěhotných žen se nachází mnoho dosud nediferencovaných struktur, protože terminální lobulární jednotky jsou plně funkčně vyvinuty až koncem těhotenství. Dosud nezralá tkáň může být více vnímavá ke škodlivým účinkům chemických látek v cigaretovém kouři [42]. Vzhledem k tomu, že byl opakovaně nalezen vztah mezi rizikem rakoviny prsu a začátkem kouření v mladém věku a/ nebo před prvním těhotenstvím [43,44], ale chybí naopak jasný průkaz o závislosti na dávce (intenzitě, délce trvání kouření), lze usuzovat, že kouření má spíše vliv na iniciaci než na progresi nádoru [1].
Pasivní kouření
Jiné práce se zaměřily na výskyt rakoviny prsu u nekouřících žen, které jsou dlouhodobě exponovány pasivnímu kouření. Statisticky významné zvýšení rizika rakoviny prsu u žen premenopauzálního věku dlouhodobě exponovaných pasivnímu kouření potvrdila studie Hanaoka et al [45] z Japonska (RR 2,6; 95% CI 1,3 – 5,2). Autoři Reynolds et al [46] kalifornské studie sledující prospektivně zdravotní stav učitelek našli zvýšené riziko u pasivních kuřaček postmenopauzálního věku (1,25; 95% CI 1,01 – 1,56); v této studii byla nalezena pozitivní korelace k hodnotám kumulativní expozice. Nejnovější publikace Chena et al [28] prezentuje meta‑analytické zpracování osmi studií uveřejněných v letech 2001 – 2011 a sledujících ženy v Číně – jako pasivní kuřačky byly zahrnuty ženy exponované alespoň 15 min denně nejméně jeden den v týdnu. Všechny studie byly případové (celkem 4 542 případů a 5 114 kontrol); u čtyř z těchto studií byly ženy do kontrolního souboru (bez rakoviny prsu) vybírány jako párové k případům onemocnění. Analýza potvrdila signifikantně zvýšené riziko u pasivních kuřaček – při hodnocení všech osmi studií bylo OR 1,73 (95% CI 1,29 – 2,33); u čtyř studií s párovým designem byl test heterogenity velmi nízký (chi ‑ kvadrát 5,07) a OR ještě vyšší (1,98; 95% CI 1,63 – 2,42).
Vliv pasivního kouření na iniciaci nebo progresi rakoviny prsu naopak zpochybnil Peto v materiálech z UK/ US konference v roce 2007 [47] poukazem na předběžné výsledky anglické Million Women Study, které tyto asociace nenaznačovaly. I některé pozdější práce souvislosti mezi expozicí pasivnímu kouření a rakovinou prsu neprokázaly [48,49].
Diametrálně rozdílné názory mají i renomované světové agentury – zatímco California EPA svá pozorování uzavřela konstatováním, že kauzální vliv pasivního kouření na rakovinu prsu je konzistentní [4], později publikované hodnocení IARC z let 2004 a 2009 souvislosti zpochybnilo s poukazem na bias v případových studiích [50].
Genetický polymorfizmus
Vzhledem k výše uvedeným teoriím o iniciačních nádorových účincích některých karcinogenů nebo jejich aktivovaných metabolitů z tabákového kouře byly zkoumány rovněž osoby s rozdílným genetickým polymorfizmem ve výbavě mikrozomálními enzymy (výše zmíněná schopnost acetylace) [11 – 13] nebo geny ovlivňujícími reparace mutagenních změn DNA. Ve studii Shena et al [51] Long Island Breast Cancer Study Project prováděli autoři genotypizaci polymorfizmu genu MGMT (O6 – metylguanidin DNA methyltransferáza), který se účastní buněčné obrany před alkylačními sloučeninami prostřednictvím přímého působení na reparaci DNA. Identifikovali tři jednotlivé nukleotidy, které stanovovali u 1 067 pacientek a 1 110 kontrolních zdravých žen. U silných kuřaček zvyšovala přítomnost jedné varianty (alela 84 - T) riziko rakoviny prsu 3násobně. U žen s alelami 84 a 143 riziko karcinomu prsu významně snižovala konzumace ovoce a zeleniny, resp. suplementace jejich stravy α a β karoteny (ne však vitaminy C a E). Autoři uzavírají, že polymorfizmus MGMT významně modifikuje jak riziko chemických látek z cigaretového kouře, tak i protektivní účinnost antioxidantů [51].
Významnou roli v reparaci mutagenních poškození DNA má i poly(ADP ‑ ribose) polymeráza 1 (PARP1), jejíž snížená aktivita byla popsána u post‑menopauzálních žen s genetickým polymorfizmem rs1136410 s následným zvýšeným rizikem nádorů prsu pro aktivně, ne však pasivně kouřící ženy [52].
Dalším sledovaným genetickým faktorem modifikujícím velikost rizika nádorů prsu je polymorfizmus genů ovlivňujících estrogenové receptory, především receptor ER‑α (gen ESR1, rs2234693). Kombinace genotypů TC/ CC signifikantně zvyšovala riziko rakoviny prsu u pasivních kuřaček v premenopauzálním (OR 2,06; 1,39 – 3,05), u žen s TT genotypem v postmenopauzálním věku (2,40; 1,27 – 4,53) [52].
Jiný gen estrogenových receptorů ESR1 – rs9340799 – významně zvyšoval riziko nádorů prsu u bělošek, aktivních kuřaček v premenopauze, a naopak u žen indiánské a hispánské rasy v postmenopauzálním věku, exponovaných pasivnímu kouření [53].
Významné rasové rozdíly ve velikosti rizika kouření pro rakovinu prsu popisuje také studie Mechanica et al [54] ze Severní Karoliny (USA), jejíž autoři našli vysoké ohrožení u kouřících Afroameričanek, ale ne u bělošek. V souboru černošek měly významně vyšší riziko kuřačky, které byly nositelkami specifických kombinací genů zahrnutých do reparace nukleotidů (nucleotide excision repair – NER), které jsou pokládány za hlavní způsob obnovy poruch DNA vyvolaných kouřením. U černošských žen s určitými kombinacemi NER byly nalezeny souvislosti mezi velikostí rizika výskytu onemocnění a intenzitou kouření, délkou doby kouření, věkem začátků kouření i dobou abstinence u bývalých kuřaček.
Také ve studii autorů McKenzie et al [55] z Nového Zélandu našli vztah pasivního kouření k vyššímu riziku rakoviny prsu jen u původních maorských obyvatel, ale ne u žen bílé rasy; ženy s více než 20letou expozicí měly riziko signifikantně větší ve srovnání s ženami s expozicí kratší (OR 2,03; 1,29 – 3,22 vs OR 1,61; 0,55 – 4,74).
Závěr
Nejednoznačné výsledky o rizikovém nebo protektivním působení aktivního a pasivního kouření na rakovinu prsu musejí být dále zkoumány. V současné době se odborníci shodují v tom, že kouření k rakovině prsu jistým způsobem přispívá [56], vysvětlení poskytují nálezy karcinogenů v cigaretovém kouři [57]. Jednoznačné pozitivní vztahy byly nalezeny u žen, které začaly kouřit v mladém věku a před prvním otěhotněním. Zapojení sledování genetického polymorfizmu ovlivňujícího metabolickou bioaktivaci chemických karcinogenů, replikační schopnosti DNA, aktivitu estrogenových receptorů, případně další interakce mezi genetickými a environmentálními faktory poskytuje přijatelné biologické vysvětlení rozdílů nacházených v epidemiologických studiích. Pro nově připravované studie se doporučuje v co největší míře vyloučit selekční bias, přesněji definovat a případně i objektivně měřit expozici (u studií prospektivních), zahrnout i inter ‑ individuální variabilitu způsobenou genetickým polymorfizmem.
Nádory prsu mohou být hormonálně senzitivní nebo insenzitivní [58]; hypoteticky by pro první typ bylo kouření alespoň částečně prospěšné, u druhého typu naopak rizikové. Nicméně i kdyby se tato teorie potvrdila, nemohlo by stanovení typu nádoru v praxi ovlivnit principy poradenství, zda pokračovat, či zanechat kouření. Vzhledem k širokému spektru škodlivých účinků kouření i k horší prognóze vývoje rakoviny prsu u kuřaček je na místě preferovat všeobecně známá doporučení – nekouřit, nepít alkohol, konzumovat dostatečná množství ovoce a zeleniny, být fyzicky aktivní, udržovat správnou tělesnou hmotnost.
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Drahoslava Hrubá, CSc.
Ústav preventivního lékařství
LF MU, Brno
Kamenice 5
625 00 Brno
e-mail: hruba@med.muni.cz
Obdrženo: 17. 6. 2013
Přijato: 27. 6. 2013
Zdroje
1. Gaudet MM, Gapstur SM, Sun J et al. Active smoking and breast cancer risk: original cohort data and meta‑analysis. J Natl Cancer Inst 2013; 105(8): 515 – 525.
2. Hecht SS. Tobacco smoke carcinogens and breast cancer. Environ Mol Mutagen 2002; 39(2 – 3): 119 – 126.
3. International Agency for Research on Cancer. A review of human carcinogens: personal habits and indoor combustion. Lyon: IARC 2012 : 100E.
4. California Environmental Protection Agency. Health effects assessment for ETS: Final. Sacramento, CA: California EPA 2005.
5. Collishaw NF, Boyd NF, Cantor KP et al. Canadian Expert Panel on Tobacco Smoke and Breast Cancer Risk. Toronto: Ontario Tobacco research Unit 2009.
6. MacNicoll AD, Easty GC, Neville AM et al. Metabolism and activation of carcinogenic polycyclic aromatic hydrocarbons in human mammary cells. Biochem Biophys Res Commun 1980; 93(4): 1599 – 1606.
7. Petrakis NL, Maack CA, Lee RF et al. Mutagenic activity in nipple ‑ aspirates of human breast fluid. Cancer Res 1980; 40(1): 188 – 189.
8. Li D, Zhang W, Sabin AA et al. DNA adducts in normal tissue adjacent in breast cancer: a review. Cancer Detect Prev 1999; 23(6): 454 – 462.
9. Rubdle A, Tang D, Hibshoosh H et al. The relationship between genetic damage from polycyclic aromatic hydrocarbons in breast tissue and breast cancer. Carcinogenesis 2000; 21(7): 1281 – 1289.
10. Terry PD, Rohan TE. Cigarette smoking and the risk of breast cancer in women: a review of the literature. Cancer Epidemiol Biomarkers Prev 2002; 11(10 Pt 1): 953 – 971.
11. Deitz AC, Zheng W, Leff MA et al. N ‑ acetyltransferase 2 genetic polymorpfism, well‑done meat intake, and breast cancer among postmenopausal women. Cancer Epidemiol Biomarkers Prev 2000; 9(9): 905 – 910.
12. Reynolds P, Hurley S, Goldberg DE et al. Active smoking, household passive smoking, and breast cancer: evidence from the California Teachers Study. J Natl Cancer Inst 2004; 96(1): 29 – 37.
13. Conlon MS, Johnson KC, Bewick MA et al. Smoking (active and passive), N ‑ acetyltransferase 2, and risk of breast cancer. Cancer Epidemiol 2010; 34(2): 142 – 149.
14. US Department of Health and Human Services: The Health consequences of Smoking: A Report of the Surgeon General. Atlanta, GA. US DHHS, Centers for Disease Control and Prevention, National Center for Chronic Disease Prevention and Health Promotion, Office of Smoking and Health, 2004.
15. Baron JA, La Vecchia C, Levi F. The antiestrogenic effect of cigarette smoking in women. Ann J Obstet Gynecol 1990; 162(2): 502 – 514.
16. Tankó LB, Christiansen C. An update on the antiestrogenic effect of smoking: a literature review with implications for researchers and practicioners. Menopause 2004; 11(1): 104 – 109.
17. Mlynareikova A, Pickova M, Sesukova S. Ovarian intrafollicular processes as a target for cigarette smoke components and selected environmental reproductive disruptors. Endocr Regul 2005; 39(1): 21 – 32.
18. Wong PK, Christie JJ, Wark JD. The effects of smoking on bone health. Clin Sci (Lond) 2007; 113(5): 233 – 241.
19. MacMahon B, Trichopoulos D, Cole P et al. Cigarette smoking and urinary estrogens. N Engl J Med 1982; 307(17): 1062 – 1065.
20. Butler LM, Gold EB, Conroy SM et al. Active, but not passive cigarette smoking was inversely associated with mammographic density. Cancer Causes Control 2010; 21(2): 301 – 311.
21. Roubidoux MA, Kaur JS, Griffith KA et al. Relationship of mammographic parenchymal patterns to breast cancer risk factors and smoking in Alaska Native women. Cancer Epidemiol Biomarkers Prev 2003; 12(10): 1081 – 1086.
22. Boyd NF, Martin LJ, Sun L et al. Body size, mammographic density, and breast cancer risk. Cancer Epidemiol Biomarkers Prev 2006; 15(11): 2086 – 2092.
23. Schneider J, Huh MM, Bradlow HL et al. Antiestrogen action of 2 – hydroxyestrone on MCF ‑ 7 human breast cancer cells. J Biol Chem 1984; 259(8): 4840 – 4845.
24. Martin LJ, Boyd NF. Mammographic density. Potential mechanisms of breast cancer risk associated with mammographic density: hypotheses based on epidemiological evidence. Breast Cancer Res 2008; 10(1): 201.
25. Key TJ, Appleby PN, Reeves GK et al. Circulating sex hormones and breast cancer risk factors in postmenopausal women: reanalysis of 13 studies. Br J Cancer 2011; 105(5): 709 – 722.
26. Nagata C, Mizoue T, Tanaka K et al. Tobacco smoking and breast cancer risk: an evaluation based on a systematic review of epidemiological evidence from the Japanese population. Jap J Clin Oncol 2006; 36(6): 387 – 394.
27. Himajima N, Hirose K, Tajima K et al. Alcohol, tobacco and breast cancer – collaborative reanalysis of individual data from 53 epidemiological studies, including 58,515 women with breast cancer and 95,067 women without the disease. Br J Cancer 2002; 87(11): 1234 – 1245.
28. Chen Z, Shao J, Gao X et al. Effect of passive smoking and female breast cancer in China: A meta‑analysis. Asia Pac J Public Health 2013. In press.
29. Seitz HK, Pelucchi C, Bagnardi V et al. Epidemiology and pathophysiology of alcohol and breast cancer: update 2012. Alcohol 2012; 47(3): 204 – 212.
30. Chen WY, Rosner B, Hankinson SE et al. Moderate alcohol consumption during adult life, drinking patterns, and breast cancer risk. JAMA 2011; 306(17): 1884 – 1890.
31. Cui Y, Miller AB, Rohan TE. Cigarette smoking and breast cancer risk: update of a prospective cohort study. Breast Cancer Res Treat 2006; 100(3): 293 – 299.
32. Luo J, Margolis KL, Wactawski ‑ Wende J et al. Associations of active and passive smoking with risk of breast cancer among postmenopausal women: a prospective cohort study. BMJ 2011; 342: d1016.
33. Xue F, Willett WC, Rosner BA et al. Cigarette smoking and the incidence of breast cancer. Arch Intern Med 2011; 171(2): 125 – 133.
34. Murin S, Inciardi J. Cigarette smoking and the risk of pulmonary metastasis from breast cancer. Chest 2001; 119 : 1635 – 1640.
35. Fentiman IS, Allen DS, Hamed H. Smoking and prognosis in women with breast cancer. Int J Clin Pract 2005; 59(9): 1051 – 1054.
36. England A, Andersen A, Haldorsen T et al. Smoking habits and risk of cancers other than lung cancer: 28 years’ follow‑up of 26,000 Norwegian men and women. Cancer Causes Control 1996; 7(5): 497 – 506.
37. Nordlund LA, Carstensen JM, Pershagen G. Cancer incidence in female smokers: a 26‑year follow‑up. Int J Cancer 1997; 73(5): 625 – 628.
38. Al ‑ Delaimy WK, Cho E, Chen WY et al. A prospective study of smoking and risk of breast cancer in young adult women. Cancer Epidemiol Biomarkers Prev 2004; 13(3): 398 – 404.
39. Olson J. Young women who smoke higher risk of breast cancer. Mayo Clinic Proceedings Study emphasizes need for smoking prevention messages 2005; 80(11): 1423 – 1448. Available from: http:/ / www.mayoclinic.org/ news.
40. Dítětová I. Známe skutečně všechny rizikové faktory karcinomu prsu? Prakt Lék 2000; 80(2): 84 – 87.
41. Rameš J, Valenta Z, Bencko V. Rizikové faktory prostředí a životního stylu u karcinomu prsu žen: dotazníkové šetření. Hygiena 2008; 53(4): 127 – 134.
42. Russo J, Moral R, Balogh GA et al. The protective role of pregnancy in breast cancer. Breast Cancer Res 2005; 7(3): 131 – 142.
43. DeRoo LA, Cummings P, Mueller BA. Smoking before the first pregnancy and the risk of breast cancer: a meta‑analysis. Am J Epidemiol 2011; 174(4): 390 – 402.
44. Gram IT, Braaten T, Terry PD et al. Breast cancer risk among women who start smoking as teenagers. Cancer Epidemiol Biomarkers Prev 2005; 14(1): 61 – 66.
45. Hanaoka T, Yamamoto S, Sobue T et al. Active and passive smoking and breast cancer risk in middle ‑ aged Japanese women. Int J Cancer 2005; 114(2): 317 – 322.
46. Reynolds P, Goldberg DE, Hurley S et al. Passive smoking and risk of breast cancer in the California Teachers Study. Cancer Epidemiol Biomarkers Prev 2009; 18(12): 3389 – 3398.
47. Millionwomenstudy.org [homepage on the Internet]. UK/ US: Million Women Study: Report questions passive smoking ‑ breast cancer link. Available from: http:/ / www.millionwomenstudy.org/ .
48. Pirie K, Beral V, Peto R et al. Passive smoking and breast cancer in never smokers: prospective study and meta‑analysis. Int J Epidemiol 2008; 37(5): 1069 – 1079.
49. Rollison DE, Brownson RC, Hathcock HL et al. Case ‑ control study of tobacco smoke exposure and breast cancer risk in Delaware. BMC Cancer 2008; 8 : 157.
50. Terry PD, Thun MJ, Rohan TE. Does tobacco smoke cause breast cancer? Women Health (Lond Engl) 2011; 7(4): 405 – 408.
51. Shen J, Terry MB, Gammon MD et al. MGTM genotype modulates the associations between cigarette smoking, dietary antioxidants and breast cancer risk. Carcinogenesis 2005; 26(12): 2131 – 2137.
52. Tang LY, Chen LJ, Qi ML et al. Effects of passive smoking on breast cancer risk in pre/ post‑menopausal women as modified by polymorphisms of PARP1 and ESR1. Gene 2013; 524(2): 84 – 89.
53. Slattery ML, Curtin K, Giuliano AR et al. Active and passive smoking, IL6, ESR1, and breast cancer risk. Breast Cancer Res Treat 2008; 109(1): 101 – 111.
54. Mechanic LF, Millikan RC, Player J et al. Polymorphisms in nucleotid excision repair genes, smoking and breast cancer in African Americans and whites: a population‑based case ‑ control study. Carcinogenesis 2006; 27(7): 1377 – 1385.
55. McKenzie F, Ellison ‑ Loschmann L, Jeffreys M et al. Cigarette smoking and risk of breast cancer in a New Zealand Multi‑Ethnic Case ‑ Control Study. PLoS One 2013; 8(4): e63132.
56. Johnson KC, Miller AB, Collishaw NE et al. Active smoking and secondhand smoke increase breast cancer risk: the report of the Canadian Expert Panel on Tobacco Smoke and Breast Cancer Risk. Tob Control 2011; 20(1): e2.
57. Secretan B, Straif K, Baan R et al. A review of human carcinogens – part E: tobacco, areca nut, alcohol, coal smoke, and salted fish. Lancet Oncol 2009; 10(11): 1033 – 1034.
58. Ebbs S (ed.). Smoking and breast cancer – Editorial [monograph on the Internet]. Available from: http:/ / www.blackwell‑synergy.com/ doi/ full/ 10.1111/ j.1742 – 1241.2005.00580.x.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial – vývoj radioterapie
- Kouření a rakovina prsu
- Radiobiologická úskalí nových technik v radioterapii
- Onkogénny potenciál papilomavírusov
- Hodnocení kvality života pacientů na onkologickém oddělení – pilotní studie
- Pětileté výsledky IMRT karcinomu prostaty – toxicita
- Pětileté výsledky IMRT karcinomu prostaty – kontrola nádoru
- Bilaterálne germinatívne nádory testis – dlhoročné skúsenosti
- Informace z České onkologické společnosti
- Studie OPERa
- Syndróm hornej dutej žily v onkológii
- Studie CLARINET – průkaz antiproliferativního účinku lanreotidu
- XOFIGO® (radium‑ 223 dichlorid) v léčbě metastatického kastračně rezistentního karcinomu prostaty
- Zajímavé případy z nutriční péče v onkologii
- Je předoperační scintigrafie skeletu v časném stadiu karcinomu prsu T1N0 indikovaná a smysluplná?
-
Onkologie v obrazech
Pacient s recidivujícím melanomem na pravé tváři
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndróm hornej dutej žily v onkológii
- Je předoperační scintigrafie skeletu v časném stadiu karcinomu prsu T1N0 indikovaná a smysluplná?
- Kouření a rakovina prsu
- Hodnocení kvality života pacientů na onkologickém oddělení – pilotní studie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



