-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
„Cukry zasahují“ aneb glykomika na poli nádorových biomarkerů
‘Sugars Interfere’ or Glycomics in the Field of Cancer Biomarkers
Glycomics is concerned with detection and characterization of glycans present in biological samples. It is well‑known that glycan structures impart high degree of structural diversity to biomolecules and thus add wide ‑ ranging biological functions, such as cellular recognition, adhesion or involvement in cellular signaling pathways. They substantially participate in oncogenesis, e. g. in phases of invasion, metastasis and angiogenesis. Therefore, analysis of glycan structures in tumor tissues or body liquids is a promising tool for searching for potential tumor biomarkers essential for an early diagnosis of the neoplastic disease. The presented review describes the process of glycosylation and the origination of N and O glycans, presenting examples of glycan profiling in pancreatic, prostate and ovarian cancer.
Key words:
glycomics – tumor biomarker – pancreatic cancer – prostate cancer – ovarian cancer
This study was supported by IGA MH CR NT/13794-4/2012, by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/2.1.00/03.0101), MEYS – NPS I – LO1413, by MH CZ – DRO (MMCI, 00209805) and by BBMRI_CZ (LM2010004).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
10. 4. 2015Accepted:
25. 6. 2015
Autori: M. Zahradníková; B. Vojtěšek; L. Hernychová
Pôsobisko autorov: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 2): 20-25
doi: https://doi.org/10.14735/amko20152S20Súhrn
Glykomika se zabývá detekcí a charakterizací glykanů přítomných v biologických vzorcích. Je známo, že glykanové struktury dodávají biomolekulám vysoký stupeň strukturní diverzity a tím i mnohostranné biologické funkce, jako jsou buněčné rozpoznávání, adheze nebo zapojení v buněčných signálních drahách. Významně se také účastní onkogeneze, např. ve fázích invaze, metastazování a angiogeneze. Analýza glykanových struktur přítomných v nádorových tkáních nebo tělních tekutinách pacientů je tedy slibným nástrojem pro hledání potenciálních nádorových biomarkerů nezbytných pro časnou diagnostiku nádorových onemocnění. V předložené práci je popsán proces glykosylace a vznik N a O glykanů, současně jsou zmíněny příklady glykanového profilování u rakoviny slinivky břišní, prostaty a vaječníku.
Klíčová slova:
glykomika – nádorový biomarker – karcinom pankreatu – karcinom prostaty – karcinom vaječníkuÚvod
V ČR je každoročně nově diagnostikováno přes 82 000 případů nádorového onemocnění (data z roku 2010). Ze statistik současně vyplývá, že se u každého třetího obyvatele ČR v průběhu života nádorové onemocnění vyskytne a každý čtvrtý mu podlehne [1,2]. Jedním z faktorů vysoké úmrtnosti na nádorová onemocnění je absence diagnostických biomarkerů. Za nádorové biomarkery mohou být považovány povrchové i secernované molekuly různého charakteru produkované nádorovými, ale i nenádorovými buňkami jako odpověď na přítomnost nádoru. Pro klinické účely ideální marker podává informace pouze o jednom biologickém nebo patologickém procesu [3]. Biomarkery lze stanovovat z krve (séra, plazmy), dalších tělesných tekutin nebo ze vzorků tkání, ale obecně jsou upřednostňovány neinvazivní způsoby odběru biologického materiálu minimalizující zátěž pacienta [4]. Jedním z velmi nadějných odvětví pro hledání nových potenciálních biomarkerů je glykomika, která např. metodou glykanového profilování sleduje kvalitativní i kvantitativní rozdíly v glykanových strukturách mezi onkologickými pacienty a zdravou populací.
Termín glykomika vznikl z předpony glyko užívané v chemii sacharidů (z řeckého glykys – sladký) a přípony - omics dohodou používané v názvech podobných „omových“ oborů, např. proteomika (zabývající se proteiny) [5]. Objektem zájmu glykomiky je struktura a biologická funkce glykanů – monosacharidů, jednoduchých i větvených oligosacharidů, zpravidla kovalentně navázaných na další biologické (makro)molekuly a často lokalizovaných na vnějších membránách buněk, kde představují první možnost buněčné komunikace [6]. Z doposud publikované literatury vyplývá, že rakovinné buňky vykazují abnormální glykosylace – např. hyperfukosylace, charakteristické především pro rakovinu pankreatu a rakovinu kolorekta [7 – 9], nebo nadměrnou sialylaci, jejíž výskyt byl popsán u rakoviny prostaty [10] a rakoviny vaječníků [11]. S ohledem na rozmanitost glykanových struktur a množství glykokonjugátů (glykolipidy, glykosfingolipidy, muciny a jiné glykoproteiny) budou popsány pouze procesy N a O glykosylace proteinů, protože jsou nejčastěji se vyskytujícím typem glykosylace u živých organizmů.
Glykosylace
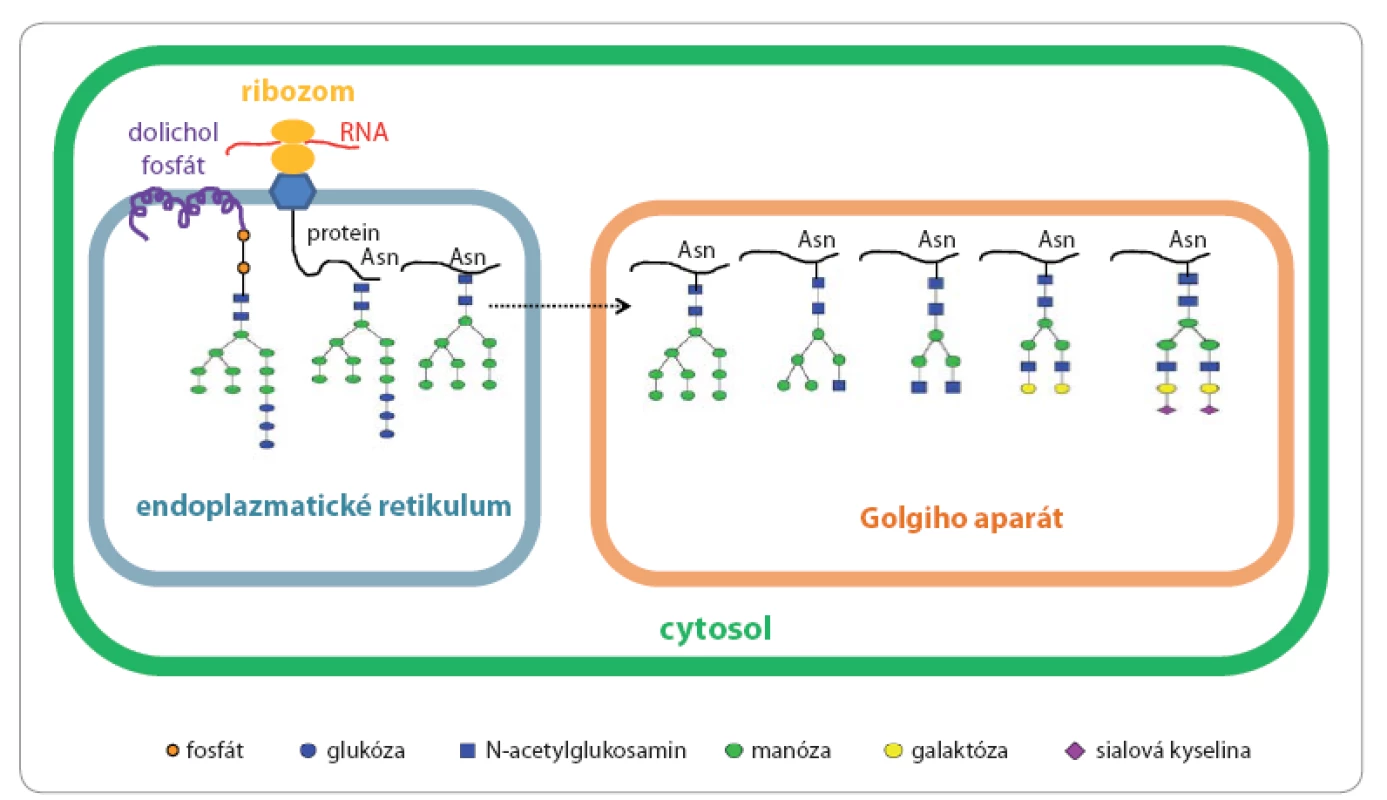
Glykosylace je komplexní proces specifického navázání monosacharidové nebo oligosacharidové jednotky na protein nebo lipid za vzniku glykoproteinu anebo glykolipidu při kotranslačních či posttranslačních procesech. N ‑ glykosylace začíná syntézou oligosacharidového prekurzoru vázaného na lipid dolichol v membráně hrubého endoplazmatického retikula. Struktura prekurzoru je v této fázi stejná pro všechny eukaryotické buňky – obsahuje tři glukózy (Glc), devět manóz (Man) a dva N ‑ acetylglukosaminy (GlcNAc), a současně obsahuje centrální strukturu všech N ‑ glykanů složenou z Man3GlcNAc2, která je někdy označována i jako trimannosyl chitobiosové jádro charakteristické pro všechny N ‑ glykany napříč živými organizmy (obr. 1A). Molekula prekurzoru Glc3Man9GlcNAc2 je následně přenesena en bloc z dolicholového nosiče na amidický dusík aminokyseliny asparagin (Asn) proteinu, který má být glykosylován. Tento krok je katalyzován enzymem oligosacharid ‑ protein transferáza, která jako substrát rozpozná pouze specifický aminokyselinový motiv Asn Xxx Ser nebo Asn Xxx Thr, kde Xxx může reprezentovat jakoukoli aminokyselinu s výjimkou prolinu. Nově vzniklý protein s navázaným jedním nebo více glykany je nejprve modifikován v endoplazmatickém retikulu enzymatickým odštěpením tří terminálních glukóz a poté vstupuje do cisteren Golgiho aparátu, v nichž je glykanu dána výsledná struktura odštěpením manóz a navázáním dalších monosacharidů kaskádou enzymatických reakcí katalyzovaných glykosidázami a glykosyltransferázami (obr. 2) [12 – 16]. Obecně lze říci, že pro různé proteiny stejně jako pro různé typy buněk jsou tvořeny N glykany nejrůznějších struktur. Nejčastěji pozorujeme tři typy lidských N glykanových struktur: 1. manózový typ, 2. hybridní typ a 3. komplexní typ (obr. 1B) [17].
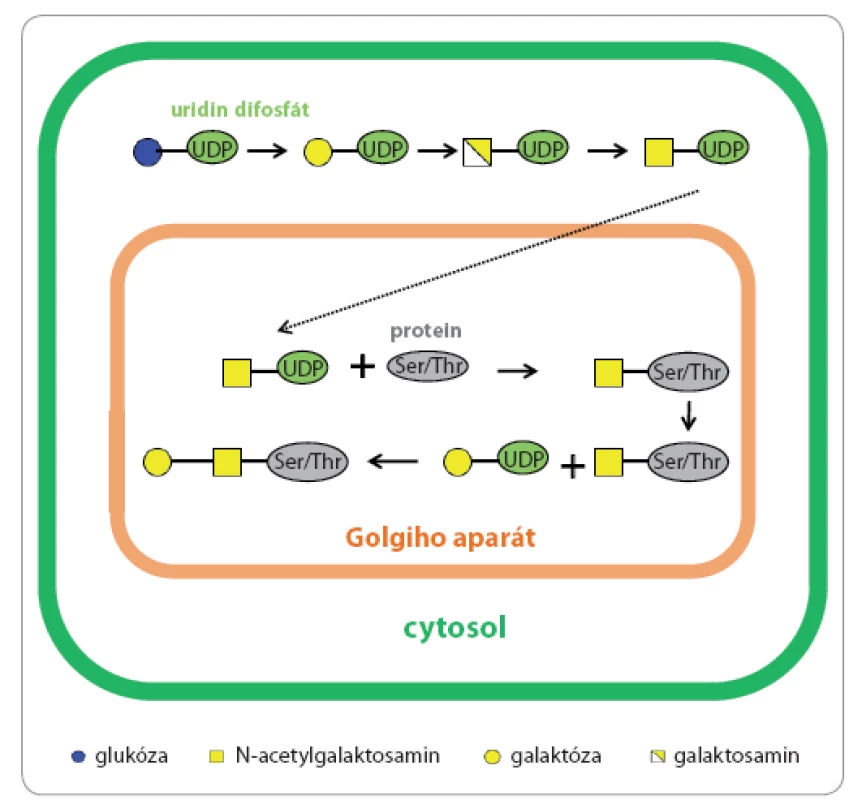
Obr. 1. Typy N- a O-glykanů. 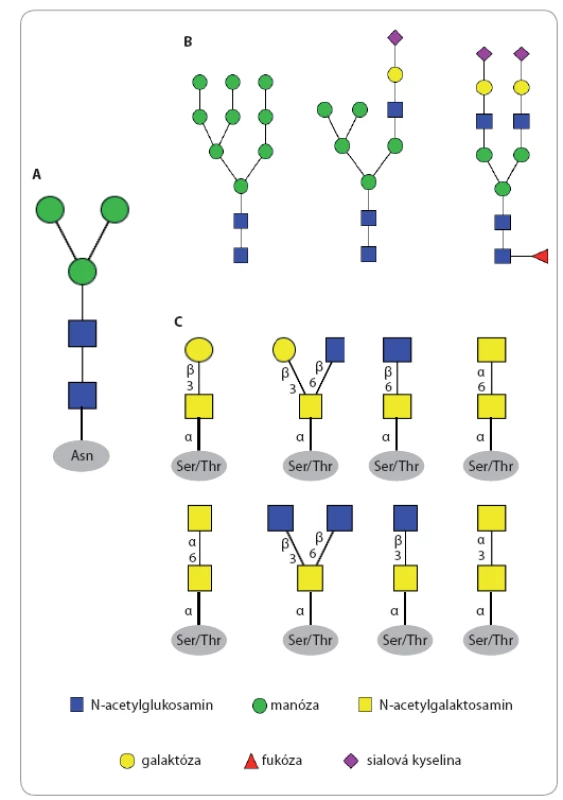
A. centrální strukturu N-glykanů. B. tři strukturní typy N-glykanů; zleva manózový typ, hybridní typ a komplexní typ. C. základní centrální struktury O-glykanů. Proces O glykosylace probíhá v cisternách Golgiho aparátu, do kterého vstupují monosacharidy navázané na nukleotidovém přenašeči (mono nebo difosfátu), a v této podobě jsou také substrátem pro odpovídající glykosyltransferázy (obr. 3) [18,19]. Pro O glykany není znám žádný vazebný motiv v aminokyselinové sekvenci, dostačující je přítomnost Ser nebo Thr v primární struktuře proteinu. Je známých osm variant centrálních struktur O glykanů (obr. 1C), nejběžnějším savčím typem jsou centrální struktury 1 a 2 mucinového typu. Muciny jsou vysokomolekulární proteiny secernované sliznicemi, které jsou současně hyperglykosylovány většinou kratšími oligosacharidy [20].
Glykosylace obecně představuje jednu z nejčastěji se vyskytujících posttranslačních modifikací, která byla zaznamenána u mnoha membránových i secernovaných proteinů. Glykosylací proteinu velmi často dochází ke změnám jeho strukturních vlastností, a tedy i funkce [21,22].
Jak glykanové struktury ovlivňují nádorová onemocnění?
V posledních letech se v literatuře téma glykomiky stále více objevuje v souvislosti s nejrůznějšími typy nádorových onemocnění, u nichž byly často pozorovány změny v glykosylaci proteinů produkovaných nádorovými buňkami. Glykanový profil přímo koreluje s biologií nádoru, významnou měrou se podílí na jeho charakteru a současně se promítá např. do procesů invazivity nádoru a neoangiogeneze. Nádorové bujení aktivuje expresi abnormálních glykanů, které podporují interakce nádorových buněk s leukocyty, trombocyty i endoteliálními buňkami a usnadňují tvorbu metastáz [23].
Rakovina pankreatu
Nádorové onemocnění pankreatu drží jednu z předních příček úmrtnosti mezi nádorovými onemocněními s pětiletým přežitím 4 %. Většině pacientů (50 %) je onemocnění diagnostikováno až ve IV. stadiu, pouze u 5 % pacientů je zachyceno už v I. stadiu. Jedním z důvodů velmi pozdní diagnostiky je absence vhodného screeningového programu, který by umožnil včasný záchyt onemocnění. V současnosti je nejčastěji stanovovaným sérovým markerem nádorový antigen 19 - 9 (CA19-9), jehož diagnosticky vypovídající hodnota je limitována vysokým počtem falešně pozitivních stanovení. CA19 - 9 neumožňuje rozlišit chronickou pankreatitidu a rakovinu pankreatu, a tudíž není vhodný pro včasnou diagnostiku choroby [24,25].
Glykomická profilování sér pacientů s diagnostikovanou rakovinou pankreatu vykazovala změny ve stupni fukosylace glykanů. Bylo zjištěno, že fukosylace β řetězce haptoglobinu je signifikantně vyšší u pacientů s rakovinou pankreatu oproti kontrolní populaci [7]. V roce 2012 byla publikována studie, v rámci níž byla analyzována tekutina pankreatických cyst identifikující více než 80 glykanových struktur, z nichž 40 bylo hyperfukosylovaných. Přítomnost fukosylovaných glykanů se tedy jeví jako slibným marker, přestože mechanizmus hyperfukosylace doposud není zcela objasněn [26].
Rakovina prostaty
V řadě vyspělých zemí světa je rakovina prostaty nejčastějším mužským zhoubným onemocněním. Každý rok je po celém světě diagnostikováno více než 600 000 nových případů rakoviny prostaty, v EU potom okolo 300 000 nových případů a přibližně 90 000 mužů ročně na rakovinu prostaty umírá [27]. Přesná příčina vzniku onemocnění není jednoznačně známa, ale i zde hraje důležitou roli včasná diagnostika, která rutinně používá stanovení hladiny prostatického specifického antigenu (PSA). Přestože PSA patří mezi nejlépe definované doposud používané biomarkery rakoviny prostaty, i tady dochází k relativně vysokému podílu falešně pozitivních výsledků. Zvýšená hladina PSA v séru byla pozorována kromě rakoviny prostaty u benigní hyperplazie prostaty, zánětu prostaty, ale i po pohlavním styku [28].
Z glykanových frakcí izolovaných ze sér pacientů s rakovinou prostaty měřených na hmotnostním spektrometru bylo identifikováno celkem 50 glykanových struktur. Statisticky významné rozdíly byly nalezeny u 12 glykanů, mezi kterými byly i více fukosylované struktury [29].
Rakovina vaječníku
„Tichý vrah“, jak se také rakovině vaječníku přezdívá, bývá ročně diagnostikován u téměř čtvrt milionu žen na světě a ročně jí podlehne okolo 140 000 pacientek. Prognóza tohoto onemocnění je velmi špatná, neboť je obvykle diagnostikováno až v pokročilém stadiu, kde je vysoká pravděpodobnost metastazování. Pro raná stadia jsou typické nespecifické symptomy jako úporné nadýmání, bolesti břicha, ztráta chuti k jídlu, které mohou být snadno zaměněny s jiným onemocněním. Diagnostické metody zahrnují nejčastěji vyšetření ultrazvukem a stanovení hladiny sérového mucinózního glykoproteinu – nádorového antigenu 125 (CA 125) [30]. Jedná se opět o nespecifický marker, protože zvýšenou hladinu CA 125 způsobují i onemocnění jater, adenomyóza, pankreatitida, ale současně i nádorová onemocnění žlučových cest, prsu, jater nebo tlustého střeva. Zvláště problematická je situace u raných, relativně dobře léčitelných, stadií rakoviny vaječníku, u kterých je specifita CA 125 jen okolo 50 % [31].
Podobně jako u výše zmíněných onemocnění byly publikovány práce spojující rakovinu vaječníků se změnou glykanového profilu a přítomností abnormálních glykanů. Studie z roku 2012 popisuje N glykanový profil 20 kontrolních sér, 19 sér pacientek s pokročilou rakovinou vaječníku a 11 sér pacientek po léčbě docetaxelem a imatinib mesylátem. Trendy pozorované mezi kontrolní skupinou vzorků a skupinami před léčbou i po ní jasně potvrzují hypotézu, že změny v glykanovém profilu mohou podávat užitečné informace o progresi onemocnění i v průběhu léčby [32].
Metodika práce s glykany
Glykany mohou být izolovány z různých typů biologických vzorků zahrnujících tkáň, tělní tekutiny a také materiál získaný z buněčných linií při in vitro studiích. Výhodou glykanové analýzy je nízká spotřeba vzorku, kdy pro kompletní glykanovou analýzu je např. dostačující 2,5 – 5 µl séra. Glykany mohou být z glykoproteinů odděleny enzymatickým štěpením, nejčastěji endoglykosidázou PNGázou F, která oddělí kompletní glykan štěpením kovalentní vazby mezi Asn a první GlcNAc [33]. Využívána je i metoda sekvenčního štěpení, při níž je použito postupně několik enzymů, poskytující detailnější informace o glykanových strukturách. Glykany lze uvolnit i neenzymaticky chemickou reakcí (β eliminací), která je doprovázena kompletní degradací proteinové složky, hojně využívanou při analýze O glykanů [34]. Po uvolnění glykanů z glykoproteinů dochází k jejich purifikaci a extrakci. Významným krokem glykanového profilování je derivatizace glykanů, nejčastěji permetylace, při níž dochází k nahrazení vodíků hydroxylových skupin metylovými skupinami. Tento krok izolované glykany stabilizuje, usnadňuje jejich ionizaci a separaci při hmotnostně spektrometrickém měření. Finálním krokem je detekce a kvantifikace glykanů, ke které se používají tři základní přístupy: 1. kapalinová chromatografie s fluorescenční detekcí, 2. kapilární elektroforéza s laserově indukovanou detekcí a 3. hmotnostní spektrometrie (obr. 4). Výběr vhodné techniky závisí na typu detekce a na komplexnosti vzorku. Pro následné vyhodnocení je možno použít široké spektrum statistických přístupů, např. výpočet p hodnoty a ROC analýza (receiver operating characteristic AUC) [35].
Obr. 4. Ukázka workflow pro práci s glykany. 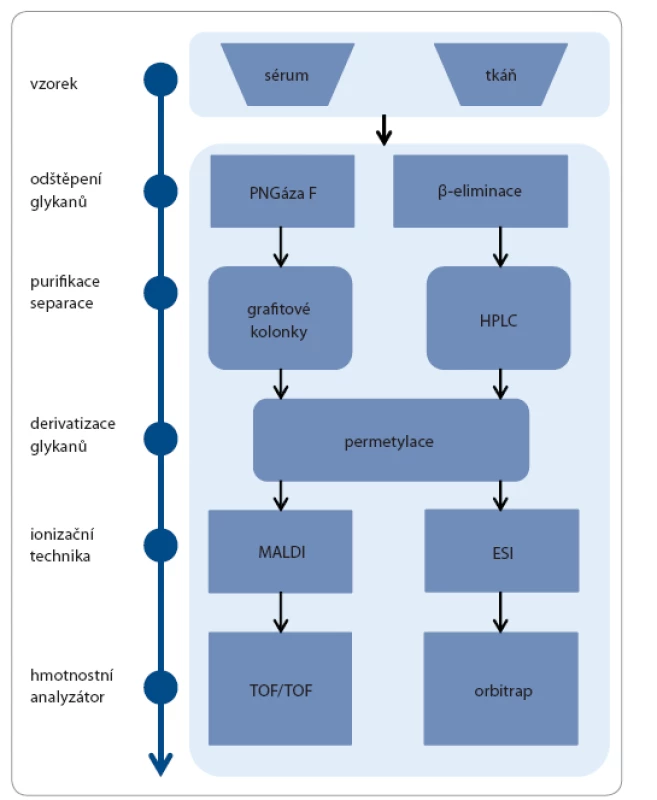
Obecné kroky glykanového profilování jsou znázorněny v levé části a některé typy vhodných metod v pravé části obrázku. Výběr vhodné metody vždy závisí na typu vzorku. Závěr
Hledání nových nádorových biomarkerů je stále výzvou a především nutností pro včasnou diagnostiku onemocnění, možnost sledování jejího průběhu a zejména pro volbu nejvhodnější a nejúčinnější léčby na základě individuálních vlastností nádorů. Komplikacemi jsou mimo jiné komplexita biologického materiálu a velmi nízké koncentrace bílkovin secernovaných nádorem v raných stadiích, v ng/ ml a nižší, do biologických tekutin (krev, sliny, moč). Glykomika představuje bezpochyby nové paradigma pro hledání nádorových biomarkerů. Je snad jen otázkou času, kdy budou nové specifické glykokonjugáty přispívat ke včasné diagnostice nádorových onemocnění.
Práce byla podpořena IGA MZ ČR NT/13794-4/2012, Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (RECAMO CZ.1.05/2.1.00/03.0101), MŠMT – NPU I – LO1413, MZ ČR – RVO (MOÚ, 00209805) a BBMRI_CZ (LM2010004).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Martina Zahradníková
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: martina.zahradnikova@mou.cz
Obdrženo 10. 4. 2015
Přijato: 25. 6. 2015
Zdroje
1. Linkos.cz [internetová stránka]. Česká onkologická společnost ČLS JEP, Česká republika; c2000 – 15 [aktualizováno 3. března 2015; citováno 5. března 2015]. Dostupné z:http:/ / www.linkos.cz.
2. Uzis.cz [internetová stránka]. Ústav zdravotnických informací a statisty ČR (ÚZIS), Česká republika, [citováno 5. března 2015]. Dostupné z: http:/ / uzis.cz/ publikace/ novotvary ‑ 2010.
3. Gutman S, Kessler LG. The US Food and Drug Administration perspective on cancer biomarker development. Nat Rev Cancer 2006; 6(7): 565 – 571.
4. Mishra A, Verma M. Cancer biomarkers: are we ready for the prime time? Cancers 2010; 2(1): 190 – 208. doi: 10.3390/ cancers2010190.
5. Srivastava S. Move over proteomics, here comes glycomics. J Proteome Res 2008; 7(5): 1799.
6. Werz DB, Ranziger R, Herget S et al. Exploring the structural diversity of mammalian carbohydrates („glycospace“) by statistical databank analysis. ACS Chem Biol 2007; 2(10): 685 – 691.
7. Lin Z, Simeone DM, Anderson MA et al. Mass spectrometric assay for analysis of haptoglobin fucosylation in pancreatic cancer. J Proteome Res 2011; 10(5): 2602 – 2611. doi: 10.1021/ pr200102h.
8. Takeda Y, Shinzaki S, Okudo K et al. Fucosylated haptoglobin is a novel type of cancer biomarker linked to the prognosis after an operation in colorectal cancer. Cancer 2012; 118(12): 3036 – 3043. doi: 10.1002/ cncr.26490.
9. Zhao YP, Ruan CP, Wang H et al. Identification and assessment of new biomarkers for colorectal cancer with serum N ‑ glycan profiling. Cancer 2012; 118(3): 639 – 650. doi: 10.1002/ cncr.26342.
10. Saldova R, Fan Y, Fitzpatrick JM et al. Core fucosylation and alpha2 – 3 sialylation in serum N ‑ glycome is significantly increased in prostate cancer comparing to benign prostate hyperplasia. Glycobiology 2011; 21(2): 195 – 205. doi: 10.1093/ glycob/ cwq147.
11. Saldova R, Piccard H, Pérez ‑ Garay M et al. Increase in sialylation and branching in the mouse serum N ‑ glycome correlates with inflammation and ovarian tumour progression. PloS One 2013; 8(8): e71159. doi: 10.1371/ journal.pone.0071159.
12. Stanley P, Schachter H, Taniguchi N. N ‑ Glycans. In: Varki A, Cummings RD, Esko JD et al (eds). Essentials of glycobiology. 2nd ed. Cold Spring Harbor: Cold Spring Harbor Laboratory Press 2009 : 101 – 114.
13. Freeze HH, Eklund EA, Ng BG et al. Neurology of inherited glycosylation disorders. Lancet Neurol 2012; 11(5): 453 – 466. doi: 10.1016/ S1474 ‑ 4422(12)70040 ‑ 6.
14. Hennet T. Diseases of glycosylation beyond classical congenital disorders of glycosylation. Biochim Biophys Acta 2012; 1820(9): 1306 – 1317. doi: 10.1016/ j.bbagen.2012.02.001.
15. Freeze HH, Haltiwanger RS. Other classes of ER/ Golgi ‑ derived glycans. In: Varki A, Cummings RD, Esko JD et al (eds). Essentials of glycobiology. 2nd ed. Cold Spring Harbor: Cold Spring Harbor Laboratory Press 2009 : 163 – 173.
16. Stanley P, Cummings RD. Structures common to different glycans. In: Varki A, Cummings RD, Esko JD et al (eds). Essentials of glycobiology. 2nd ed. Cold Spring Harbor: Cold Spring Harbor Laboratory Press 2009 : 175 – 198.
17. Mechref Y, Hu Y, Garcia A et al. Defining putative glycan cancer biomarkers by MS. Bioanalysis 2012; 4(20): 2457 – 2469. doi: 10.4155/ bio.12.246.
18. Cylwik B, Lipartowska K, Chrostek L et al. Congenital disorders of glycosylation. Part II. Defects of protein O ‑ glycosylation. Acta biochimica Polonica 2013; 60(3): 361 – 368.
19. Brockhausen I, Schachter H, Stanley P. O ‑ GalNAc glycans. In: Varki A, Cummings RD, Esko JD et al (eds). Essentials of glycobiology. 2nd ed. Cold Spring Harbor: Cold Spring Harbor Laboratory Press 2009 : 115 – 127.
20. Spiro RG. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds. Glycobiology 2002; 12(4): 43R – 56R.
21. Apweiler R, Hermjakob H, Sharon N. On the frequency of protein glycosylation, as deduced from analysis of the SWISS ‑ PROT database. Biochim Biophys Acta 1999; 1473(1): 4 – 8.
22. Drake PM, Cho W, Li B et al. Sweetening the pot: adding glycosylation to the biomarker discovery equation. Clin Chem 2010; 56(2): 223 – 236. doi: 10.1373/ clinchem.2009.136333.
23. Taniguchi N, Kizuka Y. Glycans and cancer: role of N ‑ glycans in cancer biomarker, progression and metastasis, and therapeutics. Adv Cancer Res 2015; 126 : 11 – 51. doi: 10.1016/ bs.acr.2014.11.001.
24. Li DH, Xie KP, Wolff R et al. Pancreatic cancer. Lancet 2004; 363(9414): 1049 – 1057.
25. Azeem K, Ševčíková J, Tomášková H et al. Karcinom pankreatu a faktory životního stylu. Klin Onkol 2013; 26(4): 257–262. doi: 10.14735/amko2013257.
26. Mann BF, Goetz JA, House MG et al. Glycomic and proteomic profiling of pancreatic cyst fluids identifies hyperfucosylated lactosamines on the N‑linked glycans of over expressed glycoproteins. Mol Cell Proteomics 2012; 11(7): M111.015792. doi: 10.1074/ mcp.M111.015792.
27. Ondrušová M, Mužík J, Kliment J et al. Incidencia a mortalita na karcinóm prostaty vo vybraných krajinách strednej Európy. Klin Onkol 2011; 24(2): 126 – 132.
28. Štern P, Vranovský K, Šafarčík K. Karcinom prostaty – molekulární podstata, diagnostika a ekonomika prevence. Klin Biochem Metab 2008; 16(37): 19 – 26.
29. Kyselova Z, Mechref Y, Al Bataineh MM et al. Alterations in the serum glycome due to metastatic prostate cancer. J Proteome Res 2007; 6(5): 1822 – 1832.
30. Ayhan A, Guven S, Kucukali T. Is there a correlation Bergen tomur marker panel and tumor size and histopathology in well stages patiens with bordeline ovarian tumors? Acta Obstet Gynecol Stand 2007; 86(4): 484 – 490.
31. Urban P, Bilecová ‑ Rabajdová M, Štefeková Z et al. Prehľad potenciálnych onkomarkerov detekcie skorých fáz rakoviny vaječníkov. Klin Onkol 2011; 24(2): 106 – 111.
32. Alley WR, Vasseur JA, Goetz JA et al. N‑linked glycan structures and their expressions change in the blood sera of ovarian cancer patients. J Proteome Res 2012; 11(4): 2282 – 2300. doi: 10.1021/ pr201070k.
33. Tarentino AL, Plummer TH. Enzymatic deglycosylation of asparagine‑linked glycans: purification, properties, and specificity of oligosaccharide ‑ cleaving enzymes from Flavobacterium meningosepticum. Methods Enzymol 1994; 230 : 44 – 57.
34. Jensen PH, Karlsson NG, Kolarich D et al. Structural analysis of N ‑ and O ‑ glycans released from glycoproteins. Nature Protocols 2012; 7(7): 1299 – 1310. doi: 10.1038/ nprot.2012.063.
35. Zahradníková M, Hernychová L, Vojtěšek B et al. Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění. Klin Onkol 2014; 27 (Suppl 1): S121–S129. doi: 10.14735/amko2014S121.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2015 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Analýza změn fosfoproteomu nádorové buněčné linie MDA‑ MB‑ 468 v odpovědi na expresi izoforem p63 pomocí hmotnostní spektrometrie
- „Cukry zasahují“ aneb glykomika na poli nádorových biomarkerů
- Nrf2 – dve tváre regulátora antioxidačného systému
- Editorial
- Polo‑like kináza 1 jako cíl protinádorové terapie
- PDLIM2 a jeho role v onkogenezi – tumor supresor nebo onkoprotein?
- Profil aktivace receptorových tyrozinkináz a mitogenem aktivovaných proteinkináz v terapii Maffucciho syndromu
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
- Imunologické aspekty v onkologii – cirkulující γδ T lymfocyty
- Cirkulující nádorová DNA v krvi a její využití jako potenciálního biomarkeru nádorových onemocnění
- Adenovírusové vektory v génovej terapii
- Nádory u adolescentů
- Bioinformatika a sekvenování nové generace
- IntegRECAMO: úspěšná realizace projektu OP VK
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Adenovírusové vektory v génovej terapii
- Nrf2 – dve tváre regulátora antioxidačného systému
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy