-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunologické aspekty v onkologii – cirkulující γδ T lymfocyty
Immunological Aspects in Oncology – Circulating γδ T Cells
γδ T cells present a minor population of the T cell family which basically differs in construction of their T cell receptor (TCR). Thanks to the features of γδ TCR, these cells can acquire unique effector functions and play a specific role (not only) in anti‑tumor immune response. In this article, we describe the basic characteristics of this cell population and their connection to cancer. In the experimental part we performed exploratory analysis of circulating γδ T cells in reference population and comparison with melanoma and breast carcinoma patients. The median percentage of γδ T cells from all lymphocytes was 2.9% (interquartile range – IQR 1.7– 4%). The median absolute numbers of γδ cells per liter of blood was 5.05 × 107 (IQR 2.9– 7.84 × 107). The median percentage of γδ cells between all CD3 T cells was 3.9% (IQR 2.3– 5.6%). No correlation between γδ T cells levels and gender or age was observed in reference population. Detailed immunophenotyping was also conducted describing representation of memory subsets (using CD45RO and CD27 markers) and presence of surface markers HLA‑Dr, CD69, CD25, CD28, CCR7, CTLA‑ 4, ICOS, PD‑ 1L and PD‑ 1 between γδ T cells of the controls and breast carcinoma patients. From this analysis, it is evident that γδ T cells do not represent a uniform population but they differ in surface markers as well as in their effector functions.
Key words:
γδ T cells –cancer – immune system – peripheral blood – immunotherapy – T lymfocytes
This study was supported by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/2.1.00/03.0101), by the projects MEYS – NPS I – LO1413, ACIU LM201117, and by MH CZ – DRO (MMCI, 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
4. 5. 2015Accepted:
9. 7. 2015
Autoři: M. Cibulka 1,2; I. Selingerová 1; L. Fědorová 1; Zdražilová Dubská L. 1–3
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 1; Advanced Cell Immunotherapy Unit, Farmakologický ústav, LF MU, Brno 2; Oddělení laboratorní medicíny, Masarykův onkologický ústav, Brno 3
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 2): 60-68
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko20152S60Souhrn
γδ T lymfocyty představují menšinovou populaci T lymfocytů, která se v základu liší konstrukcí TCR receptoru. Unikátní vlastnosti γδ TCR dávají pak těmto buňkám jedinečné efektorové funkce a specifickou roli (nejen) v protinádorové imunitní odpovědi. V tomto článku popisujeme základní charakteristiku těchto buněk ve vztahu k onkologickým onemocněním. V experimentální části je pak provedena exploratorní analýza zastoupení γδ T lymfocytů v běžné populaci a srovnání těchto hodnot s hodnotami pacientů s melanomem a karcinomem prsu. Medián procentuálního zastoupení γδ ze všech lymfocytů byl 2,9 % (interkvartilové rozpětí – IQR 1,7– 4 %). Medián absolutních počtů γδ buněk v litru krve byl 5,05 × 107 (IQR 2,9– 7,84 × 107). Medián procentuálního zastoupení γδ buněk mezi T lymfocyty byl 3,9 % (IQR 2,3– 5,6 %). V referenční populaci nebyla prokázána závislost kvantitativních parametrů γδ buněk na pohlaví či věku. Dále proběhla detailní imunofenotypizace popisující zastoupení paměťových subpopulací (pomocí značení CD45RO a CD27) a výskyt povrchových markerů HLA‑Dr, CD69, CD25, CD28, CCR7, CTLA‑ 4, ICOS, PD‑ 1L a PD‑ 1 mezi γδ T lymfocyty u kontrol a pacientek s karcinomem prsu. Z této analýzy je patrné, že γδ buňky netvoří uniformní populaci, ale mohou se ve svých povrchových markerech lišit, stejně jako se pak liší v efektorových funkcích.
Klíčová slova:
γδ Tlymfocyty – nádorová onemocnění – imunitní systém – periferní krev – imunoterapie – T lymfocytyÚvod
Základní povrchovou strukturou T lymfocytů je tzv. T‑ cell receptor (TCR). Pomocí tohoto receptoru a kostimulačních molekul pak T lymfocyty rozpoznávají antigenní peptidy, ve většině případů prezentované pomocí hlavního histokompatibilního komplexu (major histokompatibility complex – MHC) antigen prezentujících buněk (antigen presenting cells – APC). TCR je transmembránový heterodimer složený ze dvou řetězců, buďto α a β nebo γ a δ. Každý řetězec sestává z intracelulární, transmembránové a extracelulární domény, jejíž variabilní doména je odpovědná za rozpoznání antigenního komplexu. Zatímco TCR receptor konvenčních αβ T lymfocytů interaguje pouze s peptidy navázanými na molekuly MHC třídy I nebo II, γδ TCR je schopen rozpoznat širokou škálu vlastních a cizích antigenů, např. malých peptidů, solubilních či membránových proteinů, fosfolipidů apod., bez prezentace prostřednictvím MHC [1], díky čemuž je jejich role v rámci imunitního systému spíše vrozená než adaptivní.
Mezi efektorové funkce γδ T lymfocytů patří produkce cytokinů (INF‑γ, TNF‑α) a chemokinů (MIP‑1α/ β, RANTES), stejně jako přímá cytotoxicita (perforin, granzym) a buněčná cytotoxicita závislá na protilátkách (antibody dependent cellular cytotoxicity – ADCC) [2]. U člověka a myši představují γδ T lymfocyty méně než 5 % všech cirkulujících lymfocytů [3], naopak u přežvýkavců se jejich zastoupení pohybuje mezi 15 a 60 % a zde γδ T lymfocyty mají roli spíše regulační než cytotoxickou [4]. Mimo cirkulaci a lymfatické orgány se γδ T lymfocyty u člověka nacházejí také v epitelu. Přesné typy γδ TCR receptoru jsou tkáňově specifické. Konkrétně Vγ9Vδ2 TCR je exprimován na 50– 95 % γδ buněk v periferní krvi [5], zatímco TCR složené z jiných Vδ elementů se vyskytují na γδ buňkách ve vnitřních orgánech (Vδ1 a Vδ3 ) nebo kůži (Vδ1) [6].
Cílem tohoto sdělení je shrnout literární data o úloze γδ buněk u onkologických onemocnění. Cílem experimentální části je popsat: a) hladiny cirkulujících γδ T lymfocytů v krvi jedinců z běžné populace a provést exploratorní analýzu; b) hodnoty cirkulujících γδ T lymfocytů u pacientů s maligním melanomem a karcinomem prsu a c) detailního imunofenotypu.
Patofyziologická úloha γδ T lymfocytů
Vzhledem k tomu, že aktivace γδ buněk nevyžaduje zpracování a prezentování antigenu antigen‑ prezentující buňkou, mohou být γδ buňky velmi rychle aktivovány a sloužit tak jako součást časné fáze imunitní odpovědi. Stejně jako NK buňky, i γδ T lymfocyty reagují na stimulaci ligandy indukovanými infekcí nebo stresem, kterými jsou u lidí např. MICA/ B nebo ULBP [7]. Tyto ligandy jsou obyčejně exprimovány slabě či vůbec a k jejich upregulaci dochází pouze za přítomnosti stresu (poškození DNA, teplotní stres) nebo infekce. K aktivaci γδ buněk pak dochází prostřednictvím jejich receptoru NKG2D [8,9], v některých případech přímo prostřednictvím γδ TCR receptoru [10]. Lidské γδ T buňky navíc exprimují receptory rozpoznávající molekulární vzorce (pattern recognizing receptors – PRR) jako např. toll‑like receptory (TLR), které modulují jejich aktivaci [11]. Historicky je známa především schopnost mykobakterií reaktivovat γδ T lymfocyty [12].
Studie ukázaly, že Vγ9Vδ2 buňky lidské periferní krve dokážou po aktivaci fosfoantigenem vyvolat imunitní odpověď typu Th1 [13], která je charakterizována produkcí cytokinů TNF‑α a IFN- γ a cytotoxickou aktivitou [14]. Tato diferenciace Vγ9Vδ2 buněk cestou Th1 pravděpodobně probíhá během jejich periferní expanze po vystavení environmentálním mikrobiálním antigenům. Novorozenecké γδ buňky produkují IFN-γ, schopnost produkovat TNF‑α získávají po jednom měsíci od vystavení antigenům prostředí po porodu [15]. V in vitro podmínkách je ale v závislosti na přítomných cytokinech a stimulech TCR receptoru možno diferencovat γδ buňky do fenotypů připomínajících Th2, Th17, folikulární pomocné T buňky (Tfh) nebo regulační T buňky (Treg) [16,17].
γδ T lymfocyty a onkologická onemocnění
Mechanizmus rozpoznání nádorové buňky
Aktivace a získání efektorových funkcí je u γδ buněk, stejně jako u ostatních populací T lymfocytů, podmíněno stimulací TCR receptoru. Ten u γδ T lymfocytů specificky rozeznává molekuly, jejichž exprese je zvýšená ve stresových podmínkách. V případě normální buňky je koncentrace izoprenoidních metabolitů (jako např. izopentyl pyrofosfát – IPP) příliš malá na to, aby byla rozpoznána Vγ9Vδ2 buňkami jakožto varovný signál. Deregulace izoprenoidního metabolizmu má u některých nádorů za následek nadprodukci IPP, které je pak detekováno Vγ9Vδ2 buňkami jako nádorový antigen [18]. K akumulaci IPP dochází např. při zablokování metabolizmu kyseliny mevalonové pomocí aminobisfosfonátů. Stimulace NKR exprimovaného γδ buňkami a částečně také receptoru NKG2D může rovněž efektivně spustit protinádorové funkce těchto buněk. NKG2D je exprimován Vγ9Vδ2 buňkami a váže se na nekonvenční MHC molekuly typu MIC nebo ULBP, které jsou exprimovány nádorovými buňkami [8,9].
Vliv na aktivitu jiných imunokompetentních buněk
Kromě přímého cytotoxického efektu se γδ buňky podílí na protinádorové imunitní odpovědi také nepřímo prostřednictvím aktivace jiných buněčných typů, jako např. dendritických buněk, NK buněk a efektorových T lymfocytů (obr. 1). Při kontaktu s nádorovou buňkou nebo po stimulaci TCR, NKG2D či za působení cytokinů jako IL‑12 nebo IL‑18 produkují lidské γδ T lymfocyty IFN-γ a TNF‑α [8,19]. Tyto dva cytokiny mohou potlačovat růst nádoru několika možnými způsoby, především však iniciací protinádorové aktivity CD8 buněk (obr. 1A) a inhibicí angiogeneze [20].
Obr. 1. Mechanizmy protinádorové imunitní odpovědi prostřednictvím γδ T lymfocytů. 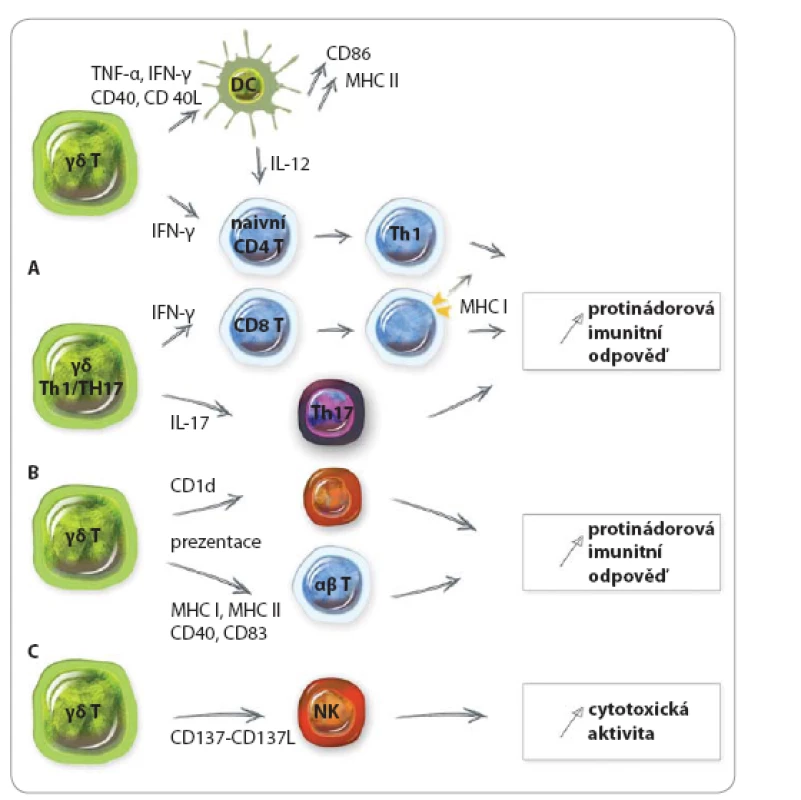
A. Aktivace γδ buněk vede k produkci TNF-α a IFN-γ a expresi CD40L. To napomáhá maturaci dendritických buněk a diferenciaci T lymfocytů do buněk Th1. γδ Th17 buňky produkují IL-17 podporující vývoj efektorových Th17 buněk. Buňky Th1 a Th17 vykazují protinádorové funkce. B. Aktivované γδ buňky dokáží prostřednictví trogocytózy získat a exprimovat molekulu CD1d a podporovat aktivaci iNKT buněk. Stejně tak vykazují funkce antigen prezentujících buněk (MHC I a II, CD40, CD83, CD86) a aktivují naivní i efektorové T lymfocyty s protinádorovou cytotoxickou aktivitou. C. Aktivované γδ buňky mohou poskytnout kostimulační signál NK buňkám prostřednictvím exprese molekuly CD137. Adaptováno dle [19]. Pro‑nádorová aktivita γδ T lymfocytů
Imunosupresivní schopnosti lidských Vγ9Vδ2 buněk mohou také hrát důležitou roli. Tyto buňky dokáží po aktivaci produkovat cytokiny jako IL‑4, IL‑10 nebo TGF‑β, potlačovat proliferaci T lymfocytů a tím vytvořit regulační mechanizmus, který může výrazně potlačit protinádorovou imunitní odpověď [21]. Vše rozhodně závisí na kontextu, jelikož Vγ9Vδ2 buňky mohou vykazovat funkce Th1, Th2, Th17 i Th1/ reg‑like funkce a syntetizovat jak IFN‑ γ, IL‑4 a IL‑17, tak IL‑10 nebo TGF‑β. Poslední dva jmenované cytokiny mají imunosupresivní funkce a mohou být tím pádem zapojeny do pro‑nádorových aktivit γδ T lymfocytů. TGF‑β hraje klíčovou roli v rozvoji nádoru díky schopnosti posílit invazivitu nádorových buněk a tvorbu metastáz prostřednictvím modulace imunitního prostředí v oblasti nádoru. Nejvýznamnější mechanizmy podpory progrese nádoru spojené s TGF‑β jsou epiteliálně‑mezenchymální tranzice, únik imunitnímu systému a podpora proliferace nádorových buněk [22]. Exprese IL‑10 a TGF‑β je u různých typů nádorů často zvýšená. IL‑10 přímo ovlivňuje funkce antigen prezentujících buněk prostřednictvím potlačení exprese MHC a kostimulačních molekul, což má za následek potlačení imunitní odpovědi, případně nastolení tolerance. IL‑10 navíc potlačuje produkci Th1 cytokinů a podporuje T‑ regulační mechanizmy.
γδ T lymfocyty v protinádorové imunoterapii
γδ buňky vykazují lytickou aktivitu nezávislou na MHC vůči nádorovým buňkám in vitro [23] a byla prokázána jejich schopnost infiltrovat různé typy nádorových tkání včetně karcinomu plic [24], karcinomu ledvin [25] a maligního melanomu [26]. Z tohoto důvodu se lidské Vγ9Vδ2 T lymfocyty jeví jako atraktivní cíl pro protinádorové terapie. Existují dva základní přístupy využití γδ T lymfocytů v protinádorové terapii: 1. imunomodulace vedoucí k in vivo stimulaci γδ buněk a jejich protinádorové aktivitě, 2. in vitro expanze a přímé podání γδ T lymfocytů onkologickým pacientům.
γδ lymfocyty jsou expandovatelné působením IL‑2, a aminobisfosfonátů nebo fosfoantigenů in vitro [24,27], kde byla také prokázána jejich cytolytická aktivita vůči nádorovým buňkám [27]. Adoptivní transfer expandovaných γδ T lymfocytů byl proveden u pacientů s metastatickým renálním karcinomem, mnohočetným myelomem a nemalobuněčným karcinomem plic [2,28– 32]. Podání γδ T lymfocytů bylo dobře tolerováno a u některých pacientů bylo dosaženo objektivní odpovědi.
K in vivo expanzi γδ lymfocytů může být využit podobný přístup jako při in vitro expanzi, tj. aplikace bisfosfonátů a IL‑2 [33,34]. Při léčbě hormonálně refrakterního karcinomu prostaty bylo dosaženo lepší léčebné odpovědi ve skupině léčených IL‑2 a zoledronátem oproti skupině se zoledronátem samotným [35]. Stimulace protinádorového efektu γδ T lymfocytů může být také jedním z efektů imunoterapie prostřednictvím vakcinace mykobakteriálním preparátem [36,37], což je v současné době také předmětem klinických zkoušek [38].
Materiál a metody
Biologický materiál
Při této studii byly průtokovou cytometrií vyšetřovány vzorky krve odebrané do K3EDTA. Vzorky byly analyzovány v den odběru nebo uchovány v lednici po dobu max. 48 hod. Celkem bylo analyzováno 50 vzorků pacientů s maligním melanomem, 50 vzorků pacientek s karcinomem prsu a 50 kontrol, pro které byly použity vzorky z preventivních vyšetření. Vzorky pacientů byly vybrány na základě diagnózy C43, resp. C50 v elektronické zdravotnické dokumentaci pacienta (NIS Grey Fox) a vzorky pacientů s nádorovou multiplicitou nebyly z analýzy vyloučeny. Věk kontrolních jedinců bez onkologické diagnózy se pohyboval od 24 do 78 let s mediánem 56 let. U pacientů s melanomem byl věkový rozptyl od 37 do 83 let s mediánem 67,5 let, u karcinomu prsu pak od 36 do 91 let s mediánem 61 let.
Průtoková cytometrie
Flowcytometrická analýza γδ T lymfocytů byla provedena za použití značení protilátkami anti‑CD3 PC5, anti‑CD4 PC7 a anti‑γδTCR FITC a pro detailní imunofenotyp anti‑CD45RO ECD, anti‑CD27 PE, anti‑HLA‑Dr PC5, anti‑CD69 PC5, anti‑-CD25 PC5, anti‑CD278 APC, anti‑CD152 PE, anti‑CD28 APC‑ Alexa fluor 750, anti‑CD279 PC7, anti‑CD274 APC a anti‑-CD197 PE (vše Beckman Coulter). Nejdříve proběhla inkubace 50 µl krve se směsí protilátek po dobu 15 min ve tmě a při pokojové teplotě, poté bylo přidáno 600 µl lyzačního roztoku VersaLyse (Beckman Coulter) a ponecháno dalších 15 min ve stejných podmínkách. Takto připravené vzorky byly analyzovány flowcytometricky na přístroji Navios (Beckman Coulter). Absolutní počet γδ T lymfocytů byl stanoven výpočtem z celkového počtu lymfocytů, který byl stanoven na hematologickém analyzátoru Sysmex XT‑ 5000.
Statistická analýza
Statistické zhodnocení bylo provedeno v programu R (verze 3.0.2). Pro porovnání hladiny γδ T lymfocytů ve dvou skupinách byl použit neparametrický Mannův‑ Whitneyho test. Vztah mezi věkem a hladiny γδ T lymfocytů byl stanoven pomocí Spearmanova koeficientu korelace a jeho významnost byla testována příslušným testem. Všechny statistické testy byly oboustranné a byly provedeny na 5% hladině významnosti.
Výsledky
Hladiny γδ T lymfocytů v periferní krvi jedinců bez onkologické diagnózy
U kontrolní populace nebyla u kvantitativních parametrů γδ T lymfocytů pozorována statisticky významná závislost na pohlaví či věku (obr. 2). Medián procentuálního zastoupení γδ ze všech lymfocytů byl 2,85 % (interkvartilové rozpětí – IQR 1,7– 4 %), z toho u žen 3,2 % (IQR 1,7– 3,9 %) a u mužů 2,7 % (IQR 1,7– 4,5 %) (obr. 2A). Medián absolutních počtů γδ buněk v litru krve byl 5,05 × 107 (IQR 2,9– 7,84 × 107), z toho u žen 5,92 × 107 (IQR 3,8– 8,02 × 107) a u mužů 4,37 × 107 (IQR 2,41– 6,84 × 107) (obr. 2B). Co se týče procentuálního zastoupení γδ buněk mezi T lymfocyty, medián byl 3,9 % (IQR 2,3– 5,6 %), z toho u žen 4,2 % (IQR 2,3– 5,3 %), u mužů pak 3,6 % (IQR 2,3– 6,1 %) (obr. 2C).
Obr. 2. Kvantifikace γδ T lymfocytů (GD) ve vzorcích periferní krve mužů a žen v referenční populaci. 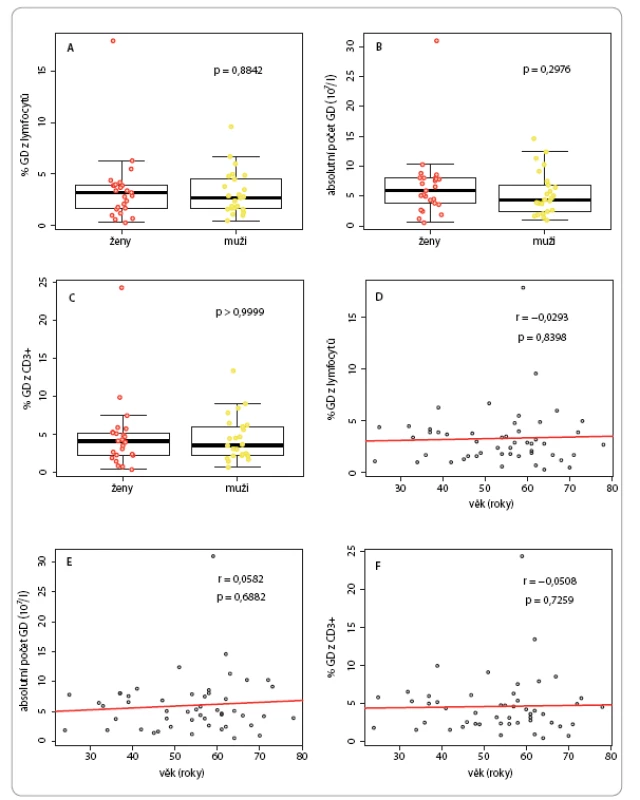
Hladiny γδ T lymfocytů v periferní krvi nemocných s maligním melanomem a karcinomem prsu
Procentuální zastoupení cirkulujících γδ T lymfocytů jak mezi T lymfocyty, tak mezi celkovými lymfocyty se neliší u pacientů s maligním melanomem a karcinomem prsu oproti zdravým kontrolám (obr. 3A, C). Absolutní počet γδ T lymfocytů byl v periferní krvi pacientů s maligním melanomem nižší než u zdravých kontrol (obr. 3B). Mediány analyzovaných hodnot byly následující: procentuální zastoupení γδ buněk ze všech lymfocytů u melanomu 2 % (IQR 1,4– 3,6 %), u karcinomu prsu 2,1 % (IQR 1,1– 3,4 %) a u kontrol 2,9 % (viz výše). Absolutní počet γδ buněk v litru krve u melanomu 2,9 × 107 (IQR 1,69– 5,56 × 107), u karcinomu prsu 3,6 × 107 (IQR 2,59– 6,13 × 107) a u kontrol 5 × 107 (viz výše). Procentuální zastoupení γδ buněk mezi CD3 lymfocyty u melanomu 3 % (IQR 2,5– 5,6 %), u karcinomu prsu 2,7 % (IQR 1,5– 5,5 %) a u kontrol 3,9 % (viz výše).
Obr. 3. Kvantifikace cirkulujících γδ lymfocytů u pacientů s maligním melanomem (M) a karcinomem prsu (P) ve srovnání s kontrolní populací (Z). 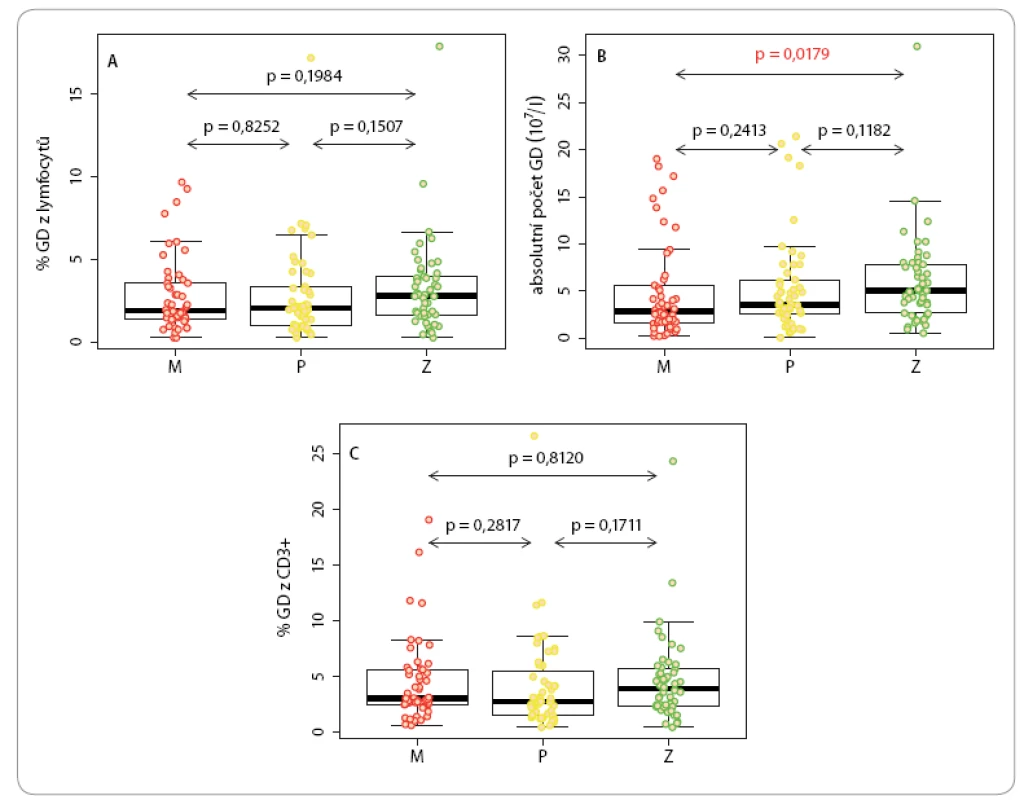
V rámci pilotní analýzy byl proveden souhrn klinických dat pacientů s maligním melanomem i karcinomem prsu, jejichž hodnoty γδ T lymfocytů byly výrazně vyšší než ostatní výsledky ze skupiny. Klinické údaje jsou aktuální k 4/ 2015. Čtyři pacienti s maligním melanomem s nejvyšší hodnotou procentuálního zastoupení γδ T lymfocytů jsou:
Případ A. Pacient, ročník 1955, s onkologickou triplicitou – adenokarcinomem rekta, adenokarcinomem prostaty a maligním melanomem v bederní krajině. Diagnóza melanomu v 8/ 2013. Ložisko kompletně excidováno, histologická klasifikace pT4b pNX, v kompletní remisi. Adenokarcinom rekta diagnostikován v 4/ 2013, T4b Nx Mx (LAP v dx třísle), inoperabilní, paliativní sigmoideostomie, 1. linie chemoterapie FOLFOX a konkomitantně radioterapie na oblast pánve, celkem absolvoval 10 sérií chemoterapie bez závažnějších nežádoucích účinků (NÚ), radioterapie ukončena předčasně pro rozvoj kožní toxicity. V 3/ 2014 onemocnění operabilní a v 4/ 2014 byla provedena exenterace pánve s ureteroileostomií. Vedlejším nálezem adenokarcinom prostaty, Gleason skóre 3 + 4, pT2c, L0 V0. Pacient dále sledován a léčen pro komplikace spojené s ureteroileostomií. Onkologické onemocnění se nyní jeví bez známek diseminace a bez lokální recidivy.
Případ B. Pacient, ročník 1968, s primárně metastatickým (lymfatické uzliny v proximální části stehna) maligním melanomem dg. 2/ 2011. Po rozšířené disekci uzlin ilioinguinální krajiny adjuvantní imunoterapie IFN‑ α, ukončena pro toxicitu v 6/ 2011. V 1/ 2012 lokoregionální recidiva a v 6/ 2012 vícečetné podkožní metastázy bez vzdálené diseminace, v 8/ 2012 provedena izolovaná hypertermická chemoperfuze levé dolní končetiny, v 10/ 2012 generalizace melanomu – podkožní metastázy levé dolní končetiny, metastázy lymfatických uzlin v pánvi a retroperitoneu, susp. jaterní metastázy. V 11/ 2012 zahájena léčba vemurafenibem v rámci klinické studie s efektem regrese kožních metastáz. Efekt léčby trvá a terapie vemurafenibem pokračuje.
Případ C. Pacient, ročník 1940, s onkologickou duplicitou – maligním melanomem a adenokarcinomem žaludku. Melanom diagnostikován v 1986. Řešen širokou excizí s disekcí levé axily. Po chirurgickém zákroku v kompletní remisi. Adenokarcinom žaludku dg. v 2009. Vzhledem k lokálnímu rozsahu onemocnění následovalo radikální odstranění tumoru s gastrektomií a omentektomií. Po resekci tumoru byl pacient sledován bez adjuvantní terapie. Relaps onemocnění nastal v 7/ 2014. Na CT objevena solitární metastáza v játrech. V 9/ 2014 byla odoperována metastatická část jater a horní okraj pankreatu. Pro histologicky pozitivní resekční okraje následovala konkomitantně pooperační radioterapie a chemoterapie v režimu FU/ FA de Gramont. Radioterapie ukončena plánovaně v lednu 2015. Nadále se pokračuje chemoterapií. Aktuálně podána 7. série.
Případ D. Pacient, ročník 1935, s diseminací maligního melanomu. Primární ložisko melanomu diagnostikováno a excidováno v 9/ 2011. Mikroskopický nález ukázal na neúplnosti excize, proto reexcidováno v říjnu 2011. Pacient dále sledován. V 11/ 2014 se objevily metastázy v kalvě a v plicích, B RAF negativní. V 2/ 2015 zahájena 1. linie chemoterapie DTIC, nyní 3. série.
Pacientky s karcinomem prsu s nejvyšším absolutním i procentuálním zastoupením γδ T lymfocytů jsou:
Případ A. Pacientka, ročník 1969, s diagnózou karcinom prsu vpravo, dg. 7/ 2012, HER2 1+, stav po parciální mastektomii a adjuvantní radioterapii (ukončena 6/ 2013) a hormonální adjuvantní terapii tamoxifenem. Nyní poradiační fibróza v pravém prsu, bez nálezu metastáz a bez známek recidivy. Nadále hormonoterapie tamoxifenem a 6/ 2014 a 12/ 2014 podány dvě dávky imunoterapie s nelipepimut‑ S (NeuVax™) v rámci studie PRESENT.
Případ B. Pacientka, ročník 1957, s diagnózou karcinom prsu vpravo z 9/ 2007. Histologicky se jedná o invazivní duktální karcinom, ER 80 %, PR 20 %, HER 3+, HER 2+ (FISH), T4b N2 M0, klinické stadium IIIB. Indikována chemoterapie a cílená léčba: 4krát AC, následně 4krát taxotere 3w a trastuzumab (1/ 2008– 6/ 2009) s efektem dočasné regrese nádoru. Dále udržovací terapie letrozolem. Progrese onemocnění 9/ 2014, paliativní chemoterapie docetaxel a trastuzumab s progresí onemocnění v 12/ 2014, dále pokračováno eribulinem. Nyní metastázy v nadklíčku, podklíčku, na hrudníku vlevo a lehce i vpravo, v levé axile a v levém prsu – další progrese ve srovnání s 12/ 2014, progredující fluidotorax vlevo. Zahájena léčba s trastuzumab emtansin.
Případ C. Pacientka, ročník 1924, s diagnózou karcinom prsu vlevo 1/ 2015. Resekce v 2/ 2015, histologicky invazivní karcinom málo diferencovaný (G3). Bez nálezu metastáz, bez nálezu postižení uzlin (cT2 N0 M0). Od 3/ 2015 adjuvantní hormonální terapie anastrozol s dobrou tolerancí.
Imunofenotyp γδ T lymfocytů
V rámci imunofenotypizace γδ buněk byly analyzovány tři kontrolní vzorky u tří pacientek s karcinomem prsu. Byl sledován výskyt znaků CD45RO a CD27 (jejich kombinace definuje rozdělení T lymfocytů na naivní, paměťové, efektorové a pozdní paměťové), HLA‑Dr (MHCII), CD69 (transmembránový lektinový protein vyskytující se na aktivovaných T lymfocytech a NK buňkách), CD25 (α‑ řetězec receptoru pro IL‑2, vyskytuje se na aktivovaných a regulačních T lymfocytech), CD278 (kostimulační molekula z rodiny CD28 – ICOS, vyskytující se na aktivovaných T lymfocytech), CD152 (CTLA‑ 4, receptor na povrchu T lymfocytů, který je afinitní k molekulám B7 a hraje významnou roli v potlačení aktivace imunitního systému), CD28 (kostimulační receptor, který se společně s TCR podílí na aktivaci T lymfocytů), CD279 (programmed cell death protein – 1PD‑ 1, receptor důležitý pro regulaci imunitního systému, zároveň indukuje apoptózu antigen‑ specifických T lymfocytů a inhibuje apoptózu regulačních T lymfocytů), CD274 (PD‑ L1 – jeden ze dvou ligandů pro PD‑ 1) a CD197 (chemokinový receptor 7 – CCR‑ 7, podílí se na kontrole migrace paměťových T lymfocytů a stimulaci maturace dendritických buněk). Výsledky jsou uvedeny v obr. 4.
Obr. 4. Imunofenotyp cirkulujích γδ T lymfocytů u zdravých kontrol (Z1–Z3) a pacientek s karcinomem prsu (P1–P3). 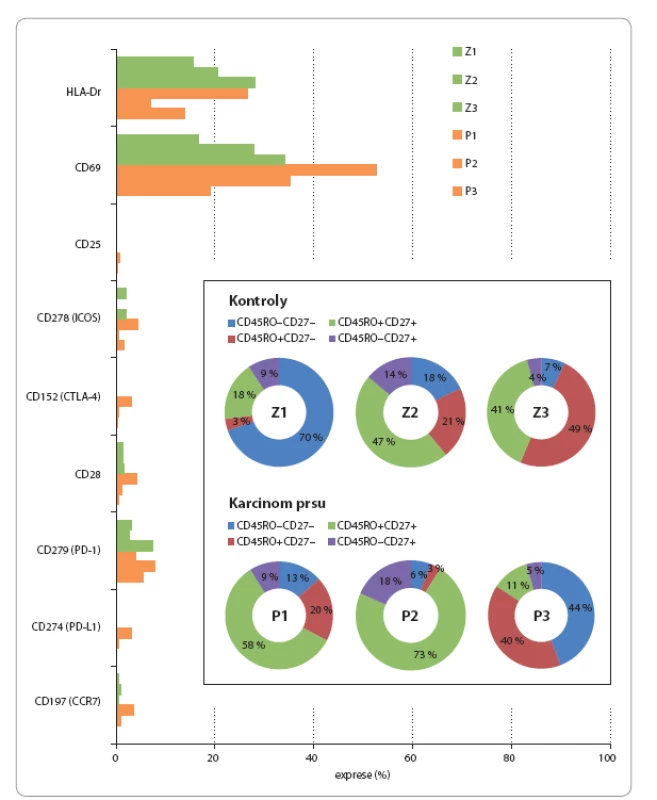
Vnitřní panel: diferenciace paměťových subpopulací probíhá od fenotypu CD45RO–CD27+ (modrý) dále po směru hodinových ručiček. Diskuze
Medián procentuálního zastoupení γδ buněk mezi všemi cirkulujícími T lymfocyty byl u referenční populace 3,87 %, což je mírně nižší hodnota než v jiných studiích, kde se pohybuje okolo 5 % [39,40]. U pacientů s melanomem byl již dříve pozorován pokles cirkulujících γδ buněk [41], což souhlasí i s našimi výsledky. V dřívější studii však autoři poukazují na jev opačný – zvýšení počtu cirkulujících cytotoxických γδ buněk u pacientů s melanomem [42]. V této oblasti je třeba provést důkladnou analýzu s větším důrazem na stadium onemocnění a typ probíhající léčby. Celkově jsme nicméně nepozorovali u onkologických pacientů elevaci γδ buněk, která by mohla být prostým odrazem aktivace imunitního systému při onkologickém onemocnění ve smyslu reaktantu akutní fáze. Otázkou je pochopitelně vliv protinádorové terapie na potlačení tvorby a vývoje γδ T lymfocytů. Zvýšené počty γδ buněk u některých pacientů jak s maligním melanomem, tak s karcinomem prsu pozorované v této práci jsou nyní v rovině kazuistik a nelze je jednoznačně interpretovat. Zajímavostí nicméně je elevace γδ buněk u pacientky na imunoterapii nonapeptidem nelipepimut‑ S a u pacienta s primárně metastatickým maligním melanomem s dlouhodobým efektem léčby vemurafenibem, v současné době více než čtyři roky od diagnózy.
Ve studii s expandovanými γδ T lymfocyty, kde autoři definovali paměťový imunofenotyp absencí znaku CD45RA, byl dominantní imunofenotyp naivní CD27+CD45RA+ nebo CD27+CD45RA– paměťový, zatímco expandované buňky měly IF CD27– CD45RA– efektorový paměťový imunofenotyp [2]. Naše exploratorní analýza definující paměťový imunofenotyp jako CD45RO+ ukázala, že imunofenotyp v rámci kontrolní skupiny zdravých jedinců je variabilní. Zatímco u kontroly Z1 převažovaly pozdní paměťové CD27– CD45RO– buňky, u kontroly Z2 převažovaly efektorové CD27– CD45RO+ buňky a u kontroly Z3 dominoval paměťový CD27+CD45RO+ a efektorový CD27– CD45RO+ imunofenotyp podobně jako ve studii [2]. U pacientek s karcinomem prsu, které měly nízké zastoupení γδ T lymfocytů, dominoval paměťový CD27+CD45RO+ imunofenotyp u pacientky P3 s vyšším počtem γδ T lymfocytů v periferní krvi, byla většina γδ T lymfocytů pozdní paměťová CD27– CD45RO– nebo efektorová CD27– CD45RO+. Exprese CD69 zcela chyběla u naivních buněk a byla rovnoměrně rozložena mezi paměťové, efektorové a pozdní paměťové subpopulace. Vzhledem k expresi HLA‑Dr je zřejmé, že γδ T lymfocyty mají schopnost prezentovat antigen. V naší studii exprese HLA‑Dr korelovala se zastoupením efektorových buněk CD27– CD45RO+ podobně jako v práci [43], kde efektorové γδ T lymfocyty sekretovaly nejen IFN‑ γ, ale také IL‑17. U pacienta P1 jsme pozorovali zvýšenou expresi znaků ICOS, CTLA‑ 4, CD28, PD‑ L1 a CCR‑ 7. Exprese PD‑ 1 byla naopak menší než u pacientů P2 a P3. Již dříve bylo zjištěno, že s aktivací γδ buněk přichází zvýšení exprese CTLA‑ 4, CD28, PD‑ 1 a PD‑ L1. Přičemž exprese PD‑ L1 byla po aktivaci vyšší než exprese PD‑ 1, přestože před aktivací byla nižší než PD‑ 1 [44]. V kontextu tohoto nálezu bychom mohli usuzovat, že u pacienta P1proběhla stimulace γδ T lymfocytů. Přičemž o aktivaci γδ T lymfocytů u P1 vypovídá také zvýšená exprese znaků ICOS, CCR‑ 7, HLA‑Dr a CD69 v porovnání s ostatními testovanými vzorky. Ve vzorku P1 jsme též zachytili malou subpopulaci γδ buněk, které exprimují zároveň markery CTLA‑ 4, PD‑ L1 a CD25, a tedy se imunofenotypem blíží γδ regulačním T lymfocytům [45].
Z preklinického i klinického výzkumu vyplývá, že γδ buňky v závislosti na přesném fenotypu hrají určitou roli jak při indukci imunitní odpovědi, tak i potlačení jeho funkce. V závislosti na kontextu tak mohou v případě onkologických onemocnění nejen inhibovat, ale do jisté míry i podporovat progresi patofyziologických jevů. Naše studie ukazuje, že i když γδ buňky tvoří jen minoritní část všech CD3+ T lymfocytů, existuje ještě mnoho podskupin, na které je možno tuto subpopulaci rozdělit a které se významně liší ve svých funkcích. Pro detailní charakteristiku a analýzu efektorových a regulačních funkcí γδ T lymfocytů je potřeba provést další experimenty, korelovat nález v periferní krvi s nálezem v nádorové tkáni a klinickými údaji, jako je typ subtyp maligního onemocnění, druh léčby, efekt léčby.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (RECAMO, CZ.1.05/2.1.00/03.0101), projekty MŠMT – NPU I – LO1413 a ACIU LM201117 a MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
RNDr. Lenka Zdražilová Dubská, Ph.D.
Oddělení laboratorní medicíny
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: dubska@mou.cz
Obdrženo: 4. 5. 2015
Přijato: 9. 7. 2015
Zdroje
1. Morita CT, Beckman EM, Bukowski JF et al. Direct presentation of nonpeptide prenyl pyrophosphate antigens to human gamma delta T cells. Immunity 1995; 3(4): 495 – 507.
2. Kakimi K, Matsushita H, Murakawa T et al. Gammadelta T cell therapy for the treatment of non‑small cell lung cancer. Transl Lung Cancer Res 2014; 3(1): 23 – 33. doi: 10.3978/ j.issn.2218 ‑ 6751.2013.11.01.
3. Groh V, Porcelli S, Fabbi M et al. Human lymphocytes bearing T cell receptor gamma/ delta are phenotypically diverse and evenly distributed throughout the lymphoid system. J Exp Med 1989; 169(4): 1277 – 1294.
4. Guzman E, Hope J, Taylor G et al. Bovine gammadelta T cells are a major regulatory T cell subset. J Immunol 2014; 193(1): 208 – 222. doi: 10.4049/ jimmunol.1303398.
5. Hinz T, Wesch D, Halary F et al. Identification of the complete expressed human TCR V gamma repertoire by flow cytometry. Int Immunol 1997; 9(8): 1065 – 1072.
6. Holtmeier W, Pfänder M, Hennemann A et al. The TCR ‑ delta repertoire in normal human skin is restricted and distinct from the TCR ‑ delta repertoire in the peripheral blood. J Invest Dermatol 2001; 116(2): 275 – 280.
7. Groh V, Steinle A, Bauer S et al. Recognition of stress‑induced MHC molecules by intestinal epithelial gammadelta T cells. Science 1998; 279(5357): 1737 – 1740.
8. Rincon ‑ Orozco B, Kunzmann V, Wrobel P et al. Activation of V gamma 9V delta 2 T cells by NKG2D. J Immunol 2005; 175(4): 2144 – 2151.
9. Das H, Groh V, Kuijl C et al. MICA engagement by human Vgamma2Vdelta2 T cells enhances their antigen ‑ dependent effector function. Immunity 2001; 15(1): 83 – 93.
10. Kong Y, Cao W, Xi X et al. The NKG2D ligand ULBP4 binds to TCRgamma9/ delta2 and induces cytotoxicity to tumor cells through both TCRgammadelta and NKG2D. Blood 2009; 114(2): 310 – 317. doi: 10.1182/ blood ‑ 2008 ‑ 12 ‑ 196287.
11. Shojaei H, Oberg HH, Juricke M et al. Toll‑like receptors 3 and 7 agonists enhance tumor cell lysis by human gammadelta T cells. Cancer Res 2009; 69(22): 8710 – 8717. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 09 ‑ 1602.
12. Modlin RL, Pirmez C, Hofman FM et al. Lymphocytes bearing antigen ‑ specific gamma delta T ‑ cell receptors accumulate in human infectious disease lesions. Nature 1989; 339(6225): 544 – 548.
13. Dunne MR, Mangan BA, Madrigal ‑ Estebas L et al. Preferential Th1 cytokine profile of phosphoantigen ‑ stimulated human Vgamma9Vdelta2 T cells. Mediators Inflamm 2010; 2010 : 704941. doi: 10.1155/ 2010/ 704941.
14. Thedrez A, Sabourin C, Gerner J et al. Self/ non‑self discrimination by human gammadelta T cells: simple solutions for a complex issue? Immunol Rev 2007; 215 : 123 – 135.
15. Gibbons DL, Hague SF, Silberzahn T et al. Neonates harbour highly active gammadelta T cells with selective impairments in preterm infants. Eur J Immunol 2009; 39(7): 1794 – 1806. doi: 10.1002/ eji.200939222.
16. Wesch D, Glatzel A, Kabelitz D. Differentiation of resting human peripheral blood gamma delta T cells toward Th1 - or Th2 - phenotype. Cell Immunol 2001; 212(2): 110 – 117.
17. Casetti R, Agrati C, Wallace M et al. Cutting edge: TGF‑beta1 and IL‑15 Induce FOXP3+ gammadelta regulatory T cells in the presence of antigen stimulation. J Immunol 2009; 183(6): 3574 – 3577. doi: 10.4049/ jimmunol.0901334.
18. Gober HJ, Kistowska M, Angman L et al. Human T cell receptor gammadelta cells recognize endogenous mevalonate metabolites in tumor cells. J Exp Med 2003; 197(2): 163 – 168.
19. Lafont V, Sanchez F, Laprevotte E et al. Plasticity of gammadelta T cells: impact on the anti‑tumor response. Front Immunol 2014; 5 : 622. doi: 10.3389/ fimmu.2014.00622.
20. Lu Y, Yang W, Qin C et al. Responsiveness of stromal fibroblasts to IFN ‑ gamma blocks tumor growth via angiostasis. J Immunol 2009; 183(10): 6413 – 6421. doi: 10.4049/ jimmunol.0901073.
21. Kuhl AA, Pawlowski NN, Grollich K et al. Human peripheral gammadelta T cells possess regulatory potential. Immunology 2009; 128(4): 580 – 588. doi: 10.1111/ j.1365 ‑ 2567.2009.03162.x.
22. Drabsch Y, ten Dijke P. TGF‑beta signalling and its role in cancer progression and metastasis. Cancer Metastasis Rev 2012; 31(3 – 4): 553 – 568. doi: 10.1007/ s10555 ‑ 012 ‑ 9375 ‑ 7.
23. Dhar S, Chiplunkar SV. Lysis of aminobisphosphonate ‑ sensitized MCF ‑ 7 breast tumor cells by Vgamma9Vdelta2 T cells. Cancer Immun 2010; 10 : 10.
24. Ferrarini M, Pupa SM, Zocchi MR et al. Distinct pattern of HSP72 and monomeric laminin receptor expression in human lung cancers infiltrated by gamma/ delta T lymphocytes. Int J Cancer 1994; 57(4): 486 – 490.
25. Choudhary A, Davodeau F, Moreau A et al. Selective lysis of autologous tumor cells by recurrent gamma delta tumor ‑ infiltrating lymphocytes from renal carcinoma. J Immunol 1995; 154(8): 3932 – 3940.
26. Cordova A, Toia F, La Mendolona C et al. Characterization of human gammadelta T lymphocytes infiltrating primary malignant melanomas. PLoS One 2012; 7(11): e49878. doi: 10.1371/ journal.pone.0049878.
27. Liu Z, Guo BL, Gehrs BC et al. Ex vivo expanded human Vgamma9Vdelta2+ gammadelta ‑ T cells mediate innate antitumor activity against human prostate cancer cells in vitro. J Urol 2005; 173(5): 1552 – 1556.
28. Kobayashi H, Tanaka Y, Yagi J et al. Safety profile and anti‑tumor effects of adoptive immunotherapy using gamma ‑ delta T cells against advanced renal cell carcinoma: a pilot study. Cancer Immunol Immunother 2007; 56(4): 469 – 476.
29. Bennouna J, Bompas E, Neidhardt EM et al. Phase ‑ I study of Innacell gammadelta, an autologous cell ‑ therapy product highly enriched in gamma9delta2 T lymphocytes, in combination with IL‑2, in patients with metastatic renal cell carcinoma. Cancer Immunol Immunother 2008; 57(11): 1599 – 1609. doi: 10.1007/ s00262 ‑ 008 ‑ 0491 ‑ 8.
30. Kobayashi H, Tanaka Y, Yagi J et al. Phase I/ II study of adoptive transfer of gammadelta T cells in combination with zoledronic acid and IL‑2 to patients with advanced renal cell carcinoma. Cancer Immunol Immunother 2011; 60(8): 1075 – 1084.
31. Nicol AJ, Tokuyama H, Mattarollo SR et al. Clinical evaluation of autologous gamma delta T cell‑based immunotherapy for metastatic solid tumours. Br J Cancer 2011; 105(6): 778 – 786. doi: 10.1038/ bjc.2011.293.
32. Abe Y, Muto M, Nieda M et al. Clinical and immunological evaluation of zoledronate‑activated Vgamma9gammadelta T ‑ cell‑based immunotherapy for patients with multiple myeloma. Exp Hematol 2009; 37(8): 956 – 968. doi: 10.1016/ j.exphem.2009.04.008.
33. Kunzmann V, Bauer E, Wilhelm M. Gamma/ delta T ‑ cell stimulation by pamidronate. N Engl J Med 1999; 340(9): 737 – 738.
34. Wilhelm M, Kunzmann V, Eckstein S et al. Gammadelta T cells for immune therapy of patients with lymphoid malignancies. Blood 2003; 102(1): 200 – 206.
35. Dieli F, Vermijlen D, Fulfaro F et al. Targeting human (gamma)delta) T cells with zoledronate and interleukin‑2 for immunotherapy of hormone ‑ refractory prostate cancer. Cancer Res 2007; 67(15): 7450 – 7457.
36. Fowler DW, Copier J, Wilson N et al. Mycobacteria activate gammadelta T ‑ cell anti‑tumour responses via cytokines from type 1 myeloid dendritic cells: a mechanism of action for cancer immunotherapy. Cancer Immunol Immunother 2012; 61(4): 535 – 547. doi: 10.1007/ s00262 ‑ 011 ‑ 1121 ‑ 4.
37. Naoe M, Ogawa Y, Takeshita K et al. Bacillus Calmette ‑ Guerin‑pulsed dendritic cells stimulate natural killer T cells and gammadeltaT cells. Int J Urol 2007; 14(6): 532 – 538.
38. Dalgleish A. A Trial comparing gemcitabine with and without IMM ‑ 101 in advanced pancreatic cancer. NCT01303172.
39. Mann ER, McCarthy NE, Peake ST et al. Skin ‑ and gut ‑ homing molecules on human circulating gammadelta T cells and their dysregulation in inflammatory bowel disease. Clin Exp Immunol 2012; 170(2): 122 – 130. doi: 10.1111/ j.1365 ‑ 2249.2012.04649.x.
40. Su C, Jakobsen I, Nei M. Diversity and evolution of T ‑ cell receptor variable region genes in mammals and birds. Immunogenetics 1999; 50(5 – 6): 301 – 308.
41. Petrini I, Scatena C, Naccarato AG et al. CD57 and gammadelta T ‑ cell receptor expression in nodal metastatic spread of melanoma. Eur J Clin Invest 2012; 42(5): 575 – 576. doi: 10.1111/ j.1365 ‑ 2362.2011.02612.x.
42. Campillo JA, Martínez ‑ Escribano JA, Minguela A et al. Increased number of cytotoxic CD3+ CD28 – gammadelta T cells in peripheral blood of patients with cutaneous malignant melanoma. Dermatology 2007; 214(4): 283 – 288.
43. Hu C, Qian L, Miao Y et al. Antigen ‑ presenting effects of effector memory Vgamma9Vdelta2 T cells in rheumatoid arthritis. Cell Mol Immunol 2012; 9(3): 245 – 254. doi: 10.1038/ cmi.2011.50.
44. Peters C, Oberg HH, Kabelitz D et al. Phenotype and regulation of immunosuppressive Vdelta2 - expres-sing gammadelta T cells. Cell Mol Life Sci 2014; 71(10): 1943 – 1960.
45. Shibuya K, Nakano N. Interleukin‑2 drives immature double negative thymocytes into gammadelta T cells expressing Foxp3 on a stromal cell line in vitro. Biochem Biophys Res Commun 2014; 452(4): 912 – 919. doi: 10.1016/ j.bbrc.2014.08.155.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2015 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Analýza změn fosfoproteomu nádorové buněčné linie MDA‑ MB‑ 468 v odpovědi na expresi izoforem p63 pomocí hmotnostní spektrometrie
- „Cukry zasahují“ aneb glykomika na poli nádorových biomarkerů
- Nrf2 – dve tváre regulátora antioxidačného systému
- Editorial
- Polo‑like kináza 1 jako cíl protinádorové terapie
- PDLIM2 a jeho role v onkogenezi – tumor supresor nebo onkoprotein?
- Profil aktivace receptorových tyrozinkináz a mitogenem aktivovaných proteinkináz v terapii Maffucciho syndromu
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
- Imunologické aspekty v onkologii – cirkulující γδ T lymfocyty
- Cirkulující nádorová DNA v krvi a její využití jako potenciálního biomarkeru nádorových onemocnění
- Adenovírusové vektory v génovej terapii
- Nádory u adolescentů
- Bioinformatika a sekvenování nové generace
- IntegRECAMO: úspěšná realizace projektu OP VK
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Adenovírusové vektory v génovej terapii
- Nrf2 – dve tváre regulátora antioxidačného systému
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



