-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Rekombinantní protilátky a jejich využití v protinádorové terapii
Recombinant Antibodies and Their Employment in Cancer Therapy
Development of recombinant therapeutic antibodies is recently one of the fastest growing disciplines of applied biomedical research. Recombinant monoclonal antibodies are increasingly applied in biological therapy of many serious human diseases and are currently an irreplaceable part of a comprehensive cancer therapy. First mouse therapeutic antibodies had only limited applicability due to the strong immune response; however, technological advances enabled engineering of antibodies with increased specificity and efficacy, and on the other hand with reduced adverse effects due to lower antigenicity. This review provides a summary of knowledge about recombinant therapeutic antibodies, their mechanism of action and approaches how to improve their efficacy.
Key words:
antineoplastic agents – immunoglobulins – humanized monoclonal antibodies – therapeutic antibodies – recombinant antibodies
This study was supported by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/2.1.00/03.0101), MEYS – NPS I – LO1413 and MH CZ – DRO (MMCI, 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
20. 4. 2015Accepted:
26. 6. 2015
Autoři: E. Růčková; P. Müller; B. Vojtěšek
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 2): 52-59
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko20152S52Souhrn
Vývoj rekombinantních terapeutických protilátek je v poslední době jednou z nejrychleji se rozvíjejících disciplín aplikovaného biomedicínského výzkumu. Rekombinantní monoklonální protilátky nalézají stále větší uplatnění v biologické terapii řady závažných lidských chorob a jsou v současné době nenahraditelnou součástí komplexní protinádorové terapie. Terapeutické protilátky využívané v klinické praxi prošly značným vývojem. Z prvních protilátek produkovaných v myších, které jako vedlejší účinek indukovaly silnou imunitní odpověď, byly metodami rekombinantní DNA a genové manipulace vyvinuty plně lidské protilátky s výrazně omezenými vedlejšími účinky a zároveň se zvýšenou specifitou a efektivitou. V této práci jsou shrnuty základní poznatky o terapeutických monoklonálních protilátkách, jejich historický vývoj a přehled metodických přístupů vedoucích k vývoji účinnějších, ale také bezpečnějších protilátek.
Klíčová slova:
protinádorová léčiva – imunoglobuliny – humanizované monoklonální protilátky – terapeutické protilátky – rekombinantní protilátkyÚvod
O využití monoklonálních protilátek k léčbě nádorových onemocnění se začalo uvažovat teprve nedávno, přesto patří v dnešní době mezi úspěšné strategie léčby onkologických onemocnění (hematologických malignit i solidních nádorů). Mechanizmus jejich působení je založen na specifické vazbě na povrchové antigeny nádorových buněk. Byla popsána řada molekul, které jsou u nádorových buněk mutovány nebo nadměrně či aberantně exprimovány a následně byly identifikovány jako potenciální cíle terapeutických protilátek. Tyto antigeny se dělí na antigeny specifické pro nádory (tumor specific antigen) a antigeny asociované s nádory (tumor associated antigen). Nejčastějšími cílovými molekulami terapeutických protilátek jsou CD (cluster of differentiation) antigeny (např. CD20, CD30 a CD52), receptory růstových faktorů (např. HER2/ neu, EGFR, MET), růstové faktory (např. VEGF), adhezivní molekuly (např. EpCAM a alfa4 - integrin) nebo imunomodulační receptory (CTLA 4 a PD 1). Mezi způsoby, jak terapeutickými protilátkami ovlivnit nádorovou buňku, patří inhibice funkce antigenu (např. receptoru), přivedení specifické toxické látky konjugované s protilátkou (např. cytostatika, radioizotopu) nebo aktivace imunitního systému [1].
Protilátky – struktura a funkce
Protilátky, imunoglobuliny (Ig), jsou molekuly produkované B lymfocyty, které mohou v organizmu volně cirkulovat v rozpustné formě nebo mohou být vázány na cytoplazmatickou membránu B lymfocytů jako součást B buněčného receptoru (B cell receptor – BCR). U savců jsou imunoglobuliny podle vlastností těžkých řetězců rozděleny do pěti izotypových tříd, a to IgM, IgD, IgA, IgE, IgG. Jednotlivé třídy izotypů mají odlišné funkce a jsou produkovány v různých fázích imunitní odpovědi. Primární imunitní odpověď je zprostředkována sekretovanými protilátkami IgM tvořícími multivalentní molekulu pěti nebo šesti protilátek, které aktivací komplementu napomáhají fagocytóze. IgD jsou exprimovány na naivních B buňkách. Sekretované IgA tvoří dimer a nachází se ve slinách, slzách, kolostru a mateřském mléce. IgE se nachází zejména v plicích a kůži a hrají důležitou roli při hypersenzitivních a alergických reakcích. IgG jsou nejhojnějším izotypem protilátek v lidském těle a účastní se sekundární fáze imunitní odpovědi. Lidské IgG se dále dělí na čtyři podtřídy, IgG1–IgG4, lišící se množstvím v séru a vazebnou afinitou k Fc (fragment crystallizable) receptorům na buňkách imunitního systému [2]. Protilátky izotypu IgG mají nejdelší biologický poločas (přibližně 21 dnů), protože se váží na receptor FcRn (neonatal Fc receptor), který se nachází v endozomech a podílí se na recyklaci imunoglobulinů pohlcených pinocytózou. Proto je tato třída imunoglobulinů nejčastěji využívána k produkci terapeutických protilátek [3].
Molekuly imunoglobulinů jsou složeny ze dvou těžkých (H) a dvou lehkých (L) polypeptidových řetězců kovalentně spojených disulfidickými můstky do charakteristické struktury ve tvaru písmene Y (obr. 1A). Těžké řetězce se skládají ze čtyř až pěti a lehké řetězce ze dvou strukturně podobných imunoglobulinových domén. Domény na N ‑ konci těžkých i lehkých řetězců se označují jako variabilní (VH, VL), přičemž každá doména obsahuje tři hypervariabilní oblasti CDR (complementarity determining region) tvořící jedinečnou prostorovou strukturu, do které se specificky váže antigen. Variabilní oblasti jednotlivých klonů B lymfocytů jsou unikátní. Zbývající domény jsou v rámci daného typu těžkých i lehkých řetězců identické a označují se jako konstantní (CH1 – CH4, CL) [2].
Obr. 1. A. Schematické znázornění struktury molekuly imunoglobulinu. B. Fragmenty protilátek vytvořené proteolytickým štěpením. 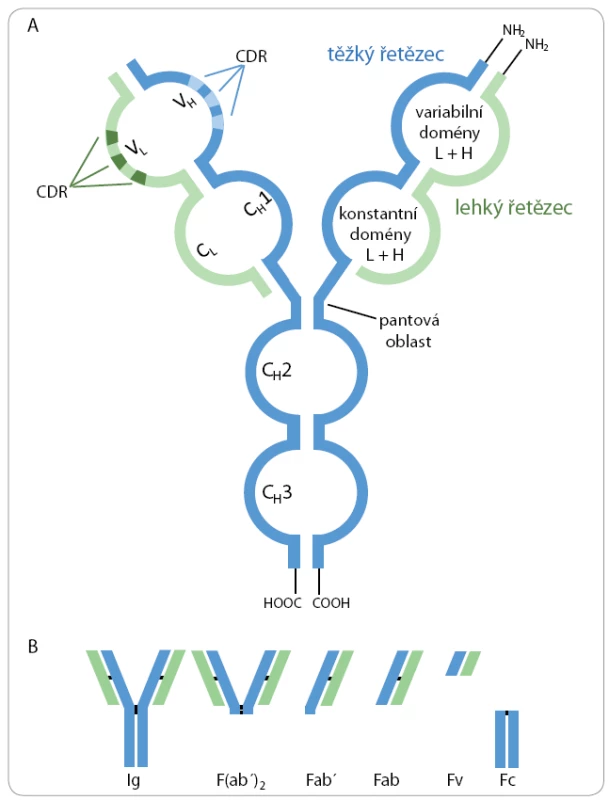
Proteolytickým štěpením imunoglobulinů je možné získat specifické fragmenty (obr. 1B). Pomocí papainu vznikají dva identické Fab fragmenty (fragment antigen binding), které jsou monovalentní a každý obsahuje jedno vazebné místo pro antigen, a jeden Fc fragment, který je tvořen konstantními oblastmi těžkých řetězců. Fab jsou tvořeny doménami VH, CH1, VL a CL, které jsou spojeny intramolekulární disulfidickou vazbou. Štěpení pepsinem, jehož rozpoznávací místo se nachází za pantovou oblastí, vede ke vzniku bivalentního fragmentu F(ab’)2, který navíc obsahuje krátký úsek Fc fragmentu. Redukcí disulfidových můstků vznikají Fab’ fragmenty obsahující volnou sulfhydrylovou skupinu, která může být využita ke konjugaci enzymu, toxinu nebo jiného specifického proteinu. Fv fragmenty (fragment variable) jsou nejmenší fragmenty obsahující kompletní vazebné místo pro antigen a jsou tvořeny pouze doménami VH a VL, které jsou drženy nekovalentními interakcemi. Fragmenty protilátek nachází díky své menší velikosti využití v určitých imunochemických technikách a experimentálních aplikacích, kdy např. protilátky účinněji pronikají do preparátu při imunohistochemickém barvení, jsou minimalizována sterická omezení pro vazbu epitopu a dále absence Fc fragmentu omezuje nespecifické interakce a snižuje imunogenicitu protilátek při in vivo experimentech [4].
Genetika protilátek
Široké spektrum protilátek schopných rozlišit jakýkoli potenciální antigen není kódováno přímo v zárodečné linii, této diverzity je dosaženo procesem somatické VDJ rekombinace během vývoje lymfocytů. Geny kódující řetězce imunoglobulinů jsou složeny z několika skupin sekvenčně příbuzných segmentů, v lidském lokusu pro těžké řetězce se nachází přibližně 50 V (variability) segmentů, 27 D (diversity) segmentů, 6 J (joining) segmentů a geny pro konstantní části těžkého řetězce. Struktura genových komplexů kódujících lehké řetězce κ a λ je podobná, ale obsahuje menší počet V a J segmentů a D segmenty chybí úplně (obr. 2). V progenitorech B lymfocytů (proB) dochází k D ‑ J přeskupení, při němž je vyštěpen úsek mezi náhodnými D a J segmenty. Následně je vyštěpen úsek mezi některým z V segmentů a DJ segmentem vzniklým v předchozím kroku (V ‑ D přeskupení). Pokud je přeskupením vytvořen produkt, ze kterého je syntetizován funkční H polypeptid, je další přeskupování na druhém chromozomu zastaveno (jedná se o alelickou exkluzi) a z buňky se stává pre‑B lymfocyt. Tato událost dává buňce signál k zahájení přeskupování genů pro lehké řetězce, nejprve řetězců κ a v případě neúspěchu dochází k přeskupování řetězců λ. Po vytvoření povrchového IgM se buňka stává nezralým B lymfocytem a po současné expresi IgM a IgD zralým B lymfocytem. Již kombinací VDJ segmentů vzniká značná diverzita, která je znásobena nepřesnostmi ve spojování jednotlivých segmentů (tzv. spojovací variabilita) a působením enzymu terminální transferázy, jež prodlužuje konce přeskupených segmentů o krátké náhodné N ‑ sekvence. V-D a D - J spojení odpovídá hypervariabilní oblasti CDR3, která vykazuje nejvyšší diverzitu v rámci spektra protilátek. Po styku zralého B lymfocytu s antigenem dochází k mutacím V segmentů, které dále zvyšují variabilitu imunoglobulinů. Všechny procesy vedoucí ke vzniku imunoglobulinů jsou důsledně kontrolovány a B lymfocyty produkující nefunkční, nestabilní nebo autoreaktivní protilátky jsou odstraněny.
Obr. 2. Schematické znázornění VDJ přesmyku genomové DNA těžkého (H) a lehkého (L) řetězce imunoglobulinu. 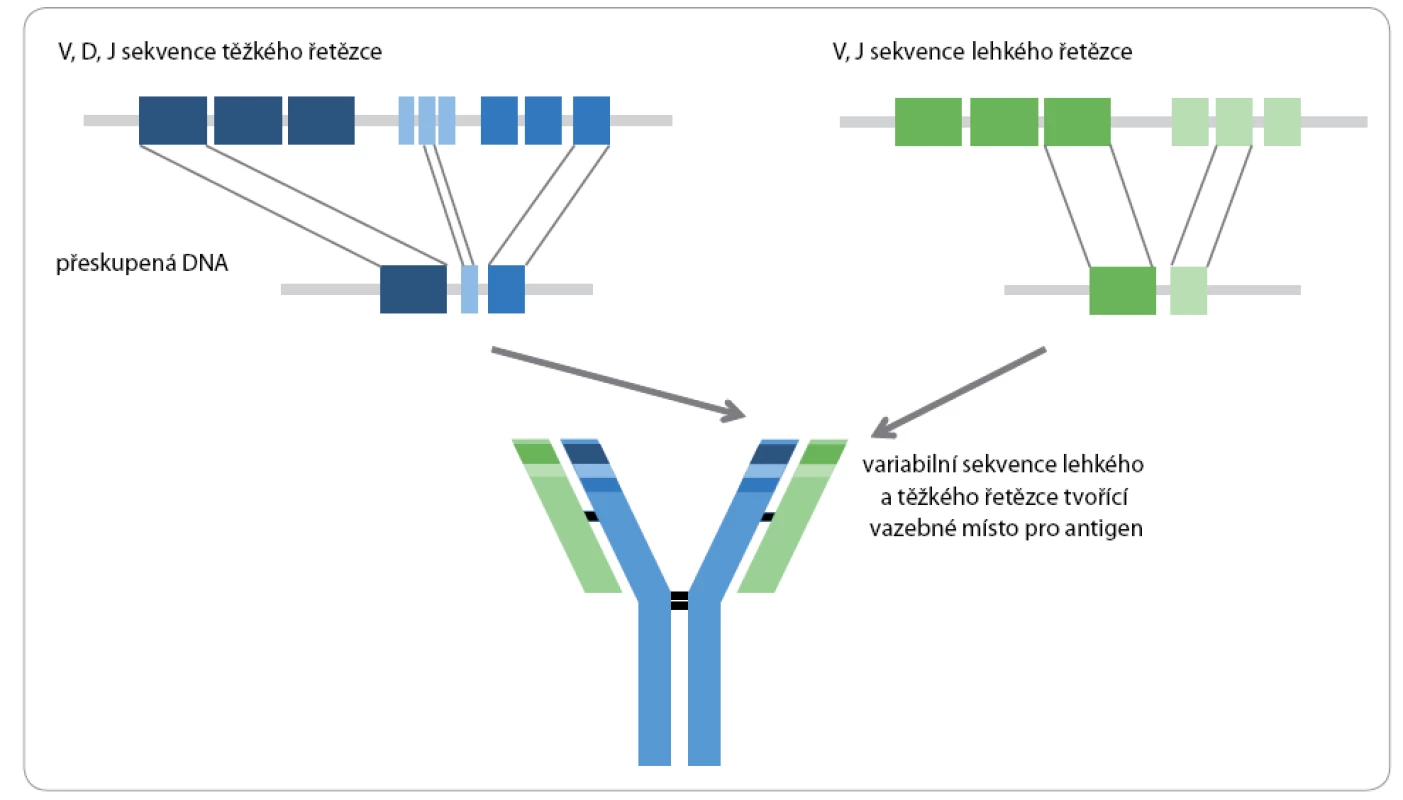
Znázorněny jsou také oblasti molekuly imunoglobulinu, které odpovídají přeskupeným řetězcům. Během terminální diferenciace B lymfocytu po aktivaci antigenem dochází k další rekombinační události, izotypovému přesmyku (class switching), při kterém jsou vyštěpovány konstantní úseky těžkých řetězců. Izotypové přesmyky mohou v dané buňce probíhat několikrát za sebou, dokud jsou přítomny sekvence, které lze eliminovat. Typ přesmyku a výsledný izotyp protilátky, který bude buňka produkovat, je regulován cytokiny [2].
Monoklonální terapeutické protilátky – historický vývoj
Monoklonální protilátky jsou získávány hybridomovou technologií, kdy jsou fúzovány B lymfocyty izolované ze sleziny imunizovaných myší a nesmrtelné myší myelomové buňky [5]. Takto vytvořené myší monoklonální protilátky se staly významným nástrojem pro základní i aplikovaný výzkum a klinickou diagnostiku. Brzy se začalo uvažovat také o jejich terapeutickém využití a první terapeutickou protilátkou schválenou FDA (Food and Drug Administration – Úřad pro kontrolu léčiv) v USA se stal v roce 1986 muromonab ‑ CD3 (Orthoclone OKT3®, k prevenci odmítnutí orgánu po transplantaci). Klinická praxe však ukázala, že podávání čistě myších protilátek vyvolává silnou imunitní odpověď organizmu, což zabránilo jejich širšímu využití. Vývoj nových generací terapeutických protilátek byl umožněn výraznými pokroky v technologiích genového inženýrství a rekombinantní DNA. Nejdříve byly vytvořeny chimérické protilátky, které mají zachovány myší variabilní řetězce, zatímco konstantní řetězce jsou nahrazeny lidskými [6]. První chimérická protilátka abciximab (ReoPro®, k inhibici agregace krevních destiček), která je Fab fragmentem, byla na trh v USA uvedena v roce 1994. Poté byly vyvinuty humanizované protilátky, které mají myší sekvence zachovány pouze v hypervariabilní oblasti CDR odpovědné za vazbu antigenu. Tato technika se nazývá CDR grafting [7]. První humanizovaná protilátka daclizumab (Zenapax®, k prevenci odmítnutí orgánu po transplantaci) byla schválena v roce 1997. Roky 1997 a 1998 byly v historii vývoje terapeutických protilátek přelomem, na trh bylo uvedeno pět protilátek a zájem o tuto oblast výzkumu prudce vzrostl. V roce 1997 byla schválena i první protilátka k léčbě nádorového onemocnění rituximab (Rituxan®, anti‑CD20 protilátka k léčbě hematologických malignit). Dalším milníkem bylo vytvoření plně lidských monoklonálních protilátek. K jejich vývoji bylo potřeba vyvinout alternativní strategie, neboť imunizace lidí nepřichází z etického hlediska v úvahu a dále nebyla k dispozici stabilní lidská myelomová linie vhodná k vytvoření hybridomu. K pokroku došlo teprve s rozvojem metod založených na klonování variabilních sekvencí protilátek a jejich selekci prostřednictvím bakteriofágů [8] a později také přípravou transgenních myší (tzv. humanizované myši), které mají myší geny pro imunoglobuliny nahrazeny lidskými [9,10]. První plně humánní protilátkou uvedenou na trh v USA byl v roce 2002 adalimumab (Humira®, inhibitor TNF-α pro léčbu revmatoidní artritidy) vytvořený pomocí technologie „phage display“, která využívá exprese variabilních řetězců na povrchu bakteriofága. Následně schválené protilátky panitumumab (Vectibix®, inhibitor EGFR pro léčbu kolorektálního karcinomu) v roce 2006 nebo ipilimumab (Yervoy®, anti‑CTLA4 protilátka pro léčbu metastatického melanomu) v roce 2011 byly vytvořeny s využitím transgenních myší. Významnou technologií, jak upravit vlastnosti protilátek, je modifikace Fc fragmentů připojením proteinů nebo jejich domén [11]. První schválenou fúzní terapeutickou protilátkou byl v roce 1998 etanercept (Enbrel®), který má k Fc oblasti připojen receptor pro TNF, a inhibuje tudíž signalizaci TNF-α. Tato protilátka se využívá k léčbě autoimunitních onemocnění [12].
Mezi objevem nových technologií a schválením a uvedením na trh prvních protilátek vytvořených danou technologií bývá průměrně 9 – 13 let prodleva, což je vzhledem k mnoha fázím procesu registrace nového léčiva (preklinického vývoje, preklinických toxikologických testování a klinických studií) standardní doba odpovídající jiným typům léčiv [13].
Mechanizmy působení terapeutických monoklonálních protilátek
Terapeutické protilátky mohou působit na nádorové buňky různými způsoby buď přímo, nebo nepřímo. Přímé účinky spočívají v ovlivnění membránových receptorů nebo proteinů vázaných na buněčném povrchu, růstových faktorů či cirkulujících proteinů. Přímé účinky protilátek mohou být také zprostředkovány pomocí toxinů, radioizotopů nebo cytokinů, které jsou kovalentně navázány na molekulu imunoglobulinu (imunokonjugace). Nepřímé účinky protilátek jsou zprostředkovány Fc oblastí protilátek, kdy protilátky po navázání na cílovou buňku aktivují komplement (complement ‑ dependent cytotoxicity – CDC), stimulují efektorové buňky imunitního systému (antibody ‑ dependent cytotoxicity – ADCC) nebo regulují aktivitu T lymfocytů [1]. Převážná většina terapeutických protilátek schválených ke klinickému použití jsou klasické protilátky první generace, jako např. trastuzumab (Herceptin®, anti‑HER2 pro léčbu karcinomu prsu), cetuximab (Erbitux®, anti‑EGFR pro léčbu kolorektálního karcinomu), panitumumab (Vectibix®, anti‑EGFR) nebo bevacizumab (Avastin®, anti‑VEGF pro léčbu kolorektálního karcinomu). Méně často se využívají konjugované protilátky, které umožňují specifické doručení terapeutických látek přímo k nádorovým buňkám, čímž dochází ke zvýšení koncentrace léčiva v cílové oblasti a zároveň se minimalizují vedlejší účinky na zdravé tkáně [1]. Přehled monoklonálních terapeutických protilátek schválených FDA k léčbě onkologických onemocnění je uveden v tab. 1 [14,15].
Tab. 1. Přehled terapeutických protilátek využívaných v terapii onkologických onemocnění schválených FDA. Převzato z [14,15]. ![Přehled terapeutických protilátek využívaných v terapii onkologických onemocnění schválených FDA. Převzato z [14,15].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/d2559141e824c8d9de8739d109ab7586.png)
ADC (antibody drug conjugate) jsou monoklonální protilátky chemicky konjugované s cytotoxickými látkami, zejména látkami inhibujícími organizaci mikrotubulů. V současné době jsou registrovány dvě protilátky – brentuximab vedotin (Adcetris®) a trastuzumab emtansine (Kadcyla®), obě konjugované s toxiny mikrotubulů [16]. Další variantou jsou monoklonální protilátky konjugované s radioaktivními izotopy. Registrovány jsou protilátky ibritumomab tiuxetan (Zevalin®) a tositumomab ‑ 131I (Bexxar®), které jsou cíleny na CD20 [17]. Bispecifické protilátky jsou protilátky obsahující dva různé Fv fragmenty rozpoznávající dva různé antigeny, např. catumaxomab (Removab®) váže CD3 a EpCAM (epithelial cell adhesion molecule) [18]. Potenciálně využitelné jsou také imunotoxiny, kdy jsou protilátky fúzovány s bakteriálními toxiny Pseudomonas exotoxin A, Diphteria toxin nebo rostlinnými toxiny gelonin a ricin, které zprostředkovávají smrt nádorové buňky inhibicí proteosyntézy, a proto je tento mechanizmus účinný také v případě nedělících se buněk [19]. Antibody directed enzyme prodrug therapy (ADEPT) je přístup, kdy je s protilátkou konjugován enzym konvertující netoxickou látku v látku cytotoxickou. Po podání netoxické látky dochází k její konverzi specificky v oblasti nádoru [20].
Protilátky druhé generace s cíleně změněnou glykosylací v oblasti Fc fragmentu byly připraveny genovou manipulací za účelem posílení ADCC. První schválenou protilátkou je obinutuzumab (Gazyva®, anti‑CD20 protilátka k léčbě chronické lymfatické leukemie) [21].
Během procesu přípravy těchto terapeutických protilátek často dochází ke změnám farmakokinetiky, funkce efektoru, velikosti a imunogenicity. Z tohoto důvodu je důležité věnovat pozornost výběru cílových antigenů i optimálních protilátek, včetně typu konstruktu rekombinantní protilátky a terapeutického přístupu.
Klonování protilátek – knihovny protilátek
Příprava knihoven lidských protilátek z přirozeně variabilních (naivních) zdrojů je v současné době zavedená technologie využívaná k produkci protilátek s definovanou specifitou k jakémukoli antigenu. Tato technologie se rozšířila díky zavedení metody phage display, která umožňuje vystavit peptidové sekvence na povrchu bakteriofágů a podrobit je opakované selekci vůči specifickému antigenu (obr. 3). Phage display je tak analogií přirozené selekce protilátek in vivo [8]. Pro účely selekce protilátek je nejvhodnější bakteriofág M13, přičemž kódující sekvence protilátek jsou fúzovány s genem pro plášťový protein pIII a fragmenty protilátek jsou tak vystaveny na povrchu bakteriofága. Tímto způsobem je propojen fenotypový projev, fragment protilátky na povrchu bakteriofága, s genotypem, nukleotidovou sekvencí kódující protilátku.
Obr. 3. Schéma postupu přípravy protilátek metodou phage display. 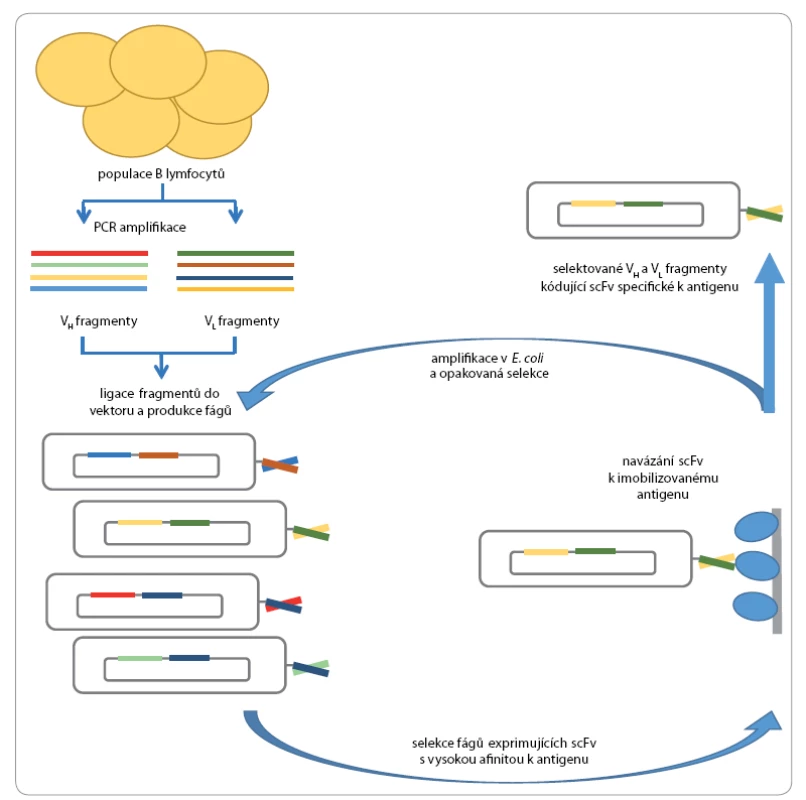
První krok k přípravě knihovny je izolace kvalitní RNA z vybraných buněk (např. mononukleární buňky z periferní krve). Tato RNA je reverzní transkriptázou přepsána do cDNA, která je použita jako templát pro PCR amplifikaci VH a VL řetězců s využitím primerů specifických pro konstantní oblasti VH a VL řetězců. Takto jsou amplifikovány přeskupené variabilní oblasti celého repertoáru imunoglobulinů, které odráží specifitu všech protilátek daného jedince. PCR produkty jsou ligovány do vektorů, které umožňují exprimovat VH a VL řetězce jako scFv (single chain fragment variable) fúzované ke kapsidovému proteinu pIII. Takto lze připravit knihovny tvořené 108 – 1011 unikátními klony, které jsou podrobeny 3 – 4 cyklům selekce a amplifikace, při níž jsou selektovány klony s vysokou specifitou a afinitou k antigenu. Zvolené klony mohou být podrobeny analýze vazebných vlastností a geny kódující VH a VL řetězce sekvenovány. Solubilní scFv fragmenty mohou být snadno exprimovány v bakteriích a purifikovány.
Screening knihoven umožňuje přípravu protilátek specifických k jakýmkoli antigenům, včetně toxinů nebo proteinů, které jsou konzervovány v rámci savčích buněk a lze je obtížně připravit imunizací. Během selekce je možné navíc získat množství různých protilátek pokrývajících široké spektrum epitopů. Syntetické monoklonální protilátky mají relativně nízkou afinitu k antigenu, a proto byly vyvinuty metody napodobující proces zvyšování afinity (affinity maturation), jejichž výsledkem jsou kompletní syntetické protilátky [22,23].
Phage display není jediná metoda selekce protilátek. Alternativní metody jsou mRNA display [24] a ribozomový display scFv fragmentů [25], kdy selekce probíhá při in vitro translaci nebo vystavení scFv a Fab fragmentů na povrchu bakterií [26] či kvasinek [27].
Transgenní myši
Transgenní myši mají do svého genomu včleněny geny pro lidské imunoglobuliny, zatímco endogenní lokusy jsou inaktivovány. Tyto transgenní myši produkují celou škálu protilátek syntetizovaných z lidských genových sekvencí, a proto mohou být využity k získávání lidských monoklonálních protilátek s vysokou afinitou a velmi nízkou imunogenicitou přímo po imunizaci cílovou molekulou. Klinické testy ukazují, že takto produkované terapeutické protilátky jsou velmi dobře tolerovány a jsou klinicky aktivní. Těchto úspěchů bylo dosaženo díky pokrokům v technikách genové manipulace s buňkami savčích embryí. Pro úspěšnou expresi lidských protilátek v transgenních myších je nezbytné, aby vložené lidské sekvence funkčně nahradily endogenní imunoglobulinové sekvence v B lymfocytech a podléhaly všem procesům v průběhu vývoje lymfocytů, jako jsou VDJ rekombinace, somatické mutace a přesmyk izotypových tříd, a zároveň ovlivňovaly funkci, diferenciaci a přežití B lymfocytů. První transgenní myši měly do svého genomu vloženu pouze malou část VDJ segmentů, a přesto produkovaly funkční a specifické protilátky proti antigenům, kterými byly imunizovány [9,10]. Následně bylo vyvinuto mnoho kmenů transgenních myší s rozšířeným spektrem variabilních genových segmentů a nedávno bylo publikováno vytvoření transgenních myší s kompletně humanizovanými variabilními sekvencemi, kdy bylo do těchto myší vloženo až šest milionů bází DNA [28,29].
Produkce terapeutických protilátek probíhá ve velkoobjemových zařízeních, ve kterých je nutno dodržovat specifické postupy, aby byla zajištěna vysoká kvalita vyhovující standardům pro výrobu léčiv. Využívají se zejména tkáňové kultury savčích buněk, např. CHO (chinese hamster ovary) nebo hybridomové linie. Fragmenty protilátek mohou být s úspěchem produkovány v bakteriálních kulturách. Výzkum se zaměřuje také na využití kvasinkových systémů Pichia pastoris, transgenních rostlin, mléka nebo vajec transgenních živočichů.
Závěr
Vývoj monoklonálních protilátek k léčbě nádorových onemocnění je jedním z vědeckých úspěchů uplynulých let a využití terapeutických protilátek patří mezi nejrychleji se rozvíjející oblasti protinádorové léčby. Terapeutické protilátky prošly výraznou evolucí, jejich transformací z myších protilátek přes chimérické a humanizované až k plně lidským byly sníženy jejich vedlejší účinky, a naopak novými technologiemi byl zesílen jejich terapeutický potenciál. Další rozvoj terapeutických protilátek bude souviset s identifikací nových specifických nádorových antigenů, selekcí účinných protilátek a prohloubením znalostí o kontrole nádorové transformace imunitním systémem s cílem vyvinout nové strategie, které povedou ke klinickému prospěchu u onkologických pacientů.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (RECAMO, CZ.1.05/2.1.00/03.0101), projektem MŠMT – NPU I – LO1413 a MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
RNDr. Bořivoj Vojtěšek, DrSc.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: vojtesek@mou.cz
Obdrženo: 20. 4. 2015
Přijato: 26. 6. 2015
Zdroje
1. Scott AM, Wolchok JD, Old LJ. Antibody therapy of cancer. Nat Rev Cancer 2012; 12(4): 278 – 287. doi: 10.1038/ nrc3236.
2. Hořejší V, Bartůňková J (eds). Základy imunologie. 1. vyd. Praha: Triton 1998.
3. Junghans RP, Anderson CL. The protection receptor for IgG catabolism is the beta2 - microglobulin‑containing neonatal intestinal transport receptor. Proc Natl Acad Sci U S A 1996; 93(11): 5512 – 5516.
4. Nelson AL. Antibody fragments: hope and hype. MAbs 2010; 2(1): 77 – 83.
5. Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975; 256(5517): 495 – 497.
6. Morrison SL, Johnson MJ, Herzenberg LA et al. Chimeric human antibody molecules: mouse antigen‑binding domains with human constant region domains. Proc Natl Acad Sci U S A 1984; 81(21): 6851 – 6855.
7. Jones PT, Dear PH, Foote J et al. Replacing the complementarity ‑ determining regions in a human antibody with those from a mouse. Nature 1986; 321 (6069): 522 – 525.
8. McCafferty J, Griffiths AD, Winter G et al. Phage antibodies: filamentous phage displaying antibody variable domains. Nature 1990; 348(6301): 552 – 554.
9. Lonberg N, Taylor LD, Harding FA et al. Antigen ‑ specific human antibodies from mice comprising four distinct genetic modifications. Nature 1994; 368(6474): 856 – 859.
10. Green LL, Hardy MC, Maynard ‑ Currie CE et al. Antigen ‑ specific human monoclonal antibodies from mice engineered with human Ig heavy and light chain YACs. Nat Genet 1994; 7(1): 13 – 21.
11. Capon DJ, Chamow SM, Mordenti J et al. Designing CD4 immunoadhesins for AIDS therapy. Nature 1989; 337(6207): 525 – 531.
12. Zalevsky J, Secher T, Ezhevsky SA et al. Dominant ‑ negative inhibitors of soluble TNF attenuate experimental arthritis without suppressing innate immunity to infection. J Immunol 2007; 179(3): 1872 – 1883.
13. Lonberg N. Human antibodies from transgenic animals. Nat Biotechnol 2005; 23(9): 1117 – 1125.
14. Antibodysociety.org [homepage on the Internet]. The Antibody Society, USA; c2007 – 2013 [updated 2015 January 17; cited 2015 April 10]. Available from: http:/ / www.antibodysociety.org/ news/ approved_mabs.php.
15. FDA.gov [homepage on the Internet]. U.S. Food and Drug Administration, USA [cited 2015 April 10]. Available from: http:/ / www.accessdata.fda.gov/ scripts/ cder/ drugsatfda/ index.cfm.
16. Klute K, Nackos E, Tasaki S et al. Microtubule inhibitor‑based antibody ‑ drug conjugates for cancer therapy. Onco Targets Ther 2014; 7 : 2227 – 2236. doi: 10.2147/ OTT.S46887.
17. Kraeber ‑ Bodéré F, Rousseau C, Bodet ‑ Milin C et al. A pretargeting system for tumor PET imaging and radioimmunotherapy. Front Pharmacol 2015; 6 : 54. doi: 10.3389/ fphar.2015.00054.
18. Kontermann RE, Brinkmann U. Bispecific antibodies. Drug Discov Today 2015. doi: 10.1016/ j.drudis.2015.02.008.
19. Alewine C, Hassan R, Pastan I. Advances in anticancer immunotoxin therapy. The Oncologist 2015; 20(2): 176 – 185. doi: 10.1634/ theoncologist.2014 ‑ 0358.
20. Zawilska JB, Wojcieszak J, Olejniczak AB. Prodrugs: a challenge for the drug development. Pharmacol Rep 2013; 65(1): 1 – 14.
21. Listinsky JJ, Siegal GP, Listinsky CM. Glycoengineering in cancer therapeutics: a review with fucose‑depleted trastuzumab as the model. Anticancer Drugs 2013; 24(3): 219 – 227. doi: 10.1097/ CAD.0b013e328359e3f4.
22. Barbas CF, Burton DR. Selection and evolution of high‑affinity human anti‑viral antibodies. Trends Biotechnol 1996; 14(7): 230 – 234.
23. Razai A, Garcia ‑ Rodriguez C, Lou J et al. Molecular evolution of antibody affinity for sensitive detection of botulinum neurotoxin type A. J Mol Biol 2005; 351(1): 158 – 169.
24. Fukuda I, Kojoh K, Tabata N et al. In vitro evolution of single‑chain antibodies using mRNA display. Nucleic Acids Res 2006; 34(19): e127.
25. Hanes J, Plückthun A. In vitro selection and evolution of functional proteins by using ribosome display. Proc Natl Acad Sci U S A 1997; 94(10): 4937 – 4942.
26. Fuchs P, Breitling F, Dübel S et al. Targeting recombinant antibodies to the surface of Escherichia coli: fusion to a peptidoglycan associated lipoprotein. Biotechnology (N Y) 1991; 9(12): 1369 – 1372.
27. Boder ET, Wittrup KD. Yeast surface display for screening combinatorial polypeptide libraries. Nat Biotechnol 1997; 15(6): 553 – 557.
28. Lee EC, Liang Q, Ali H et al. Complete humanization of the mouse immunoglobulin loci enables efficient therapeutic antibody discovery. Nat Biotechnol 2014; 32(4): 356 – 363. doi: 10.1038/ nbt.2825.
29. Murphy AJ, Macdonald LE, Stevens S et al. Mice with megabase humanization of their immunoglobulin genes generate antibodies as efficiently as normal mice. Proc Natl Acad Sci U S A 2014; 111(14): 5153 – 5158. doi: 10.1073/ pnas.1324022111.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2015 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Analýza změn fosfoproteomu nádorové buněčné linie MDA‑ MB‑ 468 v odpovědi na expresi izoforem p63 pomocí hmotnostní spektrometrie
- „Cukry zasahují“ aneb glykomika na poli nádorových biomarkerů
- Nrf2 – dve tváre regulátora antioxidačného systému
- Editorial
- Polo‑like kináza 1 jako cíl protinádorové terapie
- PDLIM2 a jeho role v onkogenezi – tumor supresor nebo onkoprotein?
- Profil aktivace receptorových tyrozinkináz a mitogenem aktivovaných proteinkináz v terapii Maffucciho syndromu
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
- Imunologické aspekty v onkologii – cirkulující γδ T lymfocyty
- Cirkulující nádorová DNA v krvi a její využití jako potenciálního biomarkeru nádorových onemocnění
- Adenovírusové vektory v génovej terapii
- Nádory u adolescentů
- Bioinformatika a sekvenování nové generace
- IntegRECAMO: úspěšná realizace projektu OP VK
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Adenovírusové vektory v génovej terapii
- Nrf2 – dve tváre regulátora antioxidačného systému
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



