-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Adenovírusové vektory v génovej terapii
Adenoviral Vectors in Gene Therapy
This review is focused on gene therapy, especially adenovirus vectors and their relationship with the immune system response. Adenovirus vectors belong to the most used gene delivery vehicles in gene therapy, study of gene expression or immunotherapy. One of the most important questions concerning their use is their influence on organism in vivo. Study of immunomodulating properties of the adenovirus vectors opens a way for further manipulation and their more effective practical use.
Key words:
gene therapy – adenoviridae – immune system
This study was supported by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/2.1.00/03.0101), by the project MEYS – NPS I – LO1413 and by (MH CZ – DRO (MMCI, 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
2. 4. 2015Accepted:
20. 7. 2015
Autoři: M. Pjechová 1; L. Hernychová 1; P. Tomašec 1,2; G. W. Wilkinson 1,2; B. Vojtěšek 1
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 1; Department of Medical Microbiology, Institute of Infection and Immunity, School of Medicine, Cardiff University, United Kingdom 2
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 2): 75-80
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko20152S75Souhrn
Tento článok je zameraný na génovú terapiu, špeciálne na adenovírusové vektory a ich vzťah k imunitnej odpovedi. Adenovírusové vektory patria k najviac využívaným nosičom genetického materiálu pri génovej terapii, štúdiu expresie génov či imunoterapii. Dôležitou otázkou pri in vivo používaní je ich vplyv na organizmus. Štúdium ich imunomodulačných vlastností je preto veľmi významná oblasť výskumu, vďaka ktorej je možné adenovírusové vektory progresívne upravovať a tak zefektívniť ich potenciál pre využitie v praxi.
Kľúčové slová:
génová terapia – adenoviridae – imunitný systémÚvod
Génová terapia ako horizontálny prenos génov bola prvýkrát skoncipovaná v 70. rokoch minulého storočia s nástupom technologických možností vnášania genetického materiálu do eukaryotických buniek [1]. „Prísna“ génová terapia je založená na koncepte nahradenia defektného génu vnesením a integráciou jeho funkčnej verzie. Z tohto dôvodu bola génová terapia vyvíjaná hlavne voči genetickým chorobám spôsobeným deficienciou jedného génu [2], ako napr. recesívne enzymatické poruchy. Avšak v dôsledku mnohých genetických abnormalít, simultánnych porúch viacerých génov pri vzniku tumorov nie je možné aplikovať prísnu génovú terapiu pri liečbe rakovinových ochorení. Preto sa génová terapia rakovinových ochorení sústreďuje najmä na vnesenie genetického materiálu s terapeutickými účinkami do tumoru, na zničenie rakovinových buniek a posilnenie imunitnej odpovede voči nim [3]. Hlavnými študovanými prístupmi v génovej terapii určenej na liečbu nádorových ochorení sú:
- Vnesenie „samovražedného génu“ na konvertovanie pro‑liečiva v tumore na liečivo a následné usmrtenie nádorových buniek. V klinických štúdiách sa testuje napr. tymidín kináza herpes simplex vírusu (HSV ‑ tk), ktorá fosforyluje gancyklovir, čo vedie k terminácii DNA syntézy [4].
- Vnesenie imunomodulátorov, cytokínových génov na pritiahnutie a aktiváciu imunitných buniek. Príkladom je adenovírusový vektor nesúci TNF‑α, pod kontrolou chemoradiačne inducibilného promótora, ktorý je súčasťou klinických štúdií [5].
- Vnesenie tumor ‑ supresorových génov na naprogramovanie apoptózy v tumorových bunkách, ako napr. adenovírusový vektor nesúci gén TP53, ktorý sa testuje v klinických štúdiách (pokročilá rakovina ústnej dutiny) [6].
- Vnesenie onkolytických vírusov špecificky lyzujúcich tumorové bunky. V klinických štúdiách II. fázy bol na liečbu metastatického malígneho melanómu použitý OncoVex – onkolytický herpes simplex vírus kódujúci stimulujúci faktor pre granulocyty/ makrofágy (GM‑CSF) [7].
- Vnesenie microRNA (miRNA), slúžiacej na umlčanie cieľových génov, napr. onkogénov [3,8]. V súvislosti s vylepšovaním onkolytických vírusov sa experimentálne testuje aj miRNA, ktorá sa používa na prevenciu replikácie vírusu v zdravých bunkách [9].
Typy vektorov
Efektivita génovej terapie v značnej miere závisí od voľby vektora. Vo vše-obecnosti môžeme vektory používané pri génovej terapii rozdeliť na dve hlavné skupiny: vírusové a nevírusové. Vírusy si evolúciou vyvinuli efektívny spôsob infikovania buniek, narušenia bunkovej obrany a expresie ich génov v bunkách. Tieto ich prirodzené vlastnosti boli využité a upravené genetickým inžinierstvom na veľmi výkonné systémy na vnesenie cudzorodých génov pomocou vírusov do buniek, tzv. transdukciu buniek. Nevírusové vektory sú atraktívnou alternatívou k vírusovým vektorom vďaka ich bezpečnosti, univerzálnosti a ľahkej príprave. Môžeme ich rozdeliť na štyri hlavné skupiny: čistá DNA, lipozómy, syntetické polyméry a nanočastice. Hlavnou nevýhodou všetkých štyroch skupín je však veľmi nízka efektivita transfekcie in vivo. V tomto článku sa budeme venovať vírusovým vektorom, hlavne adenovírusovým vektorom, ktoré boli podľa Ginn et al (2012) celosvetovo najviac využívanými génovými vektormi v klinických štúdiách (graf 1) [10].
Graf 1. Vektory používané v klinických štúdiách s génovou terapiou do roku 2012 podľa Ginn et al. 
Prevzaté z [10]. Vírusové vektory
Vírusové vektory sa podľa mechanizmu ich pôsobenia rozdeľujú na onkolytické vírusy a replikačno ‑ deficientné vírusové vektory.
Onkolytické vírusy
Onkolytické vírusy sú replikačno ‑ kompetentné, čo znamená, že gény zodpovedné za ich replikáciu sú zachované, čo je hlavný rozdiel oproti replikačno ‑ deficientným vírusovým vektorom. Terapeutické využitie onkolytických vírusov je založené na selektívnej efektivite ich replikácie v nádorových bunkách. Každý vírus má špecifický bunkový tropizmus, ktorý determinuje, aký typ buniek bude daný vírus infikovať (rabies – infikuje a ničí neuróny, hepatitida B – hepatocyty). Mnohé vírusy majú preferenčný, avšak nie exkluzívny tropizmus k nádorovým bunkám. Pravdepodobne je to dôsledok tumorovej biológie, keďže mnoho tumorov sa vyhýba detekcii a deštrukcii imunitným systémom a majú tiež porušené apoptotické mechanizmy a translačnú supresiu, čo sú kľúčové odpovede, ktoré využívajú zdravé bunky na potlačenie vírusovej infekcie. Onkolytické vírusy môžu taktiež využívať zmeny v metabolizme a bunkovom cykle tumorových buniek [11]. Schopnosť onkolytických vírusov usmrtiť nádorové bunky sa nazýva vírusová onkolýza. Onkolytické vírusy môžu zničiť infikované nádorové bunky mnohými spôsobmi – od priamej vírusovo ‑ sprostredkovanej cytotoxicity až po množstvo indukovaných imunitných mechanizmov. Hlavné typy onkolytických vírusov sú: podmienečne replikatívne adenovírusy, herpes simplex vírus 1, 2 (HSV ‑ 1, HSV ‑ 2) a variant vírusu osýpok [8]. Ďalším používaným vektorom je vírus vakcínie, pričom je zaujímavé, že niektoré jeho kmene majú prirodzený tropizmus k tumorovým bunkám (1 000 – 10 000-krát vyššia expresia vírusu než v iných tkanivách). V tejto súvislosti sa tiež študujú Sindibis vírus, reovírusy, parvovírusy a myxomavírusy [12]. Replikačno ‑ kompetentné vírusy môžu byť ďalej modifikované a exprimovať transgén tzv. armed oncolytic viruses. Príkladom je OncoVex, onkolytický herpes simplex vírus kódujúci stimulujúci faktor pre granulocyty/ makrofágy (GM‑CSF) [7]. Niektoré onkolytické vírusy (napr. onkolytické formy atenuovaného vírusu vakcínie, onkolytický herpes simplex vírus oHSV G47∆, adenovírus ONYX ‑ 015) sa využívajú aj v kombinácii s tradičnou rádioterapiou a chemoterapiou, kde bolo preukázané ich synergické pôsobenie [13–15].
Replikačno‑ deficientné vírusové vektory
Pri replikačno ‑ deficientných vírusových vektoroch sú gény zodpovedné za ich replikáciu odstránené, resp. vymenené za transgén, čo znamená, že sú schopné replikácie iba v špecializovaných pomocných bunkových líniách, ktoré tieto gény obsahujú. Medzi najviac využívané vírusové vektory patria replikačno ‑ deficientné adenovírusové vektory, retrovírusové vektory a adeno‑asociované vírusové vektory, závislé na adenovíruse alebo herpes simplex víruse, ktorý umožní dokončiť ich životný cyklus. Taktiež sa používajú vektory odvodené od HSV ‑ 1 a simian vírusu 40 (SV40) [8].
Replikačno ‑ deficientné adenovírusové vektory
Adenovírus je neobalený vírus ikosaédrového tvaru s priemerom 60 – 90 nm a lineárnou dvojvláknovou DNA o veľkosti 30 – 40 kb [16,17]. Pri transkripcii sa ako prvý exprimuje gén E1A kódujúci transaktivátor pre transkripciu skorých génov E1B, E2A, E2B, E3 a E4, rovnako spolu s E1B pôsobí pri bunkovej transformácii (obr. 1). Genómový región E2 kóduje proteíny potrebné pre DNA replikáciu: DNA polymerázu, DNA ‑ viažúci proteín a prekurzor terminálneho proteínu. Genómový región E3 kóduje produkty na moduláciu bunkových receptorov. Genómový región E4 má regulačnú funkciu, blokuje skorú a spúšťa neskorú transkripciu. Taktiež obsahuje gény, ktoré sú zodpovedné za aktivovanie imunomodulátorov. Jadrové a kapsidové proteíny a cysteínové proteázy potrebné na proteolytické zostrihnutie terminálneho proteínu ako aj ďalšie štruktúrne proteíny sú exprimované zo spoločného hlavného neskorého promótoru [18].
Obr. 1. Mapa genómu adenovírusu (sérotyp 5) a rôznych generácií adenovírusových vektorov. 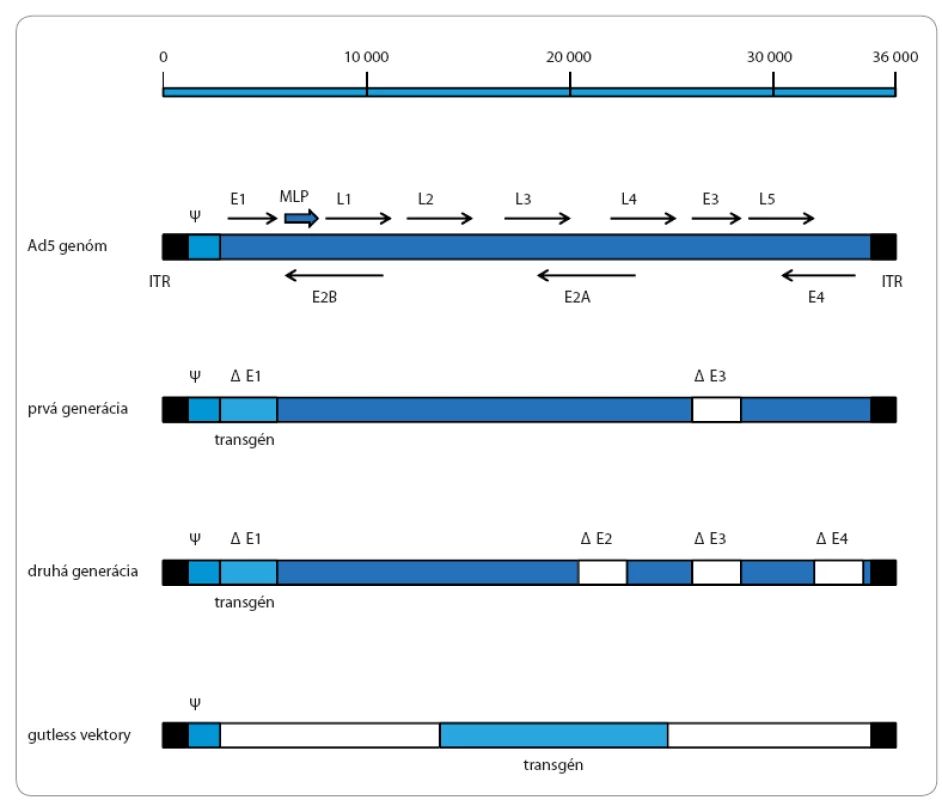
Skoré transkripty sú znázornené ako E1–E4 regióny a neskoré transkripty ako L1–L5 regióny. MLP – hlavný neskorý promótor, ψ – zbaľovací signál Prevzaté z [19]. Spomedzi viac než 50 rôznych sérotypov ľudských adenovírusov je pre génovú terapiu najviac využívaný sérotyp 5(Ad5). Pre človeka je málo patogénny, spôsobuje napr. mierne akútne respiračné infekcie. Aj napriek tomu majú Ad vektory dobrý bezpečnostný profil a môžu byť produkované vo veľkých množstvách, neintegrujú sa do bunkového genómu, majú vysokú transduktivitu in vivo a transdukujú deliace i nedeliace sa bunky [8,18]. V súvislosti s ich vývojom rozoznávame tri hlavné skupiny: tzv. adenovírusové vektory prvej a druhej generácie a „gutless“ vektory. Adenovírusové vektory prvej generácie sú založené na princípe delécie E1 a E3 regiónu. Keďže funkcia E1 regiónu je pre replikáciu vírusu nevyhnutná, musí byť zastúpená v bunkových líniách, napr. ľudských embryonálnych bunkách obličiek 293 (human embryonic kidney – HEK 293) alebo ľudských embryonálnych retinoblastov 911 (human embryonic retinoblasts – HER 911). Adenovírusové vektory druhej generácie obsahujú ďalšie delécie E2 a/ alebo E4 regiónu, čím znižujú alebo eliminujú expresiu vírusových proteínov, zlepšujú stálosť expresie transgénu a podľa niektorých štúdií znižujú imunitnú odpoveď organizmu [17]. Gutless vektory dokážu niesť až 36 kb DNA. Sú zbavené všetkých kódujúcich regiónov (okrem 5’ a 3’ ITRs a zbaľovacieho signálu Ψ) a na dokončenie svojho replikačného cyklu potrebujú pomocný adenovírus, ktorý nesie všetky kódujúce regióny. Preto sú nazývané aj helper ‑ dependent adenoviruses. Zbaľovací signál pomocného adenovírusu je odstránený (napr. pomocou Cre loxP systému), čím sa zabráni vytvoreniu pomocných adenovírusových častíc [19].
Adenovírusový vektor prvej generácie pJM17 bol vyvinutý Frankom Grahamom v roku 1988 [20]. Má veľkosť 40,3 kb a obsahuje celú Ad5 DNA molekulu a pBRX inzert nesúci ampicilínovú a tetracyklínovú rezistenciu. Transgén sa včleňuje do E1 regiónu. Rekombinantné virióny sa vytvárajú homológnou rekombináciou po kotransfekcii tohto plazmidu s pomocným plazmidom obsahujúcim E1 región v bunkách HEK 293 [20].
Veľkým prelomom v manipulácii Ad vektorov bol systém AdEasy1. Je založený na umelom bakteriálnom chromozóme (BAC), odvodený od Ad5 s deléciou E1 a E3 regiónov. Na včlenenie transgénu sa využíva homológna rekombinácia s pomocným plazmidom nesúcim transgén v baktériách E. coli. Veľkosť transgénu je do 10 kb, pričom je možné produkovať viacero transgénov z jedného vektora. Prítomnosť génu pre rezistenciu na antibiotikum kanamycín zabezpečuje ľahkú identifikáciu rekombinantov (BAC s transgénom). Rekombinantné BAC sú linearizované pridaním enzýmu PmeI a následne vnesené do adenovírusových pomocných buniek HER 911 alebo HEK 293, ktoré obsahujú E1 región umožňujúci replikáciu vírusu. Vektor môže obsahovať zelený fluorescenčný proteín (green fluorescent protein – GFP), čo dovoľuje priamu kontrolu efektivity infekcie [21].
Oveľa jednoduchší a modernejší je adenovírusový systém AdZ (Ad with zero clonning steps – adenovírusový vektor bez klonovacích krokov). Bol vyvinutý neskôr než AdEasy1 a v porovnaní s týmto systémom obsahuje viacero vylepšení. AdZ je vektor odvodený od Ad5 s deléciou E1 a E3 regiónov, vložený v umelom jednokópiovom BAC v baktériách E. coli (kmeň SW102), čo umožňuje priame vloženie transgénu (ako PCR fragment) do buniek E. coli, teda bez pomocného plazmidu. Rekombinácia prebieha na základe teplotne-kontrolovaného λ fágového systému. Tento systém obsahuje endonukleázu I‑ SceI, ktorá zabezpečuje jeho linearizáciu po transfekcii do pomocných buniek. Transgény môžu byť exprimované v natívnej forme alebo so streptavidínovým V5 alebo GFP tagom. AdZ obsahuje aj tetracyklínový operátor, vďaka ktorému je možné umlčať expresiu transgénu [22].
Imunitná odpoveď na adenovírusové vektory
Mechanizmy prirodzenej imunity odpovedajú na vírusovú infekciu ako prvé. Adenovírusový kapsid interaguje so zložkami klasickej, alternatívnej a lektínovej komplementovej dráhy, čo má za následok aktiváciu komplementu v prítomnosti už existujúcich anti‑adenovírusových protilátok (po prekonanej infekcii spôsobenej adenovírusom), ako aj bez nich. U Ad séropozitívnych pacientov, ktorí prijímajú vysoké dávky Ad vektora, tak vzniká riziko silnej komplementovej aktivácie, ktorá môže viesť až k život ohrozujúcej systémovej odpovedi [23].
V skorej odpovedi prirodzenej imunity na infekciu zohrávajú doležitú úlohu toll like receptory (TLR) prítomné na povrchu mnohých imunitných buniek, vrátane dendritických buniek a makrofágov. Tieto molekuly rozpoznávajú vysoko konzervované mikrobiálne štruktúry pathogen‑associated molecular patterns (PAMPs), ako napr. peptidoglykán a lipopolisacharid. Adenovírusovo ‑ asociované molekulárne motívy rozoznávajú receptory TLR2 a TLR9. Ich stimulácia iniciuje signálne dráhy MAPK a NF‑κ B vedúce k indukcii prozápalovej cytokínovej a chemokínovej odpovede. Medzi cytokíny a chemokíny exprimovené po podaní Ad vektorov patria interleukín (IL)-6, IL‑8, IL‑12, TNF‑α, interferón γ a λ, interferón inducibilný proteín 10, makrofágový zápalový proteín (MIP) 1β a MIP2 [24,25].
Infekcia buniek vírusmi, ale aj vírusovými vektormi spúšťa signálne dráhy indukujúce produkciu molekúl, ktoré aktivujú imunitný systém. Bunkové rozpoznávanie adenovírusu cez kapsidové komponenty je regulované pomocou týchto molekúl: coxackie-adenovirus receptor (CAR), membránový kofaktorový proteín (membrane cofactor protein) CD46, integríny a heparán sulfát – obsahujúce proteoglykány. Antivírusová vrodená imunitná odpoveď iniciovaná infikovanou bunkou aktivuje interferónovú odpoveď na zablokovanie vírusovej replikácie, pričom simultánne produkuje chemokíny na pritiahnutie neutrofilov a NK buniek [26].
Heterogénna populácia NK buniek je schopná rozoznať a usmrtiť predovšetkým nádorové a vírusmi infikované bunky. NK bunka na svojom povrchu exprimuje mozaiku inhibičných a aktivujúcich receptorov. Príkladom je receptor NKG2D, ktorý rozoznáva min. 7 ligandov (príbuzné polypeptidové sekvencie k MHC triedy I). Tieto ligandy môžu byť nadexprimované u buniek vystavených stresu, napr. infekcii (vírusová, bakteriálna), tepelnému šoku alebo poškodeniu DNA [27]. Po ich rozpoznaní NK bunka spúšťa deštrukciu cieľovej bunky pomocou proteínov ako perforíny a granzýmy, ktoré sú prítomné v granulách v jej cytoplazme. Obsah granúl sa vyleje do priestoru synapsie medzi NK bunkou a cieľovou bunkou. Perforíny vytvárajú póry v membráne cieľovej bunky a granzýmy prechádzajú do vnútra cieľovej bunky, kde indukciou kaspáz iniciujú apoptotický proces. Tento jav bol popísaný aj v prípade infekcie adenovírusovými vektormi AdEasy1, kde bolo zistené zvýšenie expresie MICA antigénov (ligand pre NKG2D, príbuzná polypeptidová sekvencia k MHC triedy I) [27]. V prípade génovej terapie, ktorej cieľom je expresia transgénu, môže byť takýto scenár nežiadúci. Na zamedzenie tohto procesu sú vo vývoji adenovírusové vektory s ďalšími modifikáciami, ktorých úlohou je predísť aktivácii signálnych dráh vedúcich k aktivácii imunitného systému. Jednou z možností modifikácií je manipulovanie regiónom E4 namiesto jeho úplnej delécie, ktorá spôsobuje ťažkosti pri príprave vektorov druhej generácie a gutless vektorov, a tým obmedzuje ich použitie v praxi. Naopak manipulácia E4 regiónom má znížiť aktiváciu imunitného systému, pričom vitalita vírusu zostáva zachovaná.
Adaptívna imunitná odpoveď na vírusovú infekciu je spojená s T a B bunkami imunitného systému. Adenovírusovo špecifické T cytotoxické bunky (CD8+, CTLs) rozoznávajú vírusový antigén v komplexe s molekulou MHC class I na povrchu infikovanej bunky, čo vedie k uvoľneniu perforínu a následnej lýze infikovanej bunky. CD4+ pomocné T bunky sú aktivované vírusovým antigénom v komplexe s molekulou MHC class II na povrchu antigén prezentujúcich buniek. Po aktivácii začnú produkovať cytokíny a stimulovať proliferáciu B buniek [28].
B bunky zabezpečujú humorálnu odpoveď, čo je jeden z kľúčových komponentov imunitnej odpovede. Produkcia protilátok závisí od schopnosti B buniek rozpoznať špecifický epitop na cudzom antigéne. V súvislosti s humorálnou imunitnou odpoveďou je potrebné spomenúť, že ľudská populácia je vystavená adenovírusom a adeno‑asociovaným vírusom a väčšina ľudí má k týmto vírusom protilátky. Ich prítomnosť môže negatívne ovplyvniť úspešnosť génovej terapie založenej na adenovírusoch a adeno‑asociovaných vírusoch. Jedným zo spôsobov, ako sa vyhnúť už prítomným anti‑adenovírusovým protilátkam, je využitie alternatívnych sérotypov vírusu (namiesto sérotypu 5), ako napr. adenovírus 2 a 7. Taktiež sa vyvíjajú vektorové systémy s využitím zvieracích (psích, prasacích, šimpanzích) adenovírusov [29,30]. Tieto prístupy tiež riešia problém s pamäťovými B bunkami, u ktorých sa produkcia anti‑adenovírusových protilátok nedá zablokovať.
Adenovírusové vektory v klinických štúdiách
V roku 1993 podstúpil génovú terapiu pomocou Ad vektora prvý pacient. Odvtedy do roku 2012 bolo uskutočnených dokopy 438 klinických štúdií, v ktorých sa použili rôzne typy adenovírusových vektorov a 92 klinických štúdií, pri ktorých boli využité adeno‑asociované vektory [10,18].
Adenovírusové vektory môžu byť aplikované systémovo alebo lokálne v závislosti od účelu terapie. Podávané sú intravenózne, subkutánne alebo intradermálne, intramusklárne a tiež respiračnou cestou [31]. Pri klinických štúdiách je táto terapia celkovo dobre tolerovaná, medzi vedľajšie účinky použitia Ad vektorov patria mierna horúčka, lokálna bolesť, triaška a zimnica [32]. Avšak v roku 1999 18 - ročný pacient s čiastočnou deficienciou ornitíntranskerbamylázy (OTC) zomrel po podaní veľmi vysokej dávky (3,8 × 1013 častíc) Ad vektora druhej generácie, ktorý niesol funkčný OTC gén. Príčinou jeho smrti bola Ad vektorom indukovaná prirodzená imunita, ktorá spôsobila akútne uvoľnenie zápalových mediátorov, čo viedlo k systémovému zápalu a multiorgánovému zlyhaniu [33]. Táto udalosť mala za následok reevaluáciu protokolov a sprísnenie podmienok na používanie Ad vektorov.
Podľa U.S. National Institutes of Health [34] je k 1. 3. 2015 v I. fáze klinických testov ukončených 49 štúdií s použitím adenovírusových vektorov, z ktorých 14 je zameraných na liečbu nádorových ochorení. V II. fáze je ukončených 18 štúdií, z ktorých deväť sa zaoberá liečbou rakovinových ochorení. V III. fáze je ukončená jedna štúdia zaoberajúca sa exprimovaním TNF‑α, ktorý je pod kontrolou chemoradiačne inducibilného promótora, v tkanivách vystavených radiácii pri rakovine pankreasu [5]. Novozačínajúcich štúdií (so statusom prijímajúci/ ešte neprijímajúci dobrovoľníkov) I. fázy je 19, z čoho v šiestich prípadoch sa jedná o génovú terapiu určenú na liečbu nádorových ochorení, novozačínajúcich štúdií II. fázy je deväť, pričom v piatich prípadoch ide o protinádorovú terapiu a v III. fáze je jedna novozačínajúca štúdia zameraná na liečbu nádorového ochorenia. Okrem využitia adenovírusových vektorov na liečbu nádorových ochorení sú vo vývoji a klinických skúškach aj adenovírusové vakcíny proti rôznym infekčným ochoreniam (HIV, ebola, malária, chrípka, tuberkulóza a i.) [34].
Záver
Génová terapia ponúka množstvo možností na liečbu nádorových ochorení. Využitie vírusových ako aj nevírusových systémov je efektívny spôsob na vnesenie genetického materiálu do buniek. Ďalšie štúdium vplyvov génovej terapie na organizmus a imunitný systém, najmä v prípade vírusových vektorov, nám dáva priestor na optimalizovanie jej účinkov a na ďalšie vylepšenia, vďaka ktorým by mohla byť rutinne používaná v klinickej praxi. V tejto súvislosti je nutné študovať vplyv vektorov na vnútrobunkové mechanizmy a následne zabezpečiť ich úpravu tak, aby sa minimalizovala imunitná odpoveď organizmu. U adenovírusových vektorov sa zdá byť sľubným postupom manipulácia regiónom E4, ktorý hrá dôležitú úlohu pri aktivácii imunomodulátorov. Ideálnym výsledkom tejto manipulácie by mal byť vektor, ktorý pri použití vyvoláva minimálnu imunitnú odpoveď organizmu a mohol by byť bežne používaný in vivo.
Práca bola podporená Európskym fondom pre regionálny rozvoj a štátnym rozpočtom Českej republiky (OP VaVpI – RECAMO CZ.1.05/2.1.00/03.0101), projektom MŠMT – NPU I – LO1413 a MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Mariana Pjechová
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: mariana.pjechova@mou.cz
Obdržané: 2. 4. 2015
Prijaté: 20. 7. 2015
Zdroje
1. Friedmann T, Roblin R. Gene therapy for human genetic disease? Science 1972; 175(4025): 949 – 955.
2. Sheridan C. Gene therapy finds its niche. Nat Biotechnol 2011; 29(2): 121 – 128. doi: 10.1038/ nbt.1769.
3. Kwiatkowska A, Nandhu MS, Behera P et al. Strategies in gene therapy for glioblastoma. Cancers 2013; 5(4): 1271 – 1305. doi: 10.3390/ cancers5041271.
4. Zhao F, Tian J, An L et al. Prognostic utility of gene therapy with herpes simplex virus thymidine kinase for patients with high‑grade malignant gliomas: a systematic review and meta analysis. J Neurooncol 2014; 118(2): 239 – 246. doi: 10.1007/ s11060 ‑ 014 ‑ 1444 ‑ z.
5. Herman JM, Wild AT, Wang H et al. Randomized phase III multi‑institutional study of TNFerade biologic with fluorouracil and radiotherapy for locally advanced pancreatic cancer: final results. J Clin Oncol 2013; 31(7): 886 – 894. doi: 10.1200/ JCO.2012.44.7516.
6. Li Y, Li LJ, Wang LJ et al. Selective intra ‑ arterial infusion of rAd ‑ p53 with chemotherapy for advanced oral cancer: a randomized clinical trial. BMC Med 2014; 12 : 16. doi: 10.1186/ 1741 ‑ 7015 ‑ 12 ‑ 16.
7. Senzer NN, Kaufman HL, Amatruda T et al. Phase II clinical trial of a granulocyte ‑ macrophage colony ‑ stimulating factor‑encoding, second ‑ generation oncolytic herpesvirus in pacients with unresectable metastatic melanoma. J Clin Oncol 2009; 27(34): 5763 – 5771. doi: 10.1200/ JCO.2009.24.3675.
8. Fillat C, Jose A, Bofill ‑ De Ros X et al. Pancreatic cancer gene therapy: from molecular targets to delivery systems. Cancers 2011; 3(1): 368 – 395. doi: 10.3390/ cancers3010368.
9. Leja J, Nilsson B, Yu D et al. Double‑detargeted oncolytic adenovirus shows replication arrest in liver cells and retains neuroendocrine cell killing ability. PLoS One 2010; 5(1): e8916. doi: 10.1371/ journal.pone.0008916.
10. Ginn SL, Alexander IE, Edelstein ML et al. Gene therapy clinical trials worldwide to 2012 – an update. J Gene Med 2013; 15(2): 65 – 77. doi: 10.1002/ jgm.2698.
11. Russell SJ, Peng KW, Bell J. Oncolytic virotherapy. Nat Biotechnol 2014; 30(7): 658 – 670. doi: 10.1038/ nbt.2287.
12. McCart JA, Ward JM, Lee J et al. Systemic cancer therapy with a tumor ‑ selective vaccinia virus mutant lacking thymidine kinase and vaccinia growth factor genes. Cancer Res 2001; 61(24): 8751 – 8757.
13. Khuri FR, Nemunaitis J, Ganly I et al. A controlled trial of intratumoral ONYX ‑ 015, a selectively ‑ replicating adenovirus, in combination with cisplatin and 5 - fluorouracil in patients with recurrent head and neck cancer. Nat Med 2000; 6(8): 879 – 885.
14. Mansfield D, Pencavel T, Kyula JN et al. Oncolytic Vaccinia virus and radiotherapy in head and neck cancer. Oral Oncol 2013; 49(2): 108 – 118. doi: 10.1016/ j.oraloncology.2012.07.019.
15. Kanai R, Rabkin SD, Yip S et al. Oncolytic virus ‑ mediated manipulation of DNA damage responses: synergy with chemotherapy in killing glioblastoma stem cells. J Natl Cancer Inst 2012; 104(1): 42 – 55. doi: 10.1093/ jnci/ djr509.
16. Doerfler W, Boehm P (eds). The molecular repertoire of adenoviruses. Berlin: Springer 1995.
17. Stewart PL. Adenovirus structure. In: Curiel DT, Douglas JT (eds). Adenoviral vectors for gene therapy. San Diego: Academic Press 2002 : 1 – 18.
18. Volpers C, Kochanek S. Adenoviral vectors for gene transfer and therapy. J Gene Med 2004; 6 (Suppl 1): S164 – S171.
19. Alba R, Bosch A, Chillon M. Gutless adenovirus: last ‑ generation adenovirus for gene therapy. Gene Ther 2005; 12 (Suppl 1): S18 – S27.
20. McGrory WJ, Bautista DS, Graham FL. A simple technique for the rescue of early region I mutations into infectious human adenovirus type 5. Virology 1988; 163(2): 614 – 617.
21. He T, Zhou S, da Costa LT et al. A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci U S A 1998; 95(5): 2509 – 2514.
22. Stanton RJ, McSharry BP, Armstrong M et al. Re ‑ engeneering adenovirus vector systems to enable high‑throughput analzses of gene fiction. Biotechniques 2008; 45(6): 659 – 668.
23. Jiang H, Wang Z, Serra D et al. Recombinant adenovirus vectors activate the alternative complement pathway, leading to the binding of human complement protein C3 independent of anti‑ad antibodies. Mol Ther 2004; 10(6): 1140 – 1142.
24. Appledorn DM, McBridge A, Seregin S et al. Complex interaction withseveral arms of the complement system dictate innate and humoral imunity to adenoviral vectors. Gene Ther 2008; 15(24): 1606 – 1617. doi: 10.1038/ gt.2008.114.
25. Cerullo V, Seiler MP, Mane V et al. Toll‑like receptor 9 triggers an innate immune response to helper‑dependent adenoviral vectros. Mol Ther 2007; 15(2): 378 – 385.
26. Chen RF, Lee CY. Adenoviruses types, cell receptors and local innate cytokines in adenovirus infection. INt Rev Immunol 2014; 33(1): 45 – 53. doi: 10.3109/ 08830 185.2013.823420.
27. Tomasec P, Wang EC, Groh V et al. Adenovirus vector delivary stimuletes natural killer cell recognition. J Gen Virol 2007; 88(4): 1103 – 1108.
28. Russell WC. Update on adenovirus and its vectors. J Gen Virol 2000; 81(11): 2573 – 2604.
29. Farina SF, Gao GP, Xiang ZQ et al. Replication ‑ defective vector based on a chimpanzee adenovirus. J Virol 2001; 75(23): 11603 – 11613.
30. Kremer EJ, Boutin S, Chillon M et al. Canine adenovirus vectors: an alternative for adenovirus ‑ mediated gene transfer. J Virol 2000; 74(1): 505 – 512.
31. Ahi YS, Bangari DS, Mittal SK. Adenoviral vector imunity: its implications and circumvention strategies. Curr Gene Ther 2011; 11(4): 307 – 320.
32. Vorburger SA, Hunt KK. Adenoviral gene teraphy. Oncologist 2002; 7(1): 46 – 59.
33. Raper SE, Yudkoff M, Chirmule N et al. A pilot study of in vivo liver ‑ directed gene transfer with an adenoviral vector in partial orthonine transcarbamylase deficiency. Hum Gene Ther 2002; 13(1): 163 – 175.
34. Clinicaltrials.gov [homepage on the Internet]. U.S. National Institutes of Health, USA; [updated 2014 May, cited 2015 March 1]. Available from: https:/ / clinicaltrials.gov/ ct2/ results?term=adenoviral+vector&recr=Open&no_unk=Y&phase=0.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2015 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Analýza změn fosfoproteomu nádorové buněčné linie MDA‑ MB‑ 468 v odpovědi na expresi izoforem p63 pomocí hmotnostní spektrometrie
- „Cukry zasahují“ aneb glykomika na poli nádorových biomarkerů
- Nrf2 – dve tváre regulátora antioxidačného systému
- Editorial
- Polo‑like kináza 1 jako cíl protinádorové terapie
- PDLIM2 a jeho role v onkogenezi – tumor supresor nebo onkoprotein?
- Profil aktivace receptorových tyrozinkináz a mitogenem aktivovaných proteinkináz v terapii Maffucciho syndromu
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
- Imunologické aspekty v onkologii – cirkulující γδ T lymfocyty
- Cirkulující nádorová DNA v krvi a její využití jako potenciálního biomarkeru nádorových onemocnění
- Adenovírusové vektory v génovej terapii
- Nádory u adolescentů
- Bioinformatika a sekvenování nové generace
- IntegRECAMO: úspěšná realizace projektu OP VK
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Adenovírusové vektory v génovej terapii
- Nrf2 – dve tváre regulátora antioxidačného systému
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



