-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nádory u adolescentů
Cancer in Adolescents
Cancer in adolescents (15 to 19 years) appears to be a serious medical, psychologic, ethical and economical problem as well. This group of patients has been languishing in the shadow of pediatric oncology and out of interest of adult oncology. Spectrum of types of tumors and their biologal characteristics are age‑ specific and different from all other age groups. The overall incidence of cancer in adolescents is continuously increasing. Treatment results and outcome of adolescent cancer are worse compared with outcome in children with cancer younger than 15 years.
Key words:
adolescents – cancer – age‑specific differences – diagnostic challenges – therapeutic options
This study was supported by the European Regional Development Fund and the State Budget of the Czech Republic – RECAMO, CZ.1.05./2.1.00/03.0101 and by the project MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, orservices used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
17. 5. 2015Accepted:
22. 7. 2015
Autoři: V. Bajčiová; Z. Onderčová; D. Kodýtková
Působiště autorů: Klinika dětské onkologie LF MU a FN Brno
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 2): 81-90
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko20152S81Souhrn
Zhoubné nádory u adolescentů (15– 19 let) představují v současnosti závažný medicínský, psychologický, etický a ekonomický problém. Skupina pacientů ve věku dospívání byla dlouho na pokraji zájmu dětské onkologie a téměř zcela mimo zájem onkologie dospělého věku. Spektrum nádorů a jejich biologické vlastnosti i klinické chování jsou věkově specifické a odlišné od nádorů jiných věkových skupin. Incidence malignit v období adolescence má trvale stoupající trend. Výsledky léčby nádorů u adolescentů jsou horší než výsledky léčby u dětí mladších 15 let.
Klíčová slova:
adolescenti – nádory – věkově specifické rozdíly – diagnostické problémy – léčebné možnostiÚvod
I když dle demografických údajů populace v ČR stárne, je počet dospívajících ve věku 15– 19 let v ČR kolem 670 000, tedy asi 7 % z celkové populace. Víc než v minulosti je u dnešní generace adolescentů vyhrocen střet a nepoměr mezi biologickou zralostí a zralostí psychickou a sociální, což přináší řadu rizik a problémů moderního světa – antisociální chování mladých lidí (abúzus alkoholu, kouření, drogy, gemblerství, sexuální promiskuitu). Alarmujícím tempem stoupá u mladých lidí počet sebevražd.
Kromě těchto problémů jsou dospívající ohroženi celou řadou závažných onemocnění. Více než 12 % adolescentní populace žije s chronickým onemocněním. Do skupiny chronických nemocných se dnes řadí i pacienti s nádorovým onemocněním.
Charakteristika a specifika období dospívání
Období dospívání je období přechodu z věku dětského do věku dospělého, které není jednoznačně ohraničeno. Začátek dospívání je biologicky a medicínsky dán začátkem pohlavního zrání (objevení se sekundárních pohlavních znaků). Období pohlavního dozrávání (puberta) začíná v našich zeměpisných šířkách u dívek mezi 11. a 12. rokem, u chlapců mezi 13. a 14. rokem. Konec dospívání je v ČR určen legislativně dosažením 18. roku života. V medicíně pod pojmem adolescentní věk rozumíme věk 12– 15 let (mladší adolescentní věk) a 15– 19 let (starší adolescentní věk) [1,2].
V onkologii rozlišujeme onkologii dětského věku (tedy od narození do 15 let věku) a onkologii dospělého věku, tedy od 18 let výše. Je více jak zřejmé, že období dospívání mezi 15. a 18. (19.) rokem věku je někde „ztracené“ mezi dětmi a dospělými. Pod pojmem nádory adolescentů hodnotíme nádory u onkologických pacientů ve věku 15– 19 let [2,3].
Období dospívání je velmi složité vývojové období charakterizované nejen změnami tělesnými, ale i metabolickými, psychickými a emočními se snahou o osamostatnění. Pro adolescenta je velmi významný fakt autonomie a nezávislosti s typickým nerespektováním autorit, řádů a norem. O to větší šok znamená v tomto citlivém období diagnóza maligního onemocnění. Psychosociální stránka péče o adolescenta (izolace od přátel a rodiny, změny tělesného vzhledu, uvědomění si akutního ohrožení života a strach ze smrti) je stejně důležitá jako samotná protinádorová léčba. Psychický stav pacienta výrazně ovlivňuje průběh a celkovou toleranci léčby. Fyziologické tělesné změny v průběhu puberty (změny metabolizmu v době pubertálního růstu, hormonální aktivita, růstová aktivita, změny body mass indexu, změny objemové distribuce tukové tkáně) mohou ovlivnit efekt a toxicitu onkologické léčby (změny farmakokinetiky a biofarmakologické tolerance) [1,2,4– 6].
Epidemiologie nádorů u dospívajících
V Evropě jsou údaje o incidenci nádorů u dětí do 15 let věku a rozdíly v incidenci dle jednotlivých regionů a států dobře dokumentovány. Ve srovnání s tím je podstatně méně informací o incidenci nádorů a celkové přežití (overall survival – OS) u adolescentů a mladých dospělých. V celé Evropě ze všech invazivních zhoubných nádorů v populaci méně než 0,3 % vyrůstá u dospívajících ve věku 15– 19 let.
Výskyt nádorových nemocí u adolescentů má neustále stoupající trend, který v posledních letech předstihl incidenci nádorů v dětské populaci. Incidence maligních onemocnění u dospívajících je dvakrát vyšší než u 5– 9letých dětí a až o 2/ 3 vyšší než u 10– 14letých dětí. S postupujícím věkem se incidence nádorů zvyšuje. Celkový vzestup meziroční incidence zhoubných nádorů je kolem 1 % za rok, s výjimkou maligního melanomu a nádorů varlat u dospívajících, u kterých je meziroční vzestup incidence kolem 2– 3,5 % za rok.
Věkově specifická incidence je založena na faktu, že incidence nádorů roste exponenciálně s věkem. Adolescenti mají vyšší riziko rozvoje nádoru než děti do 15 let na základě předpokladu delší karcinogenní expozice faktorů zevního prostředí, stárnutí buněk a s tím spojených nitrobuněčných a genetických změn. Faktory zevního prostředí hrají pouze částečnou roli v etiologii a patogenezi nádorů u adolescentů, protože u dospívajících převažují nádory tzv. dětského typu.
Incidence nádorů u dospívajících ve věku 15– 19 let v ČR se pohybuje kolem 15/ 100 000/ rok. Celkem tedy v ČR onemocní maligním nádorem ročně kolem 350– 400 mladých lidí ve věku 15– 20 let [1– 9].
Dalším důležitým demografickým ukazatelem je rozbor příčin úmrtí u dospívajících. Nádory jsou v této věkové skupině na čtvrtém místě hned za úrazy, sebevraždami a vraždami a jsou tedy nejčastějším onemocněním vedoucím k smrti u adolescentů [10]. OS adolescentů s maligním onemocněním v ČR je srovnatelné s OS v jiných státech Evropy [9].
Specifika nádorů u dospívajících
Spektrum nádorů u dospívajících a jejich biologické vlastnosti jsou věkově specifické a významně se liší od spektra nádorů dětí mladších 15 let nebo od nádorů dospělé a starší populace. Epiteliální nádory (karcinomy), typické pro onkologii dospělých a starší věk, tvoří méně než 12 % ze všech nádorů u adolescentů (graf 1, 2). Etiopatogeneze karcinomů u dospívajících a spektrum patogenetických změn se s věkem mění [2,4,5,7,11].
Graf 1. Relativní frekvence (%) 12 diagnostických skupin dle ICCC (International Classification of Childhood Cancer) u dětí a adolescentů v Evropě. 
Zdroj: [26]. Graf 2. Distribuce typů nádorů dle věku v USA [10]. ![Distribuce typů nádorů dle věku v USA [10].](https://pl-master.mdcdn.cz/media/image/6ae0f452d061ef8ac2902d0a92c2f195.png?version=1537794450)
Nádory embryonálního původu typické pro dětský věk (neuroblastom, nefroblastom, hepatoblastom, retinoblastom atd.) jsou u adolescentů spíše raritní, a pokud se vyskytnou, mají výrazně agresivnější klinické chování a špatnou prognózu.
U dospívajících převažují maligní lymfomy (především Hodgkinův lymfom) s převahou u dívek, nádory varlat u chlapců a germinální nádory ovarií u dívek. Vrchol výskytu je u sarkomů kostí (osteosarkom, Ewingův sarkom), časté jsou rovněž sarkomy měkkých tkání (s převahou rabdomyosarkomu) a nádory CNS. V posledních letech velmi prudce stoupá výskyt maligního melanomu (především kožní formy) s převahou u dívek (graf 3). Z karcinomů je nejčastější karcinom štítné žlázy u dospívajících dívek. Karcinomy plic ve srovnání s dospělou populací jsou u dospívajících extrémně raritní. Na etiologii kolorektálního karcinomu u dospívajících se ve vyšší míře podílejí predispoziční hereditární syndromy spíše než dietetické návyky.
Graf 3. Incidence zhoubných nádorů u dospívajících (15–19 let) v období 2000–2010 v ČR. 
Srovnání klinických, epidemiologických, molekulárních a léčebných závěrů jasně prokazují rozdíly u nejčastějších zhoubných nádorů u adolescentů. Klinické výzkumy docházejí k závěru, že biologie nádorů u adolescentů je rozdílná ve srovnání s jinými věkovými skupinami, i když se dle histopatologie jedná o stejný typ nádoru. Rozdílné věkově specifické cytogenetické a molekulárně genetické studie dávají prostor k úvahám o rozdílné patogenezi, která se liší podle věku nositele. Jestli přijmeme hypotézu, že biologie maligních nádorů u adolescentů se liší dle věku pacienta, pak se zřejmě bude lišit i optimální léčebná strategie, speciálně v současnosti při rozvoji cílené biologické léčby [2,6,8,11,12].
Kromě biologie nádoru hraje svou roli i věkově specifická biologie hostitele. Dospívající jedinci jsou obvykle zdraví, na rozdíl od starší populace netrpí téměř žádnými komorbiditami. Důležité jsou rovněž fyziologické změny organizmu v rámci puberty. Růstový spurt, vliv pohlavních hormonů, zrychlený metabolizmus mohou měnit farmakokinetiku (jaterní a renální funkce, clearence cytostatik) a biofarmakologickou toleranci, a tedy mohou mít vliv na efekt a toxicitu aplikované protinádorové léčby. Všeobecně lze říct, že dospívající tolerují onkologickou léčbu hůř než děti, ale lépe než starší pacienti. Ve srovnání s dětmi trpí adolescenti častěji periferní polyneuropatií, intolerancí glukózy u kortikoidů, mají vyšší riziko vzniku osteonekrózy. Ve srovnání s dospělými a staršími pacienty mají dospívající nižší orgánovou toxicitu, farmakokinetické procesy jsou efektivnější. Léčebné strategie, které by byly cíleny na věkově specifickou skupinu se specifickými biologickými charakteristikami nádoru a hostitele, by v budoucnu mohly výrazně zlepšit výsledky a prognózu dospívajících s maligním nádorem [2,4,11,13].
Aktuální specifické problémy v onkologii dospívajících
V současnosti se v onkologii dospívajících setkáváme především se čtyřmi hlavními a palčivými problémy.
1. Problém pozdní diagnózy a oddálení léčby nádorů u adolescentů
Velké procento dospívajících má lokálně pokročilou nebo metastatickou nemoc v čase diagnózy. Iniciální rozsah nádoru patří mezi nejdůležitější faktory ovlivňující prognózu, a pozdní diagnóza se tak výraznou mírou podílí na horším OS u adolescentů (obr. 1). Příčin pozdní diagnózy nádorů u dospívajících je několik, a to na všech úrovních – od pacienta samotného přes rodinu a rodiče až po lékaře [2,14,15].
Obr. 1. Délka OS a PFS u Ewingova sarkomu dle rozsahu nemoci. 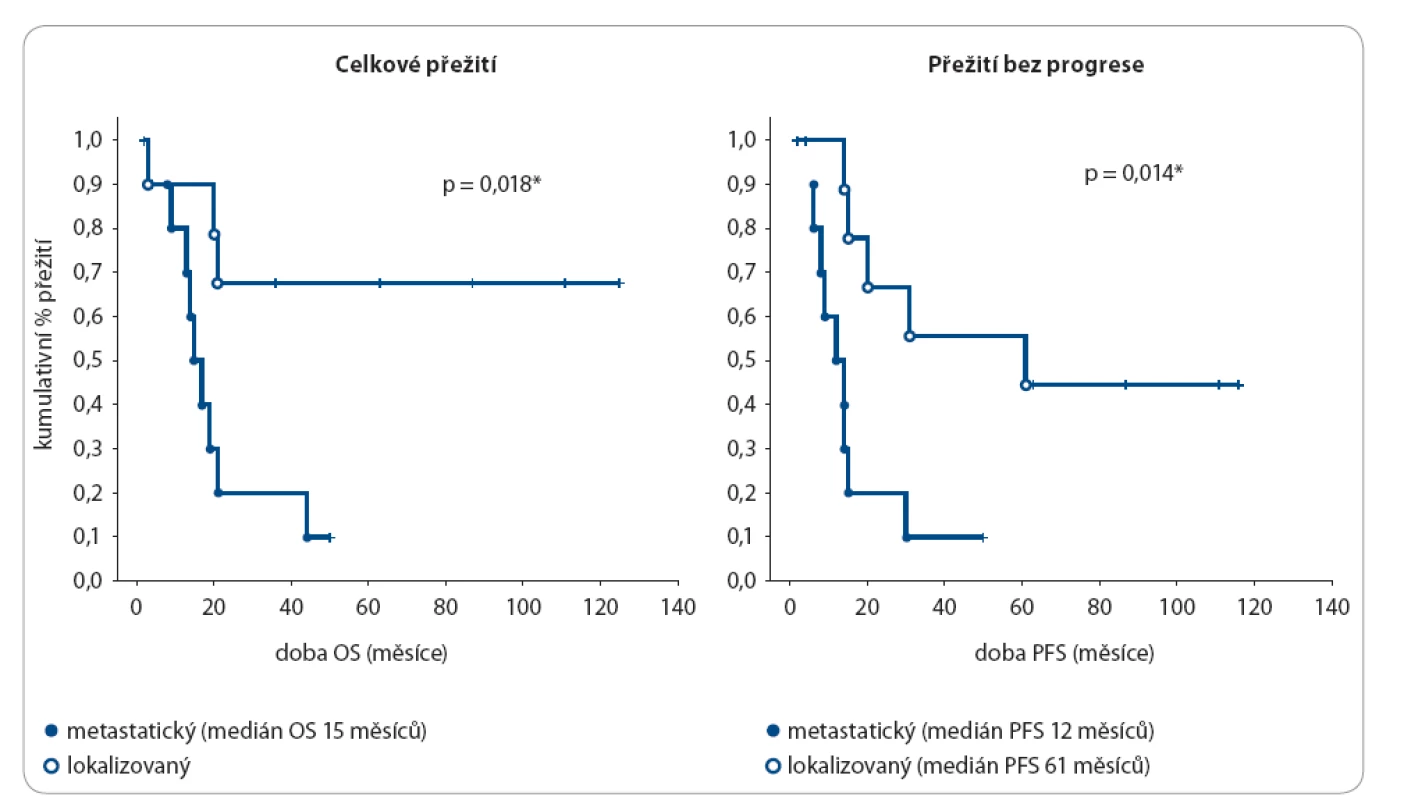
Zdroj: Klinika dětské onkologie, FN Brno. OS – celkové přežití, PFS – přežití bez progrese Ze strany pacienta hraje roli právě věk – období psychického dozrávání a formování osobnosti. Protože nádor jako takový obvykle nebolí, nevěnuje dospívající iniciálním příznakům obvykle pozornost, navíc mladý organizmus dokáže kompenzovat poměrně dlouho nárůst nádoru (např. útlak plic nádorovou masou bez dyspnoe či tachypnoe). Adolescenti většinou ani netuší, že by ve svém věku mohli onemocnět zhoubným nádorem [2,15].
Rodina a především rodiče se obvykle zaměřují zvláště na sociální stránku a problémy dospívajícího (škola a prospěch, další vzdělávání a pracovní uplatnění, kamarádi atd.). Často bagatelizují iniciální zdravotní problémy a stížnosti adolescenta, protože již vyrostl z dětského věku, kdy se báli o jeho zdraví a každou „bolístku“ řešili návštěvou lékaře („děti již vyrostly, jsou mladí, nemohou být tedy vážně nemocní…“). Je to dáno i faktem, že příznaky způsobené nádorem u mladých lidí jsou většinou nespecifické a dětské typy nádorů obvykle nemají příznaky, které jsou v povědomí populace spjaty s rozvojem nádoru [2,14,15].
Ze strany poskytovatelů zdravotní péče (lékařů primárního kontaktu, ale i kolegů z různých oddělení či klinik všeobecných nemocnic) rovněž dochází k mnoha omylům. Stále se bohužel i dnes setkáváme s mladými lidmi, u kterých byly iniciální příznaky nádoru i několik měsíců podceňovány nebo byly hodnoceny nesprávně, často se na možnost nádoru jako vyvolávající příčiny vůbec nemyslelo (obr. 2). Tento fakt může být dán vzácným výskytem nádorů u mladých lidí. Ovšem v populaci počet preventivních prohlídek s věkem klesá, a co je možná horší, mnohdy proběhnou pouze formálně. I mezi zdravotníky se setkáváme s názorem, že mladý člověk nemůže být vážně nemocen a je automaticky zdravý z titulu svého mládí [14– 18].
Obr. 2. Synoviální sarkom stehna diseminovaný (délka anamnézy osm měsíců). 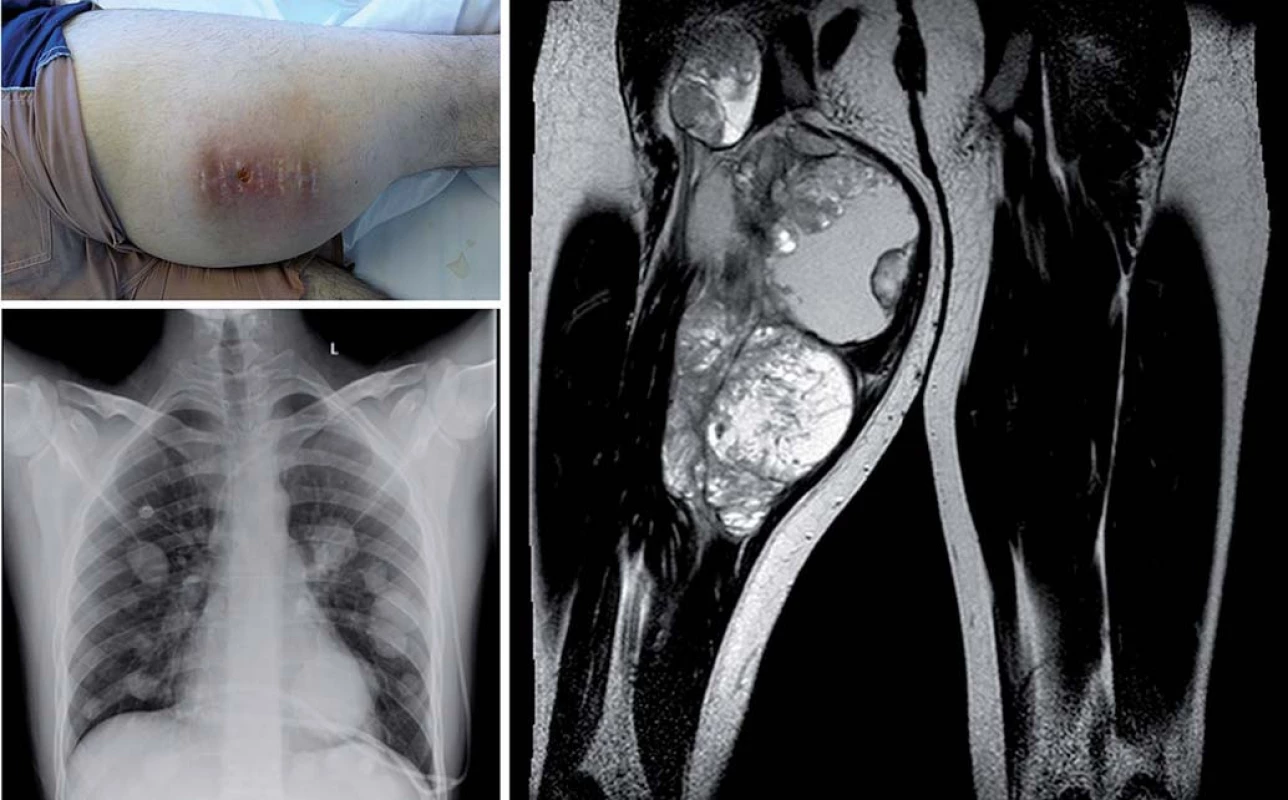
Zdroj: Klinika dětské onkologie, FN Brno. 2. Místo léčby dospívajících s malignitou
V ČR všeobecně péči o dospívající pacienty do dovršení 18 [19] roku věku zabezpečuje lékař primárního kontaktu – pediatr. Situace se v jednotlivých krajinách Evropy liší [12]. V současnosti není v ČR vytvořeno věkově specifické centrum pro léčbu nádorů u dospívajících. Dospívající pacient se může dostat na pracoviště dospělé onkologie nebo na pracoviště dětské onkologie. Většina dospívajících je léčena na pracovištích dětské onkologie, ale v současném systému zdravotní péče existuje riziko, že se dle typu nádoru (např. plicní nádory či ložiska, gynekologické nádory, sarkomy) může adolescent ocitnout sice na specializovaném pracovišti, které ale nemá dostatek zkušeností ani znalostí o specifických problémech juvenilních typů nádorů. Není zaveden jednotný systém reference dospívajícího onkologického pacienta. Centralizace v onkologických věkově specifických centrech se tak stává pro pacienta životně důležitou v čase, kdy histologický nález a klinické stadium již zdaleka nestačí k přesnému určení diagnózy, určení individuální míry rizika a tím adekvátní léčby a prognózy. Diagnostika a léčba juvenilních typů nádorů je velmi složitá a vyžaduje dlouholetou zkušenost a úzkou spolupráci specializovaného týmu odborníků [2,4,5,7,8,11,18].
Kromě často rozdílné strategie léčebného přístupu u dospělé a dětské onkologie je důležitý především faktor zkušeností s léčbou agresivních juvenilních typů nádoru. Pokud onkolog pro dospělé používá stejnou dávkovou intenzitu a modifikace léčby u dospívajících jako u starší generace pacientů, je více než pravděpodobné, že adolescent bude vzhledem k agresivnímu typu nádoru a vysoké míře biofarmakologické tolerance relativně podléčen a jeho nádor nebude zvládnut a léčen úspěšně [13].
Ideální postup je společná péče dětského onkologa i onkologa dospělého věku o dospívajícího pacienta s maligním nádorem, která bude reflektovat typ nádoru, jeho biologické a cytogenetické charakteristiky, klinické chování a stejně tak i věkově specifickou biologii pacienta. Ve Velké Británii, kde se nejdéle věnují problematice dospívajících onkologických pacientů, je v rámci National Health Services Trust nemocnic vytvořeno 28 specializovaných jednotek pro adolescenty.
3. Možnosti prevence a časné diagnostiky nádorů u dospívajících – osvěta
Možnosti, způsoby a formy prevence nádorů u dospívajících se zásadně neliší od prevence v jiných věkových skupinách. Platí především dodržování zásad zdravého životního stylu. U dospívajících je tento bod o to důležitější, že právě v období dospívání se fixují životní návyky a životní styl.
Primární prevence je u adolescentů obtížně definovatelná. Aktivní vyhledávání, tj. screening nádorů, se rutinně neprovádí z několika důvodů – nádory u dospívajících patří mezi vzácná onemocnění, chybí specifické indikátory nádorové nemoci, etiologie není známa (resp. je multifaktoriální souhrou genetických faktorů a vlivů vnějšího prostředí) a tedy nelze definovat rizikovou skupinu mladých lidí [4].
I tu však existuje výjimka, a to u dospívajících s genetickými k nádorům predisponujícími syndromy (např. Li‑ Fraumeni syndrom, syndrom familiární adenomatózní polypózy, neurofibromatóza typu I a II, Gardnerův syndrom, Lynchův syndrom, tuberózní skleróza atd.). Genetických predispozičních nádorových syndromů je popsáno v literatuře kolem 200. Pacienti do 19 let věku, u kterých byl nádorový predispoziční syndrom prokázán genetickým vyšetřením nebo mají vysokou pravděpodobnost jeho výskytu vzhledem k rodinné anamnéze, by měli být dispenzarizováni a pravidelně sledováni na odborném pracovišti dětské onkologie [19,20].
U dospívajících dívek je možností prevence rozvoje karcinomu děložního čípku v pozdějším věku očkování vakcínou proti HPV, a to před zahájením aktivního pohlavního života (vakcína hrazena do věku 14 let).
Časná diagnostika a zkrácení doby od prvních příznaků ke stanovení diagnózy a zahájení efektivní onkologické léčby je pro adolescenty klíčová a tady hraje významnou roli informovanost a osvěta – nejenom adolescentů, ale i jejich rodičů. Znalost možných rizikových a predispozičních faktorů, zdravotní osvěta a výchova mladé generace k odpovědnému přístupu k vlastnímu zdraví je nezbytnou součástí prevence nádorových onemocnění v mladém věku. V přípravě je webová stránka www.fighttogether.cz zaměřená na bližší informace o maligních nádorech u adolescentů a mladých dospělých včetně anonymní poradny, která by měla začít fungovat v průběhu roku 2015.
Poučení o samovyšetření prsu u mladých dívek a samovyšetření varlat u chlapců a mladých mužů lze nalézt na stránkách: www.prevencenadoru.cz, www.maskoule.cz, www.hlidackouli.cz.
V sekundární prevenci a časném záchytu nádorů u dospívajících hraje mimořádně důležitou roli lékař primárního kontaktu a systém pečlivě prováděných preventivních prohlídek. Doškolování lékařů primárního kontaktu v oblasti onkologie nejen dospělých, ale i dětí a dospívajících, je nutností [16–18]. Lékaři i laici najdou informace na www.linkos.cz, na nichž funguje i bezplatná poradna stran prevence a časné diagnostiky nádorů, dále www.mojemedicina.cz, na webových stránkách Kliniky dětské onkologie FN Brno a Kliniky dětské onkologie a hematologie FN v Motole, Praha. Ze zahraničních stránek jsou všeobecné užitečné informace pro pacienty na www.cancer.gov (adolescents and young adults).
Již po několikáté probíhá doškolovací vzdělávací akce pro lékaře primárního kontaktu v rámci Brněnských onkologických dní.
Dalším zdrojem informací jsou články zabývající se touto tematikou v odborných časopisech a dvě monografie cílené na tuto věkovou skupinu pacientů (Nádory adolescentů a mladých dospělých, Grada 2011 a Vybrané kazuistiky nádorů u adolescentů a mladých dospělých, Mladá fronta 2012).
4. Dlouhodobě přežívající dětští onkologičtí pacienti (childhood cancer survivors), problémy přechodu z dětské onkologie do péče medicíny dospělého věku (tzv. transitional care)
Specifickou skupinou v onkologii jsou mladí dospělí, kteří byli léčeni pro maligní nádorové onemocnění v dětském věku a dlouhodobě přežívají bez přítomnosti nádoru. Jejich počet v populaci narůstá, v současnosti je jeden z 850 lidí do 35 let věku přežívající dětský onkologický pacient; 25 % z nich je mladších 20 let věku, 75 % je mladších 40 let věku. Tito pacienti by měli být dlouhodobě, ideálně celoživotně, sledováni na specializovaném pracovišti. Velké procento z nich již dosáhlo dospělého věku a je ohroženo vznikem pozdních následků protinádorové léčby (poruchy růstu, kardiotoxicita, neurotoxicita, hormonální poruchy, poruchy fertility, neurokognitivní změny atd.). Nejvážnějším z nich je vyšší riziko vzniku sekundárního nádoru (schéma 1) [2,4,12,21]. Míra rizika rozvoje sekundárního nádoru a typu sekundárního nádoru závisí na typu primárního nádoru a typu protinádorové léčby, riziko zvyšuje rovněž přítomnost genetické zátěže (např. mutace Rb1 genu). Pro lékaře, který pacienta dlouhodobě sleduje, je důležité znát míru rizika a předpokládaný typ sekundární malignity (graf 4). O významu této problematiky svědčí mimo jiné fakt, že problémy adolescentů a „childhood cancer survivors“ překročily hranice dětské onkologie a byly tématem speciální sekce v rámci kongresu ESMO 2014 v Madridu.
Schéma 1. Rizika pozdních následků u bývalých dětských onkologických pacientů. 
Graf 4. Typ sekundárních nádorů dle primárního nádoru u dětí. 
Modifikovaný graf dle [21]. V reálné klinické praxi je často velmi problematický přechod z pracoviště dětské onkologie na pracoviště dospělé medicíny (tzv. transitional care) [11,22– 25]. Ve světě existuje několik modelů následné péče:
- Pacienta sleduje praktik nebo rodinný lékař, onkolog (a většinou již ne dětský onkolog, který pacienta léčil) je konzultován pouze v případě potíží. Nevýhodou je, že ošetřující lékař nemá zpětnou vazbu a neví nic o dlouhodobých problémech svého bývalého pacienta a nemůže tak korigovat současnou léčbu.
- Pacient je sledován u svého praktického lékaře, který odesílá výsledky všech vyšetření a zápis o kontrole onkologovi dospělého věku – kontinuita informací o pacientovi záleží na spolupráci a domluvě zainteresovaných lékařů.
- Pacient je sledován onkologem dospělého věku, který často pro nedostatek času a jiných faktorů nekomunikuje s dětským onkologem a ten opět nemá informace o dalším vývoji zdravotního stavu svého bývalého pacienta.
- Pacient je sledován onkologem dospělého věku ve spolupráci s dětským onkologem. Tento stav se jeví jako ideální.
Měřítkem léčebného úspěchu je v současné onkologii kromě délky samotného OS zejména kvalita života, schopnost mladých lidí zařadit se zpět do vzdělávacího či pracovního procesu, schopnost najít si partnera a založit si rodinu a žít plnohodnotný život. Proto je dlouhodobé sledování přežívajících mladých onkologických pacientů mezioborový multidisciplinární proces (onkologové, psychologové, kardiologové, gynekologové, ale také sociální pracovníci, tzv. poradci pro školu a práci atd.). Je to v podstatě zrcadlo a způsob hodnocení kvality práce dětského onkologa.
Subjektivní vnímání dobré kvality života u vyléčených mladých lidí závisí také na adekvátním chování a dostatečném pochopení ze strany jeho okolí. Proto je nevyhnutná osvěta široké populace i v tomto směru.
Vlastní zkušenosti s léčbou adolescentů
Na Klinice dětské onkologie FN Brno jsme v 10letém období 2004– 2014 léčili 358 pacientů starších 15 let se širokým spektrem diagnóz. Počet pacientů v jednotlivých letech byl stacionární s minimálními odchylkami v rozmezí 26– 36 pacientů za rok. Spektrum diagnóz zahrnovalo všechny typy nádorů a hematologických malignit typických pro tuto věkovou skupinu s převahou maligních lymfomů, sarkomů kostí a měkkých tkání, gonadálních germinálních nádorů. V posledních letech pozorujeme nárůst kožního maligního melanomu. Z karcinomů, i když vzácných, byl nejčastější hepatocelulární karcinom, renální karcinom a karcinom střeva na podkladě genetické zátěže (familiární adenomatózní polypóza, Lynchův syndrom atd.). Zemřelo celkem 57 pacientů (16 %), z nich 95 % na progresi maligního nádoru, pouze 5 % pacientů zemřelo na komplikace léčby nebo komplikace v souvislosti se základním onemocněním. Přežívá 84 % pacientů, délka OS se liší dle typu nádoru (graf 5).
Graf 5. Křivka OS dle diagnóz. 
Závěr
Zhoubné nádory u dospívajících a mladých dospělých patří v rámci oboru onkologie mezi onemocnění vzácná. Nízký výskyt je snad příčinou, proč byla tato skupina pacientů dlouhé období mimo centra zájmu onkologů dospělého věku i dětských onkologů. I když jsou juvenilní nádory potenciálně vyléčitelné, OS adolescentů nedosahuje úspěchy dosažené v dětské onkologii.
Při srovnání počtu klinických studií, úsilí a nemalých finančních nákladů, které jsou věnovány nádorům dospělého věku s velmi špatnou prognózou, kde se za úspěch považuje prodloužení života o několik málo měsíců, je naší morální povinností věnovat alespoň stejnou pozornost mladé generaci s onkologickým onemocněním, která má navíc podstatně lepší šance na dlouhodobé vyléčení. Využít tuto šanci a pomoct mladým lidem zvládnout jejich náročný boj s maligním nádorem ve složitém období dospívání se dá pouze širokou spoluprací jednotlivých medicínských specializací a vytvořením jednotných a všeobecně akceptovaných podmínek pro všechny mladé lidi.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (RECAMO, CZ.1.05/2.1.00/03.0101) a projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Viera Bajčiová, CSc.
Klinika dětské onkologie
LF MU a FN Brno
Černopolní 9
625 00 Brno
e-mail: vbajciova@fnbrno.cz
Obdrženo: 17. 5. 2015
Přijato: 22. 7. 2015
Zdroje
1. Bajčiová V. Definice adolescentního věku. In: Bajčiová V, Tomášek J, Štěrba J. Nádory adolescentů a mladých dospělých. Praha: Grada 2011 : 1 – 2.
2. Bajčiová V. Adolescenti a mladí dospelí – „zabudnutá“ skupina v onkológii? Onkológia 2006; 1(2): 98 – 102.
3. Aubin S. What should the age range be for AYA oncology? J Adol Young Adult Oncol 2011; 1(1): 3 – 7.
4. Coccia PF, Altman J, Bhatia S et al. Adolescent and young adult oncology. Clinical practice guidelines in oncology. J Nat Compr Cancer Netw 2012; 10(9): 1112 – 1150.
5. Pearce MS, Parker L, Windebank KP et al. Cancer in adolescents and young adults aged 15 – 24 years: a report from the North of England young person’s malignant disease registry, UK. Pediatr Blood Cancer 2005; 45(5): 687 – 693.
6. Bleyer WA. Cancer in older adolescents and young adults: epidemiology, diagnosis, treatment, survival and importance of clinical trials. Med Ped Oncol 2002; 38(1): 1 – 10.
7. Pentheroudakis G, Pavlidis N. Juvenile cancer: improving care for adolescents and young adults within the frame of medical oncology. Ann Oncology 2005; 16(2): 181 – 188.
8. Albritton K, Bleyer WA. The management of cancer in the older adolescent. Eur J Cancer 2003; 39(18): 2584 – 2599.
9. Bajčiová V. Epidemiologie nádorů u dospívajících a mladých dospělých. In: Bajčiová V, Tomášek J, Štěrba J. Nádory adolescentů a mladých dospělých. Praha: Grada 2011 : 7 – 22.
10. Bleyer WA. Young adult oncology: the patients and their survival challenges. CA Cancer J Clin 2007; 57(4): 242 – 255.
11. Freyer DR, Felgenhauer J, Perentesis J et al. Children΄s oncology grou’s 2013 blueprint for research: adolescent and young adult oncology. Ped Blood Cancer 2013; 60(6): 1055 – 1058. doi: 10.1002/ pbc.24431.
12. Vassal G, Fitzgerald E, Schrappe M et al. Challenges for children and adolescents with cancer in Europe: the SIOP ‑ Europe agenda. Pediatr Blood Cancer 2014; 61(9):1551 – 1557. doi: 10.1002/ pbc.25044.
13. Veal GJ, Hartford CHM, Stewart CF. Clinical pharmacology in the adolescent oncology patient. J Clin Oncol 2010; 28(32): 4790 – 4799. doi: 10.1200/ JCO.2010.28.3473.
14. Dang ‑ Tan T, Franco EL. Diagnostic delay in childhood cancer: a review. Cancer 2007; 110(4): 703 – 713.
15. Bajčiová V. Rizika a následky pozdní diagnózy u dospívajících. Vox Pediatriae 2012; 12(6): 26 – 29.
16. Ahrensberg JM, Fenger ‑ Grøn M, Vedsted P. Use of primary care during the year before childhood cancer diagnosis: a nationwide population – based-matched comparative study. PLoS One 2013; 8(3): e59098. doi: 10.1371/ journal.pone.0059098.
17. Fern LA, Campbell CH, Eden TO et al. How frequently do young people with potential cancer symptoms present in primary care? Brit J Gener Pract 2011; 61(586): 223 – 230. doi: 10.3399/ bjgp11X572418.
18. Hayes ‑ Lattin B, Mathews ‑ Bradshaw B, Siegel S. Adolescent and young adult oncology training for health professionals: a position statement. J Clin Oncol 2010; 28(32): 4858 – 4861. doi: 10.1200/ JCO.2010.30.5508.
19. Schiffman JD, Geller JI, Mundt E et al. Update of pediatric cancer predisposition syndromes. Ped Blood Cancer 2013; 60(8): 1247 – 1252. doi: 10.1002/ pbc.24555.
20. American Society of Clinical Oncology. American Society of Clinical Oncology policy statement update: genetic testing for cancer suspectibility. J Clin Oncol 2003; 21(12): 2397 – 2406.
21. Meadows AT, Friedman DL, Neglia JP et al. Second neoplazma in survivors of childhood cancer: findings from the Childhood Cancor Survivor Study cohort. J Clin Oncol 2009; 27(14): 2356 – 2362. doi: 10.1200/ JCO.2008.21.1920.
22. Freyer DR. Transitional of care for young adult survivors of childhood and adolescent cancer: rationale and approaches. J Clin Oncol 2010; 28(32): 4810 – 4818. doi: 10.1200/ JCO.2009.23.4278.
23. Sender LS. The AYA cancer patientś survivorship: challenges and opportunities. J Adol Young Adult Oncol 2013; 2(3): 87 – 88.
24. Zahara R, Rosenberg ‑ Yunger S, Klassen AF et al. Barriers and facilitators of transition from pediatric to adult long‑term follow up care in childhood cancer survivors. J Adol Young Adult Oncol 2013; 2(3): 104 – 111.
25. Fernandes SM, O΄Sullivan ‑ Oliviera J, Landzberg MJet al. Transition and transfer of adolescents and young adults with pediatric onset chronic disease: the patient and parent perspective. J Pediatr Rehabil Med 2014; 7(1): 43 – 51. doi: 10.3233/ PRM ‑ 140269.
26. Tayc.org [homepage on the Internet]. Teenagers and young adults with cancer. Available from: www.tyac.org.uk.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2015 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Analýza změn fosfoproteomu nádorové buněčné linie MDA‑ MB‑ 468 v odpovědi na expresi izoforem p63 pomocí hmotnostní spektrometrie
- „Cukry zasahují“ aneb glykomika na poli nádorových biomarkerů
- Nrf2 – dve tváre regulátora antioxidačného systému
- Editorial
- Polo‑like kináza 1 jako cíl protinádorové terapie
- PDLIM2 a jeho role v onkogenezi – tumor supresor nebo onkoprotein?
- Profil aktivace receptorových tyrozinkináz a mitogenem aktivovaných proteinkináz v terapii Maffucciho syndromu
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
- Imunologické aspekty v onkologii – cirkulující γδ T lymfocyty
- Cirkulující nádorová DNA v krvi a její využití jako potenciálního biomarkeru nádorových onemocnění
- Adenovírusové vektory v génovej terapii
- Nádory u adolescentů
- Bioinformatika a sekvenování nové generace
- IntegRECAMO: úspěšná realizace projektu OP VK
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Adenovírusové vektory v génovej terapii
- Nrf2 – dve tváre regulátora antioxidačného systému
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



