-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Recidiva tromboembolické nemoci a možnosti její prevence
Recurrence of thromboembolic disease and the possibility of its prevention
Patients with an initial VTE event are at an increased risk for recurrence, but the risk is not equivalent in all patients. Currently available anticoagulation therapies are effective in reducing VTE recurrence, they are associated with bleeding risks. When assessing the need for and duration of secondary prophylaxis the risk for recurrence needs to be balanced with the risk for bleeding. Warfarin is the most widely used oral anticoagulation agent but is inconvenient in the setting of long-term prophylaxis as it requires frequent monitoring and dose adjustments. New oral anticoagulant agents can be given in fixed doses without the need for coagulation monitoring hold the promise of being more convenient for secondary prophylaxis.
Key words:
thromboembolic disease, anticoagulation treatment, bleeding.
Autoři: J. Chlumský
Působiště autorů: Přednosta: prof. MUDr. Milan Kvapil, CSc., MBA ; 2. lékařská fakulta a Fakultní nemocnice Motol ; Interní klinika ; Univerzita Karlova v Praze
Vyšlo v časopise: Prakt. Lék. 2011; 91(10): 577-581
Kategorie: Přehledy
Souhrn
Pacienti po prodělané trombolembolické příhodě mají zvýšené riziko recidivy, ale riziko není stejné u všech pacientů. V současné době máme k dispozici účinné antikoagulační léky, problémem ale zůstává riziko krvácení. Při posuzování indikace a trvání sekundární profylaxe musí být v rovnováze riziko opakování a riziko krvácení. Warfarin je nejrozšířenější perorální antikoagulační lék, ale pro dlouhý poločas je počáteční nastavení léčby pomalé, vyžaduje časté laboratorní kontroly a úpravy dávkování. Nová perorální antikoagulancia mohou být podávána ve fixních dávkách bez nutnosti laboratorního sledování, a proto budou v klinické praxi vhodnější pro sekundární profylaxi.
Klíčová slova:
tromboembolická nemoc, antikoagulační léčba, krvácení.Úvod
Tromboembolická nemoc (TEN) zahrnuje hlubokou žilní trombózu (HŽT) a plicní embolii (PE). Studie z průmyslově vyspělých zemí ukázaly, že roční výskyt TEN je 1–2 případy na 1 000 osob (1). Odhaduje se, že ve Spojených státech postihne TEN 900 000 pacientů ročně (2). Tyto odhady však budou pravděpodobně podhodnoceny, protože klinické příznaky TEN jsou nespecifické, a diagnostické testy nejsou vždy dostatečně citlivé pro stanovení správné diagnózy u asymptomatických pacientů.
TEN je spojena s významným zvýšením mortality a morbidity. Do 1 měsíce od diagnózy zemře přibližně 6 % nemocných po prodělané HŽT a 12 % nemocných po PE (3). Ve Spojených státech je PE odpovědna za 300 000 úmrtí ročně. Antikoagulační léčba u většiny pacientů vede k úplnému uzdravení. Neúplné rozpuštění trombu však může mít za následek dlouhodobé komplikace
- plicní hypertenzi, a
- posttrombotický syndrom,
které jsou spojeny s významnou morbiditou.
Plicní hypertenze se vyskytuje až u 5 % pacientů po PE a může vyústit v selhání pravé komory a vést k úmrtí (4).
Posttrombotický syndrom je charakterizovaný chronickou bolestí, otokem a vznikem bércových vředů a vyskytuje se až u 50 % pacientů s HŽT (5).
Data z populačních studií naznačují, že pacienti, kteří prodělali TEN, mají zvýšené riziko recidivy. Riziko opakování se mění časem po příhodě a je nejvyšší v prvních 6–12-ti měsících. Celková incidence opakovaných TEN je asi
- 10 % za 6 měsíců,
- 12 % za rok,
- 25 % během 5-ti let, a
- 30 % během 10-ti let (7, 8).
Stejně jako akutní tromboembolická příhoda, je i recidiva TEN spojena s významnou morbiditou a mortalitou. Opakující se HŽT je spojena s výrazně vyšší pravděpodobností posttrombotického syndromu než první HŽT (9) a opakující se PE vede k úmrtí u 4–9 % pacientů (10). Opakující se PE také předurčuje pacienty ke vzniku chronické plicní hypertenze (11).
Rizikové faktory recidivy TEN
Riziko pro opakující se TEN během antikoagulační léčby je velmi nízké a dosahuje asi 1 % během půlroční antikoagulační léčby (6). Po ukončení antikoagulační léčby určují riziko vzniku recidivy TEN různé faktory.
Dnes známe celou řadu rizikových faktorů pro vznik TEN. Některé z těchto faktorů jsou dočasné nebo vratné, jako např.
- chirurgický zákrok,
- trauma,
- imobilizace,
- porod,
- dlouhé cestování,
- hormonální léčba,
- těhotenství.
Mezi perzistentní, neboli nevratné faktory počítáme
- rakovinu,
- ochrnutí, a
- antifosfolipidový syndrom (APS).
Na základě povahy těchto rizikových faktorů mohou TEN být zařazeny do 3 skupin:
- TEN spojená s dočasnými rizikovými faktory,
- TEN spojená s přetrvávajícími rizikovými faktory, nebo
- nevyprovokované (idiopatické, tj. bez známé příčiny) TEN (12).
Čtvrtina až polovina všech prvních případů VTE je idiopatických (8).
Riziko recidivy je vyšší, pokud rizikové faktory nejsou známy nebo přetrvávají (7, 13). Obecně platí, že čím významnější je dočasný rizikový faktor, tím nižší je riziko recidivy po ukončení antikoagulační léčby. Například u pacientů s první epizodou TEN v souvislosti s chirurgickým zákrokem je během dvouletého sledování incidence opakovaných TEN prakticky nulová, ale riziko opakování dosahuje 19,4 % u nemocných s idiopatickou TEN a 8,8 % u nemocných s nechirurgickým rizikovým faktorem (fraktura, imobilizace, cestovní TEN nebo hormonální léčba) (12).
TEN u pacientů s nádorovým onemocněním mají přibližně 2 až 4 krát vyšší riziko recidivy, než je tomu u pacientů bez nádoru, a to jak v průběhu, tak i po ukončení antikoagulační léčby (14). Riziko se dále zvyšuje závažností malignity, kdy nejvyšší je u karcinomu žaludku nebo pankreatu a v průběhu chemoterapie (8, 14).
U pacientů s TEN v přítomnosti APS je riziko recidivy 2,3–8,5 krát vyšší a roční riziko recidivy u těchto pacientů může dosáhnout až 50–67 %, a to zejména během prvních několika měsíců po vysazení antikoagulační terapie (15).
Riziko recidivy TEN ovlivňují i další faktory:
- Proximální HŽT znamená 2 krát vyšší riziko recidivy, než je tomu u nemocných s distální HŽT (16). U nemocných s proximální HŽT platí, že čím je výše proximální hranice trombózy, tím je vyšší riziko pro opakování.
- Pacienti s iliofemorální HŽT mají 2 krát vyšší riziko recidivy HŽT ve srovnání s pacienty s femorální nebo podkolenní HŽT (17).
- V prvních měsících po ukončení antikoagulační léčby je riziko recidivy TEN u pacientů s PE výrazně vyšší než u pacientů s proximální HŽT. Tento rozdíl se časem vyrovnává a při 10-ti letém sledování je pozorován podobný počet recidiv (18).
Bylo zjištěno, že první klinická manifestace TEN je spojena se stejným klinickým typem při vzniku recidivy. Pacienti s PE mají 4 krát větší pravděpodobnost, že při recidivě budou postiženi PE spíše než HŽT, zatímco nemocní s HŽT mají 4 krát větší pravděpodobnost, že při recidivě se TEN bude manifestovat jako HŽT (10).
Metaanalýza 15 studií s více než 15 000 pacienty dospěla k závěru, že muži mají o 50 % vyšší pravděpodobnost výskytu opakující se epizody TEN než ženy, bez ohledu na povahu počáteční TEN, lokalizaci trombózy nebo počet recidiv (18). Rozdíl v riziku recidiv není vysvětlitelný léčbou estrogeny.
Běloši (23/100 000) a afroameričané (29/100 000) mají vyšší roční výskyt TEN než hispánci (14/100 000) nebo obyvatelé ostrovů ležících v asijsko-tichomořské oblasti (6/100 000) (3). Naopak výrazně vyšší počet recidiv byl hlášen u hispánských a afroamerických žen ve srovnání s běloškami (3,1 % / rok oproti 1,8 % / rok). Mezi muži rasový a etnický původ neměl vliv na riziko recidiv (20).
Stárnutí je významným rizikovým faktorem pro počáteční TEN, např. riziko pro PE se zvyšuje o 22 % za 10 let života (21).
Dědičné trombofilní stavy (deficience antitrombinu, proteinu C, proteinu S) a genové polymorfismy jako Leidenská mutace a mutace protrombinu G20210A by měly být logicky spojeny s vyšším rizikem recidivy pro první atace TEN, ale jejich vliv na riziko recidivy je v klinické praxi kontroverzní. Dvě velké prospektivní studie pacientů s TEN nevykázaly žádné významné zvýšení rizika recidivy u pacientů s trombofilií ve srovnání s pacienty bez trombofilie (12, 23). Dvě studie (23, 24) prokázaly zvýšené riziko TEN recidivy u heterozygotních nosičů Leidenské mutace (1,4 násobné riziko) a mutace protrombinu G20210A (1,7 a 1,2 násobné riziko).
Kardiovaskulární rizikové faktory ukázaly spojitost se zvýšeným výskytem TEN (25). Obezita je nezávislým prediktorem recidivy TEN (27), zvýšení rizika pro opakování bylo 1,3 u pacientů s nadváhou a 1,6 u obézních jedinců.
Zvýšené hodnoty D-dimeru rovněž mají předpovědní hodnotu pro opakování TEN po ukončení antikoagulační léčby. Normální hodnoty D-dimeru znamenaly 3,5% roční riziko recidivy, zvýšené hodnoty 8,9% roční riziko recidivy (29).
Reziduální žilní trombóza prokázána sonograficky po ukončení antikoagulační léčby je potenciální rizikem recidivy TEN (28). V několika studiích byla zbytková trombóza spojená se dvojnásobným zvýšeným rizikem opakování TEN (8). Prospektivní studie sledující hodnotu D-dimeru a zbytkové trombózy u pacientů s idiopatickou proximální DVT ukázala, že abnormální D-dimer (více než 500 ng /ml) za 1 měsíc po ukončení antikoagulační léčby byl nezávislým rizikovým faktorem pro opakování TEN s 3,3 násobným zvýšením rizika. V případě zbytkové trombózy nebylo zvýšené riziko prokázáno (28).
Délka trvání sekundární profylaxe
Délka antikoagulační terapie je stále diskutována. Je třeba vzít v úvahu obě rizika:
- riziko pro opakující se TEN, i
- riziko krvácení a v neposlední řadě i pohodlí pro pacienta (30).
Podle současných doporučení u pacientů s distální HŽT a přechodným rizikovým faktorem (např. pooperační žilní trombóza) by 6 týdenní antikoagulační léčba mohla být dostačující, a to vzhledem k tomu, že riziko opakování v prvních 6-ti letech je asi 1 % ročně (31). Běžně ale tyto nemocné léčíme 3 měsíce. U ostatních nemocných léčbu prodlužujeme na 6 měsíců. V případě recidivy, kombinace hyperkoagulačních stavů či nádoru léčbu prodlužujeme podle snášenlivosti na neomezenou dobu.
Riziko krvácení při antikoagulační léčbě
Všechna antikoagulancia jsou spojena s rizikem krvácení (31), které může být ovlivněno několika faktory (tab. 1). Riziko krvácení je nejvyšší během prvních měsíců antikoagulační terapie, pravděpodobně kvůli krvácení z preexistujících lézí (32). Po počátečních měsících léčby riziko krvácení klesá s délkou léčby. Věk ovlivňuje riziko krvácení během antikoagulační léčby, riziko krvácení zvyšuje z 1 % za rok ve věku 20 let na 2 % ve věku 70 let a dosahuje 3,5 % ve věku 90-ti let (18).
Tab. 1. Krvácení během antikoagulační léčby 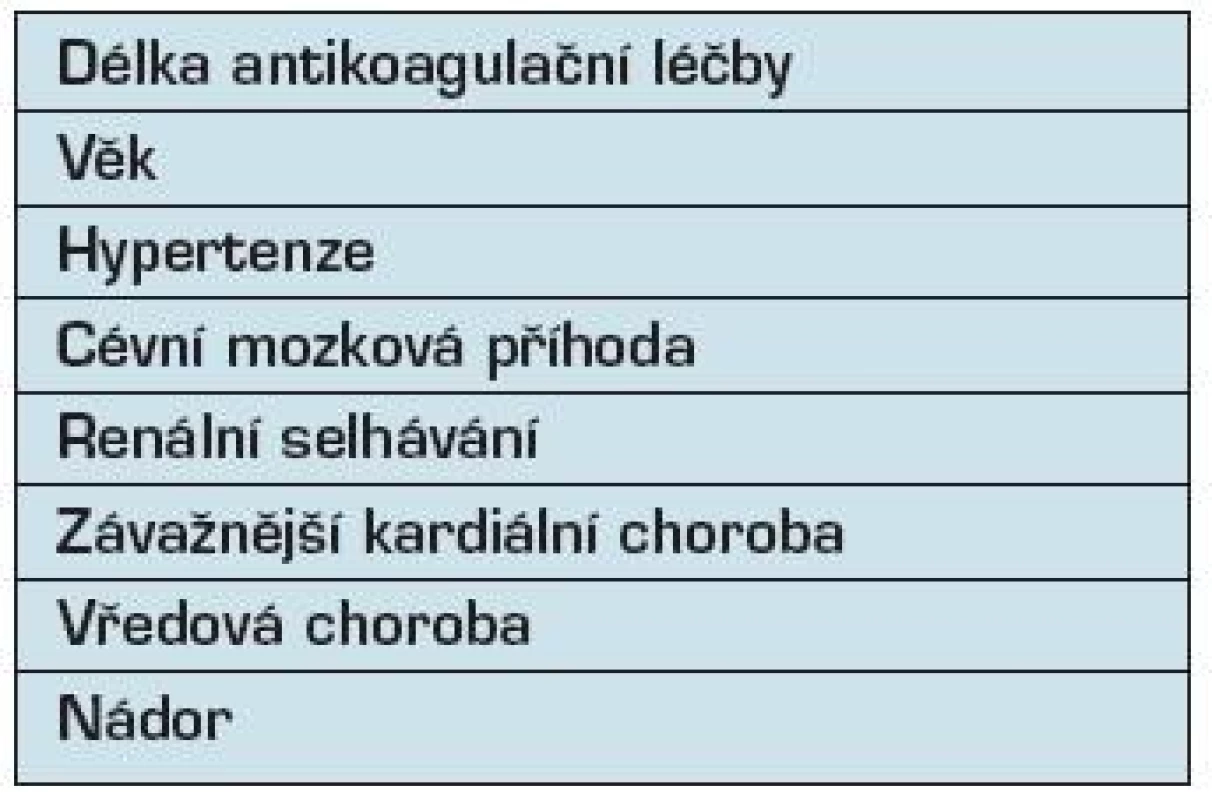
Riziko krvácení je také zvýšeno v přítomnosti dalších chorob, včetně hypertenze, anamnézy cévní mozkové příhody, renální insuficience, vážných srdečních onemocnění, vředové choroby a nádoru (32). Rakovina zvyšuje riziko krvácení přibližně 4 násobně (13). Je to částečně způsobeno přítomností cévních lézí, trombocytopenií nebo koagulopatií.
V klinické praxi můžeme použít některý ze skórovacích systémů rizika krvácení (RIETE – tab. 2). Při tomto skórovaní nemocní se skóre 0 bodů měli riziko závažných krvácení 0,1 %, skóre 1–4 mělo riziko 2,8 % a skóre nad 4 znamenalo riziko krvácení 6,2 % během 3 měsíčního sledování (33).
Tab. 2. Riziko krvácení podle registru RIETE 
Antikoagulancia pro sekundární prevenci
Antagonisté vitaminu K (warfarin) a LMWH jsou v současné době dostupné pro prevenci recidivující TEN. Oba léky však mají svá omezení, zejména pokud jde o dlouhodobou léčbu.
Warfarin blokuje syntézu koagulačních faktorů závislých na vitamínu K:
- protrombin (faktor II),
- faktor VII,
- faktor IX, a
- faktor X.
Warfarin je nejrozšířenějším antikoagulačním lékem, který je léčebně používán více jak 6 desetiletí. Mezi nežádoucí účinky warfarinu patří významná inter - a intraindividuální variabilita v terapeutickém účinku, úzký terapeutický index, pomalá farmakodynamická odpověď a četné interakce se stravou a jinými léky (34).
Komplex LMWH – antitrombin katalyzuje především inaktivaci faktoru Xa a v menší míře faktoru II (36). Ve srovnání s warfarinem má LMWH stabilní antikoagulační účinek, předvídatelný účinek při podané dávce, známé interakce s ostatními léky, rychlý nástup účinku a nevyžaduje rutinní laboratorní monitorování. Nejasnosti panují v dávkování u pacientů s renální nedostatečností či obezitou, kdy je v některých případech přínosné měření hladiny anti-Xa.
Několik studií ukázalo, že LMWH může být účinnější v prevenci recidivy VTE u pacientů s maligním nádorovým onemocněním (35, 37). Proto je doporučeno podávat LMWH po dobu prvních 3–6 měsíce u pacientů s TEN a rakovinou, následuje antikoagulační léčba warfarinem nebo LMWH na dobu neurčitou, nebo do vyléčení nádoru.
Kromě onkologických pacientů je sekundární profylaxe s LMWH zvažována v několika dalších klinických situacích (30), kdy je nevhodné nebo kontraindikované podávání warfarinu (např. těhotenství, krátkodobá antikoagulační léčba). Hlavním omezením pro dlouhodobou léčbu LMWH je jeho parenterální podávání. Kromě toho jsou LMWH spojeny s rizikem heparinem indukované trombocytopenie, i když v menší míře než při léčbě nefrakcionovaným heparinem (36).
Nová perorální antikoagulancia
Omezení warfarinu a heparinu podnítilo rozvoj nových perorálních antikoagulancií, která blokují přímo jeden aktivovaný koagulační faktor. Do klinické praxe přichází
- dabigatran,
- apixaban, a
- rivaroxaban (34).
Dabigatran etexilate je prolék a po perorálním podání se rychle a kompletně přeměňuje na aktivní formu. Jedná se o přímý a reverzibilní inhibitor trombinu. Maximální koncentrace v plazmě je dosaženo do 3 hodin po podání a poločas činí 12–14 hodin (38). Dabigatran etexilate je vylučován převážně ledvinami. Dabigatran etexilate v dávce 150 mg dvakrát denně byl srovnáván ve studii RE - COVER s warfarinem v léčbě akutní TEN, kde prokázal stejný účinek v prevenci opakujících se nebo fatálních TEN. Krvácení bylo nižší než u warfarinu. Velké nebo klinicky závažné krvácení bylo významně sníženo o 37 % (p = 0,002) a jakékoli krvácení bylo sníženo o 29 % (p = 0,0002) u pacientů užívajících dabigatran (39).
Apixaban je přímý inhibitor faktoru Xa. Maximální plazmatické koncentrace dosahuje apixaban za 3 hodiny po podání a poločas v plazmě je 8-15 hodin. Ledvinami se vylučuje přibližně z 25 % (40).
Studie Amplify sleduje účinnost a bezpečnost podávání apixabanu 10 mg denně u nemocných s HŽT a studie Amplify - EXT hodnotí apixaban v sekundární prevenci TEN u pacientů, kteří dokončili léčbu symptomatické DVT nebo PE (49).
Rivaroxaban je dalším inhibitorem faktoru Xa. Má vysokou perorální biologickou dostupnost a rychlý nástup účinku dosahuje maximálních plazmatických koncentrací během 2–4 hodin po podání a jeho poločas je až 9 hodin u zdravých mladých jedinců a 12–13 hodin u starších osob. Ledvinami se vylučuje 30 % rivaroxabanu a stolicí 70 % (42).
Ke zjištění účinnosti a bezpečnosti rivaroxabanu u nemocných s tromboembolickou nemocí byl v roce 2006 zahájen program EINSTEIN s celkovým počtem 9 000 pacientů, který zahrnuje studii EINSTEIN - DVT u nemocných s HŽT, EINSTEN - EXT s prodloužením léčby o 6 nebo 12 měsíců po ukončení alespoň 6 měsíční léčby VTE. Výsledky obou těchto studií byly publikovány v závěru roku 2010 (43). Výsledky dosud probíhající EINSTEN - PE s léčbou plicní embolie se očekávají koncem tohoto roku.
Studie EINSTEN-DVT je otevřená randomizovaná studie, která srovnává perorální léčbu rivaroxabanem (15 mg dvakrát denně po dobu 3 týdnů, následně 20 mg jednou denně) s podkožně podávaným enoxaparinem a následně warfarinem na 3, 6 nebo 12 měsíců u pacientů s akutní symptomatickou HŽT. Po dokončení této studie mohli nemocní přejít do studie EINSTEIN - EXT, dvojitě-slepé, randomizované studie, která srovnávala podávání samotného rivaroxabanu (20 mg jednou denně) oproti placebu po dobu dalších 6 nebo 12 měsíců.
Primárním výsledkem v obou studiích byla recidiva žilní trombózy a riziko většího nebo klinicky závažného krvácení.
Do studie EINSTEIN - DVT bylo zařazeno 3 449 pacientů – 1 731 do skupiny léčené rivaroxabanem a 1 718 léčených enoxaparinem s antagonisty vitaminu K. Ve skupině nemocných léčených rivaroxabanem mělo recidivu HŽT nebo plicní embolii 36 nemocných (2,1 %), ve skupině nemocných léčených enoxaparinem s warfarinem 51 nemocných (3,0 %) (RR 0,68, CI 0,44 1,04; p <0,001). Ke krvácení došlo u 8,1 % pacientů v každé skupině (tab. 3). Účinnost a bezpečnost léčby nebyla ovlivněna věkem, pohlavím či hmotností nemocných.
Tab. 3. Výsledky studie EINSTEIN-DVT 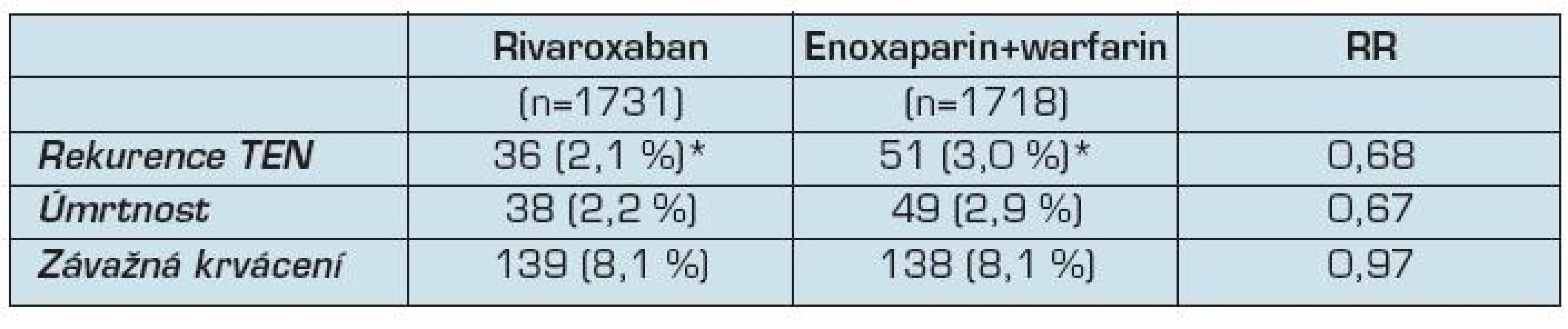
Legenda: * – p < 0,001 Vaskulární příhody se vyskytly u 12 nemocných (0,7 %) v rivaroxabanové skupině a u 14 nemocných (0,8 %) ve skupině léčené LMWH a warfarinem. Elevace transamináz nebo bilirubinu byla zjištěna u 0,1 % nemocných léčených rivaroxabanem a u 0,2 % nemocných v kontrolní skupině.
Studie EINSTEIN - EXT zahrnovala 602 pacientů léčených rivaroxabanem a 594 pacientům bylo podáváno placebo (tab. 4). Ve skupině léčených rivaroxabanem se vyskytlo 8 případů (1,3 %), oproti 42 případům (7,1 %) TEN ve skupině s placebem (RR 0,18, CI 0,09 až 0,39; p <0,001). Čtyři pacienti v rivaroxabanové skupině byli postižení nefatálním velkým krvácením (0,7 %), ve skupině s placebem větší krvácení nebylo zaznamenáno (p = 0,11). Celkově prodloužení léčby o 6 měsíců zabránilo 34 recidivám HŽT za cenu 4 větších krvácení. Výskyt menších krvácení se zvýšil ze 1,2 % v placebové skupině na 5,4 % ve skupině s rivaroxabanem. Tyto krvácivé příhody byly převážně slizniční a většina pacientů (81 %) pokračovala ve studii.
Tab. 4. Výsledky studie EINSTEIN-EXT 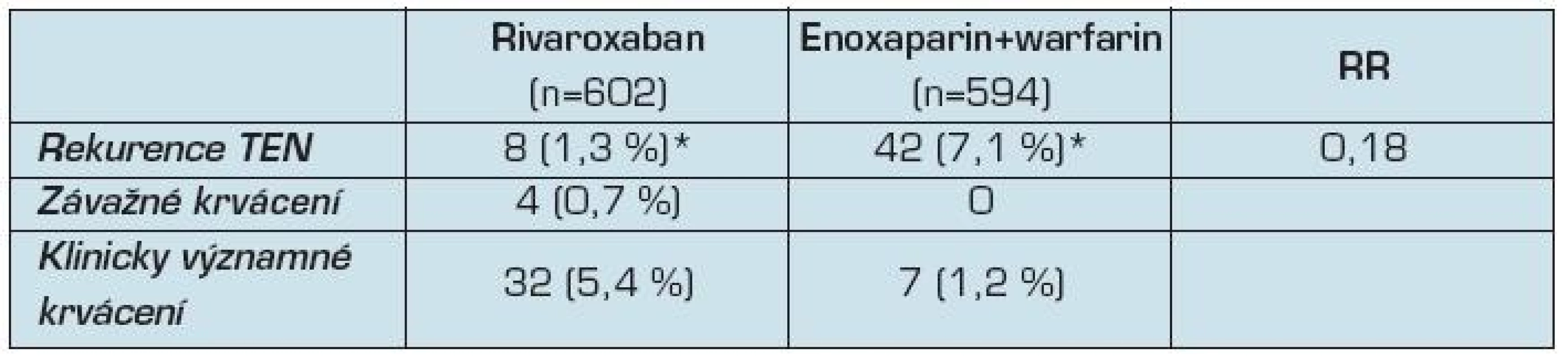
Legenda: * – p < 0,001 Cévní příhody se objevily u 3 pacientů ve skupině rivaroxabanu a u 4 pacientů ve skupině s placebem. Nebyla zjištěna hepatotoxicita rivaroxabanu, protože u žádného pacienta v obou skupinách nebyla zjištěna během léčby vyšší než trojnásobná sérová hodnota alaninaminotransferázy nebo dvojnásobná koncentrace bilirubinu.
* * *
Výsledky studie EINSTEIN pro klinickou praxi lze shrnout tak, že rivaroxaban v léčbě HŽT ve srovnání se standardní léčbou prokazuje stejnou účinnost s podobným rizikem krvácení. Pohlaví, věk nebo hmotnost nemocných neovlivnil klinický účinek. Léčbu rivaroxabanem je možno zahájit bez předléčení LMWH a rivaroxaban tedy bude vhodným lékem pro ambulantní léčbu HŽT. Prodloužení léčby rivoraxabanem o dalších 6 nebo 12 měsíců je v prevenci recidivy velmi účinné a ve srovnání s placebem má přijatelné riziko krvácení.
Závěr
Opakující se TEN je spojena s nezanedbatelným rizikem komplikací a úmrtnosti. V současné době máme k dispozici účinnou antikoagulační terapii (warfarin a LMWH), nicméně tato léčba je spojená s rizikem krvácení. Sekundární prevence proto musí být přizpůsobena každému pacientovi s vyvážením rizika recidivy a rizika krvácení.
Omezení současných antikoagulačních léků vedlo k rozvoji nových perorálních antikoagulancií – dabigatranu, apixabanu a rivaroxabanu. Tyto léky mají předvídatelný klinický účinek, jsou podávány v jedné dávce a nevyžadují laboratorní kontrolu.
Klinická účinnost a bezpečnost byla v případě rivoraxabanu a dabigatranu již potrvzena, na přínos apixabanu v sekundární prevenci TEN je třeba počkat na výsledky probíhající klinické studie.
Doc. MUDr. Jaromír Chlumský, PhD.
Interní klinika 2. LF UK ve FN Motol
V úvalu 84
150 00 Praha 5
E-mail: jaromirchlumsky@seznam.cz
Zdroje
1. Silverstein, M.D., Heit, J.A., Mohr, D.N. et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study. Arch. Intern. Med. 1998, 158, p. 585-593.
2. Lilienfeld, D.E. Decreasing mortality from pulmonary embolism in the United States, 1979-1996. Int. J. Epidemiol. 2000, 29, p. 465-469.
3. White, R.H. The epidemiology of venous thromboembolism. Circulation 2003, 107, p. I4-I8.
4. Kahn, S.R., Ginsberg, J.S. Relationship between deep venous thrombosis and the postthrombotic syndrome. Arch. Intern. Med. 2004, 164, p. 17-26.
5. Schulman, S., Lindmarker, P., Holmstrom, M. et al. Post-thrombotic syndrome, recurrence, and death 10 years after the first episode of venous thromboembolism treated with warfarin for 6 weeks or 6 months. J. Thromb. Haemost. 2006, 4, p. 734-742.
6. Prandoni, P., Lensing, A.W., Cogo, A. et al. The long-term clinical course of acute deep venous thrombosis. Ann. Intern. Med. 1996, 125, p. 1-7.
7. Heit, J.A., Mohr, D.N., Silverstein, M.D. et al. Predictors of recurrence after deep vein thrombosis and pulmonary embolism: a population-based cohort study. Arch. Intern. Med. 2000, 160, p. 761-768.
8. Prandoni, P., Villalta, S., Bagatella, P. et al. The clinical course of deep-vein thrombosis. Prospective long-term follow-up of 528 symptomatic patients. Haematologica 1997, 82, p. 423-428.
9. Pesavento, R., Bernardi, E., Concolato, A. et al. Postthrombotic syndrome. Semin Thromb. Hemost. 2006, 32, p. 744-751.
10. Douketis, J.D., Gu, C.S., Schulman, S. et al. The risk for fatal pulmonary embolism after discontinuing anticoagulant therapy for venous thromboembolism. Ann. Intern. Med. 2007, 147, p. 766-774.
11. Pengo, V., Lensing, A.W., Prins, M.H. et al. Incidence of chronic thromboembolic pulmonary hypertension after pulmonary embolism. N. Engl. J. Med. 2004, 350, p. 2257-2264.
12. Cushman, M., Tsai, A., White, R. et al. Deep vein thrombosis and pulmonary embolism in two cohorts: the Longitudinal Investigation of Thromboembolism Etiology (LITE). Am. J. Med. 2004, 117, p. 19-25.
13. Palareti, G., Legnani, C., Lee, A. et al. A comparison of the safety and efficacy of oral anticoagulation for the treatment of venous thromboembolic disease in patients with or without malignancy. Thromb. Haemost. 2000, 84, p. 805-810.
14. Schulman, S., Svenungsson, E., Granqvist, S. Anticardiolipin antibodies predict early recurrence of thromboembolism and death among patients with venous thromboembolism following anticoagulant therapy. Duration of Anticoagulation Study Group. Am. J. Med. 1998, 104, p. 332-338.
15. Hansson, P.O., Sörbo, J., Eriksson, H. Recurrent venous thromboembolism after deep vein thrombosis: incidence and risk factors. Arch. Intern. Med. 2000, 160, p. 769-774.
16. Douketis, J.D., Crowther, M.A., Foster, G.A., Ginsberg, J.S. Does the location of thrombosis determine the risk of disease recurrence in patients with proximal deep vein thrombosis? Am. J. Med. 2001, 110, p. 515-519.
17. Boutitie, F., Schulman, S., Kearon, C. et al. Factors at baseline influencing the risk of recurrence in venous thromboembolism: results of a meta-analysis on individual patient data. Blood 2003, 102, Abstract 730.
18. McRae, S., Tran, H., Schulman, S. et al. Effect of patient’s sex on risk of recurrent venous thromboembolism: a meta-analysis. Lancet 2006, 368, p. 371-378.
19. Kyrle, P.A., Minar, E., Bialonczyk, C. et al. The risk of recurrent venous thromboembolism in men and women. N. Engl. J. Med. 2004, 350, p. 2558-2563.
20. Ögren, M., Eriksson, H., Bergqvist, D., Sternby, N.H. Subcutaneous fat accumulation and BMI associated with risk for pulmonary embolism in patients with proximal deep vein thrombosis: a population study based on 23 796 consecutive autopsies. J. Intern. Med. 2005, 258, p. 166-171.
21. Schulman, S., Wåhlander, K., Lundström, T. et al. Secondary prevention of venous thromboembolism with the oral direct thrombin inhibitor ximelagatran (THRIVE III). N. Engl. J. Med. 2003, 349, p. 1713-1721.
22. Christiansen, S.C., Cannegieter, S.C., Koster, T. et al. Thrombophilia, clinical factors, and recurrent venous thrombotic events. JAMA 2005, 293, p. 2352-2361.
23. Ho, W.K., Hankey, G.J., Quinlan, D.J., Eikelboom, J.W. Risk of recurrent venous thromboembolism in patients with common thrombophilia: a systematic review. Arch. Intern. Med. 2006, 166, p. 729-736.
24. Marchiori, A., Mosena, L., Prins, M.H., Prandoni, P. The risk of recurrent venous thromboembolism among heterozygous carriers of factor V Leiden or prothrombin G20210A mutation. A systematic review of prospective studies. Haematologica 2007, 92, p. 1107-1114.
25. Ageno, W., Becattini, C., Brighton, T. et al. Cardiovascular risk factors and venous thromboembolism: a meta-analysis. Circulation 2008, 117, p. 93-102.
26. Heit, J.A., Silverstein, M.D., Mohr, D.N. et al. The epidemiology of venous thromboembolism in the community. Thromb. Haemost. 2001, 86, p. 452-463.
27. Eichinger, S., Hron, G., Bialonczyk, C. et al. Overweight, obesity, and the risk of recurrent venous thromboembolism. Arch. Intern. Med. 2008, 168, p. 1678-1683.
28. Prandoni, P., Lensing, A.W., Prins, M.H. et al. Residual venous thrombosis as a predictive factor of recurrent venous thromboembolism. Ann. Intern. Med. 2002, 137, p. 955-960.
29. Hron, G., Kollars, M., Binder, B.R. et al. Identification of patients at low risk for recurrent venous thromboembolism by measuring thrombin generation. JAMA 2006, 296, p. 397-402.
30. Bounameaux, H., Perrier, A. Duration of anticoagulation therapy for venous thromboembolism. Hematology Am. Soc. Hematol. Educ. Program. 2008, p. 252-258.
31. Levine, M.N., Raskob, G., Beyth, R.J. et al. Hemorrhagic complications of anticoagulant treatment: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004, 126, p. 287S-310S.
32. Linkins, L.A., Choi, P.T., Douketis, J.D. Clinical impact of bleeding in patients taking oral anticoagulant therapy for venous thromboembolism: a meta-analysis. Ann. Intern. Med. 2003, 139, p. 893-900.
33. Ruíz-Gimínez, N., Suárez, C., González, R. et al. Predictive variables for major bleeding events in patients presenting with documented acute venous thromboembolism. Findings from the RIETE Registry. Thromb. Haemost. 2008, 100, p. 26-31.
34. Garcia, D. Novel anticoagulants and the future of anticoagulation. Thromb. Res. 2009, 123,Suppl. 4, p. S50-S55.
35. Nishioka, J., Goodin, S. Low-molecular-weight heparin in cancer-associated thrombosis: treatment, secondary prevention, and survival. J. Oncol. Pharm. Pract. 2007, 13, p. 85-97.
36. Spinler, S.A., Wittkowsky, A.K., Nutescu, E.A., Smythe, M.A. Anticoagulation monitoring part 2: unfractionated heparin and low-molecular-weight heparin. Ann. Pharmacother. 2005, 39, p. 1275-1285.
37. Louzada, M.L., Majeed, H., Wells, P.S. Efficacy of low - molecular - weight - heparin versus vitamin K antagonists for long term treatment of cancer-associated venous thromboembolism in adults: a systematic review of randomized controlled trials. Thromb. Res. 2009, 123, p. 837-844.
38. Nishio, H., Ieko, M., Nakabayashi, T. New therapeutic option for thromboembolism−dabigatran etexilate. Expert. Opin. Pharmacother. 2008, 9, p. 2509-2517.
39. Schulman, S., Kearon, C., Kakkar, A.K. et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N. Engl. J. Med. 2009, 361, p. 2342-2352.
40. Raghavan, N., Frost, C.E., Yu, Z. et al. Apixaban metabolism and pharmacokinetics after oral administration to humans. Drug. Metab. Dispos. 2009, 37, p. 74-81.
41. AMPLIFY - EXT. A safety and efficacy trial evaluating the use of apixaban for the extended treatment of deep vein thrombosis and pulmonary embolism [on-line]. Dostupné na http://clinicaltrials.gov/ct2/show/NCT00633893.
42. Weinz, C., Schwarz, T., Kubitza, D. et al. Metabolism and excretion of rivaroxaban, an oral, direct factor Xa inhibitor, in rats, dogs, and humans. Drug. Metab. Dispos. 2009, 37, p. 1056-1064.
43. The EINSTEIN Investigators. Oral rivaroxaban for symptomatic venous thromboembolism. N. Engl. J. Med. 2010, 363, p. 2499-2510
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2011 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
-
Základy kognitivní, afektivní a sociální neurovědy
X. Kooperace - Recidiva tromboembolické nemoci a možnosti její prevence
- Glukometry v rukou pacientů, praktických lékařů a na jednotkách intenzívní péče
-
Pocty členům České lékařské společnosti J.E Purkyně
Udělení čestných medailí a čestného členství ČLS JEP - Probiotika z pohledu praktického lékaře – kmeny bakterií používané jako probiotika, jejich účinek, bezpečnost a dávkování
- Migranti a zdravotní péče z pohledu praxe v České republice
- Jak může logoterapie pomoci lékaři při doprovázení umírajících
- Rizikové faktory rozvoje inzulínové rezistence
- Sexualita seniorů
- Využití FICA dotazníku ve stáří
- Empatie v etickém přístupu lékaře k pacientovi
- Primární hyperparathyreosa při ektopicky uloženém adenomu příštítných tělísek v horním mediastinu jako příčina hyperkalcemie
- Ze života odborných společností ČLS JEP
- Hazard a patologické hráčství u seniorů
-
Miniportréty slavných českých lékařů
Profesor MUDR. František Šamberger – dermatolog a venerolog - Ze života odborných společností ČLS JEP
- Imunologické objevy ověnčené Nobelovou cenou
- Nobelovský kaleidoskop
- Držitelé Nobelovy ceny za fyziologii a medicínu
- Jubilea
-
Základy kognitivní, afektivní a sociální neurovědy
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Probiotika z pohledu praktického lékaře – kmeny bakterií používané jako probiotika, jejich účinek, bezpečnost a dávkování
- Primární hyperparathyreosa při ektopicky uloženém adenomu příštítných tělísek v horním mediastinu jako příčina hyperkalcemie
- Recidiva tromboembolické nemoci a možnosti její prevence
- Jubilea
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



