-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Moderní radioterapie karcinomu prostaty
Up-to-date radiotherapy for prostate cancer
Radiotherapy with radical prostatectomy is one of the basic methods of treatment of prostate cancer. Over the last 20 years, radiotherapy for prostate cancer underwent dramatic development. This progress was made possible in particular by introducing computer tomography, and magnetic resonance afterwards, in the planning of radiotherapy and using software to calculate the dose distribution in space. Three-dimensional conformal radiotherapy (3D-CRT) techniques and intensity modulated radiotherapy (IMRT) are associated with a better dose distribution in comparison with conventional techniques and allow the dose escalation without increasing the risk of morbidity. Further advances in technology led to image-guided radiation therapy (IGRT). It is clearly shown that the ability of radiotherapy to cure prostate cancer is dependent on the dose of radiation. Height of dose is an important predictive factor for survival without clinical and biochemical relapse. The higher the delivered dose, the higher the probability of local control. The article highlights also other aspects associated with radiotherapy for prostate cancer, such as brachytherapy, hormonal therapy in combination with radiotherapy, postoperative radiotherapy after RAPE, hypofractionation, stereotactic radiotherapy and proton beam therapy.
Keywords:
prostate cancer – radiotherapy – hormonal therapy – sequelae of radiotherapy
Autoři: P. Čoupek 1; I. Čoupková 1; T. Prochazka 2; P. Šlampa
Působiště autorů: Masarykův onkologický ústav, Brno Klinika radiační onkologie LF MU Přednosta: prof. MUDr. Pavel Šlampa, CSc. 1; Oddělení radiologické fyziky Vedoucí: Ing. Jan Garčic 2
Vyšlo v časopise: Prakt. Lék. 2014; 94(2): 64-68
Kategorie: Přehledy
Souhrn
Radioterapie společně s radikální prostatektomií patří mezi základní léčebné metody karcinomu prostaty. V průběhu posledních 20 let prodělala radioterapie karcinomu prostaty dramatický vývoj. Tento pokrok byl umožněn zejména zavedením počítačové tomografie a následně i magnetické rezonance, do plánování radioterapie a využitím softwarů pro kalkulaci rozložení dávky v prostoru. Dnes je samozřejmostí použití techniky trojrozměrné konformní radioterapie (3D-CRT) a svazku záření s modulovanou intenzitou (IMRT), což je spojeno s lepší distribucí dávky ve srovnání s technikami konvenčními a je umožněna dávková eskalace bez zvýšení rizika morbidity. Další pokrok v technologii vedl k radioterapii řízené obrazem (IGRT). Je jednoznačně prokázáno, že schopnost radioterapie vyléčit rakovinu prostaty je závislá na dávce záření. Výška dávky je významným prediktivním faktorem pro přežití bez klinického a biochemického relapsu. Čím vyšší dávku záření dodáme, tím vyšší je pravděpodobnost lokální kontroly onemocnění.
Článek poukazuje rovněž na další aspekty související s radioterapií karcinomu prostaty, jako je brachyradioterapie, hormonoterapie v kombinaci s radioterapií, pooperační radioterapie po RAPE, hypofrakcionace, stereotaktická radioterapie a léčba protonovým svazkem.Klíčová slova:
karcinom prostaty – radioterapie – hormonoterapie – komplikace radioterapieÚVOD
V rámci největší české onkologické konference „Brněnské onkologické dny“ proběhla 19. dubna 2013 celodenní vzdělávací akce „Onkologická problematika v ordinaci praktického lékaře“. Akce byla zaměřená zejména na problematiku onkologické prevence a časného záchytu nádorů. Praktický lékař se ve své ordinaci setkává rovněž s pacienty po ukončení onkologické léčby. Pacienti si s sebou přinášejí zprávy o proběhlé terapii s doporučením symptomatické péče, lokálního ošetření či kontrolního vyšetření a v případě paliativního přístupu jsou nezřídka předáváni praktikovi do trvalé péče. Praktický lékař se i v delším odstupu od proběhlé terapie setkává s komplikacemi onkologické léčby.
Jednou z velmi častých diagnóz u mužů je karcinom prostaty. Tento článek poskytuje pohled na radioterapii karcinomu prostaty v současné době.
RADIOTERAPIE KARCINOMU PROSTATY
Základními léčebnými modalitami lokalizovaného karcinomu prostaty je radikální prostatektomie a radioterapie; oba způsoby léčby dosahují stejného dlouhodobého přežití. Kurativní radioterapie karcinomu prostaty je indikována rovněž u lokálně pokročilého onemocnění. Je jednoznačně prokázáno, že schopnost radioterapie vyléčit rakovinu prostaty je závislá na dávce záření. Výška dávky je významným prediktivním faktorem přežití bez klinického a biochemického relapsu. Čím vyšší dávku záření dodáme, tím vyšší je pravděpodobnost lokální kontroly onemocnění (7, 23). V současné době je za kurativní dávku při radioterapii karcinomu prostaty považována hodnota 76–80 Gy i vyšší. Eskalace dávky záření ovšem může vést k nárůstu toxicity – urinární i gastrointestinální, neboť prostata se nachází v bezprostřední blízkosti močového měchýře a rekta. Metody moderní radioterapie umožňují aplikovat dávky dostatečně vysoké k vyléčení nádoru a současně udržet rizika vzniku nežádoucích účinků na akceptovatelné úrovni (11, 13, 24).
Obrázek 1 znázorňuje možné způsoby zevní radioterapie. Konvenční radioterapie byla v kurativní léčbě karcinomu prostaty v osmdesátých letech 20. století nahrazena trojrozměrnou konformní radioterapií (3D-CRT), v následujících letech potom došlo k rozvoji radioterapie s modulovanou intenzitou svazku (intensity modulated radiotherapy – IMRT), dalším jejím zdokonalením do současnosti je technika RapidArc. Všechny tyto modernější techniky ozáření umožňují ve srovnání s konvenční radioterapií dosáhnout lepší prostorovou distribuci dávky zejména u cílových orgánů konkávního tvaru, jakým je prostata se semennými váčky, a tím větší šetření zdravých tkání a aplikaci vyšších dávek (obr. 2). Nové techniky radioterapie bylo možné zavést do praxe díky použití počítačové tomografie (CT) a následně i magnetické rezonance (MR), při plánování radioterapie a využitím softwarů pro kalkulaci rozložení dávky v prostoru. K definování cílových objemů je dnes doporučována fúze CT a MR obrazu, která poskytuje přesnější lokalizaci prostaty. Důsledkem je menší riziko poškození okolních zdravých tkání při ozáření vysokou dávkou.
Obr. 1. Možné způsoby zevní radioterapie 
Obr. 2. Distribuce dávky v oblasti prostaty a semenných váčků 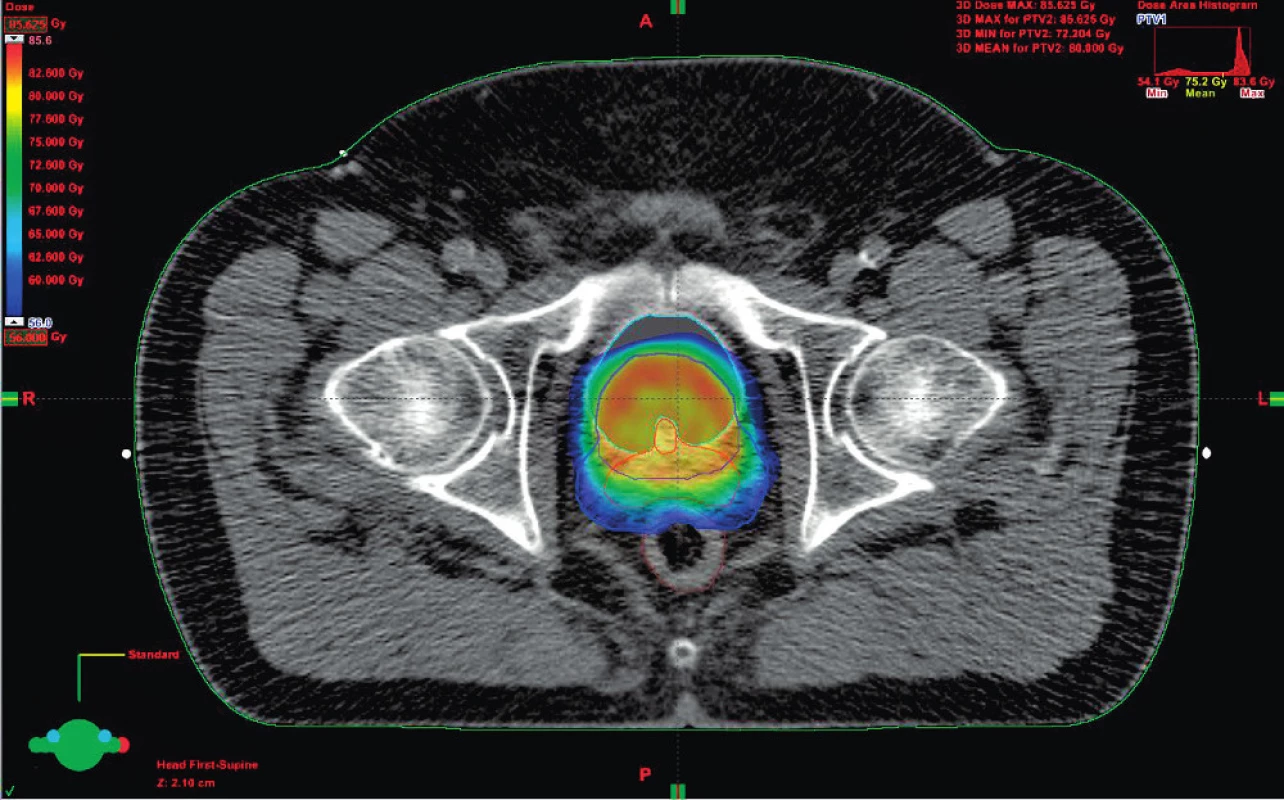
Při přesném zacílení svazku záření je problémem měnící se poloha prostaty v pánvi vlivem náplně močového měchýře a rekta. Moderní lineární urychlovače jsou vybaveny technologií umožňující obrazem řízenou radioterapii (image-guided radiotherapy – IGRT), pomocí které lze provést přímo na ozařovně portálový snímek, kilovoltážní zobrazení či dokonce jednoduché CT vyšetření a následně korekci nastavení na samotnou prostatu, ať už s použitím kontrastních markerů zavedených do prostaty, nebo bez nich (obr. 3). Denní kontrolou uložení prostaty a korekcí případné změny polohy je zaručeno přesné zacílení svazku záření a minimalizace toxického působení záření na okolní kritické orgány.
K léčbě karcinomu prostaty se používá nejen zevní radioterapie, ale i brachyterapie, to znamená vnitřní ozáření, při kterém je zdroj záření zaveden přímo do prostaty (5). Používá se ve formě dočasné intersticiální aplikace iridia-192, obvykle v kombinaci se zevní radioterapií, nebo jako trvalá implantace radioaktivních zrn jódu-125 nebo palladia-103, která se časem stanou neaktivními. Brachyterapie slouží k dalšímu zvýšení dávky v prostatě.
Hormonoterapie má po dlouhou dobu svůj nezpochybnitelný význam u metastatického a recidivujícího karcinomu prostaty. Své nezastupitelné postavení získala postupně i u lokalizovaných stadií v kombinaci s kurativní radioterapií. Pro karcinom prostaty vysokého rizika a lokálně pokročilé onemocnění je dnes léčebným standardem radioterapie s dlouhodobou neoadjuvantní, konkomitantní a adjuvantní androgen-deprivační terapií po dobu 2–3 let; touto léčbou se dosahuje nejen snížení rizika lokální recidivy a rizika distančních metastáz, ale i zlepšení celkového přežití (1). Krátkodobou androgenní blokádu (4–6 měsíců) v kombinaci s radioterapií je možno zvážit rovněž u karcinomu prostaty středního rizika rekurence. Základem medikamentózní androgenní deprivace je LHRH analog, případně v kombinaci s antiandrogenem, adjuvantně je možné použít nesteroidní androgen II. generace.
V posledních letech urologové stále častěji indikují radikální prostatektomii i u pacientů s lokálně pokročilým karcinomem prostaty. Publikované studie ukazují, že chirurgické řešení má své místo i u lokálně pokročilého onemocnění u selektovaných pacientů. S tím souvisí indikace multimodální léčby – radikální prostatektomie s pánevní lymfadenektomií, pooperační radioterapie a hormonoterapie. Tři prospektivní randomizované studie stanovily roli adjuvantní radioterapie u pT3a, pT3b a pozitivních resekčních okrajů; je zlepšena lokální kontrola a přežití bez biochemického relapsu, jedna ze studií prokázala i zlepšení celkového přežití (2, 14, 16, 17, 20, 21). Na druhé straně byly publikovány výsledky nerandomizovaných studií, které prokazují význam záchranné (salvage) radioterapie, tedy ozáření lůžka prostaty až při elevaci PSA po radikální prostatektomii (15).
Posledních několik let je možné pozorovat obnovení zájmu o hypofrakcionovanou radioterapii, neboť pomalá proliferace a dlouhý buněčný cyklus karcinomu prostaty je spojen s jeho vysokou senzitivitou k vyšším jednotlivým frakcím (více než 2 Gy), kterými je dosaženo vyššího radiobiologického účinku (8, 10). Tohoto využívá rovněž stereotaktická radioterapie, při které se aplikují na oblast prostaty vysoké dávky záření v 5 či méně frakcích (např. 5 × 7,25 Gy ob den).
Inovativní technikou současné doby je léčba protonovým svazkem jakožto atraktivní alternativa fotonového záření. Protony zasáhnou v hloubce uložené ložisko s menším poškozením okolních tkání (Braggův peak). Protonová terapie je tedy slibnou metodou, ovšem v současné době není doporučena pro rutinní použití, neboť klinické studie dosud neposkytly data, která by prokázala pro léčbu karcinomu prostaty výhodu nebo rovnocennost protonového svazku v porovnání s modernímu technikami ozařování fotonovým svazkem.
Na radioterapeutická pracoviště jsou v současné době častěji odesíláni ke konzultaci vhodnosti radioterapie pacienti vyššího věku, u kterých byl verifikován karcinom prostaty. Rozhodnutí o léčebném postupu u starších pacientů by mělo vzít v úvahu riziko úmrtí na karcinom prostaty, potenciální nežádoucí účinky léčby a upřednostnění určitého způsobu léčby samotným informovaným pacientem. Je třeba se vyvarovat postupu, při kterém by došlo ke zhoršení kvality života bez prodloužení přežití. Life expectancy (předpokládána doba života) je určujícím faktorem možného prospěchu z léčby. Při rozhodování, zda staršího pacienta s karcinomem prostaty léčit standardně, hraje roli celkový zdravotní stav, interkurence, soběstačnost pacienta a jeho nutriční stav.
Kurativní radioterapie, při které aplikujeme vysoké dávky záření, je provázena vedlejšími účinky na zdravých tkáních (3, 4, 12, 19, 22). Na rozdíl od chirurgické léčby (radikální prostatektomie – RAPE), druhé základní léčebné metody karcinomu prostaty, má radioterapie jiné spektrum nežádoucích účinků. Podle časového období vzniku rozlišujeme dva typy postradiačních reakcí: akutní (časné) a chronické (pozdní). Akutní změny po ozáření se mohou vyskytnout již během radioterapie a přetrvávají krátce i po jejím ukončení (do 1–2 měsíců), většinou spontánně odeznívají nebo mohou přecházet do chronické toxicity. Pozdní změny vznikají za několik měsíců až let po ukončení léčby zářením, obvykle do 2–3 let. Časné nežádoucí účinky radioterapie jsou důsledkem působení záření na rychle se dělící zdravé tkáně, při ozařování prostaty postihují zejména sliznici močového měchýře a sliznici konečníku. U chronických změn může dojít k poškození cév a vazivové tkáně, postupně začínají převažovat fibrotické změny, dochází k jizvení a atrofii sliznic. Po vysoké dávce záření se mohou objevit vředy, striktury, píštěle a obstrukce. Chronická toxicita zůstává jedním z hlavních problémů zhoršujících kvalitu života pacientů po radikální radioterapii karcinomu prostaty. Právě moderní technika radioterapie umožňuje přesné zacílení dávky do nádoru při maximálním šetření okolních zdravých tkání a tím i snížení komplikací na minimum.
Existuje několik stupnic pro hodnocení radiační toxicity. Nejčastěji jsou používána RTOG/EORTC (Radiation Therapy Oncology Group/ European Organisation for Research and Treatment of Cancer) kritéria toxicity, která toxicitu rozdělují do pěti stupňů (tab. 1 a 2). Za akceptovatelné se považují komplikace do stupně 2, toxicita vyššího stupně je pokládána za závažnou. Pro jednotlivé rizikové orgány jsou stanoveny limity dávek, které by neměly být překračovány. Při dodržování těchto limitů dávek v kritických orgánech je procento závažných reakcí velmi nízké.
Tab. 1. Hodnocení akutních změn po ozáření podle RTOG/EORTC 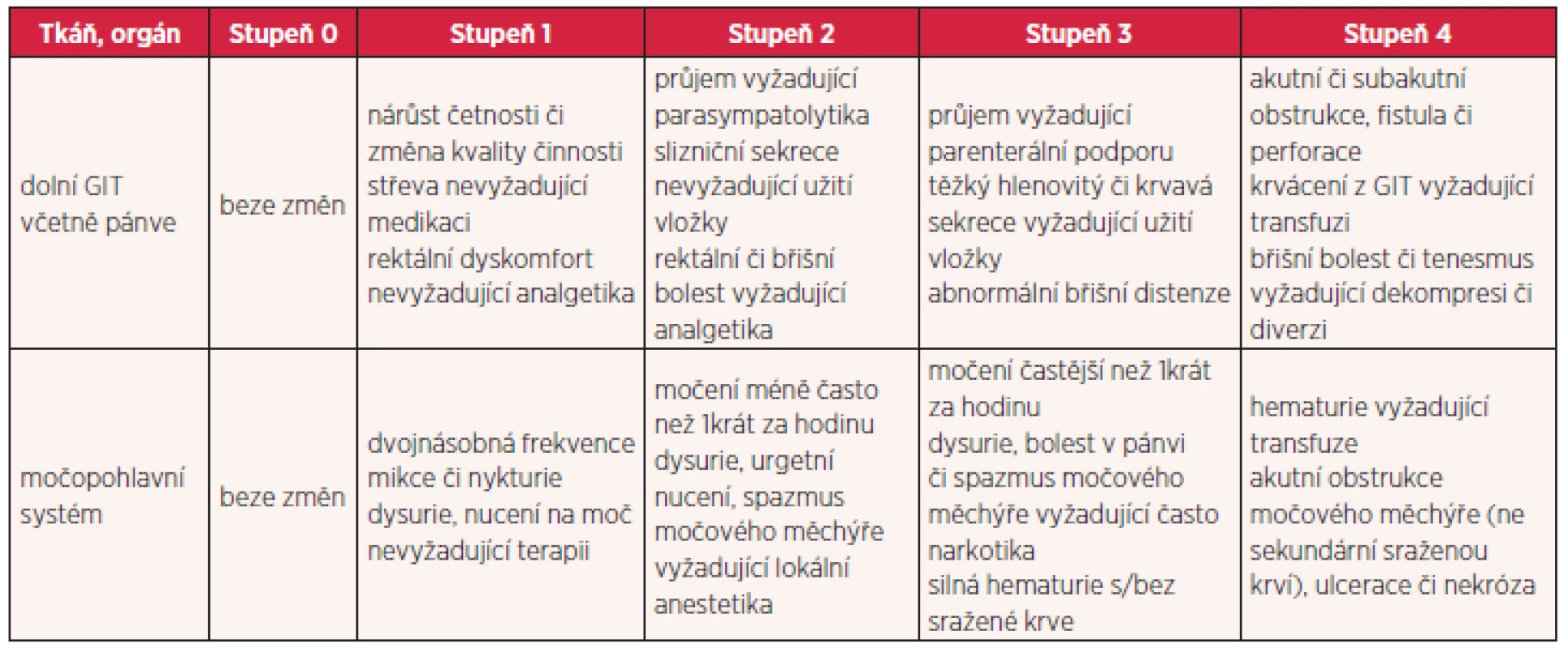
Tab. 2. Hodnocení chronických změn po ozáření podle RTOG/EORTC 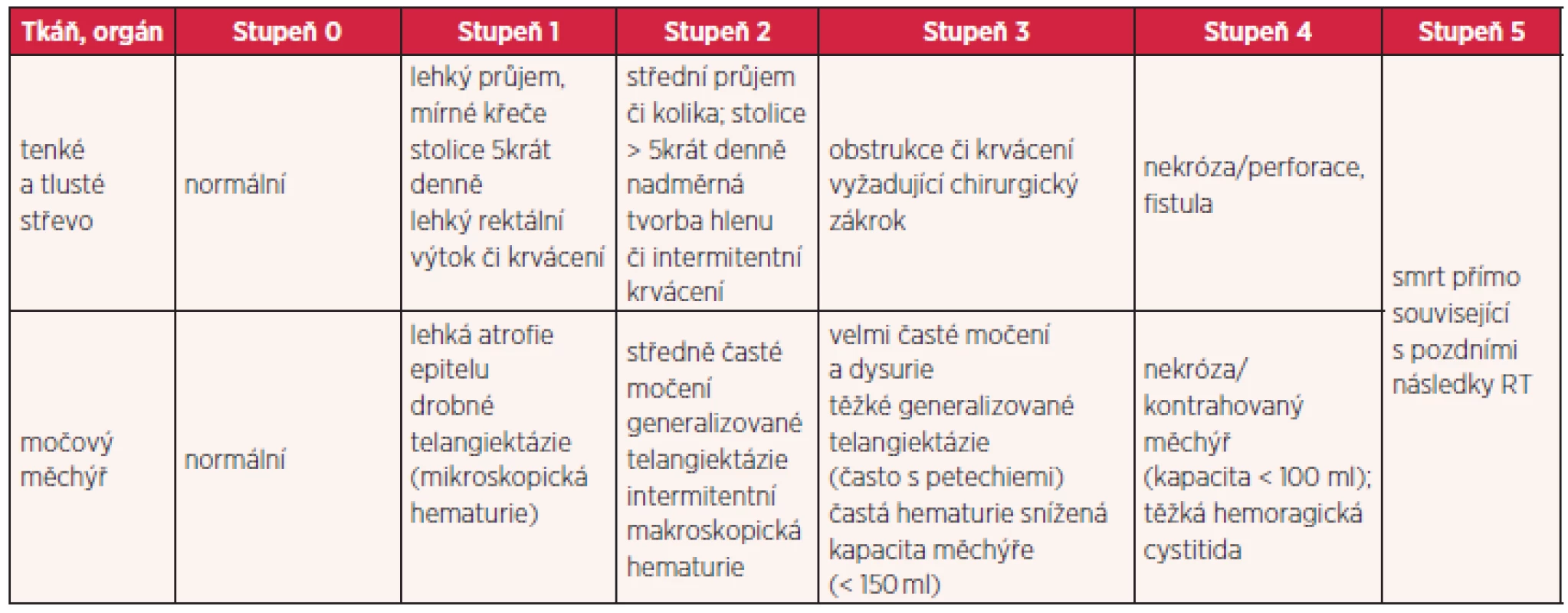
Gastrointerstinální toxicita se již v průběhu radioterapie může projevit častějšími stolicemi, tenesmy nebo průjmy v důsledku radiační proktitidy, může se objevit i krvácení z poškozené sliznice konečníku. Tyto akutní postradiační reakce se zhojí do 4–6 týdnů po skončení radioterapie. Méně často tyto potíže mohou přejít do chronického stadia, kdy přetrvávají tenesmy a enteroragie jako výraz postradiační proktitidy, která je typická svým endoskopickým obrazem a histologickým nálezem. Vzácně se objeví rektální striktury, pozdní vředy střevní sliznice, hemoragická proktitida. V době moderní radioterapie se akutní gastrointestinální toxicita stupně 2 a více pohybuje v závislosti na výši dávky a použité technice radioterapie okolo 15–30 %, chronická gastrointestinální toxicita stupně 2 a více u 10–15 % pacientů. Incidence pozdní postradiační proktitidy stupně 3 a 4 se uvádí v 0–1 %. Výskyt akutní toxicity se jeví jako prediktivní faktor chronické gastrointestinální toxicity (6).
Urinární toxicita se během ozařování projevuje jako polakisurie a dysurie v důsledku radiační cystitidy, vzácně jako akutní močová retence a hematurie. Pozdní následek radioterapie v podobě postradiační cystitidy se klinicky projevuje jako hematurie a snížení kapacity močového měchýře na podkladě fibrózy. U 1–2 % pacientů může vzniknout striktura uretry. Akutní toxicita močového traktu stupně 2 a více je popisována do 30 %, chronická urinární toxicita stupně 2 a více v 10–20 %, míra pozdní postradiační cystitidy stupně 3 a 4 se uvádí v 0–3 %.
Dalším popisovaným nežádoucím účinkem po kurativní radioterapii karcinomu prostaty je snížení potence až impotence. Zachování sexuálních funkcí se udává asi u 65–70 % pacientů, po permanentní intersticiální brachyterapii je pravděpodobnost udržení erekce dokonce až 80 %.
Po delší době (řádově několik let) po radioterapii může dojít vzhledem k subletálnímu poškození zdravých buněk ke vzniku sekundárních tumorů. U zevní radioterapie karcinomu prostaty je větší pravděpodobnost vzniku sekundárních malignit rekta a močového měchýře, eventuálně sarkomů v oblasti pánve.
Léčba lehčích akutních komplikací je symptomatická, pacient se řídí pokyny radioterapeuta. Většina akutních reakcí je zvládnutelná dietními a režimovými opatřeními, popřípadě běžnou medikamentózní léčbou, jakou jsou analgetika, spazmolytika, antidiaroika, případně chemoterapeutika a antibiotika. Ošetření závažných akutních a chronických komplikací je nutné řešit s gastroenterologem a urologem (9, 18).
ZÁVĚR
Radioterapie a radikální prostatektomie patří mezi základní léčebné metody karcinomu prostaty. Tyto dva způsoby léčby se od sebe liší spektrem nežádoucích účinků. V době moderní radioterapie lze pravděpodobnost akutní i chronické toxicity výrazně snížit zejména použitím pokročilých technik při plánování radioterapie i při vlastním ozařování.
Práce byla financována z institucionální podpory výzkumné organizace poskytnuté Ministerstvem zdravotnictví ČR Masarykovu onkologickému ústavu.
ADRESA PRO KORESPONDENCI:
MUDr. Petr Čoupek
Klinika radiační onkologie
Masarykův onkologický ústav
Žlutý kopec 7, 656 53 Brno
e-mail: coupek@mou.cz
Zdroje
1. Bolla M, de Reijke TM, Van Tienhoven G, et al. Duration of androgen suppression in the treatment of prostate cancer. N Engl J Med 2009; 360 : 2516–2527.
2. Bolla M, Van Poppel H, Collette L, et al. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC 22911). Lancet 2005; 366 : 572–578.
3. Čoupková I, Čoupek P, Krupa P, Šlampa P. Komplikace spojené s radioterapií karcinomu prostaty, jejich prevence a léčba. Urol. praxi 2011; 5 : 292–294.
4. Choe KS, Jani AB, Liauw SL. External beam radiotherapy for prostate cancer patients on anticoagulation therapy: how significant is the bleeding toxicity? Int J Radiat Oncol Biol Phys 2010; 76(3): 755–760.
5. Jabbari S, Hansen EK, Roach III M. Prostate cancer. In: Hansen EK, Roach III M. Handbook of evidence-based radiation oncology. Second edition. New York: Springer 2010; 431–477.
6. Jereczek-Fossa BA, Zerini D, Fodor K, et al. Correlation between acute and late toxicity in 973 prostate cancer patients treated with three-dimensional conformal external beam radiotherapy. Int J Radiat Oncol Biol Phys 2010; 78(1): 26–34.
7. Kuban DA, Tucker SL, Dong L, et al. Long-term results of the M. D. Anderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol Biol Phys 2008; 70 : 67–74.
8. Lim TS, Cheung PCF, Loblaw DA, et al. Hypofractionated accelerated radiotherapy using concomitant intensity-modulated radiotherapy boost technique for localized high-risk prostate cancer: Acute toxicity result. Int J Radiat Oncol Biol Phys 2008; 72(1): 85–92.
9. Macík D, Staník M, Doležel J. Léčba urologických komplikací spojených s ozářením karcinomu prostaty. Urol. praxi 2011; 5 : 295–297.
10. Marzi S, Saracino B, Petrongari MG, et al. Modeling of alpha/beta for late rectal toxicity from a randomized phase II study: conventional versus hypofractionated scheme for localized prostate cancer. J Exp Clin Cancer Res 2009; 28 : 117.
11. Odrážka K, Doležel M, Vaňásek J. Moderní metody zevní radioterapie v léčbě karcinomu prostaty. Ces Urol 2010; 14(2): 81–91.
12. Odrážka K, Doležel M, Vaňásek J, a kol. Chronická urinární toxicita 3D-CRT a IMRT karcinomu prostaty. Ces Urol 2010; 14(3): 156–163.
13. Odrážka K, Šlampa P, Soumarová R. Karcinomy prostaty. In Šlampa P, Peter J. a kol. Radiační onkologie. Praha: Galén-Karolinum 2007; 287–297.
14. Spiotto MT, Hancock SL, King CR. Radiotherapy after prostatectomy: Improved biochemical relapse-free survival with whole pelvic compared with prostate bed only for high-risk patients. Int J Radiat Oncol Biol Phys 2007; 69 : 54–61.
15. Stephenson AJ, Scardino PT, Kattan MW, et al. Predicting the outcome of salvage radiation therapy for recurrent prostate cancer after radical prostatectomy. J Clin Oncol 2007; 25 : 2035–2041.
16. Swanson GP, Thompson IM, Tangen CM, et al. Updated results of SWOG 8794: adjuvant radiation for high risk prostate cancer. Radiotherap Oncol 2008; 88(Suppl 2): 148.
17. Swanson GP, Thompson IM, Tangen CM, et al. Update of SWOG 8794: adjuvant radiotherapy for pT3 prostate cancer improves metastasis free survival. Int J Radiat Oncol Biol Phys 2008; 72 : 31.
18. Šachlová M, Ondrák M, Novotný I, Polko V. Gastrointestinální slizniční toxicita po radioterapii karcinomu prostaty. Urol. praxi 2011; 5 : 298–300.
19. Šefrová J, Paluska P, Odrážka K, Jirkovský V. Chronická gastrointestinální toxicita po zevní radioterapii karcinomu prostaty. Klin Onkol 2009; 22(5): 233–241.
20. Thompson IM, Tangen CM, Paradelo J, et al. Adjuvant radiotherapy for pathological T3 N0 M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term follow up of a randomized clinical trial. J Urol 2009; 181 : 956–962.
21. Wiegel T, Bottke D, Steiner U, et al. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radical prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate-specific antigen: ARO 96-02/AUO AP 09/95. J Clin Oncol 2009; 27(18): 2924–2930.
22. Zelefsky MJ, Levin EJ, Hunt M, et al. Incidence of late rectal and urinary toxicities after three-dimensional conformal radiotherapy and intensity-modulated radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 2008; 70 : 1124–1129.
23. Zelefsky MJ, Yamada Y, Fuks Z, et al. Long-term results of conformal radiotherapy for prostate cancer: impact of dose escalation on biochemical tumor control and distant metastases-free survival outcomes. Int J Radiat Oncol Biol Phys 2008; 71(4): 1028–1033.
24. Zelefsky MJ, Yamada Y, Kollmeier MA, et al. Long-term outcome following three-dimensional conformal/intensity-modulated external-beam radiotherapy for clinical stage T3 prostate cancer. Eur Urol 2008; 53 : 1172–1179.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článek ChudobaČlánek OmluvaČlánek Vladimír VondráčekČlánek Lymeská boreliózaČlánek eHealth Day 2014Článek JubilantiČlánek Laxativa – bezpečná a účinnáČlánek Předčasná ejakulace
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2014 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
-
Všetky články tohto čísla
- Vladimír Vondráček
-
Richard Saitz (ed.)
ADDRESSING UNHEALTHY ALCOHOL USE IN PRIMARY CARE - Lymeská borelióza
- Personalizovaná medicína a zriedkavé choroby
- eHealth Day 2014
- HELSINSKÁ DEKLARACE WMA – ETICKÉ ZÁSADY PRO LÉKAŘSKÝ VÝZKUM S ÚČASTÍ LIDSKÝCH BYTOSTÍ
- Jubilanti
-
Josef Charvát
Jak jsme ho poznávali - Chudoba
- Omluva
- Alergická bronchopulmonální aspergilóza
- Moderní radioterapie karcinomu prostaty
- Diskuze o medicíně a zdravotnictví jako součást výuky humanitních základů lékařství
- Posuzování zdravotní způsobilosti k práci v noci
- PLÁNOVANÉ AKCE SLOŽEK ČLS JEP
- Laxativa – bezpečná a účinná
- Roční zkušenosti s posuzováním stupně závislosti pro účely příspěvku na péči
- Molekulární mechanismy rezistence u nádorového onemocnění prostaty
- Předčasná ejakulace
- MUDr. Hynek Pelc, profesor sociálního lékařství a ředitel Státního zdravotního ústavu
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Posuzování zdravotní způsobilosti k práci v noci
- Laxativa – bezpečná a účinná
- Alergická bronchopulmonální aspergilóza
- Moderní radioterapie karcinomu prostaty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




