Spasticita po poranění míchy
Autoři:
J. Kříž
Vyšlo v časopise:
Rehabil. fyz. Lék., 22, 2015, No. 3, pp. 128-135.
Kategorie:
Původní práce
ÚVOD
Spasticita je jedním z negativních doprovodných jevů, které se mohou rozvinout po kompletním i nekompletním míšním poranění. Sám termín spasticita není zcela jednoznačně chápán. Někteří autoři nazývají spasticitou souhrnně svalový hypertonus, zvýrazněné šlachové reflexy a klonus (17, 42). Naopak např. Sheean vnímá spasticitu pouze jako formu hypertonu a řadí ji spolu s hyperreflexií, klonem, flexorovými a extenzorovými spasmy a dalšími projevy mezi pozitivní příznaky syndromu horního motoneuronu (40). Stejně tak se různí definice spasticity. Zatímco nejčastěji citovaný Lance ji definuje jako motorickou poruchu charakterizovanou zvýšením tonického napínacího reflexu v závislosti na rychlosti pasivního protažení spolu se zvýšenými šlachovými reflexy (29), Pandyan popisuje spasticitu jako poruchu senzomotorické kontroly na podkladě léze horního motoneuronu, manifestující se intermitentní nebo trvalou mimovolní svalovou aktivací (35). Z našeho pohledu je zajímavá definice, respektive subdefinice podle Decqa, který používá pojmy 1. vnitřní tonická spasticita – zvýraznění tonické komponenty napínacího reflexu manifestující se zvýšeným tonem, 2. vnitřní fázická spasticita – zvýraznění fázické komponenty napínacího reflexu manifestující se šlachovou hyperreflexií a klonem a 3. vnější spasticita – zvýraznění flekčních a extenčních míšních reflexů vyvolaných zevním stimulem (16). Důsledkem jsou flexorové a extenzorové spasmy, které lze svou podstatou rovněž zařadit pod fázickou spasticitu. Rozdělení na tonickou a fázickou složku spasticity je důležité z hlediska způsobu hodnocení, klinických projevů i léčebných postupů.
V literatuře nejsou k dispozici recentní epidemiologické údaje. Různí autoři uvádějí, že jsou některé symptomy spasticity přítomné u 65-78 % jedinců více než 1 rok po poranění míchy (33, 42). Skold a spol. dále uvádějí vyšší procento spasticity u krčních poranění, u kterých dominují kompletní léze, než u hrudních, kde lehce převažují léze nekompletní (42). 27-40 % jedinců vnímá spasticitu jako obtěžující a jako důvod zhoršení funkčního omezení (23, 31).
PATOFYZIOLOGIE
V současné době je obecně rozšířená klasifikace, která řadí spasticitu mezi pozitivní příznaky tzv. syndromu horního motoneuronu. Horní (centrální) motoneuron zahrnuje kromě pyramidové dráhy i tzv. dráhy mimopyramidové, které pomocí inhibičních a excitačních vláken zajišťují vyváženou míšní reflexní aktivitu. Zatímco čistá pyramidální léze způsobí pouze mírný neurologický deficit, za rozvoj pozitivních příznaků syndromu horního motoneuronu je zodpovědná léze sousedních mimopyramidových drah. Hlavní inhibiční dráhou je dorzální retikulospinální dráha vycházející z ventromediální retikulární formace. Nejdůležitější excitační dráhou je mediální retikulospinální dráha, která vychází z bulbopontinního tegmenta. Důsledkem odlišného průběhu těchto drah jsou různé klinické symptomy vyplývající z rozsahu míšního poranění. Proto může pacient s nekompletní míšní lézí při zachování excitačních vláken vykazovat závažnější formu spasticity než pacient s lézí kompletní. Hlavním důvodem rozdílu mezi cerebrální a spinální formou spasticity je dorzální retikulospinální dráha, která je pod přímým excitačním vlivem kortexu. Vyřazením tohoto excitačního vlivu při lézi kortikobulbárních vláken dochází ke snížení inhibičního působení na míšní reflexy s rozvojem pozitivních příznaků horního motoneuronu. Přímá léze dorzální retikulospinální dráhy na míšní úrovni však znamená kompletní dezinhibici těchto reflexů s výraznějšími projevy spasticity (40).
Různé pozitivní příznaky syndromu horního motoneuronu mají odlišný patofyziologický podklad podle toho, který z míšních reflexů je lézí zvýrazněný. Jedná se jak o proprioceptivní, tak o exteroceptivní reflexy. V další části uvádíme patofyziologické poznámky k těm klinických symptomům, které jsou přítomné po poranění míchy a které souhrnně označujeme zastřešujícím pojmem spasticita.
Svalový hypertonus (spasticita v užším slova smyslu)
Svalový hypertonus je způsobený na rychlosti závislým zvýšením tonického napínacího reflexu. Jedná se o proprioceptivní mono či polysynaptický reflex. Hyperexcitabilita tohoto reflexu po míšním poranění však nevzniká pouze jeho prostou disinhibicí, ale abnormálním zpracováním proprioceptivního vstupu v míše, který je patrně dán denervační hypersenzitivitou a pučením (sprouting) nových synapsí (40). V literatuře se diskutuje i možný vliv změn svalové tkáně, jako je fibróza a atrofie svalových vláken (16). Tyto změny však nemohou mít vliv v prvních měsících po úrazu, kdy je již hypertonus běžně přítomen.
Hyperreflexie a klonus
Jedná se o zvýraznění fázické komponenty napínacího reflexu. Proprioceptivní fázický napínací reflex je nazýván též hlubokým šlachovým reflexem. Šlachová hyperreflexie je zvýrazněná svalová odpověď na zevně aplikovaný poklep na hluboké šlachy. Klonus je definován jako mimovolní rytmická kontrakce svalu, která může přecházet v oscilaci distálního kloubu. Zatímco hyperreflexie je důsledkem snížené presynaptické inhibice, na klonu se kromě přerušení descendentních vlivů pravděpodobně podílí i centrální generátor v míše, který rytmicky aktivuje alfa motoneurony (16).
Flexorové spasmy
Flexorové spasmy jsou u spinálních pacientů obvyklé, ale jejich patofyziologie se od předchozích symptomů liší. Nejsou způsobeny abnormálními proprioceptivními reflexy, ale mají podklad v normálních obranných flexorových reflexech, které ztratily supraspinální inhibici a staly se hyperexcitabilními. Jsou provokované aferentními impulzy z kůže, podkoží, svalů a kloubů (1, 32).
Extenzorové spasmy
V patofyziologii extenzorových spasmů hrají pravděpodobně zásadní roli proprioceptory v kyčelním kloubu. Odpověď na způsobenou extenzi v kyčli zahrnuje aktivaci svalů ve všech segmentech dolní končetiny. To naznačuje její zprostředkování polysynaptickými drahami zahrnující aktivaci interneuronálních okruhů, které zajišťují míšní reflexní kontrolu lokomoce (48).
KLINICKÝ OBRAZ
Spasticita u pacientů po poranění míchy se v některých svých projevech liší od cerebrální formy. Po poškození mozku je nález spíše fokální a kromě spasticity a dalších pozitivních příznaků syndromu horního motoneuronu dominují negativní příznaky jako paréza, zvýšená únavnost a zkrácení svalu. Klinické hodnocení spasticity je zaměřeno na její dopad na funkci jednotlivých svalů a léčba je pak vedena tak, aby došlo k co nejvýraznějšímu zlepšení funkce postiženého segmentu. U pacientů po poranění míchy je spasticita spíše generalizovaná zpravidla na dolních končetinách a trupu, nezřídka při plegii, přičemž většinou nemá výraznější podíl na případném vzniku kontraktur. Kontraktury se častěji rozvíjejí následkem dysbalancí mezi svalem s normální svalovou sílou a plegickým svalem (pacient s neurologickou úrovní léze C6 není schopen provést extenzi v lokti a aktivním pohybem drží končetinu ve flexi), nebo sedem ve vozíku (protrahovaná flexe v kyčelním a kolenním kloubu). Proto není naším cílem hodnotit spasticitu jednotlivých svalů, ale získat celkový obraz, včetně vlivu na běžné denní činnosti.
Jak je uvedeno v patofyziologii, spasticita u spinálních pacientů se může projevovat svalovým hypertonem, šlachovou hyperreflexií, klonem, flexorovými a extenzorovými spasmy. Kromě občasného zjištění těžších projevů spasticity u pacientů s nekompletní míšní lézí proti pacientům s lézí kompletní nebyl dosud zjištěn konzistentní vzorec závislosti mezi intenzitou jednotlivých složek spasticity a neurologickou úrovní či rozsahem léze, dobou od úrazu ani jinými faktory.
Obecně může mít spasticita u spinálních pacientů některé pozitivní aspekty, jako je stabilnější postura v sedu, případně ve stoji, rovněž může usnadnit přesuny nebo jiné běžné denní aktivity. Spasticita může také zmírnit svalovou atrofii, která by mohla nepřímo ovlivnit funkční nezávislost, chůzi a incidenci zlomenin (19). Bennegard a Karlsson zjistili, že spasticita zvyšuje resorpci glukózy, a tím snižuje riziko rozvoje diabetu (7). Většinou však převažují negativní vlivy. Tonická složka spasticity může zhoršit mobilitu na vozíku, přesuny, změny polohy na lůžku, může komplikovat hygienu nebo autokatetrizaci. Rovněž se může stát zdrojem postupně se fixujících svalových kontraktur a zvýšeného rizika rozvoje dekubitů. Při převaze fázické složky spasticity se významně zvyšuje riziko pádu při jakýchkoliv přesunech, ale i při běžné jízdě na vozíku. Flexorové spasmy jsou často vnímány pacientem jako bolestivé, mohou rušit spánek a vést k únavě a rozvoji depresivního syndromu. V případě motoricky nekompletní míšní léze může být na končetinách i trupu přítomná oslabená volní hybnost, kterou pacient kvůli spasticitě antagonického svalu nedokáže využít. Pacienti, kteří jsou schopni chůze, mohou mít vlivem spasticity zhoršený chůzový stereotyp. Často je nutné řešit symptomy spojené se spasticitou již při jejím nástupu po odeznění míšního šoku, protože mohou negativně ovlivnit průběh rehabilitace.
V průběhu poúrazového období může docházet k určitým změnám v intenzitě spasticity. Pravidelně dochází ke zhoršení spastických projevů při ukončení pobytu v rehabilitačním ústavu a návratu do domácího prostředí, kde chybí pravidelná pohybová aktivita. Spasticita se však může zhoršit i při působení různých škodlivých stimulů, které zvyšují aferentní působení na napínací reflex. Často se jedná o uroinfekce, obstipaci, dekubity nebo jiné kožní afekce (39). Součástí klinického hodnocení spasticity by proto mělo být vždy důsledné komplexní vyšetření. Při senzitivním deficitu může být zvýšená spasticita jediným příznakem závažného onemocnění.
Možnosti klinického hodnocení
Kvantitativní zhodnocení tonické a fázické složky spasticity je důležité pro rozhodnutí o terapeutickém postupu a sledování jeho efektivity. Bohužel, i když je spasticita u spinálních pacientů dobře diagnostikovatelná, je obtížné jí kvantifikovat. Neurofyziologické metody nabízejí přesnější objektivizaci, v klinické praxi však nemusejí být běžně dostupné. Nejrozšířenější jsou hodnotící škály vycházející z klinického vyšetření nebo dotazníkového šetření. Jejich nevýhodou je však většinou nízká úroveň reliability.
Ashworthova / Modifikovaná Ashworthova škála (AS / MAS)
Ashworthova škála byla původně vyvinuta k hodnocení antispastického efektu carisoprodolu u pacientů s roztroušenou sklerózou (6). Škála hodnotí odpor, který klade vyšetřovaný sval v průběhu pasivního protažení. Jedná se tedy o vyšetření míry zvýšení svalového tonu. Původní pětibodovou stupnici rozšířili v roce 1987 Bohannon a Smith o stupeň 1+ a upravili název na „Modifikovaná Ashworthova škála“ (10) (tab. 1). Problém MAS je v diskrepanci výsledků mezi vyšetřujícími kvůli nejednoznačné interpretaci jednotlivých stupňů, ale také ve změnách reflexní odpovědi i viskoelastických vlastností svalů při opakovaném vyšetření (45). Proto je třeba průběh vyšetření maximálně standardizovat a hodnotit pouze první vyšetřovaný pohyb po určitém, nejlépe 5minutovém klidovém intervalu. Důležité také je, aby vyšetření probíhalo ve stejnou denní dobu.
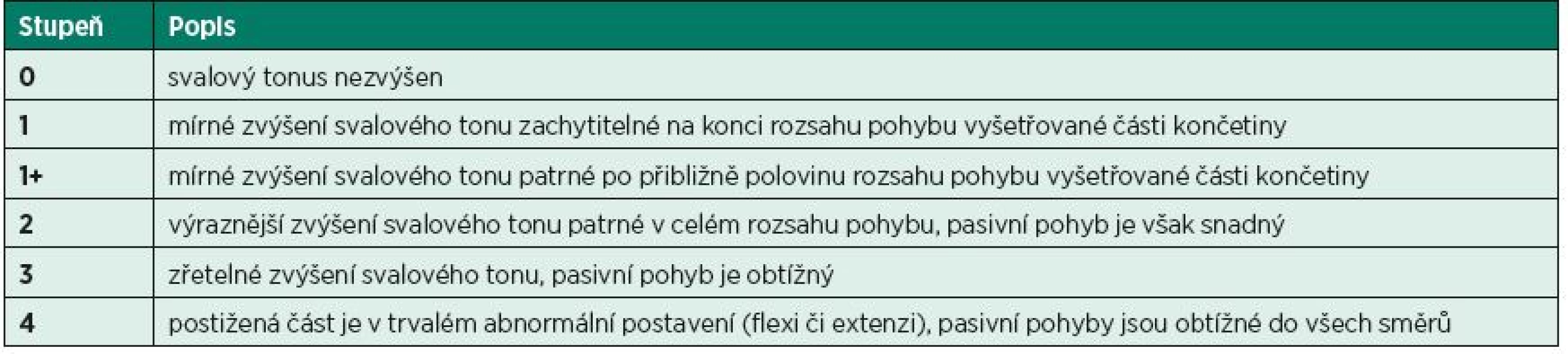
Několik studií hodnotilo reliabilitu MAS u spinálních pacientů pro svaly dolních končetin. Lee nalezl odpovídající inter-rater reliabilitu pro adduktory a flexory DK (30), zatímco v pravděpodobně dosud poslední studii Cravena a Morrise na 20 pacientech v chronickém stadiu po poranění míchy byla nalezena nedostatečná inter-rater a inter-session reliabilita pro MAS hodnotící spasticitu dolních končetin. Na základě těchto výsledků autoři doporučují hledat jiné metody hodnocení (15). Nicméně podle našich zkušeností může být MAS efektivním klinickým nástrojem pro zhodnocení tonické složky spasticity.
Pennovo skóre frekvence spasmů (PSFS)
Pennovo skóre bylo vytvořeno k hodnocení efektu intrathekálního baclofenu u 20 pacientů se spasticitou způsobenou roztroušenou sklerózou nebo míšním poraněním (37). Autor hodnotil na 5bodové stupnici počet vyvolaných nebo spontánních spasmů až k maximu více než 10 spontánních spasmů za hodinu. Slabou stránkou PSFS může být závislost na spolupráci a „objektivitě“ pacienta. Desinterpretace PSFS může také vycházet ze změn intenzity spasmů v průběhu denní doby.
Reliabilita pro hodnocení spasticity pomocí PSFS nebyla dosud stanovena (22). Nicméně byla částečně stanovena validita hodnocením korelací s dalšími škálami, jako je AS nebo „Nástroj pro hodnocení míšních spastických reflexů“ (SCATS) (8).
Nástroj pro hodnocení míšních spastických reflexů (SCATS)
Autoři Benz a spol. vytvořili SCATS pro hodnocení fázické složky spasticity. Vyšetření má 3 složky pro zhodnocení klonu, flexorových a extenzorových spasmů. Každá složka je hodnocena zvlášť a škálována 4bodovou stupnicí. Výsledek tedy tvoří 3 samostatné hodnoty. To umožňuje přesnější hodnocení, ale obtížnější korelaci s dalšími hodnotícími škálami (8).
Autoři uvádějí vysokou korelaci všech tří složek SCATS s kinematickými a elekromyografickými nálezy. Vysoká korelace byla také pozorována mezi extenzorovými spasmy a AS pro flexory kyčle a kolene a plantární flexory hlezna. S PSFS byla nalezena korelace pouze pro klonus.
Nástroj pro hodnocení spasticity po poranění míchy (SCI-SET)
SCI-SET byl vytvořen k hodnocení vlivu spasticity na běžný denní život lidí po poranění míchy. Autoři Adams a spol. formulovali 35 otázek týkajících se různých běžných denních činností, které by mohly být spasticitou ovlivněny. Na sedmibodové stupnici (od -3 pro extrémně problematický po +3 pro extrémně užitečný) pacienti označují, jaký vliv měla spasticita na každou dotazovanou aktivitu, a to během posledních sedmi dnů (3).
Autoři zkoumali inter-rater reliabilitu a konstruktovou validitu vytvořeného dotazníku. Reliabilita byla zkoumána opakováním dotazníku 3x po týdnu a výsledek byl dostatečný. Validita byla zkoumána korelací s dalšími škálami dotazníkového typu – Funkční skóre nezávislosti (FIM), PSFS a dotazníkem kvality života po poranění míchy (QLI SCI verze III). Zatímco korelace s FIM byla nízká, korelace s ostatními škálami byla přiměřená až vysoká.
Škála svalové dráždivosti (MES)
Pracoviště, která se v České republice věnují léčbě a rehabilitaci pacientů po poranění míchy, standardně využívají k hodnocení spasticity modifikovanou Ashworthovu škálu. Při zachování jednotných vyšetřovacích postupů a podmínek je stupnice 0-4 dostačující. Tato škála se však spíše soustřeďuje na tonickou složku spasticity – svalový hypertonus jako odpor při pasivním protažení svalu. Naším záměrem bylo vytvořit podobně jednoduchou škálu pro hodnocení fázické složky spasticity. Nazvali jsme ji škálou svalové dráždivosti a měla by odrážet pohotovost svalu ke spasmu či klonu. Zvolení stupnice 0-4 bylo cílené kvůli lepšímu porovnávání výsledků.
Principem této škály je kvantitativní zhodnocení motorické odpovědi svalu na podráždění. Kombinaci motorické a senzitivní stimulace jsme zvolili kvůli pokrytí proprioceptivních i exteroceptivních impulzů. Hodnocení je v rozsahu žádného spasmu svalu nebo svalové skupiny při senzitivní nebo motorické stimulaci až po generalizovanou spastickou reakci na jakýkoliv podnět (tab. 2).

V současné době probíhá hodnocení validity a reliability testu. Pokud budou výsledky uspokojivé, nabídneme škálu, včetně detailního popisu postupu a videodokumentace, ostatním pracovištím jako jednoduchý klinický nástroj, který v kombinaci s MAS přispěje ke komplexnímu zhodnocení spinální spasticity. Výstupy z obou hodnocení by měly být podkladem pro rozhodnutí o efektivní terapii a pro kontrolu její účinnosti.
LÉČBA
Terapie je vedená odlišným způsobem u pacientů v postakutním stadiu a u pacientů rok a více po úrazu, u kterých je zdravotní stav stabilizovaný. Rozdíly mohou být také mezi pacienty s motoricky kompletní a motoricky nekompletní míšní lézí, kde může spasticita interferovat s volní hybností.
V postakutním stadiu po odeznění míšního šoku dochází k postupnému nárůstu spasticity. Pokud spasticita dobře reaguje na fyzioterapeutické techniky a nezpůsobuje bolest nebo jiné komplikace, využíváme její pozitivní efekt na zpevnění postury a nezahajujeme medikamentózní terapii. V této fázi jsou důležité pravidelné konzultace lékaře, fyzioterapeuta a ergoterapeuta, aby se včas zachytily změny intenzity v neprospěch pacienta. Pokud se spasticita rozvine do stadia, kdy již brání intenzivní rehabilitaci, nebo působí pacientovi bolest, popřípadě poruchy spánku, je vhodné nasadit nízkou dávku medikace. U pacientů s motoricky nekompletní lézí jsou důležitá další kritéria, a to do jaké míry brání spasticita aktivnímu pohybu v daném segmentu, ale také do jaké míry snižuje aktivní pohyb antispastická medikace.
V chronickém stadiu onemocnění je cílem dosáhnout dlouhodobé rovnováhy mezi užitečným a škodlivým efektem spasticity. Je důležité odhalit, které aktivity vnímá pacient kvůli spasticitě jako omezující, klinicky zhodnotit, zda nedochází vlivem spasticity ke zdravotním komplikacím a upravit medikaci, případně doporučit určité prospěšné režimové změny. Většina jedinců v chronické fázi po míšním poranění je na projevy spasticity adaptovaná a schopná její intenzitu do jisté míry ovlivnit.
Nefarmakologická léčba
Nezbytnou součástí léčby spasticity je fyzioterapie, a to nejen jako terapie první volby, ale také před nebo po zavedení medikamentózní či chirurgické léčby. Fyzioterapie má kromě krátkodobého vlivu na snížení spasticity i vliv na prevenci komplikací se spasticitou spojených. Cílem je nastavení optimálních pohybových vzorců, umožnění co nejefektivnějšího využití funkčních schopností, minimalizace kontraktur a deformit a snížení bolesti (38). K tomu lze využít různé techniky a koncepty. Uvedené postupy jsou ověřené dosavadními klinickými zkušenostmi ze spinálních pracovišť v České republice.
Jedním ze základních postupů je pravidelné polohování. Nocicepce způsobená tlakem při déletrvající strnulé poloze nebo neoptimálním postavením kloubů může zvyšovat spasticitu. Polohování tak pomůže spasticitu snížit a má rovněž preventivní efekt na tvorbu kontraktur a deformit. Pravidelné změny polohy jsou důležité vleže, ale i vsedě ve vozíku. K polohování lze v indikovaných případech využít i různé individuální dlahy nebo ortézy. Výhodná je kombinace dlahování a fyzioterapie. Nasazení dlahy před cvičením pomůže připravit měkké tkáně, v průběhu terapie lze fixovanou končetinu lépe funkčně využít, po terapii umožní dlaha krátkodobě udržet efekt protažení. Pro zvýšené riziko vzniku dekubitů při senzitivním deficitu je nezbytné každou dlahu individuálně upravit, přizpůsobit délku dlahování a po sejmutí provádět detailní kontroly predilekčních míst.
Pasivní cvičení má kromě prevence kontraktur i další pozitivní efekt. Způsobuje přechodné snížení intenzity spastické odpovědi na pasivní protažení (4). Efekt může přetrvávat i několik hodin (26). Dále může způsobit biomechanické změny ve svalech a dalších měkkých tkáních (24). Rytmický pasivní pohyb lze u spastického pacienta aplikovat s využitím přístrojů typu MOTOMed pro cyklický pohyb dolních končetin. I když převážná většina pacientů subjektivně udává po terapii významné snížení spastických projevů, autoři Kakebeeke a spol. při objektivizaci výsledků dynamometrem nenalezli u 10 subjektů s míšní lézí signifikantní snížení spasticity po hodině a půl cyklického pohybu (25).
Vertikalizace do stoje na vertikalizačním stole nebo stojanu působí antispasticky prolongovaným protažením plantárních flexorů hlezna. Mechanismus není zcela objasněn, pravděpodobně dochází ke snížení excitability vlivem působení z kožních a kloubních receptorů na spinální motorické neurony. Efekt přetrvává déle než u protažení, někdy i do druhého dne (9). Adams a spol. porovnávali antispastický efekt stoje na vertikalizačním stojanu s tréninkem chůze na pohyblivém chodníku v odlehčení u pacientů v chronickém stadiu po míšním poranění s využitím široké škály hodnotících nástrojů. Po jednom cvičení měl pohyblivý chodník lepší efekt na svalový tonus a flexorové spasmy než vertikalizační stůl. Podobné výsledky byly patrné i po 4týdenní terapii. Naopak extenzorové spasmy se snížily více po stoji na vertikalizačním stole (2). Wirz a spol. sledovali efekt tréninku na pohyblivém chodníku v odlehčení na přístroji Lokomat u chronických spinálních pacientů. Kromě chůzových testů hodnotili efekt na spasticitu pomocí MAS a SCATS s pozitivním výsledkem pouze u extenzorových spasmů (47). Boutilier a spol. hodnotili vliv dynamického stoje na přístroji Segway (elektrický dopravní prostředek využívající ke svému pohybu dynamickou stabilizaci) na spasticitu, bolest a únavu u osmi pacientů po poranění míchy. Dynamický stoj měl krátkodobý efekt na snížení spasticity, stejně tak jako snížil bolest a únavu (11).
Dalším fyzioterapeutickým prostředkem, který pomáhá přechodně snížit spasticitu u pacientů v postakutní fázi po poranění míchy, je aktivní cvičení. K tomu se využívají různé globální modely a pohybové vzory. Základem je celkové nastavení postury, které určuje kvalitu cvičení. Poté se lze zaměřit na konkrétní spasticitou ovlivněný segment. Vychází se z centrovaného postavení, které může přechodně snížit spasticitu a pomoci lepší aktivaci paretických svalů. V centrovaném postavení lze použít jakoukoliv techniku aktivního cvičení (proti odporu, manuální dopomoc) s důrazem na vyváženou aktivaci agonistů a antagonistů. V terapii se kombinují metody na neurofyziologickém podkladě, např. prvky proprioceptivní neuromuskulární facilitace (PNF), dynamická neuromuskulární stabilizace (DNS), Vojtova reflexní lokomoce nebo Bobath koncept. Dlouhodobý efekt těchto metod však nebyl dosud experimentálně ověřen.
Za jistou formu terapie aktivním pohybem lze považovat funkční elektrickou stimulaci (FES). Autoři Krause a spol. srovnávali antispastický efekt pasivního cyklického pohybu dolních končetin a cyklického pohybu s využitím FES u 5 pacientů s kompletní hrudní míšní lézí. Při hodnocení pomocí MAS a Pendulum testu bylo patrné signifikantně výraznější snížení svalového tonu po FES (28). Nicméně další práce nepotvrdily antispastický efekt FES na dostatečném počtu spinálních pacientů.
Farmakologická léčba
Medikamentózní perorální terapie je standardem v léčbě spasticity. Volba preparátu se řídí podle toho, zda v klinickém obrazu převažuje tonická či fázická složka spasticity. Při převaze tonické složky je lékem první volby baklofen, případně v kombinaci s tizanidinem. Pokud dominuje složka fázická, je vhodným preparátem pregabalin, na noc je možné přidat clonazepam. Po nasazení medikace je třeba pacienta dále sledovat a opakovaně hodnotit jak změny v intenzitě spasticity, tak eventuální výskyt nežádoucích účinků.
Baklofen je derivát inhibičního neurotransmitéru gama-aminomáselné kyseliny (GABA). Ke snížení spasticity dochází pravděpodobně zvýšením inhibičních vlivů na míšní napínací reflex skrze zvýšení presynaptické inhibice (26). Baklofen má zpravidla největší efekt na snížení svalového hypertonu, ale také na snížení flexorových spasmů (20). Nicméně je popisován i negativní vliv na funkční schopnosti jako je stoj a chůze (26). Autoři Angeli a spol. nedávno popsali případ muže se senzitivně nekompletní krční míšní lézí, u kterého se po vysazení baklofenu 33 měsíců od úrazu objevila hybnost na dolních končetinách (5). Léčba baklofenem se většinou zahajuje dávkou 3x5 mg až 3x10 mg a zvyšuje se až na maximální dávku 4x25 mg. Užívání mohou negativně ovlivnit některé nežádoucí účinky, jako je ospalost, závratě, ataxie, zmatenost. Podobné příznaky se ovšem mohou objevit i po náhlém vysazení (20).
Tizanidin je centrálně působící alfa2 adrenergní agonista inhibující uvolnění excitačních aminokyselin v míšních interneuronech, které zvyšují presynaptickou inhibici motoneuronů (46). Mirbagheri a spol. popsali významný efekt na snížení spasmů bez ovlivnění vnitřních vlastností svalu (34). Léčbu zahajujeme dávkou 2x2 mg, která může být navýšena až na 36 mg denně. Nejčastější vedlejší účinky jsou sedace, hypotenze, oslabení svalů a únava (41), i když například Kita a Goodkin nezaznamenali s pomocí svalového testu snížení svalové síly (27).
Gabapentin je antikonvulzivum s chemickou strukturou podobnou GABA bez receptorové aktivity. Autoři Gruenthal a spol. zkoumali efekt gabapentinu na spasticitu u spinálních pacientů. Tři ženy a 25 mužů se podrobili placebem kontrolované studii, ve které se prokázalo snížení spasticity po 48 hodinách podávání gabapentinu. I když rozdíly v klinickém hodnocení spasticity po podání gabapentinu a placeba byly relativně malé, mnoho pacientů uvedlo zásadní zlepšení kvality života spojené s užíváním gabapentinu (21).
Pregabalin byl podobně jako gabapentin vyvinutý k léčbě epileptických záchvatů, ale jeho užití bylo rozšířeno na neuropatickou bolest a spasticitu. Bradley a Kirker zhodnotili retrospektivně efekt pregabalinu u 22 pacientů po poranění míchy a u části z nich nalezli snížení úrovně spasticity. Nicméně 36 % pacientů přerušilo léčbu pro významné vedlejší příznaky (12). Autoři Braid a spol. zkoumali na 12 subjektech po poranění míchy, užívajících alespoň rok pregabalin v indikaci spasticity, zda při postupném snížení dávky dojde k jejímu nárůstu. Výsledky ukázaly, že u těchto pacientů došlo po snížení dávky ke statisticky významnějšímu nárůstu spasticity než bolesti (13).
Clonazepam je benzodiazepin, který stejně jako diazepam zvyšuje účinnost přenosu GABA. Výsledkem je zvýšení presynaptické inhibice aferentních neuronálních zakončení s následnou redukcí mono a polysynaptických reflexů (14). Proto má pozitivní efekt na snížení hyperreflexie a bolestivých spasmů. Na rozdíl od diazepamu způsobuje menší sedaci s nižším rizikem vzniku závislosti. Typicky se využívá k redukci nočních spasmů (26).
Botulotoxin je neurotoxin produkovaný anaerobní bakterií Clostridium botulinum. Pro léčbu spasticity byl poprvé použit v roce 1989 (26). Působí na nervosvalové ploténce, kde inhibuje uvolnění acetycholinu z presynaptických motorických axonů. Délka působení je uváděna mezi 2 a 6 měsíci. Botulotoxin je používán jako lék první volby u fokální spasticity kvůli jeho efektu na snížení bolesti a svalového tonu a zlepšení rozsahu pohybu, funkce a schopnosti chůze (24). Kvůli generalizované spasticitě u spinálních pacientů není léčba botulotoxinem standardně využívána, i když v omezených indikacích může aplikace do izolovaných svalových skupin zlepšit ošetřovatelskou péči, hygienu nebo funkční aktivity (26). Na našem pracovišti jsme využili botulotoxin ve dvou indikacích. V postakutním stadiu aplikace do adduktorů kyčelních kloubů u dvou pacientů zlepšila osobní hygienu a autokatetrizaci, u 6 chronických pacientů schopných chůze při nekompletní míšní lézí byl botulotoxin aplikován do adduktorů kyčle a m. rectus femoris nebo do hamstringů s pozitivním efektem na zlepšení postury a chůzového stereotypu.
V případě těžké formy spasticity, která nereaguje na perorální léčbu, lze aplikovat baklofen intrathekálně. Baklofenová pumpa se implantuje subkutánně do oblasti břišní stěny a katetr se zavádí do páteřního kanálu z bederní krajiny do úrovně T10-12 (44). Jednou z hlavních výhod je výrazná redukce vedlejších nežádoucích účinků proti perorálnímu podání. Byl popsán pozitivní efekt intrathekálního baklofenu na snížení hypertonu, frekvenci spasmů a hyperreflexii, a na zlepšení kvality života usnadněním přesunů, ošetřovatelské péče a schopnosti chůze (18). V poslední době jsme však zaznamenali dva případy nežádoucího efektu intrathekálního podávání baklofenu u našich pacientů. Významné snížení tonu posturálních svalů vedlo k dekompenzaci neurogenní skoliózy, zhoršení sedu na vozíku a rozvoji bolestí zad. Autoři Penn a Kroin popsali jiné riziko intrathekálního podávání baklofenu, a to při navyšování dávky rozvoj postupné tolerance, která si vynutila změnu za intrathekální morfin (36). Podobný případ 36letého muže po kompletní míšní lézi v úrovni T6, u kterého musel být intrathekální baklofen nahrazen morfinem, popsali Soni a spol. (43).
ZÁVĚR
Spasticita je častou komplikací u pacientů po poranění míchy. Je snaha ji ovlivnit fyzioterapií, při nedostatečném efektu se nasazuje antispastická medikace. V postakutní fázi je důležité zhodnocení tonické a fázické složky za účelem správného nastavení terapie. V chronickém stadiu je hlavním měřítkem subjektivní vnímání omezení, které spasticita pacientovi působí.
Adresa ke korespondenci:
MUDr. Jiří Kříž, Ph.D
Klinika rehabilitace a tělovýchovného lékařství 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: jiri.kriz@fnmotol.cz
Zdroje
1. ADAMS, M. M., HICKS A. L. Spasticity after spinal cord injury. Spinal Cord, 43, 2005, 10, s. 577-586.
2. ADAMS, M. M., HICKS, A. L. Comparison of the effects of body-weight-supported treadmill training and tilt-table standing on spasticity in individuals with chronic spinal cord injury. J. Spinal Cord Med., 34, 2011, 5, s. 488-494.
3. ADAMS, M. M., GINIS, K. A., HICKS, A. L. The spinal cord injury spasticity evaluation tool: development and evaluation. Arch. Phys. Med. Rehabil., 88, 2007, 9, s. 1185–1192.
4. ALBERT, T., YELNIK, A. Physiotherapy for spasticity. Neurochirurgie, 49, 2003, 2–3, s. 239-246.
5. ANGELI, C., OCHSNER, J., HARKEMA, S.: Effects of chronic baclofen use on active movement in an individual with a spinal cord injury. Spinal Cord, 50, 2012, 12, s. 925-927.
6. ASHWORTH, B.: Preliminary trial of carisoprodol in multiple sclerosis. Practitioner, 192, 1964, s. 540-542.
7. BENNEGARD, G. M., KARLSSON, A. K.: Higher glucose uptake in paralysed spastic leg. Spinal Cord, 46, 2008, 2, s. 103-106.
8. BENZ, E. N., HORNBY, T. G., BODE, R. K., SCHEIDT, R. A., SCHMIT, B. D.: A physiologically based clinical measure for spastic reflexes in spinal cord injury. Arch. Phys. Med. Rehabil., 86, 2005, 1, s. 52-59.
9. BOHANNON, R. W.: Tilt table standing for reducing spasticity after spinal cord injury. Arch. Phys. Med. Rehabil., 74, 1993, 10, s. 1121-1122.
10. BOHANNON, R. W., SMITH, M. B.: Interrater reliability of a modified Ashworth Scale of muscle spasticity. Phys. Ther., 67, 1987, 2, s. 206-207.
11. BOUTILIER, G., SAWATZKY, B. J., GRANT, C., WIEFELSPUETT, S., FINLAYSON, H.: Spasticity changes in SCI following a dynamic standing program using the Segway. Spinal Cord, 50, 2012, 8, s. 595-598.
12. BRADLEY, L. J., KIRKER, S. G.: Pregabalin in the treatment of spasticity: a retrospective case series. Disabil. Rehabil., 30, 2008; s. 1230-1232.
13. BRAID, J. J., KIRKER, S. G., BAGULEY, I. J.: Spasticity increases during pregabalin withdrawal. Brain Inj., 27, 2013, 1, s. 120-124.
14. BURCHIEL, K. J., HSU, F. P.: Pain and spasticity after spinal cord injury: mechanisms and treatment. Spine, 26, 2001, Suppl., s. S146-S160.
15. CRAVEN, B. C., MORRIS, A. R.: Modified Ashworth scale reliability for measurement of lower extremity spasticity among patients with SCI Spinal Cord, 48, 2010, 3, s. 207-213.
16. DECQ, P.: Pathophysiology of spasticity. Neurochirurgie, 49, 2003, 2–3, s. 163–184.
17. DIETZ, V.: Spastic movement disorder. Spinal Cord, 38, 2000, 7, s. 389-393.
18. EMERY, E.: Intrathecal baclofen. Literature review of the results and complications. Neurochirurgie, 49, 2003, 2–3, s. 276-288.
19. GORGEY, A. S., DUDLEY, G. A.: Spasticity may defend skeletal muscle size and composition after incomplete spinal cord injury. Spinal Cord, 46, 2008, 2, s. 96-102.
20. GRACIES, J. M., NANCE, P., ELOVIC, E., MCGUIRE, J., SIMPSON, D. M.: Traditional pharmacological treatments for spasticity. Part II: General and regional treatments. Muscle Nerve Suppl., 6, 1997, s. 92-120.
21. GRUENTHAL, M., MUELLER, M., OLSON, W.L., PRIEBE, M. M., SHERWOOD, A. M., OLSON, W. H.: Gabapentin for the treatment of spasticity in patients with spinal cord injury. Spinal Cord, 35, 1997, 10, s. 686-689.
22. HSIEH, J. T. C., WOLFE, D. L., MILLER, W. C., CURT, A. and the SCIRE Research Team: Spasticity outcome measures in spinal cord injury: psychometric properties and clinical utility. Spinal Cord, 46, 2008, 2. s. 86-95.
23. JOHNSON, R. L., GERHART, K. A., MCCRAY, J., MENCONI, J. C., WHITENECK, G. G.: Secondary conditions following spinal cord injury in a population-based sample. Spinal Cord, 36, 1998, 1, s. 45-50.
24. JOZEFCZYK, P. B.: The management of focal spasticity. Clin. Neuropharmacol., 25, 2002, 3, s. 158-173.
25. KAKEBEEKE, T. H., LECHNER, H. E., KNAPP, P. A.: The effect of passive cycling movements on spasticity after spinal cord injury: preliminary results. Spinal Cord, 43, 2005, 8, s. 483-488.
26. KIRSHBLUM, S.: Treatment alternatives for spinal cord injury related spasticity. . Spinal Cord Med., 22, 1999, 3, s. 199-217.
27. KITA, M., GOODKIN, D. E.: Drugs used to treat spasticity. Drugs, 59, 2000, 3, s. 487-495.
28. KRAUSE, P., SZECSI, J, STRAUBE, A. : Changes in spastic muscle tone increase in patients with spinal cord injury using functional electrical stimulation and passive leg movements. Clin. Rehabil., 22, 2008, 7, s. 627-634.
29. LANCE, J. W.: The control of muscle tone, reflexes, and movement: Robert Wartenberg Lecture. Neurology, 30, 1980, 12, s. 1303-1313.
30. LEE, A., PATTERSON, V.: A double-blind study of L-threonine in patients with spinal spasticity. Acta Neurol. Scand., 88, 1993, 5, s. 334-338.
31. LEVI R., HULTLING, C., SEIGER, A.: The Stockholm spinal cord injury study: 2. Associations between clinical patient characteristics and post-acute medical problems. Paraplegia, 33, 1995, 10, s. 585-594.
32. MAYER, N. H.: Clinicophysiologic concepts of spasticity and motor dysfunction in adults with an upper motoneuron lesion. Muscle Nerve Suppl., 6, 1997, s. S1-13.
33. MAYNARD, F. M., KARUNAS, R. S., WARING III, W. P.: Epidemiology of spasticity following traumatic spinal cord injury. Arch. Phys. Med. Rehabil., 71, 1990, 8, s. 566-569.
34. MIRBAGHERI, M. M., CHEN, D., RYMER, W. Z.: Quantification of the effects of an alpha-2 adrenergic agonist on reflex properties in spinal cord injury using a system identification technique. J. Neuroeng. Rehabil., 7, 2010, s. 29.
35. PANDYAN, A. D., GREGORIC, M., BARNES, M. P., WOOD, D., VAN WIJCK, F., BURRIDGE, J. et al.: Spasticity: clinical perceptions, neurological realities and meaningful measurement. Disabil. Rehabil., 27, 2005, 1-2, s. 2-6.
36. PENN, R. D., KROIN, J. S.: Long-term intrathecal baclofen infusion for treatment of spasticity. J. Neurosurg., 66, 1987, 2, s. 181-185.
37. PENN, R. D., SAVOY, S. M., CORCOS, D., LATASH, M., GOTTLIEB, G., PARKE, B. et al.: Intrathecal baclofen for severe spinal spasticity. N. Engl. J. Med., 320, 1989, 23, s. 1517-1521.
38. RICHARDSON, D.: Physical therapy in spasticity. Eur. J. Neurol., 9, 2002, Suppl 1, s. 17-22.
39. SATKUNAM, E.: Rehabilitation medicine: 3. Management of adult spasticity. CMAJ, 169, 2003, 11, s. 1173-1179.
40. SHEEAN, G.: The pathophysiology of spasticity. Eur. J. Neurol., 9, 2002, Suppl 1, s. 3-9.
41. SIMON, O., YELNIK, A. P.: Managing spasticity with drugs. Eur. J. Phys. Rehabil. Med., 46, 2010, 3, s. 401-410.
42. SKOLD, C., LEVI, R., SEIGER, A.: Spasticity after traumatic spinal cord injury: nature, severity, and location. Arch. Phys. Med. Rehabil., 80, 1999, 12, s. 1548-1557.
43. SONI, B. M., MANI, R. M., OO, T., VAIDYANATHAN, S.: Treatment of spasticity in a spinal cord-injured patient with intrathecal morphine due to intrathecal baclofen tolerance-A case report and review of literature. Spinal Cord, 41, 2003, 10, s. 586-589.
44. ŠTĚTKÁŘOVÁ, I.: Léčba spasticity u dospělých. Med. Prax., 9, 2012, 3, s. 124-126.
45. ŠTĚTKÁŘOVÁ, I.: Mechanismy spasticity a její hodnocení. Cesk. Slov. Neurol. N., 76/109, 2013, 3, s. 267-280.
46. WAGSTAFF, A. J., BRYSON, H. M.: Tizanidine. A review of its pharmacology, clinical efficacy and tolerability in the management of spasticity associated with cerebral and spinal disorders. Drugs, 53, 1997, 3, s. 435-452.
47. WIRZ, M., ZEMON, D. H., RUPP, R., SCHEEL, A., COLOMBO, G., DIETZ, V., HORNBY, T. G.: Effectiveness of automated locomotor training in patients with chronic incomplete spinal cord injury: a multicenter trial. Arch. Phys. Med. Rehabil., 86, 2005, 4, s. 672-680.
48. WU, M., SCHMIT, B. D.: Spastic reflexes triggered by ankle load release in human spinal cord injury. J. Neurophysiol., 96, 2006, 6, s. 2941-2950.
Štítky
Fyzioterapia Rehabilitácia Telovýchovné lekárstvoČlánok vyšiel v časopise
Rehabilitace a fyzikální lékařství

2015 Číslo 3
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
- Hluboká stimulace globus pallidus zlepšila klinické příznaky u pacientky s refrakterním parkinsonismem a genetickou mutací
- V ČR chybí specializovaná péče o pacienty s nervosvalovým onemocněním
Najčítanejšie v tomto čísle
- Spasticita u dětské mozkové obrny (DMO)
- Rameno v kostce – III. část
- Neuroplasticita, restituce motorických funkcí a možnosti rehabilitace spastické parézy
- Spasticita a roztroušená skleróza
