-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
IGF1 a nádorové markery ve stadiích nádoru prsu
IGF1 and Tumor Markers in Different Breast Cancer Stages
Introduction:
In our work we asked ourselves whether it would be possible to use growth factors for a quick orientation in the clinical status of patients prior to biopsy and histological examination.Material and methods:
Our patient group included 82 patients with breast cancer. Serum samples were collected preoperatively. Histological examination findings were available for each patient. Our set was divided into three groups based on the disease stage. The values of analytes in different tumor stages were statistically evaluated and statistical comparisons of Stage I and II, and then of Stage II and III were performed.Results:
Tumor markers CEA, CA 15-3, TK, TPA-M and MonoTotal correlate with the disease severity. Serum levels of the growth factor IGF1 negatively correlated with the severity of cancer. There was aa statistically significant increase in the EGF growth factor serum levels between Stage I and II. No statistically significant differences between Stage I vs. II and Stage II vs. III were detected when HGF and VEGF growth factor serum levels were assessed.Conclusion:
The growth factor EGF is one of the candidates to become a tumor growth marker in early disease stages. The IGF1, HGF and VEGF growth factors can not be used for quick and correct orientation in the clinical condition of patients in the early stages of tumor growth.Key words:
breast carcinoma – tumor markers – growth factors
Autoři: M. Černá 1; A. Ňaršanská 1; V. Třeška 1; R. Kučera 2; O. Topolčan 2
Působiště autorů: Chirurgická klinika LF UK a FN v Plzni, přednosta: prof. MUDr. Vladislav Třeška, CSc. 1; Centrální izotopová laboratoř LF UK a FN v Plzni, přednosta: prof. MUDr. Ondřej Topolčan 2
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 12, s. 688-694.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
V naší práci jsme si položili otázku, zda by nebylo možné použít růstové faktory pro rychlejší orientaci v klinickém stavu pacientek ještě před biopsií a histologickým vyšetřením.Materiál a metodika:
Náš soubor čítal 82 pacientek s karcinomem prsu. Náběry sérových vzorků byly prováděny předoperačně. U každé pacientky jsme měli k dispozici histologický nález. Náš soubor jsme rozdělili do tří skupin podle stadia nádorového onemocnění. Hodnoty analytů v jednotlivých nádorových stadiích jsme statisticky vyhodnotili a provedli statistické srovnání stadia I a II, dále potom stadia II a III.Výsledky:
Nádorové markery CEA, CA 15-3, TK, TPA-M a MonoTotal korelují se závažností onemocnění. Sérové hladiny růstového faktoru IGF1 negativně korelují se závažností nádorového onemocnění. U růstového faktoru EGF jsme zaznamenali statisticky významné zvýšení sérové hladiny mezi stadii I a II. U růstových faktorů HGF a VEGF jsme při porovnání stadií I vs. II a II vs. III nezaznamenali žádné statistické významnosti.Závěr:
Růstový faktor EGF je jedním z kandidátů na marker monitorace růstu nádorů v časném stadiu. Růstové faktory IGF1, HGF a VEGF nelze použít k rychlé a správné orientaci v klinickém stavu pacientek v časných stadiích růstu nádoru.Klíčová slova:
karcinom prsu – nádorové markery – růstové faktoryÚVOD
Karcinom prsu je nejčastější typ nádoru u žen a podle statistik WHO postihuje 20 % žen. Mortalita má tendenci mírného, ale vytrvalého vzestupu s velkými variacemi mezi jednotlivými zeměmi, které jsou v rámci statistik WHO sledovány. V řadě evropských zemí je karcinom prsu co do četnosti výskytu v populaci na prvních místech spolu s karcinomem kolorektálním [1, 2]. I když se terapeutické možnosti nádoru prsu každý rok zlepšují a na trh jsou uváděny nové generace onkologických léčiv, včasná diagnostika výrazně zvyšuje šance na úspěšnou léčbu a přežití pacientek. Ke správné strategii léčby přispívá i zjištění typu nádoru a jeho agresivity. V naší práci jsme si položili otázku, zda by nebylo možné použít růstové faktory pro rychlejší orientaci v klinickém stavu pacientek ještě před biopsií a histologickým vyšetřením.
TEORETICKÁ ČÁST
Základní charakteristiky měřených analytů uvádí (Tab. 1).
Tab. 1. Charakteristika měřených analytů Tab. 1. Characteristics of measured analytes 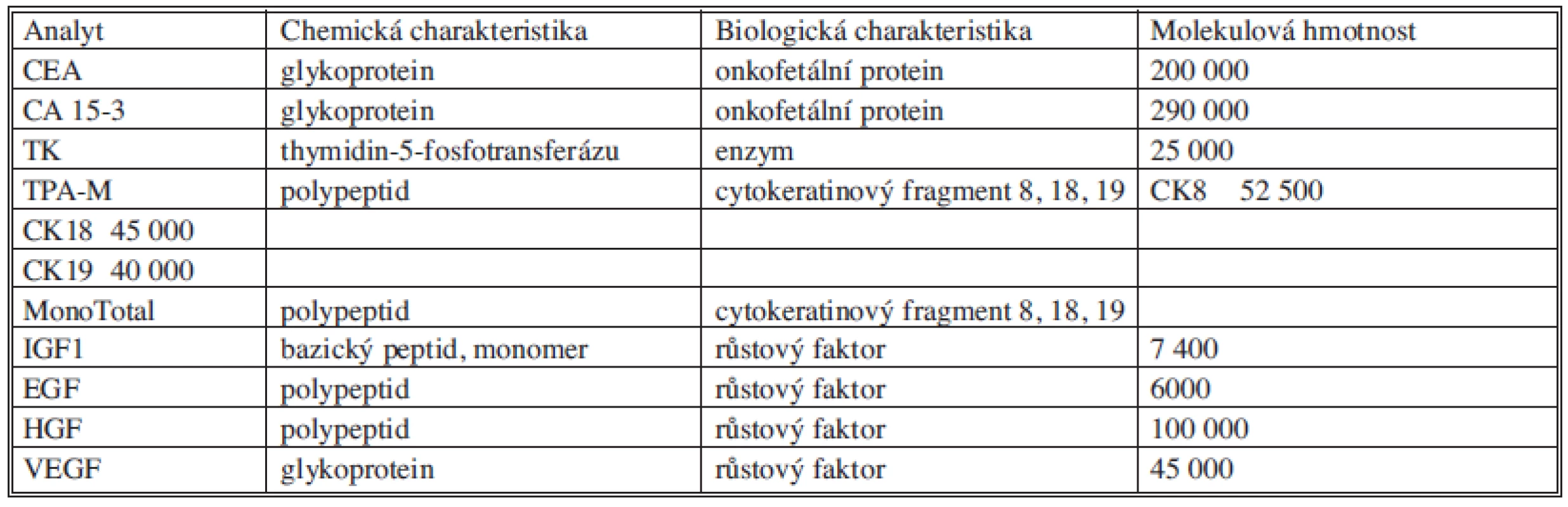
CEA
Sérový CEA (Carcinoembryonic antigen) patří k základním markerům studovaným u různých nádorových lokalizací. Jde o onkofetální glykoprotein s vysokým obsahem sacharidů o molekulové hmotnosti 180–200 kDa. Za fyziologických podmínek je CEA produkován ve vyvíjejícím se embryu.
V dospělosti je omezeně syntetizován epiteliálními buňkami střevní sliznice, žaludku a bronchů. CEA patří do imunoglobulinové genové rodiny a podílí se pravděpodobně na procesu adheze a metastazování buněk. CEA má v současné době význam především při stagingu a monitorování kolorektálních karcinomů, karcinomů plic, prsu, močového měchýře a dalších malignit. Z klinických zkušeností vyplývá, že se nedá použít ani pro screening ani pro primární nebo diferenciální diagnostiku nádorových onemocnění. V průběhu maligního procesu je produkován CEA nádorovou tkání, jeho hladiny se výrazně zvyšují především ve vztahu k celkové hmotě nádoru. Vzhledem k odbourávání játry a vylučování ledvinami je jeho hladina zvýšena u nemaligních postižení těchto orgánů (hepatitida, selhání ledvin atd.). Hladinu CEA mohou též zvyšovat Crohnova choroba, střevní polypy, onemocnění plic, pankreatitida, kouření [4].
CA 15-3
CA 15-3 (Cancer antigen 15-3) je glykoprotein o molekulové hmotnosti 290 kDa, antigen polymorfního epiteliálního mucinu (PEM), nazývaný rovněž MUC1. V dospělosti je syntetizován v epiteliálních buňkách vývodů mléčné žlázy, slinných žláz a bronchů.
V současné době se CA15-3 využívá především k monitorování nemocných s karcinomem prsu. Koncentrace CA 15-3 korelují se stadiem onemocnění. Při 90% specificitě dosahuje senzitivita u neléčených nemocných pouze 20–40 %, u metastázujících nádorů až 80 %. Relaps onemocnění bývá charakterizován senzitivitou CA 15-3 dosahující 60–90 %. Stanovení CA 15-3 umožňuje předpovědět návrat onemocnění s předstihem několika měsíců před detekcí dostupnými zobrazovacími metodami. Dynamika změn po terapii obvykle koreluje s terapeutickým efektem. Stanovení nelze použít pro screening nemocných s karcinomem prsu a stanovení primární nebo diferenciální diagnózy. Sérovou hladinu CA 15-3 mohou zvyšovat benigní onemocnění prsu, benigní nádory trávicího ústrojí, jaterní cirhóza, akutní a chronická hepatitida, chronická renální insuficience, chronická bronchitida a pneumonie [5].
TK
TK (Thymidine kinase) patří k enzymům syntézy DNA, charakteristickým pro proliferující tkáň.
Jde o thymidin-5-fosfotransferázu, která existuje v eukaryotických buňkách ve dvou izoenzymech: TK1 a TK2. TK katalyzuje přeměnu thymidinu na thymidinmonofosfát, čímž je umožněna syntéza DNA náhradní cestou. Za fyziologických podmínek je TK intenzivně syntetizována především v játrech během vývoje plodu, po porodu se syntéza zpomaluje. V séru převažuje fetální forma (95 % z celkového množství).
Pro screening a stanovení diagnózy nelze stanovení TK použít. Monitorování průběhu onemocnění a úspěšnosti terapie je hlavní oblastí jejího využití. Zvýšení hladiny TK v séru z nemaligních příčin zahrnuje respirační virové infekty s lymfocytární aktivací, zánětlivá onemocnění plic a trávicího ústrojí, infekce EB virem, cytomegaloviry nebo herpesviry a revmatická onemocnění [6].
TPA-M
TPA-M (Tissue polypeptid antigen) je polypetid ze solubilních fragmentů cytokeratinů typu středních filament (cytokeratin 8, 18 a 19). Jde o velmi nespecifický nádorový marker, který odráží intenzitu aktivity nádorových buněk. TPA-M je nádorovým markerem vhodným především pro monitorování a hodnocení účinnosti terapie. Je markerem s nejvyšší senzitivitou pro sledování nemocných s karcinomem močového měchýře. Vyšetření tohoto markeru nelze použít pro screening, diagnózu a staging onemocnění. Dále se užívá pro monitorování nemocných s nádory prsu, plic, GIT a ledvin. Dynamika jeho změn při terapii je obvykle rychlejší než u markerů diferenciačního typu.
Nespecificky je TPA-M v séru zvýšen při některých onemocněních jater (cirhóza, hepatitida), rovněž tak u infekčních onemocnění [7].
MonoTotal
MonoTotal je polypetid ze solubilních fragmentů cytokeratinů typu středních filament (cytokeratin 8, 18 a 19). Jde o velmi nespecifický nádorový marker, který odráží intenzitu aktivity nádorových buněk. MonoTotal je nádorovým markerem vhodným především pro monitorování a hodnocení účinnosti terapie malobuněčného karcinomu plic. Vyšetření tohoto markeru nelze použít pro screening, diagnózu a staging onemocnění. Dále se užívá jako doplňkový nádorový marker u nemocných s nádory v oblasti hlavy. Nespecificky je MonoTotal v séru zvýšen při některých onemocněních jater (cirhóza, hepatitida), rovněž tak u infekčních onemocnění [8].
IGF1
Inzulínu podobný růstový faktor 1 (IGF1, insulin-like growth factors 1) je peptid, který se podílí na řízení růstu, metabolismu, přežívání a diferenciaci buněk a je regulován růstovým hormonem (GH, growth hormone). IGF1má specifické vazebné proteiny (IGFBP, insulin-like growth factor binding proteins). Až 95 % IGF1 cirkuluje v krvi vázáno na specifické vazebné proteiny [9]. Funkcí vazebného proteinu je prodloužit poločas rozpadu faktorů růstu v oběhu na několik hodin.
IGF1 je bazický peptid s nízkou molekulovou hmotností 7400 Da. Je tvořen jednoduchým řetězcem o 70 aminokyselinách. IGF1 je produkován ve velkém množství v játrech (přibližně 10 mg/den). IGF1 je produkován lokálně i v mnoha jiných tkáních, např. ledvin, srdce, plic, tukové tkáni a tkáních různých žláz. IGF1 je produkován také chondroblasty, fibroblasty a osteoklasty [10]. Na orgánové úrovni IGF1 účinkuje autokrinním i parakrinním mechanismem. Účinek v buňkách je zprostředkován vlastním IGF1 receptorem. Nejvyšší koncentrace nacházíme u dětí v pubertě. V pozdějších letech jejich hladiny klesají, přibližně o 10 procent za každých 10 let [11].
EGF
Epidermální růstový faktor (Epidermal growth factor) je růstový faktor, který hraje důležitou roli v regulaci buněčného růstu, proliferace a diferenciace. Lidský EGF je protein o molekulové hmotnosti 6045 Da tvořený 53 aminokyselinami a třemi intramolekulárními disulfidickými můstky. EGF se nachází v lidských krevních destičkách, makrofázích, moči, slinách, mléku a plazmě. EGF účinek na buňky je umožněn specifickým receptorem EGFR. Tento receptor, jinak také označován HER1 patří do skupiny receptorů, které jsou společné pro více růstových faktorů. HER1 může být využíván i růstovými faktory, jako je TGFα.
EGFR je exprimován na povrchu řady nádorů. V současné době jsou v klinickém použití inhibitory EGFR a používají se především v léčbě karcinomu v oblasti hlavy, krku a metastázujícího kolorektálního karcinomu. Tyto léky dokážou kromě blokace receptoru tlumit i autokrinní produkci TGFα a VEGF v buňce [12].
HGF
Hepatocytární růstový faktor (Hepatocyte growth factor) je parakrinně produkovaný růstový faktor, který působí na růst, pohyblivost a diferenciaci buněk. Je vylučován mezenchymálními buňkami a funguje jako multifunkční cytokin v buňkách především epiteloidního původu. Jeho schopnost stimulovat mitogenezi a invazivitu mu dává centrální roli v angiogenezi, tumorogenezi a regeneraci tkání. Je vylučován jako neaktivní polypeptid a je štěpen serinovými proteázami na 69 kDa alfa řetězec a 34 kDa beta řetězec. Disulfidický můstek mezi alfa a beta řetězcem vytváří aktivní, heterodimerickou molekulu. Účinek HGF na buňku je zprostředkován receptorem pro růstový faktor hepatocytů (HGFR) též zvaný MET [13].
MET je membránový receptor, který je nezbytný pro embryonální vývoj a hojení ran. HGF je jediný známý ligand MET receptoru. Při stimulaci MET růstovým faktorem HGF dojde ke spuštění kaskády MET signální dráhy, což vyvolává řadu biologických reakcí, které společně vedou k výsledku, známému jako invazivní růst. MET vyvolává růst nádoru, tvorbu nových cév (angiogeneze), které dodávají nádoru živiny, a metastázy se šíří do dalších orgánů. Signální dráha MET je deregulována v mnoha typech lidských nádorů včetně rakoviny ledvin, jater, žaludku, prsu a mozku [14].
Na základě současných poznatků byly vyvinuty blokátory MET receptoru, které se již klinicky používají v onkologické léčbě, především v indikacích pro gastrointestinální a renální karcinom.
VEGF
Vaskulární endoteliální růstový faktor (Vascular endothelial growth factor) je protein o molekulové hmotnosti 45 kDa produkovaný buňkami a stimuluje vasculogenezi a angiogenezi. VEGF je název celé podskupiny růstových faktorů. Je to součást systému, který obnovuje přísun kyslíku do tkání v případě, že krevní oběh nedostatečně zásobuje tkáně kyslíkem. Normální funkcí VEGF je tvorba cév během embryonálního vývoje, novotvorba cév po zranění svalů a kolaterálních cév pro překonání míst s neprůchodným cévním řečištěm [15]. Také nádory nemohou růst bez dostatečného prokrvení. Buňky nádorů jsou schopné za podpory VEGF růst a metastazovat. Produkce VEGF může být vyvolána v buňkách, které mají nedostatek kyslíku. Účinek VEGF umožňují VEGF receptory na endotelových buňkách. Na základě znalostí o fungování signální dráhy pro VEGF byly vyvinuty léky blokující VEGF receptory [16]. Tyto léky jsou již v klinickém použití a využívají se v onkologické léčbě především generalizovaného karcinomu ledvin a gastrointestinálních stromálních tumorů.
MATERIÁL A METODA
Náš soubor čítal 82 pacientek s karcinomem prsu. Jednalo se o pacientky operované na chirurgické klinice FN Plzeň v letech 2008–2010. Věková charakteristika souboru žen v době stanovení diagnózy je obsažena v tabulce 2.
Tab. 2. Věková charakteristika souboru žen s karcinomem prsu Tab. 2. Age characteristics of the breast cancer patient group 
U všech pacientek jsme měli k dispozici histologický nález. Mohli jsme tedy náš soubor rozdělit do tří skupin podle stadia nádorového onemocnění. Hodnoty analytů v jednotlivých nádorových stadiích jsme statisticky vyhodnotili a provedli statistické srovnání stadia I a II, dále potom stadia II a III. Zajímalo nás, zda se hodnoty analytů v jednotlivých nádorových stadiích od sebe statisticky významně liší a jestli hladiny analytů nějakým způsobem korelují se závažností nádorového onemocnění.
Použité analytické metody
Sérové vzorky byly odebírány předoperačně. Vzorky venózní krve byly odebírány za pomoci odběrového systému VACUETTE (Greiner, Rakousko). Krevní vzorky byly centrifugovány 10 minut při 1 700x g, poté zamraženy při -80 °C. Vzorky byly rozmrazeny pouze jedenkrát, a to před samotnou analýzou.
Sérové hladiny CEA a CA 15-3 byly měřeny za použití analytického systému DxI (BeckmanCoulter, USA). Sérové hladiny IGF1 a TK byly stanoveny izotopovými soupravami IGF1 IRMA a TK REA (Immunotech, ČR). Sérové hladiny cytokeratinů byly stanoveny izotopovými soupravami IRMA, TPA-M (DiaSorin, Belgie) a MonoTotal (IDL, Švédsko). Sérové hladiny růstových faktorů EGF, HGF a VEGF byly stanoveny pomocí systému multiplexové analýzy xMAPLuminex (Merck, USA).
Statistické zpracování
Pro statistické vyhodnocení byl použit software SAS 9.2. U souborů pacientek byly spočítány průměry a mediány sérových koncentrací. V tabulkách jsou ještě uvedeny hodnoty minimální a maximální koncentrace daného analytu. Pro porovnání jednotlivých nádorových stadií byl použit Kruskalův-Wallisův test.
VÝSLEDKY
Výsledky byly shromažďovány od roku 2008 a do studie jsme cíleně zařadili pouze ty ženy, u kterých bylo možné dohledat histologické a jiné údaje. Tím, že jsou ženy sledovány ve specializované ambulanci chirurgické kliniky, je zajištěna přesnost a dostupnost klinických údajů. Bylo tedy možné rozdělit soubor žen na tři skupiny podle stadia nádorového onemocnění. Porovnáním hladin analytů v těchto skupinách bylo možné zjistit, zda se nějak významně liší.
Výsledky a fakta, která jsme obdrželi po statistickém vyhodnocení, obsahují tabulky 3 až 11.
Tab. 3. Sérové hladiny CEA v jednotlivých nádorových stadiích Tab. 3. Serum levels of CEA in individual cancer stages 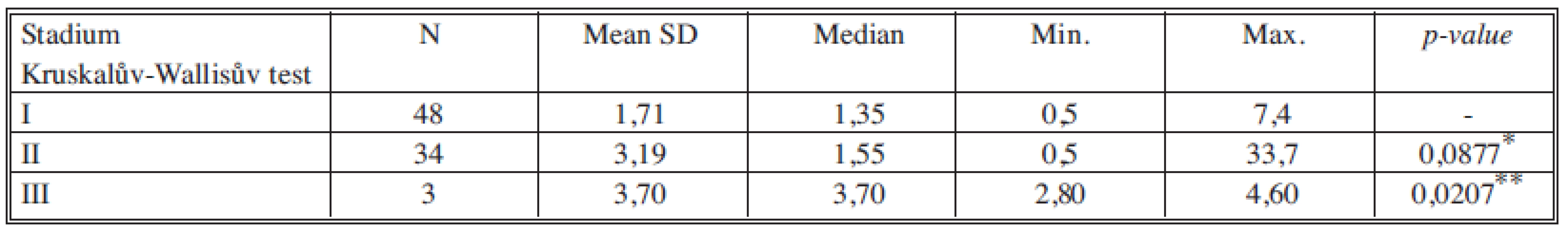
*porovnání stadia I a II, **porovnání stadia II a III Tab. 4. Sérové hladiny CA 15-3 v jednotlivých nádorových stadiích Tab. 4. Serum levels of CA 15-3 in individual cancer stages 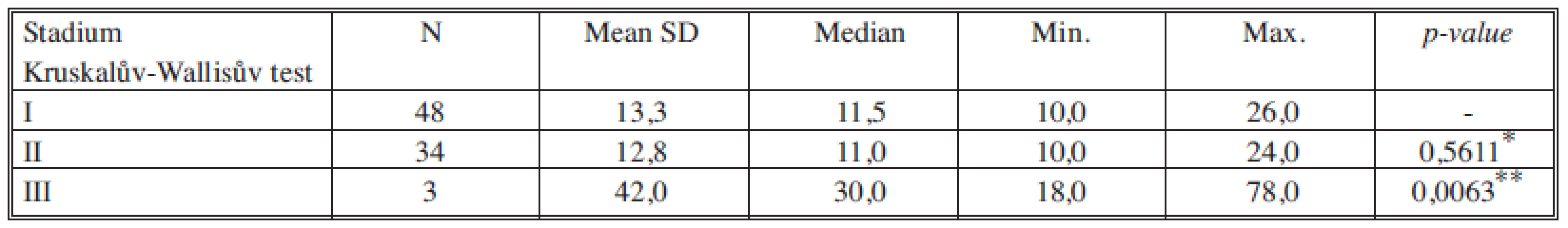
*porovnání stadia I a II, **porovnání stadia II a III Tab. 5. Sérové hladiny TK v jednotlivých nádorových stadiích Tab. 5. Serum levels of TK in individual cancer stages 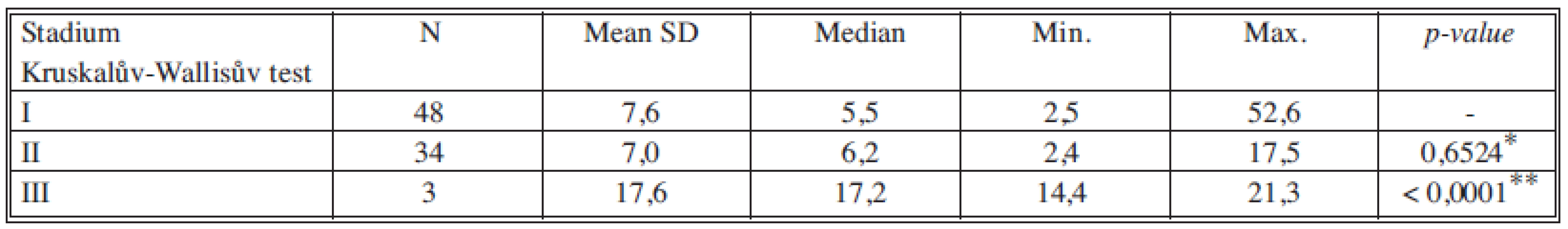
*porovnání stadia I a II, **porovnání stadia II a III Tab. 6. Sérové hladiny TPA-M v jednotlivých nádorových stadiích Tab. 6. Serum levels of TPA-M in individual cancer stages 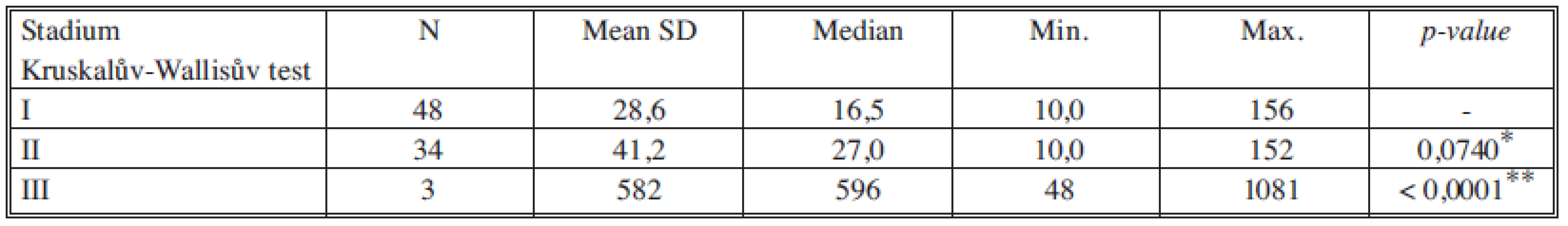
*porovnání stadia I a II, **porovnání stadia II a III Tab. 7. Sérové hladiny MonoTotalu v jednotlivých nádorových stadiích Tab. 7. Serum levels of MonoTotal in individual cancer stages 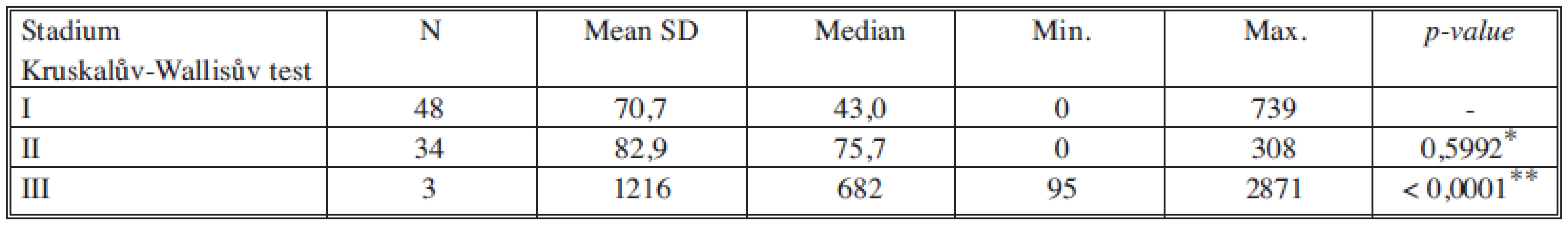
*porovnání stadia I a II, **porovnání stadia II a III Tab. 8. Sérové hladiny IGF1 v jednotlivých nádorových stadiích Tab. 8. Serum levels of IGF1 in individual cancer stages 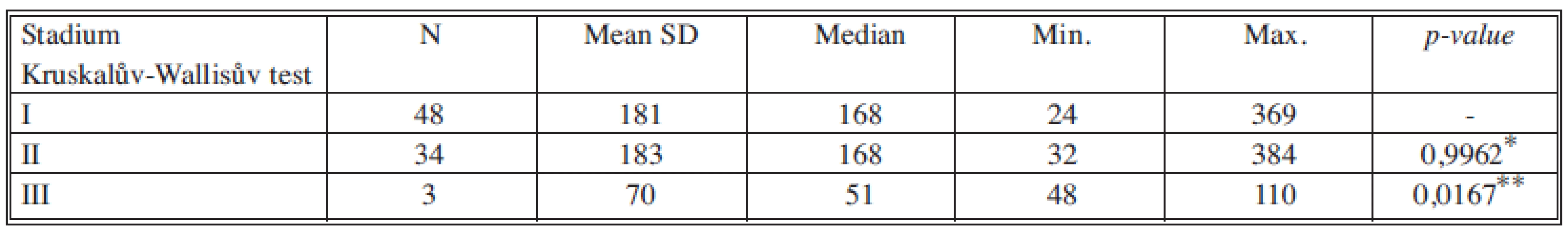
*porovnání stadia I a II, **porovnání stadia II a III Tab. 9. Sérové hladiny EGF v jednotlivých nádorových stadiích Tab. 9. Serum levels of EGF in individual cancer stages 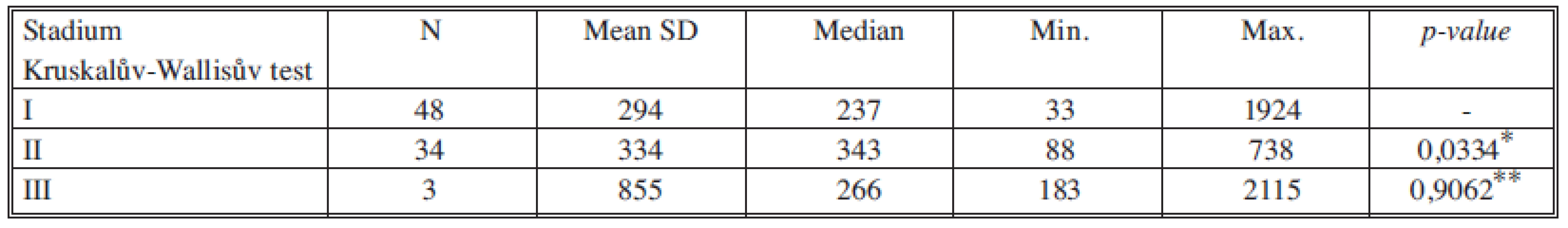
*porovnání stadia I a II, **porovnání stadia II a III Tab. 10. Sérové hladiny HGF v jednotlivých nádorových stadiích Tab. 10. Serum levels of HGF in individual cancer stages 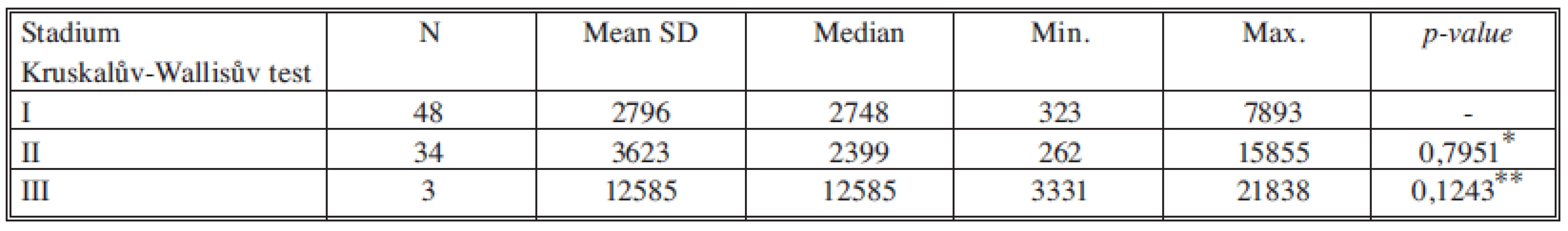
*porovnání stadia I a II, **porovnání stadia II a III Tab. 11. Sérové hladiny VEGF v jednotlivých nádorových stadiích Tab. 11. Serum levels of VFGF in individual cancer stages 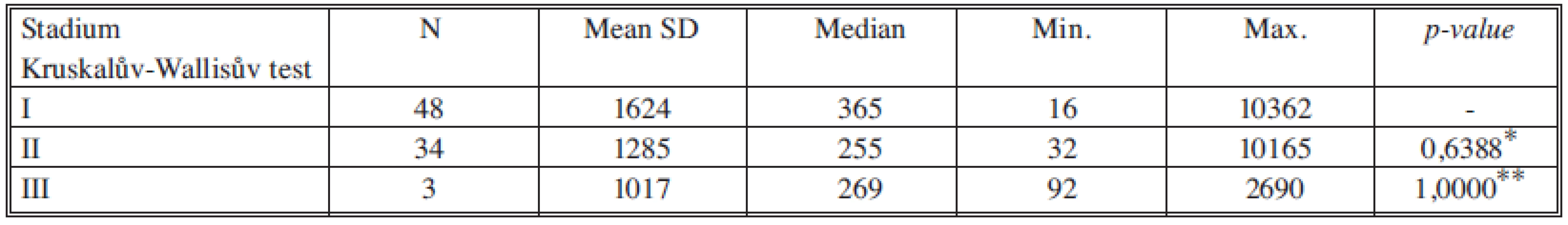
*porovnání stadia I a II, **porovnání stadia II a III DISKUSE
Nádorové markery CEA, CA 15-3, TK, TPA-M a MonoTotal korelují se závažností onemocnění, tj. se stadiem nádorového onemocnění, přičemž statisticky významný rozdíl jsme pozorovali především u všech markerů mezi stadiem II a III. Rozdíl v hodnotách ve stadiích I a II nebyl statisticky významný. Tabulka12 souhrnně ukazuje statistické významnosti sledovaných nádorových marketů mezi stadii I vs. II a II vs. III.
Tab. 12. Statistické významnosti nádorových markerů Tab. 12. Statistical significance of tumor markers 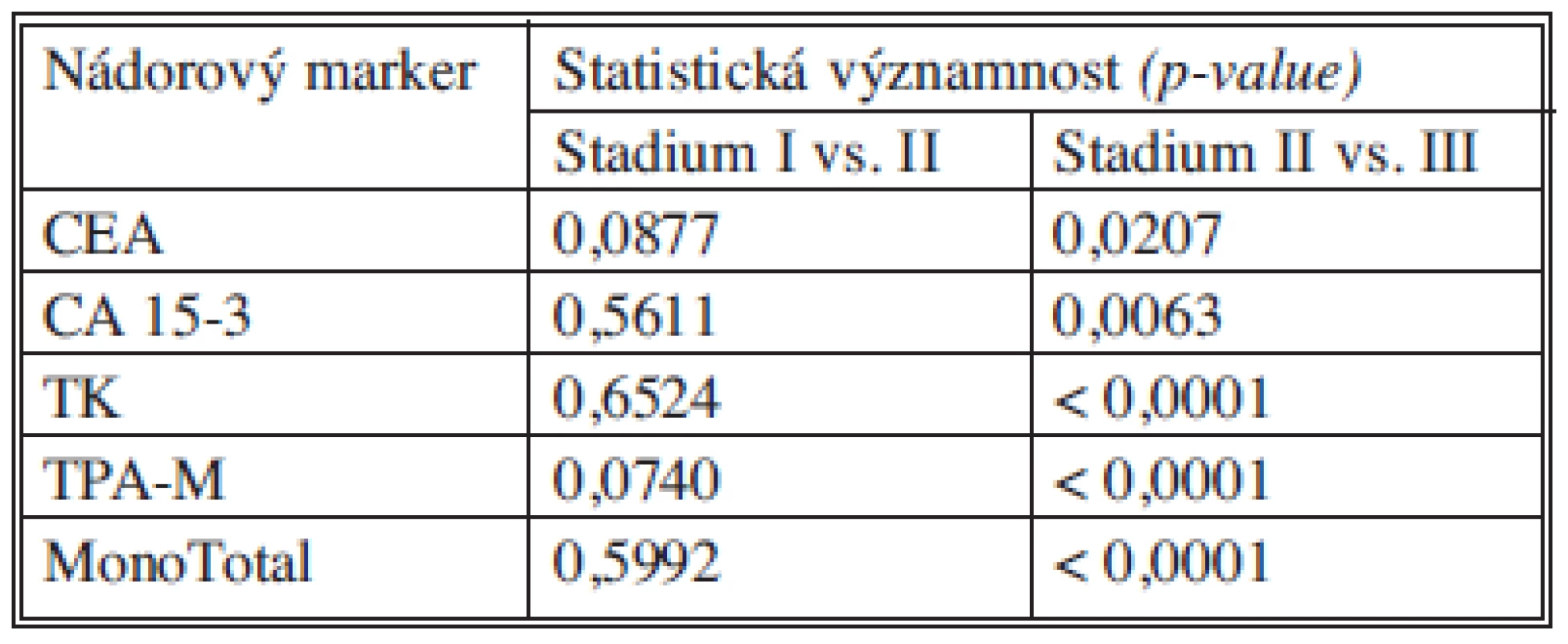
Tab. 13. Statistické významnosti růstových faktorů Tab. 13. Statistical significance of growth factors 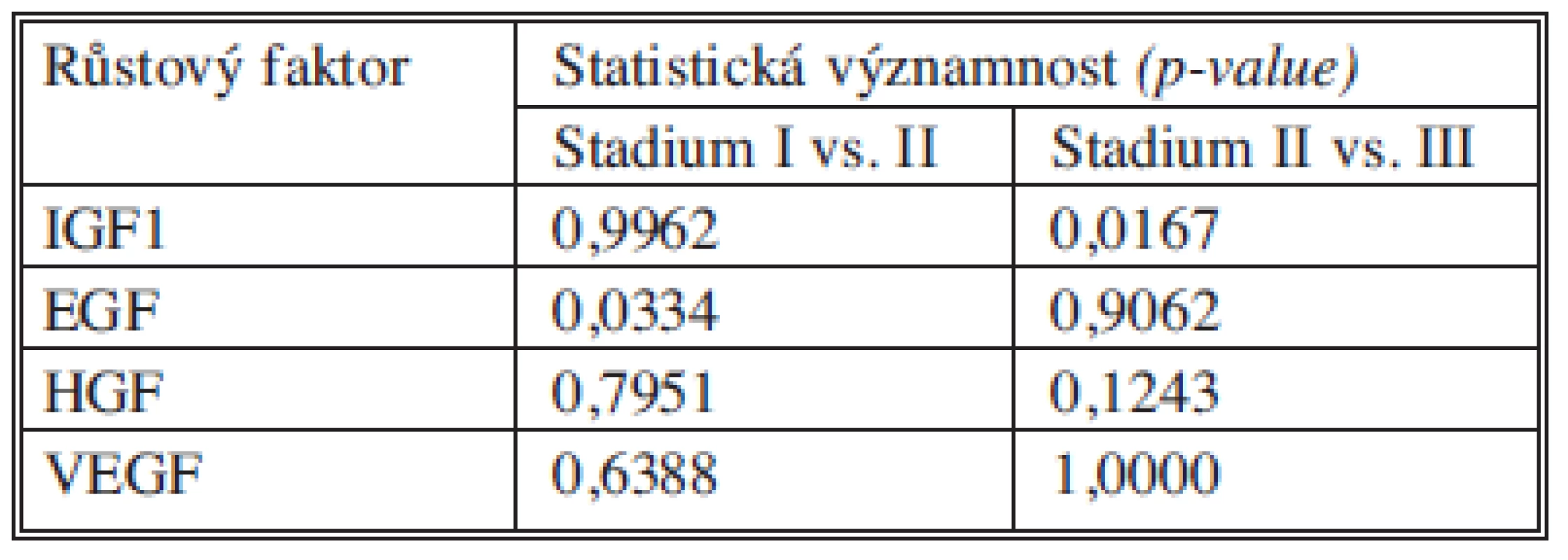
Koncentrace nádorových markerů pozitivně korelují s průběhem nádorového onemocnění [17], čím vyšší a závažnější je stadium nádoru, tím vyšší jsou koncentrace v séru. Průběh zvyšování koncentrací všech nádorových markerů je dosti podobný. Z našich výsledků je dobře patrné výrazné navýšení markerů proliferace a aktivity nádorových buněk (TK, TPA-M, MonoTotal) oproti markerům odrážejícím spíše hmotu a diferenciaci nádoru (CEA, CA 15-23).
U růstových faktorů je situace odlišná.
U růstového faktoru IGF1 jsme neprokázali statisticky významný rozdíl v koncentracích mezi stadiem I a II. Statisticky významný je rozdíl mezi stadii II a III. Avšak na rozdíl od nádorových markerů jsou hladiny IGF1 nejnižší ve stadiu III. Tabulka 13 souhrnně ukazuje statistické významnosti IGF1 mezi stadii I vs. II a II vs. III.
Hladiny IGF1 v séru tedy negativně korelují se závažností nádorového onemocnění [18]. Tato skutečnost je v souladu s teorií, která byla opakovaně vyslovena některými autory v souvislosti s IGF1 a nádory prsu a tlustého střeva. Podle této teorie se signální dráha IGF1 uplatňuje v podpoře růstu nádoru v jeho časných stadiích. Čím vyšší nádorové stadium, tím je aktivováno v buňkách nádorové tkáně více prorůstových cest a význam přenosu signálu v prorůstové dráze IGF1 ustupuje do pozadí.
U růstového faktoru EGF jsme zaznamenali statisticky významné zvýšení sérové hladiny mezi stadii I a II. Růstový faktor EGF je brán jako biomarker buněčného růstu a proliferace [19] a podle našich výsledků je jedním z kandidátů na marker monitorace růstu nádorů v časném stadiu, bude nutné ověřit jeho chování na větším souboru pacientů, než bude možné rozhodnout o jeho vhodnosti k této indikaci.
U růstových faktorů HGF a VEGF jsme neprokázali statisticky významné změny hladin ve vztahu k jednotlivým nádorovým stadiím.
ZÁVĚR
Sérové hladiny nádorových markerů CEA, CA 15-3, TK, TPA-M a MonoTotal pozitivně korelují s průběhem nádorového onemocnění. Statisticky významný rozdíl jsme pozorovali mezi stadiem II a III. Rozdíl v hodnotách ve stadiích I a II nebyl statisticky významný.
Sérové hladiny růstového faktoru IGF1 negativně korelují se závažností nádorového onemocnění. Statisticky významný je rozdíl mezi stadii II a III. Rozdíl v hodnotách ve stadiích I a II nebyl statisticky významný. U růstového faktoru EGF jsme zaznamenali statisticky významné zvýšení sérové hladiny mezi stadii I a II. U růstových faktorů HGF a VEGF jsme při porovnání stadií I vs. II a II vs. III nezaznamenali žádné statistické významnosti.
Náš soubor nemocných sestával výhradně z předoperačních náběrů. Zjistili jsme, že růstové faktory prozatím nejsou využitelné pro rychlou orientaci v předoperační diagnostice. Účast jednotlivých růstových faktorů v průběhu nádorového onemocnění je však již v současné době prokázána na úrovni tkáňové. Objev receptorů a zmapování celých signálních drah růstových faktorů přispělo k pochopení řady procesů vedoucích k nekontrolovanému růstu buněk. Na základě těchto poznatků byla vyvinuta nejnovější generace onkologických léků. V současné době se již v klinické praxi používají preparáty, které blokují receptory pro vazbu jednotlivých růstových faktorů na povrchu buněk a tím blokují přenos prorůstových signálů do buňky. V klinické praxi jsou již přípravky blokující receptory pro EGF, dále preparáty, které selektivně vážou VEGF. V klinickém zkoušení jsou blokátory receptorů pro IGF1.
Náš soubor nemocných bude proto rozšířen o nemocné léčené blokátory růstových receptorů a bude vyhodnocen vliv léčby na sérové hladiny jednotlivých růstových faktorů.
MUDr. Monika Černá
Chirurgická klinika LF UK a FN
Alej Svobody 80
304 60 Plzeň
e-mail: cernam@fnplzen.cz
Zdroje
1. Ferlay, J., Autier, P., Boniol, M., Heanue, M., Colombet, M., Boyle, P. Estimates of the cancer incidence and mortality in Europe in 2006. Ann. Oncol., 2007 : 581–592.
2. Vrdoljak, E., Wojtukiewicz, M. Z., Pienkowski, T., Bodoky, G., Berzinec, P., Finek, J., Todorovic, V., Borojevic, N., Croitoru, A. Cancer epidemiology in Central and South Eastern European countries. Croat. Med. J., 2011 : 478–487.
3. Nekulová, M., Šimícková, M., Pecen, L., Eben, K., Vermousek, I., Stratil, P., Černoch, M., Lang, B. Early diagnosis of breast cancer dissemination by tumor markers follow-up and method of prediction. Neoplasma, 1994 : 113–118.
4. Topolcan, O., Holubec, L., Polivkova, V., Svobodova, S., Pesek, M., Treska, V., Safranek, J., Hajek, T., Bartunek, L., Rousarova, M., Finek, J. Tumor markers in pleuraleffusions. Anticancer Res., 2007 : 1921–1924.
5. Valík, D., Zima, T., Topolčan, O. Doporučení České společnosti klinické biochemie (ČSKB ČLS JEP), České onkologické společnosti (ČOS ČLS JEP) a České společnosti nukleární medicíny (ČSNM ČLS JEP) k využití nádorových markerů v klinické praxi. 2008.
6. Topolcan, O., Holubec, L., Polivkova, V., Svobodova, S., Pesek, M., Treska, V., Safranek, J., Hajek, T., Bartunek, L., Rousarova, M., Finek, J. Tumor markers in pleural effusions, Anticancer Res., 2007 : 1921–1924.
7. Björklund, B. Tissue polypeptide antigen (TPA): Biology, biochemistry, improved assay methodology, clinical significance in cancer and other conditions, and future outlook. Antibiot Chemother., 1978 : 16–31.
8. Debus, E., Moll, R., Franke, W. W., Weber, K., Osborn, M. Immunohistochemical distinction of human carcinomas by cytokeratin typing with monoclonal antibodies. Am. J. Pathol., 1984 : 121–130.
9. Dupont, J., LeRoith, D. Insulin and insulin-like growth factor I receptors: similarities and differences in signal transduction. Horm. Res., 2001 : 22–26.
10. Peterson, J. E., Kulik, G., Jelinek, T., Reuter, C. W., Shannon, J. A., Weber, M. J. Src phosphorylates the insulin-like growth factor type I receptor on the autophosphorylation sites. Requirement for transformation by src. J. Biol. Chem., 1996 : 31562–31571.
11. Samani, A. A., Yakar, S., LeRoith, D., Brodt, P. The role of the IGF system in cancer growth and metastasis: overview and recent insights. Endocr. Rev., 2007 : 20–47.
12. Dvořák, B. Epidermal growth factor and necrotizing enterocolitis. Clinics in perinatology, 2004 : 183–192.
13. Gallagher, J. T., Lyon, M. Molecular structure of Heparan Sulfate and interactions with growth factors and morphogens. In: Iozzo, M, V. Proteoglycans: structure, biology and molecular interactions. Marcel Dekker Inc. New York, 2000 : 27–59.
14. Kemp, L. E., Mulloy, B., Gherardi, E. Signalling by HGF/SF and Met: the role of heparan sulphate co-receptors. Biochem. Soc. Trans., 2006 : 414–417.
15. Brown, D. M., Michels, M., Kaiser, P. K., Heier, J. S., Sy, J. P., Ianchulev, T. Ranibizumab versus Verteporfin Photodynamic Therapy for Neovascular Age-Related Macular Degeneration: Two-Year Results of the ANCHOR Study. Ophthalmology, 2009 : 57–65.
16. Shah, D. K., Menon, K. M., Cabrera, L. M., Vahratian, A. , Kavoussi, S. K., Lebovic, D. I. Thiazolidinediones decrease vascular endothelial growth factor (VEGF) production by human luteinized granulosa cells in vitro. Fertil. Steril., 2010 : 2042–2047.
17. Svobodova, S., Topolcan, O., Holubec, L. Jr., Levy, M., Pecen, L., Svacina, S. Parameters of biological activity in colorectal cancer. Anticancer Res., 2011 : 373–378.
18. Jacobs, E. T., Martínez, M. E., Alberts, D. S., Ashbeck, E. L., Gapstur, S. M., Lance, P., Thompson, P. A. Plasma insulin-like growth factor I is inversely associated with colorectal adenoma recurrence: a novel hypothesis. Cancer Epidemiol Biomarkers Prev., 2008 : 300–305.
19. Herbst, R. S. Review of epidermal growth factor receptor biology. International Journal of Radiation Oncology, Biology, Physics, 2004 : 21–26.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2011 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Současná onkochirurgie a kód multidisciplinárního týmu
- Trendy v léčbě jaterních metastáz kolorektálního karcinomu v Japonsku
- Stimulace sakrálního nervu v léčbě fekální inkontinence – první zkušenosti v České republice a hodnocení funkčních výsledků
- Incidence a rizikové faktory vzniku střevní ischemie u pacientů po resekci AAA v našem souboru z let 2005–2009
- IGF1 a nádorové markery ve stadiích nádoru prsu
- Transrektální hybridní NOTES versus laparoskopická cholecystektomie – randomizovaná prospektivní studie na velkém laboratorním zvířeti
- Torzia dystopickej sleziny – možnosti riešenia
- Zpráva z 21. světového kongresu IASGO – International Association of Surgeons, Gastroenterologists and Oncologists
- Karcinom rekta, totální mezorektální excize. Současné trendy v zobrazování a hodnocení kvality. Workshop za účasti prof. R. J. Healda
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Stimulace sakrálního nervu v léčbě fekální inkontinence – první zkušenosti v České republice a hodnocení funkčních výsledků
- Torzia dystopickej sleziny – možnosti riešenia
- IGF1 a nádorové markery ve stadiích nádoru prsu
- Incidence a rizikové faktory vzniku střevní ischemie u pacientů po resekci AAA v našem souboru z let 2005–2009
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



