-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Klinické prognostické faktory kolorektálního karcinomu po jeho radikální léčbě
Prognostic clinical factors in colorectal cancer after radical therapy
Introduction:
Colorectal anastomoses frequently become the site of of complications after surgical procedures for colorectal cancer. Anastomotic dehiscence has a significant impact on the whole p postoperative disease course, may influence the overal survival (OS) and disease free interval (DFI). The aim of our study was to analyze clinical and histopathological factors, that could facilitate detection of dehiscences and are related to the prognosis of patients.Material and methods:
The authors performed statistical analysis of a cohort of patients (340 pacients, 207 males, 133 females) who underwent radical resection followed by anastomosis on the large intestine during 2003–2007. The following factors were assessed: age, gender, staging, protective stoma, neoadjuvant chemotherapy, neoadjuvant radiotherapy, adjuvant chemotherapy, adjuvant radiotherapy and anastomotic insufficiency. Complications were evaluated according to Clavien and Dindo classification.Results:
The analysis confirmed the following factors to be statistically significant for prognosis of OS and DFI: In stage T4 subjects, the risk of death was 2.5 x higher and the risk of recurrence was 1.9 x higher than in the lower disease stage subjects. The presence of N2 lymph node metastases increases the risk of death 3.7 x and the risk of recurrence 3.6 x, compared to N0 and N1 cases. The presence of postoperative complications classified asf III. – V. grade according to Clavien and Dindo classification increases the risk of death 4x. The risk of death was 5.5 x higher in patients with dehiscence of anastomosis. The surprising finding was that even protective stoma increases the risk of death 5.4 x. Patients who did not undergo adjuvant chemotherapy were at 2 x higher risk of death. In patients with IIIA, IIIB, IV, V complications, the following factors proved to be statistically significant for prognosis of OS: leakage, protective stoma, adjuvant chemotherapy and adjuvant oncological treatment. In patients with complications I and II, the following factors were proved to be statistically significant for prognosis of OS: staging and lymph nodes metastases. Multivariate analysis CART confirmed significant correlation between the lymph nodes positivity and the Clavien and Dindo classification of complications.Conclusion:
Analysis of clinical and histopathological factors is important for prediction of prognosis in patients with colorectal cancer after radical surgical treatment. Detection and application of these prognostic factors in postoperative period could influence the strategy of treatment and thus the overal survival in patients with radical resections for colorectal carcinoma. Non – administration of adjutant chemotherapy results in a significant decrease in OS and DFI.Key words:
colorectal cancer – postoperative complication – Clavien-Dindo classification – overal survival – disease free interval – prognosis.
Autori: P. Novák; V. Liška; V. Třeška; J. Kopalová; O. Vyčítal; J. Brůha
Pôsobisko autorov: Chirurgická klinika LFUK a FN Plzeň, Karlova univerzita v Praze, přednosta: Prof. MUDr. Vladislav Třeška, DrSc.
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 4, s. 219-229.
Kategória: Původní práce
Súhrn
Úvod:
Střevní anastomózy jsou častým místem komplikací operací kolorektálního karcinomu. Dehiscence anastomózy značně ovlivňuje pooperační průběh a může ovlivňovat i celkové přežití (OS) a bezpříznakové přežití (DFI). Cílem studie byla analýza klinicko-patologických faktorů, které mohou odhalit dehiscenci a mají vztah k další prognóze nemocných.Materiál a metoda:
Byla provedena statistická analýza souboru nemocných (340 pacientů, 207 mužů, 133 žen) s kolorektálním karcinomem, řešených radikální resekcí s provedením anastomózy na tlustém střevě či rektu v letech 2003–2007. Mezi studované faktory byly zařazeny: věk, pohlaví, staging, protektivní stomie, neoadjuvantní chemoterapie, neoadjuvantní radioterapie, adjuvantní chemoterapie, adjuvantní radioterapie, insuficience anastomózy. Komplikace byly hodnocené dle Claviena a Dinda.Výsledky:
Provedená analýza prokázala jako statisticky signifikantní pro prognózu celkového přežití nemocných tyto faktory. Nemocní se stadiem T4 měli 2,5krát vyšší riziko úmrtí než nemocní s nižšími stadii malignity a 1,9krát vyšší riziko recidivy. Při uzlinovém postižení N2 měli nemocní 3,7krát vyšší riziko úmrtí než nemocní s N0 a N1 uzlinovým postižením a 3,6krát vyšší riziko recidivy malignity. Přítomnost pooperační komplikace III.–V. stupně podle Clavienovy klasifikace zvyšovala riziko úmrtí 4krát. Nemocní s dehiscencí anastomózy měli 5,5krát vyšší riziko úmrtí. Překvapivě i přítomnost protektivní stomie zvyšovala riziko úmrtí 5,4krát. V případě nepodání adjuvantní chemoterapie se riziko úmrtí zvýšilo 2krát. U pacientů s komplikacemi IIIA, IIIB, IV a V hodnocených na základě stupnice dle Claviena a Dinda byly statisticky významné tyto parametry: leak, protektivní stomie, adjuvantní chemoterapie, adjuvantní léčba. U pacientů s komplikacemi I a II byla statistická významnost vyhodnocena u rozsahu primárního tumoru pozitivity lymfatických uzlin. Multivariační analýzou CART byly prokázány silné vztahy u pozitivity lymfatických uzlin a Clavienova hodnocení komplikací.Závěr:
Analýza klinicko-patologických faktorů je důležitá pro predikci prognózy pacientů s kolorektálním karcinomem, po jejich radikální léčbě. Sledování a zohledňování těchto prognostických faktorů v pooperačním období může ovlivnit strategii léčby a tím i celkové přežívání nemocných po radikální resekci kolorektálního karcinomu. Nepodání adjuvantní chemoterapie významně snižuje celkové a bezpříznakové přežití.Klíčová slova:
kolorektální karcinom – pooperační komplikace – Clavien-Dindo klasifikace – celkové a bezpříznakové přežití – prognóza
Projekt byl podpořen grantem IGA MZ CR NR 12025.Úvod
Kolorektální karcinom (KRCa) lze považovat za celospolečenský problém. Patří mezi nejčastější nádory bez rozdílu pohlaví a věku. V určitých věkových skupinách je vůbec nejčastější malignitou. Každý rok je v České republice nově diagnostikováno v průměru 8000 nových případů a 5000 pacientů na tuto chorobu zemře [1].
Prognostické faktory KRCa lze rozdělit do tří skupin: 1. Faktory biologického chování nádoru. 2. Faktory pacientovy odpovědi na nádorové onemocnění. 3. Faktory ve vztahu k léčbě. Ve výsledku se prakticky jedná o kombinaci všech tří aspektů. Naše práce byla zaměřena na faktory, které souvisejí s léčbou. Rozhodujícím faktorem z hlediska prognózy je radikální operace a R0 odstranění nádoru. S tím samozřejmě úzce souvisejí faktory biologického chování nádoru. Jeho stadia, invazivity, přítomnosti vzdálených metastáz. Tyto faktory jsou nejlépe hodnotitelné dle TNM klasifikace. Dalším důležitým faktorem, který má podíl na výskytu hlavně lokální recidivy, je komplikovaný pooperační průběh ve smyslu infekčních komplikací při prosakování či dehiscencí anastomóz. [2].
Tyto komplikace mají jednak bezprostřední dopad ve formě těžkých sepsí někdy s ireverzibilním průběhem a úmrtím nemocného, a jednak dopad z hlediska dlouhodobé prognózy. Zjistilo se, že nemocní, kteří měli v pooperačním období zánětlivou komplikaci ve smyslu prosakování nebo dehiscence anastomózy, měli častější výskyt lokální recidivy a významně snížené celkové přežití [3, 4, 5, 6, 7, 8, 8, 10]. V literatuře jsme našli i práce, které tuto hypotézu nepotvrdily [11, 12, 13, 14].
Existuje několik teorií, které vysvětlují mechanismus důvodu vyššího výskytu lokálních recidiv a snížení celkového přežití nemocných při prosakování anastomóz. Jedna z teorií je výskyt životaschopných nádorových buněk v místě anastomózy [15, 16]. V případě prosakování se mohou tyto buňky dostat do okolí a způsobit recidivu onemocnění. Dále se na tomto mechanismu podílejí volné cirkulující nádorové buňky, které mohou být příčinou vzdálených metastáz, čímž dochází i ke snížení doby přežití [1, 17]. V případě infekce, která je způsobena prosakováním z anastomózy, může dojít k systémové zánětlivé odpovědi organismu a vyplavení zánětlivých cytokinů, které mohou změnit imunitu a podpořit růst zbytkových implantovaných nádorových buněk [18, 19]. Určitě se na horší prognóze u pacientů s prosakováním anastomózy podílí i ten fakt, že se významně prodlouží vlastní pooperační období, čímž dojde k pozdějšímu zahájení následné onkologické léčby. V některých případech z důvodu dlouhodobého pooperačního stonání není onkologická léčba ani zahajována.
Prosakování střevního obsahu anastomózou je poruchou zásadního významu. Klinický projev záleží na umístění anastomózy, na obsahu střeva, předoperační přípravě střeva, množství uniklého obsahu a možnostech dutiny břišní stran schopnosti ohraničit tento infekční materiál. Větší únik střevního obsahu může vést k difúzní sterkorální peritonitidě, ke vzniku abscesu nebo píštěle. Řada prací prokázala, že k drobnému úniku může docházet až u 50 % anastomóz, ale klinicky se projeví jen asi v 5 %. Výskyt rentgenologicky prokázaných úniků podstatně převyšuje jejich počet zjištěný na základě klinických příznaků [20]. Hlavním faktorem, který ovlivňuje prosakování, popřípadě dehiscenci anastomózy, je výška anastomózy. Všechny anastomózy do 7 cm od análního okraje jsou vystaveny zvýšenému riziku prosakování a dehiscence. Dalšími faktory, které zvyšují riziko septické komplikace, jsou předoperační chemoterapie nebo radioterapie, mužské pohlaví, vyšší věk, abusus alkoholu a kouření, obezita, imunosuprese, podvýživa a diabetes mellitus [21, 22, 23]. Typ operace (laparoskopicky nebo otevřeně) a způsob šití (ručně nebo staplerem) nemají žádný význam z hlediska rizikového faktoru. Naopak na snížení rizika dehiscence anastomózy mají podle některých autorů vliv mobilizace lienální flexory, J-pouch anastomóza a zakládání protektivních stomií u nízkých resekcí rekta [22, 23, 24].
Nejčastěji dochází k prosakování anastomóz v levé polovině tračníku a rekta. Čím je anastomóza uložena distálněji, tím se zvyšuje riziko prosakování a dehiscencí anastomóz. Prosakování je definováno jako defekt integrity střevní stěny, který vede ke komunikaci mezi intra a extraluminálním prostorem. Pánevní absces v blízkosti anastomózy je taktéž považován za ohraničenou formu prosakování. Prosakování můžeme jako hlavní chirurgickou komplikaci z hlediska léčby rozdělit na tři stupně (Tab. 1).
Tab. 1. Rozdělení chirurgických komplikací z hlediska léčby Tab. 1: Distribution of surgical complications according to their treatment 
Z důvodu srovnání výsledků a kvality léčby v roce 1992 vytvořil Clavien klasifikaci pooperačních komplikací, která měla 4 stupně. První stupeň komplikací byl alternativou k ideálnímu pooperačnímu průběhu. Druhý stupeň byly stavy život ohrožující, ale bez trvalých následků. Do druhého stupně patřily komplikace vyžadující chirurgickou intervenci. Třetí stupeň zahrnoval rozšíření chirurgické intervence nebo perzistující život ohrožující stavy. Poslední čtvrtý stupeň byla smrt jako následek pooperačních komplikací [25]. Tuto klasifikaci dále v roce 2004 rozpracoval Dindo. V současné době se tato klasifikace používá k obecnému popisu pooperačních komplikací (Tab. 2) [26, 27].
Tab. 2. Clavien-Dindo klasifikace chirurgických komplikací Tab. 2: Clavien-Dindo classification of surgical complications 
Klinický obraz prosakování nebo dehiscence je velmi pestrý. Mezi klinické příznaky patří subfebrilie až febrilie, tachykardie, tachypnoe, citlivost nebo bolestivost břicha, peritonismus, elevace zánětlivých parametrů, zkalená, hnisavá, enterální nebo sterkorální sekrece z drénů, odchod plynů a zápach podél drénů, radiologický průkaz kolekce či nálezu plynu v okolí anastomózy [28]. V tabulce 3 jsou popsány charakteristické příznaky ke stupňům prosakování [29].
Tab. 3. Typické klinické charakteristiky pacientů s různými stupni závažnosti úniku z anastomózy Tab. 3: Typical clinical characteristics of patiens with various severity of anastomotic leakage 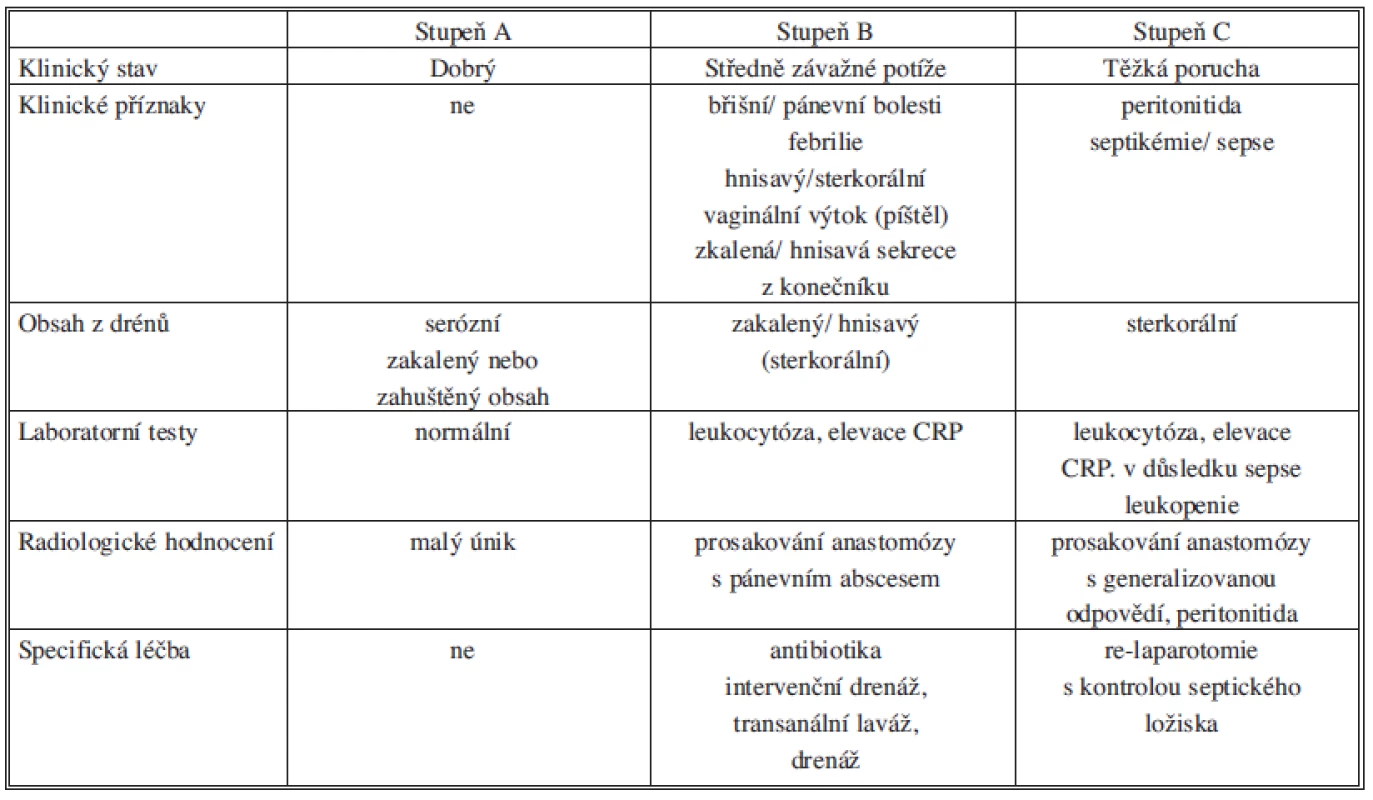
Materiál a metoda
Do retrospektivní studie byli zařazeni pacienti, kteří byli léčeni na Chirurgické klinice FN Plzeň v letech 2003–2007. Podmínkou zařazení do této studie byla R0 resekce kolorektálního karcinomu s provedením anastomózy. Tento soubor zahrnoval 340 pacientů, 207 mužů a 133 žen. Průměrný věk byl 69 let (32–91 let). Přehled výkonů uvádí Tab. 4.
Tab. 4. Přehled operačních výkonů Tab. 4: Summary of surgical procedures 
Celkově zemřelo 64 nemocných, to znamená 18,8 % pacientů z našeho souboru. Bezprostředně na následky pooperačních komplikací zemřelo 5,8 % nemocných, 6,4 % nemocných zemřelo s odstupem 1–5 let na generalizaci základního onemocnění. Prokázaný leak z anastomózy mělo 12 pacientů (3,5 %). Celkové úmrtí v této skupině bylo 58,3 %. Na pooperační komplikace zemřeli 4 nemocní (33,3 %). Tři pacienti (25,0 %) zemřeli s odstupem 1–4 let na recidivu KRCa. Protektivní stomii mělo založeno 12 pacientů. U sedmi z nich byla stomie založena v rámci reoperace pro dehiscenci anastomózy. Adjuvantní chemoterapii podstoupilo 29,8 % nemocných z celého souboru 340 pacientů. Ve skupině pacientů s leakem byla pouze v jednom případě provedena adjuvantní onkologická léčba – radioterapie. Analýza celkového přežití (OS) a bezpříznakového přežití (DFI) ve vztahu ke studovaným faktorům byla zpracována pomocí Kaplan-Maierových křivek (LogRank test, Wilcoxon test). Byla provedena multivariační analýza CART zkoumaných faktorů s cílem identifikovat nejvýznamnější prognostické faktory recidivy (bezpříznakového přežití) a celkového přežití nemocných. U spojitých proměnných bylo testováno několik vhodných cut off a za „optimální cut off“ byla prohlášena taková, u které byla v Coxově regresním modelu nalezena nejvyšší statistická signifikace. Rozdíly v přežití mezi zkoumanými skupinami byly testovány pomocí Log-rank testu. U nemocných jsme sledovali věk, staging onemocnění, uzlinové postižení, podání adjuvatní chemoterapie, pooperační komplikace a vliv těchto faktorů na celkové a bezpříznakové přežití.
Výsledky
Provedená statistická analýza při hladině významnosti p-value < 0,05 prokázala věk nad 70 let, pokročilost KRCa (ve smyslu pokročilého stagingu onemocnění), pooperační komplikace, protektivní stomii a nepodání adjuvantní chemoterapie jako prognosticky významné negativní faktory celkového přežití. Pacienti starší 70 let měli 1,7krát větší riziko úmrtí (Graf 1). Nemocní se stadiem T4 měli 2,5krát vyšší riziko úmrtí než nemocní s nižšími stadii malignity (Graf 2) a 1,9krát vyšší riziko recidivy (Graf 3). Při uzlinovém postižení N2 měli nemocní 3,7krát vyšší riziko úmrtí než nemocní s N0 a N1 uzlinovým postižením (Graf 4) a 3,6krát vyšší riziko recidivy malignity (Graf 5). Přítomnost pooperační komplikace III.–V. stupně podle Clavienovy klasifikace zvyšovala riziko úmrtí 4krát (Graf 6). Nemocní s dehiscencí anastomózy měli 5,5krát vyšší riziko úmrtí (Graf 7). Překvapivě i přítomnost protektivní stomie zvyšovala riziko úmrtí 5,4krát (Graf 8). V případě nepodání adjuvantní chemoterapie se riziko úmrtí zvýšilo 2krát (graf 9). U pacientů s komplikacemi IIIA, IIIB, IV a V hodnocených na základě stupnice dle Claviena a Dinda byly statisticky významné pro celkové přežití tyto parametry: leak (Graf 10), protektivní stomie (Graf 11), adjuvantní chemoterapie (Graf 12) a adjuvantní léčba (chemoterapie nebo radioterapie)(Graf 13). U pacientů s komplikacemi I a II byla statistická významnost prokázána u rozsahu primárního tumoru (Graf 14) a pozitivity lymfatických uzlin (Graf 15). Multivariační analýzou CART celého souboru nemocných byly prokázány silné vztahy k endpointu (kratší celkové přežití a smrt) u kombinace pozitivity lymfatických uzlin a Clavienova hodnocení komplikací (Graf 16).
Graf 1. Věk jako rizikový faktor úmrtí, cut off 70 let Graph 1: Age as a risk factor for death, cut off 70 years 
Graf 2. Lokální pokročilost nádoru jako rizikový faktor krátkého celkového přežití nemocných Graph 2: Localmalignancy stage as a risk factor for short overal survival 
Graf 3. Lokální pokročilost nádoru jako rizikový faktor krátkého bezpříznakového přežití nemocných. Graph 3: Local malignancy stage as a risk factor for short disease free interval 
Graf 4. Uzlinové postižení jako rizikový faktor krátkého celkového přežití Graph 4: Lymph nodes infiltration as a risk factor for short overal survival 
Graf 5. Uzlinové postižení jako rizikový faktor krátkého bezpříznakového přežití Graph 5: Lymph nodes infiltration as a risk factor for short disease free interval 
Graf 6. Pooperační komplikace hodnocené dle Claviena a Dinda jako rizikový faktor krátkého celkového přežití Graph 6: Postoperative complications evaluated according to Clavien and Dindo classification as a risk factor for short overal survival 
Graf 7. Leak z anastomózy jako rizikový faktor krátkého celkového přežití Graph 7: Leakage from anastomosis as a risk factor for short overal survival 
Graf 8. Význam protektivní stomie pro celkové přežití nemocných Graph 8: Importance of protective stoma for overal survival 
Graf 9. Adjuvantní chemoterapie jako prognostický faktor celkového přežití Graph 9: Adjuvant chemotherapy as a prognostic factor for short overal survival 
Graf 10. Leak z anastomózy jako rizikový faktor krátkého celkového přežití u skupiny pacientů s komplikacemi IIIA, IIIB, IV, V hodnocenými dle Claviena a Dinda Graph 10: Leakage from anastomosis as a risk factor for short overal survival at the cohort of patiens with Grade IIIA, IIIB, IV, V complications evaluated according to Clavien and Dindo 
Graf 11. Význam protektivní stomie pro celkové přežití nemocných s komplikacemi IIIA, IIIB, IV a V hodnocenými dle Claviena a Dinda Graph 11: Importance of protective stoma for overal survival in patiens with Grade IIIA, IIIB, IV, V complications evaluated according to Clavien and Dindo 
Graf 12. Adjuvantní chemoterapie jako prognostický faktor celkového přežití nemocných s komplikacemi IIIA, IIIB, IV a V hodnocenými dle Claviena a Dinda Graph 12: Adjuvant chemotherapy as a prognostic factor for overal survival in patients with Grade IIIA, IIIB, IV, V complications evaluated according to Clavien and Dindo 
Graf 13. Adjuvantní chemoterapie nebo radioterapie jako prognostický faktor celkového přežití nemocných s komplikacemi IIIA, IIIB, IV a V hodnocenými dle Claviena a Dinda Graph 13: Adjuvant chemotherapy or radiotherapy as a prognostic factor for overal survival in patients with Grade IIIA, IIIB, IV, V complications evaluated according to Clavien and Dindo 
Graf 14. Lokální pokročilost primárního tumoru jako prognostický faktor celkového přežití ve skupině pacientů s komplikacemi I a II hodnocenými dle Claviena a Dinda Graph 14: Local primary tumor stage as a prognostic factor for overal survival in a cohort of patients with Grade I and II complications, assessed according to Clavien and Dindo 
Graf 15. Pozitivita lymfatických uzlin jako prognostický faktor celkového přežití ve skupině pacientů s komplikacemi I a II hodnocenými dle Claviena a Dinda Graph 15: Positivity of lymph nodes as a prognostic factor for overal survival in a cohort of patients with Grade I and II complications according to Clavien and Dindo 
Graf 16. Multivariační analýzou CART celého souboru nemocných byly prokázány silné vztahy k endpointu (nižší celkové přežití) u kombinace pozitivity lymfatických uzlin, Clavienova hodnocení komplikací a lokálního rozsahu tumoru Graph 16: Multivariate analysis CART of the whole group of patients confirmed strong correlation between the end point (short overal survival) and the combination of the following factors: positivity of lymf nodes, Clavien evaluation of complications and local primary tumor stage 
Diskuze
Výsledky naší studie potvrdily některé prognostické faktory uváděné v literatuře a dále i nová zjištění, která mohou přinést další pohled na léčbu a pooperační péči o nemocné po radikální operaci KRCa s primárně prováděnou anastomózou. Prokázali jsme, že vyšší věk, pokročilé stadium KRCa a pooperační komplikace mají prognosticky negativní vliv na délku celkového přežití. Z hlediska dlouhodobého přežívání jsou naše výsledky ve shodě s předchozími literárními zdroji, jejichž autoři prokázali snížení celkového přežití u nemocných s komplikacemi v oblasti anastomózy, ať už se jedná o leak nebo dehiscenci anastomózy [3, 4, 5, 6, 7, 9,10]. Otázkou zůstává vysvětlení tohoto zjištění. Tento proces je někdy vysvětlován jako nestandardní imunitní odpověď organismu na zánětlivou pooperační komplikaci, čímž může docházet k mikroskopickému šíření buněk nádoru do okolí a vzdálených orgánů. Další příčinou může být ve většině případů výskytu anastomotického leaku následná abscence adjuvantní chemoterapie nebo její odložená aplikace. Profit nemocných z adjuvantní onkologické léčby je prokázaný. Indikace a zahájení adjuvantní chemoterapie je individuální. Většina onkologických pracovišť se snaží o zahájení adjuvantní chemoterapie do 8 týdnů od operace. V literatuře je i statisticky prokázaný profit nemocných, kteří začali adjuvantní chemoterapii i po 8—10 týdnech od operace [30]. Jiný přístup je u adjuvantní radioterapie, která může být zahájena i několik měsíců po operaci. Tato korelace s podáním nebo nepodáním adjuvantní chemoterapie byla patrná i v našem souboru. Nepodání adjuvantní onkologické léčby zvyšovalo riziko úmrtí 2krát. Zajímavým výsledkem byl prognosticky negativní vliv protektivních stomií, které zvyšovaly riziko úmrtí 5,4krát. Na základě těchto poznatků se domníváme, že příčinou negativního charakteru prognostického faktoru protektivní stomie – je fakt, že většinou byly tyto stomie zakládány z důvodu pooperačních chirurgických komplikací a dalším důvodem je absence následné adjuvantní chemoterapie, která byla vyloučena z důvodů dalších komorbidit, jak vyplývá z podrobné analýzy našeho souboru.
Závěr
Analýza klinicko-patologických faktorů je důležitá pro predikci prognózy pacientů s kolorektálním karcinomem po jejich radikální léčbě. Pacienti hodnocení na základě časných pooperačních klinických příznaků mohou poukázat na ne zcela manifestní dehiscenci střevních anastomóz. Sledování a zohledňování těchto prognostických faktorů v pooperačním období může ovlivnit strategii léčby a tím i celkové přežívání nemocných po radikální resekci kolorektálního karcinomu. Nepodání adjuvantní chemoterapie významně snižuje celkové a bezpříznakové přežití.
Poděkování:
Práce byla podpořena grantem IGA MZ ČR 12025.
MUDr. Petr Novák
Hromnice 204
330 11 Hromnice, p. Třemošná
e-mail: novakp@fnplzen.cz
Zdroje
1. Pitule P, Liška V, Třeška V, Novák P, Čedíková M, Kralíčková M. Přínos molekulární biologie k diagnostice a léčbě kolorektálního karcinomu – současnost a budoucnost. Rozhl Chir 2011;90 : 315–32.
2. Lipská L, Visokai V. et al. Recidiva kolorektálního karcinomu, Grada Publishing, 2009 : 120–121.
3. Miccini M, Borghese O, Scarpini M, Cassini D, Gregori M, Amore Bonapasta S, Tocchi A. Anastomotic leakage and septic complications: impact on local recurrence in surgery of low rectal cancer. Ann Ital Chir 2011;82(2):117–23.
4. Mirnezami A, Mirnezami R, Chandrakumaran K, Sasapu K, Sagar P, Finan P. Increased local recurrence and reduced survival from colorectal cancer following anastomotic leak: systematic review and meta – analysis. Ann Surg 2011;253(5):890–9.
5. Law WL, Choi HK, Lee YM, Ho JW, Seto CL.: Anastomotic leakage is associated with poor long-term outcome in patients after curative colorectal resection for malignancy. J Gastrointest Surg 2007;11(1):8–15.
6. Law WL, Choi HK, Lee YM, Ho JW. The impact of postoperative complications on long-term outcomes following curative resection for colorectal cancer. Ann Surg Oncol 2007;14(9):2559–66. Epub 2007 May 24.
7. Chang SC, Lin JK, Yang SH, Jiang JK, Chen WC, Lin TC. Long-term outcome of anastomosis leakage after curative resection for mid and low rectal cancer. Hepatogastroenterology 2003;50(54): 1898–902.
8. Petersen S, Freitag M, Hellmich G, Ludwig K. Anastomotic leakage: impact on local recurrence and survival in surgery of colorectal cancer. Int. J. Colorect Dis (1998);13 : 160–163.
9. Branagan G. Prognosis after anastomotic leakage in colorectal Sumery. Dis Colon Rectum 2005;48;1021–1026.
10. McArdle CS, McMillan DC, Hole DJ. Impact of anastomotic leakage on long-term survival of patients undergoing curative resection for colorectal cancer. Br J Surg. 2005 Sep;92(9):1150–4.
11. Bertelsen CA, Andreasen AH, JŅrgensen T, Harling H. Danish Colorectal Cancer Group: Anastomotic leakage after curative anterior resection for rectal cancer: short and long-term outcome. Colorectal Dis 2010;12(7 Online):e76–81. Epub 2009 Apr 29.
12. Kressner U, Graf W, Mahteme H, PĆhlman L, Glimelius B. Septic complications and prognosis after surgery for rectal cancer. Dis Colon Rectum 2002;45(3):316–21.
13. Lee WS, Yun SH, Roh YN, Yun HR, Lee WY, Cho YB, Chun HK. Risk factors and clinical outcome for anastomotic leakage after total mesorectal excision for rectal cancer. World J Surg 2008;32(6): 1124–9.
14. Jörgren F, Johansson R, Damber L, Lindmark G. Anastomotic leakage after surgery for rectal cancer: a risk factor for local recurrence, distant metastasis and reduced cancer-specific survival? Colorectal Dis 2011;13(3):272–83. doi: 10.1111/j.1463–1318.2009. 02136.x.
15. Van den Tol PM, van Rossen EE, van Eijck CH, Bonthuis F, Marquet RL, Jeekel H. Reduction of peritoneal trauma by using nonsurgical gauze Leeds to less implantation metastasi sof spilled tumor cells. Ann Surg 1998;227 : 242–248.
16. Umpleby HC, Fermor B, Symes MO, Williamson RC. Viability of exfoliated colorectal carcinoma cells. Br J Surg 1984;71 : 659–663.
17. Molnar B, Ladanyi A, Tanko L, Sreter L, Tulassay Z. Circulating tumor cell clusters in the peripheral blood of colorectal cancer patiens. Clin Cancer Res 2001;7 : 4080–4085.
18. Mc Millan DC, Canna K, McArdle CS. Systemic inflammatoryresponse predicts survival following curative resection of colorectal cancer. Br J Surg 2003;90 : 215–219.
19. Balkwill F, Mantovani A. Inflammation and cancer: Back to Wirchow. 2001;357,539–545.
20. Hoch J. Akutní chirurgie tlustého střeva, Maxdorf, 1998 : 106–107.
21. Moran BJ. Predicting the risk and diminishing the consequences of anastomotic leakage after anterior resection for rectal cancer. Acta Chir Iugosl 2010;57(3):47–50.
22. Taflampas P, Christodoulakis M, Tsiftsis DD. Anastomotic leakage after low anterior resection for rectal cancer: facts, obscurity, and fiction. Surg Today 2009;39(3):183–8. Epub 2009 Mar 12.
23. Cong ZJ, Fu CG, Wang HT, Liu LJ, Zhang W, Wang H. Influencing factors of symptomatic anastomotic leakage after anterior resection of the rectum for cancer. World J Surg 2009;33(6):1292–7.
24. Feng C, Yao RQ, Huang FZ, Nie WP, Liu XY. Risk factors for anastomotic leakage after anterior resection for rectal cancer. Nan Fang Yi Ke Da Xue Xue Bao. 2011;31(5):908–10.
25. Clavien PA, Sanabria JR, Strasberg SM. Proposed classification of complications of surgery with examples of utility in cholecystektomy. Surgery 1992;111 : 518–26.
26. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with valuation in a cohort of 6336 patients and results of a survey. Ann Surg 2004;240(2):205–13.
27. Clavien PA, Barkun J, de Oliveira ML, Vauthey JN, Dindo D, Schulick RD, de SantibaĖes E, Pekolj J, Slankamenac K, Bassi C, Graf R, Vonlanthen R, Padbury R, Cameron JL, Makuuchi M.: The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg 2009;250(2):187–96.
28. Lipska MA, Bissett IP, Parry BR, Merrie AE. Anastomotic leakage after lower gastrointestinal anastomosis: men are at a higher risk. ANZ J Surg 2006;76 : 579–85.
29. Rahbari N, Weitz J, Hohenberger W, Heald JR, Moran B, Ulrich A. Definition and grading of anastomotic leakage following anterior resection of the rectum: A proposal by the International Study Group of Rectal Cancer Surgery 2010;147 : 339–51.
30. Czaykowski PM, Gill S, Kennecke HF, Gordon VL, Turner D. Adjuvant chemotherapy for stage III colon cancer: does timing matter? Dis Colon Rectum 2011;54(9):1082–9.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2012 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Budoucnost úrazové chirurgie u nás
- GIST: Novodobé poznatky a léčebné modality
- Kvalita života je důležitým faktorem indikační rozvahy u nemocných s pokročilým karcinomem pankreatu – multicentrická prospektivní studie
- Biomarkery detekce minimální systémové diseminace u nemocných s karcinomem plic
- Prevence parastomální hernie primoimplantací síťky laparoskopicky – první zkušenosti
- Klinické prognostické faktory kolorektálního karcinomu po jeho radikální léčbě
- Laparoskopická adrenalektomie – indikace a selekční kritéria
- Retroperitoneoskopická adrenalektomie dorzálním přístupem
- Překlad knihy Schein´s Common Sense Emergency Abdominal Surgery – Urgentní břišní chirurgie
- Extragastrointestinální stromální tumor (EGIST)
- McKittrick-Wheelockov syndróm: Komplikácia mucinózneho adenómu rekta
- Gastrointestinal Cancers Symposium
- XXI. Jarní setkání Loket – pokroky v léčbě nemocných s karcinomem pankreatu
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- GIST: Novodobé poznatky a léčebné modality
- Laparoskopická adrenalektomie – indikace a selekční kritéria
- Prevence parastomální hernie primoimplantací síťky laparoskopicky – první zkušenosti
- Extragastrointestinální stromální tumor (EGIST)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



