-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Krvácení do hrudní stěny jako komplikace antikoagulační léčby – kazuistika
Chest wall haemorrhage as a complication of anticoagulation treatment – a case study
Low-molecular-weight heparins (LMWH) are a class of medication used as an anticoagulant. They belong amongst the so called direct anticoagulants. The effect on the coagulation cascade is mediated through the inactivation of anti-factor Xa. They are used in prophylaxis of thrombosis because of their lack of fibrinolytic effect. If the dosage is adequate, the effect on the bleeding time is minimal and thus monitoring is not necessary unlike in case of direct anticoagulants. Nevertheless, the monitoring is advisable in patients with renal insufficiency in whom the renal elimination of LMWH and their metabolites is reduced, hence they can cumulate in the organism and increase the risk of various bleeding complications.
We present a case study of an 83-year-old patient with a massive subcutaneous haematoma caused by the cumulation of LMWH and with the subsequent huge defect of the chest wall treated with negative wound pressure therapy (Vacuum Assisted Closure – V.A.C.)Key words:
low-molecular – weight heparin – renal insufficiency – bleeding – antiXa – negative pressure wound therapy
Autori: L. Bébarová 1; T. Řezáč 1; Dušan Klos 1
; M. Šimek 2; Č. Neoral 1
Pôsobisko autorov: I. chirurgická klinika LF UP a FN Olomouc, přednosta: doc. MUDr. Č. Neoral, CSc. 1; Kardiochirurgická klinika LF UP a FN Olomouc, přednosta: Doc. MUDr. V. Lonský, Ph. D. 2
Vyšlo v časopise: Rozhl. Chir., 2013, roč. 92, č. 2, s. 95-97.
Kategória: Kazuistiky
Súhrn
Nízkomolekulární hepariny (LMWH) jsou látky snižující krevní srážlivost. Řadí se mezi takzvaná přímá antikoagulancia, jejichž účinek na koagulační kaskádu je zprostředkován inaktivací faktoru Xa. Využívají se k prevenci vzniku trombů, vzhledem k absenci fibrinolytického účinku. Při správném dávkování dochází jen k minimálnímu ovlivnění krvácivosti, a monitorace není tedy u těchto látek, na rozdíl od nepřímých antikoagulancií, nutná. Je však vhodná zejména u pacientů s limitovanými renálními funkcemi, u nichž je sníženo vylučování LMWH a jejich metabolitů močí, a tudíž dochází k jejich kumulaci v organismu a zvýšení rizika krvácivých komplikací.
Prezentujeme případ 83leté pacientky s masivním hematomem podkoží vzniklým v důsledku kumulace LMWH a následným rozsáhlým defektem hrudní stěny léčeným metodou podtlakové terapie (Vacuum Assisted Closure – V.A.C.).Klíčová slova:
nízkomolekulární hepariny – renální insuficience – krvácení – antiXa – podtlaková terapieKazuistika
83letá obézní pacientka s bohatou kardiologickou anamnézou prodělala 7. 6. 2011 kardiochirurgickou operaci s náhradou aortální chlopně mechanickou protézou. Vlastní výkon byl komplikován rupturou ascendentní aorty řešenou záplatou. Další pooperační průběh byl již bez komplikací, u pacientky byla zahájena antikoagulační léčba kombinací Fraxiparine 1,0 ml a Warfarinu 10 mg denně a pacientka byla cestou interní kliniky přeložena do lázeňského zařízení. Zde došlo k postupnému zhoršování jejího zdravotního stavu s kardiální dekompenzací, pro niž byla vyšetřena ve spádovém zdravotnickém zařízení. Byl zjištěn levostranný fluidothorax, který byl zadrénován, a pro anurii při renální insuficienci zahájena kontinuální dialýza (CVVHD). 24. 6. 2011 byla pacientka přeložena zpět na I. interní kliniku Fakultní nemocnice Olomouc. Antikoagulační léčba byla v té době zajištěna pomocí Clexane 0,8 ml dvakrát denně.
Po přechodné stabilizaci stavu došlo 16. 7. 2011 k rozvoji objemného hematomu hrudní stěny vlevo (Obr. 1 a 2). Přes opakované podávání krevních derivátů stav progredoval do obrazu hemoragického šoku bez možnosti zvládnutí konzervativními postupy. Pro podezření na krvácení z poškozené interkostální tepny v důsledku punkce hrudníku byla pacientka indikována k operační revizi. Quickův čas byl 50 %, aktivovaný parciální tromboplastinový čas (aPTT) 41,7 s, INR 1,7 a hodnota antiXa faktoru 1,7 IU/ml. Při operační revizi provedené cévním chirurgem nebyl v ráně nalezen tepenný zdroj, jen difúzní, tzv. nechirurgické, krvácení. Bylo evakuováno zhruba 3000 ml tekuté krve a množství koagul, spodina rány byla ošetřena elektrokoagulací, opichy a argon laserem a aplikací Surgicelu, byla provedena sutura podkoží a kůže jen adaptačně a doporučena úprava koagulačních parametrů. Vzhledem k mimocévní příčině krvácení byla pacientka předána do péče naší kliniky, respektive hrudního chirurga. Rána v oblasti levé poloviny hrudníku sahala od levé lopatky až do zevních kvadrantů levého prsu, tedy se táhla v délce asi 30 cm.
Obr. 1, 2: Rozsáhlý hematom hrudní stěny vlevo (CT nález) Fig. 1, 2: Extensive haematoma of the left chest wall (CT scan) 
V průběhu hospitalizace na JIP přetrvával rozsáhlý tmavě fialový hematom hrudní stěny vlevo s indurací a postupně došlo i k nekróze samotných okrajů rány s prosakováním tmavé krve mezi rozvolněnými stehy. Laboratorně byla kromě již známé renální insuficience přítomna elevace zánětlivých parametrů. 11 dní po revizi byly z rány odstraněny 2 kožní stehy, evakuováno menší množství koagul a do rány byl vložen rukavicový drén. Pro nově vzniklou respirační insuficienci byla pacientka zaintubována a přeložena na KARIM. Vzhledem k nadále se zhoršujícímu stavu, jak celkovému, tak lokálnímu, byla rána v oblasti levého hrudníku 31. 7. kompletně rozpuštěna. Výsledkem byl defekt velikosti 30x15 cm s podminovanými okraji, vyplněný velkým množstvím koagul, pod nimiž se nacházela silně secernující spodina s páchnoucími černošedými nekrózami a četnými podkožními kapsami. Okolí rány s odbarvujícím se hematomem bylo zarudlé a indurované (Obr. 3).
Obr. 1. Stav rány před zahájením podtlakové terapie Fig. 3: The condition of the wound before negative pressure wound therapy (NPWT) 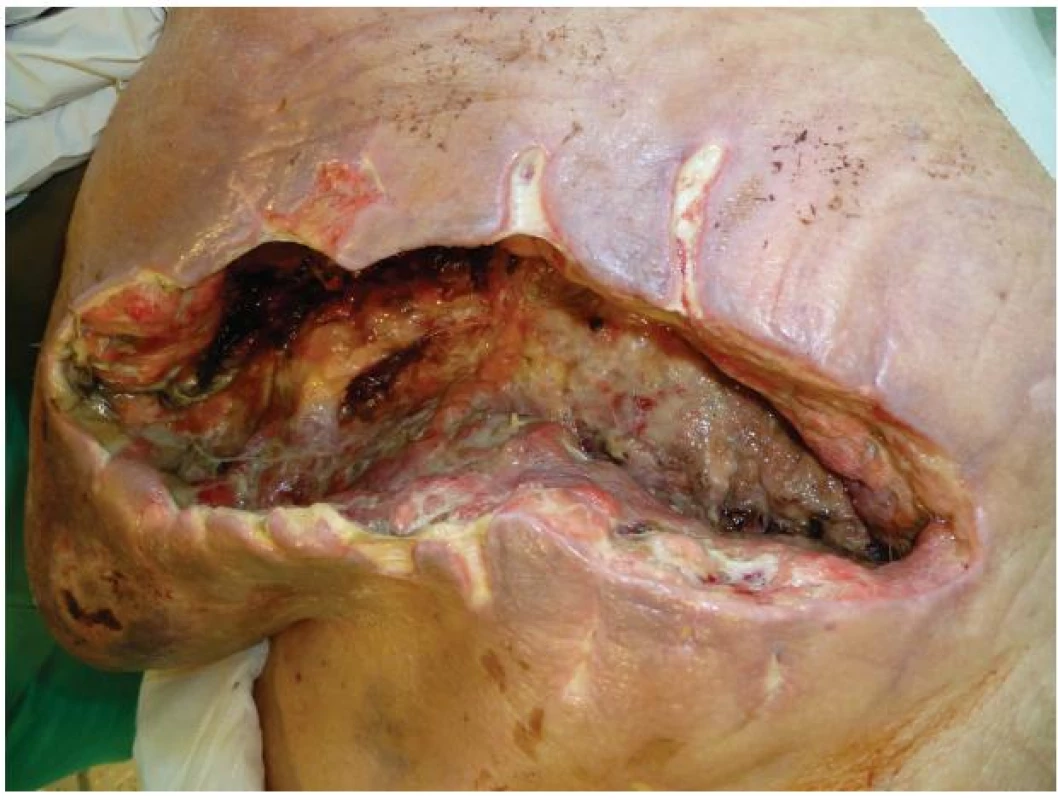
Mikrobiologické vyšetření prokázalo množství bakteriálních kmenů včetně multirezistentní Pseudomonas aeruginosa. Vzhledem k velikosti a charakteru defektu nebylo zpočátku možno použít žádnou z metod vlhkého hojení, a proto byla po důkladné nekrektomii aplikována metoda wet-to-dry pomocí obložek s Dermacynem či Prontosanem. Od chirurgické revize po celou dobu hospitalizace byla zajištěna celková antibiotická terapie, která byla průběžně upravována na základě mikrobiologických výsledků. Antikoagulační léčba byla udržována aplikací Fraxiparine 0,6 ml dvakrát denně.
Celkově nepříznivý stav polymorbidní pacientky v septickém stavu s přetrvávajícím bilaterálním fluidothoraxem při bilaterální pleuropneumonii, neodpojitelné od umělé plicní ventilace realizované přes tracheostomii a s nutností kontinuální hemodialýzy byl výrazně potencován špatným stavem rány v oblasti levého hrudníku. I přes ne úplně ideální podmínky jsme se rozhodli pro jedinou možnou metodu uzávěru rány, tedy aplikaci podtlakové terapie, tzv. V.A.C. systému. Ten byl poprvé naložen 11. 8. (Obr. 4). Po 12 hodinách však musela být terapie zastavena v důsledku masivního krvácení do drenážního systému. Pokračující sáknutí si poté vynutilo další operační revizi rány v celkové anestezii s ošetřením spodiny elektrokoagulací a argon laserem. Při kontrole koagulačních parametrů, respektive aktivity faktoru antiXa, byla zjištěna vysoká aktivita tohoto faktoru, jehož hodnota přesahovala horní terapeutickou hranici. Kardiochirurgem byla doporučena redukce dávkování na 2x0,4 ml, čímž bylo dosaženo dolní hranice terapeutické hodnoty 0,54 IU/ml. Ve dvoudenním odstupu byl opět naložen V.A.C. systém. Ten byl vyměněn celkem devětkrát v intervalu 3–4 dní. Po 6 týdnech terapie došlo ke zmenšení defektu hrudní stěny zhruba na polovinu jeho původní velikosti, spodina se téměř kompletně vyčistila, došlo k retrakci podkožních kapes, výraznému snížení bakteriální zátěže a rovněž částečnému zlepšení celkového stavu pacientky (Obr. 5). 29. 9. 2011 byla pacientka přeložena na spádové anesteziologické oddělení, kde zemřela v důsledku multiorgánového selhání.
Obr. 2. Aplikace negativního podtlaku Fig. 4: NPWT application 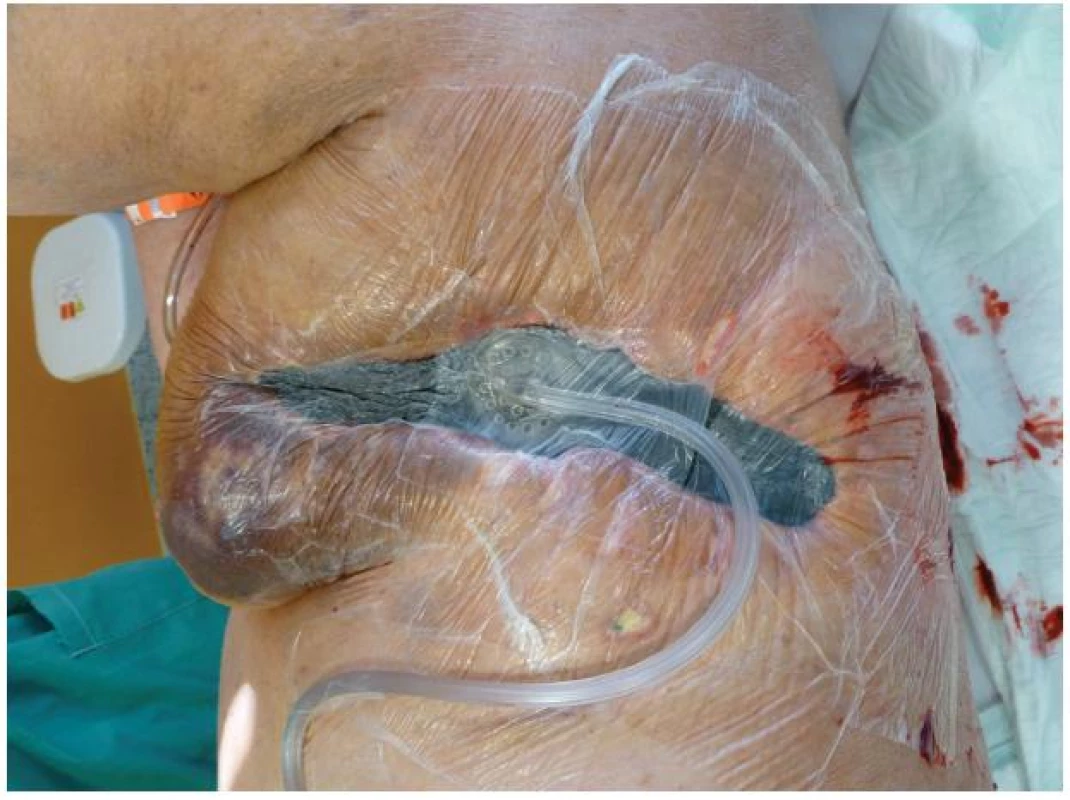
Obr. 3. Stav rány po 6 týdnech podtlakové terapie Fig. 5: The condition of the wound after 6 weeks of NPWT 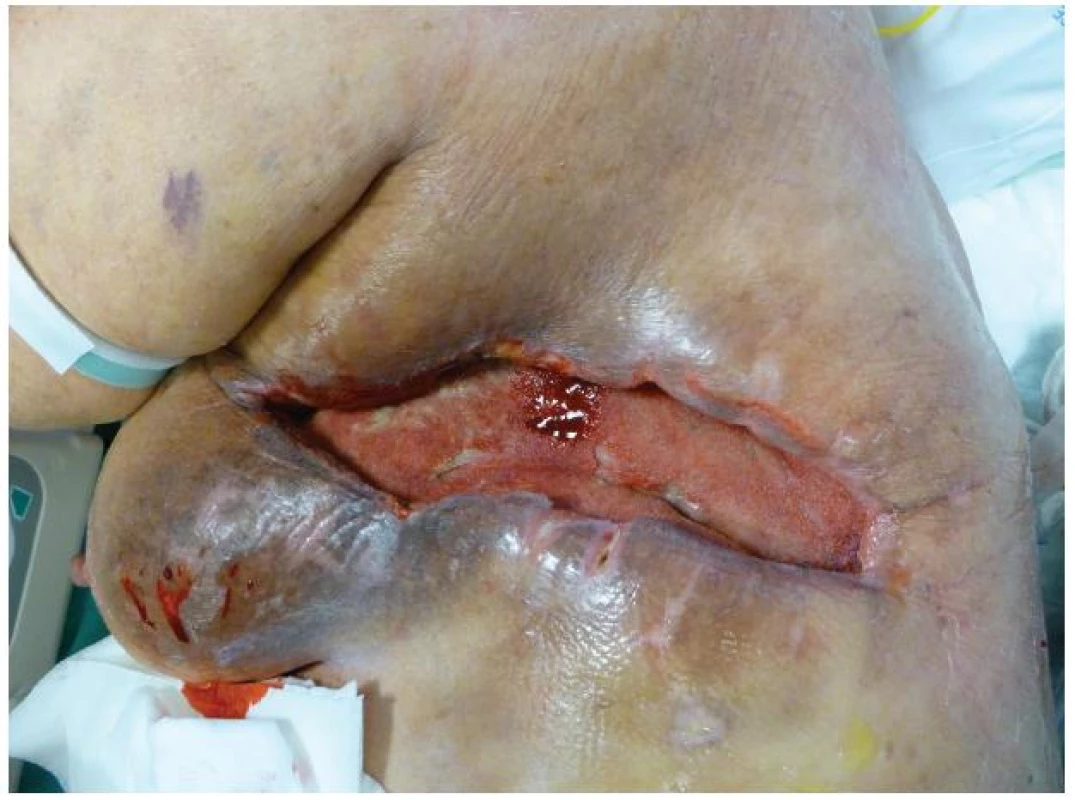
Diskuze
Nízkomolekulární hepariny jsou široce používaná antikoagulancia využívaná zejména profylakticky. Jsou považována za bezpečnou alternativu léčby, a to zejména díky svému snadnému podávání, dávkování a absenci nutnosti monitorace. Tato fakta jsou však uplatnitelná pouze za předpokladu normálních renálních funkcí. U pacientů s renální nedostatečností, či dokonce renálním selháním se riziko kumulace LMWH v organismu výrazně zvyšuje a následné krvácení se může stát život ohrožujícím stavem. Proto je u těchto pacientů velmi vhodná monitorace účinnosti LMWH, a to prostřednictvím stanovení aktivity faktoru antiXa v krevní plazmě, která by se měla pohybovat profylakticky mezi 0,2–0,4 IU/ml a terapeuticky mezi 0,5–1,2 IU/ml. Nutná je rovněž prevence úrazů rizikových pacientů. V případě, že dojde k rozvoji krvácivé komplikace, je nutné důkladně zvážit přínos chirurgické revize. Takto vzniklé defekty mohou mít značnou velikost a špatnou hojivost. Jednou z metod využitelných v terapii rozsáhlých jinak nezvládnutelných defektů je podtlaková terapie, jejímž principem je vytvoření negativního tlaku v ráně. Tím dochází k retrakci rány, podpoře granulace, odstranění přebytečného sekretu, redukci bakteriální zátěže a současně k prevenci další infekce rány. Nespornou výhodou podtlakové terapie je uzavřený systém, který usnadňuje ošetřovatelskou péči a zvyšuje komfort pacienta i ošetřujícího personálu.
MUDr. Linda Bébarová
Studentská 27
796 01 Prostějov
e-mail: nabaa@centrum.cz
Zdroje
1. Malý J. Nízkomolekulární hepariny. Remedia 2008;18 : 148–154.
2. Stryja J. Moderní postupy v léčbě nehojících se ran. Remedia 2010;20 : 180–184.
3. Hoffmann P, Keller F. Increased major bleeding risk in patients with kidney dysfunction receiving enoxaparin: a meta-analysis. Eur J Clin Pharmacol 2012;68(5):757–65.
4. Lim W, Dentali F, Eikelboom JW, Crowther MA.Meta-analysis: low-molecular-weight heparin and bleeding in patients with severe renal insufficiency. Ann Intern Med 2006;144(9):673–84.
5. Clark NP. Low-molecular-weight heparin use in the obese, elderly, and in renal insufficiency. Thromb Res 2008;123 Suppl 1:S58–61.
6. Lim W. Low-molecular-weight heparin in patients with chronic renal insufficiency. Intern Emerg Med 2008;3(4):319–23.
7. Nutescu EA, Spinler SA, Wittkowsky A, Dager WE. Low-molecular-weight heparins in renal impairment and obesity: available evidence and clinical practice recommendations across medical and surgical settings. Ann Pharmacother 2009;43(6): 1064-83.
8. Eisenstein DH. Anticoagulation management in the ambulatory surgical setting. AORN J 2012;95(4):510–21.
9. Bonar RA, Favaloro EJ, Marsden K. External quality assurance for heparin monitoring. Semin Thromb Hemost 2012;38(6): 632–9.
10. Beitz JM, van Rijswijk L. Content Validation of algorithms to guide negative Pressure wound therapy in adults with acute or Chronic wounds:a Cross-sectional study. Ostomy Wound Manage 2012;58(9):32–40.
11. Roberts DJ, at al. Negative-pressure wound therapy for critically ill adults with open abdominal wounds: A systematic review. J Trauma Acute Care Surg 2012;73(3):629–639.
12. Yamasaki O, Nagao Y, Sugiyama N, Otsuka M, Iwatsuki K. Surgical management of axillary necrotizing fasciitis: a case report. J Dermatol 2012;39(3):309–11.
13. Martindell D. The safe use of negative-pressure wound therapy. Am J Nurs 2012;112(6):59–63.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2013 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Ohlédnutí za trilaterálním sympoziem miniinvazivní chirurgie v Ostravě 2012
- Obecné komplikace laparoskopické operační techniky
- Komplikace laparoskopické cholecystektomie
- Komplikace laparoskopické splenektomie
- Komplikace chirurgické laparoskopické léčby achalázie
- Komplikace laparoskopických resekcí střeva
- Vývoj a postavení laparoskopie
- Zemřel profesor Miroslav Fára
- Pankreatická píštěl – definice, rizikové faktory a možnosti léčby
- Přínos robotického systému da Vinci v abdominální onkochirurgii – naše předběžné výsledky
- Laparoskopická plastika hernií v jazve po laparotómii – naše prvé skúsenosti
- Krvácení do hrudní stěny jako komplikace antikoagulační léčby – kazuistika
- Oboustranná perinatální torze semenného provazce – kazuistika a přehled literatury
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Obecné komplikace laparoskopické operační techniky
- Pankreatická píštěl – definice, rizikové faktory a možnosti léčby
- Komplikace laparoskopické cholecystektomie
- Komplikace laparoskopických resekcí střeva
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



