Výskyt venózního tromboembolismu u žen v časové souvislosti s užíváním hormonální antikoncepce
Venous thromboembolism in females in association with oral contraceptive use
Venous thromboembolism (VTE) is a multifactorial disease and a major cause of morbidity and mortality. Pulmonary embolism in not only one risk factor, but also postrombotic syndrome can result in decrease quality of life. The incidence of VTE in the population is approximately 1 per 1 000 per year. Absolute risk of VTE is less than 1 per 10 000 per year in women of reproductive age. Pregnancy and oral contraceptive use are common risks of venous thromboembolism in this population (the absolute risk is 3 to 6 VTE/ 10 000 women on contraceptives per year). 33% of Czech women of reproductive age are on oral contraceptives. Risk of the onset of venous thrombosis depends on: duration of use, age of female, type use of contraceptive pill, obesity and is also increased in the case of inherited thrombophilia. We analysed a cohort of 400 Czech females with thrombosis in association with oral contraceptive use with the regard to mean age at the time of thrombosis, frequency of inherited and acquired thrombophilia, frequency of additional risk factors for VTE and duration of oral contraceptive use until the onset of thrombosis.
Key words:
venous thromboembolismus, hormonal contraceptive pill, thrombophilia
Autori:
P. Ďulíček 1; P. Sadílek 1; M. Beránek 2; M. Pecka 1
Pôsobisko autorov:
IV. interní hematologická klinika, 2Oddělení klinické biochemie Fakultní nemocnice a Lékařská fakulta Univerzity Karlovy v Hradci Králové
1
Vyšlo v časopise:
Transfuze Hematol. dnes,19, 2013, No. 1, p. 33-38.
Kategória:
Souhrnné práce, původní práce, kazuistiky
Súhrn
Venózní tromboembolismus je multifaktoriální onemocnění a častou příčinou morbidity a mortality. Riziko nespočívá jen v plicní embolii, ale velmi závažné jsou i následky ve smyslu postrombotického syndromu, který vede ke změně kvality života. Incidence v populaci se udává 1/1000 obyvatel. Absolutní riziko je menší než 1/10 000 u žen v reprodukčním věku. Těhotenství a užívání hormonální antikoncepce patří mezi časté příčiny venózního tromboembolismu v této části populace (absolutní riziko je 3–6/10 000 za rok). V České republice 33 % žen v produktivním věku užívá hormonální antikoncepci. Riziko vzniku žilní trombózy závisí na délce užívání, věku uživatelky, typu antikoncepce, obezitě a na event. přítomnosti vrozeného trombofilního stavu. Ve skupině 400 českých žen s trombózou v časové souvislosti s užíváním hormonální antikoncepce hodnotíme medián věku v době trombózy, frekvenci výskytu vrozené nebo získané trombofilie, frekvenci přítomnosti dalšího rizikového momentu a délku užívání antikoncepce do vzniku trombózy.
Klíčová slova:
venózní tromboembolismus, hormonální antikoncepce, trombofilie
Úvod
Venózní tromboembolismus (VTE) stále představuje závažný medicínský a sociálně ekonomický problém. Přes stále rostoucí znalosti o etiologii VTE zůstává incidence v populaci stejná – 1/1000 a závisí na věku. Ve věkové kategorii do 45 let je o řád nižší a to 1/10 000 (1). V těchto věkových kategoriích incidence nezávisí na pohlaví. VTE je typickým představitelem onemocnění, které se manifestuje po vzájemné interakci genotypu a zevního prostředí. V naší populaci je 5-8 % jedinců s vrozeným trombofilním stavem, z toho polovina žen. Jedním z nejčastějších získaných rizikových faktorů pro VTE je ve věkové kategorii žen do 45 let užívání hormonální antikoncepce (OC). VTE je onemocněním multifaktoriálním. Hormonální antikoncepci užívá 33 % žen v produktivním věku.
Hemostáza a hormonální antikoncepce
Nasazení kombinované OC vede k následujícím, komplexním změnám hemostázy (2):
- zvýšení aktivity koagulačních faktorů – fibrinogenu, FII, FVII, F VIII, FX
- snížení inhibitorů krevního srážení – proteinu S (celkového i volného), může dojít i k mírnému snížení antitrombinu a navození získané APC-rezistence
- změnám fibrinolýzy
- ↑ TAFI (trombinem aktivovaný inhibitor fibrinolýzy)
- ↑ plazminogenu
- ↑ tPa (tkáňový aktivátor plazminogenu)
- ↓ PAI-I (inhibitor tkáňového aktivátoru plazminogenu)
Výsledkem těchto změn je vychýlení hemostázy směrem k trombóze a větší riziko VTE. Nutno však zdůraznit, že tyto změny jsou individuální a proto jsou ženy rozdělovány do 2 skupin dle odpovědi hemostázy: ženy s nízkou odpovědí – „low responders” a ženy s výraznější odpovědí „high responders“. Tyto změny hemostázy vedou tedy k většímu riziku VTE. Toto riziko je 2x–4x větší ve srovnání s normální populací (1–3/10 000) (3). Tento vztah byl poprvé popsán Jordanem v r. 1961 (4). První přípravky obsahovaly více než 100 µg estrogenu. Snížení obsahu estrogenu na 50 µg ethynilestradiolu (EED) skutečně vedlo k signifikantnímu snížení rizika VTE (5, 6, 7), ale další snížení EED na 30–35 µg vedlo k snížení rizika už jen 2x. Toho času není jednoznačných důkazů, že by OC s 20 µg EED byla méně riziková než OC s obsahem EED 30–35 µg (8), i když některé práce tvrdí opak. Riziko VTE nezáleží jen na obsahu EED, ale také na typu gestagenu. Metaanalýza studií porovnávajících riziko VTE u kombinované hormonální antikoncepce II. a III. generace prokázala 1,7x větší riziko III. generace (3x větší u žen užívající OC poprvé v životě) (9, 10). Pokud porovnáme vliv OC II. a III. generace na hemostázu (při stejném množství EED), tak při užívání OC III. generace dochází k: většímu zvýšení aktivity F VII, F II, F X (2), zvýšení TAFI (11), většímu poklesu proteinu S (jak volného, tak celkového) (11), rezistenci na aktivovaný protein C (12) (stanoveno trombin generačním testem). Také gestagen v OC III. generace méně „chrání” před účinky EED než gestagen II. generace. Přípravky obsahující cyproteron acetát mají stejné riziko VTE jako III. generace, přípravky obsahující drospirenon pak jako II. generace OC (27). Monofázické přípravky jsou spojené se stejným rizikem jako bifázické a trifázické.
Riziko venózního tromboembolismu při užívání hormonální antikoncepce
VTE je onemocnění multifaktoriální, proto se riziko VTE při užívání OC dále zvyšuje při přítomnosti dalších rizikových faktorů (RF) žilního tromboembolismu. Riziko VTE při užívání OC je při BMI > 25 asi 5–10x větší, při BMI > 30 více než 10x (13). K VTE také často dochází v souvislosti s operací, imobilizací dolní končetiny a dalšími rizikovými situacemi pro vznik VTE (pokud není žena zajištěna profylakticky nízkomolekulárním heparinem) (LMWH). Riziko VTE dále stoupá v přítomnosti vrozeného trombofilního stavu.
Vrozené trombofilní stavy a hormonální antikoncepce
Vzhledem k velkému množství poznatků o trombofilních stavech dnes víme, že toto riziko není u všech stejné.
Vrozené trombofilní stavy lze dělit do 2 základních skupin:
- skupina. Trombofilní stavy způsobené deficitem vrozených inhibitorů koagulace – deficit antitrombinu, proteinu C či proteinu S. Jejich četnost v populaci je nižší, ale riziko VTE vyšší než v 2. skupině.
- skupina. Mutace F V Leiden, mutace protrombinu G20210A. Ty jsou v populaci naopak velmi četné (závislost na geografické distribuci). Frekvence výskytu F V Leiden je u nás 2–5 %, mutace protrombinu 1–2 %. Vedou k tzv. získání funkce – větší generaci trombinu a patří mezi mírné rizikové faktory VTE (rizikovost však značně stoupá v homozygotní konstituci, která vzhledem k četnosti výskytu není vzácná). Homozygotní forma Leidenské mutace má stejný výskyt jako deficit antitrombinu. Také kombinace obou mutací je poměrně častá.
V populaci se vyskytují také získané trombofilní stavy – vysoká aktivita některého z koagulačních faktorů, nejčastěji F VIII, antifosfolipidový syndrom (APS). Hyperhomocysteinemie může být jak vrozená, tak získaná. Vlastní mutace MTHFR C677T bez zvýšené hladiny homocysteinu není trombofilní stav (14, 15,16), nicméně je u nás hojně vyšetřována. Vysoké riziko VTE je při deficitu antitrombinu (17). Po nasazení OC ženě s deficitem antitrombinu (samozřejmě dosud nediagnostikovaným) je riziko 70–80 %, že dojde k trombotické příhodě v prvních 6. měsících po nasazení. Tyto trombózy jsou většinou rozsáhlé – proximální, pánevní trombózy, často komplikované plicní embolií. Méně dat je o riziku VTE u deficitu proteinu C a S. Zde se většinou udává, že riziko je 6x–10x větší, ale záleží také na typu deficitu (18). Vzhledem k velké prevalenci mutace F V Leiden a protrombinové mutace (F II G20210A) je o riziku VTE nejvíce informací. Riziko VTE při užívání kombinované OC u ženy s Leidenskou mutací lze vyčíslit následovně – viz tabulka l (19).
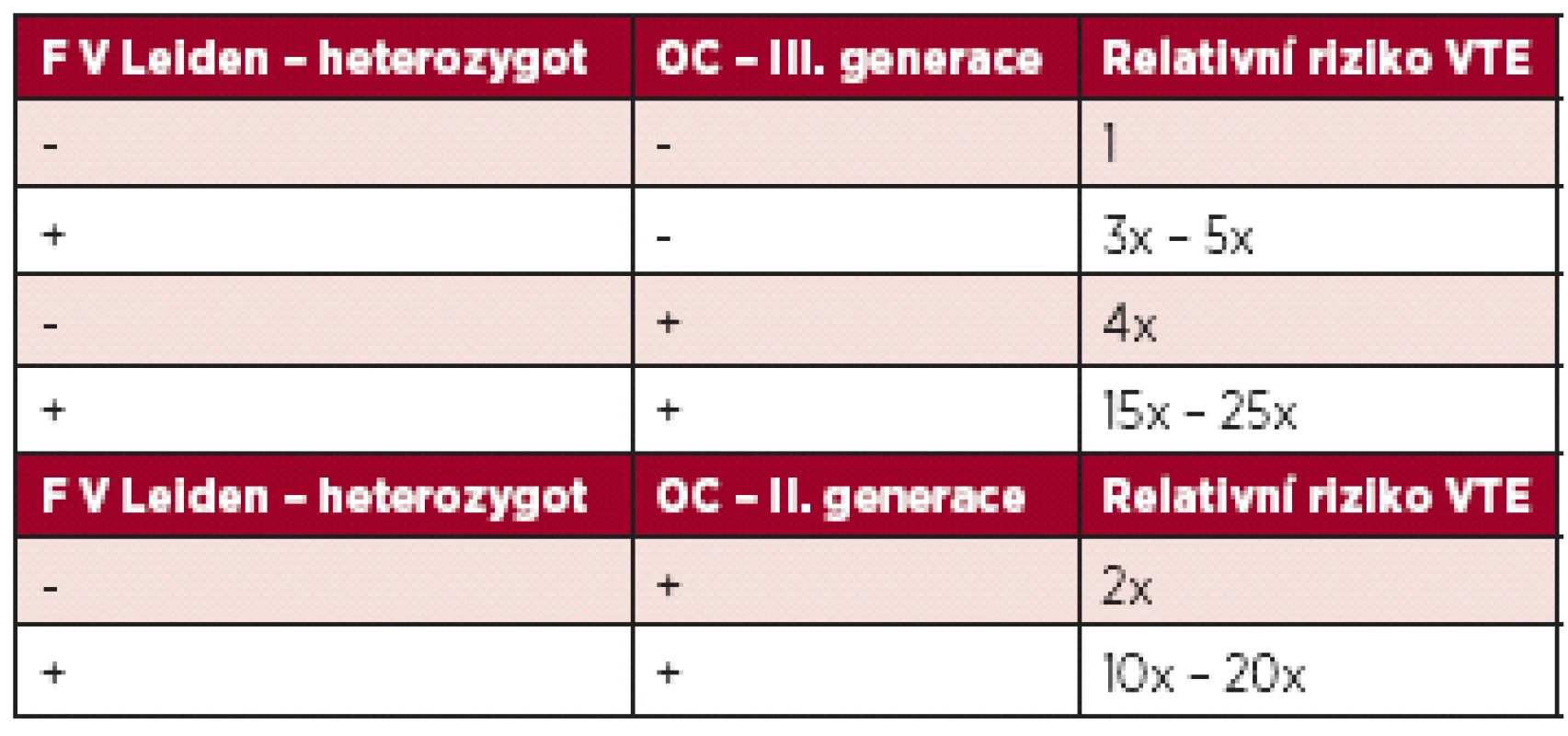
Při homozygotní formě Leidenské mutace je riziko ještě 10x větší (20, 21). Nicméně v dalších letech se na základě dalších prací riziko vyčíslilo jako nižší, a to jako 10,25x větší (5,69–18,45) (22). Riziko VTE je u F II G20210A velmi podobné jako u Leidenské mutace, a to 7,14 x větší (3,39–15,04) (22). Nicméně je zde větší riziko trombóz nitrolebních splavů. Podstatně méně dat je o riziku VTE v přítomnosti vrozeného trombofilního stavu a užívání čistě gestagenní OC. Riziko je považováno za podstatně nižší.
Riziko vzniku VTE také záleží na délce užívání OC, které je větší v prvním roce užívání (zejména v prvních 6. měsících), poté riziko VTE klesá (23, 24).
Postup před nasazením OC u asymptomatických žen (VTE) s prokázaným vrozeným trombofilním stavem
K průkazu dochází zejména v rámci vyšetření pokrevních příbuzných.
Kombinovanou OC považujeme za:
- Kontraindikovanou při nálezu:
Deficit antitrombinu, proteinu C, proteinu S, mutace F V Leiden v homozygotní formě, mutace F II20210A v homozygotní formě, kombinace mutace F V Leiden + F II G20210A v heterozygotní formě.
- Rizikovou při nálezu mutace F V Leiden či mutace F II G20210A v heterozygotní formě + přítomnosti dalšího, jasně definovaného RF VTE, např. větším BMI aj. V této situaci ženě užívání OC nedoporučujeme do event. eliminace RF.
- Možnou při nálezu F V Leiden či F II G20210A v heterozygotní formě bez dalšího RF VTE, ale je nutné:
- → vyčíslit míru rizika VTE (viz výše)
- → zhodnotit přítomnost dalších RF. Pokud nejsou přítomny další RF, pak je vlastní rozhodnutí na ženě. V případě, že chce OC užívat, je nutno ženu poučit o:
- příznacích VTE
- návštěvě lékaře při prvních příznacích VTE,
- nutnosti hlásit užívání OC v případě další rizikové situace – imobilizaci dolních končetin aj.
Samozřejmě výběr typu antikoncepce může snížit riziko VTE (čistý gestagen, II. generace).
Vzhledem k prevalenci trombofilních stavů a rozšířenosti OC se nabízí otázka plošného vyšetřování trombofilních stavů před nasazením OC. To není t.č. v rozvinutých zemích doporučováno. Např. při plošném vyšetřování Leidenské mutace by muselo být vyšetřeno 0,5 milionu žen, aby došlo k prevenci jedné fatální VTE.
Cíl práce
V naší práci jsme analyzovali skupinu 400 žen, které byly vyšetřeny na našem pracovišti na trombofilní stav po prodělané VTE v časové souvislosti s užíváním hormonální antikoncepce.
Materiál a metodika
Vyšetřeno bylo 400 žen (průměrný věk 31 let, věkové rozmezí 17–55 let) v časové souvislosti s užíváním kombinované hormonální antikoncepce (COC), a to v časovém období od roku 1997 do roku 2009. U každé ženy byla trombóza objektivně prokázána zobrazovacím vyšetřením (ultrazvukové vyšetření žil, perfuzní plicní scan, angioCT plic).
Hodnoceno bylo:
- délka užívání COC do VTE
- výskyt vrozeného nebo získaného trombofilního stavu (protein C, S, antitrombin, mutace F V Leiden, mutace F II20210A, homocystein, APS – přítomnost protilátky typu lupus antikoagulans (LA), antikardiolipinové protilátky – ACa, protilátky proti beta2 glykoproteinu I
- frekvence výskytu dalšího rizikového faktoru (RF) pro VTE: imobilizace, operace, imobilizace dolní končetiny (přiložení sádry či dlahy)
- typ trombózy
- v plánu ještě bylo vyhodnocení u všech žen: BMI, anamnéza kouření, typ užívané antikoncepce
Laboratorní vyšetření: Protein C: koagulační metoda – Staclot Protein C (STAGO D-normální rozmezí, 70–130 %) Protein S: (Staclot protein S /STAGO/ (normální hodnota 65–140 %) v případě nízké hodnoty, antigen celkového proteinu S a volného proteinu S: protein S kit (STAGO D) (normální hodnoty celkového proteinu S, 70–140 %, volného 70–130 %). Antitrombin: Chromogenní princip – Stachrom AT kit (STAGO D) (rozmezí normy 80–120 %). Diagnóza APS byla založena na stanovení: aPTT, PTT Automate (STAGO D); aPTT s reagencií citlivou na LA, PTT-LA (STAGO D); “Tissue Thromboplastin Inhibition Test”; test s ředěným jedem Russelovy zmije. V případě pozitivity jednoho z těchto testů, vyšetření bylo opakováno s odstupem 6–8 týdnů + byl proveden s hexagonálními fosfolipidy (Staclot LA, STAGO D). Immunoassay byla použita pro kvantitativní stanovení ACa a protilátek proti beta2 glykoproteinu I. Leidenská mutace F V a mutace protrombinu G 20210A byly stanoveny pomocí LightCycleru (Factor F V Leiden Mutation Detection Kit a Prothrombin (G20210A) Mutation Detection Kit (Roche Diagnostics). Homocystein byl stanoven imunochemicky po l2 h. lačnění (normální rozmezí 12,5–7 µmol/l) na analyzátoru – DPC Immulite 2000).
Výsledky
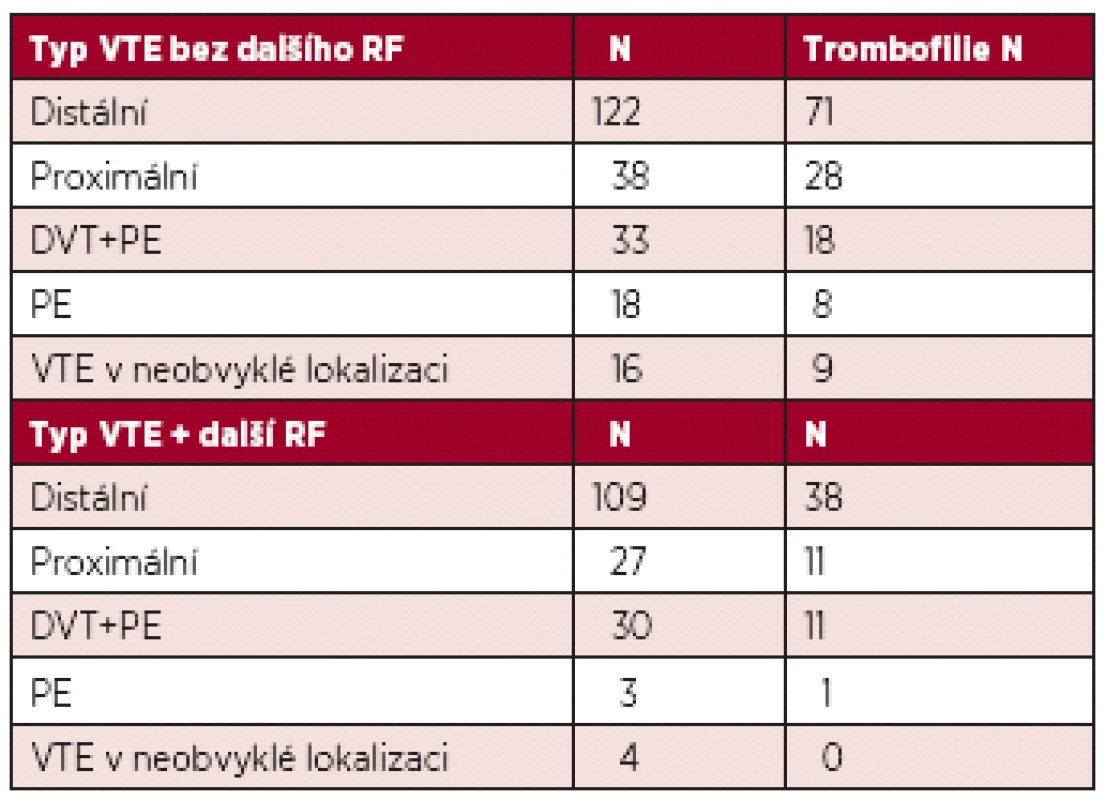
Medián věku žen v době VTE byl 26 let, průměrná délka užívání COC do VTE byla 45 měsíců. VTE bez dalšího RF se vyskytla u 57 % žen, u dalších 43 % byl přítomen další přechodný RF. V klinické manifestaci převládla distální trombóza (N = 231, 58 %), následně proximální DVT (N = 65, 16 %), plicní embolie (N = 21, 5 %) a trombóza v tzv. neobvyklé lokalizaci (N = 20, 5 %). Vrozený nebo získaný trombofilní stav byl prokázán u 195 žen (49 %): mutace F V Leiden v 35 %, vrozený deficit AT v 1,8 %, protein C v 0,8 %, protein S v 1 %, mutace F II2021A v 5 % a APS v 5,3 %. Mezi přídatnými RF převládala imobilizace dolní končetiny, malá a velká chirurgie a trauma. Výsledky jsou shrnuty v tabulce 2.
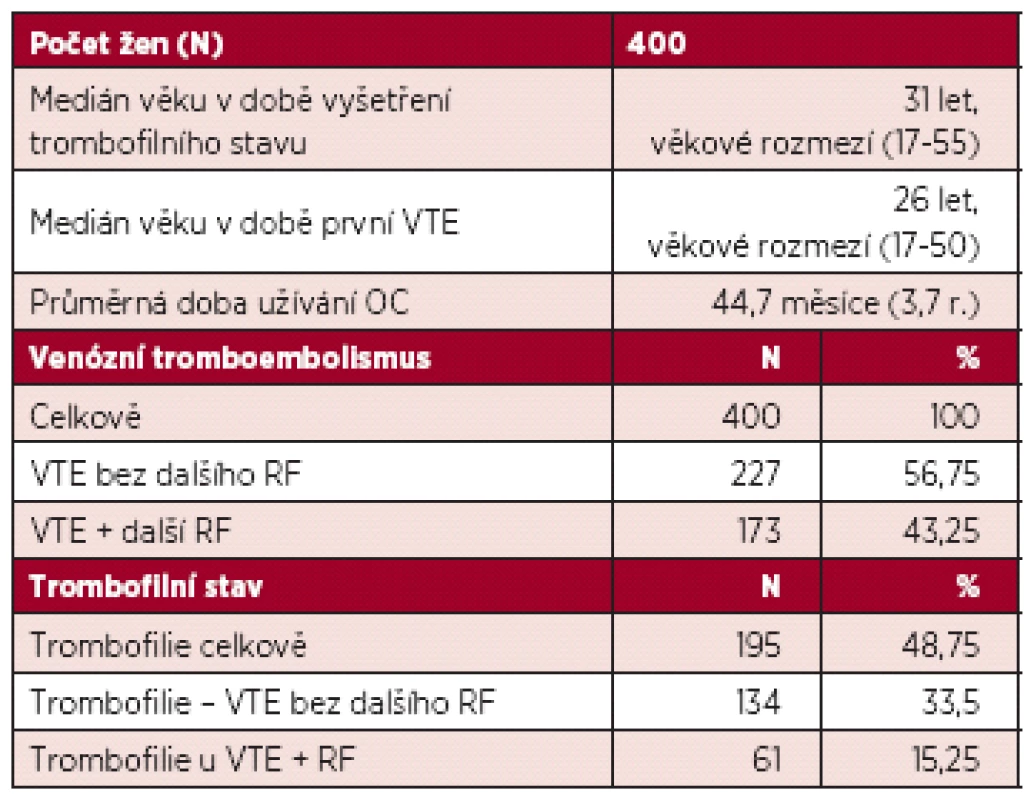
Výskyt jednotlivých trombofilií shrnuje tabulka 3.
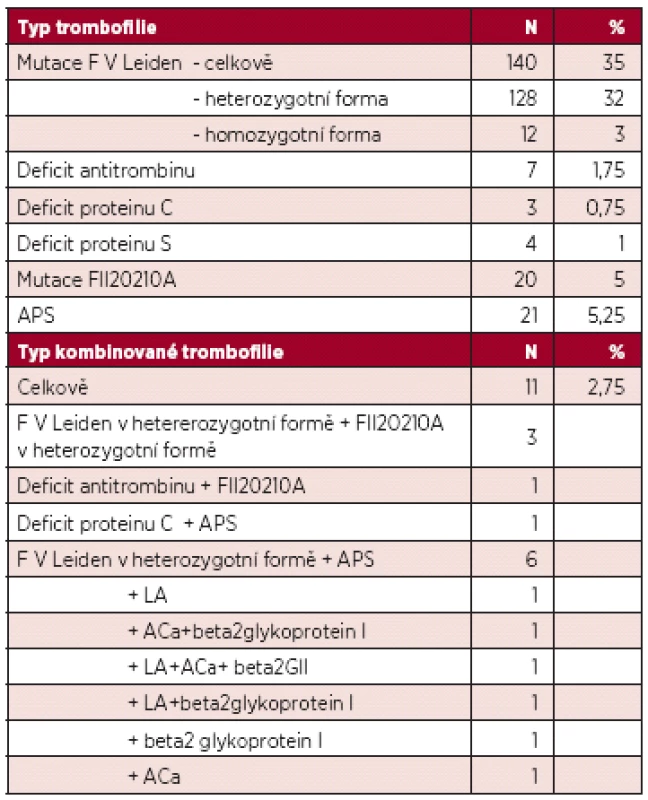
Zastoupení jednotlivých typů VTE shrnuje tabulka 4.
Výskyt VTE během prvního roku a prvního půlroku je uveden v tabulce 5.
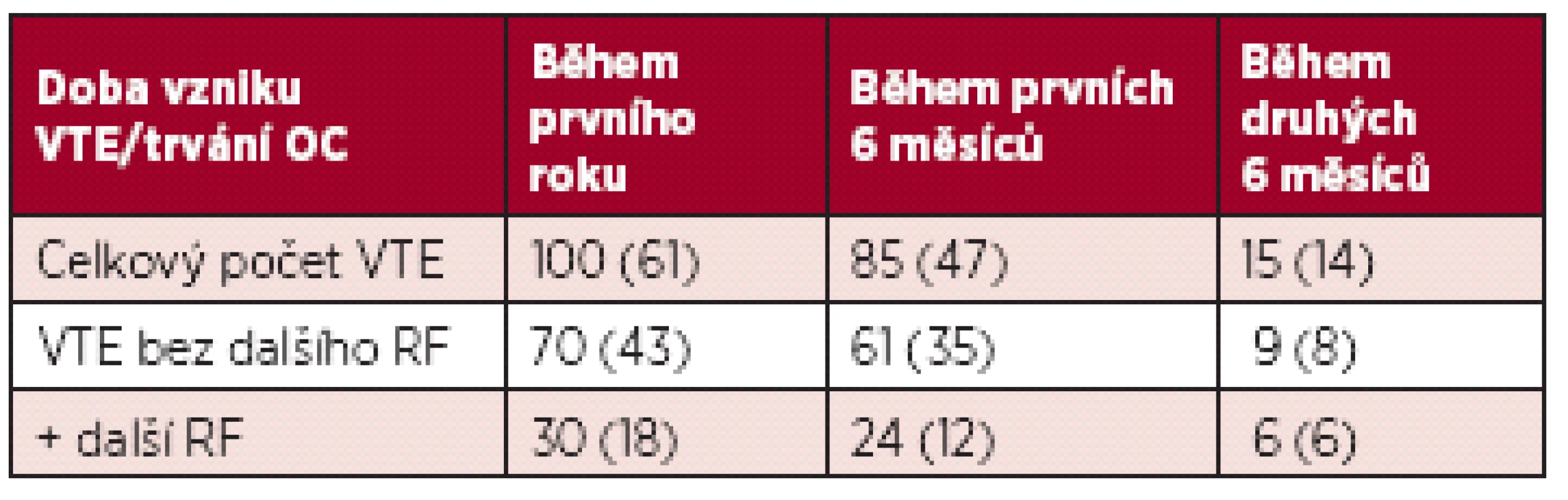
Vzhledem k faktu, že ne všechny ženy byly léčeny v naší nemocnici a u některých byl trombofilní stav vyšetřen až po skončení antikoagulační terapie, není k dispozici přesný údaj o BMI. Anamnéza kouření je dostupná u ¾ žen, ale nelze spolehlivě hodnotit denní množství.
Typ užívané antikoncepce není zmíněn, protože cca polovina žen nevěděla název užívané antikoncepce. Nicméně k vlastnímu hodnocení rizikovosti jednotlivých typů by musel být k dispozici kontrolní soubor žen se stejnými kontraceptivy, což je velmi obtížné získat. Navíc podíl jednotlivých typů užívané antikoncepce není v populaci znám.
Shrnutí výsledků
V práci jsme prokázali vysoké zastoupení trombofilních stavů. Mezi vrozenými trombofiliemi jednoznačně převládá mutace F V Leiden. To je v souladu s poznatky, že u žen s F V Leiden dochází k manifestaci VTE právě v souvislosti s užíváním antikoncepce nebo graviditou. Ostatní trombofilní stavy jsou zastoupeny méně, ale např. APS je zastoupen v 5 %, což je pro ženu velmi podstatné. Jednak je indikována antikoagulační terapie po delší dobu, jednak je nutno případnou další graviditu zajistit Anopyrinem a nízkomolekulárním heparinem.
Nicméně u signifikantního počtu žen došlo k rozvoji VTE v přítomnosti dalšího rizikového momentu, kde převládá imobilizace dolní končetiny. Podstatné je, že převládají trombózy distální, tedy s nejnižším rizikem plicní embolie a rizikem posttrombotického syndromu. Neprokázali jsme zásadně vyšší výskyt VTE během prvního roku užívání COC, ale spíše v závislosti na přítomnosti dalšího přídatného rizika VTE. Domníváme se, že je výhodné u žen na antikoncepci zajistit výše uvedené rizikové situace nízkomolekulárním heparinem po dobu přetrvávání rizika, přestože t. č. neexistují jednoznačné doporučené postupy pro tyto situace.
Závěr
Hormonální antikoncepci užívá na světě více než 100 miliónů žen. Je velmi efektivní a oblíbenou formou antikoncepce. VTE je nejčastější a nejvýznamnější komplikací. Také podíl na celkové frekvenci výskytu VTE v populaci je malý, ale ve věkové skupině žen užívající OC je signifikantním rizikovým faktorem venózního tromboembolismu. Nicméně riziko VTE lze snížit při dodržování jednoduchých pravidel před jejím nasazením a dále zajištěním všech dalších rizikových situací.
Podíl autorů na přípravě rukopisu
P. D. – příprava rukopisu, kontrola a schválení finální verze;
P. S. – úprava rukopisu a schválení finální verze;
M. B. – úprava rukopisu a schválení finální verze;
M. P. – úprava rukopisu a schválení finální verze.
Doručeno do redakce: 30. 11. 2012
Přijato po recenzi: 10. 1. 2013
Doc. MUDr. Petr Dulíček, Ph. D.
IV. interní hematologická klinika
FN a LF UK v Hradci Králové
Sokolská 581
500 05 Hradec Králové
e-mail: PetrDulicek@seznam.cz
Zdroje
1. Nordström M, Lindblad B, Bergqvist D, Kjellström T. A prospective study of the incidence of deep – vein thrombosis within a defined urban population. J Intern Med 1992; 232:155-160.
2. Middeldorp S, Meijers JCM, van den Ende AE, et al. Effects on coagulation of levonorgestrel and desogestrel containing low dose oral contraceptives: a cross over study. Thromb Haemost 2000; 84: 4-8.
3. Rosendaal FR. Thrombosis in the young: Epidemiology and risk factors. A focus on venous thrombosis. Tromb Haemost 1997; 78:1-3.
4. Jordan WM. Pulmonary embolism. Lancet 1961; 278: 1146-1147.
5. Meade TW, Greenberg G, et al. Progestagens and cardiovascular reactions associated with oral contraceptives and comparison of the safety of 50-30 microgram oestrogen preparations. BMJ 1980; 280: 1157-1160.
6. Battiger LE, Boman G, Eklund G, Westerholm B. Oral contraceptives and thromboembolic disease: effects of lowering estrogen content. Lancet 1980; 1: 1097-1100.
7. Gerstman BB, Piper JM, Tomita DK, Ferguson WJ, Stadel BV, Lundin FE. Oral contraceptive estrogen dose and the risk of deep venous thromboembolism disease. Am J Epidemiol 1991; 133(1): 32-37.
8. World Health Organisation. Venous thromboembolic disease and combined oral contraceptives: results of international multicentre case-control study. World Health Organisation Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception. Lancet 1995; 346: 1575-1582.
9. Kemmeren JM, Algra A, Grobbee DE. Third generation oral contraceptives and risk of venous thrombosis: meta-analysis. Br Med J 2001; 323: 131-134.
10. Battaglioni T, Martinelli I. Hormone therapy and thromboembolic disease. Curr Opion Hematol 2007;14: 488-500.
11. Meijers JCM, Middeldorp S, Tekelenburg W, et al. Increased fibrinolytic activity during use of oral contraceptives is counteracted by an enhanced factor XI – independent down regulation of fibrinolysis. Tromb Haemost 2000; 84: 9-14.
12. Tans G, Curvers J, Middeldorp S, et al. A randomised a cross over study on the effects of levonorgestrel and desogestrel containing oral contraceptives on the anticoagulant pathways. Thromb Haemost 2000; 84: 15-21.
13. Abdollahi M, Cushman M, Rosendaal FR. Obesity: risk factors and oral contraceptive use. Thromb Haemost 2003; 89: 493-498.
14. Salden, A, Keeney S, Hay CRM, Cumming AM. The C677T variant and the risk of venous thrombosis (letter). Br J Haematol 1997; 99: 472.
15. Tosseto A, Missiaglia E, Frezzato M, Rodeghiero F. The VITA project: C677T mutation in the methylen-tetrahydrofolate reductase gene and the risk of venous thromboembolism. Br J Haematol 1997; 97: 804-806.
16. Brown K, Luddington R, Baglin T. Effect of the MTHFR C677T variant on the risk of venous thromboembolism: interaction with factor F V Leiden and prothrombin (F2G20210A) mutations. Br J Haematol 1998; 103: 42-44.
17. Simioni P, Sanson BJ, Prandoni P, et al. Incidence of venous thromboembolism in families with inherited thrombophilia. Thromb Haemost 1999; 81: 198-202.
18. Martinelli I, Mannucci PM, De Stefano V, et al. Different risk of thrombosis in four coagulation defects associated with inherited thrombophilia: a study of 150 families. Blood 1998; 92: 2353-2358.
19. Vandenbroucke JP, Koster T, Briët E, Reitsma PH, Bertina RM, Rosendaal FR. Increased risk of venous thrombosis in oral-contraceptive users who are carriers of factor V Leiden mutation. Lancet 1994; 344: 1453-1457.
20. Rosendaal FR, Koster T, Vandenbroucke JP, Reitsma PH. High risk of thrombosis in patients homozygous for factor V Leiden (activated protein C resistance). Blood 1995; 85: 1504-1508.
21. Rintelen C, Mannhalter C, Ireland H, et al. Oral contraceptives enhance the risk of clinical manifestation of venous thrombosis at a young age in females homozygous for factor V Leiden. Br J Haematol 1996; 93: 487-490.
22. Emmerich J, Rosendaal FR, Cattaneo M, et al. Combined effect of factor F V Leiden and prothrombin 20210A on the risk of venous thromboembolism-pooled analysis of 8 case-control studies including 2310 cases and 3204 controls. Study Group for Pooled-Analysis in Venous Thromboembolism. Thromb Haemost 2001; 86: 809-816.
23. Bloemenkamp KWM, Rosendaal FR, Helmerhorst FM, Vandenbroucke JP. Higher risk of venous thrombosis during early use of oral contraceptives in women with inherited clotting defects. Arch Intern Med 2000; 160: 49-52.
24. Herings RMC, Urquhart J, Leufkens HGM. Venous thromboembolism among new users of different oral contraceptives. Lancet 1999; 354: 127-128.
25. Dulíček P, Kalousek I. Hormonální antikoncepce a tromboembolická nemoc na konci tisíciletí. Plánování rodiny & reprodukční zdraví. 2000; 3: 60-62.
26. Dulíček P, Košťál M. Hormonální antikoncepce a tromboembolická nemoc, příručka pro praxi. Gynekologie po promoci-speciální vydání. 2002, ročník 2, 12.
27. Dinger JC, Heinemann LA, Kühl-Habich D, et al. The safety of a drospirenone-containing oral contraceptive, final results from the European Active Surveillance study on oral contraceptions based on 142,475 women-years of observation. Contraception 2007; 75: 344-347.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Hematológia Interné lekárstvo OnkológiaČlánok vyšiel v časopise
Transfuze a hematologie dnes

2013 Číslo 1
- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Statiny indukovaná myopatie: Jak na diferenciální diagnostiku?
- Mýty a fakta ohledně doporučení v těhotenství
Najčítanejšie v tomto čísle
- Rizikové monoklonální gamapatie nejasného významu – léčit nebo neléčit?
- Kryokonzervace krve – historie, metody a současnost
- Přístupy k antimykotické terapii: od profylaxe k léčbě
- Klinické aspekty „pravé“ nesekretorické formy mnohočetného myelomu
