-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Klinické aspekty „pravé“ nesekretorické formy mnohočetného myelomu
Clinical aspects of „true“ non-secretory multiple myeloma
Non-secretory myeloma represents a less frequent variant of multiple myeloma. The development of electrophoretical methods and especially serum free light chain assessment has enabled the identification of secretion in patients formerly classified as non-secretory disease. Therefore, „true“ non-secretory myeloma defines a very rare condition, with typical biological-genetic characteristics, which requires a very specific diagnostic and therapeutic approach.
Key words:
multiple myeloma, non-secretory myeloma
Autoři: T. Pika 1; P. Lochman 2; P. Flodr 3; P. Mičková 4; M. Novák 4; Z. Jehlíková 5; A. Hamplová 6; J. Minařík 1; J. Bačovský 1; L. Kučerová 3; M. Jarošová 4; V. Ščudla 1
Působiště autorů: III. interní klinika – nefrologická, revmatologická, endokrinologická, LF UP a FN Olomouc 1; Oddělení klinické biochemie, FN Olomouc, 3Ústav klinické a molekulární patologie, LF UP a FN Olomouc, 4Hematoonkologická klinika, LF UP a FN Olomouc, 5Hematologická ambulance, Šumperská Nemocnice a. s., 6Hematologická ambulance, Nemocnice Šternberk 2
Vyšlo v časopise: Transfuze Hematol. dnes,19, 2013, No. 1, p. 27-32.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Nesekretorický myelom představuje méně častou variantu mnohočetného myelomu. Rozvoj elektroforetických metod a zejména pak stanovení sérových hladin volných lehkých řetězců imunoglobulinu v séru, umožňují dodatečně identifikovat sekreci i u nemocných dříve klasifikovaných jako nesekretorické onemocnění. Proto tzv. „pravý“ nesekretorický myelom představuje vzácnou jednotku, která se vyznačuje typickými biologicko-genetickými vlastnostmi a která vyžaduje velmi specifický terapeuticko-diagnostický přístup.
Klíčová slova:
mnohočetný myelom, nesekreční, nesekretorický myelomÚvod
Mnohočetný myelom (MM) je zhoubné hematologické onemocnění patřící do skupiny monoklonálních gamapatií. Onemocnění je charakterizované přítomností klonální proliferace a akumulace neoplasticky transformovaných plazmocytů, produkujících monoklonální imunoglobulin (M-protein, MIg) detekovatelný v séru a/nebo v moči a asociovaným s orgánovým postižením (ROTI – related organ or tissue impairment): hyperkalcemie, renální nedostatečnost, anémie, kostní postižení (1, 2). Vzácnou variantou MM je nesekretorický typ (NSMM) – tvořící přibližně 1–5 % všech MM, který se vyznačuje absencí detekovatelné M-komponenty v séru či moči, avšak splňující veškeré ostatní charakteristiky onemocnění (2, 3). V posledních letech se součástí rutinní praxe stalo vyšetření umožňující detekci a kvantifikaci sérových hladin volných lehkých řetězců imunoglobulinu (systém FreeLiteTM), které díky své senzitivitě umožnilo identifikovat různě významnou produkci volných lehkých řetězců myelomovými populacemi a tak prokázat sekreci monoklonální komponenty až u 2/3 nemocných, dříve dle konvenčních kritérií klasifikovaných jako nesekretorický MM (3–6). Proto se „pravý“ nesekretorický myelom – tedy onemocnění bez imunofixačního průkazu M-komponenty a s negativitou FreeLiteTM testu stal raritním onemocněním (~ 1 % všech MM) (7). Cílem práce je popis 2 případů „pravé“ formy nesekretorického myelomu ve vztahu ke klinicko-biologickým vlastnostem onemocnění.
Popis případů
Prvním pozorováním „pravého“ nesekretorického myelomu byla 71letá žena, odeslaná na naše pracoviště v srpnu 2008 s podezřením na mnohočetný myelom. Nemocná byla několik měsíců sledována a vyšetřována pro výrazné bolesti skeletu s minimálním účinkem analgetické terapie a teprve po několika měsících bylo doplněno radiografické vyšetření skeletu, které kromě četných kompresivních zlomenin obratlových těl v terénu osteoporózy (T-skóre – 2,8) prokázalo i četné osteolytické léze žeber. Vyšetření kostní dřeně na naší klinice prokázalo masivní infiltraci kostní dřeně (80 %) méně diferencovanou myelomovou populací, zčásti až plazmablastického vzhledu, s expresí znaků CD138+, CD38+, CD79+ a navíc s vysoce atypickou přítomností znaků CD13+, CD33+ (obr. 1–3). Průtoková cytometrie i opakované imunohistochemické vyšetření kostní dřeně nezjistilo přítomnost povrchových či intracytoplazmatických lehkých či těžkých řetězců imunoglobulinu v myelomových plazmocytech. Dodatečně doplněné imunohistochemické vyšetření prokázalo slabou jadernou pozitivitu cyklinu D1 u cca 10 % plazmocytů, barvení na přítomnost znaku CD20 bylo negativní. Cytogenetické vyšetření plné kostní dřeně určilo karyotyp 46,-XX - [15] a metoda FISH (Fluorescenční in situ hybridizace) prokázala deleci RB1 genu (67 %), translokaci t(11;14)(q13;q32) (74 %) a 3 kopie oblasti 1q21 (78 %). Opakovaným elektroforetickým a imunofixačním vyšetřením nebyla zjištěna přítomnost MIG v séru a moči a stejně tak byl v mezích normy i index volných lehkých řetězců κ/λ (0,907), při supresi absolutních hladin obou řetězců (2,92 resp. 3,22 mg/l). Nefelometrické vyšetření prokázalo supresi hladin všech podtříd polyklonálních imunoglobulinů (IgG 2,65, IgA < 0,24, IgM < 0,19 g/l). Vysoce patologické byly hladiny β2mikroglobulinu (6,32 mg/l) i aktivita sérové thymidinkinázy (44,5 IU/l). Byla zjištěna i výrazná makrocytová anémie (Hb 68 g/l) a trombocytopenie (trombocyty 73 x 1012/l). Další standardní biochemická vyšetření byla v mezích širší normy. Vyšetření pozitronovou emisní tomografií s použitím fluorem značené glukózy (18F-FDG-PET/CT) a vyšetření páteře magnetickou rezonancí zobrazilo četné osteolytické léze s difuzní aktivitou nádorového procesu. Stav byl tedy uzavřen jako nesekretorický mnohočetný myelom, stadia III-A dle Durieho-Salmona a stadia 3 dle ISS. Byla zahájena chemoterapie režimem MPT (Melfalan, Prednison, Thalidomid) s celkovým podáním 8 cyklů, vedoucí k dosažení remise onemocnění, což bylo potvrzeno histobioptickým vyšetřením kostní dřeně (Pb 4,8 %) a podpořeno negativitou nálezu při 99Tc-MIBI scintigrafickém vyšetření skeletu. U nemocné došlo k úpravě hemogramu a k výraznému ústupu bolestí skeletu. Nemocná byla proto ponechána bez další terapie, pouze na antiresorpční terapii perorální formou klodronátu. Za 2 měsíce od ukončení chemoterapie došlo ale k prudkému zhoršení klinického stavu s bolestmi páteře a poklesem červené složky hemogramu. Opětovné vyšetření kostní dřeně prokázalo masivní infiltraci (75 %) anaplastickou dediferencovanou myelomovou populací. Promptně byla zahájena chemoterapie režimem VD (bortezomib, dexametazon), nebylo ale dosaženo kontroly onemocnění a nemocná zmírá v průběhu 2. cyklu chemoimunoterapie na komplikující bronchopneumonii v terénu závažné pancytopenie.
Obr. 1. Histologické vyšetření kostní dřeně, nesekreční myelom, masivní infiltrace kostní dřeně, četné méně diferencované myelomové elementy až plazmablastického vzhledu (barvení HE, zvětšení 200x). 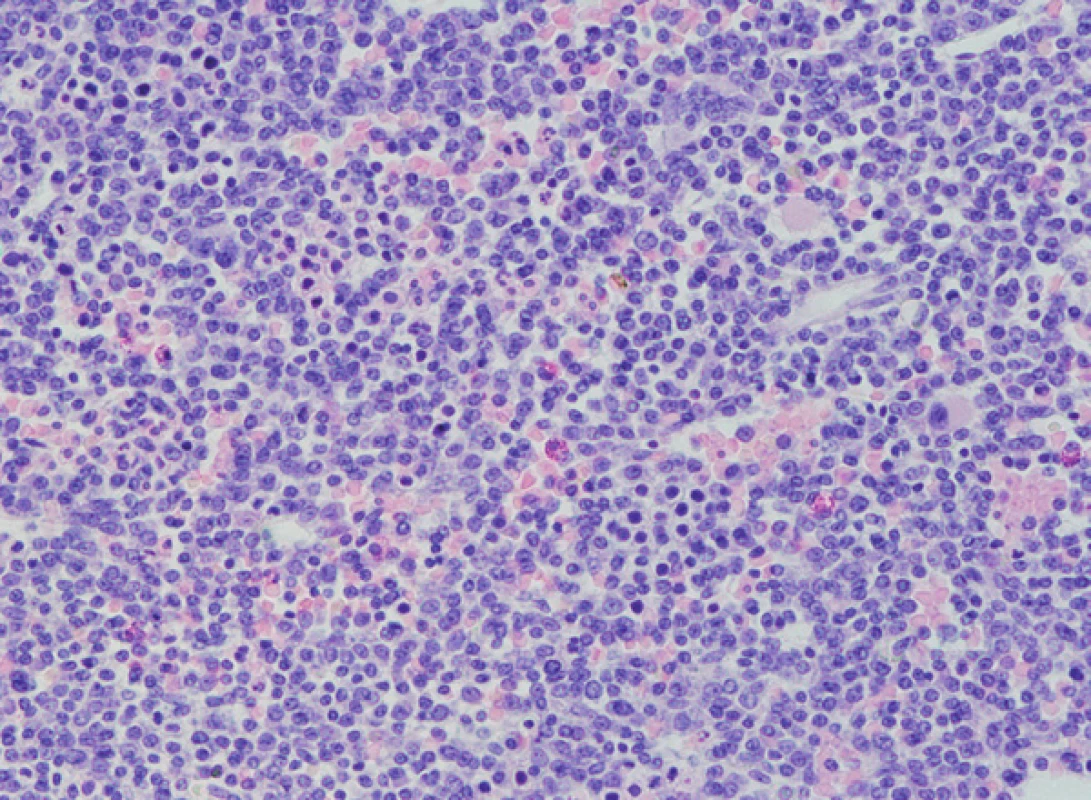
Obr. 2. Imunohistochemické vyšetření kostní dřeně, nesekreční myelom, difuzní infiltrace nádorovými plazmocyty s výraznou membránovou pozitivitou CD138 (zvětšení 200x). 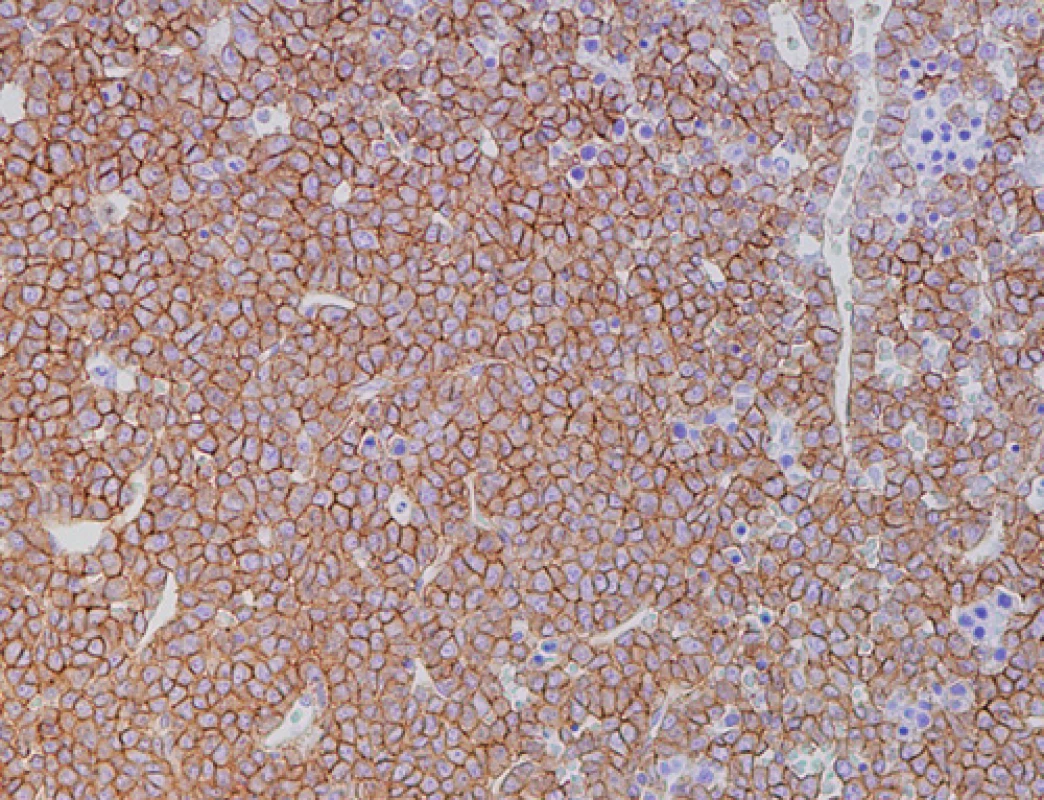
Obr. 3. Imunohistochemické vyšetření kostní dřeně, nesekreční myelom, infiltrace nádorovými plazmocyty fokálně s pozitivitou CD79a (zvětšení 200x). 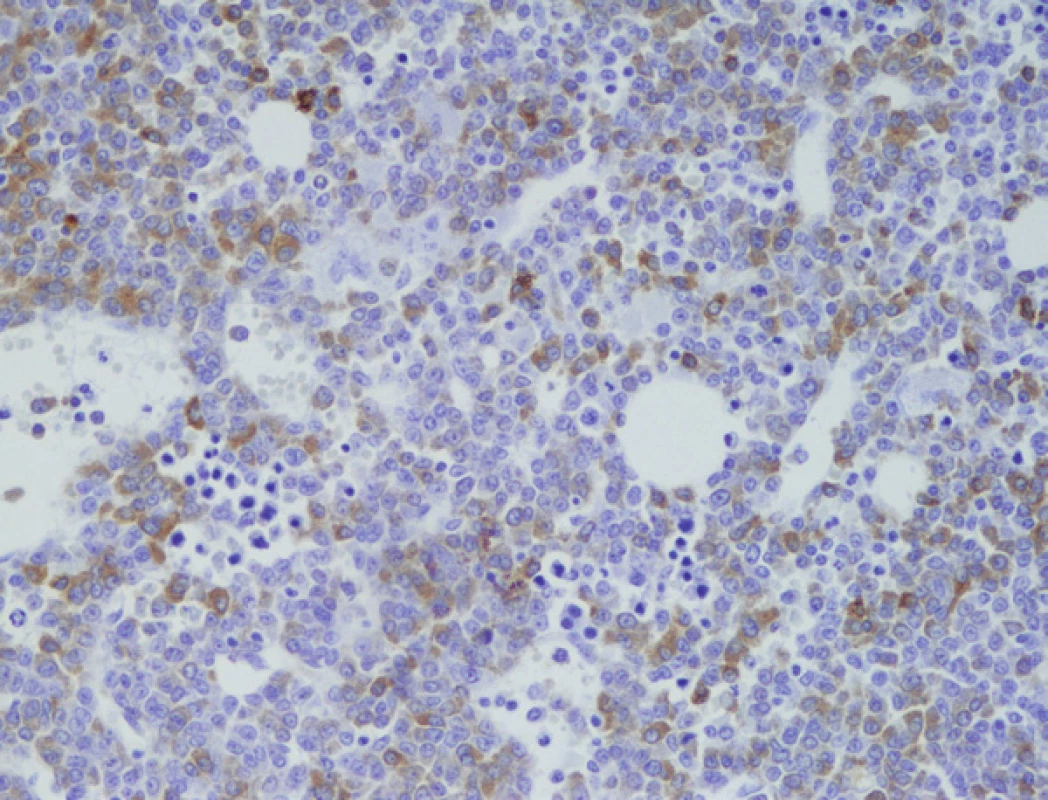
Druhým pozorováním „pravé“ formy nesekretorického myelomu byla 68letá nemocná, která byla 3 roky léčena a sledována pro těžkou formu osteoporózy (T-skóre -3,6) s mnohočetnými kompresivními frakturami obratlových těl a dokonce i frakturou krčku femuru, léčené „konzervativně“, což vedlo k imobilitě nemocné. Teprve při vzniku další fraktury v oblasti bérce bylo vzhledem k radiografickému nálezu četných osteolytických lézí pojato podezření na MM a nemocná byla odeslána k došetření na naši kliniku. Vyšetření kostní dřeně prokázalo výraznou (50 %) infiltraci kostní dřeně malými myelomovými elementy s redukcí normální hemopoézy. Plazmocyty vykazovaly pozitivitu CD138+, CD38+, nicméně opět se nepodařilo s použitím imunohistochemie či průtokové cytometrie prokázat expresi cytoplazmatických či povrchových molekul MIg. Exprese znaku CD20 byla negativní, byla však zaznamenána slabá jaderná pozitivita cyklinu D1 přibližně u 30 % myelomových buněk. Cytogenetické vyšetření, provedené na buňkách plné kostní dřeně určilo karyotyp 46, -XX-[27] a metodou FISH byla prokázána delece RB1 genu (65 %) a přítomnost translokace t(11;14) (q13;q32) (57 %). Sérologické vyšetření i vyšetření moči opakovaně nezjistilo přítomnost MIg. Stanovení sérových hladin volných lehkých řetězců prokázalo supresi hladin obou typů lehkých řetězců κ i λ (0,06 resp. 0,37 mg/l) s lehce podhraničním indexem klonality (0,162). Rovněž byla zjištěna suprese hladin polyklonálních imunoglobulinů (IgG 4,77, IgA < 0,22 a IgM < 0,18 g/l) a vysoce patologické hladiny β2mikroglobulinu (6,66 mg/l) i sérové thymidinkinázy (32,8 IU/l). I přes masivní infiltraci kostní dřeně nebyla zaznamenána alterace hemogramu, stejně tak i standardní biochemický profil byl v mezích normy. Radiografické a 99Tc-MIBI vyšetření skeletu zobrazilo četné aktivní osteolytické léze. Stav byl tedy uzavřen jako nesekretorická forma mnohočetného myelomu stadia III A, ISS 3 a s ohledem na četné komorbidity (ICHS, dysrytmie s implantací kardioverteru) byla zvolena chemoterapie režimem MPT (melfalan, prednizon, thalidomid) spolu s antiresorpční terapií ve formě intravenózní aplikace pamidronátu v měsíčních intervalech. Celkem bylo podáno 9 cyklů chemoterapie s dosažením remise onemocnění – což bylo potvrzeno při cytologickém vyšetření kostní dřeně. Nemocná byla ponechána bez terapie, pouze se zajištěním perorální antiresorpční terapií klodronátem. Při pravidelné kontrole 11 měsíců od ukončené chemoterapie bylo provedeno kontrolní imunohistochemické vyšetření kostní dřeně s nálezem přibližně 40% infiltrace myelomovými elementy. Byla zahájena chemoterapie režimem cyklofosfamid + nízce dávkovaný dexametazon. Celkem bylo podáno 10 cyklů s dosažením remise v kostní dřeni (5 % plazmocytů). V současnosti, 9 měsíců od ukončení chemoterapie trvá remise nemoci.
Diskuse
V současnosti užívaná diagnostická kritéria pro nesekretorickou variantu MM jsou součástí IMWG kritérií, přičemž pro diagnózu je nezbytná absence MIg v séru a/nebo v moči při imunofixačním vyšetření, dále klonální plazmocytóza kostní dřeně ≥ 10 % nebo histologicky verifikovaný plazmocytom a přítomnost asociovaného orgánového postižení – CRAB (2). V posledních letech již běžně užívané vyšetření, umožňující stanovení sérových hladin volných lehkých řetězců (systém FreeLiteTM) dále umožnilo dodatečnou identifikaci sekrece u nemocných klasifikovaných podle tradičních kritérií jako nesecernující. Pozitivita testu je nacházena přibližně u 66 % nemocných s NSMM a navíc dovoluje využití tohoto kvantitativního parametru v dalším sledování těchto nemocných, přičemž za měřitelné onemocnění se pokládají hladiny dominantního lehkého řetězce > 100 mg/l spolu s patologií indexu κ/λ. Jednoznačný přínos testu byl potvrzen řadou studií i naším vlastním pozorováním publikovaným v předchozích sděleních (4, 5, 6, 8). Pomineme-li problematiku adekvátní detailní analýzy monoklonálních imunoglobulinů, dále existuje několik dalších variant tzv. „pravého“ nesekretorického myelomu. Řadou autorů jsou v současnosti rozlišovány 2 typy NSMM a to „nesecernující“ a „neprodukující“ typy, přičemž některými autory je připouštěna i třetí varianta a to „falešně nesecernující“ (9, 10). Pro tuto variantu svědčí několik prací popisujících uvolňování molekul MIg z plazmocytů ve formě vezikul, tvořených membránami endoplazmatického retikula, či v jiných případech docházelo k rychlé clearance pozměněných molekul MIg (zejména glykosylací) ze séra proteolýzou nebo naopak k akumulaci ve tkáních ve formě nonamyloidových depozit (Randallova typu), přičemž v těchto případech nebylo možno konvenčními technikami detekovat monoklonální komponentu v tělních tekutinách (9, 10).
Samotný pravděpodobný princip ztráty sekrece či možnosti syntézy MIg myelomovými plazmocyty byl popsán v detailní přehledné práci Decourtové et al. (9). Ve stručnosti lze říci, že „nesecernující typ“ NSMM je charakterizován ztrátou možnosti uvolnění molekul MIg z buněk při jejich normální syntéze nebo naopak dochází k jejich rychlé intracelulární degradaci (nejčastěji procesem degradace asociovaným s endoplazmatickým retikulem a následnou degradací proteasomem v cytosolu). Tento typ NSMM je většinou spojen s přítomností denzních intracytoplazmatických tělísek Rusellova typu, což jsou inkluze tvořené molekulami MIg obklopené rozšířenými membránami endoplazmatického retikula (9). Akumulace tělísek může být výrazná, což vede k defiguraci buněčného tvaru a vzniku, pro cytology „lákavého“ obrazu, tzv. Mottovy buňky. Mnohem častěji a snáze jsou urychleně degradovány glykosylované či jinak pozměněné molekuly MIg. Při imunohistochemickém vyšetření lze obvykle pozorovat přítomnost molekul MIg, resp. lehkých a těžkých řetězců v cytoplazmě, stejně tak i elektronová mikroskopie prokazuje agregáty proteinů nejčastěji v cisternách endoplazmatického retikula (9, 11). Naopak u „neprodukujícího“ typu NSMM došlo ke ztrátě syntetické kapacity MIg (těžkých řetězců, lehkých řetězců či obou typů) na podkladě molekulárně-genetických změn, které však stále nejsou zcela objasněny a budou potřebné další práce využívající genomicko-proteomické metody (9, 12). V tomto případě není možno většinou imunohistochemií či elektronovou mikroskopií prokázat molekuly MIg v buňkách (13). V našem případě nebyla i při opakovaném imunohistochemickém vyšetření prokázána povrchová či intracytoplazmatická přítomnost molekul imunoglobulinu (resp. lehkých a těžkých řetězců), stejně tak nebyla zaznamenána přítomnost denzních tělísek. Cytologická a imunohistochemická identifikace plazmatických buněk při výraznějších infiltracích nečiní větší problém, standardně je využíváno barvení na přítomnost znaků CD138+, popř. CD79a, aberantní populace (CD19-/CD56+) lze identifikovat průtokovou cytometrií. Naše imunohistochemické vyšetření bylo doplněno o analýzu přítomnost znaku CD20, neboť literárně je zmiňována častá přítomnost tohoto znaku spolu s malobuněčnou až lymfoplazmocytoidní morfologií, stejně tak i s t(11;14) a expresí cyklinu D1, ale v obou případech nebyla u našich nemocných exprese tohoto znaku prokázána (14, 15). Naopak u jedné nemocné byla prokázána atypická exprese znaků CD13 a CD33. Jedná se o povrchové znaky primárně exprimované myeloidními liniemi. Výskyt exprese znaku CD33 se udává přibližně u 22–35 % nemocných s MM, přičemž míra exprese u nádorových plazmocytů představuje přibližně 12-100 % populace. Exprese znaku CD33 je spojena s kratším přežitím nemocných (3leté přežití 31 vs. 50 % u CD33+ vs. CD33-, p = 0,042), se zvýšenou mortalitou v 1 roce léčby (43 vs. 10 %, p = 0,005) a rezistencí na chemoterapii (16, 17). Míra exprese CD33+ stoupá s počtem léčebných linií a naopak je známo, že během evoluce nádorových linií má IL-6 indukovaná aktivace MYC onkogenu vliv na snížení exprese CD33 u CD33+ myelomových buněk, přičemž tyto mechanismy vedou k další heterogenitě myelomových linií a dalším příčinám rezistence na chemoterapii (18). Lze předpokládat, že myelomové buněčné linie exprimující znak CD33 budou v budoucnu využívány jako terapeutický cíl specifické biologické terapie (gemtuzumab ozogamicin) (17). Exprese myelomonocytárního znaku CD13 je spíše raritní a je spojena se špatnou prognózou a rezistencí na chemoterapii (19). Prokázaná exprese cyklinu D1 je typická pro nemocné nesoucí t(11;14) a značí příznivý prognostický faktor, je spojená s dobrou reakcí na podávanou terapii a dlouhodobým přežitím (20). Provedené molekulárně cytogenetické vyšetření prokázalo u obou nemocných nonhyperdiploidní status, tedy přítomnost delece RB1 genu, translokaci (11;14) a u jedné nemocné byl detekován i zisk oblasti 1q21. Přítomnost přestaveb IgH genu ve smyslu translokace (11;14) představuje neutrální prognostický faktor pro nemocné s mnohočetným myelomem. Translokace je spojena se zvýšenou expresí cyklinu D1 a klinicky je charakterizována příznivou reakcí na podávanou chemoterapii, dlouhým trváním léčebné remise a dlouhodobým přežitím. Buněčné linie nesoucí t(11;14)(q13;q32) jsou často charakterizovány malobuněčnou až lymfoplazmocytoidní morfologií a častou expresí znaku CD20 (21-24). Bylo zjištěno, že t(11;14) (q13;q32) je typickým znakem pacientů s NSMM (ale i IgM, IgE), což je v souladu s naším pozorováním (25). Prognosticky neutrální vliv samotné t(11;14) však může být ovlivněn přítomností dalších cytogenetických změn, což byl i případ naší první nemocné, kdy krom zmíněné translokace byl zaznamenán zisk oblasti 1q21. Tato cytogenetická změna je spojena s nepříznivou prognózou a s kratším celkovým přežitím (26, 27).
Klinická manifestace onemocnění ve formě NSMM je často spojena v období diagnózy s pokročilým postižením skeletu, jak tomu bylo i u obou našich nemocných, neboť pokud je použit běžný screeningový algoritmus, tak zcela selhávají klasické diagnostické ukazatele, jako jsou patologické hodnoty sedimentace erytrocytů, stanovení proteinurie, vyšetření hladin celkové bílkoviny v séru či elektroforéza séra a moči. Stejně tak i postižení ledvin bývá u NSMM vzácné, většinou přechodné při hyperkalcemii. Z biochemických ukazatelů obvykle na možnost NSMM lékaře upozorní vedle bolestí skeletu až hyperkalcemie, elevované hodnoty β2mikroglobulinu či různě závažná anémie. Pravidelným nálezem bývá suprese hladin všech tříd polyklonálních imunoglobulinů v důsledku polyklonální suprese při masivní infiltraci kostní dřeně (28). Pokud zobrazovací vyšetření prokážou kompresivní fraktury obratlových těl, bývá většinou tento nález přisuzován v běžné klinické praxi spíše závažné osteoporóze a teprve až záchyt osteolytických lézí upozorní lékaře na možnost myelomu. Pravidelné sledování nemocných s NSMM je velmi obtížné a často vyžaduje opakované aspirační či bioptické vyšetření kostní dřeně. V současné době lze však do jisté míry využít i zobrazovacích metod umožňujících zobrazení aktivní nádorové masy (18F-FDG-PET/CT), přičemž vyšetření kostní dřeně jednoznačně nenahrazují (29).
Prognóza nemocných je obvykle příznivá, ač jak již bylo řečeno, onemocnění bývá většinou diagnostikováno v pokročilém stavu. Prakticky se nesetkáváme s postižením ledvin, a proto postižení skeletu bývá pro pacienty nejvíce zatěžující. Výsledky léčby NSMM se prakticky neliší od pacientů s MM s identickou rizikovou stratifikací, jak při konvenční chemoimunoterapii, tak při vysoko dávkované chemoterapii, problematická ovšem zůstává monitorování průběhu nemoci (10, 30).
Závěr
Nesekretorický myelom ve své „pravé“ formě představuje raritní variantu mnohočetného myelomu, která se vyznačuje typickými biologicko-genetickými vlastnostmi. Stanovení správné diagnózy je mnohdy obtížné a opožděné i z důvodu chybění obvyklých laboratorních nálezů svědčících pro diagnózu myelomu. Proto je nutno na tuto formu onemocnění pomýšlet, zejména pak v případě diferenciální diagnostiky osteoporózy či šetření etiologie fraktur skeletu.
Poděkování
Vypracováno s podporou grantu NT/12451-5, LF--2012-007.
Podíl autorů na přípravě rukopisu
P. T. – příprava a zpracování rukopisu;
L. P. – provádění biochemických vyšetření a schválení finální verze rukopisu;
F. P. a K. L. – provedení imunohistochemických vyšetření, zpracování fotodokumentace a schválení finální verze rukopisu;
M. P. a J. M. – provedení cytogenetických vyšetření a připomínkování rukopisu;
N. M. – provedení vyšetření průtokovou cytometrií a připomínkování rukopisu;
J. Z., H. A. – spolupráce při sběru dat a připomínkování rukopisu;
M. J., B. J. a Š. V. – kritická revize rukopisu.
Doručeno do redakce: 30. 11. 2012
Přijato po recenzi: 25. 1. 2013
MUDr. Tomáš Pika, Ph.D.
III. interní klinika – nefrologická, revmatologická, endokrinologická, LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: tomas.pika@seznam.cz
Zdroje
1. Kyle AR, Rajkumar SV. Multiple myeloma. Blood 2008; 111 : 2962-2972.
2. The International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121 : 749-757.
3. Drayson M, Tang LX, Drew R, Mead GP, Carr-Smith H, Bradwell AR. Serum free light-chain measurements for identifying and monitoring patients with nonsecretory multiple myeloma. Blood 2001; 97 : 2900-2902.
4. Bradwell AR. Serum free light chain measurements move to center stage. Clin Chem 2005; 51 : 805-807.
5. Katzmann JA, Abraham RS, Dispenzieri A, Lust JA, Kyle RA. Diagnostic performance of quantitative κ and λ free light chain assays in clinical practice. Clin Chem 2005; 51 : 878-881.
6. Pika T, Minařík J, Lochman P, Bačovský J, Ščudla V. Přínos vyšetření sérových hladin volných lehkých řetězců pro subklasifikaci nesekretorické formy mnohočetného myelomu. Klin Biochem Metab 2010; 18 : 77-79.
7. Shaw GR. Nonsecretory plasma cell myeloma – becoming even more rare with serum free light-chain assay: a brief review. Arch Pathol Lab Med 2006; 130 : 1212-1215.
8. Dispenzieri A, Kyle RA, Merlini G, et al. International Myeloma Working Group guidelines for serum-free light chain analysis in multiple myeloma and related disorders. Leukemia 2009; 23 : 215-224.
9. Decourt C, Galea HR, Sirac Ch, Cogné M. Immunologic basis for the rare occurrence of true nonsecretory plasma cell dyscrasias. J Leukoc Biol 2004; 76 : 528-536.
10. Bourantas K. Nonsecretory multiple myeloma. Eur J Haematol 1996; 56 : 109-111.
11. Arend WP, Adamson JW. Nonsecretory myeloma - Immunofluorescent demonstration of paraprotein within bone marrow plasma cells. Cancer 1974; 33 : 721-728.
12. Coriu D, Weaver K, Schell M, et al. A molecular basis for nonsecretoty myeloma. Blood 2004; 104 : 829-831.
13. River GL, Tewksbury DA, Fudenberg HH. Nonsecretory multiple myeloma. Blood 1972; 40 : 204-206.
14. Robillard N, Avet-Loiseau H, Garand R, et al. CD20 is associated with a small mature plasma cell morphology and t(11;14) in multiple myeloma. Blood 2003; 102 : 1070-1071.
15. Quinn J, Percy L, Glassford J, et al. CD20-positive multiple myeloma – differential expression of cyclins D1 and D2 suggests a heterogeneous disease. Brit J Haematol 2009; 149 : 150-163.
16. Sahara N, Ohnishi K, Ono T, et al. Clinicopathological and prognostic characteristic of CD33-positive multiple myeloma. Eur J Haematol 2006; 77 : 14-18.
17. Robillard N, Wuilléme S, Lodé L, Magrangeas F, Minvielle S, Avet-Loiseau H. CD33 is expressed on plasma cells of a significant number of myeloma patients, and may represent a therapeutic target. Leukemia 2005; 19 : 2021-2022.
18. Shamsasenjan K, Otsuyama K, Abroun S, et al. IL-6-induced activation of MYC is responsible fór the down-regulation of CD33 expression in CD33(+) myeloma cells. Int J Hematol 2009; 89 : 310-318.
19. Ruiz-Arguelles GJ, San Miguel JF. Cell surface markers in mutliple myeloma. Mayo Clin Proc 1994; 69 : 684-690.
20. Soverini S, Cavo M, Cellini C, et al. Cyclin D1 overexpression is a favorable prognostic variable for newly diagnosed multiple myeloma patients treated with high-dose chemotherapy and single or double autologous transplantation. Blood 2003; 102 : 1588-1594.
21. Garand R, Avet-Loiseau H, Accard F, Moreau P, Harousseau JL, Bataille R. t(11;14) and t(4;14) translocations correlated with mature lymphoplasmacytoid and immature morphology, respectively, in multiple myeloma. Leukemia 2003; 17 : 2032-2035.
22. Gertz M, Lacy MQ, Dispenzieri A, et al. Clinical implications of t(11;14)(q13;q32), t(4;14)(p16.3;q32), and -17p13 in myeloma patients treated with high-dose therapy. Blood 2005; 106 : 2837-2840.
23. Chen W, McNamara M, Kim Y, Huang Q. t(11;14) plasma cell disorder presents as true nonsecretory, nonproducer multiple myeloma. Clin Lymph Myeloma 2009; 9 : 243-246.
24. Fonseca R, Blood EA, Oken MM, et al. Myeloma and the t(11;14)(q13;q32); evidence for a biologically defined unique subsets of patients. Blood 2002; 99 : 3735-3741.
25. Avet-Loiseau H, Garand R, Lodé L, Harousseau J-L, Bataille R. Translocation t(11;14)(q13;q32) is the hallmark of IgM, IgE, and nonsecretory multiple myeloma variants. Blood 2003; 101 : 1570-1571.
26. Hanamura I, Stewart JP, Huang Y, et al. Frequent rain of chromosome band 1q21 in plasma-cell dyscrasias detected by fluorescence in situ hybridization: incidence increases from MGUS to relapsed myeloma and is related to prognosis and disease progression following tandem stem-cell transplantation. Blood 2006; 108 : 1724-1732.
27. Balcarkova J, Urbankova H, Scudla V, et al. Gain of chromosome arm 1q in patients in relapse and progression of multiple myeloma. Cancer Genet Cytogenet 2009; 192 : 68-72.
28. Guillan RA, Ranjini R, Zelman S, Hocker EV, Smalley RL. Multiple myeloma with hypogammaglobulinemia. Cancer 1970; 25 : 1187-1192.
29. Dimopoulos M, Terpos E, Comenzo RL, et al. International myeloma working group consensus statement and guidelines regarding the current role of imaging techniques in the diagnosis and monitoring of multiple myeloma. Leukemia 2009; 23 : 1545-1556.
30. Kumar S, Pérez WS, Zhang M-J, et al. Comparable outcomes in nonsecretory and secretory multiple myeloma after autologous stem cell transplantation. Biol Blood Marrow Transplant 2008; 14 : 1134-1140.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2013 Číslo 1- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
-
Všetky články tohto čísla
- Rizikové monoklonální gamapatie nejasného významu – léčit nebo neléčit?
- Klinické aspekty „pravé“ nesekretorické formy mnohočetného myelomu
- Výskyt venózního tromboembolismu u žen v časové souvislosti s užíváním hormonální antikoncepce
- Přístupy k antimykotické terapii: od profylaxe k léčbě
- Kryokonzervace krve – historie, metody a současnost
- Úvodník
- Myeloproliferative neoplasms in Budd-Chiari syndrome and portal vein thrombosis: a meta-analysis
- Cardiovascular risk factors in hematopoietic cell transplantation survivors: role in development of subsequent cardiovascular disease
- A randomized trial of dasatinib 100 mg versus imatinib 400 mg in newly diagnosed chronic-phase chronic myeloid leukemia
- Genome-wide association study identifies germline polymorphisms associated with relapse of childhood acute lymphoblastic leukemia
- A randomized phase II study to evaluate tacrolimus in combination with sirolimus or methotrexate after allogeneic hematopoietic cell transplantation
- Soutěž
- Realita vyšetřování minimální reziduální nemoci u akutních leukemií aneb kolik laboratorní akrobacie je skutečně třeba?
- Identifikace nových molekulárních markerů pro sledování minimální reziduální nemoci u akutních leukemií
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Rizikové monoklonální gamapatie nejasného významu – léčit nebo neléčit?
- Kryokonzervace krve – historie, metody a současnost
- Přístupy k antimykotické terapii: od profylaxe k léčbě
- Klinické aspekty „pravé“ nesekretorické formy mnohočetného myelomu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



