-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika a léčba hemofilie
Autori: P. Smejkal 1; J. Blatný 2; B. Blažek 3; Z. Černá 4; P. Ďulíček 5; J. Hak 6; I. Hrachovinová 7; A. Hluší 8; R. Hrdličková 9; V. Komrska 10; D. Pospíšilová 11; D. Procházková 12; J. Šlechtová 13; P. Timr 14; I. Vonke 15; L. Walterová 16; M. Penka 1
Pôsobisko autorov: Oddělení klinické hematologie, Fakultní nemocnice Brno, 2Oddělení dětské hematologie, Fakultní nemocnice Brno, 3Klinika dětského lékařství, Fakultní nemocnice Ostrava, 4Dětská klinika, Fakultní nemocnice Plzeň, 5II. interní klinika – Oddělení klinické hem 1
Vyšlo v časopise: Transfuze Hematol. dnes,19, 2013, No. 2, p. 100-114.
Kategória: Souhrnné práce, původní práce, kazuistiky
* za Český národní hemofilický program
Preambule
Ačkoli doporučení a informace obsažené v následujícím textu jsou formulovány v dobré víře a na základě znalostí aktuálně dostupných v době zveřejnění dokumentu, autoři, ČNHP (Český národní hemofilický program), žádná ze zainteresovaných odborných společností ani vydavatel tohoto doporučení nenesou žádnou právní zodpovědnost za obsah tohoto textu.
Stručná charakteristika standardu
Cílem standardu je stanovit základní diagnostické a terapeutické postupy v péči o pacienty s hemofilií A a B. Na tento standard navazují doporučení pro zajištění chirurgických/ortopedických výkonů a doporučení pro léčbu hemofilie s inhibitorem.
Hlavní epidemiologické charakteristiky
Incidence choroby je přibližně 1 případ na 5000–-10 000 narozených chlapců pro hemofilii A a 1 případ na 30 000–50 000 pro hemofilii B. Odhad prevalence hemofilie (A+B) dle Světové hemofilické federace (World Federation of Hemophilia – WFH) je 105–160 / milion mužské populace. Výskyt hemofilie není závislý na rase. Celosvětově by tedy na celé zeměkouli mělo být až půl milionu hemofiliků, avšak v roce 2010 bylo diagnostikováno pouze cca 163 000, tj. asi 1/3 z předpokládaného počtu. Ve vyspělých státech je diagnostikováno 90–100 % případů. V ČR bylo v roce 2011 registrováno 850 pacientů s hemofilií A a 130 s hemofilií B.
Etiologie
Hemofilie A a B jsou dědičné krvácivé choroby, které jsou způsobeny deficitem koagulačního faktoru (F) VIII, resp. FIX. Dle tíže defektu koagulační aktivity FVIII (FVIII:C) nebo FIX (FIX:C) se oba typy hemofilie dělí na hemofilii těžkou (< 1 %), středně těžkou (1–5 %) a lehkou (> 5–40 %). Za fyziologickou hladinu koagulační aktivity FVIII/FIX se považuje rozpětí 50–150 %.
Dědičnost je v obou případech recesivní, vázaná na pohlavní chromozom X. Ženy s postiženým chromozomem tuto nemoc přenášejí. Z uvedené dědičnosti vyplývá, že muž hemofilik (XHY) a zdravá žena (XX) budou mít všechny syny zdravé (XY) a všechny dcery přenašečky (XHX). Žena přenašečka (XHX) a zdravý muž (XY) budou mít 50 % synů zdravých (XY) a 50 % nemocných (XHY) a 50 % dcer zdravých (XX) a 50 % přenašeček (XHX). Nemocní hemofilií jsou muži, u žen se choroba vyskytuje velmi vzácně. Žena může mít hemofilii, pokud je dvojitý heterozygot XHXH nebo hemizygot chromozomu X, např. Turnerův syndrom (XO). U více než 1/3 postižených je rodinná anamnéza negativní. V tomto případě se jedná buď o nově vzniklou mutaci, nebo je postižení po generace přenášeno pouze ženami, bez klinických projevů onemocnění u mužů. Hladina faktoru včetně poměru koagulační aktivity k antigenu FVIII/FIX jsou přímým výrazem genetického postižení a u členů jedné rodiny bývají stejné. U těžké hemofilie A se nejčastěji setkáváme s inverzí v intronu 22 (až ve 45 %) nebo v intronu 1 (kolem 3–5 %), s delecí části genu (5–8 %) či s bodovou mutací (asi 45 %) a méně často s inzercí nebo delecí několika nukleotidů. U středně těžkých a lehčích forem hemofilie A převládají bodové mutace. U hemofilie B nebyla nalezena žádná predominantní mutace, převažují bodové mutace (80 %). Raritou je mutace v promotoru genu FIX, která se fenotypicky projevuje v dětství středně těžkou formou hemofilie B a v dospělosti vlivem androgenní stimulace dochází k vzestupu FIX na lehký deficit či až k jeho normalizaci (hemofilie B Leyden). V ostatních případech hemofilie A/B je hladina faktorů celoživotně stejná.
Podstata strukturálních a funkčních změn
FVIII i FIX patří mezi plazmatické koagulační faktory. Oba se tvoří v játrech, FVIII v minimálním množství i v jiných tkáních. FIX je na vitaminu K závislá serinová proteáza, která se v krvi vyskytuje jako proenzym (zymogen). Na aktivní enzym je aktivován komplexem tkáňový faktor+FVIIa za přítomnosti fosfolipidů a vápníkových iontů nebo FXIa. Vitamin K je nutný pro gama-karboxylaci FIX, která je nezbytná pro jeho funkční aktivitu. FVIII není zymogen a je v plazmě chráněn před inaktivací vazbou na von Willebrandův faktor (VWF). I když jsou obě choroby způsobeny chyběním různého koagulačního faktoru, jejich klinické projevy jsou stejné, protože oba dva faktory působí v koagulační kaskádě společně; FVIIIa je kofaktorem FIXa při aktivaci FX (komplex je nazýván tenáza). Příčinou krvácení u hemofilie je selhání sekundární hemostázy. Dojde sice k vytvoření primární destičkové zátky a vzniku menšího množství trombinu, vlivem defektu FVIII či FIX však selhává cesta amplifikace koagulace a celkově vytvořené množství trombinu je nedostatečné pro vznik kvalitní fibrinové sítě. Nedochází tak k úplné zástavě krvácení, u těžkých forem hemofilie se sice dočasně zmírní, ale trvale se nezastaví.
Nejčastějším typem krvácení u těžké hemofilie je krvácení do kloubů, které většinou vzniká „spontánně“. Místem vzniku krvácení jsou pravděpodobně subsynoviální kapilární pleteně. Opakované krvácení do kloubů vede k reaktivní synovitidě a k destrukci kloubní chrupavky. Klíčovou roli má železo uvolněné z erytrocytů. Depozita hemosiderinu v synoviální tkáni indukují proliferaci synovie a neovaskularizaci subsynoviální vrstvy. Důsledkem je snadnější zranitelnost synovie a tím i vznik dalšího krvácení. Synovie po krvácení produkuje více zánětlivých cytokinů a byla prokázána zvýšená exprese různých genů podílejících se na buněčné proliferaci. Výsledkem je vystupňování fagocytární aktivity vedoucí k porušení integrity kloubní chrupavky až k její destrukci. To je navíc podpořeno současnou inhibicí syntézy proteoglykanů následkem kontaktu chrupavky s krví. Po ztrátě chrupavky nastupuje destrukce kosti se vznikem subchondrálních cyst a osteofytů, postupně dochází k fibrotizaci kloubu až k jeho ankylóze. Současně se prohlubuje svalová atrofie, vznikají kontraktury, deviace kloubní osy.
Klinický obraz
Tíže klinických projevů u obou typů nemoci zpravidla odpovídá koagulační aktivitě faktorů v plazmě. Většinou v průběhu druhého roku života se u těžké hemofilie objeví kloubní krvácení, které patří vedle tzv. pozdního krvácení po poraněních a chirurgických zákrocích k hlavním příznakům této krvácivé nemoci. U těžké formy hemofilie dochází průměrně jednou měsíčně ke spontánnímu krvácení do kloubu a 1–2x do roka do svalu, avšak frekvence krvácivých epizod je značně individuální, od krvácení více než 1x týdně až po jen ojedinělé projevy 1–2x ročně. U těžkých hemofiliků se může objevit hematurie, krvácení do zažívacího traktu, retroperitonea (musculus iliopsoas), velmi závažné je mozkové krvácení (větší riziko je perinatálně: 1–4 %). U lehčích forem hemofilie jsou krvácivé projevy méně nápadné a krvácení se může objevit pouze při úrazech a invazivních zákrocích. Krvácením mohou být ohroženy i ženy přenašečky, mají-li hladinu faktorů nižší než cca 40 %.
Následkem opakovaného krvácení do kloubů dochází u těžkých pacientů k jejich postupnému poškození až destrukci a rozvoji hemofilické artropatie.
Diagnostika
Diagnózu onemocnění lze stanovit na základě stanovení snížené koagulační aktivity FVIII/FIX. Současně je nutné vyloučení inhibitoru a u hemofilie A von Willebrandovy choroby (VWCH) typ 2, Normandy. Významně k diagnóze přispívá pozitivní rodinná anamnéza s x-recesivním způsobem dědičnosti.
Základní vyšetření (na všech hematologických ambulancích ve spojení s regionální hematologickou laboratoří):
- Screening krvácivého stavu:
- a) Anamnéza se zaměřením na krvácivé projevy – osobní i rodinná.
- b) Základní koagulační testy odebírané při screeningovém vyšetření krvácivého stavu – trombocyty, aPTT, PT, fibrinogen. Pro hemofilii A/B je charakteristické prodloužení pouze aPTT a ostatní screeningová vyšetření jsou negativní s výjimkou hemofilie Bm, kdy může být prodloužen i PT.
- Stanovení FVIII:C a/nebo FIX:C jednofázovou metodou. Dle vybavení pracoviště, případně toto vyšetření provést až na pracovišti vyššího stupně typu hemophilia treatment centre (HTC) nebo comprehensive care centre (CCC). Diagnóza onemocnění musí být vždy potvrzena na pracovišti typu HTC/CCC. Především u lehčích forem hemofilie A může být hladina stanovená jednofázovou metodou u některých pacientů odlišná od hladiny stanovené metodou dvoufázovou, resp. fotometrickou pomocí chromogenního substrátu. Je-li diskrepance mezi hladinou faktoru VIII stanovenou běžně používanou jednofázovou metodou a mezi klinickým fenotypem (krvácivými projevy), je vhodné v centru typu CCC vyšetřit hladinu FVIII fotometricky. U lehké a středně těžké formy je doporučeno vždy měřit FVIII oběma metodami.
- Orientační stanovení inhibitoru pomocí směsného testu na bázi aPTT včetně inkubace (tzv. stanovení cirkulujícího antikoagulans) nebo přímo vyšetření inhibitoru Bethesda metodou (na pracovišti typu HTC nebo CCC).
Vyšetření z bodu 1 a 2 je nutno provést i u všech možných přenašeček hemofilie k vyloučení rizika krvácení a také kvůli odlišení VWCH, subtyp 2 Normandy.
Specializované vyšetření (na pracovištích typu HTC a CCC):
- Vyšetření inhibitoru a jeho přesné stanovení (titr) pomocí Bethesda metody, nejlépe Nijmegen modifikací, která odfiltruje falešně pozitivní hraniční inhibitory (0,5–1,5 BU/ml).
Poznámka: Inhibitor je nutno pravidelně sledovat v průběhu substituce koncentráty FVIII/FIX pro riziko vzniku alogenního inhibitoru FVIII/FIX. Během prvních 25 dnů expozice koncentrátů FVIII/FIX je nutné sledovat inhibitor FVIII/FIX po každých cca 5 dnech expozice alogennímu koncentrátu FVIII/FIX, později každých cca 10 dnů do 50. dne expozice a dál á 6 měsíců do 150. dne expozice a dál stačí jen jednou ročně. Jsou-li dětští pacienti na profylaktické aplikaci FVIII/FIX, což je v ideálním případě nejpozději po první krvácivé epizodě, je vhodné inhibitor monitorovat minimálně á 2 měsíce prvního půl roku a pak á 3 měsíce druhého půl roku a posléze á 6 měsíců. Při změně koncentrátu FVIII/FIX je doporučeno během prvních třiceti expozičních dnů inhibitor vyšetřovat každých 5–10 dnů expozice, u dospělých pacientů, již dříve léčených vícero koncentráty, dle klinického stavu – při podezření na snížení terapeutické odpovědi na podávaný faktor. - U všech hemofiliků je nezbytné molekulárně genetické vyšetření k identifikaci kauzální mutace a stanovení haplotypu hemofilické alely. Molekulárně genetické vyšetření je nutné pro:
- a) charakterizaci onemocnění
- b) identifikaci přenašeček onemocnění
- c) zajištění prenatální diagnostiky (v případě přenašeček)
- d) určení rizika vzniku inhibitoru (nejvyšší je v případě velkých delecí, nonsense mutací a inverze intronu 1)
Genetické vyšetření je doporučeno provést u všech pacientů, především však u těžké formy onemocnění. U lehčích forem zejména pokud je v rodině možná fertilní přenašečka. Přenašečství hemofilie by mělo být stanoveno před dosažením fertilního věku. Prenatální vyšetření se provádí z DNA izolované z choriové biopsie v 11.–13. týdnu gravidity. Po vyšetření pohlaví se u plodů mužského pohlaví stanovuje přítomnost hemofilické alely buď pomocí haplotypu polymorfních markerů nebo kausální mutace. Alternativně lze využít v 15.–18. týdnu amniocentézu.
- Pokud není pro hemofilii pozitivní rodinná anamnéza, provést vyšetření i ostatních koagulačních faktorů v rámci diferenciální diagnostiky prodloužení aPTT. U hemofilie A vyloučit defekt faktoru V a von Willebrandovu chorobu (tuto vyloučit i u všech přenašeček hemofilie A). Pro vysokou frekvenci von Willebrandovy choroby je vhodné tuto vyloučit vždy u každého nového pacienta s hemofilií A i B.
- Stanovení antigenu FVIII/FIX – pro klinický postup není nezbytné (pokud by bylo třeba, provedení by mělo zabezpečit pracoviště typu CCC).
U každého nově diagnostikovaného pacienta s hemofilií je vhodné vyšetřit:
- hladinu FVIII:C/FIX:C jednofázovou metodou minimálně ze dvou různých odběrů, VWF antigen (VWF:Ag) a ristocetin kofaktor (VWF:RCo)
- vyloučit inhibitor
- provést genetické vyšetření a důkladnou anamnézu rodokmenu s cílem zaměřit se v rodině na možné přenašečky hemofilie ve fertilním věku (u přenašeček je také nutné i vyšetření koagulační ke zhodnocení rizika krvácení). Je důležité shromažďovat i údaje o zemřelých hemofilicích.
- markery hepatitidy A, B, C a HIV (parvoviru B19)
- jaterní testy
- krevní skupinu
- protilátky proti krevním elementům
Dispenzarizace
Všichni pacienti s krvácivými projevy dostávající opakovaně krevní deriváty musí být pravidelně (na pracovišti typu HTC či CCC) alespoň jednou ročně dispenzarizováni vzhledem k riziku přenosu infekcí, rozvoji inhibitoru FVIII/FIX, progresi hemofilické artropatie či jiného poškození organismu následkem opakovaného krvácení. Děti častěji – těžcí hemofilici min. 2x ročně, lehcí 1x ročně, naopak dospělé lehké hemofiliky nevyžadující substituční léčbu stačí dispenzarizovat 1x za 2-3 roky, dospělé těžké hemofiliky 1–2x ročně. Pacientům je vhodné nabídnout možnost očkování na hepatitidu A, B. Pravidelně nutno sledovat:
- inhibitor FVIII/FIX
- stav kloubního aparátu
- markery hepatitidy A, B, C a HIV
- jaterní testy
- krevní obraz
- případně protilátky proti krevním elementům
- jiné změny dle klinického stavu, resp. charakteru krvácivých projevů
- samozřejmostí by měly být i stomatologické kontroly standardně jako v normální populaci á půl roku
- pracoviště typu HTC/CCC mají možnost nabídnout a/nebo zprostředkovat i konsultaci psychologa a sexuologa
- zejména u dětí je vhodný preventivní rehabilitační/fyzioterapeutický program
Diferenciální diagnostika
Diferenciálně diagnosticky při nálezu snížené hladiny FVIII musíme vyloučit získaný inhibitor (specifický proti FVIII nebo typu lupus antikoagulans), von Willebrandovu chorobu (především typ 2N – vyšetření vazebné kapacity VWF pro FVIII), kombinovaný defekt faktorů. Fyziologicky se s lehce nižší hladinou FVIII můžeme setkat u osob s krevní skupinou 0. Při snížení FIX vylučujeme opět inhibitor FIX a vzácné kombinace defektů.
Léčba
Pilířem péče jsou centra typu CCC/HTC akreditovaná ČNHP. Nekomplikované krvácivé epizody a vydávání koncentrátů lze realizovat i na regionálních/spádových hematologických pracovištích, pakliže na ně centrum tuto pravomoc deleguje. Léčba každého pacienta s hemofilií však musí být pod dohledem centra CCC/HTC, které provádí pravidelnou dispenzarizaci.
Léčba u hemofiliků je v současné době možná pouze formou substituční. Spočívá v podávání chybějících/defektních faktorů k dosažení hemostaticky dostatečné hladiny. Cílem je zástava krvácení či prevence jeho vzniku.
Možnosti léčby
- Léčba „on demand“ – koncentrát FVIII/FIX je podáván až při objevení se krvácení.
- Léčba profylaktická:
U dětských pacientů je doporučeným standardem léčby profylaktická aplikace koncentrátů FVIII/FIX. Profylaxe je indikovaná u těžkých hemofiliků (případně s vyšší hladinou FVIII/FIX, pakliže je spojena s fenotypovými projevy obdobnými těžké hemofilii). Cílem je držet hladiny faktorů minimálně nad 1 %, ideálně nad 2 %.- a) primární profylaxe: takto se označuje profylaktická aplikace koncentrátů FVIII/FIX započatá nejpozději po objevení se první krvácivé epizody nebo do ukončení druhého roku života
- b) sekundární profylaxe: toto označení nese profylaxe započatá později než u primární a/nebo po větším počtu krvácivých epizod
- c) krátkodobá profylaxe: dle klinického stavu se přechodně zavádí po operaci, úraze, při rehabilitaci apod.
1.DDAVP
Vzestupu plazmatické hladiny FVIII lze někdy dosáhnout u lehkých forem hemofilie A podáním DDAVP(1-deamino-8-D-arginin vasopressin). V ostatních případech je nutno použít koncentráty FVIII. Standardní dávkování je 0,3 µg/kg v i. v. infuzi trvající 20–30 min. á 12–24 hod. Po této dávce dochází k vzestupu FVIII 3–4x, s maximální hladinou za 30–60 min. od ukončení aplikace, s plazmatickým poločasem 4–8 hod. Dosažení hemostaticky dostatečné hladiny FVIII nad 40–50 % lze tedy očekávat u hemofiliků s výchozí hladinou FVIII nad 10–15 %. Před terapeutickým použitím je nutné provést vždy terapeutický pokus, při kterém se ověří vzestup hladiny FVIII. Při léčbě krvácení pak lze očekávat obdobným vzestup FVIII. Při nutnosti opakované aplikace nutno počítat s efektem tachyfylaxe, tedy že vzestup hladiny FVIII při opakované aplikaci bude nižší než po první, při druhé aplikaci cca o 30 %, a k méně výraznému snížení může docházet i po dalších dávkách. Při použití DDAVP je třeba respektovat jeho kontraindikace (zejména věk pod 2 roky, srdeční insuficience) a současně omezit příjem tekutin p. o. na 1–1,5 litru denně. Po podání DDAVP je vhodné zkontrolovat hladiny iontů, zejména Na. DDAVP lze ve stejné dávce jako i. v. použít i s. c. s dosažením téměř stejného vzestupu FVIII jako po i. v. aplikaci s odstupem cca 60–90 min. od podání. Podobný efekt jako podkožní aplikace má použití intranasální v dávce 150 µg do každé nosní dírky, při hmotnosti pod 50 kg se dávka snižuje na polovinu.
V současné době však není DDAVP v ČR registrován v žádné formě vhodné pro parenterální aplikaci ani pro intranasální aplikaci v dostatečné koncentraci. Lze ho však získat na mimořádný dovoz.
2. Koncentráty koagulačního FVIII/FIX
V současné době jsou v ČR nejčastěji používány plazmatické (pd), vysoce čištěné a protivirově ošetřené koncentráty FVIII/IX. U dosud neléčených hemofiliků jsou upřednostňovány rekombinantní (r) koncentráty FVIII/FIX z důvodu snížení rizika krví přenosných infekcí. Pediatrická společnost ČLS JEP na doporučení své Pracovní skupiny pro dětskou hematologii (PSDH) doporučuje tyto rekombinantní preparáty používat zejména pro nově narozené, dosud neléčené či minimálně léčené pacienty s hemofilií, u kterých se tímto postupem zabrání případné infekci spojené s léčbou krevními deriváty. Tento postup je v souladu s pediatrickými doporučeními většiny zemí EU.
Nejasná je otázka vyššího výskytu inhibitoru po rFVIII, která je intenzivně zkoumána s nejednoznačnými závěry. Nebylo dosud prokázáno, že by použití rekombinantních faktorů bylo spojeno se signifikantně vyšším rizikem vzniku inhibitoru. U jednotlivého pacienta je vhodné substituci chybějícího faktoru provádět pokud možno pouze jedním koncentrátem, protože střídání různých koncentrátu koagulačního faktoru (liší se způsobem zpracování a protivirového ošetření, což může mít vliv na výslednou imunoreaktivitu antigenu FVIII) je podezřelé z vyšší frekvence výskytu inhibitoru (zejména pro koncentráty FVIII), byť některé práce toto riziko rovněž zpochybňují.
Dávka podaných koncentrátů závisí na tíži hemofilie a na závažnosti krvácení, event. na charakteru plánovaného výkonu. Obecně se předpokládá, že u FVIII zvýší 1 jednotka (j) / kg hladinu v průměru o cca 2 %, zatímco u FIX 1 j / kg asi o 1 %. Plazmatický poločas FVIII je přibližně 8–12 hod., FIX kolem 18 hod. Tyto údaje sice platí pro většinu pacientů, ale reakce na podaný FVIII či FIX je značně individuální a je vhodné mít u každého hemofilika ověřeno alespoň „recovery“ (dochází-li k přiměřenému procentuálnímu vzestupu plazmatické hladiny FVIII/FIX po aplikaci určitého množství koncentrátu udaného v j/kg), zejména před chirurgickým zákrokem či při změně preparátu. U dětí a zejména novorozenců je vhodné oproti dospělým substituci koncentráty FVIII/FIX navýšit (cca o 10–25 %) vzhledem k předpokládanému kratšímu plazmatickému poločasu. Při akutním krvácení či perioperačně musíme počítat se zkrácením plazmatického poločasu. U rFIX je třeba počítat s jeho až o 30 % nižším recovery. Doporučené plazmatické hladiny FVIII/FIX a trvání substituce dle WFH uvádí tabulka 1. Dle klinického stavu je po jakémkoli závažném krvácení ke zvážení krátkodobá profylaxe v řádu několika týdnů.
Tab. 1. Doporučované hladiny faktoru a délka substituce u jednotlivých krvácivých epizod a operací. 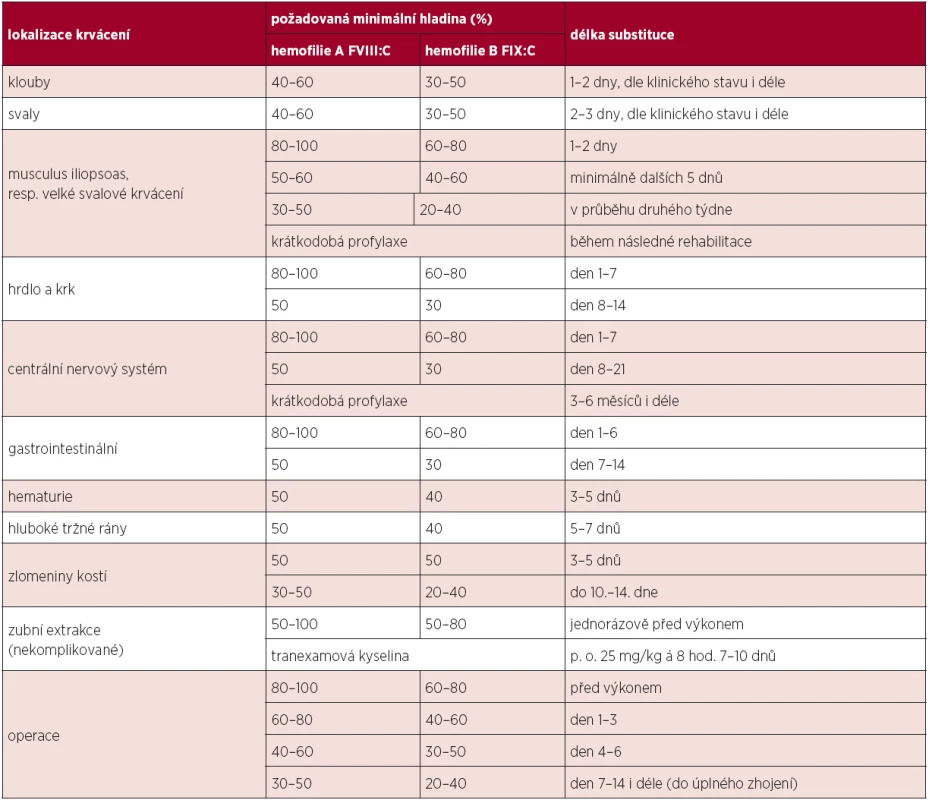
Legenda: FVIII:C = koagulační aktivita faktoru VIII; FIX:C = koagulační aktivita FIX Kontinuální infuze FVIII/FIX
Kromě bolusové aplikace lze s úsporou množství až 30 % použitého koncentrátu podávat FVIII/FIX formou kontinuální infuze. V poslední době se však od této možnosti upouští, protože aplikace formou kontinuální infuze je, především u lehčích forem hemofilie A, podezřelá z vyššího rizika vzniku inhibitoru, zejména, je-li taková léčba spojena s chirurgickým výkonem.
Principy terapie krvácivých epizod
- Léčba krvácení by měla být zahájena co nejdříve, čímž lze minimalizovat poškození tkání a předcházet pozdějším komplikacím.
- Je vhodné, aby u všech pacientů s vysokým rizikem krvácení (minimálně u těžkých hemofiliků) byla zavedena domácí léčba a pacient (případně rodiče) si byl schopen aplikovat koncentrát koagulačního faktoru sám.
- Začátek krvácení nejlépe pozná pacient sám a v ideálním případě je léčba zahájena při časných známkách krvácení ještě před manifestací krvácení dle fyzikálního vyšetření.
- Pokud není do 12–24 hodin adekvátní léčebná odpověď na substituci koagulačního faktoru, je nutno vyloučit inhibitor a je nutné vyšetření lékařem hematologem, případně hospitalizace.
- Terapie musí být vedená pod dohledem centra typu HTC, resp. CCC.
- Při mírném a středně těžkém krvácení (nejčastěji se jedná o krvácení do kloubů, do svalů, epistaxe, krvácení z dásní, z povrchových ran) je vhodné dosáhnout hladiny FVIII 40–60 % a FIX 30–50 %, tedy aplikovat u těžké hemofilie FVIII 20–30 j/kg a FIX 30–50 j/kg.
- Je-li podezření na život či končetinu ohrožující krvácení, je nutné nejprve substituovat koagulační faktor a teprve potom provádět vyšetření k potvrzení diagnózy (zejména při susp. na krvácení do CNS).
- Při závažném krvácení (intrakraniální, do míchy, v oblasti krku, do hrudníku, břicha, pánve, musculus iliopsoas, jakékoli rozsáhlé svalové i kloubní krvácení, fraktury s dislokací, hluboká poranění, resp. jakékoli masivní krvácení) je nutné dosáhnout hladiny FVIII 80–100 % a FIX 60–80 %, tedy u těžké hemofilie aplikovat FVIII 40–50 j/kg a FIX 60–80 j/kg.
Doporučený postup léčby dle lokalizace krvácení
Krvácení do kloubu
- Při počínajícím krvácení do kloubu je většinou postačující dosáhnout požadovanou hladinu faktoru (FVIII 40–60 %, FIX 30–50 %) pouze jednorázovou aplikací faktoru, při pokročilejším krvácení nebo i počínajícím do cílového kloubu podat druhou dávku faktoru za 12–24 hodin od první a třetí dávku přibližně třetí den od zahájení léčby.
- Jedná-li se o rozsáhlejší krvácení do velkého kloubu, musí se hemostatická hladina FVIII > 40 % či FIX > 30 % udržovat minimálně 2–3 dny i déle a iniciálně je vhodné dosáhnout hladiny FVIII > 80 % a FIX > 60 %.
- Vždy je vhodné kloub dle rozsahu krvácení minimálně jeden den imobilizovat elastickým/kompresním obinadlem v jeho „úlevové“ pozici a poté velmi pozvolně rozcvičovat a dalších 4–5 dnů plně nezatěžovat. Současně minimálně prvních 12–24 hodin kloub chladit, což zmírní prokrvení i bolest. Chlazení by mělo být intermitentní (opakovaně po dobu cca 20 min. každé 2 hodiny).
- Pokud do 12–48 hod. od zahájení substituce faktoru nedojde k ústupu potíží, lze po vyloučení inhibitoru (ověření hladiny faktoru) zvážit při velké náplni kloubu provedení odlehčovací aspirace kloubu za substituce FVIII/FIX minimálně nad 30–50 % a následně další minimálně 2–3 dny. Tento postup je však alternativní a neexistuje literární pramen, který by tento postup u hemartros doporučoval standardně. U masivní náplně kloubu však artrocentéza může být prospěšná. Tento výkon může být proveden pouze v centru HTC/CCC.
- Při recidivujícím krvácení do kloubu a rozvoji tzv. cílového kloubu (4 a více krvácení za 6 měsíců nebo 3 a více krvácení během 3 měsíců) je vhodné zavést i u dospělého pacienta na několik týdnů krátkodobou profylaxi (6–8 týdnů) v minimální dávce FVIII 15–25 j/kg 2x týdně až obden a FIX minimálně 15–25 j/kg 2x týdně či každý třetí den. V období mimo krvácení lze zkusit efekt selektivních COX-2 inhibitorů.
- Pokud tento postup situaci nezlepší a jsou známky chronické synovitidy (ověřit dle ultrazvukového vyšetření, případně dle magnetické rezonance), je vhodné provedení radiační synoviortézy s aplikací radionuklidu do kloubu, případně chemické synoviortézy při nedostupnosti radiační. Náročnější je chirurgická synovectomie, která může být artroskopická či otevřená (viz další odstavec).
Léčba chronické synovitis
- Chronická synovitis je charakteristická nebolestivým otokem kloubu, který nereaguje na aplikaci koagulačního faktoru a který je současně provázen častým krvácením do kloubu.
- Jako první postup lze zvolit krátkodobou profylaxi koncentrátem FVIII/FIX, jejíž úspěšnost však nedosahuje ani 50 %.
- V období mimo krvácení lze využít i NSAID, preferovány jsou selektivní COX-2 inhibitory. Krátkodobě možno použít i kortikoidy.
- Radiační synoviortézu lze indikovat, pokud není zřejmý efekt profylaktické aplikace faktoru ani antirevmatik i jako postup první volby vzhledem k většinou nedostatečnému efektu samotné profylaxe.
- Na menších kloubech lze využít i synoviortézu chemickou, není však léčbou volby.
- Chirurgická synovektomie je vhodná až jako poslední možnost řešení chronické synovitis vzhledem k její ekonomické náročnosti na substituci faktoru i riziku ztuhnutí kloubu.
- Uvedené postupy musí probíhat v gesci a na doporučení HTC/CCC.
Radiační synovektomie (synoviortéza)
- Indikací k zákroku je časté krvácení do kloubu bez reakce na krátkodobou profylaxi se známkami chronické synovitidy. Zákrok má největší efekt, pokud se provede ještě před destrukcí kloubní chrupavky, resp. ve stadiu ještě bez radiologických známek destrukce kloubu. Pokročilejší stupeň artropatie sice není kontraindikací výkonu, lze však očekávat jeho menší efekt.
- Synoviortézu je nevhodné provádět na kloubu po předchozím zakrvácení, proto při častém krvácení do kloubu před plánovaným termínem zákroku je vhodné vřadit cca na 2–4 týdny profylaxi koncentrátem FVIII/FIX.
- Na zákrok dosáhnout fyziologické hladiny FVIII (80–100 %) a FIX (60–80 %) a po další 3 dny udržovat FVIII/FIX minimálně ≥ 30–40 %. Následně další 3–4 dny dávkování FVIII/FIX postupně snižovat a přejít na profylaxi minimálně na cca 3–6 týdnů i déle.
- První 2–3 dny po výkonu kloub imobilizovat.
- S rehabilitací lze začít až za týden od zákroku. Její délka a tím i délka profylaktické aplikace koncentrátů se odvíjí od klinického stavu – ztuhnutí kloubu vlivem přechodné imobilizace po zákroku.
- Zákrok lze na jednotlivém kloubu provést celkem až 3x s odstupem minimálně 3 měsíce mezi jednotlivými procedurami.
- Obvyklá dávka radionuklidu je 2–5 mCi, používán je radionuklid ytria90, případně rhenia186, dříve byl používán a v USA je dosud doporučován fosfor32 (nevýhodou je dlouhý poločas rozpadu – 2 týdny, oproti zhruba 3 dnům u předchozích dvou radionuklidů).
- Zákrok lze provést po konzultaci s CCC i v dětském věku. Dolní věková hranice není přesně stanovena; je však třeba adekvátně snížit dávku radionuklidu.
Chemická synoviortéza
- Provádí se při nedostupnosti synoviortézy radiační, většinou pouze na menších kloubech.
- U dětí tento postup není považován za standardní.
- Používá se rifampicin s aplikací 5x á týden.
- Nároky na substituční terapii jsou menší, stačí jednorázová substituce na zákrok nad 60–80 % FVIII/FIX a následně pouze první den držet hladinu nad 30–40 % a dál pokračovat aplikací v profylaktickém dávkování.
- Na rozdíl od radiační synoviortézy není nutná první dny imobilizace kloubu.
Chirurgická synovektomie
- Provádí se při selhání a/nebo nedostupnosti synoviortézy radiační.
- Substituce FVIII/FIX je jako pro operační zákrok (viz tabulka 1).
- Důraz musí být kladen na řádnou rehabilitaci současně s profylaktickou aplikací FVIII/FIX jako prevence ztuhnutí kloubu, ke kterému je po tomto typu zákroku tendence.
Krvácení do svalů
- Cílová hladina FVIII/FIX při substituci je obdobná jako při krvácení do kloubů, většinou však je třeba delší doba její aplikace (minimálně 2–3 dny).
- Při menším rozsahu krvácení je cílová hladina FVIII 40–60 % a FIX 30–50 %, při rozsáhlých hematomech je nutno na úvod dosáhnout hladiny FVIII 80–100 % a FIX 60–80 %.
- Toto platí zejména při krvácení do musculus iliopsoas, kdy je doporučováno vysokou hladinu faktoru (60–100 %) udržovat 1–2 dny a následně minimálně dalších 5 dnů držet hladinu FVIII/FIX nad 40–60 % a v průběhu druhého týdne substituci postupně snižovat. Pacienta je nutno vždy hospitalizovat.
- Při závažném krvácení s útlakem okolních struktur může edém svalu zmírnit krátkodobá aplikace kortikoidů (100 mg hydrokortizonu).
- Součástí terapie je i imobilizace postižené končetiny, v případě krvácení do m. iliopsoas klid na lůžku do ústupu bolesti, a dle dostupnosti i chlazení krvácením postiženého místa.
- Po krvácení do m. iliopsoas i po rozsáhlých hematomech na končetinách je následně vhodné přejít na několikatýdenní profylaktickou aplikaci koncentrátu FVIII/FIX.
- Po odeznění příznaků provázejících krvácení je vhodná následná rehabilitace, většinou za současné profylaktické aplikace faktoru.
Hematurie
- Pokud není hematurie masivní a není provázena bolestí, je možno prvních 48 hodin léčit pouze klidem na lůžku a zvýšenou hydratací.
- Při bolesti a/nebo přetrvávající a/nebo masivní hematurii je nutná substituce faktoru FVIII > 50 % a FIX > 40 % po dobu 3-5 dnů.
- Při přetrvávající a/nebo recidivující hematurii může mít efekt podání prednizonu 0,5–1 mg/kg na 3–5 dnů.
- Hematurie z proximální části močových cest je kontraindikací antifibrinolytik.
- Při přetrvávající a/nebo recidivující hematurii se doporučuje provést urologické došetření, resp. při každé hematurii je vhodné provést alespoň ultrazvukové vyšetření ledvin a močových cest a močový sediment (zevrubné vyloučení litiázy a uroinfektu).
Epistaxe
- Před substitucí faktoru zkusit mírný tlak na nosní křídlo po dobu 10–20 min. za současného ochlazování.
- Použít antifibrinolytika, obvykle tranexamová kyselina v dávce 15–25 mg/kg 3x denně.
- Je-li překrvení sliznice v rámci alergie, použít antihistaminikum.
- Při alergii i infekci dýchacích cest lze užít i lokální kapky s vasokonstrikčním účinkem.
- Při selhání výše doporučených postupů substituovat koagulační faktor > 30–40 % do zástavy krvácení.
- V případě nutnosti provést tamponádu za současné substituce faktoru a podávání antifibrinolytika, zejména při detamponádě (tampon je vhodné namočit do roztoku antifibrinolytika), po které výše uvedenou hladinu faktoru udržet alespoň 12–24 hodin a antifibrinolytikum podávat ještě několik (7–10) dnů.
Krvácení z dutiny ústní
- Mírné krvácení je možno pokusit se zvládnout jen pomocí antifibrinolytika formou výplachu 10% roztokem tranexamové kyseliny za následného spolknutí, do dávky 75–100 mg/kg/den.
- Není-li krvácení tímto způsobem zastaveno, je třeba substituovat faktor > 30–40 % do zástavy krvácení.
- V podávání antifibrinolytika celkově p. o. pokračovat ještě několik (7–10) dnů po zástavě krvácení.
- Dle lokalizace krvácení provést stomatologické vyšetření a zvážit možnost lokální aplikace fibrinového lepidla.
- Podávat studenou a měkkou stravu.
Poranění a/nebo krvácení do oka
- Nejdříve podat faktor a pak provést vyšetření oftalmologem.
- Faktor iniciálně substituovat na hladinu jako u závažného krvácení (FVIII na 80–100 % a FIX na 60–80 %) a následně udržovat > 40–50 %.
- Další terapie ve spolupráci s oftalmologem.
- Délka substituce koagulačního faktoru je individuální, u závažného krvácení lze doporučit substituci obdobnou jako při krvácení do CNS.
Intrakraniální (intraspinální) krvácení
- Při podezření nejprve substituovat faktor (FVIII > 80 %, FIX > 60 %) a teprve potom došetřovat.
- První týden substituovat FVIII na 80–100 %, FIX na 60–80 %, další dva týdny FVIII > 50 % a FIX > 30 % a následně přejít na profylaktickou aplikaci na minimálně 3–6 měsíců.
Krvácení do měkkých tkání s rizikem útlaku dýchacích cest (krvácení retrofaryngeální, v oblasti krku, průdušnice, rozsáhlé krvácení do jazyka)
- První týden substituovat FVIII na 80–100 %, FIX na 60–80 %, druhý týden FVIII > 50 % a FIX > 30 %.
- Při těžké akutní tonsilitidě profylakticky substituovat i koagulační faktor.
Gastrointestinální krvácení
- Substituce FVIII na 80–100 % a FIX na 60–80 % 6 dnů a do 10–14. dne držet hladinu FVIII > 50 % a FIX > 30 %.
- Vhodné je současně podávat antifibrinolytikum (tranexamová kyselina v dávce 15–25 mg/kg á 8 hod.).
- Současně provést vyšetření k objasnění zdroje krvácení.
- Obdobná substituce (jako u život ohrožujícího krvácení) je i při krvácení do dutiny břišní, do parenchymatózních orgánů, do stěny střeva.
Podkožní krvácení
- Menší podkožní hematomy nevyžadují substituci koagulačního faktoru a většinou je postačující mírný lokální tlak a chlazení.
- Ke zvážení je podat antifibrinolytikum.
- V případě masivního krvácení je však také nutná substituční terapie a při rozsáhlém krvácení či při hrozbě compartment syndromu může být nutná substituce jako u život ohrožujícího krvácení, tedy iniciálně FVIII > 80 % a FIX > 60 % a následně nad 30–60 %.
Tržné rány a eroze
- Povrchové eroze netřeba léčit substitucí koagulačního faktoru.
- Ke zvážení je podat antifibrinolytikum.
- Hluboké tržné rány je třeba léčit substitucí FVIII > 50 % a FIX > 40 % po dobu 5–7 dnů.
Zlomeniny
- Prvních 3–5 dnů substituovat FVIII > 50 % a FIX > 50 % a do stabilizace fraktury do 10.–14. dne udržovat hladinu koagulačního faktoru nad 20–50 %.
- Intenzivnější substituce je třeba při frakturách s dislokací, kdy může být nutná iniciální substituce jako při krvácení s ohrožením končetiny (FVIII 80–100 % a FIX 60–80 %) první týden a druhý týden udržovat hladinu FVIII > 50 % a FIX > 30 %.
Chirurgické a ortopedické výkony
– viz samostatný doporučený postup
Profylaxe
Profylaxe primární či sekundární je indikována u všech těžkých forem (případně i středně těžkých forem s častými krvácivými projevy) hemofilie, aby se předešlo nevratnému poškození kloubů, které jsou v dětství více náchylné ke krvácení než v dospělosti. Profylaxe rovněž předchází život ohrožujícím krvácivým epizodám. Cílem profylaxe je udržet hladinu FVIII/FIX > 1 %, lépe >2 %. Z toho vychází doporučované dávky pro profylaxi: 25–40 j/kg 2–3x týdně až obden u hemofilie A a 2x týdně až každý třetí den u hemofilie B. U dětí lze použít i tzv. „tailored“ profylaxi s méně frekventní aplikací koncentrátu faktoru, která se zahajuje dávkou 25–50 j FVIII/kg 1x týdně a až dle klinického stavu se přechází na aplikaci 30 j/kg 2x týdně, případně na standardní protokol 3x týdně. V posledních letech se stále častěji objevují doporučení hovořící o profylaktickém režimu, který má za cíl nejen předejít vzniku postižení pohybového aparátu, ale i předejít vzniku inhibitoru u dětí s hemofilií A. Profylaxe je zahájena ideálně mimo krvácení nejpozději ve 12 měsících života a/nebo po prvním krvácení dávkou 25–35 j/kg 1x týdně a teprve při prvním kloubním a/nebo opakovaných měkkotkáňových krváceních se zvyšuje frekvence aplikace FVIII. Maximální dávka, kterou lze v takovém režimu podat, je 50 j/kg, doporučováno je však spíše zmíněných 25–35 j/kg/dávku. Zdá se, že tato léčba vede k signifikantnímu snížení rizika vzniku inhibitorů u PUPs (Previously Untreated Patients – dosud neléčení pacienti). Tato profylaxe je v současné době doporučeným režimem pro nově diagnostikované děti s těžkým fenotypem hemofilie A v České republice (viz doporučení PSDH a ČNHP).
Nevyřešená je otázka, kdy lze profylaxi ukončit. Pokud pacient nemá při profylaxi časté krvácivé epizody, lze ji v dospělém věku, lépe až ve třetí dekádě života, postupně vysadit. U části pacientů, zejména s vyšší frekvencí krvácivých příhod (některé práce uvádí nad 20/rok), je zřejmě vhodné pokračovat v profylaxi i v dospělém věku. Ve vyspělých zemích přibližně 1/3 pacientů na profylaxi v ní pokračuje trvale, 1/3 ji přechodně vysadí nebo sníží dávku a zbývající 1/3 ji trvale ukončí a je dál léčená „on demand“.
Domácí léčba
Vždy, když je to možné, je koncentráty faktorů vhodné podávat formou tzv. domácí léčby, při které aplikaci provádí pacient sám nebo jeho rodina, případně praktický lékař či zdravotní sestra. Tento postup zaručí co nejmenší časové prodlení při léčbě krvácení a umožní profylaxi bez nutnosti docházet/dojíždět k aplikaci do zdravotnického zařízení. Domácí léčba je legislativně umožněna metodickým pokynem ministra zdravotnictví z roku 1992 (Věstník MZ ČR č. 3/1992). Centra vydávající hemofilikům koncentráty koagulačních faktorů pro domácí léčbu musí nejprve pacienty seznámit s technikou aplikace koncentrátů a jejich skladováním, náležitě poučit o způsobu léčby krvácivých epizod a možných rizicích této léčby, což musí být zaznamenáno ve zdravotnické dokumentaci a stvrzeno podpisem (doporučeno formou protokolu shrnujícího hlavní zásady domácí léčby) pacienta či jiné oprávněné osoby – zákonného zástupce (většinou rodičů). O realizaci domácí léčby je veden protokol, do kterého je zaznamenáváno vydávání koncentrátů zdravotnickým zařízením a jejich aplikace pacientem.
3. Podpůrná léčba
Antifibrinolytika (např. Pamba®, Exacyl®) používáme především při krvácení z dutiny ústní a zubních extrakcích, kdy je doporučováno je podávat 7–10 dnů. V literatuře je zmiňována především tranexamová kyselina, doporučované dávkování je p. o. 25 mg/kg á 8 hod. nebo 15–20 mg/kg á 6 hod nebo i. v. 10 mg/kg á 8 hod. Vhodná jsou i při epistaxi a podkožním krvácení. Kontraindikována je při hematurii z horní etáže močových cest (nevhodná je též při krvácení do kloubů) a při současné aplikaci aPCC (výrobce doporučuje minimálně 6hodinový odstup, vhodnější je však spíše delší interval mezi aplikací aPCC a antifibrinolytika). Důvodem je riziko rozvoje diseminované intravaskulární koagulace a trombózy.
Další postupy
Obecně jsou kontraindikovány nitrosvalové injekce, kdy hrozí obtížně stavitelné krvácení, při podkožní aplikaci stačí komprese. Očkování je proto doporučováno místo i. m. provádět s.c. Tam, kde to není možné, je třeba i. m. injekci aplikovat šetrně, místo vpichu komprimovat, případně i chladit. V současné době není při vakcinaci doporučována prevence krvácení pomocí aplikace faktorů krevního srážení. Naopak, s ohledem na riziko vzniku inhibitoru při konkomitantním podání vakcíny a faktoru, se doporučuje odstup mezi vakcinací a podáním faktoru alespoň 2 dny. Podávání salicylátů stejně jako jiných NSAID v době krvácení je kontraindikováno. Při nutnosti jejich použití jsou preferovány selektivní COX-2 inhibitory.
Genová terapie dosud nenašla praktické uplatnění pro selhání dlouhodobější produkce chybějícího koagulačního faktoru a nežádoucí účinky. V přípravě je produkce koncentrátu FIX z mléka transgenních prasat. Jsou snahy prodloužit plazmatický poločas koncentrátů vazbou na albumin, fc-fragment imunoglobulinů, lysozomy nebo pegylací. Ani tyto postupy však dosud nejsou v současné době v ČR dostupné, resp. probíhají zatím studie I.–III. fáze.
Hemofilii lze vyléčit i transplantací jater, která se u hemofiliků provádí z důvodu terminálního stadia hepatopatie, nejčastěji v důsledku chronické hepatitidy C. Samotná hemofilie pro rizika spojená s transplantací není její indikací.
Léčba virové hepatitidy C a B i HIV je realizována infektologem v rámci HTC/CCC. Sledování markerů virových hepatitid a HIV realizují rovněž pracoviště typu HTC/CCC. Biopsie jater se pro riziko krvácení a nutnost náročné substituční léčby u pacientů s hemofilií standardně neprovádí.
Doporučení pro léčbu arteriální a žilní trombózy
Pacienti s hemofilií mají obdobné riziko aterosklerózy jako ostatní populace, riziko trombózy je nižší, avšak tepenná i žilní trombóza u těchto pacientů může nastat. V literatuře se již objevila doporučení i pro tyto situace:
Trombolýza
- Udržovat hladinu FVIII/FIX nad 80 %, ideálně 80–100 % během trombolýzy a následných 24–48 hodin.
Léčba terapeutickou dávkou (nízkomolekulárního) heparinu
- Opět udržovat hladinu FVIII/FIX nad 80 % obdobně jako u trombolýzy.
Duální antiagregace
- Doporučená hladina FVIII/FIX je nad 30 %.
Léčba acetylsalicylovou kyselinou
- Doporučená hladina FVIII/FIX je nad 5 %.
Koronární angiografie diagnostická
- K provedení výkonu je doporučena hladina FVIII/FIX nad 80 %, zhruba poloviční dávku faktoru pak podat za 12 hod. (20 j/kg FVIII, resp. 30 j/kg FIX).
Perkutánní koronární intervence (PCI)
- Upřednostnit přístup z a. radialis ( lepší možnost komprese, prevence retroperitoneálního a tříselného krvácení vyžadujícího prolongovanou léčbu koncentráty faktorů).
- Je doporučováno použití „bare metal stentu“ před „drug eluting stentem“ z důvodu kratšího zajištění duální antiagregační léčbou.
- K provedení koronární intervence je nutná hladina FVIII/FIX nad 80 %, s udržováním této hladiny po dobu aplikace terapeutické dávky (nízkomolekulárního) heparinu – obvykle 48 hodin.
- Následně viz postup pro antikoagulační léčbu heparinem.
- Při duální antiagregační léčbě udržovat hladinu FVIII/FIX nad 30 %. Neexistují zatím jednoznačná doporučení, tato zatím publikoval pouze Mannucci, který doporučuje výše uvedenou hladinu faktoru a délku podávání duální antiagregace na 4 týdny.
- Při antiagregační léčbě v monoterapii (obvykle ASA) udržovat hladiny FVIII/FIX nad 5 %.
Léčba warfarinem
- Je možná při hladině FVIII/FIX nad 30 %.
Prevence vzniku inhibitoru
Při hereditárním defektu a expozici alogennímu nebo rekombinantnímu FVIII/FIX u části hemofiliků dochází ke vzniku protilátek proti FVIII/FIX. Protilátka se váže na molekulu FVIII/FIX a znemožňuje tak vykonávat jeho funkci v průběhu srážení krve, případně dochází ke zrychlení clearence komplexu faktor+inhibitor. Riziko vzniku inhibitoru je nejvyšší u těžké hemofilie A, incidence kolísá mezi 10–40 %, s prevalencí 12–13 %, u těžké hemofilie B je incidence inhibitoru kolem 3 %. Jen ojediněle vzniká inhibitor u středně těžké a lehké hemofilie B, zatímco u stejné tíže hemofilie A se objevuje ve 3–13 % pacientů. Celková prevalence inhibitoru u hemofilie A je 5–7 %. Ke vzniku inhibitoru dochází většinou během prvních 50 dnů podávání koncentrátu koagulačního faktoru, nejčastěji mezi 10.–12., resp. 9.–36. dnem aplikace, což bývá u těžkých hemofiliků již v předškolním věku. Zřídka kdy dojde k jeho vývoji po sté aplikaci derivátu. V tabulce 2 jsou uvedeny faktory mající vliv na vznik inhibitoru, jde o údaje platné pro inhibitor FVIII, který je mnohem častější a je tedy o něm i více informací než o inhibitoru FIX. Z uvedeného vyplývají doporučení pro léčbu koncentráty FVIII, které lze převzít i pro FIX:
- Nově narozenému hemofilikovi aplikovat koncentráty FVIII/FIX pokud možno co nejpozději, ne dříve než mezi 6.–12. měsícem života (neprovokovat předčasnou vertikalizací a pokusy o chůzi riziko krvácení následkem pádů batolete, elektivní operace odložit minimálně po 6.–12. měsíci života).
- U těžkých hemofiliků začít s profylaxí co nejdříve po první expozici koncentrátu koagulačního faktoru, vhodné do 5.–10. dne expozice (vzhledem k výše uvedenému mediánu vzniku inhibitoru u hemofilie A, u hemofilie B nejsou data), zejména pokud bylo 5 a více dnů expozice jdoucích po sobě a zejména při dávce nad 50 j/kg/den.
- Ideální je s profylaxí začít v období mimo tzv. „nebezpečné signály“ stimulující imunitní odpověď jako vakcinace, infekce, probíhající akutní krvácení, operace, což v praxi znamená začít s profylaktickou aplikaci koagulačního faktoru v dávce 25–35 j/kg 1x týdně po objevení se prvních podkožních hematomů, které ještě nevyžadují substituci koncentrátem chybějícího faktoru (podrobně viz doporučení v odstavci „Profylaxe“).
- Nestřídat různé typy koncentrátů a pokud možno hemofilikovi podávat stále stejný koncentrát FVIII/FIX.
- Zejména u lehkých hemofiliků perioperačně upřednostnit bolusovou aplikaci před kontinuální infuzí.
- Nejsou důvody pro doporučení upřednostňovat plazmatické koncentráty před rekombinantními, kromě jedné retrospektivní studie není jednoznačně prokázán vyšší trvalý výskyt high responderů po léčbě rekombinantními koncentráty.
Tab. 2. Faktory ovlivňující vznik inhibitoru. 
Léčba pacientů s inhibitorem FVIII/FIX
- Je obsažena v samostatném doporučeném postupu
Prognóza
Krvácivé projevy jsou celoživotní, většinou se objevují s počátkem chůze v batolecím věku. V období růstu mohou být častější než v dospělém věku. Tíže postižení závisí na tíži onemocnění a včasnosti a dostatečném dávkování koncentrátů chybějících koagulačních faktorů při léčbě každého krvácení. Opakovaná krvácení do kloubů mají za následek artropatii, která může vyústit až v ankylózu kloubu či nutnost implantace kloubní protézy.
Aktuální možnost prevence
Jedinou současnou možností prevence hemofilie je prenatální diagnostika s následným ukončením gravidity v případě mužského plodu postiženého hemofilií. Toto je možno zvážit zejména u těžké formy hemofilie, případně i u středně těžkých forem. Definitivní rozhodnutí o ukončení gravidity je však vždy rozhodnutím rodičů a není medicínský důvod na něm trvat či jej jednoznačně doporučovat. Oba nastávající rodiče by ale měli být důkladně informováni o všem, co souvisí s péčí o dítě s hemofilií. V začátcích je preimplantační diagnostika hemofilie.
V užším slova smyslu lze pod pojmem prevence chápat prevenci artropatie a život ohrožujícího krvácení pomocí primární či sekundární profylaxe aplikací koncentrátu FVIII/FIX.
Posudková hlediska
Choroba je dědičná a nevyléčitelná, tedy v průběhu života lze očekávat zhoršení postižení – především stavu kloubního aparátu, což většinou bývá hlavní faktor pro přiznání pracovní neschopnosti a invalidního důchodu. Posouzení je přísně individuální. Z odborné stránky je žádoucí přiznání alespoň částečného invalidního důchodu ještě před invalidizací pacienta (a mnohdy i ztrátě soběstačnosti) následkem progrese kloubního poškození, jež lze zpomalit (nikoli zcela zastavit) včasným přizpůsobením pracovní zátěže.
Etická hlediska
Onemocnění není vyléčitelné, je však léčitelné, a cílem by mělo být dosažení co nejlepší kvality života po stránce fyzické i psychosociální, tedy vytvoření takových podmínek, aby pacienti s hemofilií nebyli ve společnosti hendikepováni a mohli žít normální osobní i společenský život.
Personální a technické předpoklady
Péče o nemocné v České republice je vedena v síti center na základě definice požadavků Světové hemofilické federace (WFH) a Evropských doporučení – tzv. center komplexní péče (CCC – Comprehensive Care Centres) a center pro léčbu hemofilie (HTC – Haemophilia Treatment Centres) akreditovaných na principu čtyř kompetencí: kvalifikace, vybavení, sebehodnocení a komunikace. V roce 2011 proběhly audity jednotlivých center. S centry spolupracují pracoviště sdílené péče (spádová hematologická oddělení) dle vzájemné domluvy a potřeb zajištění péče o hemofiliky v daném spádu a v dané době. Pracoviště sdílené péče mají právo sama si vybrat jedno či více HTC/CCC ke spolupráci. Vždy je nutné potvrzení diagnózy a pravidelná dispenzarizace v centru typu CCC/HTC. Genetické vyšetření je pak v kompetenci centra CCC.
Terapii (substituci koncentráty koagulačních faktorů) lze v základní míře poskytovat regionálním/spádovým hematologickým pracovištěm, avšak pod dohledem a dle doporučení center typu CCC/HTC, která tuto léčbu řídí a kde se realizují veškeré operační výkony a veškerá léčba pacientů s inhibitorem a léčba klinicky závažných krvácivých epizod. Centra CCC/HTC jsou odpovědná i za péči poskytovanou regionálními pracovišti, která tuto péči nemohou poskytovat samostatně, ale za metodického vedení pracoviště CCC/HTC.
Požadavky vychází z deklarace ČNHP, kde jsou stratifikovány pro centra typu CCC, HTC a pracoviště sdílené péče [http://cnhp.registry.cz/res/file/cnhp-deklarace.pdf]
Stratifikace center:
- Hemofilici s inhibitorem
- k elektivním chirurgickým (vč. ortopedických) výkonům (CCC)
- k imunotoleranční léčbě – CCC
- k profylaktickému podávání a event. domácí léčbě – CCC
- k akutní péči – CCC/HTC
- k běžné péči – CCC/HTC
- Hemofilici bez inhibitoru – těžcí a středně těžcí
- k elektivním ortopedickým výkonům (vč. synovektomie chirurgické i radiační) – CCC. Radiační synoviortéza může být provedena i v HTC, je-li dostupné patřičné odborné a technické zázemí
- k elektivním chirurgickým výkonům – CCC/HTC
- k akutním výkonům – CCC/HTC
- k profylaktickému podávání – CCC/HTC
- k domácí péči – CCC/HTC
- k běžné péči – CCC/HTC + spádová (regionální) pracoviště
- Hemofilici – lehcí
- dispenzarizováni v CCC/HTC
Nezbytnými podmínkami získání statutu centra jsou:
- Pravidelná účast v cyklech externí kontroly kvality, včetně získání příslušných certifikátu zejména pak v oblasti vyšetřování koagulačních faktorů a jejich inhibitorů.
- Zavedení systému správné laboratorní praxe a systému řízení jakosti (vychází z platné direktivy EU – tzv „Blood directive“ z roku 1998).
- Dostatečné zásoby a adekvátní dostupnost koncentrátů koagulačních faktorů pro léčbu hemofilie a jiných vrozených krvácivých stavů a jejich nepřetržitá dostupnost.
Stratifikace péče v České republice:
- CCC Praha – ÚHKT (dospělí) + FN v Motole (děti) – spádová oblast Praha a střední Čechy, Vysočina; ve vybraných případech Čechy
- CCC FN Brno (Bohunice – dospělí, Dětská nemocnice – děti) – spádová oblast jižní Morava, Zlínský kraj, Vysočina; ve vybraných případech Morava
- HTC FN Olomouc – spádová oblast střední Morava
- HTC FN Ostrava – spádová oblast severní Morava
- HTC FN Hradec Králové – spádová oblast východní Čechy
- HTC Nemocnice Liberec (dospělí) – spád. oblast Liberecký kraj
- HTC Nemocnice Ústí n. L. (děti) – spád. oblast Ústecký kraj
- HTC FN Plzeň – Plzeňský kraj a Karlovarský kraj
- HTC Nemocnice Č. Budějovice – Českobudějovický kraj
Použité pojmy a zkratky
aPCC – aktivovaný koncentrát protrombinového komplexu
aPTT – aktivovaný parciální tromboplastinový čas
ASA – acetylosalicylová kyselina (acetylsalicylic acid)
BU – Bethesda jednotka
CCC – centrum komplexní péče (comprehensive care centre)
CNS – centrální nervový systém
COX-2 – cyklooxygenáza 2
ČNHP – Český národní hemofilický program
DDAVP – 1-deamino-8-D-arginin vasopressin
DL – domácí léčba
FVII:C – koagulační aktivita FVII
FVIII – koagulační faktor VIII
FVIII:C – koagulační aktivita FVIII
FIX – koagulační faktor IX
FIX:C – koagulační aktivita FIX
HIV – virus lidské imunitní nedostatečnosti (human immunodeficiency virus)
HTC – centrum pro léčbu hemofilie (hemophilia treatment centre)
i. m. – intramuskulárně
i. v. – intravenózně
j – jednotka
NSAID – nesteroidní antirevmatika (non-steroidal anti-inflammatory drug)
pd – plazmatický (plasma derived)
p. o. – per os
PSDH – pracovní skupina pro dětskou hematologii
PT – protrombinový čas
PUP2 – dosud neléčení pacienti (Previously untreated patients)
r – rekombinantní
rFVIIa – rekombinantní aktivovaný faktor VII
s. c. – subkutánně
ÚHKT – Ústav hematologie a krevní transfuze
VWF – von Willebrandův faktor
VWF:Ag – von Willebrandův faktor antigen
VWCH – von Willebrandova choroba
VWF:RCo – von Willebrandův faktor ristoceetin kofaktor
Tento článek vznikl za podpory projektu OPVK Vzdělávací síť hemofilických center (CZ.1.07/2.4.00/12.0048)
Doručeno do redakce: 12. 3. 2013
Přijato po recenzi: 17. 4. 2013
Kontaktní adresa – koordinátoři ČNHP
MUDr. Petr Smejkal, Ph.D.
Oddělení klinické hematologie
FN Brno, pracoviště medicíny dospělého věku
Jihlavská 20
625 00 Brno
e-mail: psmejkal@fnbrno.cz
prim. MUDr. Jan Blatný, Ph.D.
Oddělení dětské hematologie
FN Brno, pracoviště dětské medicíny
Černopolní 9
613 00 Brno
jblatny@fnbrno.cz
Zdroje
Annual Global Survey. World Federation of Hemophilia 2010. http://www.wfh.org/en/page.aspx?pid=878
Astermark J, Altisent C, Batorova A, et al. Non-genetic risk factors and the development of inhibitors in haemophilia: a comprehensive review and consensus report. Haemophilia 2010; 16 : 747-766.
Astermark J. Why do inhibitors develop? Principles of and factors influencing the risk for inhibitor development in haemophilia. Haemophilia 2006; 12 (Suppl. 3): 52-60.
Auerswald G, Bidlingmaier C, Kurnik K. Early prophylaxis/FVIII tolerization that avoids immunological ganger signals is still effective in minimizing FVIII inhibitor developments in previously untreated patients – long-term follow-up and continuing experience. Haemophilia 2012; 18: e18-e20.
Australian Haemophilia Centre Directors´Organisation (AHCDO). Guideline for the management of patients with haemophilia undergoing surgical procedures. July 2005. http://www.ahcdo.org.au/sitebuilder/publications/knowledge/asset/files/10/surgeryguidelinesfinalver27.7.06.pdf
Barrowcliffe TW. Monitoring inhibitor patients with the right assays. Semin Hematol 2008; 45 (Suppl. 1): 25-30.
Bátorová A, Jankovičová D, Žarnovičanová M, et al. Národné štandardné postupy pre liečbu hemofilie a iných vrodených koagulopatií v Slovenskej republike. Lek Obz 2008; 56 : 330-340.
Bojar M. Metodický návod o komplexní péči o nemocné s hemofilií a dalšími poruchami hemostázy. Č.j.: PKP/2-2713-1.4. 92 (Věstník MZ ČR č. 3/1992).
Bolton-Maggs PHB. Optimal haemophilia care versus the reality. Br J Haematol 2005; 132 : 671-682.
Colvin BT, Astermark J, Fischer K, et al. European principles of haemophilia care. Haemophilia 2008; 14 : 361-374.
Český národní hemofilický program. http://cnhp.registry.cz
Forbes CD, Aledort L, Madhok R. Hemophilia. London, Chapman & Hall 1997.
Franchini M, Mannucci PM. Co-morbidities and quality of life in elderly persons with haemophilia. Br J Haematol 2009; 148 : 522-33.
Goudemand J, Rothschild C, Demiguel V, et al. Influence of the type of factor VIII concentrate on the incidence of factor VIII inhibitors in previously untreated patients with severe hemophila A. Blood 2006; 107 : 46-51.
Gouw SC, et al. Recombinant versus plasma-derived factor VIII products and the development of inhibitors in previously untreated patients with severe hemophilia A: the CANAL cohort study. Blood 2007; 109 : 4693-97.
Gouw SC, van der Bom JG, van den Berg HM. Treatment-related risk factors of inhibitor development in previously untreated patiens with hemophilia A: the CANAL kohort study. Blood 2007; 109 : 4648-54.
Gringeri A, Mannucci PM. Italian guidelines for the diagnosis and treatment of patiens with haemophilia and inhibitors. Haemophilia 2005; 11 : 611-619.
Guidelines for dental treatment of patients with inherited bleeding disorders. World Federation of Hemophilia 2006. http://www.wfh.org/2/docs/Publications/Dental_Care/TOH-40_Dental_treatment.pdf
Guidelines for the Management of Hemophilia. World Federation of Hemophilia 2005. http://www.wfh.org/2/docs/Publications/Diagnosis_and_Treatment/Gudelines_Mng_Hemophilia.pdf
Hay CRM, Brown S, Collins PW, et al. The diagnosis and management of factor VIII and IX inhibitors: a guideline from the United Kingdom Haemophilia Centre Doctors´ Organisation. Br J Haematol 2006; 133 : 591-605.
Hay CRM, Brown S, Collins PW, et al. The diagnosis and management of factor VIII and IX inhibitors: a guideline from the United Kingdom Haemophilia Centre Doctors´ Organisation. Br J Haematol 2006; 133 : 591-605.
Hay CRM. Prophylaxis in adults with haemophilia. Haemophilia 2007; 13 (Suppl 2): 10-15.
Hemophilia of Georgia, U.S.A. Protocol for the treatment of haemophilia and von Willebrand Disease. Haemophilia 2000; 6 (Suppl 1): 84-93.
Hemophilia of Georgia, U.S.A. Protocol for the treatment of haemophilia and von Willebrand Disease. Haemophilia 2000; 6 (Suppl. 1): 84-93.
Hill FGH, et al. Guidelines on the selection and use of therapeutic products to treat haemophilia and other hereditary bleedings disorders. Haemophilia 2003; 9 : 1-23.
Hoots WK. Emergency care issues in hemophilia. http://www.wfh.org/2/docs/Publications/Diagnosis_and_Treatment/TOH-43-Emergency-Care.pdf
http://cnhp.registry.cz/res/file/cnhp-deklarace.pdf
Kitchen S, Hayward C, Negrier C, Dargaud Y. New developments in laboratory diagnosis and monitoring. Haemophilia 2010; 16 (Suppl. 5): 61-66.
Kubeš R. Hemofilie: Návrh terapeutického postupu u komplikací postihujících pohybový aparát. Zdravotnické noviny 25. 7. 2002.
Kulkarni R, Lusher J. Perinatal management of newborns with haemophilia. Br J Haematol 2001; 112 : 264-274.
Lee CA, Berntorp E, Hoots WK. Textbook of Hemophilia. 2. vyd. Blackwell Publishing 2010.
Mahlangu JN, Gilham A. Guideline for the Treatment of Haemophilia in South Africa. S Afr Med J 2008; 98 : 1296-1311.
Makris M, Baglin T, Dusheiko G, et al. Guidelines on the diagnosis, management and prevention of hepatitis in haemophilia. Haemophilia 2001; 7 : 339-345.
Mannucci PM, Mauser-Bunschoten EP. Cardiovascular disease in haemophilia patients: a contemporary issue. Haemophilia 2010; 16 (Suppl 3): 58-66.
Mannucci PM, Schutgens REG, Santagostino E, Mauser-Bunschoten EP. How I treat age-related morbidities in elderly persons with hemophilia. Blood 2009; 114 : 5256-63.
Morfini M, Auerswald G, Kobelt RA, et al. Prophylactic treatment of haemophilia patients with inhibitors: clinical experience with recombinant factor VIIa in European Haemophilia Centres. Haemophilia 2007; 13 : 502-7.
O´Mahony B. WFH: back to the future. Haemophilia 2004; 10 (Suppl. 4): 1-8.
O´Shaughnessy D, Makris M, Lillicarp D. Practical Hemostasis and Thrombosis. 1. vyd. Blackwell Publishing 2005.
Peerlinck K, Hermans C. Epidemiology of inhibitor formation with recombinant factor VIII replacement therapy. Haemophilia 2006; 12 : 579-590.
Penka M, Blatný J, Matýšková M, et al. Hemofilie z pohledu zajištění péče o nemocné. Vnitř Lék 2009;55 (Suppl 1): 48-54.
Pipe SW, Valentino LA. Optimizing outcomes for patients with severe haemophilia A. Haemophilia 2007; 13 (Suppl 4): 1-16.
Raffini L, Manno C. Modern management of haemophilic arthropathy. Br J Haematol 2007; 136 : 777-787.
Risebrough N, Oh P, Blanchette V. Cost-utility analysis of Canadian tailored prophylaxis, primary prophylaxis and on-demand therapy in young children with severe haemophilia A. Haemophilia 2008; 14 : 743-752.
Rodriguez-Merchan EC, Quintana M, de la Corte-Rodriguez H, Coyas J. Radioactive synoviorthesis for the treatment of haemophilic synovitis. Haemophilia 2007; 13 (Suppl 3): 32-37.
Rodriguez-Merchan EC, Rocino A, Ewenstein B, et al. Consensus perspectives on surgery in haemophilia patients with inhibitors: summary statement. Haemophilia 2004; 10 (Suppl 2): 50-52.
Rodriguez-Merchan EC. Articular bleeding (hemarthrosis) in hemophilia. http://www.wfh.org/2/docs/Publications/Musculoskeletal_Physiotherapy/TOH-23-Hermarthrosis-Revised2008.pdf
Santagostino E, Mannucci PM, Bonomi Bianchi A. Guidelines on replacement therapy for haemophilia and inherited coagulation disorders in Italy. Haemophilia 2000; 6 : 1-10.
Schutgens REG, Tuinenburg A, Roosendal G, et al. Treatment of ischemic heart disease in haemophilia patients: an institutional guideline. Haemophilia 2009; 15 : 952-8.
Sorensen B, Benson GM, Bladen M, et al. Management of Musile haematoma in patiens with severe haemophilia in an evidence-poor world. Haemophila 2012; 18 : 598-606.
White GC, Rozendal F, Aledort L, et al. Definitions in Hemophilia. Tromb Haemost 2001; 85 : 560.
Young G, Auerswald G, Jimenez-Yuste V, et al. When should prophylaxis therapy in inhibitor patients be consider? Haemophilia 2011; 17: e849-e857.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2013 Číslo 2- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Diagnostika a léčba hemofilie
- XXVII. Olomoucké hematologické dny s mezinárodní účastí
- Clinical aspects and pathogenesis of congenital dyserythropoietic anemias: from morphology to molecular approach
- New autoimmune diseases after cord blood transplantation: a retrospective study of EUROCORD and the Autoimmune DiseaseWorking Party of the European Group for Blood and Marrow Transplantation
- Finding the origin of pulmonary emboli with a total-body magnetic resonance direct thrombus imaging technique
- Safety and efficacy of eltrombopag for treatment of chronic immune thrombocytopenia: results of the long-term, open-label EXTEND study
- Extramedullary relapse of acute myeloid leukemia following allogeneic hematopoietic stem cell transplantation: incidence, risk factors and outcomes
- Characteristics and outcome of early-onset, severe forms of Wiskott-Aldrich syndrome
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL)
- Praktický pohled na význam HLA shody pro transplantaci krvetvorných buněk od dospělých nepříbuzných dárců
- Klinické a biologické prognostické faktory u maligních lymfomů
- Separace plné krve a výroba krevních složek gravitací soupravou ErySep® s filtrem z dutých vláken
-
Standardy péče o nemocné s hemofilií
1. revize, vydání 2012
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Praktický pohled na význam HLA shody pro transplantaci krvetvorných buněk od dospělých nepříbuzných dárců
- Separace plné krve a výroba krevních složek gravitací soupravou ErySep® s filtrem z dutých vláken
- Diagnostika a léčba hemofilie
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



