-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Extrakorporální eliminace cholesterolu u familiární hypercholesterolemie – srovnání dvou metodik.
Extracorporeal elimination in familial hypercholesterolemia - comparison of two methods
Introduction:
Familial hypercholesterolemia is a hereditary disorder with autosomal dominant heritance. The underlying cause involves the gene for the LDL-receptor leading to accelerated atherosclerosis. Extracorporeal elimination of cholesterol (CH) is indicated in 3–5% of patients not responding to conservative treatment or in homozygous FH. Two methods are used at our institution: immunoadsorption of LDL - cholesterol and rheohemapheresis.Patients and Methods:
We currently have long term follow-up available for 14 patients with familial hypercholesterolemia (8 males, 6 females) aged 28–70 years (median 57 years). 10 patients are treated with immunoadsorption (5 homozygous and 5 heterozygous) and 4 patients are treated with rheohemapheresis (2 males, 2 females). Median follow-up is 8.5 years. During immunoadsorption, plasma is collected by continuous separation and flows through alternating pairs of adsorbers in an automatic adsorbing-desorbing device. In rheohemapheresis, plasma is collected similarly but goes through a “second step” – filter. Procedures are repeated every 2–4 weeks. Cholesterol and LDL - cholesterol values are measured before and after each procedure.Results:
1922 procedures have been performed (immunoadsorption 1590 times, rheohemapheresis 332 times). Average cholesterol and LDL - cholesterol values before the procedure were 5.34 and 3.12 mmol/l in immunoadsorption, 5.07 and 2.86 in rheohemapharesis; after the procedure: 1.73 and 0.72 (a fall of 72% and 85%), resp. 1.96 and 0.97 mmol/l (a drop of 61% and 66% drop). Fibrinogen fell by 22% (from 3.05 to 2.42 g/l) and 64% (from 3.48 to 1.2g/l). There were 3.1% of adverse reactions and no difference was observed between the two methods.Conclusion:
Treatment of FH is very effective when indicated. There is a significant decrease in all observed parameters. No patient experienced worsening of atherosclerosis. Both methods are safe with minimum adverse reactions. Immunoadsorption is more effective in CH elimination. RHF can be used in patients with hyperfibrinogenemia as an additional risk factor of atherosclerosis. Care of these patients is costly and requires an experienced team and an interdisciplinary approach.Key words:
familial hypercholesterolemia, LDL cholesterol, immunoadsorption, rheohemapheresis
Autoři: M. Lánská; M. Bláha; P. Žák
Působiště autorů: IV. Interní hematologická klinika, Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice Hradec Králové
Vyšlo v časopise: Transfuze Hematol. dnes,20, 2014, No. 3, p. 67-75.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Úvod.
Familiární hypercholesterolemie je autozomálně dominantně dědičná choroba. Podstatou je nejčastěji postižení genu pro LDL-receptor a rozvoj akcelerované aterosklerózy. U 3-5 % heterozygotních pacientů nereagujících na konzervativní terapii a u homozygotních pacientů je indikována extrakorporální eliminace LDL cholesterolu. Na našem pracovišti se používají dvě metody: imunoadsorpce LDL cholesterolu a rheohemaferéza. Jejich srovnání je předmětem tohoto sdělení.Soubor a metody.
Dlouhodobě je sledováno 14 pacientů s familiární hypercholesterolémií (8 mužů a 6 žen) ve věku 28-70 let (medián 57 let). 10 pacientů je léčeno imunoadsorpcí (5 homozygotů a 5 heterozygotů) a 4 pacienti rheohemaferézou (2 muži, 2 ženy). Medián sledování je 8.5 roku. Při imunoadsorpci se plazma získává kontinuálním separátorem a pak protéká střídavě párem adsorberů uložených v automatickém adsorpčně-desorpčním zařízení. U rheohemaferézy je plazma, získaná stejným postupem, proháněna “druhým stupněm” – filtrem. Frekvence výkonů je 2-4 týdny. Hodnoty cholesterolu a LDL cholesterolu jsou sledovány před a po každém výkonu.Výsledky.
Celkem bylo provedeno 1922 výkonů (imunoadsorpce 1590 výkonů, rheohemaferéza 332 výkonů). Průměrná hodnota cholesterolu a LDL cholesterolu byla před výkonem 5,34 a 3,12 mmol/l u imunoadsorpce, u rheohemaferézy 5,07 a 2,86; po výkonu 1,73 a 0,72 (pokles o 72 a 85 %), resp. 1,96 a 0,97 mmol/l (pokles o 61 a 66 %). Fibrinogen poklesl o 22 % (z 3,05 na 2,42 g/l) a o 64 % (z 3,48 na 1,2 g/l ). Nežádoucích reakcí bylo 3,1 %, nebyl rozdíl mezi metodami.Závěr.
Léčba familiární hypercholesterolemie je u indikovaných pacientů velmi účinná, dochází k statisticky významnému snížení požadovaných parametrů. U pacientů nedošlo ve sledovaném období k progresi ICHS. Obě metody jsou bezpečné s minimem nežádoucích účinků. Pro eliminaci cholesterolu je imunoadsorpce efektivnější, rheohemaferéza se s výhodou využívá u nemocných s hyperfibrinogenémií jako dalším rizikovým faktorem aterosklerózy. Péče o tyto nemocné je nákladná, vyžaduje vyškolený tým a mezioborovou spolupráci.Klíčová slova:
familiární hypercholesterolemie, LDL cholesterol, imunoadsorpce, rheohemaferézaÚvod
Kardiovaskulární choroby jsou vedoucí příčinou morbidity a mortality. Hypercholesterolemie (především zvýšená hladina LDL-cholesterolu) je významným rizikovým faktorem pro ischemickou chorobu srdeční (1). Individuální hladinu cholesterolu (CH) lze ovlivnit faktory jako je dieta, životní styl (fyzická aktivita), ale důležité jsou genetické faktory. Familiární hypercholesterolemie (FH) je nejčastější metabolická autozomálně dědičná genetická porucha (2), podstatou je v 85–90 % mutace genu pro LDL-receptor (3), kterých již bylo popsáno více než 1600 (4). Dalších 5–10 % tvoří pacienti s mutací genu pro apolipoprotein B, a/nebo PCSK9 (proprotein convertase subtilisin kexin type 9) – což je enzym odpovědný za degradaci LDL receptoru (5). Vzácná je mutace genu LDLRAP1 (low density lipoprotein receptor adaptor protein 1), jehož dosud známých 10 mutací vede k vzniku autozomální recesivně dědičné hypercholesterolemie. Při mutaci genu LDLRAP1 se sice LDL-cholesterol naváže na LDL receptory na povrchu jaterních buněk, ale není transportován do buněk (5). Konečně existuje velmi vzácná sitosterolemie (phytosterolemie), která je rovněž (jako mutace LDLRAP1) autozomálně recesivně dědičná – dvě dosud známé mutace vedou k nadměrnému vstřebávání rostlinných sterolů (6). Pravděpodobně existují další, dosud nepopsané genetické poruchy, které ještě budou zahrnuty do rodiny poruch vedoucích k hypercholesterolemii, protože jsou pacienti s hypercholesterolemií, kde se nezjistí dosud známá mutace a nejde o sekundární hypercholesterolemii (hypotyreóza, nefrotický syndrom, jaterní choroby) (5). FH velmi výrazně zvyšuje riziko předčasné aterosklerózy – až 20krát (7), zejména ischemické choroby srdeční – již ve čtvrtém deceniu života u mužů a u žen o 10 – 15 let později (1). Pokud jde o klinická diagnostická kritéria, je FH dle Harada-Shiba et al. (8) klasicky charakterizována: zvýšenou hladinou LDL cholesterolu, kožními a šlachovými xantomy (zejména nad extenzory) a výskytem předčasné morbidity a mortality na komplikace aterosklerózy v rodinné anamnéze (9).
Existují dvě klinické formy FH – toto rozdělení je významné pro terapeutickou praxi. U heterozygotní formy, jejíž výskyt v populaci je 1 : 500 osob, jde o mutaci jedné alely defektního genu (zděděna od jednoho z rodičů). Hladiny cholesterolu jsou zvýšeny typicky na dvoj - až trojnásobek (cca 8–15 mmol/l) (9). Druhá forma je homozygotní forma, která je vzácná, vyskytuje se přibližně u 1 : 1 000 000 osob; zde je defektní gen v obou alelách (zděděn od obou rodičů). Hodnoty cholesterolu jsou extrémně vysoké – troj - až šestinásobek normy (12–30 mmol/l), symptomy ischemické choroby srdeční lze nalézt již v raném dětství a úmrtí byla popsána u neléčených případů i před 20. rokem věku (2). Při těžkých případech homozygotní FH byly popsány tukové proužky (fatty-streaks) již ve fetální aortě (10). Ojediněle jsou popsány případy úmrtí 4letého dítěte s homozygotní FH na infarkt myokardu (11), anebo případ 13letého dítěte s homozygotní FH, kde bylo nutno pro ischemickou chorobu srdeční provést trojnásobný bypass (12).
Základem terapie FH je totální změna životního stylu, striktní dieta a k dosažení cílových hodnot LDL-cholesterolu jsou nutné obvykle maximálně tolerovatelné dávky hypolipidemik. FH je takto relativně dobře léčitelná choroba, ale u 3–5 % heterozygotních pacientů (p.) nereagujících na výše uvedenou terapii (nebo když netolerují hypolipidemika) a téměř u všech homozygotních p. s FH je indikována extrakorporální eliminace (EE) LDL cholesterolu (13). ASFA (American Society for Apheresis) vydává doporučení (guidelines) pro jednotlivé výkony u různých onemocnění. Dle nejnovějších kritérií z roku 2013 (14) je LDL aferéza jednoznačně indikována u homozygotů FH (kategorie I, st. IA, což je nejstriktnější indikace, metoda první volby), ale i u vybraných, jinak obtížně léčitelných heterozygotů (kategorie II, st. IA). I přes léčbu extrakorporální eliminací se nadále pokračuje v medikamentózní hypolipidemické terapii.
Terminologická poznámka: pojem LDL-aferéza byl původně zaveden a používán autory Stoffel et al. (15) pro imunoadsorpční metodu EE. V té době šlo o jedinou selektivní metodu odstranění LDL-cholesterolu. Kromě LDL-aferézy byla známá jen plazmaferéza, která je neselektivní. V současné době se obvykle pojem „LDL-aferéza“ nebo „lipoprotein apheresis“ (případně „lipidapheresis“) používá pro všechny metodiky EE cholesterolu.
Obecně se považuje za efektivních 6 metod EE cholesterolu: nejstarší je plazmaferéza, ale je neselektivní. Proto se preferují selektivnější metody, kdy je odstraněno 60 % a více LDL-cholesterolu (16). Současné metody využívají tří fyzikálně-chemických principů: filtrace, precipitace nebo adsorpce. Jsou to: imunoadsorpce, dvojitá filtrace plazmy (double plasma filtration), dextransulfátová eliminace buď z plazmy, nebo plné krve, DALI (direct apheresis of lipoproteins – eliminace z plné krve) a HELP (heparin induced LDL precipitation) (2, 9, 16).
Na našem pracovišti se dlouhodobě zabýváme extrakorporálními eliminačními metodami. Pokud jde o eliminaci LDL-cholesterolu, vybrali jsme po seznámení se všemi výše uvedenými metodami k dlouhodobé terapii dvě metody: vlastní modifikaci klasické Stofellovy a Borbergovy LDL-aferézy – imunoadsorpci a jako druhou metodu filtraci plazmy (jde o modifikaci dvojité filtrace plazmy, kdy se k oddělení plazmy nepoužívá filtr, ale centrifugační separátor), a protože jde o pacienty se zvýšeným fibrinogenem, používáme filtry, které vychytávají některé proteiny o velké molekulové hmotnosti a mění reologické vlastnosti krve (viz níže). Jde tedy také o formu lékařské reoterapie (17). Proto pro tuto metodu používáme pojem „reohemaferéza“, zavedený autory z Deutsches Hämapheresis Zentrum v Kolíně nad Rýnem (18). Tyto metody byly vybrány z důvodů vysoké klinické efektivity i relativně přijatelné ekonomiky. Cílem tohoto sdělení bylo vyhodnotit léčbu FH na našem pracovišti a srovnat uvedené 2 metody EE cholesterolu.
Foto 1 Přístrojové vybavení při LDL-aferéze. 
Pacienti a metody
EE cholesterolu používáme na našem pracovišti od r. 1994 – zprvu plazmaferézu, od r. 1996 LDL–aferézu. Homozygotní pacienti se soustřeďují do našeho centra z České republiky. Dlouhodobě sledujeme 14 pacientů s FH (8 mužů, 6 žen) ve věku 28–70 let (věkový průměr 52,5 roku, medián 57 let, rozmezí 28–70 let). Jedná se o 5 homozygotů FH, kde je věkový průměr nižší – 35 let (rozmezí 28–59 let) a 9 heterozygotů FH s věkovým průměrem 59 let (rozmezí 48–70 let). Medián sledování p. je 8,5 roku (rozmezí 1–17 let). Charakteristiky pacientů jsou uvedeny v tabulce 1. 10 pacientů se léčí imunoadsorpcí (5 homozygotů a 5 heterozygotů, pacienti číslo 1–10) a 4 pacienti reohemaferézou (2 muži, 2 ženy, všichni heterozygoti, pacienti číslo 11–14).
Tab. 1. Popisné údaje o pacientech. 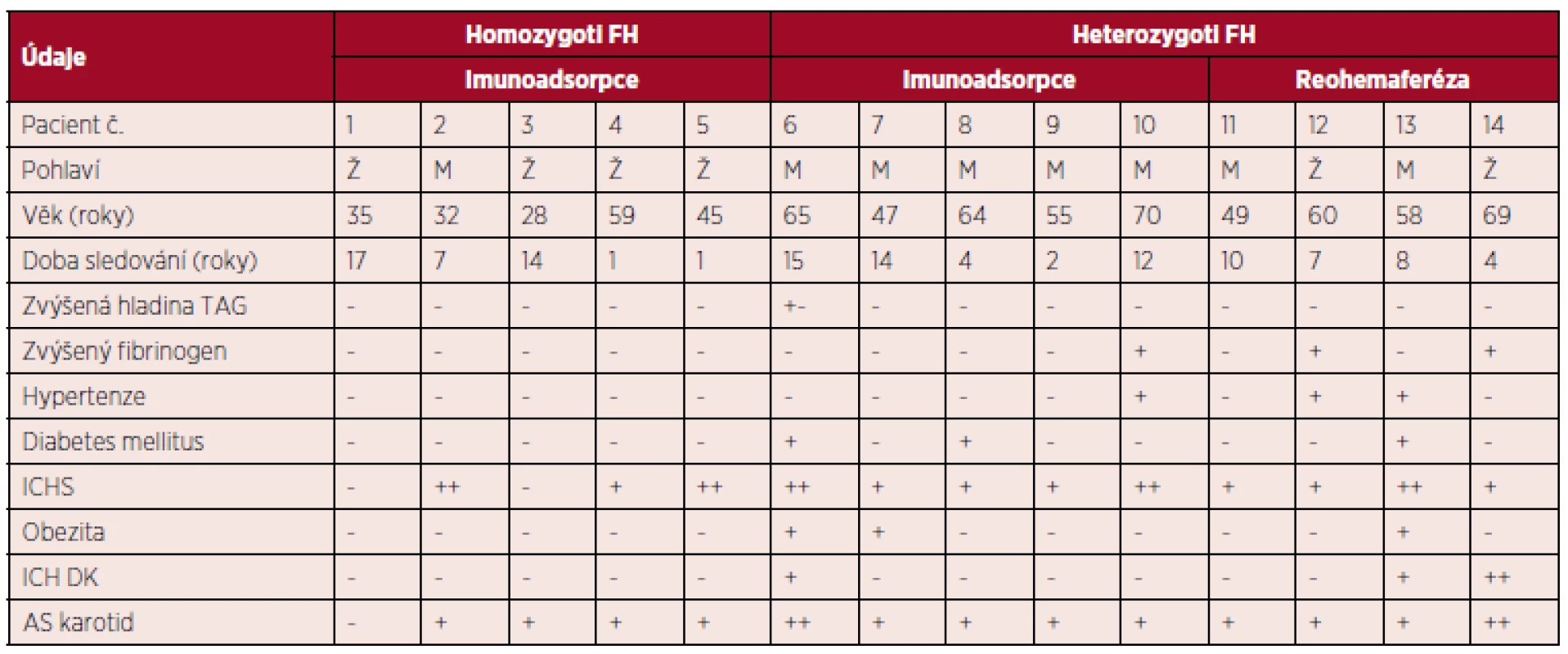
Legenda: Ž – žena, M – muž, ICHS – ischemická choroba srdeční, ICH DK - ischemická choroba dolních končetin, AS – ateroskleróza, TAG – triglyceridy. Princip imunoadsorpce: Při imunoadsorpci (IA) se plazma získává kontinuálním separátorem (Cobe Spectra nebo Spectra Optia, Terumo BCT, USA) a pak protéká střídavě párem adsorberů uložených v automatickém adsorpčně-desorpčním zařízení (Adasorb, Medicap, Německo). Jako adsorbery používáme kolony Lipopak (Pocard, Rusko) určené k opakovanému užití, s navázanou ovčí protilátkou proti Apo B. Jednou kolonou protéká plazma, ve druhé koloně probíhá regenerace s vymýváním adsorbovaného cholesterolu. Průtok plazmy je kontinuální, množství promyté plazmy se řídí hladinou LDL cholesterolu. Pro výpočet množství plazmy, které protéká kolonou je vytvořen matematický model (19). Jde o speciální počítačový program, který vypočte optimální množství plazmy k saturaci adsorpční kolony při dané hladině LDL-cholesterolu. Antikoagulaci provádíme v kombinaci heparinu (bolus i.v. v úvodu, následně kontinuální infuze) a ACD-A. Schematicky je princip znázorněn na obrázku 1.
Obr. 1. Schéma LDL imunoadsorpce. 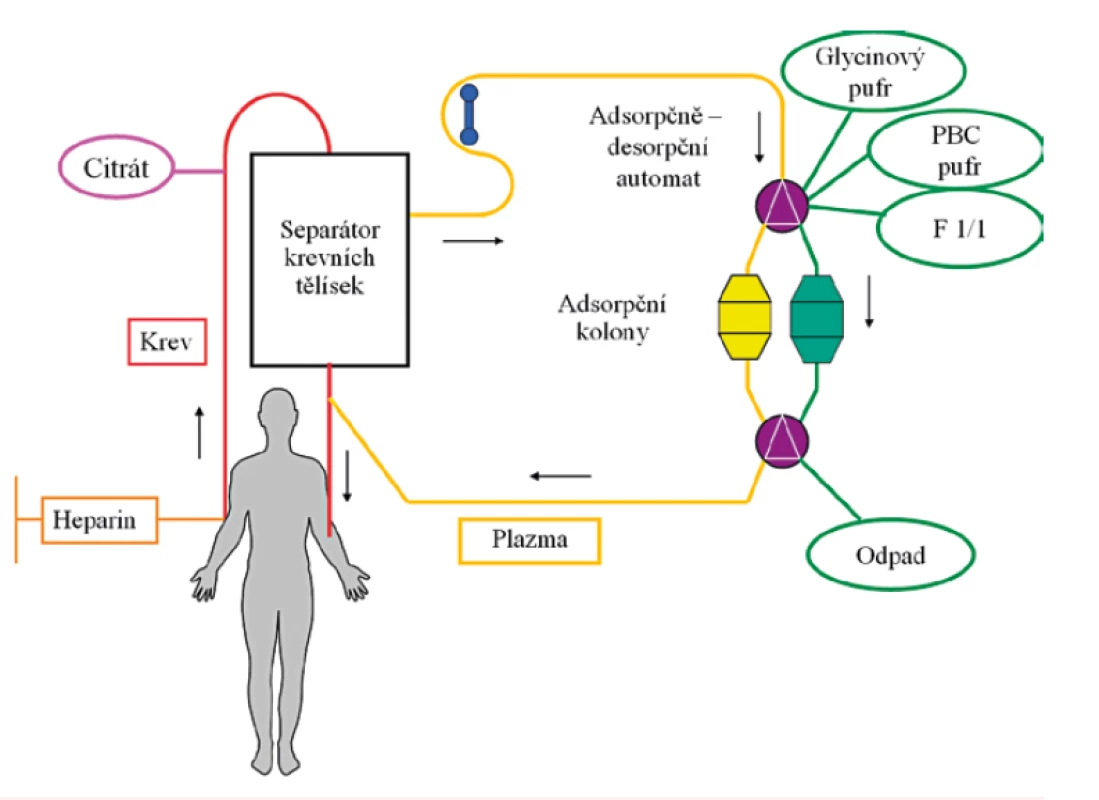
Legenda: Krev se odebírá z periferní žíly a je vedena k separátoru krevních buněk. Odseparovaná plazma se čerpá do adsorberu (znázorněno žlutou barvou). Očištěná plazma potom odtéká spolu s erytrocyty zpět k pacientovi a vrací se mu jinou periferní žílou. Adsorbery pracují v páru: po naplnění jednoho adsorberu, přepne automat na druhý a zaplněný adsorber se vymyje promývacími roztoky (NaCl, glycin, PBS) – je znázorněno zeleně – a promytý adsorber je připraven k dalšímu cyklu. Princip reohemaferézy (RHF): U RHF je plazma, získaná stejným postupem jako u IA, proháněna “druhým stupněm” – filtrem. Používáme filtry Evaflux 4A (Kuraray, Osaka, Japonsko). Jde o simultánní odstranění LDL-cholesterolu, ale i spektra některých dalších vysokomolekulárních bílkovin, které jsou reologicky účinné (např. α2-makroglobulin, fibrinogen, Lp(a), von Willebrandův faktor, IgM, fibronectin a multimerický vitronectin). Průtok plazmy je kontinuální, množství zpracované plazmy je 1,5 tělesného objemu plazmy (vypočteno separátorem). Antikoagulace je prováděná kombinací heparinu (bolus i.v. v úvodu) a ACD-A. Schematicky je princip znázorněn na obrázku 2.
Obr. 2. Schéma naší modifikace reohemaferézy. 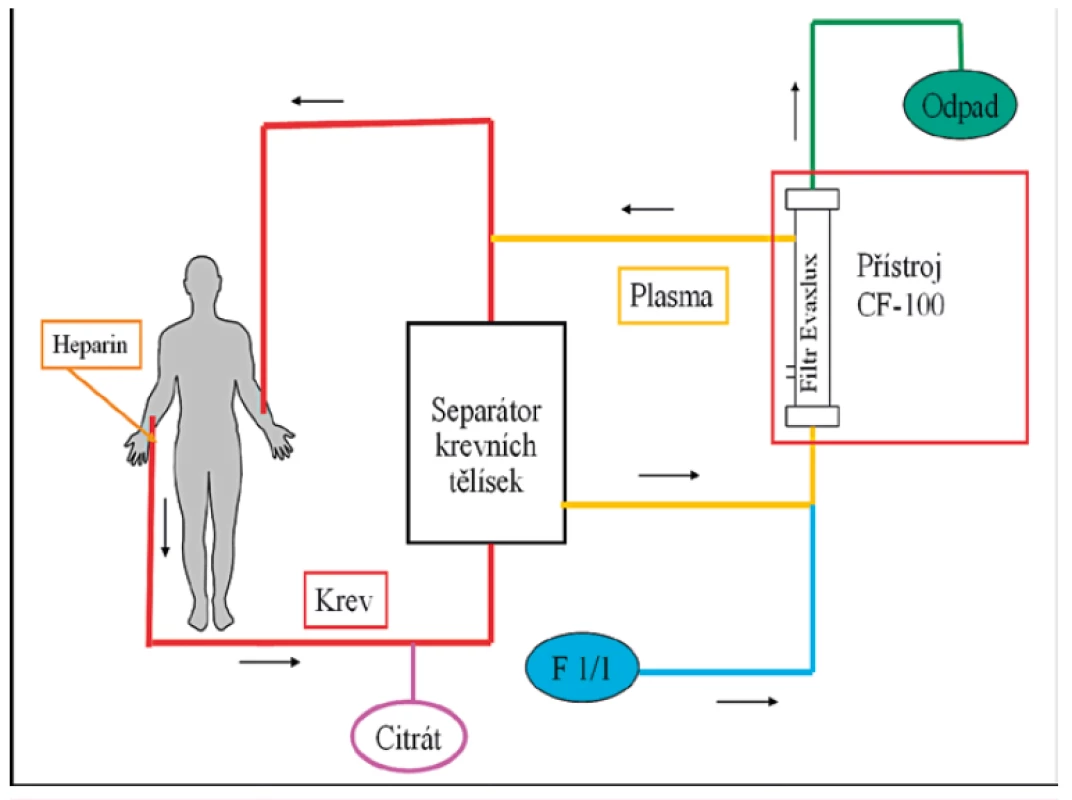
Legenda: Plazma se oddělí od krevních buněk pomocí separátoru Cobe-Spectra a dále čerpá do linek přístroje CF 100 (Infomed, Geneve, Switzerland), který řídí průtok plazmy přes filtr Evaflux (Kuraray, Osaka, Japan). Po průchodu filtrem se plazma odvádí spolu s krevními buňkami zpět do oběhu nemocného. Při vzestupu tlaku v kapilárách filtru přístroj automaticky propláchne kapiláry filtru fyziologickým roztokem, který se spolu s odfiltrovanými částicemi odvede do odpadního vaku. Všechny výkony (IA i RHF) byly prováděny ambulantně s použitím periferního žilního vstupu, u jedné nemocné přes A-V fistuli. Výkon trvá 4–6 hodin podle množství promyté plazmy a rychlosti průtoku krve (což je dáno především stavem odběrové periferní žíly). Frekvence výkonů: u IA 1x za 2–4 týdny; častost výkonu záležela na hodnotách cholesterolu a také tíži postižení pacienta. U nemocných homozygotů FH byla proto frekvence IA 1x za 2–3 týdny, u heterozygotů 1x za 3–4 týdny; při RHF šlo vždy o heterozygoty – frekvence výkonů byla 1x za 4 týdny.
U všech nemocných byla prováděna pravidelná laboratorní sledování – základní biochemické a hematologické vyšetření (krevní obraz, kompletní biochemie, základní koagulační vyšetření, fibrinogen) a jako marker progrese aterosklerózy kontrola vrstvy intima-media na karotidách po 6 měsících. Další laboratorní vyšetření byla prováděna výzkumně. Rutinně jsme kontrolovali hladiny lipoproteinů (cholesterol celkový, LDL-cholesterol, HDL-cholesterol a triacylglyceridy).
Výsledky
Od 14. 4. 1996, kdy jsme zahájili léčbu extrakorporální eliminací cholesterolu u první pacientky, bylo provedeno celkem 1922 výkonů, z toho 1590 LDL imunoadsorpcí a 332 reohemaferéz. Cholesterol i jeho frakce, vyšetřené před a po každém výkonu, dále 2krát ročně komplexnější vyšetření (viz výše) i UZ karotid jako marker progrese aterosklerózy – vše toto neprokázalo klinicky významné změny parametrů. Podrobné laboratorní sledování (paleta výzkumných testů) před a po výkonu (2krát ročně) bude předmětem jiného sdělení a bylo provedeno u 160 LDL imunoadsorpcí a 147 reohemaferéz.
Foto 2 Přístrojové vybavení při reoferéze. 
Průměrná hodnota CH a LDL-CH byla před výkonem 5,34 a 3,12 mmol/l u IA, u RHF 5,07 a 2,86; po výkonu 1,73 a 0,72 (pokles o 72 a 85 %), resp. 1,96 a 0,97 mmol/l (pokles o 61 a 66 %). Výsledky jsou přehledně zobrazeny v tabulce 2. Fibrinogen poklesl o 22 % u IA (z 3,05 na 2,42 g/l) a o 64 % u RHF (z 3,48 na 1,2 g/l). Tento rozdíl u RHF je očekávaný, léčebně příznivý, je daný filtrační metodikou. Podrobnější zhodnocení jednotlivých pacientů s jejich průměrnými hodnotami cholesterolu je v tabulce 3.
Tab. 2. Výsledky léčby. 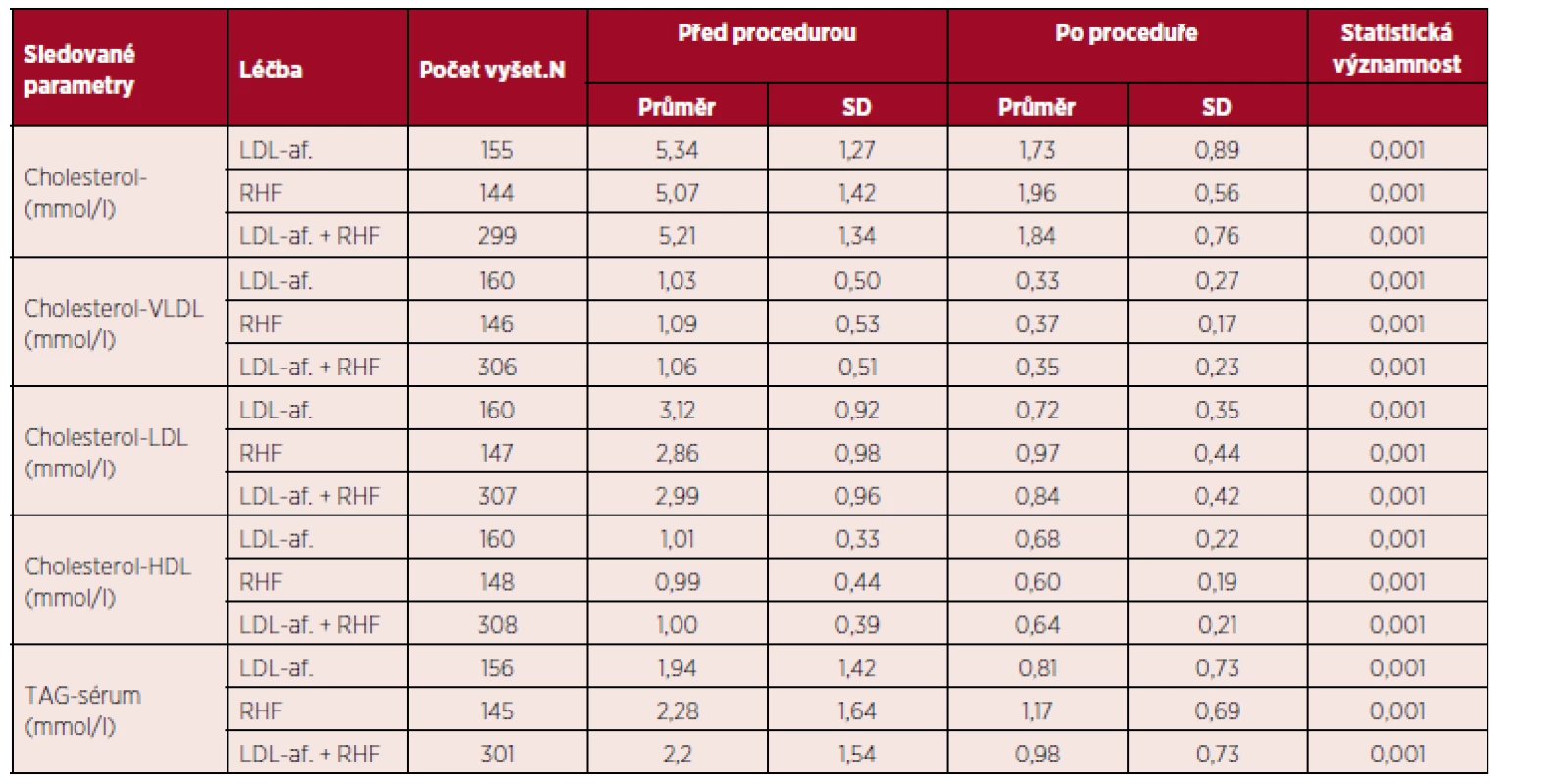
Legenda: LDL-af. – LDL aferéza; RHF – reohemaferéza Normální rozmezí: cholesterol 0 –5,18 mmol/l, LDL cholesterol 1,5 –3,34 mmol/l, HDL cholesterol 0,9 –3 mmol/l, TAG 0 – 2,26 mmol/l Tab. 3. Výsledky u jednotlivých pacientů. 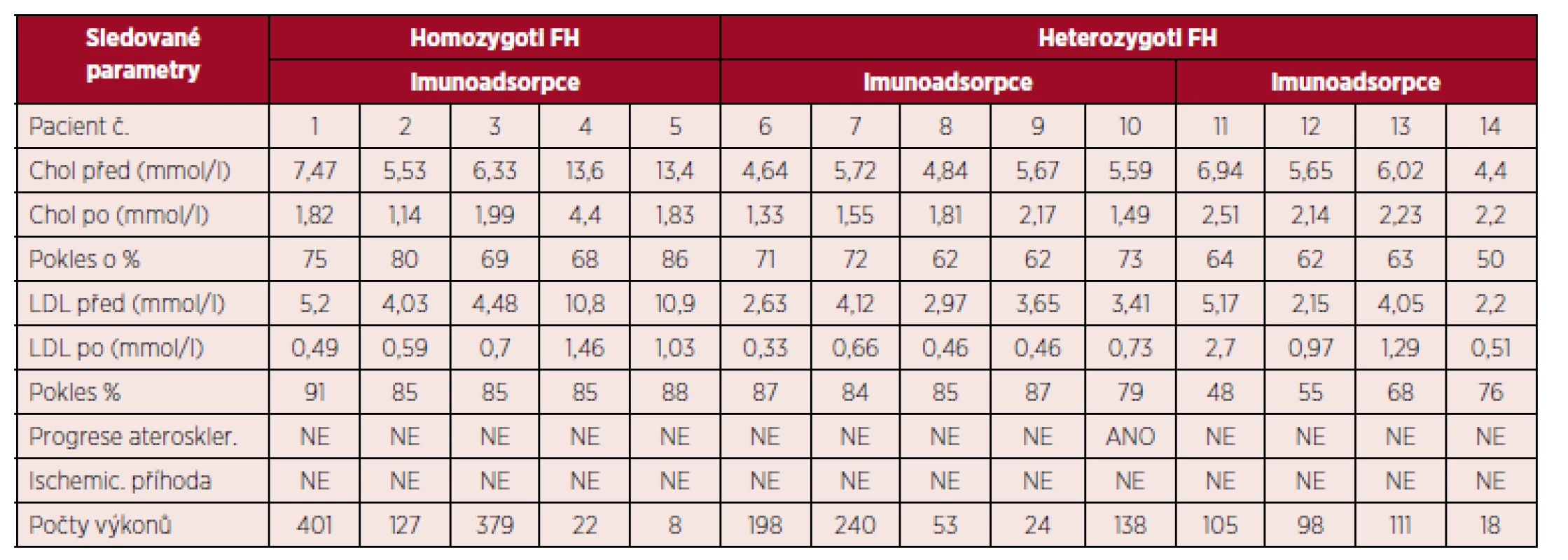
Legenda: Chol před – cholesterol před procedurou; Chol po – cholesterol po proceduře Nežádoucích reakcí bylo 3,1 %, nebyl rozdíl mezi IA a RHF. Nebyly klinicky závažné, většinou se jednalo o toxicitu ACD-A (mírné klinické příznaky hypokalcemie). Po infuzi s kalciem (Calcium gluconicum 10%, Braun) došlo k vymizení potíží. Infuze s kalciem u našich pacientů nepodáváme standardně při každém výkonu, pečlivě monitorujeme výskyt příznaků hypokalcemie a včas zahajujeme kontinuální infuzi. Dále monitorujeme hladinu hemoglobinu, střední objem erytrocytu a event. vyšetření ferritinu a metabolismu železa k včasnému odhalení mikrocytové anémie, preparáty železa nepodáváme preventivně. Z dalších nežádoucích účinků jsme se setkali s nutností předčasného ukončení výkonu z důvodu deficitu periferních žil, u jednoho pacienta jsme pozorovali hypotenzi s bradykardií s nutností předčasného ukončení výkonu – tato komplikace byla v souvislosti s nově nasazenou léčbou ACE-inhibitory, kdy nemocný neuvedl změnu léků při zahájení aferézy. Nežádoucí reakce jsou pravidelně hlášeny do registru WAA (World Apheresis Assotiation).
U nemocných jsme sledovali progresi aterosklerózy a vznik ischemické příhody. U nemocných s homozygotní FH byly před zahájením léčby přítomny xantomy, které do 1 roka od zahájení léčby vymizely. U jednoho nemocného došlo k progresi AS na tepnách dolních končetin, podstoupil angioplastiku tepen. Ve sledovaném období nedošlo ke vzniku nové koronární příhody ani k úmrtí žádného pacienta. Jedna nemocná v průběhu léčby otěhotněla, byla vysazena medikace statiny, zintenzívněna IA na 1 výkon po 10 dnech. Porod proběhl normální cestou bez komplikací, u nemocné nedošlo k progresi aterosklerózy.
Diskuse
Snaha o selektivní odnětí patogenních substancí z plazmy pomocí hemaferézy je progresivní směr v oboru terapeutických hemaferéz. Je potěšitelné, že česká specializovaná hematologická a transfuzní pracoviště jsou schopna provádět veškeré dosud známé hemaferetické procedury. Pokud jde o odstraňování (aferézy) lipoproteinů, jsou to opakované procedury, které jsou medicínsky, technicky i ekonomicky náročné. Jde o typicky týmovou práci, ve spolupráci se specialisty v oboru metabolických poruch, neurology, nefrology, pediatry a dalšími specialisty.
Léčba FH extrakorporální eliminací cholesterolu je známá již řadu let. Úspěšné použití plazmaferézy v léčbě FH bylo poprvé popsáno Thompsonem et al. v roce 1975 (20). Již v roce 1980 byla tato léčba zahájena v Československu (21). V roce 1985 popsal opět Thompson et al. v další práci pregnantní úspěch plazmaferézy u pěti dvojic sourozenců s homozygotní FH, z nichž vždy jeden byl léčen plazmaferézou (22). Byli sledováni 8,4 roku, kdy všichni neléčení nemocní zemřeli, avšak 4 z 5 léčených nemocných přežili. Budoucnost však patřila specifičtějším metodám. V Československu byla poprvé použita imunoadsorpční LDL-aferéza r. 1996 (23). Pozornost v celém světě byla věnována samozřejmě především nejtěžší formě FH – homozygotním nemocným. Pro to svědčí i počet prací věnovaných tomuto tématu – podle PubMed bylo za posledních 10 let do roku 2013 publikováno 47 článků a léčeno 243 pacientů s homozygotní FH (24). Úspěch LDL-aferézy u homozygotů se pokládá za nesporný, podle znalců dokonce není třeba dalších studií v tomto směru (24). Pokud jde o heterozygotní formy rezistentní FH, jsou v současné době také v centru pozornosti. V PubMed bylo problematice heterozygotů FH věnováno za léta 2003–2013 20 prací o léčbě 213 případů (24). Pokládá se za prokázané, že u heterozygotní FH s postižením koronárních tepen je LDL-aferéza jednoznačně prospěšná (2, 8, 16, 25); dosud provedené studie svědčí, že u heterozygotů při progredující ateromatóze bez postižení koronárních tepen je nejspíše také vhodná, ale je nutno ještě některé detaily dořešit (24). Z hlediska medicíny založené na důkazech (evidence based medicine) je do budoucna obtíž v tom, že obvyklá klasická prospektivní randomizovaná studie je z etických důvodů již nevhodná (24).
Naše výsledky prokázaly signifikantní snížení hodnot cholesterolu a LDL cholesterolu u nemocných léčených aferézou. Nežádoucí účinky dlouhodobé terapie jsou minimální (včetně příhod při procedurách) – 3 % nezávažných příhod. Léčba byla účinná. U našich pacientů, kde byla dříve progrese aterosklerózy, nedošlo od zahájení terapie kromě jednoho k progresi aterosklerózy.
V literatuře se diskutuje vhodnost a účinnost jednotlivých typů procedur k odstranění LDL-cholesterolu (26–29). Pro pacienta i pro pracoviště je důležité, aby byly z výše uvedených 6 možností zvoleny procedury, které jsou co nejvíc účinné, ale ještě technicky a ekonomicky přijatelné. Z těchto důvodů jsme zvolili především LDL-aferézu (metodou imunoadsorpce). Ve srovnání s ostatními šesti ve světě uznávanými procedurami (30) se ukázala jako velmi účinná – podle našich výsledků klesá po proceduře hladina LDL-cholesterolu o 85 %. I když odečteme efekt diluce po proceduře, což je cca 5 %, jde o skvělý výsledek. Podle literatury se považuje za úspěšnou metodu ta, kde se odstraní jednou procedurou 60 % a více LDL-cholesterolu (26). Je velmi výhodné, že po IA klesá i lipoprotein(a) – při našich 54 vyšetřeních lipoproteinu(a) párových vzorků před a po IA klesal lipoprotein(a) v průměru o 75 procent (vyšetření provedená u našich pacientů r. 2011–2013, dosud nepublikováno).
Reohemaferézu (naši modifikaci „double plasma filtration“) jsme zvolili pro pacienty, kteří mají zároveň s hyperlipoproteinemií vyšší hodnoty fibrinogenu. Výsledná docílená průměrná hodnota snížení fibrinogenu o 64 % prokazuje efektivitu metodiky. RHF umožňuje kromě snížení hladiny LDL cholesterolu ještě aditivní efekt (využít ji k reoterapii) – v jiných indikacích. Máme dobrou zkušenost s léčbou v případech akutní ztráty sluchu nebo věkem podmíněné makulární degenerace (31,32); tuto možnost oceňují i jiní autoři (30). Pro velká pracoviště by bylo vhodné provádět ještě další z výše uvedených účinných procedur – umožňuje to lehčí přechod od jedné k druhé metodice při malé efektivitě u individuálního pacienta; jsou pacienti, kde je daná metoda málo účinná a neví se přesně proč (i když se vyloučí obvyklé kolísání výtěžku při insuficienci přívodního periferního žilního řečiště) (30). To můžeme potvrdit z vlastní zkušenosti, stejně jako existenci prosté nesnášenlivosti některé metody – pacient může např. žádat metodu s kratším trváním, mohou být kontraindikace podání heparinu a další.
Je reálné, že vbrzku budou daleko lepší možnosti léčby pro nemocné s FH. Objevila se nová, velmi účinná hypolipidemika, která působí jiným mechanismem nežli statiny a je možno je kombinovat navzájem i s LDL-aferézou. Bylo by tak možné dosáhnout cílové hodnoty LDL cholesterolu podle posledního konsensu European Atherosclerosis Society, tj. u pacientů s FH 2,5 mmol/l a u pacientů s FH a projevy ICHS a/nebo diabetem 1,8 mmol/l (14). Je možné, že nová hypolipidemika (mipomersen, lomitapid – obojí mohou snížit hladinu LDL cholesterolu o 50 %) povedou k podstatnému snížení potřeby LDL-aferéz (7). Stále se vyvíjejí i metody genetického inženýrství, kde se jeví reálné připravit po parciální hepatektomii směs hepatocytů, v kterých by se upravily chybné informace (kvalita a kvantita LDL receptorů), možná pomocí nosičů – malých virů, pronikajících tkáňové fenestrace. Na zvířatech byly docíleny slibné výsledky (33).
Závěr
Léčba familiární extrakorporální eliminací cholesterolu je u indikovaných pacientů velmi účinná. U sledovaného souboru došlo k statisticky významnému poklesu požadovaných parametrů, i když cílových hodnot LDL cholesterolu podle posledních požadavků vědy (2) nebylo dosaženo. K progresi aterosklerózy došlo u jednoho pacienta (AS tepen na dolních končetinách), u nikoho nedošlo k rozvoji infarktu myokardu, cévní mozkové příhody, ani k úmrtí pacienta. Obě sledované metody jsou bezpečné – s minimem nežádoucích účinků. Pro eliminaci cholesterolu je LDL imunoadsorpce efektivnější, RHF se s výhodou využívá u nemocných s hyperfibrinogenemií jako dalším rizikovým faktorem aterosklerózy. Péče o tyto nemocné je nákladná, vyžaduje vyškolený tým a mezioborovou spolupráci. U homozygotní formy FH se dosud jednalo o celoživotní terapii, což může být změněno k lepšímu vývojem nových léků zmíněných výše.
Poděkování
Práce byla podporována výzkumnými úkoly Prvouk P37/4,12; IGA NT/12287-5, NT/14265-3, NT/14037-3, NT /13475-4.
Podíl autorů na rukopisu
ML: příprava studie, léčba nemocných, sepsání rukopisu
MB: příprava studie, léčba nemocných, sepsání rukopisu
PZ: revize rukopisu
MUDr. Miriam Lánská
IV. interní hematologická klinika
Fakultní nemocnice Hradec Králové
e-mail: miriam.lanska@fnhk.cz
Doručeno do redakce: 11. 6. 2014
Zdroje
1. Ito MK, McGovan MP, Moriarty, PM. Management of familial hypercholesterolemias in adult patients. Recommendation from National Lipid Association Expert panel on familial hypercholesterolemia. J Clin Lipidol 2011; 5 : 538-545.
2. Nordestgaard BG, Chapman MJ, Humphries SE, et al. Familial hypercholesterolemia is underdiagnosed and untreated in the general population: guidance for clinicians to prevent coronary heart disease. Consensus statement of the European Atherosclerosis Society. Eur Heart J 2013; 34(45): 3478-90.
3. Donato LJ, Seanger AK, Train JL, et al. Genetic and biochemical analysis in dyslipidemic patients undergoing LDL apheresis. J Clin Apher; publikováno elektronicky 2014 Jan 13. doi: 10.1002/jca.21317.
4. Hopkins PN, Toth PP, Ballantyne CM, Rader DJ. Familial hypercholesterolemias: prevalence, genetics, diagnosis and screening recommendations from the National Lipid Association Expert Panel on familial hypercholesterolemia.lin Lipidol 2011 Jun; 5(3 Suppl): 9-17.
5. Goldberg AC, Hopkins PN, Toth PP, et al. Familial hypercholesterolemia: screening, diagnosis and management of pediatric and adults patients. J Clin Lipidol 2011; 5 : 1-8.
6. Berge KE, Tian H, Graf GA, et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters. Science 2010; 290 (5497): 1771–5.
7. Sniderman AD, Tsimikas S, Fazio S. The severe hypercholesterolemia phenotype. J Am Coll Cardiol 2014; 63(19): 1935-1947.
8. Shib MH, Arai H., Oikawa S, Ohta T, Okada T, Okamura T, et al. Guidelines for the managment of familial hypercholesterolemia. J Atheroscler Thromb, 2012; 19 : 1043-1060
9. Vishwanath R, Hemphill LC. Familial hypercholesterolemia and estimation of US patients eligible for low-density lipoprotein apheresis after maximally tolerated lipid-lowering therapy. J Clin Lipidol 2014; 8 : 18-28.
10. Versmissen J1, Botden IP, Huijgen R, et al. Maternal inheritance of familial hypercholesterolemia caused by the V408M low-density lipoprotein receptor mutation increases mortality. Atherosclerosis 2011 Dec; 219(2): 690-3. doi: 10.1016/j.atherosclerosis.2011.08.039.
11. Widhalm K, Binder CB, Kreissl A, et al. Sudden death in a 4-year-old boy: a near-complete occlusion of the coronary artery caused by an aggressive low-density lipoprotein receptor mutation (W556R) in homozygous familial hypercholesterolemia. J Pediatr 2011; Jan: 158-167.
12. Nemati MH. Coronary revascularization in a child with homozygous familial hypercholesterolemia. Interact Cardiovasc Thorac Surg 2010 Jan; 10(1): 131-2.
13. Raal FJ, Santos RD. Homozygous familial hypercholesterolemia: current perspectives on diagnosis and treatment. Atherosclerosis 2012; 223 : 262-268.
14. Schwarz J, Winters JL, Padmanabhan A. Guidelines on the use of therapeutic apheresis in clinical practice evidence-based approach from the writing committee of the American Society for Apheresis: the sixth special issue. J Clin Apher 2013; 28 : 145–284.
15. Borberg HS, Stoffel W, Greve V. Application of specific extracorporeal removal of low density lipoprotein in familial hypercholesterolaemia. Lancet 1981; 7; 2(8254): 1005-1007.
16. Leebman J, Roeseler E, Julius U, Heigl F, Spitthoever R, Heutling D, et al. Lipoprotein apheresis in patients with maximally tolerated lipid-lowering therapy, lipoprotein(a)-hyperliporoteinemia, and progressive cardiovascular disease: prospective observational multicenter study. Circulation 2013; 128 : 2567-2576.
17. Bláha M, Rencová E, Malý R, Dršata, J, Blažek M. Léčba hemorheoferézou (současný stav a vlastní zkušenosti). Aktuality z nefrologie, 14, 2008, č. 3, s.118-124.
18. Borberg HS. 26 years of LDL--apheresis: a review of experience. Transfus Apher Sci. 2009 Aug; 41(1): 49-59.
19. Masin V, Blaha M, Stransky P, et al. Optimization of therapeutic procedure during LDL-apheresis - verification of the computerized model in clinical practice. Transfus Apher Sci. 2007 Feb; 36(1): 39-45.
20. Heigl F, Hettich R, Eder B, Arendt R. Lipoprotein apheresis standard for apheresis competence center - an update synthesis and amendment to pro-existing standards. Atherosclerosis Suppl 14 2013; 57-65.
21. Kalinová M, Zadák Z, Bláha M. Léčba hyperlipoproteinémií kontinuálními plazmaferézami. Lék. Zprávy (Hradec Králové) 26, 1981; 7/8 : 135-142.
22. Thompson GR, Miller JP, Breslow JL. Improved survival of patients with homozygous familial hypercholesterolaemia treated by plasma exchange. Br Med J 1985; 291 : 1674-3.
23. Bláha M, Zadák Z, Havel E, Bláha V, Malý J, Solichová M. Léčba těžké hyperlipoproteinémie LDL-aferézou. Transfuze dnes 1997; 19 : 9-10.
24. Thompson GR. The evidence-base for the efficacy of lipoprotein apheresis min combating cardiovascular disease. Atherosclerosis Suppl. 14 2013; 67-70.
25. Watts GF, Gidding S, Wierbicki AS, Toth PP, Alonso R, Brown WV, et al. Integrated guidance on the care of familial hypercholesterolemia from international FH Foundation. J Clin Lipidol 2014; 8 : 148-172.
26. Palcoux JB, Meyer M, Jouanel P, Vanlieferinghen P, Malpuech G. Comparison of different treatment regimens in a case of homozygous familial hypercholesterolemia. Ther Apher 2002; 6(2): 136-139.
27. Raal FJ, Pilcher GJ, Panz VR, van Deventer HE, Brice BC, et al. Reduction in Mortality in subjects with homozygous familial hypercholesterolemia associated with advances in lipid-lowering therapy. Circulation 2011; 124 : 2202-2207.
28. Julius U, Parthofer KG, Heibges A, Kurz S, Klingel R, Geiss HC. Dextran-sulfate-adsorption of atherosclerotic liporoteins from whole blood of separated plasma for lipid-apheresis-comparison of performance characteristics with DALI and lipidfiltration. J Clin Apheresis 2007; 22 : 215-223.
29. Julius U, Frind A, Tselmin S, Kopprasch S, Poberschin I, Siegert G. Comparison of different LDL apheresis methods. Expert Rev Cardiovasc Ther 2008; 6(5): 629-639.
30. Julius U, Fischer S, Schatz U, Passauer J, Bornstein S. Why an apheresis center should offer more than one lipoprotein apheresis method. Therapeutic Apheresis and Dialysis 2013; 17(2): 179-184.
31. Bláha M, Rencová E, Langrová H, et al. The importance of rheological parameters in the therapy of the dry form of age-related macular degeneration with rheohaemapheresis. Clin Hemorheol Microcirc 2012; 50(4): 245-55.
32. Dršata J, Bláha M, Chrobok V, Rencová E, Lánská M. Léčba percepční ztráty sluchu pomocí reohemaferézy“ Přijato do tisku časopisu Otorinolaryngologie a foniatrie 8.10.2012.
33. Marais AD, Blom DJ. Recent advances in the treatment of homozygous familial hypercholesterolemia. Curr Opin Lipidol 2013; 24 : 288-294.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2014 Číslo 3- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Léčba on-demand je jednoznačně neefektivní v prevenci vývoje hemofilické artropatie
-
Všetky články tohto čísla
- Vliv trombocytových růstových faktorů na proliferaci fibroblastů na nanovlákenném tkáňovém nosiči
- Případ diferenciální diagnostiky pancytopenie
- Extrakorporální eliminace cholesterolu u familiární hypercholesterolemie – srovnání dvou metodik.
- AL amyloidóza v obrazech
- Epidemiologie a rizikové faktory spojené s Hodgkinovým lymfomem
- Effect of body mass in children with hematologic malignancies undergoing allogeneic bone marrow transplantation
- D-dimer to guide the duration of anticoagulation in patients with venous thromboembolism: a management study
- Dexamethasone (6 mg/m2/day) and prednisolone (60 mg/m2/day) were equally effective as induction therapy for childhood acute lymphoblastic leukemia in the EORTC CLG 58951 randomized trial
- Diagnostic and risk criteria for HSCT-associated thrombotic microangiopathy: a study in children and young adults
- Validation and refinement of the Disease Risk Index for allogeneic stem cell transplantation
- Erythropoietin therapy after allogeneic hematopoietic cell transplantation: a prospective, randomized trial
- Molecular analysis of Fanconi anemia: the experience of the Bone Marrow Failure Study Group of the Italian Association of Pediatric Onco-Hematology
- Immunodeficiency scoring index to predict poor outcomes in hematopoietic cell transplant recipients with RSV infections
- Outcome and management of pregnancies in severe chronic neutropenia patients by the European Branch of the Severe Chronic Neutropenia International Registry
- Outcome of patients with abnl(17p) acute myeloid leukemia after allogeneic hematopoietic stem cell transplantation
- Allogeneic hematopoietic stem cell transplantation in patients with polycythemia vera or essential thrombocythemia transformed to myelofibrosis or acute myeloid leukemia: a report from the MPN Subcommittee of the Chronic Malignancies Working Party of the European Group for Blood and Marrow Transplantation
- Platelet diameters in inherited thrombocytopenias: analysis of 376 patients with all known disorders
- Postthrombotic syndrome following upper extremity deep vein thrombosis in children
- Poděkování členům minulého výboru České hematologické společnosti.
- Nový výbor České hematologické společnosti
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Případ diferenciální diagnostiky pancytopenie
- AL amyloidóza v obrazech
- Epidemiologie a rizikové faktory spojené s Hodgkinovým lymfomem
- Vliv trombocytových růstových faktorů na proliferaci fibroblastů na nanovlákenném tkáňovém nosiči
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



