-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Případ diferenciální diagnostiky pancytopenie
Differential diagnosis of pancytopenia – a case report
The aim of this paper is to report the differential diagnosis undertaken in a 47-year-old patient who was admitted for severe pancytopenia at the Department of Internal Medicine, Tomas Bata Regional Hospital in Zlín in August 2012. As the initial examinations regarding inflammation, tumours, infections and systemic diseases were negative, myelodysplastic syndrome was suspected. Trephine biopsy was performed, but myelodysplastic syndrome was not confirmed. The patient quickly became dependent on transfusions and suffered from recurrent infections. The differential diagnostic process was further complicated by the patient’s repeated refusal to be hospitalized at the department of Internal Medicine. Repeated CT scans showed increasing splenomegaly and eventually multiple osteoplastic and mixed deposits in the pelvic bone appeared, pointing to a probable malignancy. The patient was referred for further investigation to the Department of Internal Medicine, Haematology and Oncology Clinic, University Hospital Brno-Bohunice. The indicated whole-body PET/CT found extensive deposits of viable tumour tissue in the chest wall. Histological samples were taken and corticosteroid treatment was started. However, this resulted in tumour lysis syndrome followed by kidney failure. The patient developed multiple organ failure with disseminated intravascular coagulopathy and died on the day that the histological diagnosis of undifferentiated sarcoma was made.
Key words:
myelodysplastic syndrome, (pan)cytopenia, sarcoma
Autoři: E. Kadlčková 1; P. Rohoň 2; M. Navrátil 3; L. Křen 4; I. Zimová 5; J. Palíšek 6; J. Staníček 7; I. Ryšavý 8
Působiště autorů: Hematologicko-transfuzní oddělení Krajské nemocnice T. Bati Zlín 1; Hemato-onkologická klinika Fakultní nemocnice a Lékařské fakulty Univerzity Palackého Olomouc 2; Interní hematoonkologická klinika (IHOK) Fakultní nemocnice Brno-Bohunice 3; Ústav patologie Fakultní nemocnice Brno-Bohunice 4; Klinika anesteziologie, resuscitace a intenzivní medicíny (KARIM) Fakultní nemocnice Brno-Bohunice 5; Radiodiagnostické oddělení Krajské nemocnice T. Bati Zlín 6; Oddělení nukleární medicíny Masarykova onkologického ústavu Brno, Žlutý kopec 7; Interní klinika Krajské nemocnice T. Bati Zlín 8
Vyšlo v časopise: Transfuze Hematol. dnes,20, 2014, No. 3, p. 59-66.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Náplní sdělení je případ diferenciální diagnostiky 47letého pacienta, který byl v srpnu 2012 přijat na Interní kliniku Krajské nemocnice Tomáše Bati ve Zlíně pro těžkou pancytopenii. Protože úvodní vyšetření směřující k vyloučení zánětu, tumoru, infekce a systémového onemocnění byla negativní, bylo vysloveno podezření na myelodysplastický syndrom. Aspirát kostní dřeně byl nevýtěžný, trepanobiopsie však nepotvrdila přítomnost myelodysplastického syndromu. Pacient se rychle stal závislým na transfuzích, opakovaně prodělával infekce. Další diferenciálně diagnostický proces komplikoval sám pacient svými opakovanými negativními reversy stran interní hospitalizace. Na opakovaných vyšetřeních počítačovou tomografii (CT) byla patrná narůstající splenomegalie a poté i vícečetná osteoplastická a smíšená ložiska ve skeletu pánve, která ukazovala na pravděpodobnou malignitu. Pacient byl proto odeslán k dalšímu došetření na Interní hematoonkologickou kliniku Fakultní nemocnice Brno-Bohunice. Zde bylo indikováno celotělové vyšetření pozitronovou emisní tomografií v kombinaci s CT a nalezeno rozsáhlé ložisko viabilní nádorové tkáně v hrudní stěně. Byl proveden odběr histologie a započata prefáze kortikoidy, po které ale následovalo renální selhání při syndromu nádorového rozpadu. Pacient zemřel pod obrazem multiorgánového selhání a diseminované intravaskulární koagulopatie v den stanovení histologické diagnózy diseminovaného nediferencovaného sarkomu.
Klíčová slova:
myelodysplastický syndrom, (pan)cytopenie, sarkomÚvod
Jako pancytopenii označujeme stav, při kterém dochází k poklesu počtu všech typů krevních buněk v obvodové krvi pod dolní hranici normálních hodnot. Základním vyšetřením k objasnění příčiny tohoto patologického stavu je vyšetření kostní dřeně pomocí sternální punkce a trepanobiopsie. Podle mechanismu vzniku dělíme pancytopenie na stavy se sníženou buněčností kostní dřeně, kde typickým představitelem je aplastická anémie, a na stavy s normální nebo zvýšenou dřeňovou celularitou, kde nejčastější chorobou je myelodysplastický syndrom. K pancytopenii mohou vést i procesy poškozující normální krvetvorbu infiltrací kostní dřeně, nejčastěji maligní lymfomy (1). Myelodysplastický syndrom (MDS) je potenciálně maligní onemocnění krvetvorby vznikající na podkladě poruchy genomu pluripotentní hemopoetické kmenové buňky. Pro tuto chorobu je ve většině případů typický nepoměr mezi normo - až hypercelulární dysplastickou kostní dření a periferní pancytopenií, který je způsoben předčasnou apoptózou prekurzorů dysplastického klonu (2, 3). I přes recentní významné pokroky ve vyšetřování tohoto maligního onemocnění zůstává v některých případech myelodysplastický syndrom diagnózou per exclusionem (4). Jeho odlišení oproti jiným cytopeniím nejrůznějšího původu může být opravdu náročné, jak dokládá samotná kazuistika (5, 6) (obr. 1).
Obr. 1. Diferenciální diagnostika (pan)cytopenií. 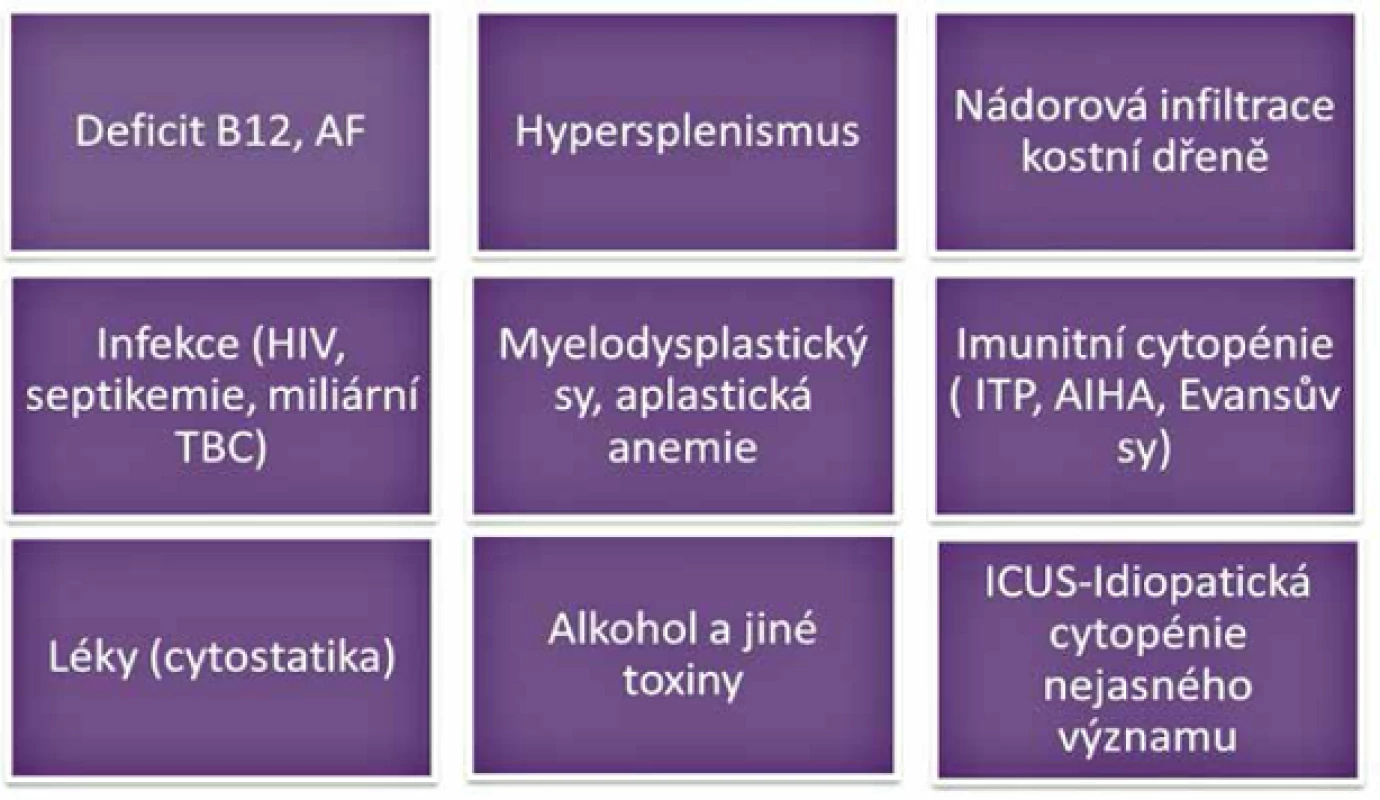
Obr. 2. Trepanobioptický nález: obraz těžkých megaloblastoidních změn v červené řadě -prekurzory erytropoézy s výraznými, místy až naznačeně tyčinkovitými jadérky, hematoxilin-eosin, 400x. 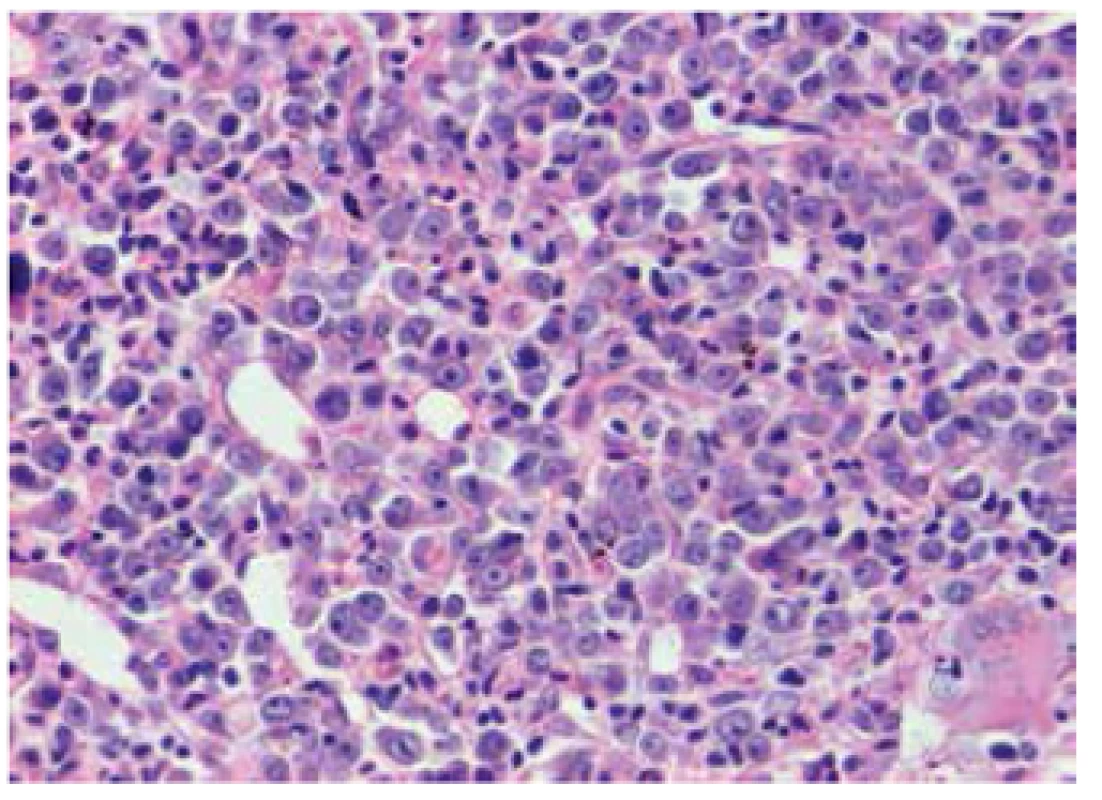
Obr. 3. Trepanobioptický nález: Imunohistochemické vyšetření na glykoforin (marker erytrocytové linie, hnědě pozitivní), 400x 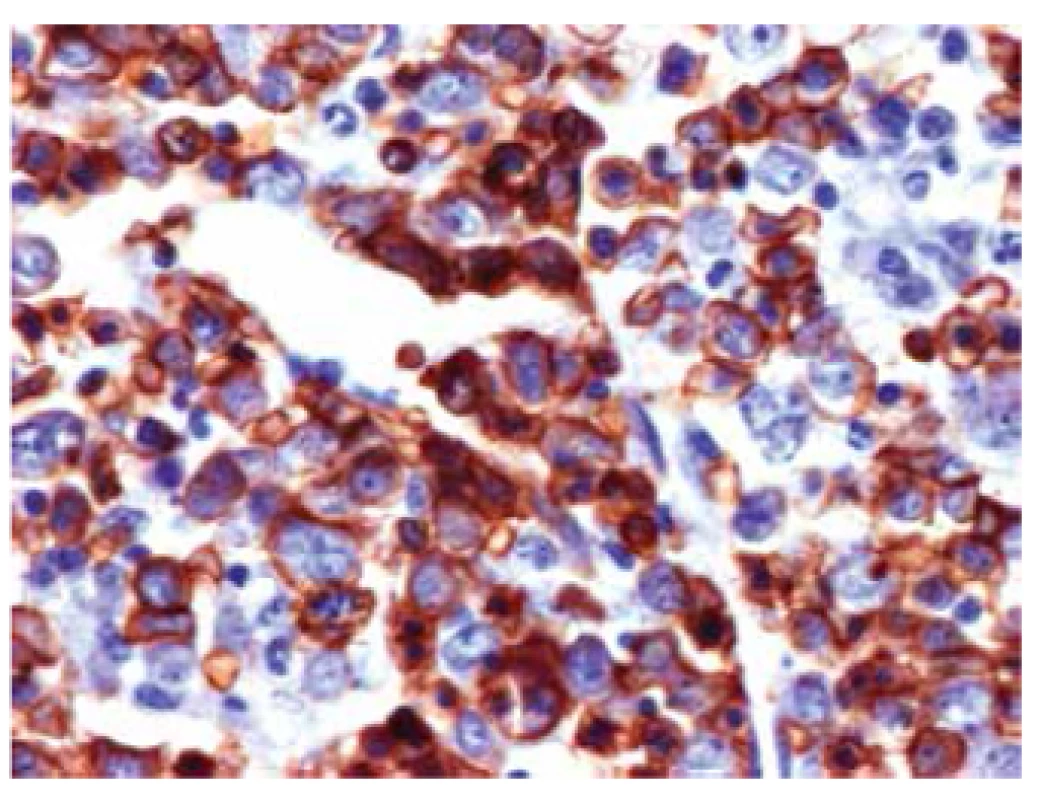
Obr. 4. Splenomegalie s infarktem sleziny. 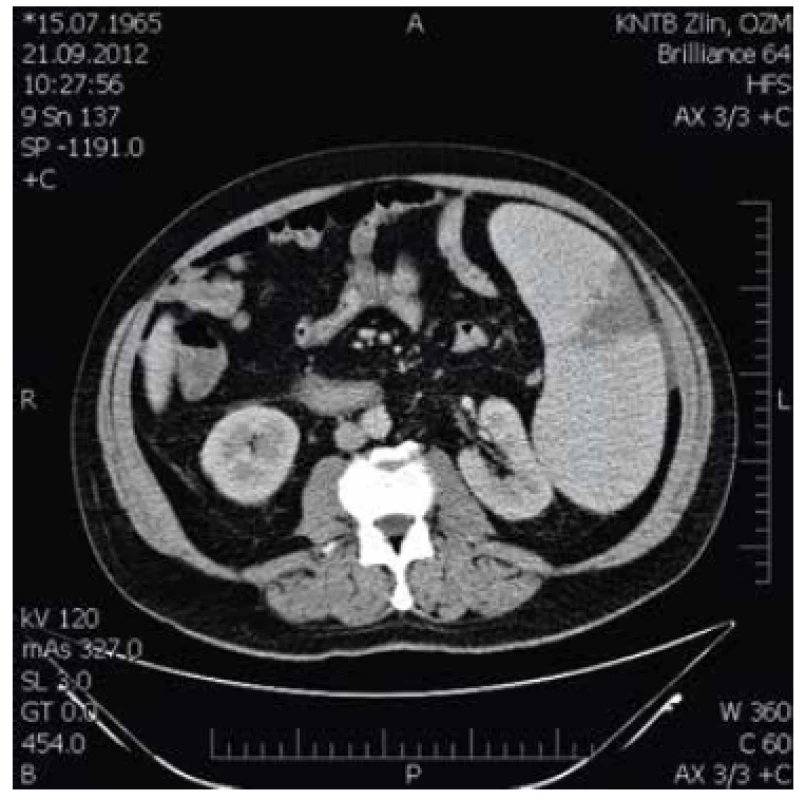
Popis případu
47letý pacient, narozen 1965, dosud bez vážnějších chorob, otec 5 dětí, toho času nezaměstnaný, přichází v červenci 2012 ke svému praktickému lékaři k prohlídce před vstupem do nového zaměstnání. Protože je u něj zjištěna těžká bicytopenie, je odeslán k hospitalizaci na Interní kliniku Krajské nemocnice T. Bati, a.s. Zlín (IK KNTB Zlín). Pacient se dostavil se čtyřdenním zpožděním poté, co u něj 2 dny přetrvávaly febrilie reagující na paracetamol. V krevním obraze je při přijetí potvrzena pancytopenie (erytrocyty 1,48 x 1012/l, hemoglobin 46 g/l, hematokrit 0,124, MCV 84 fl, MCH 31 pg, trombocyty 66 x 10⁹/l, leukocyty 2,9 x 10⁹/l, neutrofily 1,6 x 10⁹/l, retikulocyty 0,014) bez sideropenie, deficitu vitaminu B12 a folátů, s negativními markery hemolýzy, bez signifikantní patologie v diferenciálním rozpočtu leukocytů mikroskopicky a ve vyšetření z periferní krve průtokovou cytometrií. Sternální punkce je opakovaně suchá, proto je provedena pouze trepanobiopsie. Při vyšetření uzlin krku až malé pánve počítačovou tomografii (CT) ze dne 7. 8. 2012 jsou popsány pouze zvětšené axilární lymfatické uzliny, největší příčně 15-20 mm, tukově degenerované, oválného tvaru, hodnoceny jako benigní. Slezina je zvětšená, velikosti 19 x 7 x 17 mm, bez ložiskových změn. Pacient je přeléčen amoxicilinem/kyselinou klavulanovou s poklesem CRP. Během hospitalizace je podáno celkem 12 transfuzních jednotek (T. U.) erytrocytových transfuzních přípravků (ETP). Pacient naléhá na dimisi z rodinných důvodů, proto je propuštěn jako afebrilní s hodnotou hemoglobinu 93 g/l a objednán ke kontrolám do hematologické ambulance (HA) KNTB Zlín. Ve výsledkovém protokolu vyšetření trepanobiopsie je kostní dřeň popsána jako silně hypercelulární (90–100 %). Poměr mezi myeloidní a erytroidní řadou je udáván v úseku 5–10 : 1. Erytropoéza je popsána jako silně hyperplastická, megaloblastická, glykoforin +/-. Granulopoéza je potlačena, vyzrávající. Megakaryopoéza je taktéž potlačena, megakaryocyty mají normolobulizovaná jádra a nevykazují přítomnost pleiomorfních, parožnatých či dysplastických forem. Retikulin není v hemopoetické tkáni zvýšen, kostní dřeň se tedy nevyznačuje fibrotickými změnami. Stromální železo je v normě. Plazmatické buňky i lymfocyty činí shodně 2–3 %. Extrinsické buňky nejsou přítomny, kostní trámce jsou přiměřené stavby. Důvody pro výše popsané změny mohou být následující: a) nedostatek vitaminu B12 a folátů, b) reaktivní změny po předchozím útlumu, c) megaloblastoidie jako dysplatická změna v rámci MDS (vzhledem k potlačení/vytlačení zbylých dvou linií nelze posoudit event. dysplastické změny v nich, vytlačení je rovněž považováno za důvod cytopenie v těchto liniích). Patolog upozorňuje, že nález je nutno korelovat s dalším vývojem, každopádně toho času se jeví bez známek hematologické malignity. K vyšetření trepanobiopsie bylo použito speciální barvení Periodic Acid-Schiff (PAS), Gömöri, barvení Weigert van Gieson, enzymová histochemie chloracetátesterázou a imunohistochemie CD 34, CD 61, myeloperoxidáza, lysozym a glykoforin (obr. 2 a 3). Během ambulantních kontrol pacient popírá jakékoliv obtíže i přes subfebrilie, progredující pancytopenii a nutnost dalších transfuzí. Protože výsledky dalších vyšetření svědčí pro pravděpodobnou malignitu, je dohodnuto pokračování diferenciálně diagnostického procesu za hospitalizace na Interní hematoonkologické klinice (IHOK) FN Brno-Bohunice. Zde je provedena kontrolní trepanobiopsie s totožným výsledkem jako při prvním odběru. Opět se nedaří získat aspirát kostní dřeně ani materiál pro vyšetření cytogenetiky a vyšetření průtokovou cytometrií. Pacient po 3 dnech podepisuje negativní revers. V polovině září je znovu přijat k hospitalizaci na IK KNTB Zlín pro febrilie, tachykardii, závažnou bicytopenii (hemoglobin 64 g/l, trombocyty 27 x 10⁹/l, leukocyty 3,0 x 10⁹/l, neutrofily 1,7 x 10⁹/l), elevaci CRP (119,3 mg/l) a k dokončení diferenciální diagnostiky za hospitalizace. Stolice na okultní krvácení je sice pozitivní, ale gastrofibroskopie je bez signifikantní patologie. Na základě revize rentgenu plic ze srpna 2012, která prokazuje sníženou transparenci plicního parenchymu, je provedeno CT plic s vysokým rozlišením, které nevykazuje patologické změny plicních křídel. Nález je také bez lymfadenomegalie v oblasti hrudníku. Okrajově je zachycena splenomegalie s infarktem sleziny (obr. 4) a zmnožení lymfatických uzlin v povodí truncus coeliacus, největší z lymfatických uzlin dosahují velikosti 17,8 x 10 mm. Zobrazený skelet páteře prokazuje vícečetná ložiska obratlových těl, z nichž některá okrajově zasahují na pedikly. Zřetelně jsou ložiska patrná v obratových tělech Th 1, 5, 6, 9, 11, 12, L1 a 2. Všechna ložiska obsahují sklerotickou složku, některá jsou smíšená. Nález je bez komprese obratlových těl či jiných destrukcí skeletu. Charakter ložisek je nejednoznačný, vhodné je tedy srovnání s ostatními metodami (obr. 5). Během hospitalizace jsou podány 4 T. U. ETP a zahájena léčba amoxicillinem/klavulanátem intravenózně. Další vyšetření výše uvedených závažných patologií však už není realizováno, protože pacient opět podepisuje negativní revers. Při kontrole v HA KNTB Zlín koncem září 2012 pacient neguje krvácivé projevy, pouze přiznává teploty kolem 37 °C, jinak si na nic nestěžuje. Vzhledem k významným patologiím v laboratorních nálezech (hemoglobin 73 g/l, hematokrit 0,209, trombocyty 26 x 10⁹/l, leukocyty 1,5 x 10⁹/l, neutrofily 0,9 x 10⁹/l, FW 105/hod., Hemocult 71µg/l (pozitivní)) je pacientu doporučena okamžitá rehospitalizace za účelem provedení dalších vyšetření, což striktně odmítá a po transfuzi ETP odchází domů. K další, v pořadí již třetí hospitalizaci na IK KNTB Zlín je pacient přijat začátkem října 2012. Při přijetí dominuje únavnost, slabost, dušnost, subfebrilie, bi - až pancytopenie s hemoglobinem 46 g/l, trombocyty 23 x 10⁹/l, leukocyty 2,2 x 10⁹/l, neutrofily 1,3 x 10⁹/l a CRP 142 mg/l. Při endoskopickém vyšetření tlustého střeva je nalezen pouze tubulózní adenom s hyperplazií a mírnou dysplazií. Po aplikaci celkem 10 T. U. ETP chce pacient opět podepsat negativní revers a odejít domů, ale nakonec je přeložen na IHOK FN Brno Bohunice jako pancytopenie nejasné etiologie a splenomegalie v. s. při hematologické malignitě. Zde progreduje pacientova únava, slabost, pro febrilní neutropenii je podávána širokospektrá kombinovaná antibiotická terapie, pro krvácivé projevy jsou aplikovány trombocytové transfuzní přípravky, na které je však pacient postupně prakticky refrakterní. Nové CT vyšetření prokazuje jen progredující splenomegalii a levostranný fluidothorax, při druhém čtení CT nálezu je však identifikováno ložisko v oblasti pravé strany hrudníku usurující 6. žebro. Následné vyšetření pozitronovou emisní tomografií (PET) v kombinaci s CT detekuje ložisko hypermetabolismu glukózy svědčící o přítomnosti viabilní nádorové tkáně. V nálezu je popsán tumor hrudní stěny vpravo vetrolaterálně s usurací 5. žebra a suspektní postižení supraklavikulárních lymfatických uzlin vlevo a v levé axile. Přítomna je i splenomegalie s fotopenickou lézí (nekrotické ložisko?) a výrazná aktivace nebo infiltrace kostní dřeně páteře, pánve, proximálních částí obou humerů a femurů (obr. 6, 7 a 8). Plánována je chirurgická excise z nádorového ložiska na hrudi. Ve snaze stabilizovat stav pacienta a předléčit potenciální agresivní lymfom je zahájena prefáze kortikoidy. Ta je však následována syndromem nádorového rozpadu a renálním selháním. Z vitální indikace je proveden odběr histologického vzorku z tumorózní masy na hrudníku a pacient je přeložen na Kliniku anesteziologie, resuscitace a intenzivní medicíny (KARIM) FN Brno-Bohunice. Zde pak pacient umírá pod obrazem multiorgánového selhání a diseminované intravaskulární koagulopatie (DIC) v den stanovení histologické diagnózy nediferencovaného (dediferencovaného) sarkomu (obr. 9 a 10).
Obr. 5. Mnohočetná ložiska v obratlových tělech. 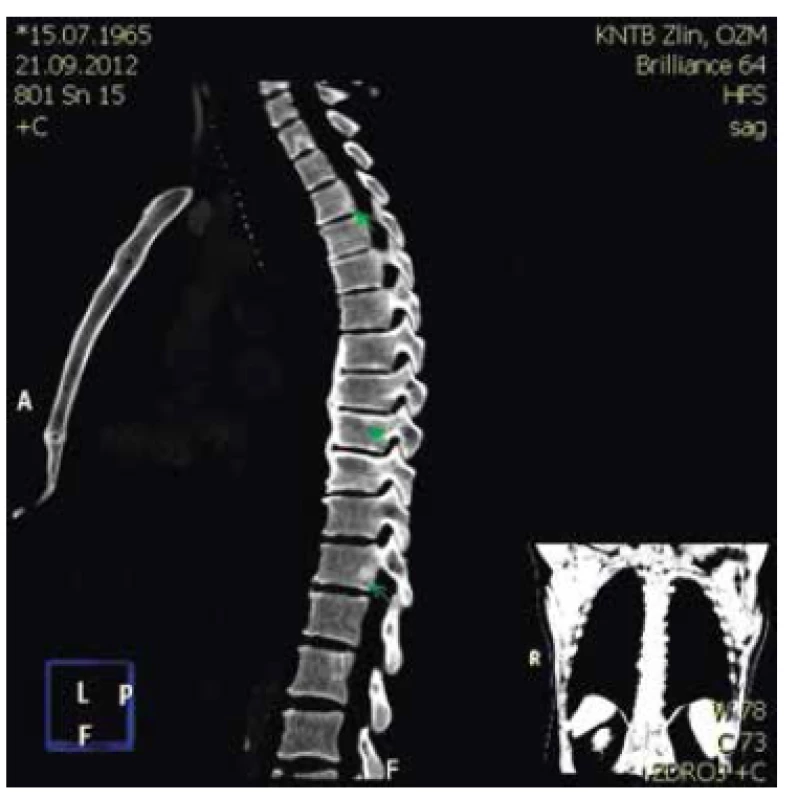
Obr. 6. CT snímek nádorového ložiska v hrudní stěně. 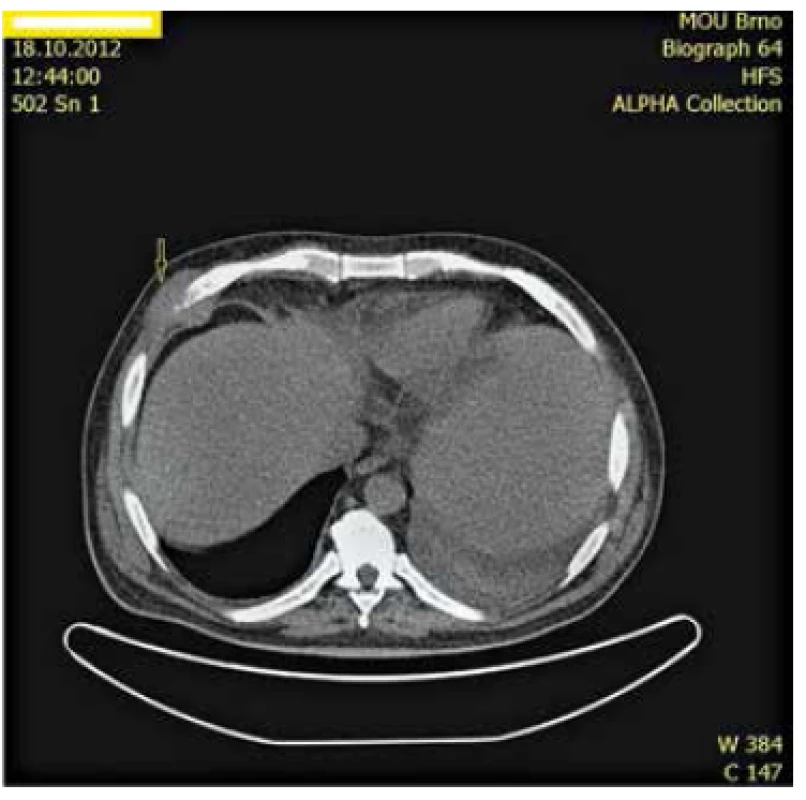
Obr. 7. PET zobrazení nádorového ložiska v hrudní stěně. 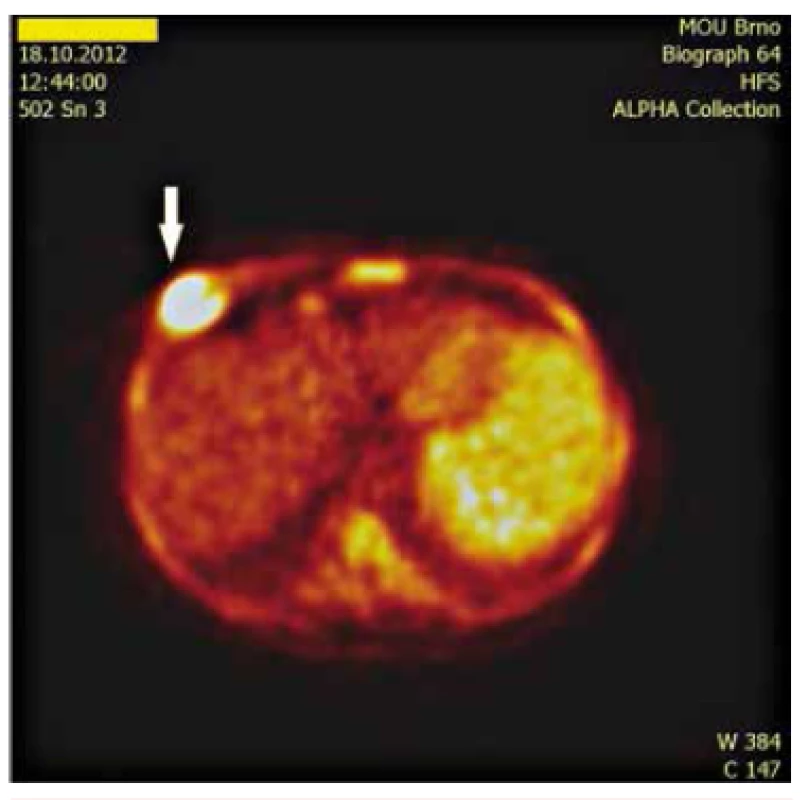
Obr. 8. PET/CT 3 D fúze nádorového ložiska v hrudní stěně. 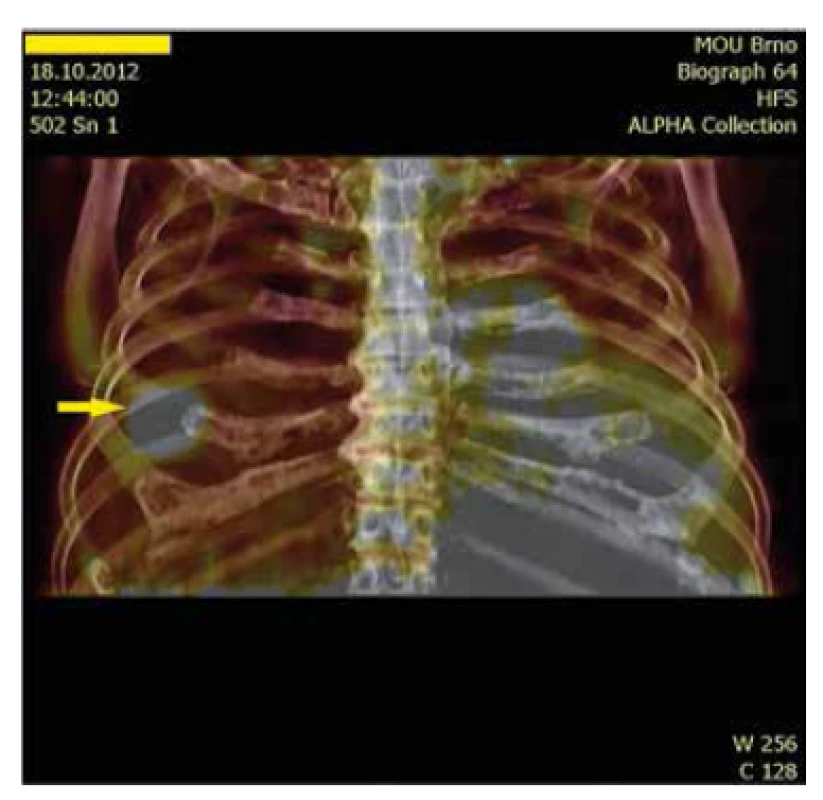
Obr. 9. Nízce diferencovaný/kulatobuněčný sarkom, hematoxilineosin, 400x. Solidně utvářený, nízce diferencovaný nádor složený z epiteloidních, silně anizomorfních buněk s objemnými jádry a nápadnými nukleoly. Buněčné hranice jsou nezřetelné, místy mají nádorové elementy až syncytiální charakter a disperzně jsou přítomny mnohojaderné obrovské buňky. Mitotická aktivita je velmi vysoká, s přítomností atypických mitóz. 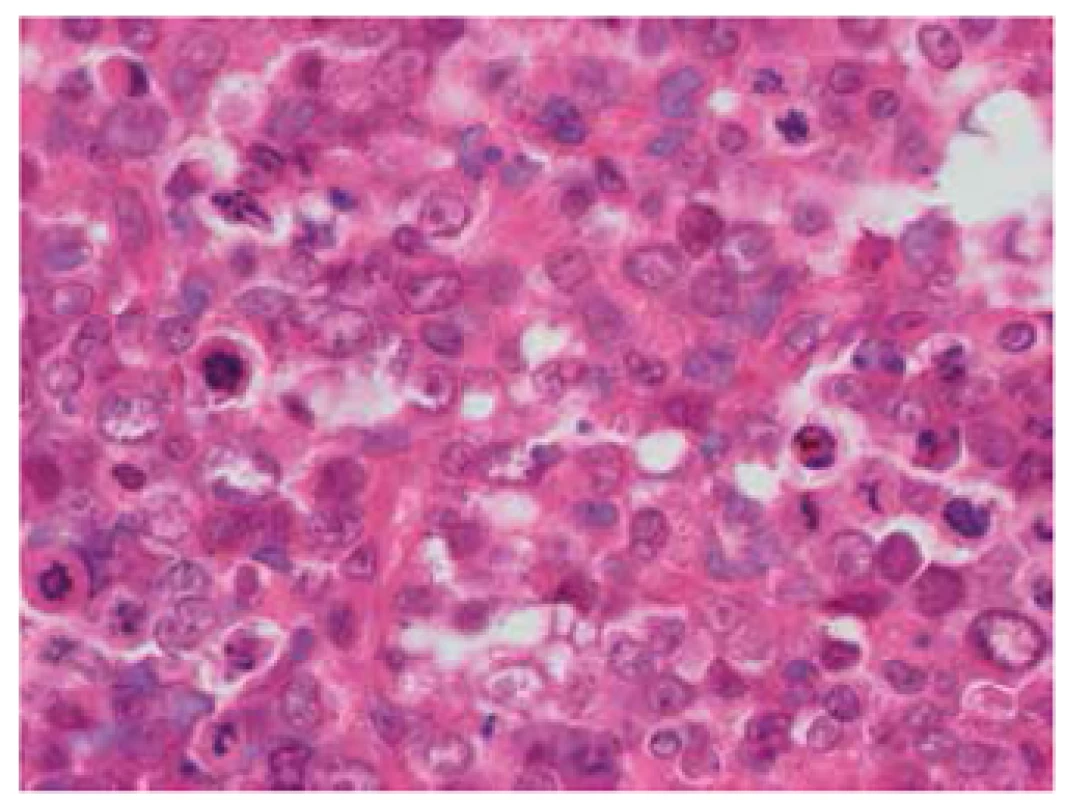
Obr. 10. Imunohistochemické vyšetření na desmin (myogenní marker): některé buňky jeví intracytopazmatickou/ paranukleární pozitivitu (hnědě), jde tedy o sarkom s parciální myogenní diferenciací, 400x. 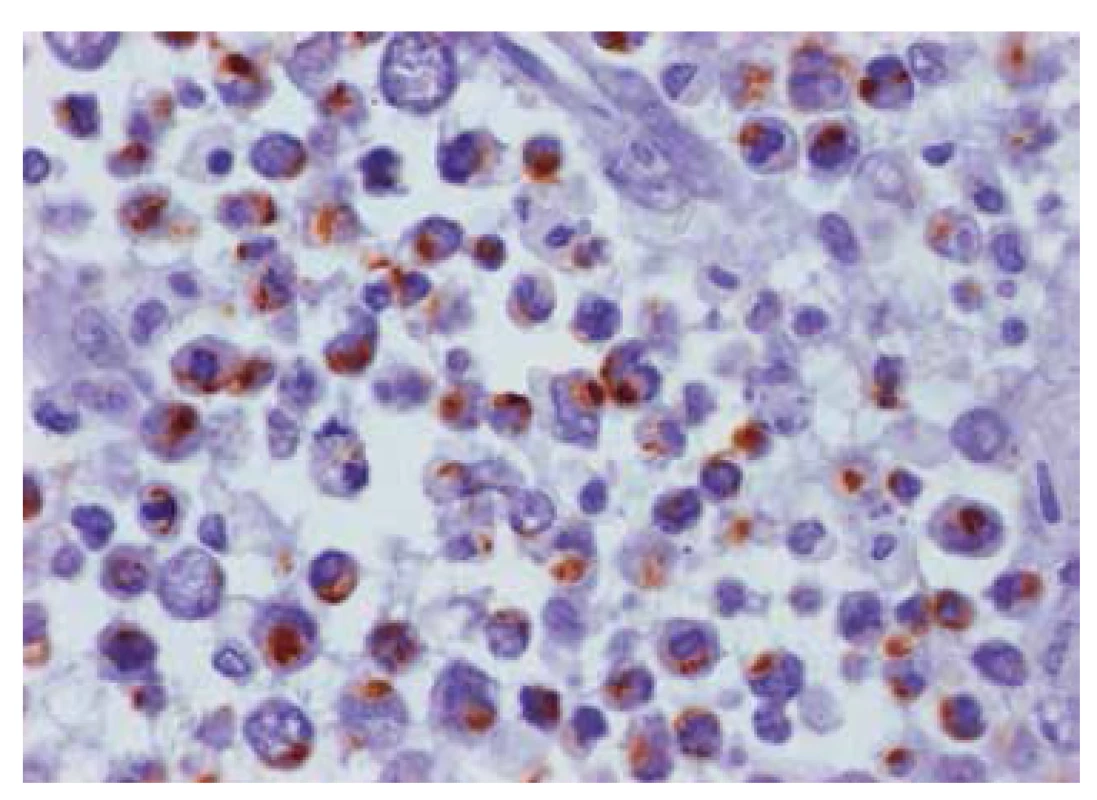
Pitevní zpráva
V závěru pitevního protokolu je za základní onemocnění označen nízce diferencovaný/dediferencovaný sarkom hrudní stěny vpravo anterolaterálně, který ve výši 5.–6. žebra tvoří vypouklý útvar velikosti 3,5 x 3 cm prominující do hrudní dutiny. Ložisko usuruje žebro a prostupuje až na vnější stranu hrudní stěny. Nekroptické vzorky ze sarkomu jsou bohužel kompletně nekrotické. Mezi jinými závažnými chorobnými stavy souvisejícími se smrtí jsou na prvním místě uvedeny známky diseminované intravaskulární koagulopatie. Dále je přítomna lymfadenopatie mediastinálních a paraaortálních uzlin, mikroskopicky je však nalezena pouze reaktivní histiocytóza v sinusech, ložiska černého pigmentu a prokrvácení. Splenomegalie dosahuje 5 090 g o rozsahu 35 x 25 x 10 cm, s četnými splývajícími infarkty, mikroskopicky jsou patrná ložiska nekróz a prokrvácení. Hepatomegalie s disperzní cholestázou činí 2 830 g. Popsán je také difuzní alveolární edém plic. Za bezprostřední příčinu smrti je označena sepse a DIC. Mezi vedlejšími nálezy figurují antrakóza plic a tracheobronchiálních lymfatických uzlin, disperzní myofibróza myokardu levé srdeční komory, mírná benigní nefroskleróza, stav po operaci vazů levého kolene a defekt sliznice krčního jícnu velikosti 5 x 5 cm.
Diskuse
Diagnostika myelodysplastického syndromu se opírá hlavně o mikroskopický nález signifikantních dysplastických změn a/nebo zvýšeného procenta myeloblastů v nátěru kostní dřeně a/nebo identifikaci cytogenetických abnormalit typických pro MDS u pacientů s trvalou nebo progredující cytopenií (4). Ke stanovení diagnózy MDS může přispět cytochemické vyšetření kostní dřeně a stanovení exprese povrchových buněčných antigenů pomocí průtokové cytometrie (7). V případě našeho pacienta se ale nepodařilo získat reprezentativní dřeňový punktát ani při sternální punkci, ani při provádění trepanobiopsie. Biopsie kostní dřeně může doplnit diagnostiku MDS v několika aspektech jako je celularita, dysmegakaryopoéza a identifikace abnormálně lokalizovaných shluků nezralých prekursorů (ALIP) (4). V našem případě však extrémní hyperplázie megaloblastoidně změněné červené řady znemožnila posoudit zbylé dvě linie, takže trepanobiopsie nepotvrdila, ale také nevyvrátila přítomnost primárního nebo sekundárního MDS. Teprve narůstající množství nepřímých důkazů pro přítomnost tumoru nás přivedla k teorii cytopenie při nádorovém bujení. Cytopenie u nádorových onemocnění je komplexní povahy a může vznikat z různých příčin, které se často vzájemně kombinují. Nádorové buňky a buňky imunitního systému produkují četné cytokiny (TNF-λ, IL-1, IL-6 a INT-γ), které potlačují produkci erytropoetinu a stimulují tvorbu feritinu a hepcidinu. Příčinou anémie u nádorových chorob může být také infiltrace kostní dřeně nádorovými buňkami, která je provázená leukoerytroblastickým obrazem v obvodové krvi. Dalšími možnými příčinami mohou být imunní a neimunní hemolýza, karence železa, vitaminu B12 a folátů a hypoplázie kostní dřeně. Vzácnou příčinou anémie u nádorů bývá erytrofagocytóza (8). Hemofagocytární syndrom je vzácná afekce s fulminantním, často fatálním průběhem, při níž dochází k infiltraci retikuloendotelového systému patologickými histiocyty, které pohlcují a rozkládají krevní elementy. V klinickém obraze dominují zejména febrilie, lymfadenopatie a hepatosplenomegalie. Vyskytuje se jednak jako familiární, jednak jako sekundární syndrom provázející infekce nebo nádorová onemocnění. V případě nádorových chorob může předcházet vlastní manifestaci malignity, kdy spouštěcím mechanismem je obvykle sekundární infekce, nebo může být součástí paraneoplastického syndromu. Pro stanovení diagnózy je rozhodující histopatologický průkaz hemofagocytózy ve slezině a kostní dřeni (9). V případě našeho pacienta byl vyloučen hemolytický stav, karence železa, vitaminu B12 a folátů a hypoplázie kostní dřeně. Pro případný hemofagocytární syndrom chybí histopatologický důkaz. V pozdějším stadiu choroby se na cytopenii mohly podílet i narůstající splenomegalie a aloprotilátky proti trombocytům a leukocytům po opakovaných transfuzích. Nicméně v pitevním protokolu byl jako základní onemocnění pacienta stanoven ne(de)diferencovaný sarkom. Sarkomy měkkých tkání (soft tissue sarcomas, STS) jsou heterogenní skupinou zhoubných nádorů mezenchymálního původu. Mohou vzniknout v kterékoli části těla, nejčastěji však na končetinách. Nemocný obvykle pozoruje nebo hmatá nebolestivé vyklenutí, což vede k relativně pozdní návštěvě lékaře. Proto každá infiltrace měkkých tkání, která neustupuje do 2–3 týdnů, by měla být vyšetřena za pomoci sonografie, CT a punkční biopsie (10). V případě našeho pacienta byla prvním příznakem náhodně zjištěná pancytopenie, zatímco nádorové ložisko zůstávalo velmi dlouho skryto. STS rostou zpočátku spíše expanzivně a působí komplikace až útlakem struktur v okolí, v pokročilejších stadiích nebo při recidivách invadují do cév nebo orgánů (10). Transfasciální šíření, které evidentně proběhlo i u našeho pacienta, je méně časté a má špatnou prognózu. STS metastazují hlavně hematogenní cestou do plic a – jako v případě našeho pacienta – do skeletu, méně často pak do centrálního nervového systému. U sarkomů retroperitonea je častější diseminace do jater. Lymfogenní metastázy jsou vzácné, zvýšené riziko postižení lymfatických uzlin se objevuje jen u některých histologických typů, například u rhabdomyosarkomu (11). U našeho pacienta bylo při vyšetření PET vysloveno podezření na nádorové postižení supraklavikulárních lymfatických uzlin vlevo a v levé axile. Mírné zvětšení axilárních uzlin benigního charakteru je zmiňováno již při prvním CT vyšetření. Tyto uzliny nebyly post mortem histologicky vyšetřeny a ve zvětšených mediastinálních a paraaortálních uzlinách byly mikroskopicky nalezeny pouze reaktivní změny, tudíž k lymfogenní diseminaci se nelze v tomto případě s jistotou vyjádřit. Podobně také metastázy do sleziny, které by jinak mohly uspokojivě vysvětlit těžkou splenomegalii, nebyly prokázány. PET vyšetření popisuje fotopenickou lézi, což dobře koreluje s mikroskopickým nálezem nekróz a prokrvácení post mortem. Incidence sarkomů měkkých tkání v ČR je 2/100 000 obyvatel, což činí 0,3-0,5 % všech zhoubných nádorů. V Evropě se vyskytují v průměru 5/100 000 obyvatel za rok (10, 12, 13). STS tedy patří k nádorům s nízkou incidencí, a proto je důležitá diagnostika a léčba na specializovaném pracovišti. Histopatologická diagnóza musí být stanovena patologem se zkušeností s mesenchymálními nádory hlavně proto, že sarkomy měkkých tkání jsou jedinými solidními nádory, u nichž o zařazení do klinického stadia rozhoduje nejen velikost ložiska a jeho šíření do lymfatických uzlin a vzdálených orgánů, ale také stupeň diferenciace nádoru (histopatologický grading) (13, 14). Histologický grade, jenž je v současnosti považován za nejvýznamnější prognostický faktor u STS, však v našem případě poněkud ustupuje do pozadí (15). Náš pacient totiž na základě přítomnosti kostních metastáz spadá do čtvrtého, nejpokročilejšího stadia (dle 6. vydání TNM (UICC/AJCC)) (16). V tomto klinickém stadiu se za stěžejní léčebnou metodu považuje paliativní chemoterapie, která je nejčastěji založena na kombinaci doxorubicinu a ifosfamidu. Léčebná odpověď se pohybuje mezi 10-15 % a celková doba přežití bývá kolem 12 měsíců (17, 18). Jako lék druhé linie je doporučováno cytostatikum trabectedin (Yondelis firmy Pharma Mar) s celkovým přežitím kolem 12 měsíců (19, 20).
Závěr
Diferenciální diagnóza pancytopenie byla v tomto případě obtížná, a to zejména pro nespolupráci pacienta, na níž se jistě podílela jeho sociální a rodinná situace. Svou roli sehrál i poměrně vzácný výskyt (rhabdomyo)sarkomu, sugestivní příznaky pro nádorová onemocnění s častějším výskytem (tumory zažívacího traktu a lymfomy) a absence validního sternálního punktátu.
Seznam použitých zkratek
AJCC American Joint Committee on Cancer
ALIP abnormálně lokalizované shluky nezralých prekursorů (blastů) v kostní dřeni
CRP C-reaktivní protein
CT počítačová tomografie
DIC disseminovaná intravaskulární koagulopatie
HA KNTB Hematologická ambulance Krajské nemocnice Tomáše Bati
IHOK Interní hematoonkologická klinika
IK KNTB Interní klinika Krajské nemocnice Tomáše Bati
IL-1,6 .interferon 1,6
INT-γ interferon gama
KARIM Klinika anesteziologie, resuscitace a intenzivní medicíny
MCH střední množství hemoglobinu v erytrocytu
MCV střední objem erytrocytu
MDS myelodysplastický syndrom
PAS .Periodic Acid-Schiff, cytochemická reakce pro průkaz glykogenu
PET .pozitronová emisní tomografie
STS soft tissue sarcomas, sarkomy měkkých tkání
TNF-λ .tumor necrosis alfa
TNM tumour, nodi, metastases
T. U. transfuzní jednotka
UICC International Union against CancerPodíl autorů na rukopisu
KE - vyšetřování a léčba pacienta, napsání rukopisu;
RP - kontrola a revize rukopisu;
NM, ZI, RI - vyšetřování a léčba pacienta, poskytnutí dokumentace;
KL, PJ, SJ - poskytnutí obrazové dokumentace a odborného komentáře k ní.
Poděkování
Práce byla podpořena studentským grantem IGA-LF UP-2014-001.
MUDr. Eva Kadlčková
Hematologicko-transfuzní oddělení
Krajská nemocnice T. Bati Zlín
Havlíčkovo nábřeží 600
760 01 Zlín
kadlckova@bnzlin.cz
Doručeno do redakce: 11. 5. 2014
Zdroje
1. Čermák J. Diferenciální diagnostika pancytopenie. Postgraduální medicína 2012; 14(8): 16-20.
2. Razza A, Gezer S, Mundle S, et al. Apoptosis in bone marrow biopsy samples involvinng stromal and hematopoietic cells in 50 patients with myelodysplastic syndromes. Blood 1995; 86 : 268-276.
3. Hochová I, Neuwirtová R, Vodičková E. Definice MDS. In: Hochová I, Neuwirtová R, Vodičková E, Starý J, Campr V, Housková J. Myelodysplastický syndrom: Diagnostický atlas. 1. vyd. Praha, Maxdorf, 2006; 12.
4. Komrokji RS, Zhang L, Bennett JM. Myelodysplastic syndromes classification and risk stratification. Hematol Oncol Clin North Amer 2010; 24(2): 443-457.
5. Krejčí M, Šmardová J, Adam Z, Mayer J. Myelodysplastický syndrom (MDS). In: Adam Z, Krejčí M, Vorlíček J et al. Hematologie. Přehled maligních hematologických nemocí: 2. doplněné a zcela přepracované vydání. 2. vyd. Praha, Grada Publishing, 2008; 23-25.
6. Malcovati L, Nimer S. Myelodysplastic syndromes: diagnosis and staging. C Cont 2008; 15; 4-13.
7. Čermák J. Myelodysplastický syndrom – novinky v diagnostice a léčbě. Postgraduální medicína 2010; 12(6):712-720.
8. Klener P. Anémie u nádorových onemocnění a jejich léčba. Remedia 2011; 7(6): 434-436.
9. Obořilová A. Hemofagocytární syndrom. In: Adam Z., Vorlíček J. a kolektiv Hematologie II Přehled maligních hematologických nemocí. 1. vyd. Praha, Grada Publishing, 2001; 661-663.
10. Žaloudík J. Sarkomy měkkých tkání. In: Adam Z, Vorlíček J a Vaníček J et al. Diagnostické a léčebné postupy u maligních chorob. 2. doplněné vydání. Praha, Grada Publishing, 2004; 313-318.
11. Lee B, Gottschalk AR. Soft tissue sarcoma. In: Hansen EK, Roach M III, et al. Handbook of evidence-based radiation oncology. Springer 2007 : 409-416.
12. Dušek L, Mužík J, et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, [2005], [cit. 2010-8-31]. Dostupný z www: http://www.svod.cz. Verze 7.0 [2007].
13. Casal PG, Blay JY. Soft tissue sarcomas: ESMO Clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010; 21(Suppl 5): v198–v203.
14. Benjamin RS. Soft tissue sarcomas. In: Skeel RT, et al. Handbook of cancer chemotherapy, 7th edition. Lippincott Williams and Wilkins 2007 : 420-432.
15. Brown FM, Fletcher CD. Problems in grading soft tissue sarcomas. Am J Clin Pathol 2000; 114(Suppl): S82-S89.
16. Sobin LH, Wittekind Ch. Nádory kostí a měkkých tkání. In: Sobin LH, Wittekind Ch. UICC Klasifikace zhoubných novotvarů TNM. 6th edition. New York, Wiley–Liss, 2002; česká verze 2004; 93-94.
17. Cormier JN, Pollock RE. Soft tissue sarcomas. CA Cancer J Clin 2004; 54 : 94-109.
18. Hartmann JT, Patel S. Recent developments in salvage chemoterapy for patients with metastatic soft tissue sarcoma. Drugs 2005; 65 : 167-178.
19. Schoffski P, Wolter P, Clement P, et al. Trabectedin (ET-743): evaluation of its use in advanced soft-tissue sarcoma. Future. Oncol 2007; 3 : 381-392.
20. Yovine A, Riofrio M, Blay JY, et al. Phase II study od Ecteinascidin-743 in advanced Pretreated soft tissue sarcoma patients. J Clin Oncol 2004; 22 : 890-899.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Vliv trombocytových růstových faktorů na proliferaci fibroblastů na nanovlákenném tkáňovém nosičiČlánek Platelet diameters in inherited thrombocytopenias: analysis of 376 patients with all known disordersČlánek Extrakorporální eliminace cholesterolu u familiární hypercholesterolemie – srovnání dvou metodik.Článek AL amyloidóza v obrazech
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2014 Číslo 3- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Vliv trombocytových růstových faktorů na proliferaci fibroblastů na nanovlákenném tkáňovém nosiči
- Případ diferenciální diagnostiky pancytopenie
- Extrakorporální eliminace cholesterolu u familiární hypercholesterolemie – srovnání dvou metodik.
- AL amyloidóza v obrazech
- Epidemiologie a rizikové faktory spojené s Hodgkinovým lymfomem
- Effect of body mass in children with hematologic malignancies undergoing allogeneic bone marrow transplantation
- D-dimer to guide the duration of anticoagulation in patients with venous thromboembolism: a management study
- Dexamethasone (6 mg/m2/day) and prednisolone (60 mg/m2/day) were equally effective as induction therapy for childhood acute lymphoblastic leukemia in the EORTC CLG 58951 randomized trial
- Diagnostic and risk criteria for HSCT-associated thrombotic microangiopathy: a study in children and young adults
- Validation and refinement of the Disease Risk Index for allogeneic stem cell transplantation
- Erythropoietin therapy after allogeneic hematopoietic cell transplantation: a prospective, randomized trial
- Molecular analysis of Fanconi anemia: the experience of the Bone Marrow Failure Study Group of the Italian Association of Pediatric Onco-Hematology
- Immunodeficiency scoring index to predict poor outcomes in hematopoietic cell transplant recipients with RSV infections
- Outcome and management of pregnancies in severe chronic neutropenia patients by the European Branch of the Severe Chronic Neutropenia International Registry
- Outcome of patients with abnl(17p) acute myeloid leukemia after allogeneic hematopoietic stem cell transplantation
- Allogeneic hematopoietic stem cell transplantation in patients with polycythemia vera or essential thrombocythemia transformed to myelofibrosis or acute myeloid leukemia: a report from the MPN Subcommittee of the Chronic Malignancies Working Party of the European Group for Blood and Marrow Transplantation
- Platelet diameters in inherited thrombocytopenias: analysis of 376 patients with all known disorders
- Postthrombotic syndrome following upper extremity deep vein thrombosis in children
- Poděkování členům minulého výboru České hematologické společnosti.
- Nový výbor České hematologické společnosti
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Případ diferenciální diagnostiky pancytopenie
- AL amyloidóza v obrazech
- Epidemiologie a rizikové faktory spojené s Hodgkinovým lymfomem
- Vliv trombocytových růstových faktorů na proliferaci fibroblastů na nanovlákenném tkáňovém nosiči
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



