-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv trombocytových růstových faktorů na proliferaci fibroblastů na nanovlákenném tkáňovém nosiči
Polycaprolactone Nanofibrous Layer Functionalized by Thrombocyte Rich Solution
Platelets hold a significant promise for the field of regenerative medicine and tissue engineering given their large content of growth factors. Released growth factors promote cell differentiation, proliferation, transcription of specific proteins, chemotaxis and other processes involved in tissue regeneration. Platelets in the form of platelet rich plasma are commonly used in vitro to stimulate cell proliferation of different types of tissue cultures. In the tissue engineering approach, cells are grown on nanofibrous scaffolds in order to create a system suitable for subsequent implantation into the human body. Nanofibrous scaffolds can be prepared from biodegradable and biocompatible polymers using electrospinning. A thrombocyte rich solution was used for modification of nanofibrous electrospun scaffolds made from the biodegradable polymer polycaprolactone, which is widely used in tissue engineering applications. The resulting scaffolds were modified in two ways: a) bathing in thrombocyte rich solution and b) spraying of thrombocyte rich solution in between forming nanofibers during the electrospinning process. Nanofibrous scaffolds were tested in vitro using mouse 3T3 fibroblasts and human dermal fibroblasts. Incorporation of thrombocytes into the nanofibrous layers increased proliferation of both cell types. The use of the spraying technique promotes cell ingrowth into 3D structures.
Key words:
platelets, electrospinning, scaffold, nanofibers, polycaprolactone
Autoři: J. Horáková 1; R. Procházková 2; V. Jenčová 1; P. Mikeš 1; M. Cudlínová 1
Působiště autorů: Katedra netkaných textilií a nanovlákenných materiálů, Technická univerzita v Liberci, Liberec 1; Transfuzní oddělení, Krajská nemocnice Liberec a. s., Liberec 2
Vyšlo v časopise: Transfuze Hematol. dnes,20, 2014, No. 3, p. 53-58.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Vzhledem k obsahu řady růstových faktorů představují trombocyty významný potenciál pro využití v oblasti tkáňového inženýrství a regenerativní medicíny. Růstové faktory uvolněné z krevních destiček ovlivňují buněčnou diferenciaci, proliferaci, transkripci specifických proteinů, chemotaxi a další procesy účastnící se regenerace tkání. In vitro se trombocyty ve formě plazmy bohaté na destičky využívají pro stimulaci buněčné proliferace různých typů tkáňových kultur. Pro účely tkáňového inženýrství buňky porůstají nanovlákenné nosiče (scaffoldy) s cílem vytvořit systém vhodný pro následnou implantaci do organismu. Nanovlákenné scaffoldy se připravují z biokompatibilních a biodegradabilních polymerů technikou elektrostatického zvlákňování. Suspenze trombocytů byla použita pro modifikaci nanovlákenných tkáňových nosičů, které byly připraveny elektrostatickým zvlákňováním biodegradabilního polymeru polykaprolaktonu, který je v tkáňovém inženýrství hojně využíván. Scaffoldy byly modifikovány dvěma metodami: a) smáčením v suspenzi trombocytů a b) sprejováním mezi vznikající nanovlákna během elektrostatického zvlákňování. Tyto modifikované nanovlákenné scaffoldy pak byly testovány in vitro s využitím myších 3T3 fibroblastů a lidských dermálních fibroblastů. Výsledky ukazují, že inkorporace trombocytů do nanovlákenných vrstev napomáhá buněčné proliferaci obou testovaných buněčných typů. Inkorporace trombocytů dovnitř nanovlákenné struktury pomocí sprejování navíc podporuje prorůstání buněk do 3D struktury.
Klíčová slova:
trombocyty, elektrostatické zvlákňování, tkáňový nosič, nanovlákna, polykaprolaktonÚvod
Tkáňové inženýrství je interdisciplinární obor, který využívá znalostí přírodních věd a inženýrství pro vývoj biologických náhrad, které slouží k obnově, zachování či zlepšení funkcí tkání nebo orgánů (1). Jedním z jeho úkolů je vyvinutí struktur, které svými vlastnostmi a strukturou vytvoří konstrukci s vhodnými podmínkami a prostředím pro proliferaci buněk in vitro a pro snadnou obnovu tkáně in vivo. Nanovlákenné tkáňové nosiče (scaffoldy) svoji strukturou napodobují nativní extracelulární matrix (2), poskytují v těle mechanickou integritu a strukturální podporu tkáně, prostor pro buněčnou adhezi a regulaci funkce buněk (tvar, proliferace, migrace, diferenciace) (3). Pro tkáňové inženýrství jsou v současnosti vyvíjeny tkáňově specifické biodegradabilní nanovlákenné scaffoldy například metodou elektrostatického zvlákňování (2–4).
Buňky na povrch nanovlákenných struktur snadno adherují a v ideálním případě prorůstají do vnitřních vrstev jejich struktury. Proliferaci buněk do vnitřní struktury scaffoldů je možné stimulovat např. destičkovými růstovými faktory (PDGF = destičkový růstový faktor, TGFB1 = transformující růstový faktor beta 1, IGF1= inzulinu podobný růstový faktor 1, FGF1= fibroblastový růstový faktor 1, EGF = epitelový růstový faktor, VEGF = vaskulární endotelový růstový faktor), jejichž zdrojem může být plazma bohatá na trombocyty (PRP). Použití PRP je v klinické praxi známé, např. v ortopedických aplikacích se využívá pro urychlení procesu hojení [5]. Integrace krevních destiček do nanovlákenných scaffoldů tak může vést ke vzniku materiálu s velkým potenciálem pro použití v tkáňovém inženýrství.
Materiál a metodika
Materiály
Polykaprolakton (PCL) s molekulovou hmotností 45 000 (Sigma Aldrich) byl rozpuštěn v systému chloroform/etanol v poměru 9 : 1 o koncentraci 18 hm%.
Suspenze trombocytů (TRS = Thrombocyte Rich Solution) byla připravena Transfuzním oddělením Krajské nemocnice v Liberci. Pro experimenty byly použity 2 různé koncentrace trombocytů: 626 x 106/ml (TRSA) a 60 x 106 (TRSB). Veškerá manipulace s trombocyty byla prováděna za sterilních podmínek.
Elektrostatické zvlákňování
Nanovlákenná vrstva z polykaprolaktonu byla připravena pomocí zvlákňovacího zařízení Nanospider model 1WS500U. Tato vrstva byla po sterilizaci v 70% etanolu po dobu 30 minut a po promytí fosfátovým pufrem (PBS, pH 7,4) následně modifikována smáčením v suspenzi trombocytů.
Pro srovnání účinnosti inkorporace trombocytů do nanovlákenné struktury bylo provedeno elektrostatické zvlákňování z jehly se současným sprejováním roztoku trombocytů mezi vznikající nanovlákna. Tento postup byl zvolen vzhledem možnosti provedení v laminárním boxu za sterilních podmínek. Schéma experimentu je znázorněno na obrázku. 1. Vzdálenost mezi jehlou a kolektorem byla 12 cm, použité napětí mělo hodnotu 16 kV. Teplota během procesu zvlákňování byla 23,6 °C a relativní vlhkost vzduchu 21 %.
Obr. 1. Elektrostatické zvlákňování bylo prováděno v laminárním boxu kvůli zajištění sterilních podmínek. Polymerní roztok byl umístěn ve stříkačce (1) s kladně nabíjenou jehlou (2). Vznikající nanovlákna byla sbírána na uzemněný kolektor (3). Suspenze trombocytů (4) byla sprejována mezi vznikající nanovlákna v 5minutových intervalech během celého procesu zvlákňování. 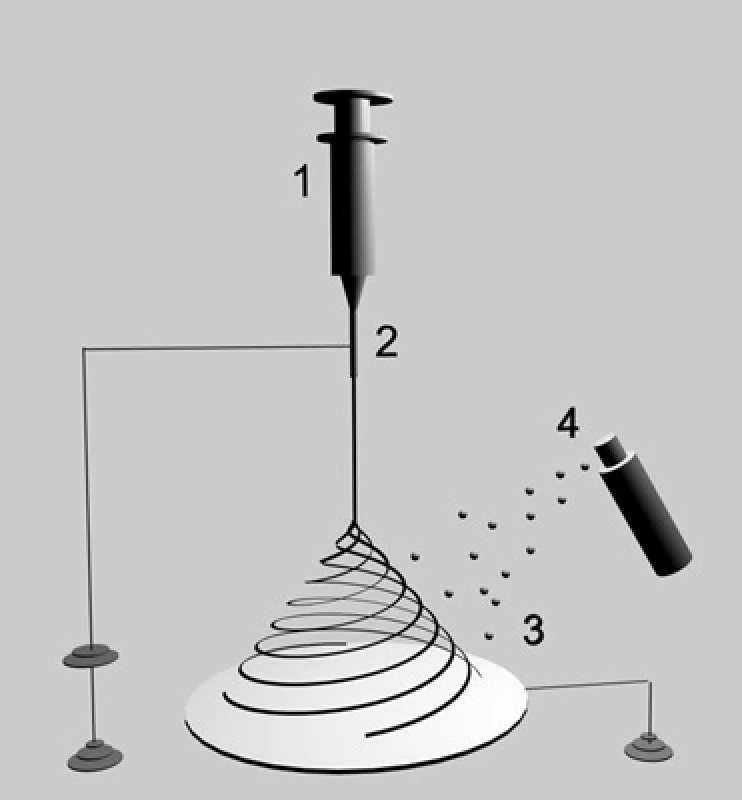
Modifikace nanovlákenného tkáňového nosiče
Modifikace nanovlákenného tkáňového nosiče byla provedena dvěma metodami: (1) nanovlákenný scaffold byl smáčen v roztoku trombocytů, (2) suspenze trombocytů byla sprejována na materiál během procesu elektrostatického zvlákňování, což vedlo k imobilizaci trombocytů uvnitř 3D struktury.
Z nanovlákenných vrstev byly připraveny kruhové vzorky s průměrem 6 mm, jejichž velikost odpovídá rozměrům 96jamkové kultivační destičky. Vzorky byly rozděleny do 3 skupin: kontrolní (K), vzorky smáčené v roztoku obsahujícím vyšší koncentraci trombocytů (TRSA) a vzorky smáčené v roztoku s nižší koncentrací trombocytů (TRSB). Scaffoldy byly ponechány v suspenzi trombocytů po dobu 2 hodin. Po inkubaci byly vzorky promyty PBS a osázeny myšími 3T3 fibroblasty a lidskými dermálními fibroblasty (NHDF).
Při modifikaci nanovlákenné vrstvy pomocí sprejování suspenze trombocytů (TRSA) byly trombocyty přidávány do vznikající nanovlákenné vrstvy v pravidelných intervalech 5 minut. Vzniklá vrstva byla vytvořena z 5,5 ml polymerního roztoku a 7 ml roztoku trombocytů. Jako kontrola sloužila nanovlákenná vrstva vyrobená za stejných podmínek bez přídavku trombocytů.
In vitro testy
Myší 3T3 fibroblasty (ATCC) byly kultivovány v médiu složeném z Dulbecco´s Modified Eagles Medium (DMEM, Lonza), 10 % fetálního bovinního séra (FBS, Lonza) a 1% penicilin/streptomycin/amfotericin B (Lonza).
Lidské dermální fibroblasty (NHDF, Lonza) byly kultivovány ve Fibroblast Basal Medium (FBM, Lonza) obohaceném o FBS, inzulin, růstový faktor fibroblastů a směs antibiotik (Lonza).
Buňky byly kultivovány v inkubátoru při 37 °C v atmosféře 5% CO2. Fibroblasty 3T3 byly nasazeny v koncentraci 104 buněk/testovací jamka, NHDF byly nasazeny v koncentraci 5 x 104/jamka. Médium bylo měněno 3x týdně během celého pokusu (14 dní).
Měření buněčné viability
Viabilita buněk byla měřena pomocí MTT testu po 1, 4, 7 a 14 dnech od nasazení buněk. Princip MTT testu spočívá v redukci MTT [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromid] metabolicky aktivními buňkami na fialový formazan. K osazeným scaffoldům bylo přidáno 50 µl roztoku MTT (2 g/l v PBS, Lonza) a 150 µl příslušného kultivačního média, vzorky byly inkubovány v inkubátoru (37 °C, 5% CO2) po dobu 4 hodin. Vzniklé krystaly formazanu byly rozpuštěny přidáním 200 µl isopropanolu. Viabilita buněk byla určena pomocí měření absorbance roztoku vzniklého po rozpuštění formazanu při 570 nm. Jako referenční hodnota byla měřena absorbance při 650 nm. Výsledná hodnota absorbance vynesená v grafu je rozdíl A570nm-A650nm. Rovněž samotné imobilizované trombocyty vykazují metabolickou aktivitu a je nutné odlišit metabolickou aktivitu fibroblastů a trombocytů. Proto scaffoldy s adherovanými trombocyty sloužily jako negativní kontroly, které byly odečteny od celkové absorbance. Výsledná absorbance tedy odráží pouze metabolickou aktivitu fibroblastů.
Rastrovací elektronová mikroskopie (SEM)
Jednotlivé vzorky určené pro SEM analýzu byly nejprve zafixovány ve 2,5% roztoku glutaraldehydu (15 minut, 4 °C) a poté odvodněny vzrůstající etanolovou řadou (60%, 70%, 80%. 90%. 96% a 100%). Před samotnou analýzou byly vzorky pozlaceny a pozorovány pomocí elektronového mikroskopu SEM Phenom-World.
Výsledky
Adheze trombocytů na povrch nanovlákenného scaffoldu (modifikace PCL pomocí smáčení v roztoku trombocytů)
Nanovlákenné vzorky byly ponořeny do suspenze trombocytů po dobu 2 hodin. Snímky z elektronové mikroskopie (obr. 2) potvrzují přítomnost trombocytů na povrchu nanovlákenné vrstvy. Viabilita trombocytů adherovaných na nanovlákennou vrstvu byla prokázána také pomocí MTT testu. Na grafu 1 můžeme vidět nízkou hodnotu absorbance u kontrolních vzorků (vzorky bez buněk) a u vzorků smáčených v roztoku s nižší koncentrací trombocytů (TRSB). Tato koncentrace trombocytů nebyla pomocí MTT testu detekovatelná (absorbance < 0,06). Při použití roztoku s vyšší koncentrací trombocytů (TRSA) byla naměřená hodnota absorbance vyšší, což vypovídá o přítomnosti živých, metabolicky aktivních trombocytů. Viabilita trombocytů s časem klesá a po 7 dnech je na stejné úrovni jako u kontrolních vzorků (vzorky bez trombocytů).
Obr. 2. Trombocyty adherované na povrch nanovlákenné PCL vrstvy (zvětšení 10 000x). 
Obr. 3. Snímky z elektronové mikroskopie: lidské dermální fibroblasty na kontrolní nanovlákenné PCL vrstvě po 7 dnech (a) a 14 dnech kultivace (b); lidské dermální fibroblasty na vrstvě modifikované vyšší koncentrací trombocytů (TRSA) po 7 (c) a 14 dnech kultivace (d). 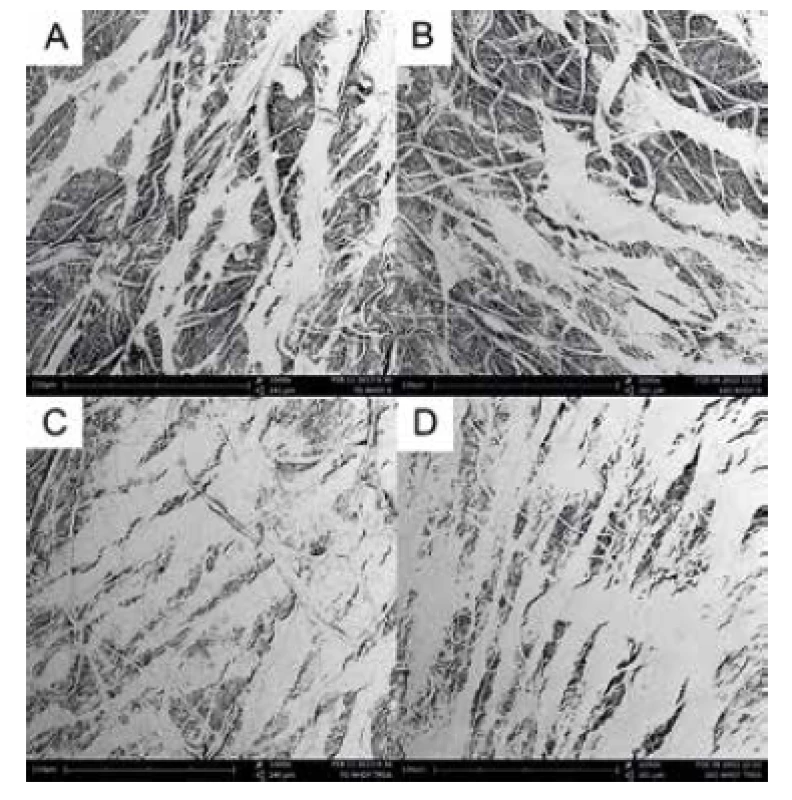
Viabilita fibroblastů u kontrolních a modifikovaných scaffoldů byla měřena pomocí MTT testu. Na grafech 2 a 3 jsou znázorněny výsledky MTT testu po 1, 4, 7 a 14 dnech inkubace. U obou použitých buněčných typů (3T3 a NHDF) byl zaznamenán podobný trend v nárůstu absorbance odpovídající počtu metabolicky aktivních buněk na scaffoldu během 14denní inkubace. Vzorky preinkubované v roztoku trombocytů (TRSA a TRSB) vykazovaly vyšší hodnoty absorbance, přítomnost trombocytů tedy pozitivně ovlivnila proliferaci fibroblastů. V případě použití vyšší koncentrace trombocytů (TRSA) byly hodnoty absorbance vyšší, zvláště u lidských dermálních fibroblastů (graf 3).
Graf 1. Výsledky MTT testu kontrolních vzorků (K), vzorků smáčených ve vyšší koncentraci trombocytů (TRSA) a v nižší koncentraci trombocytů (TRSB). 
Graf 2. Výsledky MTT testu po 1, 4, 7 a 14 dnech kultivace nanovlákenné PCL vrstvy osázené myšími 3T3 fibroblasty. 
Graf 3. Výsledky MTT testu po 1, 4, 7 a 14 dnech kultivace nanovlákenné PCL vrstvy osázené lidskými dermálními fibroblasty. 
Buněčná proliferace byla potvrzena rovněž elektronovou mikroskopií. Buňky se množily na povrchu nanovlákenné struktury a po týdnu již pokrývaly téměř celý povrch scaffoldu (viz obr. 3). Výsledky elektronové mikroskopie se shodují s výsledky MTT testu, kdy proliferace buněk byla vyšší u vzorků, které byly modifikovány přídavkem trombocytů, zejména pak při použití vyšší koncentrace (TRSA).
Metoda rozprašování trombocytů mezi nanovlákna
Na základě výsledků předchozích pokusů byla zvolena pro další testování pouze vyšší koncentrace trombocytů (TRSA) a lidské dermální fibroblasty. Modifikovaná vrstva byla vyrobena pomocí pravidelného sprejování trombocytů mezi vznikající nanovlákna. Vzorky byly osázeny NHDF buňkami a kultivovány po dobu 14 dnů. Viabilita buněk byla měřena pomocí MTT testu po 1, 4, 7 a 14 dnech kultivace. Naměřená absorbance odpovídající počtu živých buněk byla vyšší u vzorků modifikovaných trombocyty (graf 4).
Graf 4. Výsledky MTT testu nanovlákenné PCL vrstvy a vrtsvy modifikované nasprejovanými trombocyty po 1,4, 7 a 14 dnech kultivace s lidskými dermálními fibroblasty. 
Přítomnost nativních trombocytů byla potvrzena MTT testem s podobnými výsledky jako při smáčení suspenzi trombocytů: hodnota absorbance u vzorků modifikovaných trombocyty poklesla po 7 dnech na hodnotu srovnatelnou s hodnotou absorbance kontrolních vzorků (vzorky bez buněk).
Adheze fibroblastů na nanovlákennou strukturu byla sledována také pomocí elektronové mikroskopie. Na obrázku 4 jsou znázorněny lidské fibroblasty 24 hodin po nasazení buněk na tkáňový nosič. Zdá se, že buňky na vrstvě modifikované trombocyty mají tendenci prorůstat do vnitřní struktury scaffoldu.
Obr. 4. Lidské dermální fibroblasty po jednodenní kultivaci na PCL nanovlákenné vrstvě (a) a na vrstvě modifikované trombocyty (b). 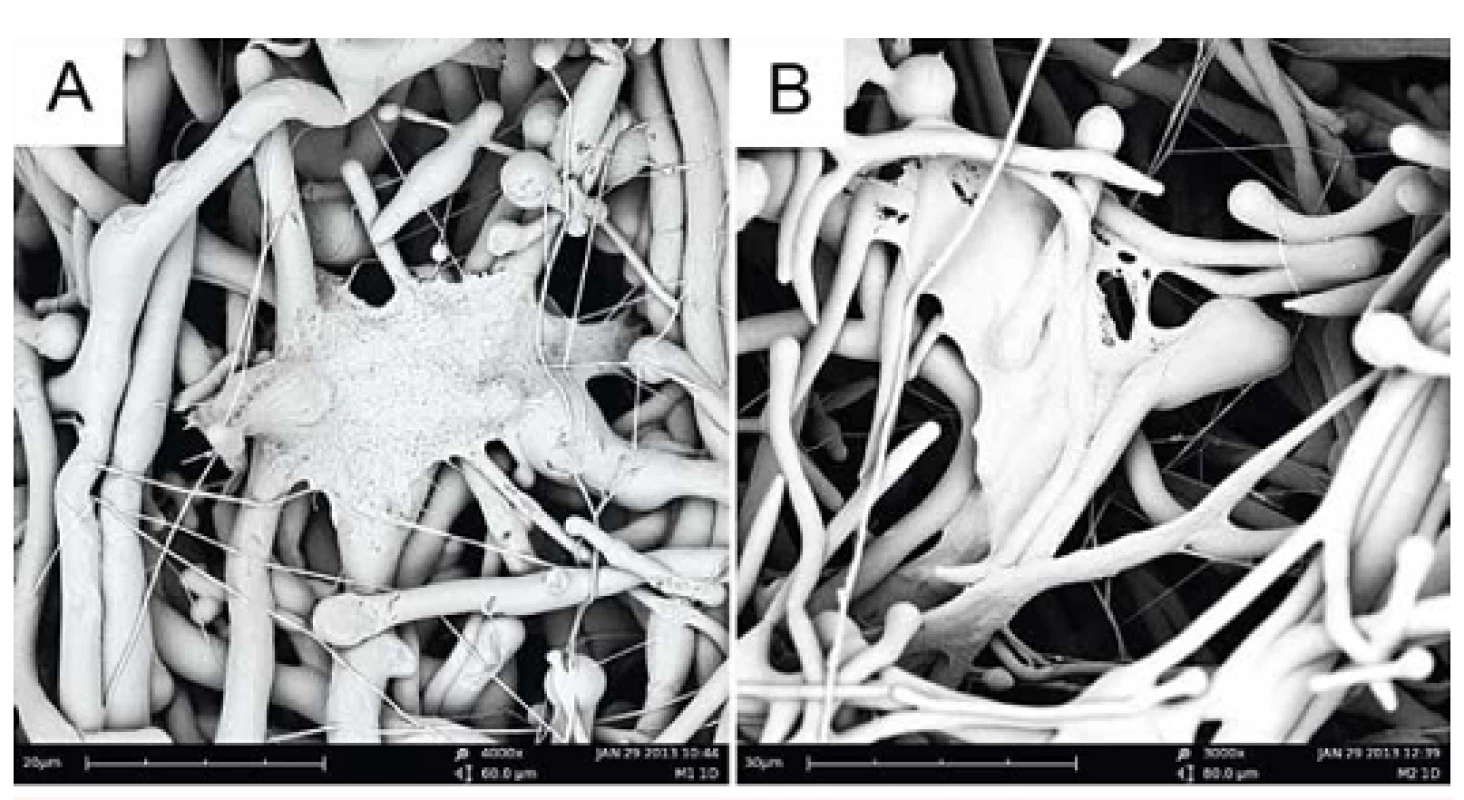
Diskuse
Adheze trombocytů na povrch nanovlákenného scaffoldu (modifikace PCL pomocí smáčení v roztoku trombocytů)
Adheze trombocytů na povrch nanovlákenné struktury proběhla úspěšně již během 2 hodin, jak potvrzuje i studie Jakubova, et al. (7). Adherované trombocyty zobrazené na obrázku 2 vykazovaly také metabolickou aktivitu naměřenou pomocí MTT testu (graf 1). Životnost trombocytů v průběhu pokusu klesala, po 7 dnech již absorbance poklesla na hodnotu srovnatelnou s kontrolními vzorky bez modifikace trombocyty. Tato skutečnost je v souladu s životností krevních destiček (7–11 dní) (8).
Ke zjištění účinnosti růstových faktorů a jejich vlivu na buněčnou proliferaci bylo využito 2 buněčných typů: 3T3 myší fibroblasty a lidské dermální fibroblasty. Lidské krevní destičky, resp. jejich růstové faktory měly pozitivní vliv na proliferaci obou buněčných typů. Tato skutečnost již byla potvrzena i na jiných buněčných typech, konkrétně Jakubova, et al. potvrdili zvýšení proliferace chondrocytů (6), Slapnička, et al. se věnoval vlivu růstových faktorů na množení lidských osteoblastů (7).
Metoda rozprašování trombocytů mezi nanovlákna
Kombinace metod elektrostatického zvlákňování se současným sprejováním suspenze trombocytů umožňuje homogenní rozptýlení trombocytů do celého objemu nanovlákenné vrstvy. Trombocyty tak nejsou pouze na povrchu scaffoldu, jako tomu bylo u předchozí modifikace, ale v celém objemu struktury, což by mohlo napomoci prorůstání buněk do celé struktury tkáňového nosiče.
Obecným problémem nanovlákenných struktur jsou omezené možnosti prorůstání buněk dovnitř 3D struktur. Díky velmi jemným vláknům jsou ve struktuře příliš malé póry omezující schopnost buněk infiltrovat se dovnitř tkáňového nosiče a vytvořit tak funkční 3D strukturu (8). Růstové faktory imobilizované uvnitř scaffoldu by mohly napomoci buněčné migraci nejen po povrchu scaffoldu, ale zejména do jeho vnitřku. Pro vytvoření takové struktury byla využita unikátní technologie - spojení elektrostatického zvlákňování ve sterilním prostředí laminárního boxu současně se sprejováním suspenze trombocytů mezi vznikající nanovlákna.
Výsledky potvrdily naši hypotézu, že přítomnost trombocytů měla pozitivní vliv na proliferaci lidských dermálních fibroblastů. Po 14 dnech kultivace byla hodnota absorbance modifikované vrstvy vyšší než u vrstvy kontrolní neobsahující trombocyty. Snímky pořízené elektronovým mikroskopem naznačují, že adheze buněk na kontrolní materiál probíhá pouze na jeho povrchu, zatímco u vrstvy modifikované trombocyty můžeme sledovat prorůstání buněk dovnitř struktury (obr. 4). Toto tvrzení je však potřeba podložit dalšími experimenty.
Závěr
Růstové faktory trombocytů byly využity pro cílenou podporu buněčné proliferace na nanovlákenných scaffoldech vyrobených z biodegradabilního polymeru polykaprolaktonu. Nanovlákenné struktury obecně podporují adhezi buněk díky podobnosti s mezibuněčnou hmotou tvořenou převážně kolagenovými vlákny. Problémem však bývá rovnoměrné rozmístění buněk a jejich prorůstání do vnitřní nanovlákenné struktury. Růstové faktory uvolňující se z krevních destiček mají pozitivní vliv na buněčnou proliferaci a slouží jako bioaktivní molekuly pro fibroblasty. Inkorporace destiček do nanovlákenné struktury může být provedena jednak jejich pouhou adsorpcí na povrch, popř. jejich sprejováním během samotného procesu zvlákňování. Tato metoda umožňuje inkorporaci trombocytů do celého objemu scaffoldu. Pozitivní vliv na proliferaci fibroblastů byl potvrzen testem metabolické aktivity MTT i mikroskopicky. Následné experimenty budou zkoumat vliv faktorů na buněčnou proliferaci s využitím konfokální fluorescenční mikroskopie, která umožňuje sledování hlubších vrstev nanovlákenné struktury.
Podíl autorů na rukopisu
JH: provedení experimentu, napsání rukopisu
RP: příprava TRS, kontrola a revize rukopisu
VJ: účast na provedení experimentu (in vitro testování), kontrola rukopisu
PM: účast na provedení experimentu (elektrostatické zvlákňování a jeho modifikace)
CM: účast na provedení experimentu
Mgr. Jana Horáková
Fakulta textilní, Katedra netkaných textilií a nanovlákenných materiálů
Studentská 2
461 17 Liberec 1
e-mail: jana.horakova@tul.cz
Doručeno do redakce: 7. 8. 2014
Přijato po recenzi: 28. 8. 2014
Zdroje
1. Langer R, Vacanti JP. Tissue engineering. Science 1993; 260 : 920-926.
2. Dahlin RL, Kasper FK, Mikos AG. Polymeric Nanofibers in tissue engineering. Tissue Engineering: Part B 2011; 17 : 349-364.
3. Beachley V, Wen X. Polymer nanofibrous structures: Fabrication, biofunctionalization, and cell interactions. Progress in Polymer Science 2010; 35 : 868-892.
4. Jirsak O, Sanetrnik F, Lukas D, Kotek V, Martinova L, Chaloupek J. A method of nanofibres production from a polymer solution using electrostatic spinning and a device for carrying out the method, US Patent, WO2005024101.
5. Frei R, Biosca FE, Handl M, Trc T. Funkce růstových faktorů v lidském organismu a jejich využití v medicíně, zejména v ortopedii a traumatologii. Acta chirurgiae orthopaedicae et traumatologeae čechosl.: Klinika dětské a dospělé ortopedie a traumatologie 2. LF UK a FN Motol 2008; 75 : 247-252.
6. Jakubova R, Mickova A, Bugzo M, et al. Immobilization of thrombocytes on PCL nanofibres enhances chondrocyte proliferation in vitro. Cell Proliferation 2011; 44 : 183-191.
7. Slapnička J. Vliv aktivované a neaktivované plazmy bohaté na trombocyty (PRP) na proliferaci lidských osteoblastů a fibroblastů in vitro. Praha 2009. Doktorandská disertační práce. Masarykova univerzita. Lékařská fakulta.
8. Nam J, Huang Y, Agarwal S, Lannutti J. Improved cellular infiltration in electrospun fiber via engineering porosity, Tissue Engineering 2007; 13 : 2249-57.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2014 Číslo 3- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Vliv trombocytových růstových faktorů na proliferaci fibroblastů na nanovlákenném tkáňovém nosiči
- Případ diferenciální diagnostiky pancytopenie
- Extrakorporální eliminace cholesterolu u familiární hypercholesterolemie – srovnání dvou metodik.
- AL amyloidóza v obrazech
- Epidemiologie a rizikové faktory spojené s Hodgkinovým lymfomem
- Effect of body mass in children with hematologic malignancies undergoing allogeneic bone marrow transplantation
- D-dimer to guide the duration of anticoagulation in patients with venous thromboembolism: a management study
- Dexamethasone (6 mg/m2/day) and prednisolone (60 mg/m2/day) were equally effective as induction therapy for childhood acute lymphoblastic leukemia in the EORTC CLG 58951 randomized trial
- Diagnostic and risk criteria for HSCT-associated thrombotic microangiopathy: a study in children and young adults
- Validation and refinement of the Disease Risk Index for allogeneic stem cell transplantation
- Erythropoietin therapy after allogeneic hematopoietic cell transplantation: a prospective, randomized trial
- Molecular analysis of Fanconi anemia: the experience of the Bone Marrow Failure Study Group of the Italian Association of Pediatric Onco-Hematology
- Immunodeficiency scoring index to predict poor outcomes in hematopoietic cell transplant recipients with RSV infections
- Outcome and management of pregnancies in severe chronic neutropenia patients by the European Branch of the Severe Chronic Neutropenia International Registry
- Outcome of patients with abnl(17p) acute myeloid leukemia after allogeneic hematopoietic stem cell transplantation
- Allogeneic hematopoietic stem cell transplantation in patients with polycythemia vera or essential thrombocythemia transformed to myelofibrosis or acute myeloid leukemia: a report from the MPN Subcommittee of the Chronic Malignancies Working Party of the European Group for Blood and Marrow Transplantation
- Platelet diameters in inherited thrombocytopenias: analysis of 376 patients with all known disorders
- Postthrombotic syndrome following upper extremity deep vein thrombosis in children
- Poděkování členům minulého výboru České hematologické společnosti.
- Nový výbor České hematologické společnosti
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Případ diferenciální diagnostiky pancytopenie
- AL amyloidóza v obrazech
- Epidemiologie a rizikové faktory spojené s Hodgkinovým lymfomem
- Vliv trombocytových růstových faktorů na proliferaci fibroblastů na nanovlákenném tkáňovém nosiči
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



