-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Anémie/Cytopenie
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. Supplementum1, p. 92-98.
Kategorie: 30. Olomoucké hematologické dny
3006. Nové poznatky v etiopatogenezi a léčbě imunitní anemie a trombocytopenie
Kozák T.
(Interní hematologická klinika, 3. LF Univerzity Karlovy v Praze a FN Královské Vinohrady, Praha)
Autoimunitní hemolytická anémie (AIHA) je způsobena rozpadem erytrocytů díky aktivitě autoprotilátek s aktivací komplementu nebo bez ní. Diagnostika AIHA je souhrnem klinických a laboratorních nespecifických a specifických vyšetření a opírá se zejména o průkaz autoprotilátek navázaných na erytrocyty, tzv. přímý antiglobulinový (Coombsův) test (PAT). Negativní výsledek PAT však ještě AIHA nevylučuje. Více než polovina AIHA je spojena s jiným, základním, onemocněním, jde o sekundární AIHA. AIHA vzniká u vice než 10% pacientů se SLE, u 18% pacientů s původně idiopatickou AIHA se vyvine maligní lymfom. Podle teploty, při níž reagují autoprotilátky s erytrocyty, se rozlišuje AIHA s tepelnými protilátkami (tzv. WA-AIHA), které se vážou na erytrocyt při teplotě 37°C, a AIHA s chladovými protilátkami (CA-AIHA), jejichž optimální teplota pro vazbu na erytrocyt je pod 30°C. AIHA s bifázickými protilátkami se vyskytuje např. u paroxysmální chladové hemoglobinurie (PCH). Incidence WA-AIHA je 1 : 100 000, CA-AIHA je ještě vzácnější onemocnění s incidencí 1 : 1000000. Pro klinický průběh AIHA je důležitý typ autoprotlátky. IgM protilátky dobře aktivují komplement, stejně tak isotypy IgG1 a IgG3. Protilátky IgG2 a IgA aktivují komplement slabě, a isotypy IgG4 komplement neaktivují. Protilátky CA-AIHA jsou většinou IgM, mají tendenci vázat komplement a pokud reagují při teplotě blízké 30°C, jsou klinicky významné. Erytrocyty s navázanými protilátkami IgG za přítomnosti komplementu C3c/C3d nebo bez něho jsou po vazbě na receptor Fc fagocytovány ve slezině, erytrocyty s navázaným smotným kompementem C3c/C3d jsou destruovány v játrech (extravaskulární hemolýza). Vazba IgM na povrch erytrocytu při teplotě blízké 30°C může vyvolat aktivaci komplementu až C6-9 (membránu atakující komplex - MAC) a způsobit hemolýzu intravaskulární. Diagnóza AIHA je postavena na klinickém průběhu s manifestací anemického syndromu a laboratorních nálezech. Pro akutní AIHA jsou v nátěru periferní krve typické mikrosférocyty a při delším trvání makrocyty. Retikulocytóza je typická, ale může chybět v akutní fázi, stejně tak v situaci, kdy je kostní dřeň insuficientní (např. při infiltraci nebo po chemoterapii). V séru je zvýšená hladina nepřímého bilirubinu, v moči urobilinogen, při intravaskulární hemolýze je přítomna hemoglobinurie s detekovatelným hemosiderinem v moči i řadu dní po příhodě. Obvykle je přítomna výrazně zvýšená hladina LDH, nicméně její normální hodnota hemolýzu nevylučuje, je snížen haptoglobin, je pozitivní PAT. Ve vzácných případech s klinicky jasnou AIHA není zachycena pozitivita v PAT. V tomto případě může pomoci např. nátěr krevního obrazu, přítomnost mikrosférocytů v něm podporuje diagnózu AIHA bez detekovatelných protilátek. Při léčbě AIHA stále platí tři zásady:
- snažíme se vyhnout podávání transfuzí, pro riziko reakce s event. aloprotilátkami, neboť aloprotilátky v séru pacienta jsou z klinického hlediska důležitější než autoprotilátky - mohou vyvolat fulminantní hemolýzu.
- Sekundární AIHA léčíme s ohledem na základní onemocnění
- Imunosupresivní terpie je základní přístup k léčbě idiopatické AIHA
První linie léčby WA-AIHA obsahuje vždy kortikosteroidy. U steroid-refrakterních forem lze použít Rituximab, který v 2. linii na mnohých pracovištích nahradil splenektomii, ta je ale stále jednou z možných léčebných modalit. IVIG je možné použít u jinak nezvladatelné akutní AIHA, efektivní dávky však musí být často ještě vyšší než u ITP. Cytostatika s imunosupresivním potenciálem (cyklofosfamid, azathioprin) lze také použít u refrakterní AIHA, ale s nejistým efektem. Výzvou stale zůstává terapie symptomatické CA-AIHA, u které bývají kortikosteroidy a splenektomie bez efektu. Účinek má cyklofosfamid a zejména Rituximab, příznivý efekt byl popsán též u kombinace Rituximab + Bendamustin a také kombinace fludarabinu s Rituximabem byla úspěšně použita v léčbě CA-AIHA. U refrakterních forem je možné zvážit plazmaferézu, anekdotické údaje jsou o pozitivním efektu eculizumabu.
Patogeneze imunitní trombocytopenie má několik složek a úrovní, které zahrnují jak časnou destrukci trombocytu vlivem navázaných protilátek, tak nedostatečnou trombopoezu v kostní dřeni. Specifita protilátek může být u ITP heterogenní, protilátky mohou být namířeny proti jednomu, dvěma nebo i více antigenům destičkového povrchu, většina autoprotilátek u ITP je namířena proti GPIIb/IIIa a GPIb/IX, přitom konformace GP IIb/IIIa není, na rozdíl od GPIb/IX, stabilní. Protilátky proti GPIb/IX se vyskytují u 20-40% pacientů s ITP, patofyziologie jejich působení je zcela odlišná od běžnějších protilátek anti-IIb/IIIa. Protilátky proti glykoropteinu Ib (GPIb) působí destrukci trombocytu mechanismem nezávislým na Fcγ receptoru makrofágu, vedou jednak k vyšší expresi P - selektinu, tím k aktivaci trombocytu, jednak k desialylaci glykoproteinů destičkové membrány, zejména transmembránového uhlovodíkového zbytku GPIbα. Pozměněná struktura antigenu GPIb je rychle detekována jinými typy receptorů než Fcγ, zejména tzv. Aswell – Morellovým receptorem hepatocytu. V případě ITP s autoprotilátkami anti-Ib/IX tak zanikají trombocyty převážně v játrech, ale ne působeních jaterních makrofágů, ale přímo v hepatocytech. Tento mechanismus také vysvětluje pomalou nebo žádnou odpověď na léčbu kortikosteroidy a/nebo IVIG u některých pacientů s ITP. Sialidáza, která způsobuje desialylaci glykoporoteinů destičkové membrány je přítomna v trombocytu v relativně vysoké koncentraci a je možné ji inhibovat přirozenými nebo syntetickými inhibitory sialydáz. Přirozenou sialydázou je u savců lysozomální Neuraminidáza 1 (NEU1). Sialydázy produkuje řada baktérií a virů. Desialylace trombocytů a jejich zkrácené přežívání je prokázaným mechanismem vzniku trombocytopenie u těžkých pneumokových infekcí a u infekce Trypanosoma cruzi (Chagasova choroba), předpokládá se také, že tímto mechanismem vzniká trombocytopenie u infekce virem chřipky. Syntetickými inhibitory jsou DANA (2-deoxy-2,3-didehydro-N-acytelneuraminová kyselina) a také oseltamivir fosfát, užívaný primárně k léčbě infekce chřipkovým virem A a B. Existuje již také několik kazuistik o efektu oseltamiviru v léčbě refrakterní ITP.
Standardní léčba 1. linie ITP se stále opírá o kortikosteroidy, v poslední době jsou preferované spíše p.o., např. Prednison v dávce 0,5 – 2 mg/kg/den. V emergentních situacích je třeba aplikovat vysoké dávky IVIG spolu s kortikosteroidy a při život ohrožujícím krvácení též trombocyty. Léčba druhé linie je spojena s přetrvávajícím dilematem dnešní terapie ITP a tím je splenektomie oproti farmakoterapii. Realitou je, že v posledních letech ve druhé linii léčby ITP je příklon k léčbě nechirurgické, často používaným přípravkem je Rituximab. Splenektomii je obecně doporučeno provádět nejdříve 6 měsíců od diagnózy, u dětí po 12 měsících. Až 2/3 pacientů nemusí mít po splenektomii další léčbu ITP. V léčbě chronické ITP, která je refrakterní k jiným způsobům léčby, se s úspěchem požívají TPO agonisté, t.č. Romiplostim nebo Eltrombopag, které dosahují odpovědi přes 80%. Jejich podávání musí být dlouhodobé, po vysazení dochází u většiny pacientů opět k poklesu počtu trombocytů.
3004. Vrozené syndromy selhání kostní dřeně – současný pohled
Pospíšilová D.
(Dětská klinika, FN a LF UP, Olomouc)
Do skupiny vrozených syndromů selhání kostní dřeně (inherited bone marrow failure syndromes, IBMFS) jsou řazeny vzácné poruchy krvetvorby charakterizované: - geneticky podmíněným selháním funkce jedné nebo více hematopoetických linií (erytrocytární, granulocytární nebo trombocytární); - vrozenými anomáliemi nebo funkčními poruchami postihujícími různé tkáně a orgány: kůži, skelet, srdce, plíce, ledviny, centrální nervový systém, často doprovázené i malým vzrůstem; - zvýšeným rizikem vzniku maligních onemocnění: nejčastěji Akutní myeloidní leukémie (AML), Myelodysplastického syndromu (MDS) nebo solidních nádorů. Společným rysem těchto onemocnění je výrazná fenotypová variabilita jak hematologických tak i somatických změn. Závažnější formy onemocnění se zřetelnými vrozenými anomáliemi, časnou manifestací cytopenií a rozvojem selhání kostní dřeně jsou obvykle diagnostikovány již v časném dětství v kojeneckém, batolecím nebo předškolním věku. Lehčí formy s nenápadnými anomáliemi a pozdní manifestací cytopenií mohou na druhé straně dlouho unikat pozornosti a jsou potom diagnostikovány až v dospělosti nebo dokonce až při vypuknutí maligního onemocnění. Znalost příznaků těchto vzácných nemocí je proto velmi důležitá pro jejich včasnou diagnostiku a správnou volbu léčebného postupu. Do skupiny vrozených syndromů setkání kostní dřeně jsou řazena následující onemocnění: Fanconiho anémie (FA), Dyskeratosis congenita (DC), Diamondova-Blackfanova anémie (DBA), Shwachmanův-Diamondův syndrom (SDS), Těžká vrozená neutropenie (SCN), Syndrom hypoplastických chrupavek a vlasů (Cartilage - hair hypoplasia - CHH), Amegakaryocytární trombocytopenie (CAMT), Trombocytopenie s chyběním radia (TAR), Pearsonův syndrom (PS). Některá z těchto onemocnění byla definována na molekulární úrovni teprve v posledních letech díky rychlému rozvoji metod molekulární genetiky. Na jejich vzniku se podílejí mutace „provozních genů“ (housekeeping genes), které kódují proteiny účastnící se čtyř důležitých regulačních buněčných systémů: reparace DNA (FA), udržování délky telomer (DC), biogeneze ribozomů (DBA, SDS, RD, DC) a regulace buněčného cyklu. Většinou se tedy nejedná o nitrobuněčné procesy specifické pouze pro hematopoezu a poruchy těchto důležitých dějů mají dopad i na řadu jiných buněčných systémů. Autorka podává přehled nejnovějších znalostí o jednotlivých skupinách uvedených onemocnění včetně přehledu dosud popsaných genetických změn.
2879. Etiológia, diagnostika a liečba sideropenickej anémie v mladšom veku
Rohoň P.
(Hemato-onkologická klinika, FN a LF UP, Olomouc)
Úvod: Anémie z nedostatku železa (Fe), sideropenické anémie (IDA) patria k najčastejším ochoreniam v celosvetovom meradle. Ich charakteristickou črtou je mikrocytóza a hypochrómia erytrocytov. Najohrozenejšou skupinou sú deti a mladé ženy. V detskom veku sa IDA môže podieľať na psychomotorickej retardácii, v dospelosti dochádza často k adaptácii i na nízke hladiny hemoglobínu (Hb) a klinický obraz je nešpecifický, chudobný. Rozvoj IDA je dôsledkom troch vzájomne prepojených procesov: zvýšených nárokov organizmu na Fe, jeho nedostatočného prísunu a krvácania. Vznik tohto ochorenia má i socioekonomický rozmer: v rozvojových krajinách je najčastejšou príčinou nedostatočný prísun Fe a/alebo ochorenia parazitmi, vo vyspelých ekonomikách sú časté chronické krvné straty alebo vegetariánstvo. Diagnostika IDA je vo väčšine prípadov jednoduchá s výnimkou situácií, keď je združená so zápalovými ochoreniami alebo niektorými vzácnymi vrodenými genetickými poruchami. V liečbe sa využívajú soli Fe, ktoré majú pri perorálnom podaní obyčajne veľmi dobrý účinok (nízke hladiny hepcidínu uľahčujú absorpciu Fe). V niektorých prípadoch je limitom perorálnej terapie jej intolerancia. Intravenózna aplikácia Fe umožní rýchlu normalizáciu celkovej hladiny Fe (často už po jednorazovej aplikácii) a je vyhradená pre špecifické situácie.
Patogenéza Fe je esenciálnym prvkom pre život a vyskytuje sa viazané v proteínoch (napr. hemové Fe), ktoré sa podieľajú na mnohých bunkových procesov. Voľné Fe je naopak pre bunku toxické, pretože katalyzuje tvorbu kyslíkových radikálov. Fe má svoj podiel i na regulácii imunitných funkcií, umožňuje ale aj rast baktérií, replikáciu vírusov či proliferáciu nádorových buniek. V organizme je preto zaisťovaná homeostáza Fe (celkové zásoby u dospelého jedinca sa pohybujú okolo 3 - 5 g s denným obratom asi 0,5 mg (zvýšené nároky pri raste, gravidite, menštruácii), väčšina cirkulujúceho Fe však vzniká z rozpadnutých erytrocytov (recyklované Fe). Organizmus dokáže ovplyvňovať spotrebu Fe a stav jeho zásob výhradne reguláciou príjmu, nemá však vytvorené cielené mechanizmy výdaja. Tok Fe v organizme je možné rozčleniť do niekoľkých krokov:
- absorbcia v duodene
- vstrebanie hemového Fe je jednoduchšie (doposiaľ neúplne objasnený mechanizmus), anorganické Fe3+ musí byť redukované na Fe2+ (ferrireduktáza, Dcytb)
- transport Fe do cytoplazmy enterocytu zabezpečuje transmembránový proteín DMT1
- Fe môže zostať v enterocyte (väzba na feritín) alebo je uvoľnené do obehu pomocou ferroportínu (transportuje Fe i z makrofágov či hepatocytov)
- oxidácia Fe2+ na Fe3+ pomocou hefestínu
- transport Fe v plazme
- väzba Fe na transferín (apotransferín), po jeho obsadení dvoma molekulami Fe3+ vzniká holotransferín (saturovaný transferín ~ 30 %)
- utilizácia Fe erytroidnými bunkami
- naviazanie holotransferínu na transferínový receptor povrchu bunky
- tvorba endozómu, uvoľnenie Fe3+ z holotransferínu (následná redukcia erytrocytovou ferrireduktázou na Fe2+) a recyklácia apotransferínu i transferínového receptoru
- uvoľnenie Fe2+ z endozómu (erytrocytová DMT1) a prie-nik do mitochondrie (mitoferín-1), nasleduje inkorporácia do protoporfyrínu IX (pomocou ferochelatázy) a vzniká hem (ten je transportovaný do cytoplazmy a napokon spojený s globínovými reťazcami za vzniku Hb)
- recyklácia Fe (erytrocytov)
- prebieha v makrofágoch sleziny, pečene a kostnej drene; export Fe z makrofágov zaisťuje už zmieňovaný ferroportín a plazmová feroxidáza (ceruloplazmín) umožňuje naviazanie Fe3+ na apotransferín, časť Fe je umiestnená v RES vo forme feritínu
- regulácia homeostázy Fe (hepcidín)
- hepcidín je zrejme kľúčovou molekulou v procese homeostázy Fe, je produkovaný v pečeni a jeho syntéza je ovplyvnená zápalom alebo vysokou koncentráciou Fe
- po naviazaní hepcidínu na ferroportín dochádza k jeho degradácii a zastaví sa uvoľnenie Fe z enterocytov a makrofágov
- deficit Fe či hypoxia majú na produkciu hepcidínu antagonistický účinok
(upravené podľa: Horváthová M, Divoký V in Molekulární hematologie, Galén 2013)
Tab. 1. Príčiny vzniku sideropénie 
Tab. 2. Prehľad laboratórnych ukazovateľov pri IDA 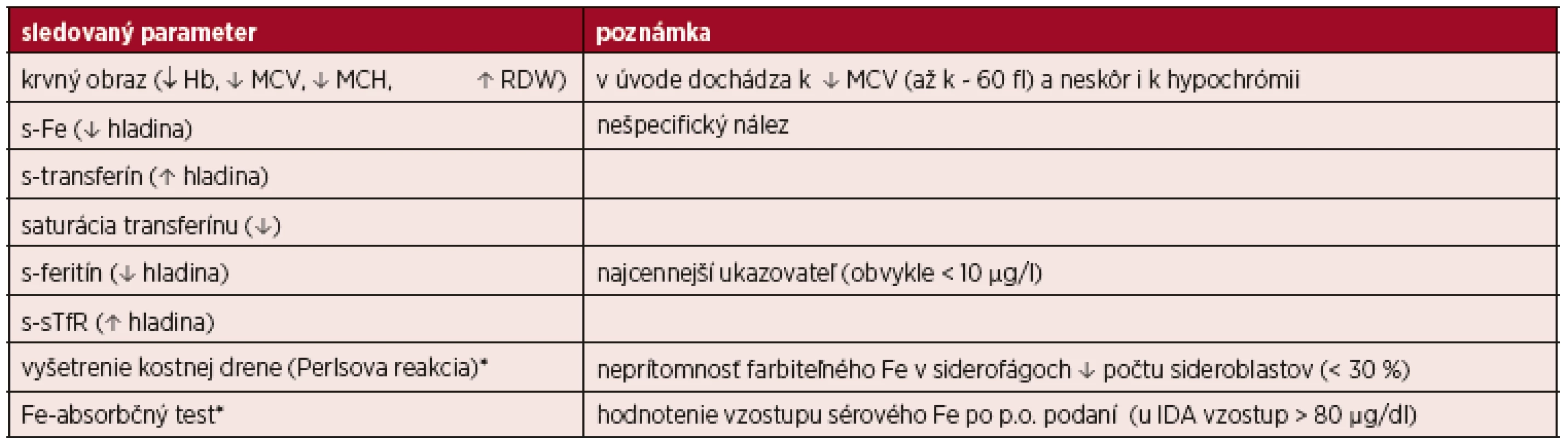
* vyšetrenie v nejasných prípadoch Klinický obraz
Iba malá časť pacientov prichádza k lekárovi pre vlastné príznaky anémie, zreteľné prejavy anemického syndrómu sa prejavia až pri poklese Hb pod 80 g/l a aj v týchto prípadoch sú často nevýrazné (chronický stav s adaptáciou). Vyskytuje sa: bledosť kože a slizníc, pálenie jazyka, zvýšená lámavosť nechtov a koilonychia, ragády ústnych kútikov, Plummer-Vinsonov syndróm (dysfágia a angulárna stomatitída), vzácne tzv. pika.
Diagnostika
Anemické stavy vo všeobecnosti majú celé spektrum príčin a chudokrvnosť je iba zriedkavo konečnou diagnózou ale skôr jedným z rôznorodých prejavov inej choroby. Základom diagnostiky je podrobná anamnéza a komplexné zhodnotenie zdravotného stavu pacienta. V niektorých prípadoch je odhalenie prvotného mechanizmu zložité – najmä vtedy, keď je anémia podmienená multifaktoriálne súbehom viacerých ochorení. Základným prvkom je zhodnotenie hemogramu vrátane retikulocytového indexu a morfológie erytrocytov.
Diferenciálna diagnostika
V prípade mikrocytových (príp. hypochrómnych) anémii je veľmi dôležité zhodnotiť tkanivové zásoby Fe, ktoré dokážu pomôcť pri odlíšení IDA (znížené zásoby) a stavov s normálnymi alebo zvýšenými tkanivovými rezervami (talasémie, anémie chronických chorôb, sideroblastické anémie či niektoré hemoglobínopatie). Dôležitým momentom pre ďalšie diagnostické úvahy je zhodnotenie refrakterity IDA k perorálnej liečbe Fe. Pokiaľ vylúčime základným endoskopickým vyšetrením krvácanie či nadužívanie NSAID je nutný podrobnejší diagnostický prístup.
Liečba
V terapii IDA je najdôležitejšie odstrániť vyvolávajúcu príčinu rozvoja sideropénie. V zásade rozdeľujeme dve formy podania Fe:
- perorálne podanie
- v súčasnosti existuje veľké množstvo preparátov Fe, odporúča sa podanie dvojmocných foriem (sulfáty) 100 - 200 mg Fe/deň
- súčasné podanie kyseliny askorbovej zlepšuje absorbciu Fe
- hodnotenie liečby sa odporúča po 4 - 6 týždňoch (optimálny nárast Hb 0,1g/dl/deň), refrakterita je definovaná ako nedostatočný vzostup po podaní minimálne 100 mg elementárneho Fe počas tohto obdobia
- neodporúča sa ukončiť substitúciu Fe pri normalizácii hladiny Hb ale doplniť i tkanivové zásoby Fe (hladina feritínu by mala byť stabilizovaná > 50 μg/l)
- pri chronických krvných stratách, ktoré nie je možné eliminovať, je nutná intermitentná substitúcia Fe
- intravenózne podanie
- parenterálna liečba Fe je indikovaná v špecifických situáciách – všeobecne pri zlyhaní či refrakterite k perorálnemu podaniu Fe (porucha resorpcie, ochorenia GIT s iritáciou pri perorálnom podaní, významné krvné straty)
- intravenózne preparáty sú pripravené tak, že obsahujú centrálnu (jadrovú) časť s obsahom Fe a schránku z polysacharidového polyméru
- intravenózna liečba musí prebiehať formou pomalej infúzie s možným rizikom rozvoja anafylaktickej reakcie
Tab. 3. Diagnostický prístup pri refrakternej IDA 
IRIDA = iron refractory iron deficiency anemia (upravené podľa: Hershko C, Camaschella C, Blood 2014) Záver: Úlohou hematológa je predovšetkým diagnostika a liečba „nevysvetliteľných“ IDA s dôrazom na refrakterné formy, pri ktorých je nutné prihliadnuť k etiopatogenetickému podielu H. pylori, autoimúnnej gastritídy, celiakie a niektorých vzácnych hereditárnych foriem mikrocytových anémií súvisiacich s poruchami tvorby proteínov zapojených do homeostázy Fe v organizme.
Literárne zdroje
- Camaschella C. How I manage patients with atypical microcytic anaemia. Br J Haematol. 2013; 160 : 12-24.
- Hershko C, Camaschela C. How I treat unexplained refractory iron deficiency anemia. Blood 2014; 123 : 326-333.
- Horváthová M, Divoký V. Metabolismus železa a jeho poruchy. In Molekulární hematologie, Galén 2013, 265-270
- Jaspers A, Caers J, Le Gac G et al. A novel mutation in the CUB sequence of matriptase-2 (TMPRSS6) is implicated in iron-resistant iron deficiency anaemia (IRIDA). Br J Haematol. 2013; 160 : 564-565.
- Krč I. Anemie z nedostatku železa (sideropenické anemie). In Hematologie, Triton 2006, 33-37
Podporené grantom IGA_LF_2016_001 a MZ ČR – RVO (FNOl, 00098892).
2869. Anémie chronických chorob
Indrák K.
(HOK, FN, Olomouc)
Anémie chronických chorob (ACD) představují, společně se sideropenickou anémií, nejčastější anémie v populaci. U nemocných vyššího věku tvoří ACD až třetinu anémií. Jedná se většinou o mírnou až středně těžkou normo-/hypochromií a normocytární anémii, která ale u asi čtvrtiny nemocných přechází v anémii mikrocytární.
Etiopatogeneze:
Příčinou ACD je zvýšená aktivita buněčné imunity vedoucí k nadbytku hepcidinu (Hepatic bacteriocidal protein) v krvi. Tíže anémie koreluje s velikostí aktivace imunitního systému. Proteiny akutní fáze aktivují signální dráhy LPS (lipopolysacharid - endotoxin) a interleukinu 6 (IL-6), které spouštějí, nezávisle na hladině železa, syndrom excesu hepcidinu. Hepcidin snižuje vstřebávání železa v duodenu a interferencí s ferroportinem a jeho degradací blokuje export železa hepatocyty a makrofágy a zvyšuje ukládání železa v makrofágo-monocytovém (MaMo) systému. V kostní dřeni je v důsledku relativně nízké hladiny erytropoetinu, s ohledem na tíži anémie, snížená proliferační aktivita erytropoezy. Poločas přežívání erytrocytů bývá zkrácený v důsledku zvýšené aktivity v MaMo systému. Mezi vyvolávající příčiny ACD patří infekce (akutní a chronické), malignity, autoimunitní onemocnění, chronická onemocnění ledvin, těžká traumata, diabetes mellitus, stáří, infarkty myokardu, velké operace a řada dalších.
Diagnostika a diferenciální diagnostika:
Objem (MCV) erytrocytů v krevním obraze nemocných s ACD bývá normální, zatímco u sideropenie nacházíme mikrocytózu. U ACD bývá snížená až normální hladina sérového železa (Fe) a snížená nebo normální hladina celkové vazebné kapacity (CVK) pro železo. U sideropenické anémie je CVK železa zvýšená. Hladina ferritinu je u ACD normální nebo zvýšená, u sideropenické anémie je snížená. Hladina solubilního transferinového receptoru (sTfR) je u ACD normální a poměr sTfR a logaritmu ferritinu (sTfR/log feritinu) bývá snížený (<1). U sideropenické anémie je hladina sTfR zvýšená a poměr sTfR/log ferritinu bývá zvýšený (>2). Dále u ACD nacházíme zvýšenou hladinu hepcidinu, která je u sideropenické anémie snížená. Také hladina cytokínů (TNF, IL-1, IL-6) je u ACD zvýšená, zatímco u sideropenické anémie bývá normální. V diferenciální diagnostice je vedle obecného odlišení ACD a sideropenické anémie nezbytné odlišit „čistou“ ACD od ACD provázené sideropenií. Odlišení těchto dvou jednotek má zásadní význam pro volbu léčebné strategie, protože u „čisté“ ACD nepodáváme preparáty železa a u ACD provázené sideropenií jsou naopak preparáty železa často nezbytné. Hladina ferritinu >100 µg/l svědčí pro „čistou“ ACD, hladina ferritinu 50-100 µg/l ukazuje na možnou kombinaci ACD a sideropenie. K zpřesnění diagnostiky bývá v tomto případě nezbyté provést další vyšetření. Hladina ferritinu < 30-50 µg/l svědčí pro kombinaci ACD a sideropenie. Hladina sTfR < 2 mg/l svědčí pro „čistou“ ACD, hladina sTfR 2 – 5 mg/l ukazuje, že může jít o kombinaci ACD a sideropenie, hladina sTfR > 5 mg/l ukazuje na přítomnost ACD a sideropenie. Index sTfR/log ferritinu >2 a ferritin < 30 µg/l ukazuje na absolutní deficit železa, index sTfR/log ferritinu <2 a ferritin v séru ≥ 30 µg/l ukazuje na relativní deficit železa, a index sTfR/log ferritinu <1 a ferritin v séru ≥ 30 µg/l ukazuje, že se jedná o „čistou“ ACD bez deficitu železa.
Léčba:
Léčebným cílem je u ACD, podobně jako u ostatních anémií, zvýšení hladiny hemoglobinu a tím i zlepšení kvality života pacienta. Dosud ale nebyl zcela přesně popsán vliv léčby anémie na přetížení železem v MaMo systému, vliv na imunitu, na tvorbu hydroxylových radikálů a na vyvolávající chorobu. Snížená nabídka železa je u ACD obranným mechanismem organismu, protože železo je růstovým faktorem pro mikroorganismy. Proti podávání železa u „čisté“ ACD mluví skutečnost, že pokud není přítomen deficit železa, je dodané železo přesouváno do zásobáren a stejně není pro krvetvorbu využitelné. Podávání preparátů železa pak může podporovat aktivitu onemocnění a může vést k orgánovému postižení svojí toxicitou. Nabídka železa nádorovým buňkám může stimulovat růst nádoru. Přísun železa do systému redoxních reakcí může stimulovat tvorbu volných hydroxylových radikálů. U autoimunitních chorob ale může železo inhibovat prozánětlivé imunitní efektorové dráhy a snižovat aktivitu choroby. Dle tíže anémie a klinických příznaků je proto třeba pečlivě zvažovat, zda ACD vyžaduje kromě léčby základního onemocnění i cílenou léčbu anémie. V cílené léčbě anémie se nejčastěji užívají krevní transfuze, erytropoezu stimulující proteiny (ESP), preparáty železa a zkoušejí se i nové léčebné přístupy. Přetížení železem v důsledku jeho substituce může být škodlivé u dialyzovaných nemocných, u nichž je toto přetížení provázeno zvýšeným rizikem vzniku infekčních komplikací: při hladině ferritinu pod 100 µg/l je riziko infekčních komplikací <20%, při hladině ferritinu >100 µg/l je riziko infekčních komplikací >20% resp. riziko septikemie je při hodnotě ferritinu >100 µg/l 2.5x vyšší, než při nižších hodnotách. Železo obecně nesubstituujeme u ACD s ferritinem >100 µg/l. Erytropoetin je u ACD produkován v relativně menším množství v důsledku působení cytokínů či poškození ledvin. Navíc je popisována snížená citlivost erytroidních prekurzorů na erytropoetin a proto můžeme konstatovat, že ACD je charakteristická relativním deficitem erytropoetinu. Podání erytropoetin stimulujících proteinů (ESP) stimuluje erytropoézu, stimuluje tvorbu sTfr a tlumí tvorbu hepcidinu. Léčebná odpověď na podávání ESP závisí na chorobě vyvolávající ACD, na jejím stádiu, stupni imunitní aktivace a dostupnosti železa. U nádorů, infekcí a u autoimunitních chorob vede podávání ESP ke zvýšení hladiny hemoglobinu, která snižuje potřebu transfuzí i se snížením jejích vedlejších nežádoucích účinků (přetížení železem). Je ale nutno říci, že biologická úloha erytropoetinového receptoru (EpoR) na nádorové buňky zatím nebyla zcela objasněna a existuje podezření, že by se zde mohlo podávání ESP projevit negativně. Proto se léčebná doporučení na podávání ESP u ACD omezují na jejich podávání u ACD při chronické renální insuficienci s cílovou hodnotou hemoglobinu 110-120 g/l (při vyšších hodnotách hemoglobinu stoupá riziko vzniku trombotických komplikací), na ACD u nádorů léčených chemoterapií (solidní TU a lymfoproliferace ), kde je indikováno podávání ESP při hladině hemoglobinu <90 g/l se stejnou cílovou hodnotou hemoglobinu (110-120 g/l). ESP jsou indikovány i u revmatoidní artritidy, ulcerosní kolitidy (efekt u 60% nemocných), u myelodysplastického syndromu (MDS) typu refrakterní anémie (RA) a refrakterní anémie s excesem blastů – 1 (RAEB-1, počet blastů v kostní dřeni <10%; efekt u 30 až 40% nemocných). Je ale popisováno, že téměř žádný efekt ESP nemůžeme očekávat u nemocných s MDS a s hladinou erytropoetinu v séru >500 U/l. Některé práce dokonce uvádějí jako rozhodující pro neúspěch léčby hladinu erytropoetinu >100-150 U/l. Zvláštní léčebný přístup si zaslouží ACD se sideropenií. Železo, které je nezbytné pro basální metabolismus, je zde blokováno v MaMo systému a díky tomu nemůže být ze zásob mobilizováno. U ACD se sideropenií je proto třeba zvažovat současnou substituci preparáty železa a ESP. Pro tuto kombinaci hovoří skutečnost, že zvýšení hladiny erytropoetinu zvyšuje nároky na dodávku železa do kostní dřeně a stimuluje tvorbu sTfR, zatímco nabídka železa použitelného pro krvetvorbu je u ACD snížená v důsledku působení cytokínů způsobujících jeho retenci v MaMo systému. Při špatné absorpci železa v duodenu je u ACD se sideropenií indikováno podávání železa intravenózně. K novým léčebným přístupům patří snaha o ovlivnění tvorby hepcidinu a jeho účinků pomocí antagonistů tvorby hepcidinu: inhibitory BMP (kostní morfogenní protein, který indukuje transkripci mRNA hepcidinu), protilátky proti receptoru pro IL-6; syntetické anti-sense oligonukleotidy, antagonisté účinku hepcidinu - neutralizující protilátky proti hepcidinu. Monoklonální protilátky proti ferroportinu blokující vazbu hepcidinu umožňují pokračování výdeje železa z buňky i za přítomnosti hepcidinu. Příkladem je Lexaptepid, antihepcidin l-oligoribonukleotid, který se váže na hepcidin a blokuje jeho účinek na cílovou molekulu ferroportin a tím brání blokádě výdeje železa z buňky. Jiným zkoušeným preparátem je erytroferon (ERFE), protein regulující účinek erytropoetinu na tvorbu hepcidinu, který zvyšuje sekreci erytropoetinu a vede ke stimulaci tvorby ERFE tlumivým efektem na tvorbu hepcidinu. Důsledkem je zvýšený výdej železa uvolňovaný do cirkulace pro potřebu vystupňované erytropoezy.
Závěr:
Předpokladem správné léčby ACD je přesná diagnostika a odlišení ACD od ACD se sideropenií a od sideropenické anémie. Léčebné přístupy vycházejí u ACD z léčby vyvolávající choroby a dle tíže anémie se rozhoduje o cílené léčbě anémie substitucí erytromasy, pečlivě se zvažuje potřeba podávání železa a/nebo erytropoetin stimulujících proteinů. Nové léčebné přístupy jsou v současnosti na úrovni klinických studií vesměs první fáze.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek POSTGRADUÁLNÍ SEKCE 1Článek Wiedermannova přednáškaČlánek Postgraduální sekce 2Článek Konference Ošetřovatelství 1Článek Konference Ošetřovatelství 2Článek Mnohočetný myelomČlánek PsychologieČlánek TransplantaceČlánek PREZIDENTSKÉ SYMPOZIUMČlánek MorfologieČlánek Dárcovské a léčebné aferézyČlánek Laboratorní diagnostikaČlánek Mnohočetný myelomČlánek TransplantaceČlánek Laboratorní diagnostikaČlánek PODPŮRNÁ PÉČEČlánek TRANSFUZNÍ PROBLEMATIKAČlánek RejstříkČlánek OŠETŘOVATELSTVÍ
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2016 Číslo Supplementum1- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
-
Všetky články tohto čísla
- Mnohočetný myelom
- Akutní leukemie/Chronická myeloidní leukemie
- Transplantace
- MALIGNÍ LYMFOMY/CHRONICKÁ LYMFOCYTÁRNÍ LEUKEMIE
- POSTGRADUÁLNÍ SEKCE 1
- Laboratorní diagnostika
- PODPŮRNÁ PÉČE
- TRANSFUZNÍ PROBLEMATIKA
- Rejstřík
- Wiedermannova přednáška
- Postgraduální sekce 2
- Symposium on Advances in Molecular Hematology 1: Lymphoma Pathogenesis
- Konference Ošetřovatelství 1
- Symposium on Advances in Molecular Hematology 2: Stressed Hematopoiesis
- Symposium on Advances in Molecular Hematology 3: State of the Art Invited Lecture
- Konference Ošetřovatelství 2
- Mnohočetný myelom
- Akutní leukemie/Chronická myeloidní leukemie
- Psychologie
- Konference zdravotních laborantů 1
- Myelodysplastický syndrom/ Myeloproliferativní onemocnění
- Transplantace
- Maligní lymfomy/Chronická lymfocytární leukemie
- Konference zdravotních laborantů 2
- PREZIDENTSKÉ SYMPOZIUM
- Morfologie
- Dárcovské a léčebné aferézy
- Laboratorní diagnostika
- Anémie/Cytopenie
- OŠETŘOVATELSTVÍ
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Myelodysplastický syndrom/ Myeloproliferativní onemocnění
- Morfologie
- Anémie/Cytopenie
- MALIGNÍ LYMFOMY/CHRONICKÁ LYMFOCYTÁRNÍ LEUKEMIE
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



