-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mnohočetný myelom
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. Supplementum1, p. 101-108.
Kategorie: Posterová sekce
P4/2871. Zkušenosti s léčbou vzácné gamapatie Schnitzler syndromu a Erdheimovy-Chesterovy choroby inhibitorem receptoru interleukinu-1, preparátem ANAKINRA
Adam Z., Krejčí M., Pour L., Sandecká V., Szturz P., Vetešníková E.
(Interní hematologická a onkologická klinikaLF MU a FN, Brno)
Schnitzler syndrom je velmi vzácné onemocnění provázení monoklonálním imunoglobulinem Pro stanovení této diagnózy byla přijata Štrasburská kritéria (neinfekční horečka, chronická kopřivka, změny kostní struktury, leukocytóza a zvýšená hodnoty zánětlivých markerů – CRP a přítomnost monoklonálního imunoglobulinu většinou typu IgM, zcela výjimečně IgG. Léčbou volby pro tuto nemoc je blokáda účinků interleukinu-1. V praxi je nejčastěji využíván antagonista receptoru pro interleukin-1, anakinra. V současnosti se objevují zprávy i o použití dalších léků blokujících účinek interleukinu-1, canakinumab a rilonacept. Dlouhodobě léčíme 4 pacienty preparátem anakinra (108, 72. 33 a 32 měsíců). U všech nemocných jsme začali s aplikací anakinry v dávce 100 mg 1x denně. Při dávkování 100 mg 1x denně vymizely kompletně všechny příznaky u 3 nemocných, pouze u jednoho nemocného došlo k ústupu příznaků asi o 75 % nikoliv však k úplnému vymizení. Tento pacient by zřejmě potřeboval navýšení dávky alespoň ve dnech se spontánním zintenzivněním potíží. U jednoho ze 3 pacientů, u nichž příznaky při dávkování 1x denně zcela vymizely, se po roce léčby ukázalo dostačující podávat anakinru ve 48hodinových intervalech. Delší prodloužení intervalu mezi aplikacemi však netoleruje. V průběhu léčby jsme nezaznamenali žádné nežádoucí účinky anakinry a v průběhu léčby nedochází k poklesu účinnosti, aplikace anakinry jsou stejně účinné jako na začátku léčby, v průběhu let se však zvyšuje koncentrace monoklonálního imunoglobulinu a v literatuře jsou popsány transformace nejčastěji v lymfoplazmocytární lymfom a proto kontrolujeme dřeň trepanobiopsií při závažném vzestupu koncentrace monoklonálního IgM. Erdheimova-Chesterova choroba je nemoc ze skupiny xanthogranulomu. Způsobuje také teploty, bolestí kostí hlavně dlouhých a způsobuje také fibrózu v oblasti tělních dutin a fibrotické změny cévních stěn. Popsaných léčebných alternativ je více (2-chlorodeoxyadenosin, thalidomid, lenalidomid) ale také anakinra. U jednoho z našich pacientů nereagovala jeho nemoc na žádnou z podaných léčebných alternativ vyjma anakinra. Od roku 2011 je léčen anakinrou (KINERET) a díky kterému jsou normální parametry zánětu a hlavně dle CT hodnocení jsou fibrotické změny retroperitonea stabilní, bez progrese, které pacienty ohrožuje hydronefrózou. Anakinra je přínosem minimální pro dvě krevní choroby - Schnitzler syndrom a Erdheimovu-Chesterovu chorobu.
P5/2875. Diagnostika a prognostická stratifikace pacientů s Waldenströmovou makroglobulinémií – zkušenosti jednoho centra
Křupková L., Pika T., Divoká M., Orviská M., Minařík J., Papajík T.
(Hemato-onkologická klinika, FN a LF UP, Olomouc)
Úvod: Waldenströmova makroglobulinémie (WM) je vzácná hematologická malignita definovaná jako lymfoplazmocytární lymfom s infiltrací kostní dřeně a přítomností monoklonálního imunoglobulinu IgM v séru. U více než 90 % pacientů s WM je přítomna bodová mutace L265P v genu MYD88 a současně jedna třetina těchto pacientů nese frameshift (WHIM-FS) nebo non-sense (WHIM-NS) mutaci v genu CXCR4. Mutace v genu CXCR4 způsobují vznik předčasného stop kodonu, což má za následek zkrácení výsledného proteinového produktu a hyperaktivaci CXCR4-zprostředkované signalizace. Přítomnost a typ mutací v genech MYD88 a CXCR4 mají význam v diagnostice a prognostické stratifikaci pacientů s WM a také ovlivňují klinickou manifestaci onemocnění. Cíle: Analyzovat mutační stav genů MYD88 a CXCR4 u pacientů s WM, porovnat výsledky s laboratorními parametry a zhodnotit prognostickou stratifikaci pacientů s ohledem na mutační status analyzovaných genů. Metody: Analyzovaná DNA byla izolována z mononukleární frakce buněk kostní dřeně v době diagnózy. Mutační stav sledovaných genů byl stanovován pomocí alelově-specifické PCR (v případě MYD88) a pomocí přímého Sangerova sekvenování (v případě CXCR4). Všechny nalezené mutace byly potvrzeny restrikčním štěpením za definovaných podmínek. Výsledky: Analyzovali jsme skupinu pacientů s WM (n=16). U 15 pacientů (93,8 %) jsme potvrdili přítomnost mutace L265P v genu MYD88 a současně u 4 pacientů (25 %) i mutaci v genu CXCR4 (1 pacient byl nositelem WHIM-FS mutace a 3 byli nositeli WHIM-NS mutace). Přítomnost CXCR4 mutace byla spojena s agresivnější chorobou (vyšší IPSS, pancytopenie, vyšší hladina paraproteinu a volných lehkých řetězců v séru, vyšší infiltrace kostní dřeně; Tab. 1), naopak pacienti s nemutovaným CXCR4 byli často asymptomatičtí. CXCR4 mutace byly také spojeny s horší léčebnou odpovědí (2 pacienti byli rezistentní a 2 měli částečnou odpověď na prvoliniovou terapii). Závěr: Analýza mutačního stavu genů MYD88 a CXCR4 je nepostradatelnou součástí diagnostiky a prognostické stratifikace pacientů s WM a umožňuje hlubší pochopení molekulární patogeneze tohoto onemocnění. V souladu s publikovanými daty jsme potvrdili, že mutace v genu CXCR4 jsou asociovány s agresivnějšími projevy onemocnění a ovlivňují léčebnou odpověď.
Tab. 1. Mediány laboratorních parametrů u WM pacientů s nemutovaným a mutovaným genem CXCR4 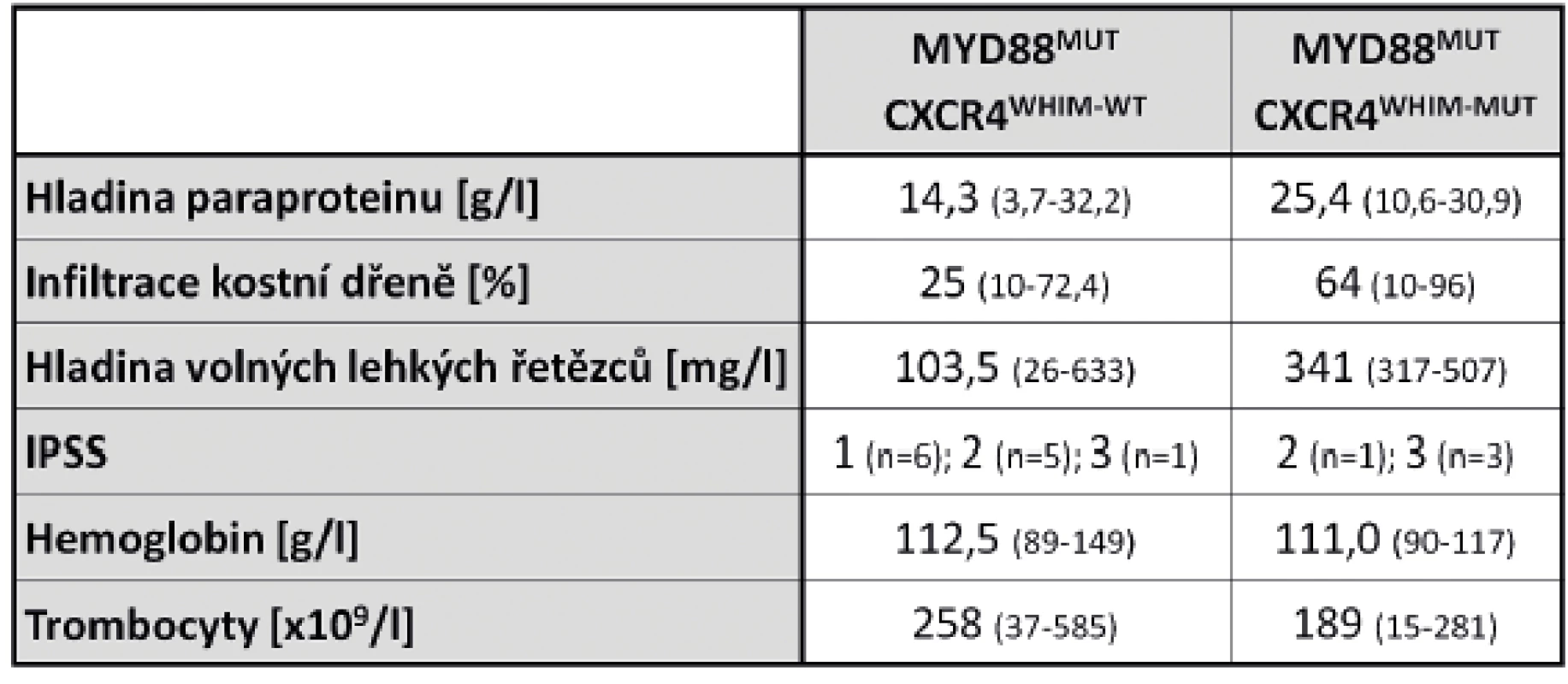
Tato práce byla podpořena grantem IGA-LF-2016-001.
P6/2882. Studium sérových proteinových profilů u monoklonální gamapatie nejasného významu a mnohočetného myelomu
Schneiderová P., Pika T., Gajdoš P., Fillerová R., Krömer P., Kudělka M., Minařík J., Papajík T., Ščudla V., Kriegová E.
(Ústav imunologie, Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc; Hemato-onkologická klinika, Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc; Katedra informatiky, Fakulta elektrotechniky a informatiky, Vysoká škola báňská - Technická univerzita, Ostrava)
Monoklonální gamapatie jsou velmi heterogenní skupinou onemocnění, která jsou charakteristická proliferací diferencovaných B-lymfocytů. U těchto nemocí se stále hledají neinvazivní biomarkery, vhodné pro spolehlivou diagnostiku jednotlivých typů a v případě maligních gamapatií ke sledování léčebné odpovědi. S cílem popsat sérové profily charakteristické pro monoklonální gamapatií nejistého významu (MGUS) a mnohočetný myelom (MM) a jeho změny po autologní transplantaci krvetvorných buněk (ASCT) jsme analyzovali proteinové profily 92 kandidátních nádorových biomarkerů pomocí inovativní, vysoce senzitivní „Proximity Extension ImmunoAssay“ (Proseek Multiplex, Olink). Soubor tvořili pacienti s MGUS (n=16), MM (n=16) a kontrolní zdraví jedinci (n=7); u pacientů s MM byly analyzovány také párové vzorky po ASCT (den 100). Pro statistické zpracování dat jsme použili Mann-Whitney-Wilcoxon test s korekcí P-hodnot metodou FDR (Benjamini-Hochberg) a klasifikační algoritmy. U pacientů s MM byly pozorovány vyšší hladiny adrenomedullinu (Pcorr=0,0004), GDF15 (Growth differentiation factor 15, Pcorr=0,003) a solubilního MICA (Major histocompatibility complex class I-related chain A, Pcorr =0,023), které přispívají k přežívání myelomových buněk, ve srovnání s MGUS. Zajímavý je nález zvýšené hladiny aktivačního faktoru pro B-buňky BAFF (B-Cell Activating Factor, Pcorr=0,00006) u MM pacientů po ASCT ve srovnání s párovým MM při diagnóze; sérový profil po ASCT byl charakteristický zvýšenými hladinami řady pro-nádorových. Prioritní je také popis zvýšené hladiny angiogenního a antiapoptotického faktoru midkin (Pcorr=0,0007) ve skupině MGUS oproti zdravým kontrolám. Popsali jsme sérové profily charakteristické pro MGUS, MM a MM po ASCT. Znalost proteinových profilů asociovaných s MGUS a MM může přispět k identifikaci klíčových molekul, které přispívají k přežívání myelomových buněk a které by se mohly stát novými terapeutickými cíly. Grantová podpora: MZ ČR VES16-32339A, LFUP_2016_001, LFUP_2016_011.
P7/2887. Kontinuálna liečba lenalidomidom pri relabovanom mnohopočetnom myelóme
Masárová K., Bátorová A., Mistrík M., Štefániková Z.
(Klinika hematológie a transfuziológie, Univerzitná nemocnica, Bratislava)
Zavedenie talidomidu, bortezomibu a lenalidomidu významne zmenilo liečbu mnohopočetného myelómu (MM). Lenalidomid má duálny mechanizmus účinku: priamo spôsobuje smrť nádorových buniek a navyše má významný imunomodulačný účinok, ktorý prispieva k udržaniu remisie. U pacientov s relabovaným alebo refraktérnym MM lenalidomid v kombinácii s dexametazónom signifikantne predĺžil čas do progresie, zvýšil celkové odpovede aj mieru kompletných remisíí a predĺžil celkové prežívanie v porovnaní so samotným dexametazónom. Naviac lenalidomid je obvykle dobre tolerovaný, s iniciálnou myelosupresiou ako najvýznamnejšou toxicitou. Lenalidomid nemá kumulatívnu toxicitu, čo umožňuje kontinuálnu liečbu. Tieto závery potvrdzuje aj kazuistika 51-ročnej pacientky s relabovaným mnohopočetným myelómom (MM), diagnostikovaným v roku 2008, ktorá je od januára 2011 liečená kombináciou lenalidomid+ +dexametazón+cyklofosfamid v štvrtej línii. U tejto značne predliečenej pacientky sa dosiahla PR, ku dnešnému dňu dostala 33 cyklov, liečbu toleruje dobre. Po 20 cykloch sme dávku lenalidomidu redukovali z pôvodných 25 mg na 15 mg. V prestávkach liečby, zapríčinených prolongovaným procesom schvaľovania úhrady v poisťovni vždy dochádza k zvýšeniu hladiny CB, M-Ig aj počtu plazmatických buniek v kostnej dreni, po opätovnom nasadení terapie sa prejavuje pokles uvedených hodnôt.
P8/2888. Dlouhé nekódující RNA v patofyziologii mnohočetného myelomu
Sedlaříková L., Gromesová B., Kubaczková V., Radová L., Almáši M., Penka M., Adam Z., Pour L., Krejčí M., Hájek R., Ševčíková S.
(Babákova myelomová skupina, UPF, LF MU, Brno; Ceitec, Masarykova univerzita, Brno; Oddělení klinické hematologie, Fakultní nemocnice Brno; Interní hematologická a onkologická klinika, Fakultní nemocnice, Brno; Klinika hematoonkologie, Fakultní nemocnice, Ostrava)
Úvod: Tato práce si klade za cíl zjistit, zda dysregulace signálních drah, které jsou příznačné pro mnohočetný myelom (MM) by mohly být alespoň částečně způsobeny podskupinou nekódujících RNA, tzv. dlouhými nekódujícími molekulami RNA (lncRNA). Tyto více než 200 nukleotidů dlouhé molekuly se nacházejí především v jádře buněk a podílejí se na významných buněčných procesech jako je např. proliferace, diferenciace a apoptóza. Zdá se, že tyto molekuly mají klíčovou roli v patogenezi lidských onemocnění, včetně nádorových, kde se podílejí na nádorové transformaci a progresi onemocnění. Cílem studie bylo identifikovat profil buněčných lncRNA souboru pacientů s MM a zdravých dárců (ZD) a porovnat je s klinickými parametry. Materiál a metody: Celkem bylo získáno padesát vzorků CD138+ buněk od pacientů s MM v době diagnózy a od ZD. Screeningová fáze práce zahrnovala analýzu 83 lncRNA a byla provedena u 6 pacientů s MM a 6 ZD pomocí RT2 lncRNA PCR Array – Human lncRNA Finder (Qiagen). Statisticky významně (p<0,05) deregulované lncRNA mezi MM a ZD byly validovány s využitím qPCR a přístupu relativní kvantifikace 2-ΔCt na větším souboru pacientů a ZD. ROC analýza (Receiver Operating Characteristic) byla provedena pro stanovení specificity a sensitivity každé lncRNA. P hodnoty <0,05 byly považovány za statisticky významné. Výsledky: Profilování pomocí RT2 lncRNA PCR Array odhalilo 27 deregulovaných lncRNA (všechny p<0,01) mezi MM pacienty a ZD. Hladiny exprese ZFAS1, UCA1, BDNF-AS, NEAT1 a FAS-AS1 byly dále validovány na větším souboru MM pacientů a ZD. Hladina exprese UCA1 byla významně snížena (p<0,0001), hladiny exprese NEAT1 a BDNF-AS byly naopak zvýšeny u MM pacientů ve srovnání se ZD (obojí p<0,00000001). Pro odlišení MM od ZD byla provedena analýza ROC. Ta odhalila 100% senzitivitu a 100% specificitu s AUC (area under curve) 1,000 pro NEAT1 a BDNF-AS expresi. A dále 95,24% senzitivitu a 75% specificitu s AUC 0,905 pro expresi UCA1. Závěr: Naše data naznačují, že lncRNA UCA1, NEAT1 a BDNF-AS mohou být zapojeny do patofyziologických procesů probíhajících v MM buňkách a podněcují tak další studie této problematiky. Podpořeno grantem: AZV 15-29508A
P9/2914. Sample pre-processing for downstream application in AL amyloidosis
Filipová J., Growková K., Kufová Z., Ševčíková T., Hanusová H., Vrublová P., Kryukova E., Zahradová L., Kryukov F., Hájek R.
(Faculty of Medicine, University, Ostrava; Department of Biology and Ecology, Faculty of Science, University, Ostrava; Blood Cancer Research Group, Department of Haematooncology, University Hospital, Ostrava)
Introduction: Immunoglobulin light chain amyloidosis (ALA) is clonal plasma cell dyscrasia. Abnormal plasma cell (aPC) clones produce Ig light chains, which are stored in the affected organs and leads to their malfunction. ALA is characterized by lower PCs infiltration (mean 3,87 %; range 0,17 – 9,34) compared to multiple myeloma (Hu et al., 2014). Due to low number of target cells and incidence approx. 10 cases per million per year (Merlini & Palladini, 2013), correct sample pre-processing is essential for all downstream application. Objective: To optimize protocol for sample processing in ALA research for a future examination by molecular biology techniques. Methods: This study was approved by institutional ethical review boards and all individuals provided written informed consent. The bone marrow was obtained during routine diagnostic procedure. Buffy-coats of healthy donors were kindly presented by Blood Centre, UH Ostrava. Mononuclear cells (MNC) were isolated by density gradient centrifugation. MNC were frozen in FBS containing 10% DMSO. Prior to nucleic acid isolation, samples were thawed and prepared for fluorescence activated cell sorting. Subsequent DNA/RNA processing optimiza-tion was done using buffy-coats of healthy donors and following kits: AllPrep DNA/RNA Micro Kit, QIAamp DNA Mini Kit (Qiagen), NucleoSpinTriPrep (Macherey-Nagel), RNeasy Micro Kit (Qiagen), MagMAX Total RNA Isolation Kit (Life Technologies), microMACS mRNA Isolation Kit (MiltenyiBiotec). Amplification kits: REPLI-g Mini Kit, REPLI-g Single Cell Kit (Qiagen). Nucleic acid concentrations were measured using Qubit® 3.0 fluorometer (Thermo Fisher Scientific) and RNA integrity number (RIN) was evaluated using Bioanalyzer 2100 (Agilent Technologies). DNA amplification specificity and reproducibility was checked by PCR and quantitative PCR on LightCycler ® 480 (Roche). ALA BM aPC (CD45dimCD38+CD19-CD56+/-) were sorted by FACS Aria III (Becton Dickinson) and DNA/RNA were isolated by AllPrep DNA/RNA Micro Kit. Results: Comparison of DNA/RNA isolation kits is presented in Fig. 1A, B. Based on these results, best strategy for ALA pre-processing was chosen and three samples were prepared. Total PC infiltration was 0,5 – 4,3 %. Population of aPC (CD45dimCD38+CD19-CD56+/-) with infiltration of 57,3 – 90,8 % from PC was sorted. Number of sorted cells ranged between 15 371 - 22 846. DNA yield was 20,6 – 27,6 ng, RNA yield was 14,4 – 46 ng (RIN >9,5). DNA was amplified using REPLI-g Mini Kit with yield 2 060 – 4 300 ng and amplification specificity was checked by PCR. Optimal strategy for sample pre-processing for molecular biology applications including high-through-put “omics” is presented in Fig. 1C. Conclusion: The proposed lab guideline for ALA sample processing was prepared to present the optimal way of cells collection and proper handling in order to maximize sample quality for further use. This guideline can be used to standardized research in the field of molecular biology for not only ALA samples but also for other haematological malignancies. Acknowledgment: Supported by The Ministry of Education, Youth and Sports (Specific university research of the Faculty of Medicine, University of Ostrava) project no. SGS03/LF/2015-2016, SGS09/LF/2016-2017; Development Plan of University of Ostrava (IRP201550); MH CZ - DRO - FNOs/2015-2016 and by the Ministry of Health (15-29667A).
P10/2924. Analýza variantních nálezů počtu signálů při určení translokace t(4;14) metodou FICTION u nemocných s mnohočetným myelomem poster
Balcárková J., Mlynárčiková M., Mičková P., Ščudla V., Pika T., Bačovský J., Minařík J., Jarošová M.
(Hemato-onkologická klinika, FN,Olomouc)
Mnohočetný myelom (MM) je charakterizován četnými chromozomovými změnami prognostického významu. Jednou z nich je translokace t(4;14)(p16.3;q32.3), která je spojena s nepříznivou prognózou. Jejím důsledkem je deregulace genů MMSET a FGFR3. Cílem práce bylo analyzovat geny IgH, FGFR3 a MMSET metodou FICTION v souboru nemocných s MM, určit frekvenci translokace t(4;14) a variantních nálezů počtu signálů této translokace, u opakovaně vyšetřených nemocných studovat klonální vývoj a vyhodnotit význam variantních nálezů. V souboru 533 nemocných s MM byla t(4;14) potvrzena u 66 (12,4 %) nemocných, z toho u 21 (32 %) nemocných byla zjištěna abnormalita v počtu signálů. Abnormalita v počtu signálů při vyšetření přestavby IgH genu byla zjištěna u 15 z 21 (71 %) nemocných, zatímco analýza genů FGFR3 a MMSET potvrdila variantní nález u 12/21 nemocných (57 %). Současně s variantním nálezem t(4;14) byly u všech nemocných nalezeny další přídatné chromozomové změny, nejčastěji delece 13q a zmnožení oblasti 1q21. U 3 z 9 opakovaně vyšetřených nemocných byl pozorován klonální vývoj. Naše výsledky upozorňují na existující heterogenitu FICTION nálezů při určení t(4;14) a na skutečnost, že změny v počtu signálů při vyšetření přestavby genu IgH, způsobené především delecí, mohou maskovat translokaci, a proto je nutné pro určení translokací u MM používat specifické translokační sondy. Přestože nález variantních počtů signálů při určení translokace nepotvrdil statisticky významný vliv na celkové přežití nemocných, vzhledem k prognostické významnosti translokace t(4;14) neurčení změny může také významně ovlivnit terapeutický přístup. Práce byla podporovaná grantem IGA MZČR NT/14400-3, IGA_LF_2016_001.
P11/2938. Buněčná analýza plasmacytoidních dendritických buněk u mnohočetného myelomu
Králová R., Říhová L., Všianská P., Krchniaková M., Piskáček M., Pacasová R., Penka M., Adam Z., Pour L., Knight A.
(Lékařská fakulta, Ústav patologické fyziologie, Masarykova univerzita, Brno; Oddělení klinické hematologie, Fakultní nemocnice, Brno; Tkáňové a transfuzní oddělení, Fakultní nemocnice, Brno; Interní hematologická a onkologická klinika, Fakultní nemocnice, Brno; Klinika hematoonkologie, Fakultní nemocnice, Ostrava)
Úvod: Plasmacytoidní dendritické buňky (pDC) jsou malou populací leukocytů. Ve zdravém organismu hrají důležitou roli jako antigen prezentující buňky, díky produkci interferonu typu I aktivují další složky imunitního systému k boji proti nádorově transformovaným buňkám. Mnohočetný myelom (MM) je maligní onemocnění, postihující zejména starší pacienty okolo věku 65 let. Klonálně zmnožené plazmatické buňky produkují patologický imunoglobulin tzv. paraprotein. Je známo, že pDC u pacientů s MM akcelerují proliferaci maligních myelomových buněk a způsobují nežádoucí rezistenci k používané myelomové terapii (Chauhan et al., 2009). Cíl: Cílem projektu bylo určení počtu pDC v periferní krvi (PK) a kostní dřeni (KD) pacientů s novou diagnózou MM a srovnání s frekvencí pDC zdravých dárců ve stejné věkové skupině. Druhým cílem bylo určení fenotypu pDC u zdravých dárců a srovnání s fenotypem pDC u pacientů s MM. Pacienti a metody: Do studie bylo zahrnuto 10 párových vzorků KD a PK pacientů s MM ve věku (48-81 let; medián 65 let), zastoupení můžu/žen = 5/5. Jako reference sloužily vzorky periferní krve zdravých dárců, n = 17, věk (56-72 let; medián 64 let), zastoupení M/Ž = 12/5. Z PK či KD pacientů a dárců byly izolovány PBMC (nebo BMNC) metodou gradientové centrifugace. Analýza vzorků byla provedena průtokovou cytometrií pomocí monoklonálních protilátek na cytometru FACS CantoII (BD Biosciences). PDC byly definovány s použitím CD123 (klon AC145), CD303 (AC144) a CD304 (AD5-17F6). Jejich aktivační fenotyp byl určen kombinací znaků HLA-DR (Immu-357) a CD45RA (HI100), kdy aktivované pDC jsou na oba znaky pozitivní. Bylo analyzováno minimálně 250-7500 živých pDC. Výsledky byly analyzovány pomocí FlowJo software, (TreeStar, verze 10.1). Výsledky: Procentuální zastoupení pDC v krvi zdravých dárců bylo identifikováno v rozmezí 0,022-0,27 % (medián 0,068 %). V krvi pacientů s MM se nacházelo 0,028-0,31 % pDC; (medián 0,0635 %). Všechny vzorky krve zdravých dárců měly aktivní celou populaci pDC na rozdíl od pacientů s MM, kdy n = 4 (100% aktivace pDC), n = 4 (> 80 %) a n = 2 (< 50 % aktivovaných pDC). V kostní dřeni MM pacientů bylo určeno pDC v rozmezí 0,045-0,22 %; (medián 0,0875 %), kdy poměr aktivovaných buněk v populaci pDC byl: n = 4 (100 % aktivovaných pDC), n = 3 (> 80 %) a n = 3 (60-70 %). V současné době probíhá analýza dalších párových vzorků pacientů s MM a zdravých dárců. Závěr: Mediány pDC v krvi zdravých dárců a pacientů s MM jsou ve stejných hladinách a statisticky se neliší. V kostní dřeni MM pacientů bylo určeno zvýšené procento pDC než v periferní krvi (p = 0,12). Naše předběžné výsledky ukazují rozdíly fenotypu pDC u zdravých dárců a pacientů s MM přítomných jak v PK, tak KD, které budou dále ověřeny ve funkčních esejích. Rozdíly v zastoupení a v aktivaci populace pDC v kostní dřeni u zdravých dárců a pacientů by mohly hrát důležitou roli pro patologickou funkci pDC v nádorovém mikroprostředí myelomu.
P12/2942. Analýza expresie receptorov EphA1 a EphA2 u nádorových bunkových línií
Krchniaková M., Králová R., Piskáček M., Knight A.
( Lékařská fakulta, Ústav patologické fyziologie, Masarykova univerzita, Brno)
ÚVOD: Ephriny predstavujú najväčšiu známu rodinu tyrozínkinázových receptorov a ich ligandov. Bývajú hojne produkované najmä počas embryonálneho vývoja, zatiaľ čo v dospelých tkanivách sú nachádzané len v nízkych hladinách. K ich hlavným funkciám patrí regulácia rastu buniek, ich proliferácie a migrácie. Tieto vlastnosti sú však v dospelých tkanivách prirodzené malígnym bunkám, a preto je väčšina ephrinových proteínov považovaných za onkogény. Ich abnormálne vysoká expresia je spájaná so vznikom a vývojom solídnych nádorov najmä epiteliálneho pôvodu, zvýšeným rizikom vzniku metastáz a zníženým prežívaním pacientov. Doposiaľ však nie je známa expresia ephrinov a ich receptorov u hematoonkologických ochorení ako je mnohopočetný myelóm. CIEĽ: Cieľom bola analýza povrchovej expresie receptorov EphA1 a EphA2 pomocou viacfarebnej flow cytometrie a paralélna analýza expresie proteínov pomocou Western blotu v modelovom systéme komerčných nádorových bunkových línií. Ako kontrola slúžili bežne dostupné línie zdravých buniek. MATERIÁL A METÓDY: Boli analyzované suspenzné nádorové línie mnohopočetného myelómu (KMS11, EJM), chronickej B-lymfocytárnej leukémie (MEC1), chronickej myeloidnej leukémie (KYO-1, LAMA-84), akútnej monoblastickej leukémie (CTV-1a) a lymfómu (U937). Nádorové bunky boli zo suspenzných kultúr izolované v exponenciálnej fázi ich rastu. Ďalej boli analyzované adherentné nádorové línie renálneho karcinómu (A-498), karcinómu prostaty (DU-145), kolorektálneho adenokarcinómu (HT-29), karcinómu prsníku (MCF-7) a multiformného glioblastómu (U373). Ako kontrola boli zaradené zdravé bunkové línie, a to ľudské astrocyty (pasáž 4) a ľudské fibroblasty (MRC-5, pasáž 38). Bunky z adherentných kultúr boli izolované v približne 80% konfluencii pomocou Trypsín-EDTA. Analýza povrchovej expresie EphA1 a EphA2 (R&D Systems) prebiehala na prietokovom cytometri FACS Canto II (BD, Becton Dickinson), pričom pri akvizícii bolo analyzovaných minimálne 100 000 udalostí živých buniek. Získané dáta boli analyzované pomocou programu FlowJo (TreeStar; verzia 10.1). VÝSLEDKY: Epiteliálne nádorové línie (A-498, DU-145, HT-29) vykazovali silnú pozitivitu na EphA2, zatiaľ čo na EphA1 boli len slabo pozitívne. Línia MCF-7 bola na oba receptory slabo pozitívna. Glioblastomová línia U373 vykazovala negativitu na EphA1 aj EphA2. Leukemické a myelómové suspenzné nádorové línie boli negatívne na EphA1 aj EphA2, iba línia LAMA-84 vykazovala slabú pozitivitu na EphA1. Čo sa týka línií zdravých buniek, MRC-5 aj ľudské astrocyty boli pozitívne na EphA2, ale negatívne na EphA1. V súčasnosti prebieha u bunkových línií analýza expresie proteínu EphA2 pomocou Western blotu. ZÁVER: Naše výsledky potvrdili povrchovú expresiu receptorov EphA1 a EphA2 u nádorových línií epiteliálneho pôvodu, akými sú agresívny karcinóm prostaty (DU-145), čreva (HT-29) či obličiek (A-498). Na rozdiel od adherentných línií, leukemické a myelómové línie boli na dané receptory negatívne. V súčasnosti je analyzovaná kohorta pacientov s mnohopočetným myelómom. Naše novo získané dáta tak po prvýkrát ukážu expresiu ephrinových receptorov nielen na primárnych nádorových bunkách pacientov, ale aj na ďalších populáciách buniek nádorového mikroprostredia vrátane stromálnych a dendritických buniek.
P13/2950. Zmeny metabolizmu železa pri mnohopočetnom myelóme pred a po transplantácii kostnej drene
Nosáľ M., Štefániková Z., Stecová A., Gáboríková M., Pospíšilová D., Holub D., Ladická M.
(Nem. Staré Mesto UNB, Bratislava; Klinika hematologie a transfuziológie LFUK, UNB, SZU, Nem.sv.Cyrila a Metoda, Bratislava;. Medirex s.r.o, Bratislava – SR; Dětská klinika LFUP a FN Olomouc – CZ ; Ústav molekulární a translační medicíny, LFUP, Olomouc -CZ)
Úvod: Hepcidin je nízkomolekulový peptidický hormón objavený pred 15 rokmi, ktorý pozostáva z 25 aminokyselín (AMK) a je hlavným regulátorom homeostázy železa (Fe). Zaisťuje komunikáciu medzi miestami ukladania Fe (hepatocyty a makrofágy) a miestami vstrebávania Fe (enterocyty) a spotreby (erytroidné bunky) alebo recykluje a uvoľňuje Fe do krvného obehu (makrofágy). Syntéza hepcidinu je riadená podnetmi, ktoré reagujú na zápal, aktivitu erytropoézy, hladinu Fe, jeho zásoby v organizme a napätie kyslíka. Kľúčovú úlohu v expesii hepcidinu hrajú prozápalové cytokíny IL-6, IL-10, TNF-a a LPS. Zvýšenie hladiny hepcidinu vedie k zadržaniu Fe v enterocytoch a makrofágoch a ku zníženiu jeho hladiny v plazme.Štúdie u pacientov s mnohopočetným myelómom, Hodgkinovým lymfómom, akútnou leukémiou a Waldenstromovou makroglobulinémiou, poukazujú na zvýšené hladiny sérového hepcidinu a nepriamo korelujú s hladinou hemoglobínu. Cieľ: zistiť zmeny metabolizmu železa pri mnohopočetnom myelóme, aké sú zmeny pred a po trasnsplantácii kostnej drene. Metodika: vyšetrili sme 67 pacientov s mnohopočetným myelómom, 15 pacientov s anémiou chronických ochorení pri zápalových ochoreniach, 18 pacientov kontrol, bez hematologického ochorenia. Vyšetrili sme FeS, Trf., sat.Trf., Feritin, solub.Trf.receptor, index = solub.Trf.rec./log., Feritin, IL-6, CRP, Epo, Hepcidin ELISA a SOLDI-TOF HPLC. Výsledky: Dosiahli sme následujúce hodnoty pre:Feritín pre skupinu kontrola 57,2 (15,5 - 257), Myelom 223,7 (18,6 - 2 489), ACD 988,1 (92,3 - 2 680). Hodnoty sú prezentované ako medián (min – max). Kontrola vs. ACD p<0,001; Kontrola vs. myelóm p=0,003; ACD vs. myelóm p=0,154. IL-6 kontrola 2,85 (2,83 - 6,22), Myelom 5,47 (4,06 - 96,6), ACD 27,29 (11,43 - 1102). Kontrola vs. ACD p<0,001; Kontrola vs. myelom p=0,024; ACD vs. myelóm p>0,05. Hepcidin ELISA kontrola 10,5 (0,12 – 33,2), Myelom 20,9 (0,33 – 78,2), ACD 35,6 (4,91 – 51,0). Kontrola vs. ACD p=0,30; Kontrola vs. myelom p=0,46; ACD vs. myelóm p=0,94. Hemoglobín významne negatívne koreloval s hodnotami hepcidínu meranými oboma metódami. Silnejšie s Chromatograficky meranou. Hepcidin ELISA vs. Hb rho = -0,50 95% interval spoľahlivosti (-0,79 to -0,02) p = 0,045 Hepcidin Chromatografia vs. Hb rho = -0,75 95% interval spoľahlivosti (-0,92 to -0,34) p = 0,004 Záver: ztistili sme zmeny najmä hladiny feritinu, prozápalového cytokína – IL-6 a negatívnu koreláciu medzi hemoglobínom a hepcidinom tzn., že čím je vyšší hepcidín, tým je nižšia hladina hemoglobínu. Zazmenanali sme významné zlepšenie metabolizmu železa po transplantácii kostnej drene.
P14/2954. Plasma cell dyscrasias and bone marrow microenvironment
Flodr P., Minařík J., Flodrová P., Pika T., Bačovský J., Krhovská P., Ščudla V.
(Department of Clinical and Molecular Pathology, Faculty of Medicine and Dentistry, Palacky University, Olomouc; Department of Hemato-oncology, University Hospital, Olomouc)
Objective: Neoplastic niche is an important microenvironment for growth, retention/adhesivity, survival, resistency or sensitivity to a therapeutic approach in all malignant diseases. We contextually studied neoplastic cells and their non-neoplastic supportive tissue in multiple myeloma and MGUS according to expressions of MIP1alfa, Annexin A2, TRAP, DKK-1, RANK, RANKL, OPG, Sclerostin, Activin A, NFkappaB proteins, p62, MMP9 and RUNX2. Methods: Bone marrow trephine biopsy specimens (n=96) with multiple myeloma (de novo and relapsed) or MGUS were included in our prospective study. FFPE tissues were processed in app. 5mm sections and placed on plus charged slides. The indirect immunohistochemistry was applied after antigen retrieval. Primary antibodies were used for the detection of observed proteins. Standard secondary antibody and ABC method were included in visualisation. The detected expressions were analysed. Results: Bone marrow specimens showed variable positivity of observed proteins with high levels in MIP1alfa, Annexin A2, RANK, RANKL, Sclerostin, p52 (cytoplasmic), p62 (cytoplasmic), p65 (cytoplasmic), RUNX2 and low levels in TRAP, DKK-1, OPG, Activin A, p50 (cytoplasmic), MMP9. Conclusion: The exact and contextual knowledge of engaged signaling pathways and their plasticity may suggest more specific or tailored therapeutic approaches (e.g. anti-RANKL, anti-DKK-1, anti-Sclerostin, anti-Activin A) in each individual case with corresponding regressive, stabile or progressive behavior mirrored in complex interactions between multiple cell types, both neoplastic and non-neoplastic origin. Supported by NT 14393.
P15/2949. Aplikace Hevylite reagents v histologickém vyšetření trepanobioptických tkáňových vzorků
Flodrová P., Flodr P., Pika T.
(Ústav klinické a molekulární patologie LF UP, Olomouc; Hemato-onkologická klinika FN, Olomouc)
Úvod: Primární protilátky, které se váží současně na těžký a lehký řetězec imunoglobulinu, patří mezi nové reagencie s využitím mimo jiné v imunohistoločků standardně odvápněných trepanobioptických vzorků a u jednoho pacienta s LPL také na vzorku lymfatické uzliny. Panel imunohistochemického vyšetření zahrnoval primární protilátky anti-CD138, anti-kappa, anti-lambda, anti-CD79a, anti-IgM, anti-IgG, anti-IgA a duální protilátky proti těžkému/lehkému řetezci (IgGkappa, IgGlambda, IgMkappa, IgMlambda, IgA kappa). Kombinace duální protilátky proti těžkému/lehkému řetězci byla vybrána pro konkrétní vzorky podle dříve diagnostikovaného typu produkovaného lehkého řetězce. Výsledky CD138+ buňky byly ve vzorcích zastoupeny v rozmezí 30-90%. V polovině případů jsme pozorovali pozitivitu všech tří duálních protilátek, ve zbývajících čtyřech vzorcích byly pozitivní dvě duální protilátky (IgMkappa nebo IgMlambda, IgGkappa nebo IgGlambda). Při vyšetření protilátkami proti samostatným těžkým řetězcům byly ve všech vzorcích detekovány nádorové buňky s pozitivitou IgG, IgA pozitivita se vyskytovala pouze u případu IgA myelomu a IgM pozitivní buňky byly zjištěny pouze u lymfoplazmocytárního lymfomu. Diskuze a závěr V pilotní studii o používání duálních heavy/light chain primárních protilátek jsme zjistili vysoké zastoupení falešně pozitivních výsledků. Vzorky od pacientů s IgG myelomem byly pozitivní také v reakci s duální protilátkou s těžkým řetězcem IgM a IgA, ačkoliv samostatné stanovení anti-IgM a anti-IgA bylo negativní. Současnou pozitivitu IgM/lehký řetězec a IgG/lehký řetězec u vyšetřených LPL nelze spolehlivě hodnotit, neboť v těchto neoplastických buňkách je exprese obou těžkých řetězců popisovaná. Jeden trepanobioptický vzorek s LPL však byl pozitivní také s anti-IgAlambda, přičemž vyšetření anti-IgA bylo negativní. Z našich výsledků vyplývá, že použití heavy/light chain protilátek u vzorků kostní dřeně je značně limitováno s předpokladem neduální „single“ vazby jedné součásti duální protilátky. Předpokládáme i možný vliv preanalytické fáze zpracování vzorků při procesu odvápnění treapanobioptických tkání. Tyto hypotézy je nutno ověřit v pokračování studie. Grantová podpora: IGA_LF_2016_013.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek POSTGRADUÁLNÍ SEKCE 1Článek Wiedermannova přednáškaČlánek Postgraduální sekce 2Článek Konference Ošetřovatelství 1Článek Konference Ošetřovatelství 2Článek Mnohočetný myelomČlánek PsychologieČlánek TransplantaceČlánek PREZIDENTSKÉ SYMPOZIUMČlánek MorfologieČlánek Dárcovské a léčebné aferézyČlánek Laboratorní diagnostikaČlánek Anémie/CytopenieČlánek OŠETŘOVATELSTVÍČlánek TransplantaceČlánek Laboratorní diagnostikaČlánek PODPŮRNÁ PÉČEČlánek TRANSFUZNÍ PROBLEMATIKAČlánek Rejstřík
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2016 Číslo Supplementum1- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Mnohočetný myelom
- Akutní leukemie/Chronická myeloidní leukemie
- Transplantace
- MALIGNÍ LYMFOMY/CHRONICKÁ LYMFOCYTÁRNÍ LEUKEMIE
- POSTGRADUÁLNÍ SEKCE 1
- Laboratorní diagnostika
- PODPŮRNÁ PÉČE
- TRANSFUZNÍ PROBLEMATIKA
- Rejstřík
- Wiedermannova přednáška
- Postgraduální sekce 2
- Symposium on Advances in Molecular Hematology 1: Lymphoma Pathogenesis
- Konference Ošetřovatelství 1
- Symposium on Advances in Molecular Hematology 2: Stressed Hematopoiesis
- Symposium on Advances in Molecular Hematology 3: State of the Art Invited Lecture
- Konference Ošetřovatelství 2
- Mnohočetný myelom
- Akutní leukemie/Chronická myeloidní leukemie
- Psychologie
- Konference zdravotních laborantů 1
- Myelodysplastický syndrom/ Myeloproliferativní onemocnění
- Transplantace
- Maligní lymfomy/Chronická lymfocytární leukemie
- Konference zdravotních laborantů 2
- PREZIDENTSKÉ SYMPOZIUM
- Morfologie
- Dárcovské a léčebné aferézy
- Laboratorní diagnostika
- Anémie/Cytopenie
- OŠETŘOVATELSTVÍ
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Myelodysplastický syndrom/ Myeloproliferativní onemocnění
- Morfologie
- Anémie/Cytopenie
- MALIGNÍ LYMFOMY/CHRONICKÁ LYMFOCYTÁRNÍ LEUKEMIE
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




