-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
VYŠETŘENÍ ZOBRAZENÍM MAGNETICKOU REZONANCÍ V UROLOGICKÝCH INDIKACÍCH
MAGNETIC RESONANCE IMAGING IN UROLOGICAL INDICATIONS
MRI examinations have increasingly been used in urological indications thanks to the better accessibility of MRI devices and absence of any known undesirable effects. In some regions such as pelvis minor the accuracy of tissue differentiation of MRI is higher than that of CT; in other regions it provides an element in the ultrasonography - computer tomography - MRI diagnostic algorithm targeting an accurate diagnosis.
KEY WORDS:
magnetic resonance, diagnostic algorithm, tissue differentiation
Autoři: MUDr. Jiří Vaníček; doc. MUDr. Petr Krupa, CSc.
Působiště autorů: Klinika zobrazovacích metod LF MU a FN U sv. Anny, Brno
Vyšlo v časopise: Urol List 2006; 4(2): 44-49
Souhrn
Zobrazení magnetickou rezonancí se díky dostupnosti přístrojů a absenci známých nežádoucích účinků MRI-vyšetření stává stále častěji nástrojem diagnostického zobrazování i v uroradiologii. V některých oblastech, jako je například malá pánev, má vyšší tkáňové rozlišení než CT, v jiných doplňuje diagnostický algoritmus ultrasonografie - počítačová tomografie - zobrazení magnetickou rezonancí na cestě ke správné diagnóze.
KLÍČOVÁ SLOVA:
magnetická rezonance, diagnostický algoritmus, tkáňové rozlišeníÚVOD
Vyšetření pomocí zobrazení magnetickou rezonancí (MRI) se díky stále většímu počtu přístrojů stává dostupnějším vyšetřením mimo jiné i v urologických indikacích. V některých případech doplňuje diagnostický algoritmus v pořadí RTG - USG - CT - MRI - PET apod. [1,2], v jiných případech lze některé modality vynechat (například CT v případě diagnostiky malé pánve či dna pánevního, kde je i vyšší tkáňové rozlišení oproti CT, vyšetření urogenitálního systému u dětí a podobně) a po USG--vyšetření provést přímo MRI a ušetřit pacienta radiační zátěže [3]. Rovněž v případech renální insuficience, závažné alergie na jodovou kontrastní látku používanou při CT-vyšetření se může MRI stát metodou volby k zobrazení urogenitálního traktu, následující po USG. Nelze opomenout i absenci nežádoucích účinků při vyšetření pomocí MRI. Problémem zůstává pouze delší doba vyšetření (okolo 30 minut), která se odráží v delších objednacích dobách k vyšetření, a dodržení kontraindikací vyšetření pomocí MRI. Doba vyšetření se ovšem s novými přístroji zkracuje (obr. 1).
Obr. 1. MR přístroj, Symphony 1,5 T, Siemens, pohled do vyšetřovacího prostoru. 
Kontrastní látka používaná při MRI-vyšetření obsahuje gadolinium, urychluje relaxaci v T1-váženém čase, a tím zvyšuje enhancement prokrvených tkání, hlavně parenchymatózních orgánů, ale také patologicky vaskularizovaných lézí. Její tole‑rance pacienty je výborná, případná nefrotoxicita je klinicky nevýznamná, idiosynkratické reakce jsou výjimečné a vážnější reakce extremně vzácné. Neobsahuje samozřejmě jod, který může být nositelem alergických reakcí při IVU - nebo CT-vyšetřeních. Tato fakta vedou ke stále častějšímu využívání MRI-přístroje k diagnostice onemocnění i urologických pacientů:
LEDVINY
K vyšetření jsou indikování pacienti, u nichž je potřebné zobrazení anatomických vztahů ledvin a okolí, vlastností ledvinných expanzí, objasnění ledvinných obstrukcí, infekcí, cévního zásobení, stavu transplantované ledviny [4] apod [5,14] a dále zobrazení vývodného močového systému u dospělých, dětí i plodu.
Senzitivita MRI-zobrazení ledvinných lézí je podobná jako při zobrazení pomocí CT [7]. V případě zobrazení obsahu cystické léze a stěny cystoidní expanze může MRI přinést nové informace (nepravidelnost a sycení stěny, nádorový uzel ve stěně, koloidní obsah léze a podobně), obr. 2-4 [8,9].
Obr. 2. Centrálně nekrotický Grawitzův nádor pravé ledviny. 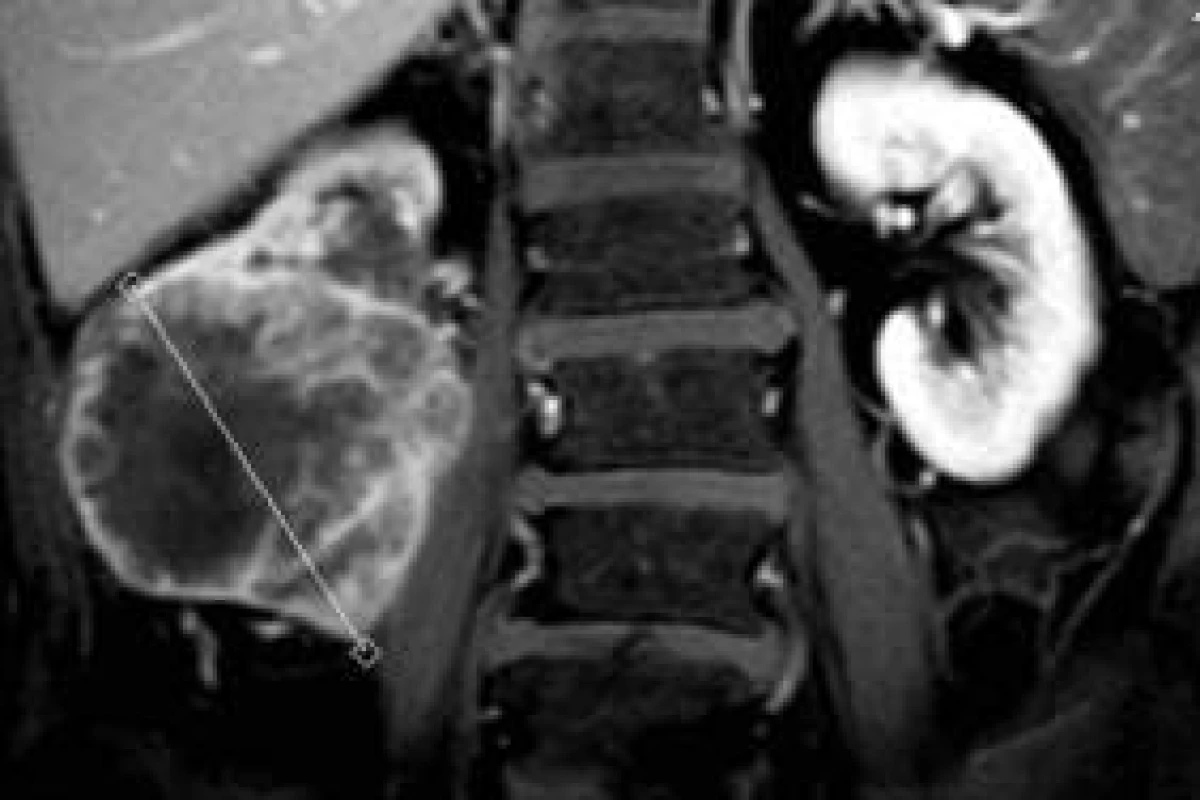
Obr. 3. Cystoidní Grawitzův nádor pravé ledviny, srovnání zesílené stěny cystoidní expanze a prosté cysty v horním pólu téže ledviny. 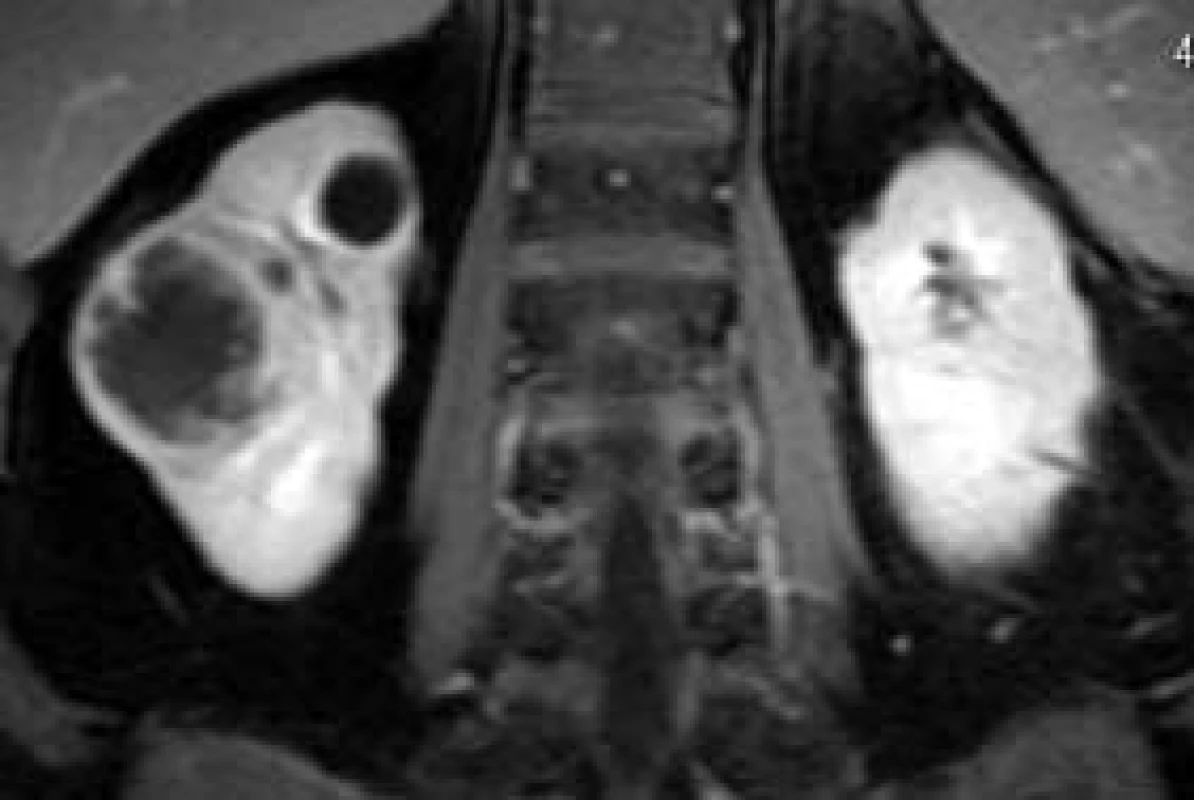
Obr. 4. Drobný cystoidní Grawitzův nádor levé ledviny. 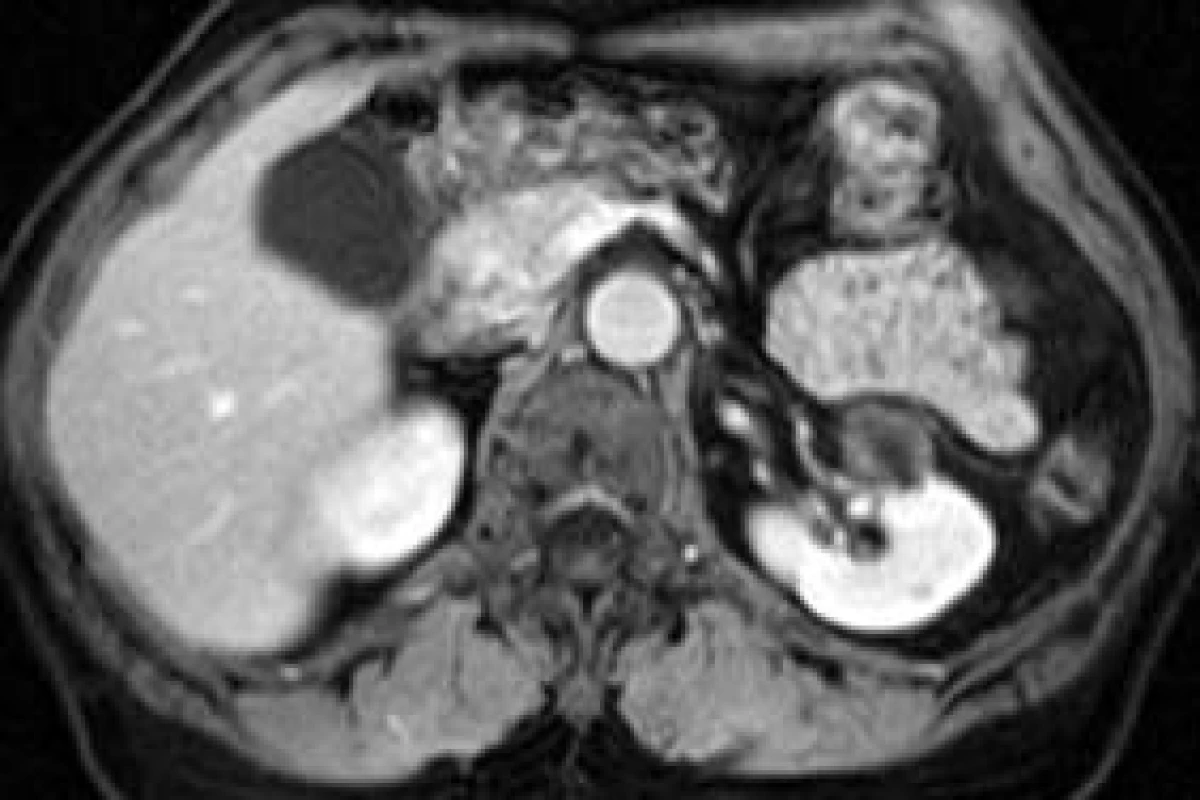
Kategorizaci cystoidních nádorových expanzí dle Bosniaka
Zde je vhodné zmínit kategorizaci cystoidních nádorových expanzí dle Bosniaka [10-12]. Právě tyto nádorové expanze bývají předmětem zájmu urologů i radiologů, podíl zhoubných nádorů v této skupině je významný, diagnostika vzhledem k podobnosti s neškodnou cystou je obtížná a biologické chování cystoidního karcinomu je nebezpečné [13]:
Čtyři kategorie cystických lézí podle Bosniaka:
- I. kategorie - prostá tenkostěnná cysta s čirým obsahem
- II. kategorie - minimálně komplikovaná cysta s nečetnými tenkými septy, s minimálními kalcifikacemi (jako výsledek zakrvácení, infekce, předchozí punkce nebo ischemie), infikovaná cysta a cysta s vyšší denzitou na CT než 20 HU (Hounsfieldových jednotek/Hounsfield Units), po zakrvácení či s vyšším obsahem proteinů a koloidu
- III. kategorie - do ní jsou zařazovány cysty s větším počtem tenkých sept, nepravidelnými kalcifikacemi a polylobulárním tvarem. V této skupině se může vyskytnout benigní multilokulární cystický nefrom, komplexní septovaná multilokulární cysta, denzní kalcifikovaná cysta, komplexní absces či infikovaná cysta, ale i cystický Wilmsův nádor u dětí nebo cystický adenokarcinom u dospělých [14,15]. Útvary zařazené do kategorie Bosniak III vyžadují chirurgické řešení.
- IV. kategorie - léze této kategorie jsou cystickými karcinomy. Mají solidní enhancující (sytící se po podání kontrastní látky na CT či MRI) porci, nepravidelnou stěnu, nádorovou hmotu ve stěně cysty a podobně [16,17].
Multiplanární rekonstrukce zhotovené na základě CT-řezů zobrazují ledviny a okolní retroperitoneum v libovolné rovině. Nejpoužívanější rovinou multiplanárního zobrazení při vyšetření ledvin je rovina koronární neboli frontální, v níž jsou zřetelné anatomické vztahy vzhledem k okolním orgánům (játra, slinivka a slezina) a vztah k páteři a svalovým strukturám okolo, ale jsou i zřetelné obě ledviny najednou a jejich umístění v retroperitoneu. Zhotovení těchto rekonstrukcí však vyžaduje menší odstup jednotlivých řezů, a tedy vyšší radiační zátěž pro pacienta. Při MRI-vyšetření lze zhotovit rovněž libovolnou rovinu řezu bez dalších nežádoucích účinků pro pacienta, pouze s nárůstem vyšetřovacího času. Rozdílem mezi těmito různými rovinami pohledu, chcete-li řezy, je možnost provedení libovolné roviny v CT-multiplanární rekonstrukci kdykoli později na základě zhotovených axiálních řezů bez účasti pacienta [18], zatímco všechny roviny řezu při MRI-vyšetření musí být zhotoveny v jedné době, k doplnění dalších rovin v plném tkáňovém rozlišení musí být znovu účast pacienta. Určitou alternativu poskytuje počítačové postprocesingové zpracování obrazu z MRI na pracovní stanici, ovšem s nižším rozlišením [19].
Častou indikací je MRI-vyšetření ledviny a retroperitonea v případě nádorového onemocnění, při němž pátráme po možném nádorovém trombu v ledvinné a dolní duté žíle (obr. 5). Stanovení rozsahu nádorové trombózy je zásadní při volbě operačního přístupu. Není výjimkou zasahování nádorového trombu vysoko nad ústí renálních žil do dolní duté žíly až do jaterního úseku, viděli jsme i červovité zasahování a vlání nádorového trombu do pravé síně srdce jak při USG-, tak při CT - či MRI-vyšetření. Možnou komplikací je krevní sraženina v dolní duté žíle pod nádorovým trombem jako odezva na oblenění toku v dolní duté žíle (obr. 5) [20].
Obr. 5. Nádorová trombóza Grawitzova nádoru levé ledviny (hvězdička) v levé ledvinné žíle, zasahující až do dolní duté žíly (silná šipka). Oblenění krevního toku v dolní duté žíle vedlo ke vzniku druhého, krevního trombu, který se liší díky jinému složení intenzitou signálu od nádorového trombu. 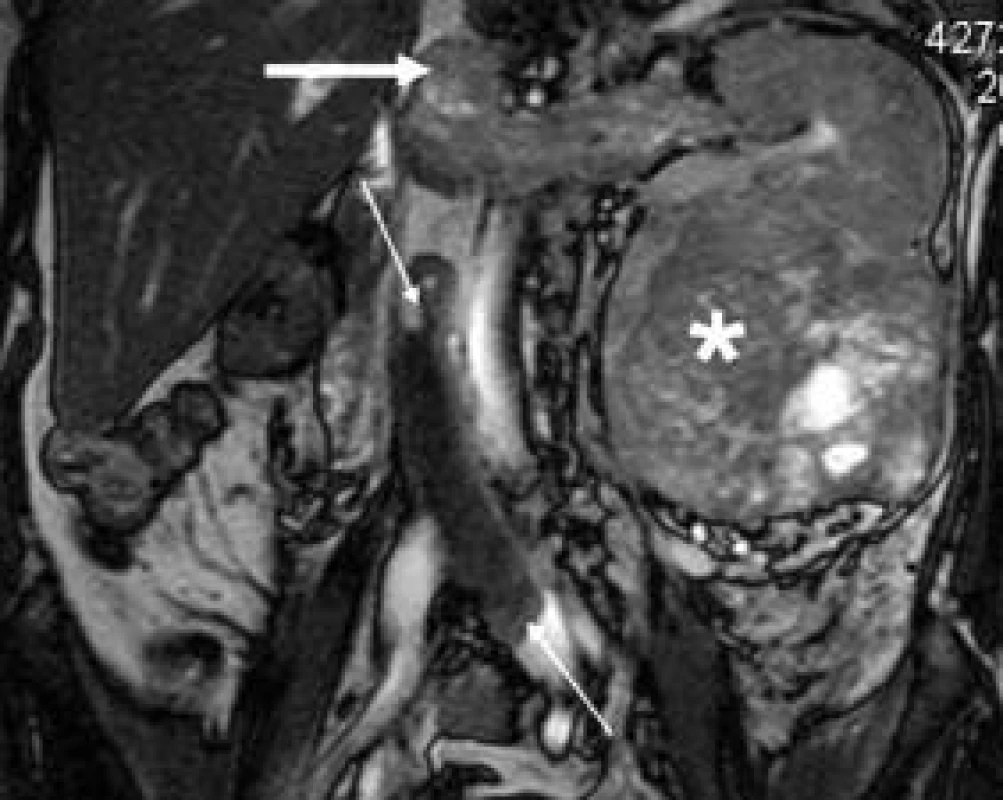
NADLEDVINY
MRI podobně jako CT zobrazuje velikost nadledvin, jejich ložiskové léze, metastázy nebo adenomy se sycením kontrastní látkou analogicky jako při CT-vyšetření. Feochromocytom je typicky hypersignální, světlý, v nativním T2-váženém MRI-obraze. Pro diagnostiku onemocnění nadledvinek se vyšetření pomocí MRI většinou, nebývají-li diagnostické rozpaky při CT-vyšetření, neužívá, snad jen v případě kontraindikací CT. V případě expanzí nadledvin platí podobná diagnostická kritéria jako u vyšetření ledvin.
URETERY, RETROPERITONEUM
K zobrazení ureterů a jejich průběhu v retroperitoneu se MRI používá hlavně u pacientů s kontraindikacemi CT-vyšetření, ve většině případů dávají IVU - a CT-vyšetření dostatek informací. U dětí se může stát metodou volby, která zajistí, aby byl malý pacient ušetřen radiační zátěže. Hlavně v koronární, ale i v axiální a sagitální rovině lze zobrazit expanze v retroperitoneu, zvětšené lymfatické uzliny v rámci onkologických onemocnění, jako jsou karcinom prostaty, měchýře, čípku či těla děložního, nádorů varlete jako seminom a karcinom z embryonálních buněk a vůbec tkání, jejichž spádová lymfatická oblast se týká retroperitonea. Zobrazujeme průběh ureterů, jak nedilatovaných, tak i hydroureterů při obstrukci močových cest následkem expanze zvenčí nebo okluze konkrementem. Díky speciální sekvenci, při níž je zvýrazněn signál tekutiny, a naopak potlačen signál okolních tkání (tuku, parenchymu, skeletu apod) získáme obraz podobný jako u vylučovací urografie, tedy náplň městnání ledviny, ureteru a měchýře. Ovšem na rozdíl od IVU se nejedná o dynamické vyšetření v čase, při němž zobrazujeme kontrastní látku vyloučenou ledvinami z krevního oběhu a které vypovídá o vylučovací schopnosti ledvinného parenchymu a postupu kontrastní látky ve vývodných močových cestách, ale pouze zobrazuje konfiguraci dilatovaného močového systému a obsahu tekutiny v něm. Podmínkou dobrého zobrazení je tedy dilatace močových cest, u gracilních ureterů či kalichů nemusí být jejich konfigurace čitelná. Jmenovaná sekvence nevyžaduje podání kontrastní látky vůbec. (obr. 6).
Obr. 6. Zdvojený dutý systém ledviny - ureter fissus. 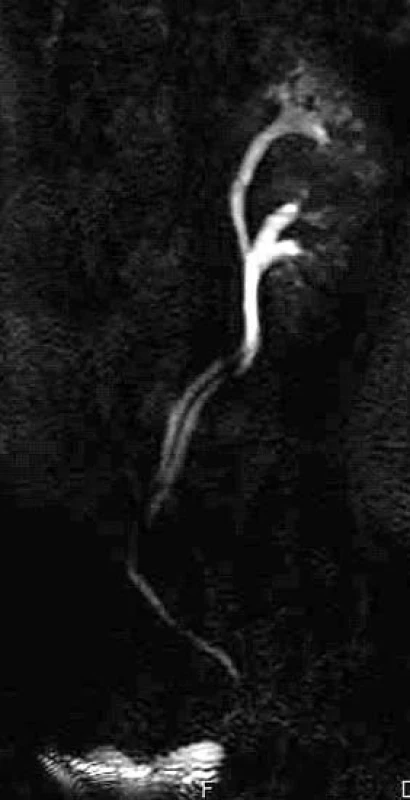
K vyšetření vezikoureterálního refluxu zejména u dětí, jež chceme ušetřit ozáření při RTG-cystografii, se rovněž nabízí MRI. Zde můžeme analogicky jako při RTG-cystografii aplikovat zředěnou kontrastní látku pro MRI do měchýře a sérií krátkých MRI-sekvencí sledovat plnění měchýře a eventuální přítomnost vezikoureterálního refluxu. Lze samozřejmě navázat i „morfologickým“ vyšetřením, při němž posoudíme konfiguraci orgánů pánve či retroperitonea.
MR-ANGIOGRAFIE
MR-angiografií stále častěji nahrazujeme invazivní digitální subtrakční angiografii při potřebě zobrazení cévního zásobení ledvin, aorty a dalších odstupujících tepen v indikacích, jako je například podezření na stenózu ledvinné tepny s eventuální renovaskulární hypertenzí, při níž pak intervenčním zásahem do krevního řečiště pacienta může být až angioplastika stenózy a zobrazovací diagnostika se odehrává pouze na neintervenčním pracovišti MRI. Dále lze použít MR-angiografii k zobrazení konfigurace cévního systému transplantované ledviny nebo ledviny dárce před operací, dále před operací, částečnou resekcí ledviny pro nádor k zobrazení počtu a odstupů zásobujících tepen. Rovněž vyšetřujeme cévní systém k zobrazení anomálních cévních struktur křížících ureter či pánvičku ledviny v případě stenózy pelviureterální junkce aberantní cévou a podobně. Zde je použita MRI-kontrastní látka, aplikovaná ve formě bolu nitrožilně (obr. 7).
Obr. 7. MR-angiografie ledvin: hyploplazie pravé ledviny, levá ledvina je naopak kompenzatorně větší. Nehomogenita sycení parenchymu ledvin je způsobeno přítomností mnohočetných cyst při polycystóze. Vlevo je patrné zdvojení ledvinné tepny a významná koncentrická stenóza jedné z nich. 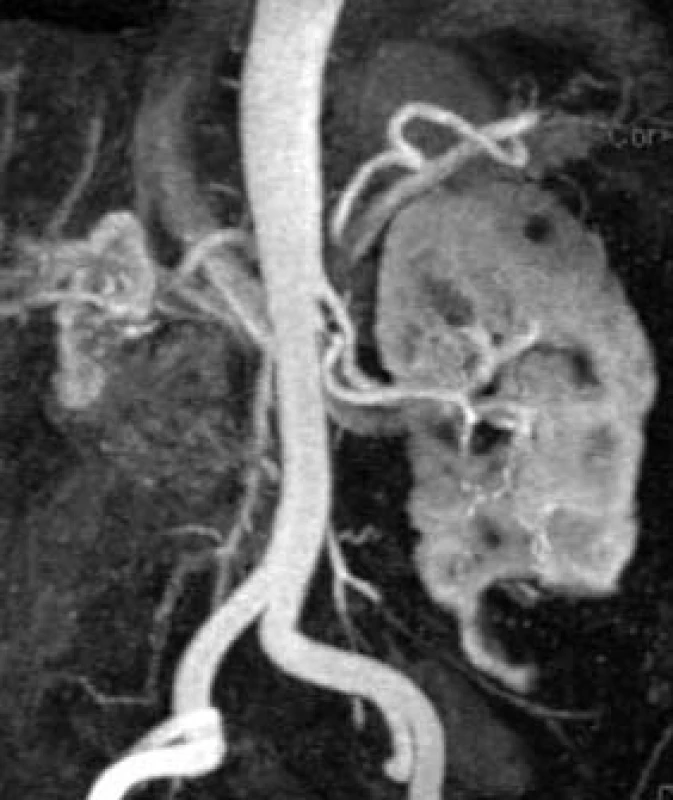
PROSTATA, SEMENNÉ VÁČKY, MOČOVÝ MĚCHÝŘ
Při MRI-vyšetření malé pánve je zjevná vyšší rozlišovací schopnost MRI oproti CT, zvláště pak při použití endorektální MRI-cívky [21]. Ta však není pro běžné použití nezbytná, také se nenachází ve výbavě mnoha MRI-pracovišť. Podobně jako u vyšetření retroperitonea je zde při MRI-vyšetření výhodná možnost zobrazení ve více rovinách (axiální, koronární, sagitální, obr. 9-11). Pro možné pohybové artefakty ze střevní peristaltiky je vhodné podat jako premedikaci před vyšetřením Buscolysin s následující krátkodobým obleněním peristaltiky střeva, obsaženého v malé pánvi. Z indikací k vyšetření je možno jmenovat například karcinom prostaty, v této indikaci pátráme po extrakapsulárním prorůstání nádoru do periprostatického tuku (obr. 12,13) s udávanou senzitivitou 87 % a specificitou 90 %. Na rozdíl od transrektální ultrasonografie, která má podobnou rozlišovací schopnost jako MRI [22,23], lze zobrazit lymfatické uzliny pánve, a už pararektální, presakrální či zevní, společné či vnitřní ilické v rámci onkologického stagingu (obr. 14). Podobně vhodné k vyšetření MRI jsou semenné váčky u diagnóz jako hematospermie apod; v této indikaci bude senzitivita podobná jako u transrektální ultrasonografie. Ovšem u MRI-vyšetření přistupuje možnost aplikace kontrastní látky za účelem zjištění přítomnosti patologického sycení tkání v rámci infiltrace při zánětlivém či nádorovém onemocnění. Orgány malé pánve jako děloha, měchýř, prostata, uretery a podobně jsou samozřejmě v těsné souvislosti s ostatními strukturami malé pánve, střevem, jehož patologické změny mohou imitovat urologické onemocnění nebo vedou nemocného k chirurgovi. Například zánětlivé onemocnění slepého střeva či Crohnova choroba s tvorbou infiltrací, píštělí či kolekcí tekutiny. Se všemi těmito změnami se setkáváme v zobrazovací diagnostice. MR-spektro-skopie prostaty k posouzení poměru obsahu citrátu a cholinu v nemocné a zdravé tkáni prostaty má smysl provádět za použití endorektální MRI-cívky a pravděpodobně pouze na 3T-MRI-přístrojích [24].
Obr. 8. Zonální anatomie prostaty, axiální řez. 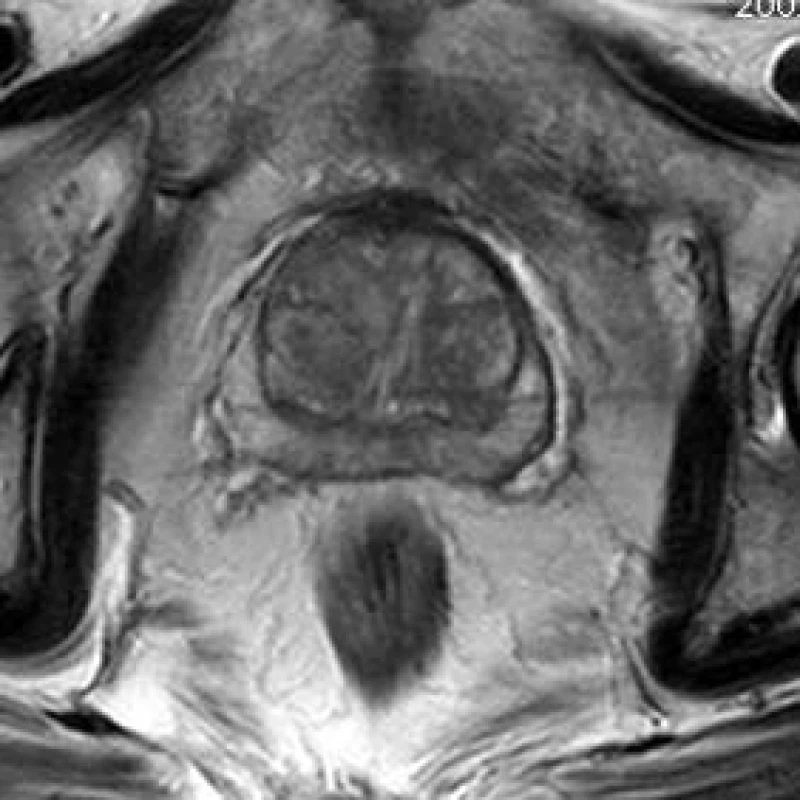
Obr. 9. Benigní hyperplazie prostaty, uzlivoté zbytnění centrální zóny, axiální řez. 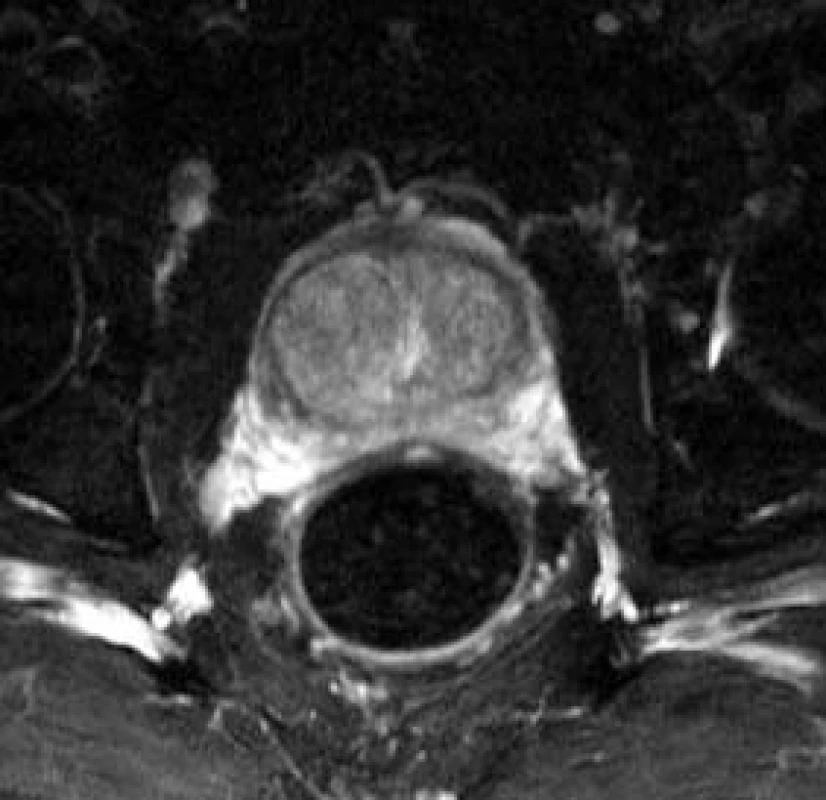
Obr. 10. Benigní hyperplazie prostaty, uzlovité zbytnění centrální zóny, koronární řez. 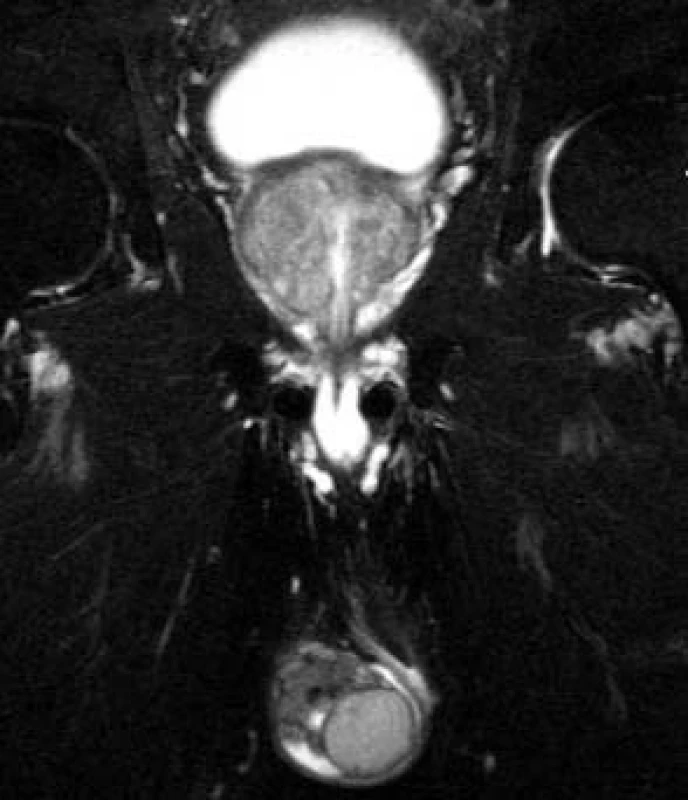
Obr. 11. Cysta utriculus prostaticus. 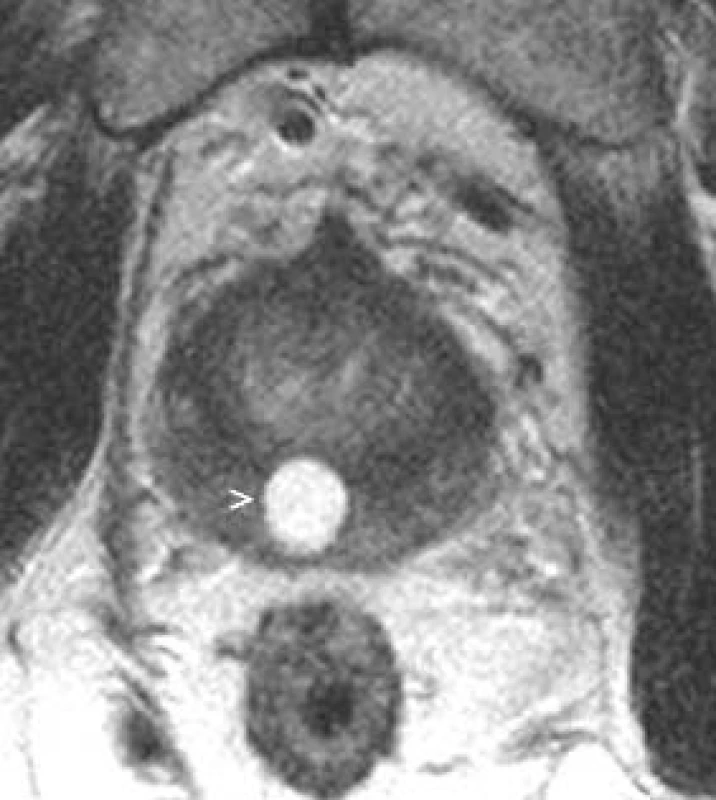
Obr. 12. Karcinom prostaty s přerůstáním na oblast levého semenného váčku. 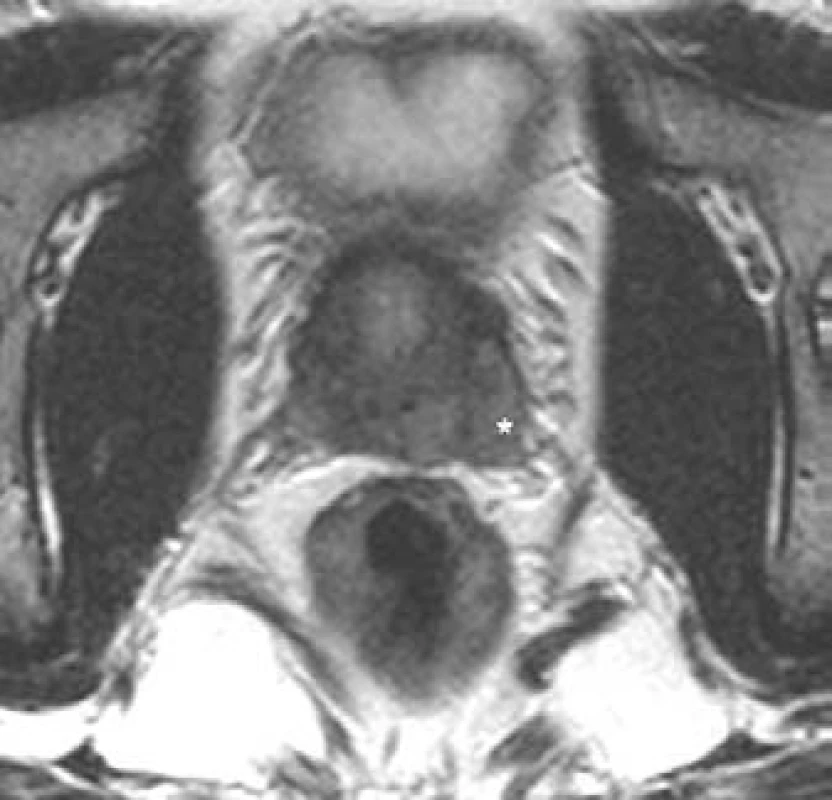
Obr. 13. Levý semenný váček asymetricky objemnější. 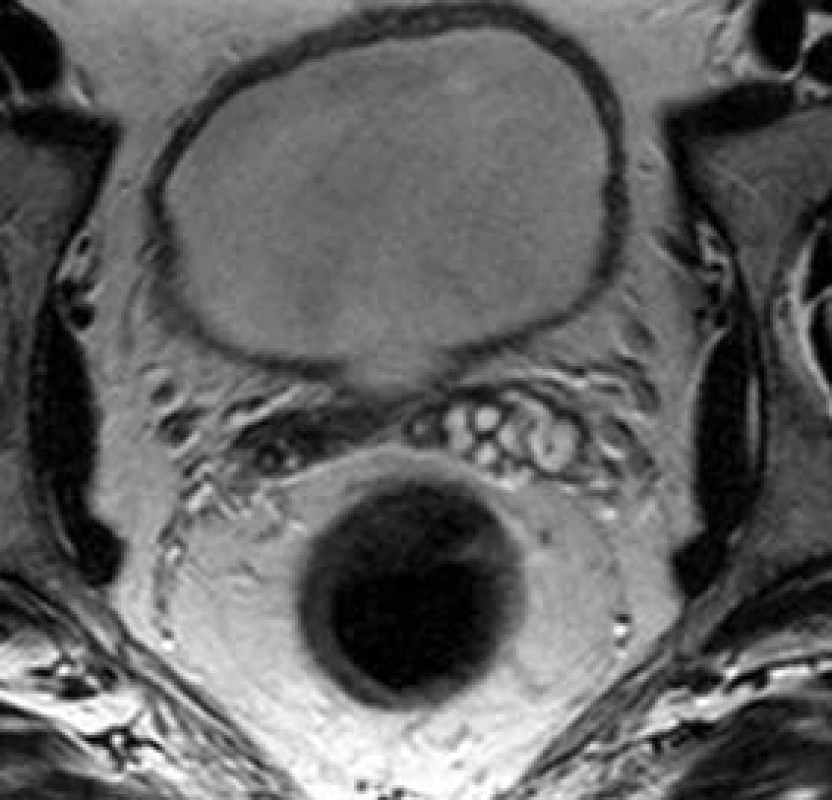
Obr. 14. Karcinom měchýře v divertiklu 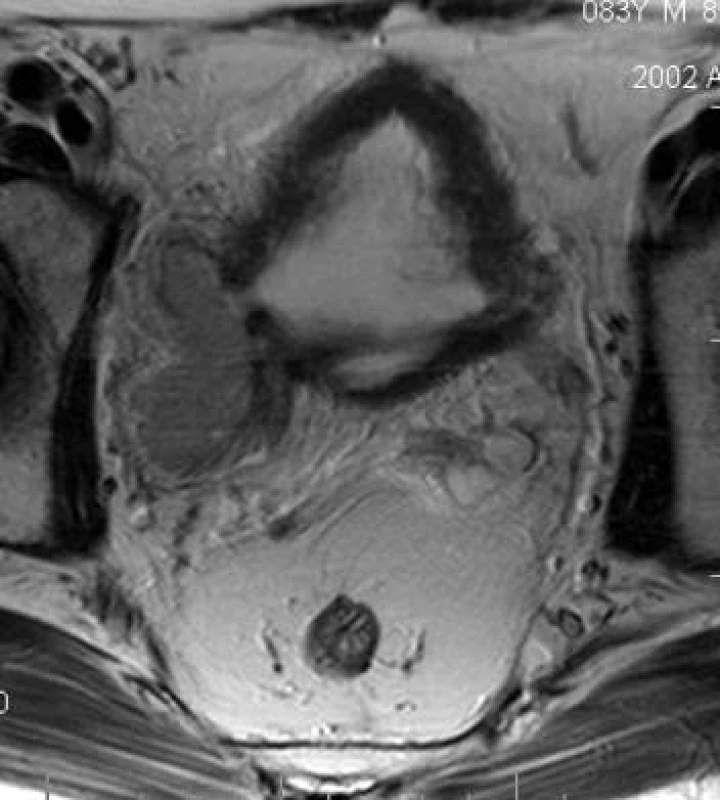
GYNEKOLOGICKÉ INDIKACE
Největší zkušenosti máme s vyšetřováním malignit malé pánve žen; v této indikaci je předmětem zájmu oblast dělohy, ovarií, pochvy, vulvy a lymfatických uzlin [25]. Nejčastější indikací je karcinom děložního čípku (obr. 15), u nějž je třeba stanovit rozsah nádorové infiltrace a její expanze hlavně do parametrií. Podle pokročilosti nálezu pak pacientky podstupují operační řešení, přitom neradikální operace v nádorové infiltraci je poškozující. Tyto pacientky pak podstupují radioterapii a chemoterapii. Zde je zřejmá důležitost správného stanovení rozsahu onemocnění. U karcinomu těla děložního (obr. 16) zase stanovujeme hloubku nádorové invaze do myometria, případně přerůstání na serózu a peritoneum s podobným rozhodováním jako u karcinomu čípku děložního. Karcinom vaječníku vzhledem k časnému přestupu na peritoneum a minimálním nálezu na vlastním vaječníku k primární diagnostice nádorového procesu pomocí MRI příliš vhodný není. Nicméně jsme měli případy pokročilejších ovariálních karcinomů, u nichž se zobrazuje rozsáhlejší infiltrát v polovině malé pánve a origo není jasné, zda pochází ze střeva, či okolí (obr. 17). Na vaječnících můžeme pomocí MRI-diagnostikovat pokročilejší endometriózu. S výhodou lze MRI-vyšetření použít při pátrání po vezikovaginální píštěli (obr. 18). Nedílnou součástí je vyšetření lymfatických uzlin pánve a třísel. Hodnotíme jejich velikost, tvar, někdy jsou patrné v lipomatózních uzlinách metastatické defekty podobně jako u lymfografie [26].
Obr. 15. Karcinom horního labia děložního čípku. 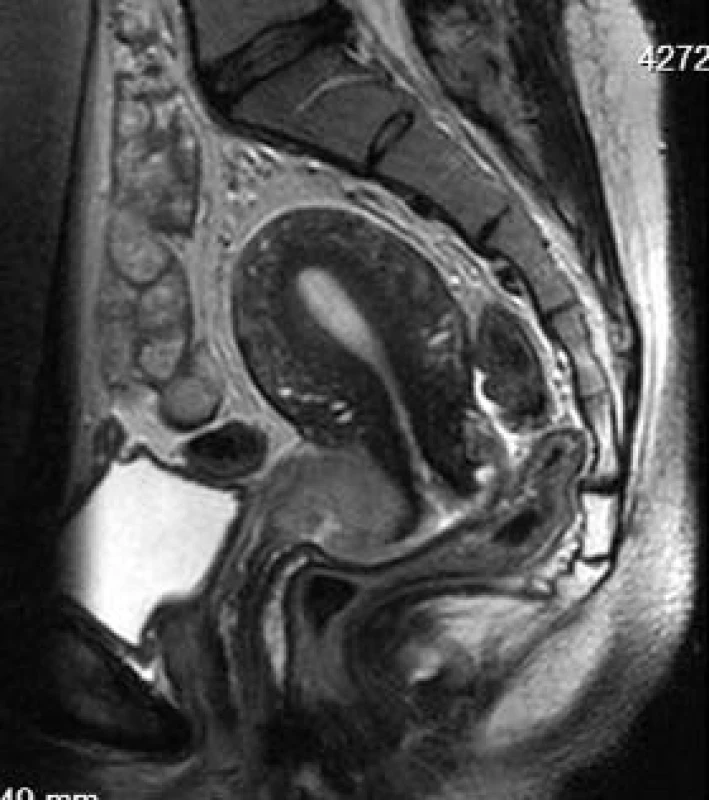
Obr. 16. Karcinom těla děložního, endometria. Vpravo v oválu skupina patologických lymfatických uzlin zevních ilických. Pruh přes snímek je artefaktem obrazu vlivem dýchacích pohybů. 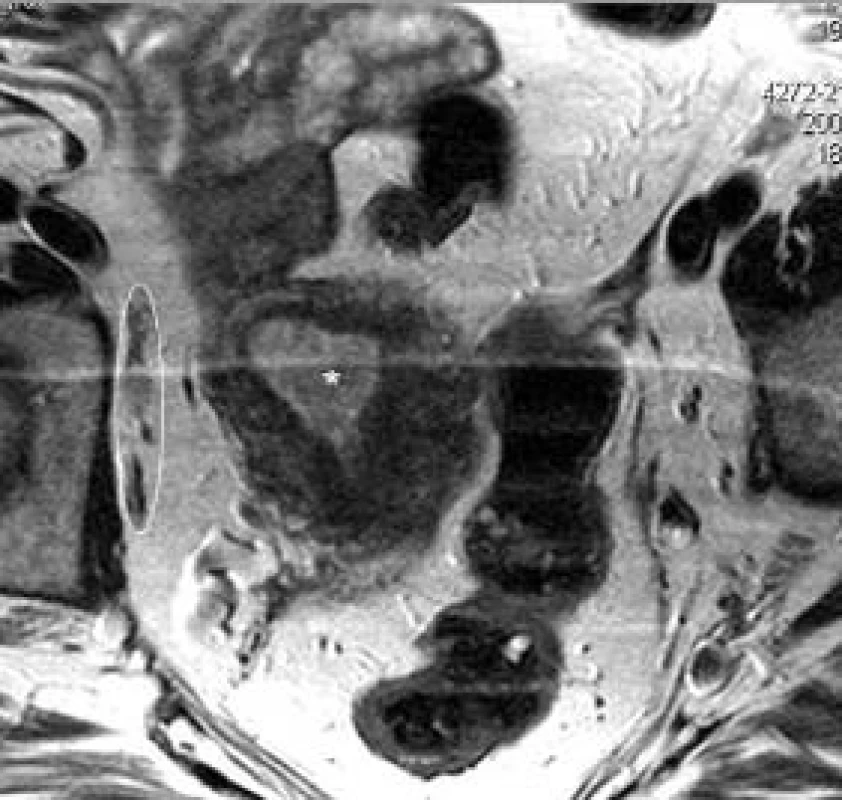
Obr. 17. Karcinom ovaria s infiltrací sigmoidea. Stěna střeva je nápadně zesílená, prosáklá se setřelou strukturou ve srovnání s stěnou rekta aborálněji. Pacientka přichází s difuzní infiltrací tkání malé pánve, diagnózu stanovuje až laparoskopie s histologií. Do té doby nebylo jasné, jaké je origo infiltrace. 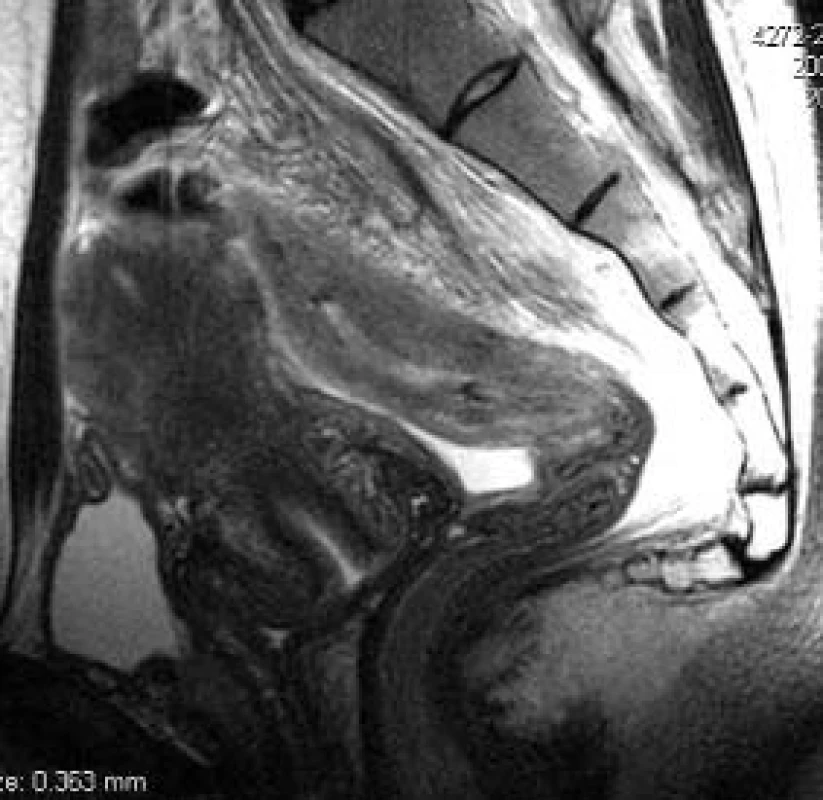
Obr. 18. Vezikovaginální píštěl. 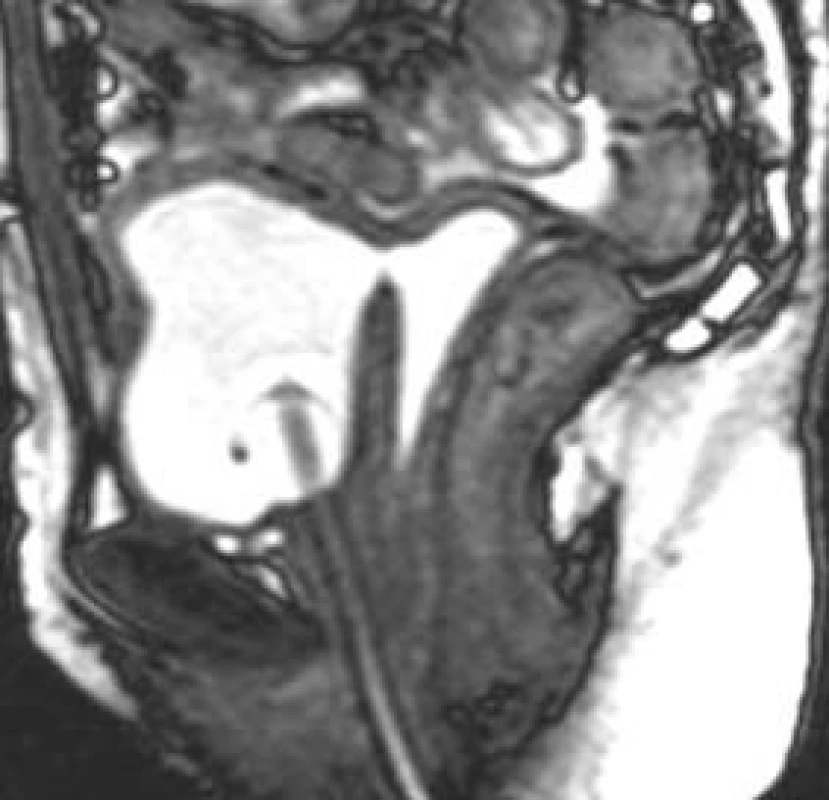
POHLAVNÍ ORGÁNY
Podobně jako při zobrazování orgánů malé pánve i při vyšetření pohlavních orgánů vývodných močových cest lze využít MRI. Zde je konkurentem ultrasonografie s lineární sondou. Nicméně možnost objektivizace zvýhodňuje zobrazení MRI oproti USG.
Fraktura penisu (obr. 19), stav penilního implantátu a rezervoáru (obr. 20), uložených ve skrotu a vedle měchýře, seminom varlete (obr. 21), karcinom vulvy (obr. 22), pochvy (obr. 23) a podobně jsou příklady využití MRI-diagnostiky v oblastech zevního urogenitálu.
Obr. 19. Fraktura penisu: patrná ruptura kavernózního tělesa a hematom. 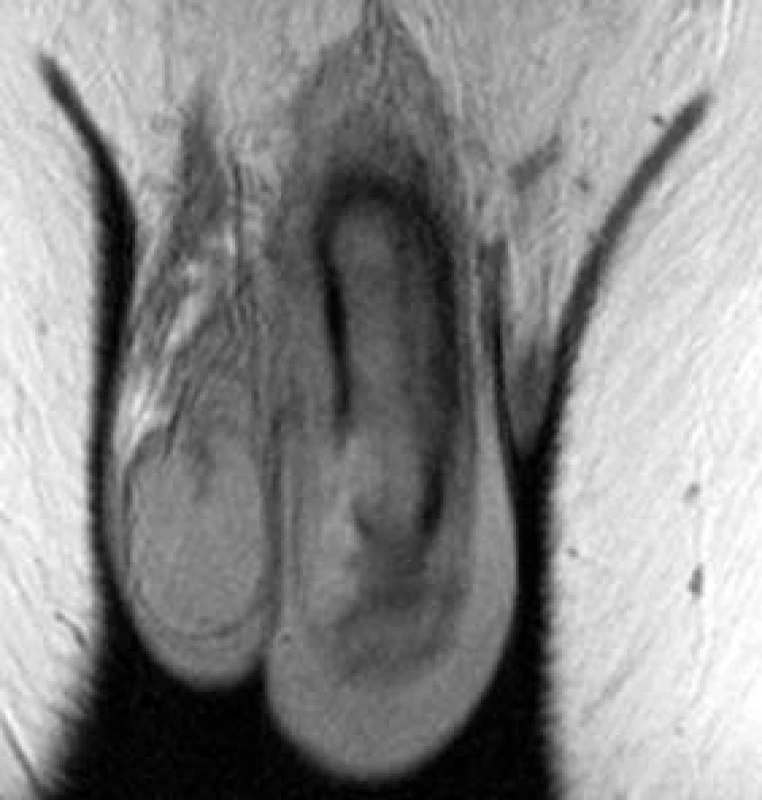
Obr. 20. Penilní implantát, sagitální řez malou pánví. Je patrná rezervoár vedle měchýře, hadička, pumpa a nová „kavernózní“ tělesa. 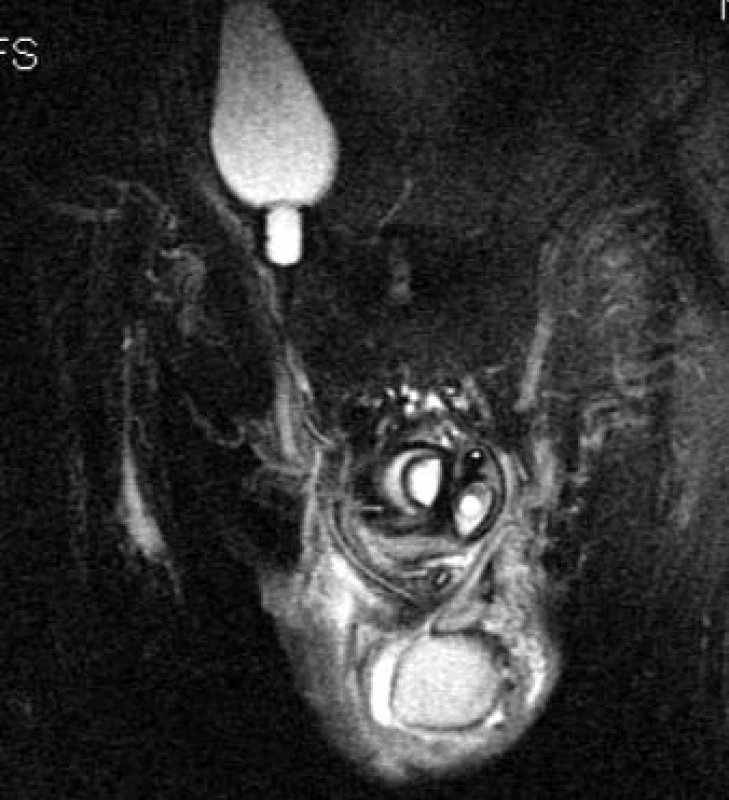
Obr. 21. Seminom varlete: pravé varle zvětšené uzlovitou nádorovou hmotou, hypointenzní v T1 MR-obraze. 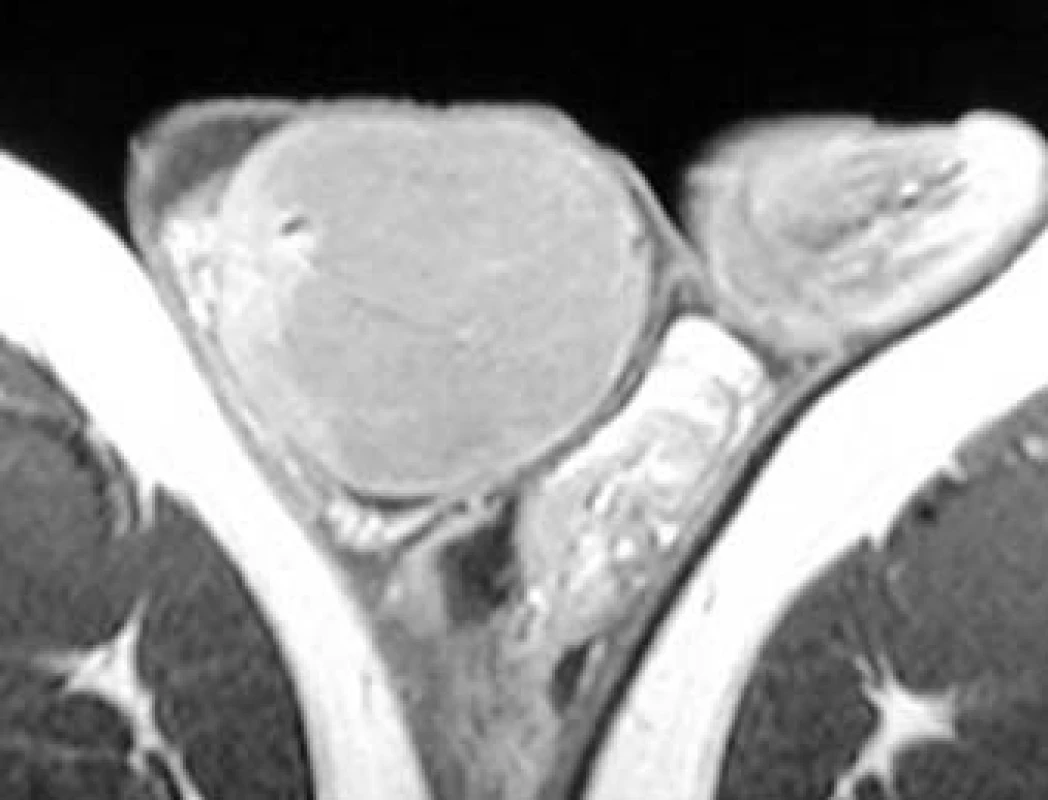
Obr. 22. Karcinom vulvy: sytící se infiltrát v rozsahu malého labia vlevo a introitu pochvy. 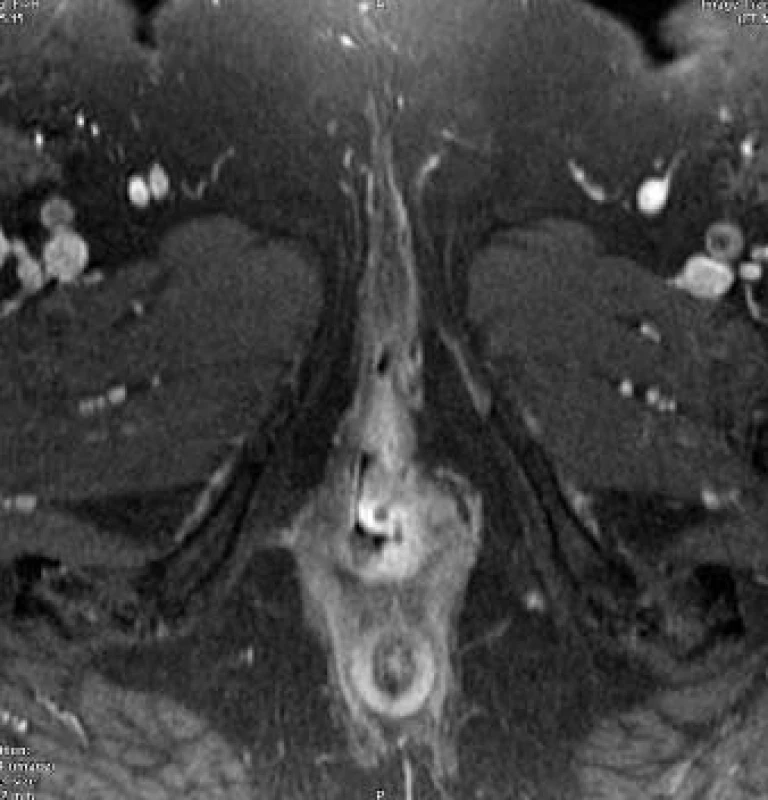
Obr. 23. Karcinom pochvy: na axiálním řezu je zjevná nádorová infiltrace přední stěny pochvy, asymetricky větší vpravo, a její vztah k uretře. 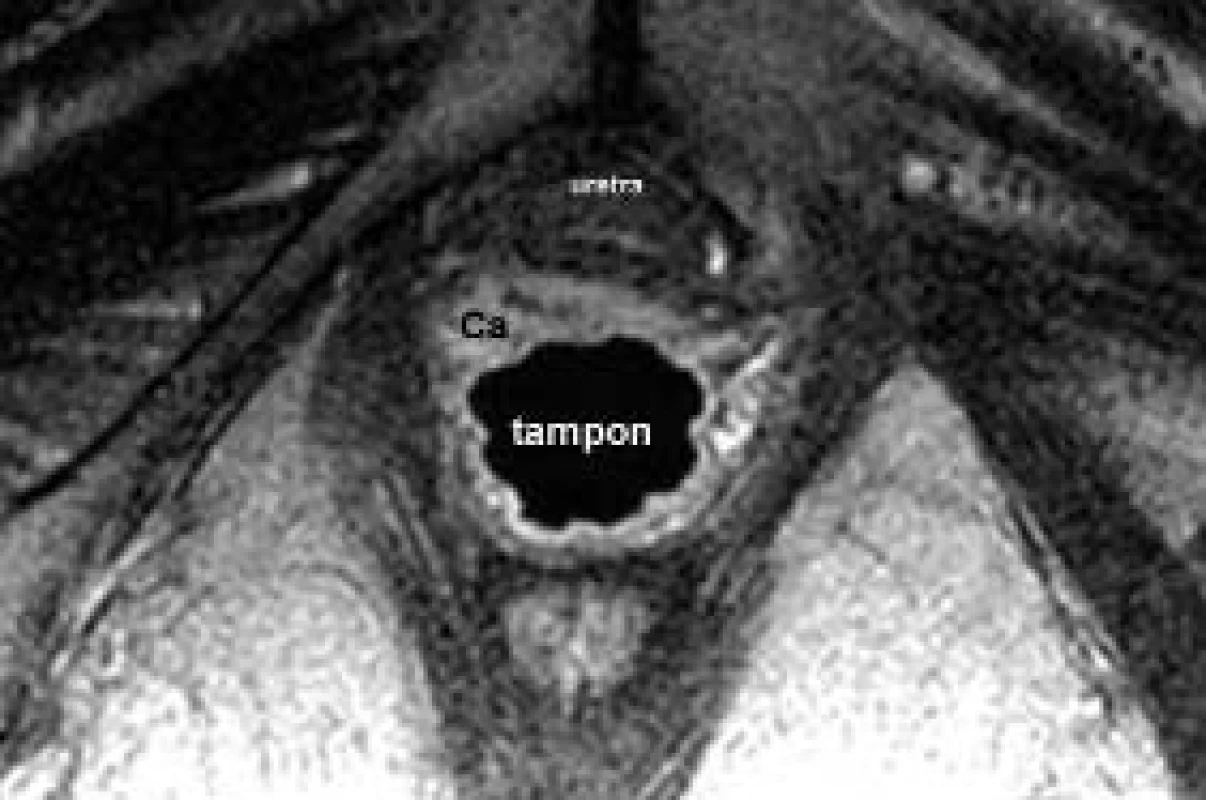
INTERVENCE POD MRI
Vzhledem k prostorovým možnostem, které dává MRI-přístroj, a vyšší ceně instrumentária kompatibilního s MRI-přístrojem se intervence pod MRI-navigací (biopsie, drenáže kolekcí tekutin) neujaly. Mimoto prakticky není oblast či onemocnění, které by se nedalo dosáhnout za pomoci USG - či CT-navigace daleko pohodlněji jak pro pacienta, tak pro lékaře provádějícího intervenci.
ZÁVĚR
Díky dostupnosti MRI-přístrojů je možné přesouvat zobrazovací diagnostiku urogenitálního systému více na MRI-pracoviště, a tak snižovat radiační zátěž pacientů při vyšetřování RTG - a CT-přístroji. Možnost objektivizace (dříve přenos snímků na film, dnes standardně archivace snímků v PACS-systému nemocnice, nebo možnost archivace údajů získaných při vyšetření na CD a jejich promítnutí kdekoli na osobním počítači) zvýhodňuje MRI-zobrazení oproti USG, u níž stále hraje velkou roli subjektivní náhled ultrasonografisty bez možnosti objektivizace. Nicméně v diagnostickém algoritmu stále zůstává a zůstane jako metoda první volby ultrasonografie, dále následuje CT a MRI, přitom v některých případech, například v diagnostice patologických procesů malé pánve lze CT vynechat.
S dalším vývojem přístrojového parku se objevují MRI-přístroje o síle magnetického pole 3 Tesla, oproti nyní běžným 1,5 T-přístrojům poskytují vyšší rozlišení obrazu díky zlepšení poměru signál - šum, s odpovídající softwarovou výbavou pak přístroje umožňují speciální vyšetření jako například spektroskopii prostaty in vivo a podobně [24].
Nové MRI-přístroje s velkým vyšetřovacím polem dovolují celotělové vyšetření v krátkém čase, tedy včetně urogenitálního systému, a tím se stávají nástrojem skríningu.
MUDr. Jiří Vaníček
doc. MUDr. Petr Krupa, CSc.
Klinika zobrazovacích metod LF MU a FN U sv. Anny, Brno
Zdroje
1. Brush JP. Positron emission tomography in urological malignancy. Current Opinion in Urology 2001; 11(2): 175-179.
2. Sakai N, Kanda F, Kondo K et al. Sonographically detected malignant transformation of a simple renal cyst. Int J Urol 2001; 8(1): 23-25.
3. Huang AJ, Lee VS, Rusinek H. MR imaging of renal function. Radiol Clin North Am 2003; 41 : 1001-1017.
4. Leonardou P, Semelka RC, Mastropasqua M et al. Renal cell carcinoma in a transplanted kidney: MR imaging findings. Magn Reson Imaging 2003; 21 : 691-693.
5. Rusinek H, Kaur M, Lee VS. Renal magnetic resonance imaging. Curr Opin Nephrol Hypertens 2004; 13(6): 667-673.
6. Zhang J, Pedrosa I, Rofsky NM. MR techniques for renal imaging. Radiol Clin North Am 2003; 41 : 877-907.
7. Israel GM, Hindman N, Bosniak MA. Evaluation of cystic renal masses: comparison of CT and MR imaging by using the Bosniak classification system. Radiology 2004; 231 : 365-371.
8. Glass RB, Astrin KH, Norton KI et al. Fabry disease: renal sonographic and magnetic resonance imaging findings in affected males and carrier females with the classic and cardiac variant phenotypes. J Comput Assist Tomogr 2004; 28 : 158-168.
9. Farres MT, Ronco P, Saadoun D et al. Chronic lithium nephropathy: MR imaging for diagnosis. Radiology 2003; 229 : 570-574.
10. Harisinghani MG, Gervais D, Hahn PF et al. CT and MR of Atypical Cystic Renal Masses: Revisiting the Bosniak Classification. Radiologist 2001; 8(3): 145-153.
11. Koga S, Nishikido M, Inuzuka S et al. An evaluation of Bosniak's radiological classification of cystic renal masses. BJU International 2000; 86(6): 607-609.
12. Leder RA. Radiological approach to renal cysts and the Bosniak classification system. Curr Opin Urol 1999; 9(2): 129-133.
13. Luciani LG, Tsui KH, Shvarts O et al. Renal cell carcinoma: prognostic significance of incidentally defected tumors. Jour Urol 2001; 65(4): 1223.
14. Borges Oliva MR, Hsing J, Rybicki FJ et al. Glomerulocystic kidney disease: MRI findings. Abdom Imaging 2003; 28 : 889-892.
15. Kreft B, Schild HH. Cystic renal lesions. Rofo 2003; 175 : 892-903.
16. Teigen EL. Newhouse JH. Imaging renal masses. Curr Opin Urol 2000; 10(5): 421-427.
17. Israel GM, Bosniak MA. Renal imaging for the diagnosis and staging of renal cell carcinoma. Urol Clin North Am 2003; 30 : 499-514.
18. Dahlman P, Semenas E, Brekkan E et al. Detection and characterisation of renal lesions by multiphasic helical CT. Acta Radiol 2000; 41(4): 361-366.
19. Yabuki T, Togami I, Kitagawa T et al. MR imaging of renal cell carcinoma: associations among signal intensity, tumor enhancement, and pathologic findings. Acta Med Okayama 2003; 57 : 179-186.
20. Ergen FB, Hussain HK, Caoili EM et al. MRI for preoperative staging of renal cell carcinoma using the 1997 TNM classification: comparison with surgical and pathologic staging. AJR Am J Roentgenol 2004; 182 : 217-225.
21. Smith W, Lewis C, Bauman G et al. 3DUS, MRI and CT Prostate Volume Definition: 3D Evaluation of Intra - and Inter-Modality and Observer Variability: TU-C-J-6B-07. Medical Physics 2005; 32(6): 2083.
22. Chan I, Wells W 3rd, Mulkern RV et al. Detection of prostate cancer by integration of line-scan diffusion, T2-mapping and T2-weighted magnetic resonance imaging; a multichannel statistical classifier. Medical Physics 2003; 30(9): 2390-2398.
23. Kim HW, Buckley DL, Peterson DM et al. In Vivo Prostate Magnetic Resonance Imaging and Magnetic Resonance Spectroscopy at 3 Tesla Using a Transceive Pelvic Phased Array Coil: Preliminary Results. Investigative Radiology 2003; 38(7): 443-451.
24. Futterer JJ, Scheenen TW, Huisman HJ et al. Initial Experience of 3 Tesla Endorectal Coil Magnetic Resonance Imaging and 1H-Spectroscopic Imaging of the Prostate. Investigative Radiology 2004; 39(11): 671-680.
25. Yang WT, Lam WW, Yu MY et al. Comparison of dynamic helical CT and dynamic MR imaging in the evaluation of pelvic lymph nodes in cervical carcinoma. AJR Am J Roentgenol 2000; 175(3): 759-766.
26. Walter C, Kruessell M, Gindele A et al. Imaging of renal lesions: evaluation of fast MRI and helical CT. Br J Radiol 2003; 76 : 696-703.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2006 Číslo 2- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- SOUČASNÉ POSTAVENÍ ANGIOGRAFIE LEDVIN VČETNĚ INTERVENCÍ
- MOŽNOSTI ULTRAZVUKU V DIAGNOSTICE UROLOGICKÝCH ONEMOCNĚNÍ
- ULTRASONOGRAFIE PROSTATY, SEMENNÝCH VÁČKŮ A MOČOVÉHO MĚCHÝŘE
- ZOBRAZOVÁNÍ MUŽSKÉHO GENITÁLU
- NATIVNÍ CT-VYŠETŘENÍ U UROLITIÁZY
- DIFERENCIÁLNÍ DIAGNOSTIKA CYSTICKÝCH LÉZÍ LEDVIN
- DVOUFÁZOVÁ MULTIDETEKTOROVÁ CT-ANGIOGRAFIE NÁDORŮ LEDVIN
- MOŽNOSTI ZOBRAZENÍ NÁDORŮ UROGENITÁLNÍHO TRAKTU POMOCÍ 18FDG-PET/CT
- Editorial
- MRI-VYŠETŘENÍ UROGENITÁLNÍHO SYSTÉMU - NOVÉ POSTUPY A JEJICH VYUŽITÍ
- VYŠETŘENÍ ZOBRAZENÍM MAGNETICKOU REZONANCÍ V UROLOGICKÝCH INDIKACÍCH
- KONVENČNÍ RENTGENOVÁ VYŠETŘENÍ VÝVODNÝCH CEST MOČOVÝCH
- RETROPERITONEÁLNÍ FIBRÓZA: NOVÉ ONEMOCNĚNÍ ZPŮSOBENÉ AZBESTEM?
- ELIGARD - NOVÝ LHRH-AGONISTA K DISPOZICI ČESKÉMU UROLOGOVI
- ZPRÁVA Z 21. VÝROČNÍHO KONGRESU EVROPSKÉ UROLOGICKÉ ASOCIACE, PAŘÍŽ 5.– 8. DUBNA 2006
- ZPRÁVA O VI. JARNÍM UROLOGICKÉM SYMPOZIU
- ADVANCED COURSE ON PROSTATE CANCER AND LAPAROSCOPIC SURGERY, BRUSEL, 4. - 5. 5. 2006
- ZE ZAHRANIČNÍCH PERIODIK
- GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH A POHLAVNÍCH CEST U MUŽŮ 2. ČÁST
- KVÍZ
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- DIFERENCIÁLNÍ DIAGNOSTIKA CYSTICKÝCH LÉZÍ LEDVIN
- NATIVNÍ CT-VYŠETŘENÍ U UROLITIÁZY
- MOŽNOSTI ULTRAZVUKU V DIAGNOSTICE UROLOGICKÝCH ONEMOCNĚNÍ
- VYŠETŘENÍ ZOBRAZENÍM MAGNETICKOU REZONANCÍ V UROLOGICKÝCH INDIKACÍCH
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



