-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba lokoregionálního onemocnění karcinomu penisu
TREATMENT OF LOCOREGIONAL DISEASE IN PATIENTS WITH PENIS CARCINOMA
Penis carcinoma is a very rare urological malignancy. Therapeutic approach includes several therapeutic strategies. The involvement of regional lymphatic nodes and its extent represent the most important prognostic factors for the length of survival in patients with spinocellular carcinoma. The biological development of spinocellular carcinoma and the involvement of locoregional lymphatic nodes long precede the development of distant metastases. In patients with invasion into lymphatic nodes lymphadenectomy has curative effect.
KEY WORDS:
penis carcinoma - treatment - lymphatic nodes - lymphatic drainage - metastasis
Autori: A. Čermák
Pôsobisko autorov: Urologická klinika FN Brno
Vyšlo v časopise: Urol List 2010; 8(4): 5-16
Súhrn
Karcinom penisu je vzácný urologický nádor a přístup k jeho léčbě zahrnuje několik možných terapeutických modalit. Postižení regionálních lymfatických uzlin a jeho rozsah patří mezi nejdůležitější prognostické faktory pro délku přežití u pacientů s dlaždicobuněčným karcinomem. Biologický vývoj dlaždicobuněčného karcinomu penisu a fáze lokoregionálního postižení LU trvá poměrně dlouhou dobu před vznikem vzdálených metastáz. U karcinomu penisu je při postižení lymfatických uzlin samotná lymfadenektomie výkonem kurativním.
KLÍČOVÁ SLOVA:
karcinom penisu - léčba - lymfatické uzliny - lymfatická drenáž - metastázaÚVOD
Karcinom penisu je vzácně se vyskytující nádor. S incidencí 1 : 100 000 tvoří u mužů méně než 1 % všech tumorů [1] . V ČR bylo v roce 2007 hlášeno 79 nových případů. Incidence karcinomu penisu má v ČR mírně narůstající tendenci, mortalita zůstává přibližně stejná.
Graf 1 zobrazuje časový vývoj hrubé incidence (počet nových případů na 100 000 osob) a hrubé mortality (počet úmrtí na diagnózu na 100 000 osob) pro karcinom penisu v celé populaci ČR.
Graf 1. Časový vývoj hrubé incidence a mortality v ČR. 
Graf 2 zobrazuje aktuální věkovou strukturu pacientů s karcinomem penisu a věkovou strukturu zemřelých na danou diagnózu v ČR. Věková struktura ukazuje procento zastoupení věkových skupin mezi pacienty (popř. zemřelými na diagnózu).
Graf 2. Časový vývoj hrubé incidence a mortality v ČR. 
Karcinom penisu postihuje ve 48 % glans, ve 21 % předkožku, v 9 % glans i preputium, v 6 % sulcus coronarius a ve 2 % tělo penisu. Palpovatelné inguinální uzliny jsou přítomny u 50 % pacientů, avšak jen u poloviny z nich se histologicky prokáže přítomnost tumoru. Naopak u 20 % pacientů s klinicky negativními uzlinami je zachycena mikroskopická diseminace [2]. S rizikem postižení lymfatických uzlin úzce souvisí způsob růstu. Povrchově se šířící karcinomy metastazují ve 42 %, vertikálně rostoucí tumory v 82 % a multicentrické karcinomy v 33 %. Lymfatické šíření verukózních karcinomů je vzácné [3].
Postižení lymfatických uzlin je významným prognostickým faktorem. Zatímco pětileté přežití u pacientů s negativními uzlinami je až 95 %, u nemocných s nálezem 1–3 LU 81 % a u pacientů mnohočetným postižením 50 %. Pětileté přežití u pacientů s pánevními uzlinami je raritní [4].
Postižení regionálních lymfatických uzlin a jeho rozsah patří mezi nejdůležitější prognostické faktory pro délku přežití u pacientů s dlaždicobuněčným karcinomem.
Narozdíl od některých jiných nádorů urogenitálního systému, u kterých je při diseminovaném onemocnění indikována systémová protinádorová terapie, je u karcinomu penisu při postižení lymfatických uzlin samotná lymfadenektomie kurativním výkonem. Biologický vývoj dlaždicobuněčného karcinomu je takový, že fáze lokoregionálního postižení lymfatických uzlin trvá poměrně dlouhou dobu před vznikem vzdálených metastáz. Včasná lymfadenektomie tak má svůj terapeutický význam.
REGIONÁLNÍ LYMFATICKÉ UZLINY
Léčebná strategie u pacientů s klinicky negativními lymfatickými uzlinami je nejednoznačná. Názory na profylaktickou inguinální lymfadenektomii jsou vzhledem k významné morbiditě a omezenému přínosu kontroverzní [5,6]. V rozhodnutí o léčebném postupu se proto zohled-ňuje rozsah nemoci, histopatologický grading, charakter růstu a celkový stav nemocného.
European Association of Urology doporučuje u pacientů s vysokým rizikem výskytu okultních lymfatických metastáz (T ≥ 2 nebo G3) modifikovanou, či radikální lymfadenektomii a u nemocných s nízkým rizikem (Ta G1–2, T1 G1) důslednou dispenzarizaci. Léčba nádorů T1 G2 závisí na přítomnosti lymfangioinvaze a charakteru růstu tumoru.
U nemocných s palpovatelnými uzlinami je doporučena bilaterální radikální lymfadenektomie. V případě histologicky potvrzené přítomnosti dvou a více lymfatických uzlin (LU) či extrakapsulárního růstu je nutná adjuvantní léčba [7].
Anatomie
Problematika mízního systému penisu není dosud zcela jednoznačně prostudována. Dosavadní studie konstatují, že jsou vytvořeny samostatné cesty z kožních obalů penisu (včetně předkožky), z oblasti glans penis a z kavernózních těles, jejichž cestami se míza z jednotlivých částí penisu dostává ke skupinám regionálních uzlin. Bylo prokázáno, že míza ze všech částí penisu směřuje do nodi lymphatici inguinales superficiales (skupina primárních regionálních uzlin).
- z kůže penisu směřuje míza do nodi inguinales superficiales, hlavně do superomediální skupiny
- z glans penis do stejné skupiny superomediálních uzlin nebo do nodi inguinales profundi, příležitostně do nodi iliaci externi, případně interni
- z erektilních těles penisu do superomediálních uzlin, někdy do hlubokých uzlin a do retrofemorálních nodi lymphatici iliaci externi
Ze skupiny primárních regionálních uzlin je pak míza drenována do dalších uzlin v pánvi – do nodi lymphatici iliaci externi. Podle směru drenáže existuje tzv. „femorální cesta“ skrze lacuna vasorum a tzv. „inguinální cesta“ skrze canalis inguinalis. „Femorální cesta“ je tvořena dvěma až třemi mízními kmeny, které prostupují femorálním kanálem a končí jeden v hluboké inguinální uzlině ve femorálním kanálu, druhý v Cloquet-Rosenmüllerově uzlině, třetí v mediální retrofemorální uzlině.
„Inguinální cesta“ je tvořena jedním mízním kmenem, který prostupuje skrze inguinální kanál pod semenným provazcem a končí v laterální retrofemorální uzlině.
Nodi lymphatici inguinales superficiales
Nodi lymphatici inguinales superficiales (obr. 1) patří k povrchovému lymfatickému systému dolní končetiny. Mízní cévy jsou uloženy v podkožním vazivu a v počtu 5–11 kolektorů směřují k nodi lymphatici inguinales superficiales. K uzlinám je přiváděna míza také z převážné části gluteální oblasti a ze zevních pohlavních orgánů. Nodi lymphatici inguinales superficiales jsou rozloženy v podkožní tukové vrstvě kolem konečného úseku v. saphena magna v okolí hiatus saphenus nad fascia lata – promítají se tedy do trigonum femorale. Jejich počet kolísá mezi 8–12 uzlinami a jsou relativně velké – mají průměr mezi 1–4 cm. Část uzlin může být vzhledem k jejich velikosti hmatná i za fyziologických podmínek.
Obr. 1. Povrchové ingvinální uzliny. 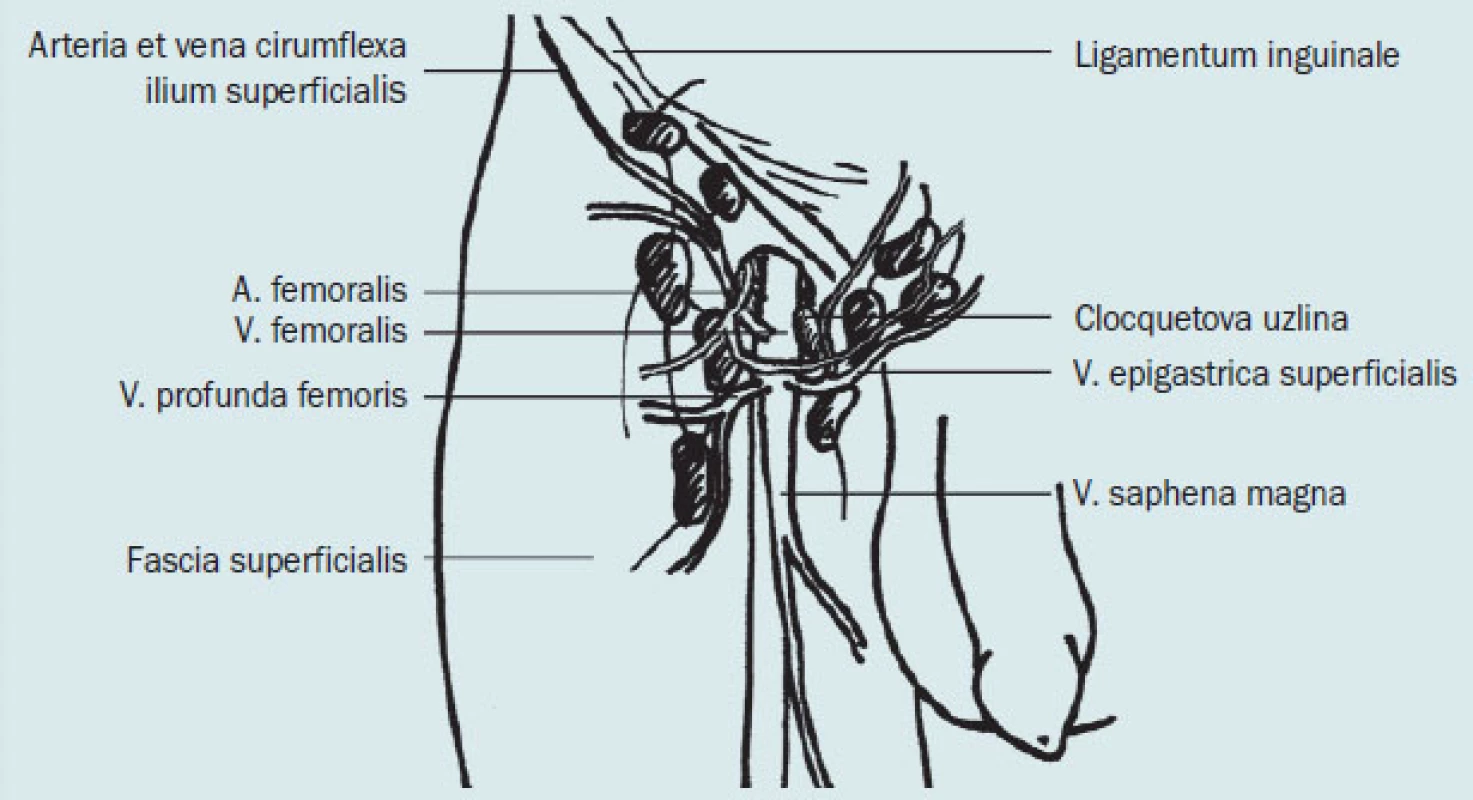
Uzliny se dělí podle uložení do 5 základních skupin: 1. superolaterální (sbírá mízu z povrchových vrstev bederní krajiny, z laterální části přední stěny břišní, z horní části gluteální krajiny a ojediněle také ze zevního genitálu z kůže penisu a z předkožky), 2. superomediální (sbírá mízu z povrchových částí přední stěny břišní kaudálně od pupku a představuje hlavní skupinu mízních uzlin, do které je odváděna míza z penisu a skrota, z perinea a z pars analis recti), 3. inferolaterální, 4. inferomediální a 5. centrální.
Eferentní cévy všech uvedených skupin uzlin prostupují v místě hiatus saphenus skrze fascia lata a sdružují se do tří svazků, které vedou do nejdistálnějších (nejperifernějších) nodi lymphatici iliaci externi (tzv. nodi lymphatici lacunares). Mediální a střední svazek prostupují skrze lacuna vasorum (cestou tzv. canalis femoralis) a jdou do nodus lymphaticus lacunaris medialis et intermedius. Laterální svazek prochází skrze lacuna musculorum nad m. iliopsoas do nodus lymphaticus lacunaris lateralis. Část cév laterální skupiny však tuto uzlinu obchází a končí přímo v nodi iliaci communes (bypass). Touto cestou je vytvořen anatomický podklad pro metastazování nádorů penisu přímo do hlubokých pánevních uzlin.
Mezi povrchovými inguinálními uzlinami pravé a levé strany je pod symfýzou uskutečněno kolaterální spojení (prostřednictvím mízních cév v oblasti kořene penisu), a vytváří tak anatomický podklad pro kontralaterální metastazování.
Obr. 2. Povrchové ingvinální uzliny, zonální dělení. 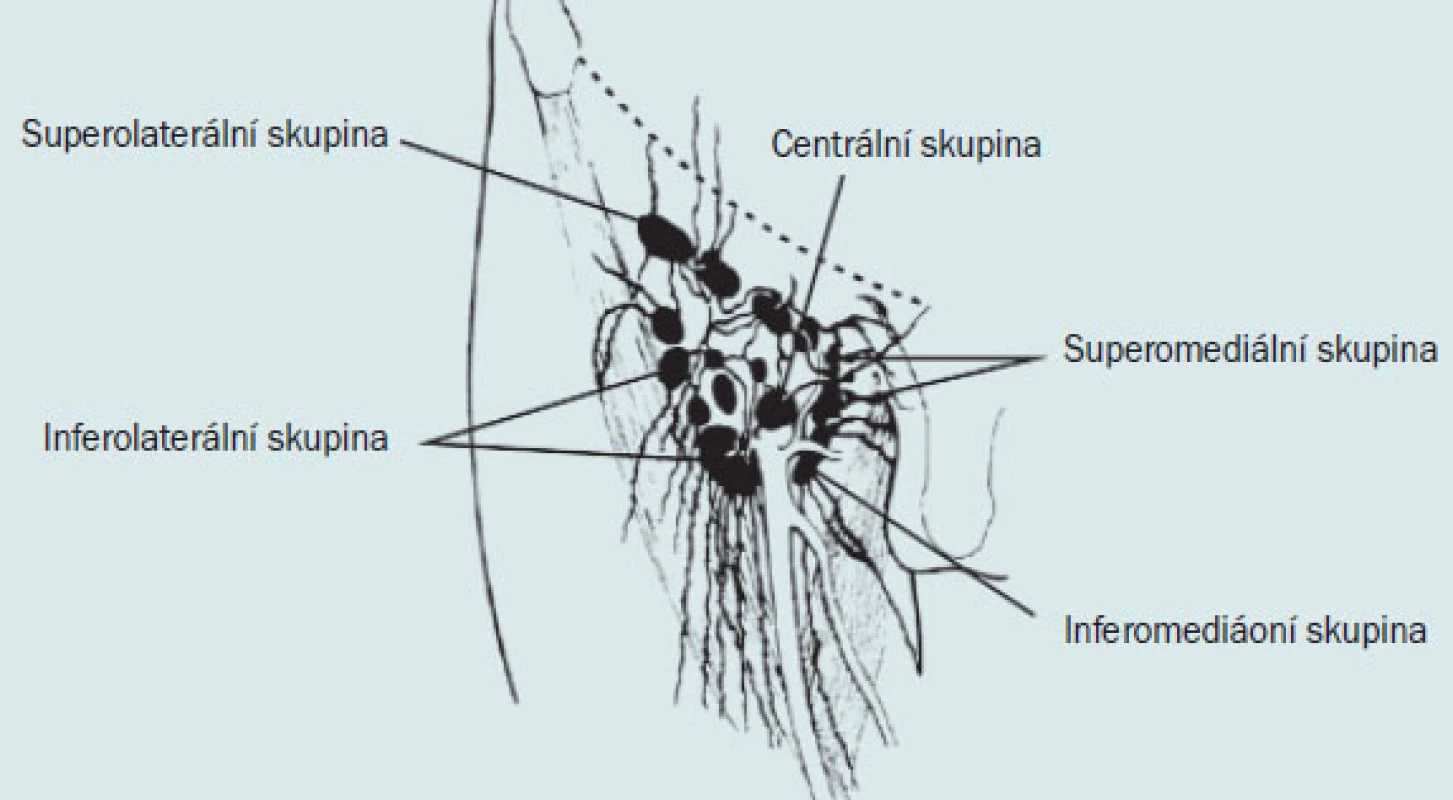
Nodi lymphatici inguinales superficiales mohou být spojeny pomocí mízních cév v podkožní oblasti přední břišní stěny s nodi lymphatici axillares (obr. 3). Homolaterální spojení znamená překročení tzv. vodního předělu – tato skutečnost umožňuje vzdálené metastazování.
Obr. 3. Rozvodí mízního řečiště na stěně trupu – tzv. vodní předěl. 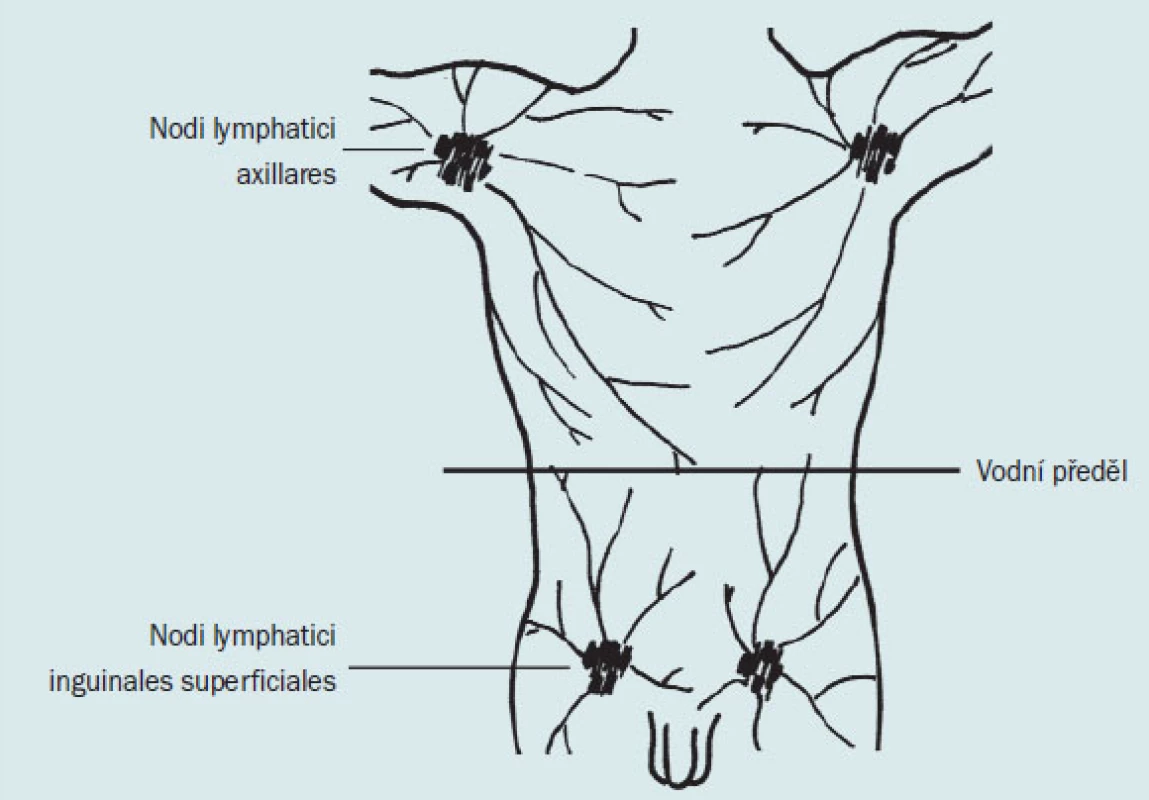
Nodi lymphatici inguinales profundi
Nodi lymphatici inguinales profundi leží ve fossa iliopectinea pod fascia lata podél vasa femoralia. Tvoří je konstantní skupina drobných uzlin v počtu 2–5. Do uzlin je přiváděna míza z hlubokého lymfatického systému dolní končetiny. Mízní cévy probíhají subfasciálně v počtu 3–10 kolektorů. Nejproximálnější a největší uzlina této skupiny leží v mediálním úhlu anulus femoralis (nodus lymphaticus Cloqueti-Rosenmülleri). Eferentní cévy hlubokých uzlin vedou do nodus lymphaticus lacunaris medialis (viz výše) a jejich tributární oblastí jsou hluboké struktury dolní končetiny (svaly, klouby, periost) a také glans a corpus penis. Metastázy nádorů penisu mohou být hmatné v nodi inguinales superficiales a profundi.
Nodi lymphatici iliaci
Pánevní mízní uzliny se dělí do tří skupin: nodi lymphatici iliaci externi, iliaci interni (hypogastrici) a communes [8].
Nodi lymphatici iliaci externi tvoří 2–3 řetězce podél vasa iliaca externa (mediální, laterální a někdy i intermediální). Uzliny přijímají mízu (prostřednictvím nodi lymphatici inguinales superficiales) z dolních končetin, ze stěny pánevní, z močového měchýře a z penisu.
Nodi iliaci externi jsou mezi sebou volně propojeny mízními cévami.
Nodi lymphatici iliaci interni (hypogastrici) jsou tvořeny uzlinami, které provázejí vasa iliaca interna a jejich větve.
Parietální uzliny – nodi lymphatici glutei superiores et inferiores, nodi lymphatici sacrales laterales et medii jsou uloženy na stěně pánve.
Viscerální uzliny mají vztah k pánevním orgánům a jejich cévám nodi lymphatici vesicales, nodus lymphaticus retroprostaticus, nodus lymphaticus vesiculodeferentialis, nodi lymphatici rectales medii. Jejich označení je dáno jejich vztahem ke krevním cévám a pánevním orgánům. Aferentní mízní cévy k těmto uzlinám přicházejí od uvedených anatomických struktur.
Nodi lymphatici iliaci communes tvoří skupina 2–5 uzlin (1–15), které jsou rozloženy podél vasa iliaca communa. Mediální skupiny uzlin obou stran se pod promontoriem spojují, a bývají proto označovány jako nodi lymphatici promontorii seu subaortici. Sbírají mízu z nodi iliaci ext. a int.
LYMFATICKÁ DRENÁŽ ZEVNÍCH POHLAVNÍCH ORGÁNŮ U MUŽE
Na penisu jsou v zásadě vytvořeny dva systémy mízních cév, které se téměř nespo-jují – mízní cévy z kůže penisu a mízní cévy z hlubokých struktur penisu.
Cévy z kůže těla penisu odstupují z ventrální strany penisu podél raphe penis a směřují laterálně a dozadu na dorsum penis. Zde se mohou spojovat s cévami z předkožy. U kořene penisu se lymfatické cévy z kůže penisu rozdělí na pravou a levou část. Probíhají podél femorogenitální rýhy a v této oblasti se spojují s mízními cévami ze skrota a perinea a pokračují do nodi lymphatici inguinales superficiales.
Cévy z předkožky jsou organizovány na laterální straně a v počtu 4–10 cév probíhají samostatně a směřují ke kořenu penisu, kde se připojují k mízním cévám kůže penisu a spolu směřují oboustranně do nodi lymphatici inguinales superficiales. Mízní cévy kožního obalu penisu probíhají v podkožní vrstvě a končí též v nodi lymphatici inguinales superficiales.
Míza z kůže penisu a z předkožky odtéká především do superomediální skupiny, kde je uložen tzv. „sentinel nodus lymphaticus“. Tato uzlina představuje primární lokalizaci metastáz karcinomů kůže penisu. Odtok mízy se děje do uzliny, která leží nejčastěji před v. epigastrica superficialis, nebo mediálně od něj. Tato uzlina je jedinou zasaženou uzlinou – podle autora jde o první filtr při karcinomech penisu (tzv. „sentinel node“). Leží mezi mediálním okrajem m. quadriceps femoris a vzestupným ramenem stydké kosti.
Lymfatické cévy z glans penis představují samostatný systém z bohatých kapilárních sítí. Jemné kapilární sítě ze submukózy a z koriálních papil glans penis se spojují do několika sběrných kmenů. Ty konvergují k frenulum praeputii, kde přibírají 2–3 kmeny z distálního úseku močové trubice. Od frenula pak pokračují dorzolaterálně na hřbet penisu. Probíhají subfasciálně (!) podél vena dorsalis penis profunda. Na úrovni corona glandis bý-vají vytvořeny drobné spojky s cévami preputia.
U kořene penisu (ligamentum suspensorium penis) mohou kolektory z glans penis anastomózovat s lymfatickými cévami kožního obalu penisu (z prepucia a z kůže penisu) s tím, že vzniká presymfyzeální pleteň, ve které může být ojediněle vytvořen drobný nodus lymphaticus praepubicus [9]. Tímto způsobem je lymfa z glans penis odváděna spolu s mízními cévami z kožního obalu penisu přímo do nodi lymphatici inguinales superficiales a jejich prostřednictvím do nodi lymphatici iliaci externi. Z presymfyseální pleteně odtéká míza také dalšími cestami. Jedna cesta vede do nodi lymphatici inguinales profundi, speciálně do nodus lymphaticus femoralis medialis a do Cloquetovy--Rosenmüllerovy uzliny. Druhá cesta jde inguinálním kanálem (po jeho dnu pod funiculus spermaticus) do nodus lymphaticus lacunaris lateralis (tzv. „retrofemorální“ uzlina), která je součástí nodi lymphatici iliaci externi. Část mízních cév z glans penis směřuje přímo – bez napojení – na presymfyzeální pleteň do nodi lymphatici inguinales profundi.
Z kavernózních těles penisu jdou 2–3 lymfatické kmeny, které doprovázejí vena dorsalis penis profunda (subfasciálně) k úrovni symfýzy.
Mízní cévy z pars membranacea urethrae (bulbomembranózní uretra) mohou směřovat do nodus lymphaticus lacunaris medialis (tzv. „retrofemorání uzlina“) – součást nodi iliaci externi. Míza z této oblasti je také napojena na periprostatické mízní pleteně a odtud do nodi lymphatici iliaci externi. Z kořene penisu tak odtéká míza podél krevních cév do uzlin pánve.
Mízní cévy pravé a levé strany jsou navzájem spojeny v oblasti kořene penisu pod symfýzou. Metastázy nádorů penisu se proto mohou šířit lymfatickými cévami na obě strany – do nodi lymphatici inguinales superficiales dextri et sinistri [10].
Léčba regionálních lymfatických uzlin
Postižení regionálních lymfatických uzlina jeho rozsah patří mezi nejdůležitější prognostické faktory pro délku přežití u pacientů s dlaždicobuněčným karcinomem.
Na rozdíl od mnoha jiných nádorů urogenitálního systému, u kterých je při diseminovaném onemocnění indikována systémová protinádorová terapie, je u karcinomu penisu při postižení lymfatických uzlin samotná lymfadenektomie kurativním výkonem. Biologický vývoj dlaždicobuněčného karcinomu je takový, že fáze lokoregionálního postižení lymfatických uzlin trvá poměrně dlouhou dobu před vznikem vzdálených metastáz. Včasná lymfadenektomie tak má svůj terapeutický význam.
Logicky vyplývá, že po primárním ošetření nádorové léze penisu musí následovat léčba zjevných palpačně zvětšených uzlin. Předcházet musí i antibiotická léčba potenciálního sekundárního zánětu lymfatických uzlin.
Zatím zůstává k diskuzi několik kontroverzních otázek v přístupu k léčbě lymfatických uzlin.
- Musí předcházet i antibiotická léčba potenciálního sekundárního zánětu LU?
- Je indikované provedení preventivní lymfadenektomie při palpačně normálních (nezvětšených) uzlinách?
- Má být provedena oboustranná lymfadenektomie, pokud je abnormální nález uzlin pouze jednostranný, nebo má být provedena lymfadenektomie pouze na straně zvětšených uzlin?
- Má být lymfadenektomie rozšířená i na pánevní uzliny (jednostranně, nebo oboustranně), nebo se má provádět pouze lymfadenektomie ingvinální?
Indikace k provedení ingvinální lymfadenektomie
Zdrojem zvětšených lymfatických uzlin a lymfagitidy může být infekce primárního nádoru, a proto by měli být všichni pacienti přeléčeni 4–6týdenní kůrou antibiotiky. Po ukončení léčby musí být znovu pečlivě vyšetřena oblast třísel na přítomnost abnormálních uzlin. Tento dříve obecně doporučovaný postup je v poslední době zpochybňován a není uveden ani v EAU Guidelines. Po ukončení antibiotické léčby je v polovině případů prokázáno metastatické postižení [11]. 30–60 % pacientů s karcinomem penisu má zvětšené, palpačně detekovatelné ingvinální uzliny. Rovněž výskyt nových zvětšených uzlin v průběhu sledování je častěji způsoben nádorovým onemocněním, vzácně z důvodu zánětlivé reakce. Pokud jsou metastázy klinicky detekovány, jsou v 60 % případů přítomny též na kontralaterální straně [12]. Pacienti s palpačně přetrvávajícími zvětšenými ingvinálními uzlinami jsou indikováni po odpovídající antibiotické léčbě k ingvinální lymfadenektomii.
Obr. 4. Hluboké ingvinální uzliny. 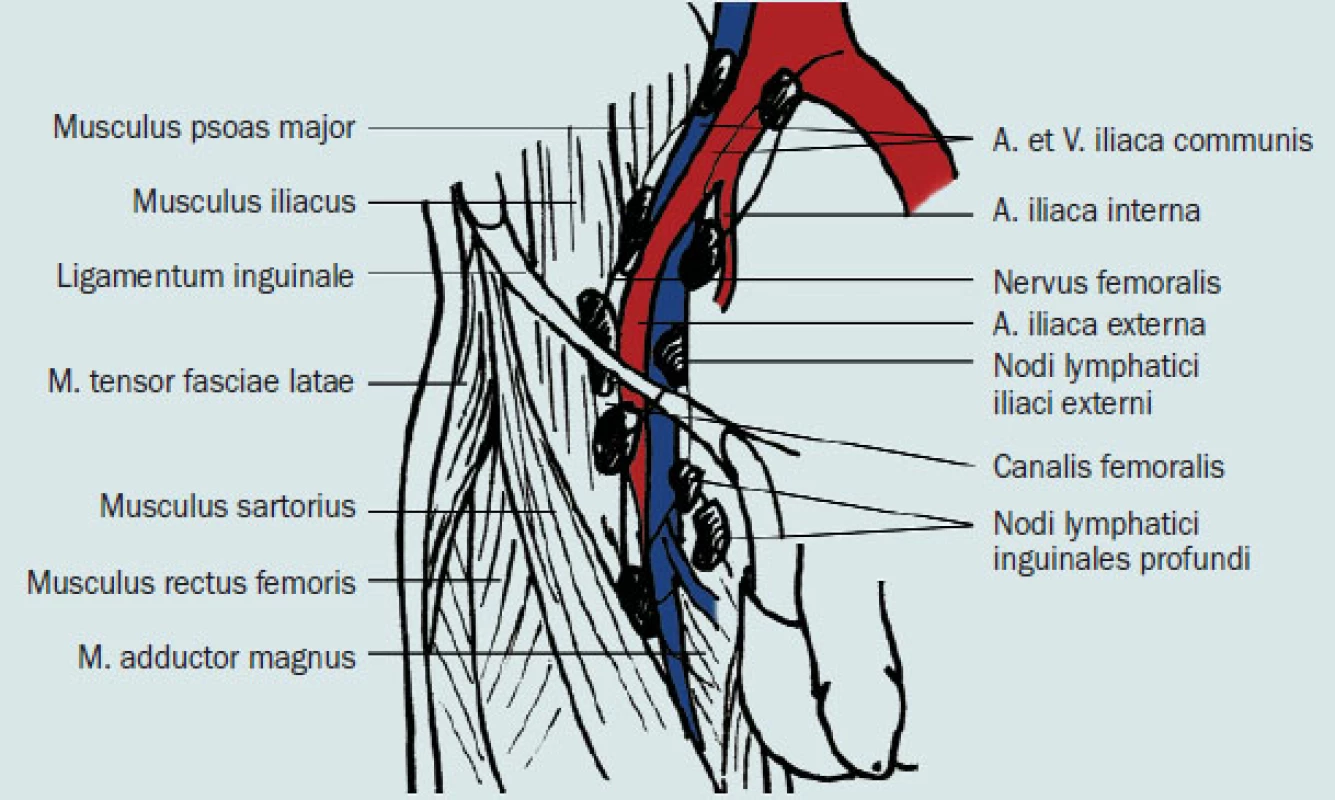
Obr. 5. Schematický přehled mízních uzlin pánve. 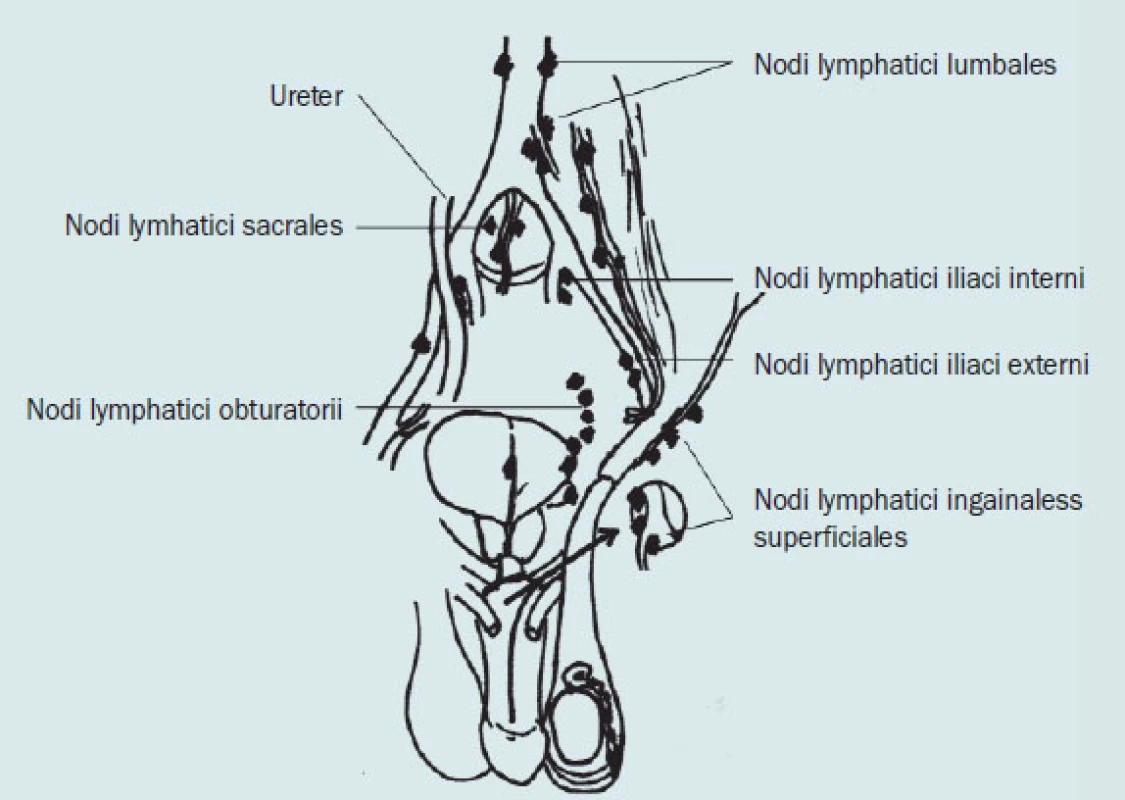
Obecně pacienti s „low-grade“, neinvazivním nádorem a klinicky negativními uzlinami mohou být sledováni. Sledování s pečlivým vyšetřením uzlin musí být prováděno každé dva měsíce po dobu dvou let. U pacientů, u kterých nelze z jakéhokoli důvodu zajistit pravidelné sledování a vyšetřování, je třeba indikovat lymfadenektomii.
Prognostické faktory výskytu a rozvoje metastatického onemocnění
Pacienti bez evidentních ingvinálních metastáz (potvrzeno histologicky) mají pravděpodobnost pětiletého přežití 73 % (46–100 %).
Pacienti po resekci ingvinálních metastáz mají 60% pravděpodobnost (0–86%) pětiletého přežití. Pacienti s minimálním metastatickým postižením (obecně £ 2 uzliny) mají vyšší pravděpodobnost pětiletého přežití (77 %/25 %) v porovnání s pacienty s vyšším počtem metastáz (> 2). Lepší šanci (80 %) na přežití mají následující pacienti
- s minimálním metastatickým postižením (počet postižených uzlin max. 2)
- unilaterální postižení
- bez známek prorůstání karcinomu mimo uzlinu
- bez známek postižení pánevních uzlin
Předoperační i pooperační i preventivní ozáření pacientů s negativním uzlinovým nálezem se nedoporučuje, neboť nemá vliv na přežití, a naopak zhoršuje hojivost oblasti operačního pole [13].
MODIFIKOVANÉ TECHNIKY
Pacienti bez palpačně zvětšených uzlin absolvují vyšetření s cílem detekovat eventuální přítomnost lymfatického postižení. Zvolený postup by měl pro pacienta znamenat co nejmenší morbiditu. Metodou volby jsou
- jehlová aspirační cytologie (FNAC – „fine-needle aspiration cytology“)
- biopsie uzlin
- sentinelová biopsie uzlin (SLNB – „sentinel lymph node biopsy“)
- rozšířená sentinelová biopsie uzlin (ESLNB – „extended sentinel lymph node biopsy“)
- peroperační lymfatická detekce (IOLM – „intraoperative lymphatic mapping“)
- povrchová lymfadenektomie
- modifikovaná kompletní lymfadenektomie
Jehlová aspirační cytologie
Zkušenosti s jehlovou aspirační cytologií nejsou rozsáhlé a většina informací je čerpána z jedné série vyšetření [14]. Technika spočívá nejprve v provedení pedální, bipedální nebo penilní lymfografie. Poté pod skiaskopickou nebo CT kontrolou je proveden vícečetný odběr vzorků. Metoda je však zatížena vyšší četností nesprávně negativních výsledků (20 %) [15]. Tyto výsledky a poměrně náročné technické manipulace při lymfografii činí zvláště u pacientů bez palpačně hmatných uzlin metodu méně praktickou. Přímá punkce a aspirace palpačně hmatných uzlin je i bez lymfografie snadná a pro pacienty málo zatěžující a v případě pozitivního nálezu umožňuje včasně zahájit odpovídající léčbu.
Biopsie strážních uzlin
Klasická Cabanasova koncepce vychází z předpokladu, že místem primárního záchytu metastatického rozsevu je lymfatická síť ležící mezi v. pudendalis externa a v. epigastrica [16,17]. Negativní biopsie strážních uzlin v třísle má dostatečnou výpovědní hodnotu a další lymfadenektomie není nutná. Potvrzuje to pětileté přežití 90 % případů. Pokud bylo biopsií vysloveno podezření na uzlinové postižení, je nutná disekce povrchových i hlubokých uzlin.
Sentinelová uzlina
Regionální lymfatické uzliny (LU) hrají obrovskou roli v obraně organizmu proti nádoru. Sentinelová uzlina je prvním místem v organizmu, kde přichází imunitní systém do kontaktu s buňkami primárního nádoru. I když informace o jednotlivých fázích metastatického procesu nejsou v současné době ještě objasněné, je jednoznačně prokázáno, že má sentinelová uzlina klíčovou roli v aktivaci imunitní odpovědi zprostředkované T-lymfocyty. Regulace imunitní odpovědi zde probíhá ve smyslu +/ – (aktivace a suprese). V současné době již existují informace o snížené modulaci imunitní funkce u těch sentinelových uzlin, kde již byla přítomna metastáza primárního nádoru. Podobně byla prokázána redukce exprese některých buněčných znaků na dendritických buňkách i jejich receptorů na T-lymfocytech. Naopak bylo prokázáno, že např. u maligního melanomu v regionálních uzlinách bez přítomné metastázy dochází k významné aktivaci imunitní odpovědi závislé na Th1 a Th2 lymfocytech, ale u pacientů s mikrometastázami nebyl prokázán vzestup hladiny cytokinů navozující Th1 a Th2 odpověď. Jedna z teorií vysvětluje tento fakt tím, že ještě před průnikem mikrometastáz do sentinelové uzliny získávají dendritické buňky informace o antigenní struktuře primárních nádorových buněk a její prezentací T-lymfocytům v sentinelové uzlině startují imunitní reakci.
Proces dalšího šíření nádorů zatím není jasný, nicméně popsaná ztráta imunoprotektivních vlastností sentinelové uzliny se zdá zásadní. V průběhu metastazování mohou antigenní změny vést k navození tolerance specifické imunity, a nádorové buňky se tak vymykají imunitní kontrole. Díky nedávnému poznání růstových faktorů specifických pro lymfatický systém (VEGF-C a D) a jejich receptorů se podařilo objasnit příčiny, které způsobují průnik nádorové buňky z primárního ložiska do okolní tkáně, průnik do lymfatické cévy a její usídlení v regionální uzlině. Cytokiny indukují zvýšenou permeabilitu cév vyživujících nádor, a tak dochází k zvýšenému objemu tkáňové tekutiny a vzestupu intersticiálního tlaku v okolí nádoru. To vede následně ke zvýšení průtoku aferentními lymfatickými cévami, následně sentinelovou uzlinou a dalšími regionálními LU. Tento zvýšený průtok může být spojen se zvýšeným výskytem metastáz v regionální LU a příčinou novotvorby lymfatických cév v okolí nádoru. Primární nádor vylučuje VEGF-C, který stimuluje lymfatické endoteliální buňky, ty migrují zvýšeným proudem tkáňové tekutiny a indukují nádorovou lymfangiogenezi. Tato nově vzniklá endoteliální lymfatická plocha může být místem úniku nádorových buněk z primárního nádoru a jejich zachycení v sentinelové LU [18,19].
Biopsie
Lymfa z určité oblasti nemusí vždy protékat sentinelovou uzlinou, ale může se dostávat do sekundárních nebo terciárních uzlin četnými kolaterálami a spojkami. Dochází tak ke vzniku „skip“ metastáz. Při biopsii tak může nastat negativní nález při vyšetření sentinelové uzliny až v 10 % případů.
Sentinelová uzlina je rozdělena na několik sektorů, protože svádí lymfu z několika spádových oblastí. Je proto nutné předoperačně vyšetřit sentinelovou LU velmi pečlivě (sériové řezy, imunohistochemická vyšetření), aby byly zachyceny i mikrometastázy jen v některé části uzliny.
Při biopsi LU je třeba pamatovat na její sektorové rozdělení. Pozitivní nález postižení potvrzuje, ale negativní vyšetření je zatíženo vysokým rizikem falešně negativního nálezu a postižení LU nevylučuje.
Pokud je průtok primární uzlinou blokován útlakem masivní nádorovou masou, nebo při tukové atrofii LU, probíhá lymfatická drenáž kolaterálami a sentinelová uzlina nemusí být dobře identifikovatelná, nebo nemusí být pozitivní.
Identifikace, odběr a histologické vyšetření je velmi odborná činnost, je zatížena velkou chybou a může mít zásadní důsledky pro nemocného. Základem dobrého výsledku je vysoká odbornost a zkušenost vyšetřujících.
Průkaz metastatického postižení LU je možný jedině histologickým vyšetřením. Klinická ani zobrazovací vyšetření nejsou s jistotou schopna prokázat či vyloučit přítomnost nádorových buněk. Punkční biopsie LU je vzhledem k jejímu sektorovému uspořádání zatížena velkým rizikem falešně negativního výsledku. Jedině chirurgická exstirpace a detailní histologické vyšetření je spolehlivou metodou k diagnostice mikrometastáz.
Identifikace sentinelové uzliny
Identifikaci sentinelové uzliny lze v současné době provést dvěma odlišnými metodami. První z nich je vitální barvení. Druhou metodou je detekce gama záření po aplikaci radioizotopem značeného koloidu. Obě metody jsou dnes považovány za komplementární. Nejvyšší účinnosti se dosahuje při jejich současném použití. Kombinace obou metod zvyšuje pravděpodobnost detekce správné sentinelové uzliny. Dosažení vyšší senzitivity i specifity je však zatíženo vyšší technickou i finanční náročností a větší zátěží pro pacienta.
U první metody se uzlina barví pomocí lipofilního barviva. Nejčastěji se používá lymfotropní patentní modř, která se po aplikaci k primárnímu nádoru rychle adsorbuje do lymfatického systému a barví lymfatickou cévu a první uzlinu. Patentní modř se šíří lymfatickým systémem difuzí a sentinelovou uzlinu barví během několika minut. Jde tedy o metodu čistě peroperační, u které je důležité sledování operačního pole ihned po aplikaci. Optimální množství barviva je okolo 1,5–2 ml [20].
Rizika metody
Před operačním výkonem je důležité upozornit pacienta i anesteziologa na plánovanou aplikaci modrého barviva. Patentní modř se vylučuje močí, a ta je již během operace zbarvena modrozeleně. Někdy může dojít k modrému zbarvení tkání, které může imitovat plicní embolizaci nebo hyperkapnii. Zbarvení obvykle rychle vymizí. Při známé alergii na patentní modř lze použít jiné lymfotropní barvivo (indocyaninová zeleň, nebo isosulfátová modř). U orgánů s komplexním systémem, kam patří urologické nádory, může dojít ke „skip“ metastázám. Tento jev je někdy připomínán jako námitka proti rozhodování o indikaci regionální lymfadenektomie na základě vyšetření sentinelové uzliny.
Dalším rizikem je nedostatečná senzitivita pooperačního vyšetření zmrazeného preparátu zvláště v případě malých metastáz, segmentárních, nebo mikrometastáz. K nedostatečnému zbarvení může dojít i při zmiňované tukové atrofii LU nebo při nedostatečném přítoku lymfatické tekutiny.
Druhou metodou je detekce gama záření po aplikaci radioizotopem značeného koloidu. Větší částice koloidu se šíří lymfatickými cévami pomaleji a na rozdíl od patentní modře jsou v první uzlině fagocytovány mikrofágy. Aplikace radiokoloidu musí být proto před operací provedena v dostatečném časovém předstihu, obvykle 2–24 hodin před operací. Gama záření může být detekováno zobrazovacím zařízením (Angerova gamakamera) nebo pomocí gamasondy při radiačně navigovaných operacích. Je třeba rozlišovat lymfoscintigrafii sentinelové uzliny – jejím cílem je identifikace první uzliny drenující primární tumor od lymfoscintigrafie zaměřené na celou spádovou oblast uzlin, která je indikovaná při diagnostice lymfedému.
Radiačně navigovaná operace sentinelové uzliny
Radiačně navigovaná operace sentinelové uzliny je založena na peroperační detekci gama záření radiofarmaka, které je vychytáváno v sentinelové uzlině. Skládá se ze tří kroků, a to
- aplikace radiofarmaka
- scintigrafie spádové uzliny
- vlastní peroperační detekce
Radionuklidem značené koloidní částice nebo makromolekuly vhodné velikosti jsou aplikovány intersticiálně a spolu s lymfou jsou transportovány přes vasa afferentia do první lymfatické uzliny, kde jsou fagocytovány. Část radifoarmaka opouští uzlinu a cestou vas efferens se dostává do dalších LU. Malá část RF se dostává cestou ductu thoracicus a je vychytávána retikuloendoteliárními buňkami jater a sleziny. Záchyt RF tedy nezáleží na tom, zda je, či není uzlina metastaticky postižená. Metastaticky postižená uzlina naopak nemusí radiofarmakum vůbec vychytávat a může být selháním metody. Množství RF v sentinelové uzlině může být velmi variabilní. Snížené vychytávání se projevuje při
- tukové degeneraci centrální části uzliny
- atrofii lymfatické tkáně
- při jizvení uzlin po předchozích zánětech
Radioaktivita sentinelové uzliny se pohybuje za 24 hodin po subkutánní 99mTc v rozmezí 0,005–5 % aplikovaného radiofarmaka. Do současné doby není jednoznačně stanoveno, které RF je pro lymfoscintigrafii ideální. Optimální radiofarmakum by se mělo rychle vstřebávat z místa aplikace, měla by být dostatečně dlouhá doba přetrvávání v sentinelové uzlině a průnik do ostatních uzlin by měl být co nejmenší. Důležitá je i komerční a cenová dostupnost. V současnosti se pro humánní účely používají farmaka registrovaná na národní či nadnárodní úrovni, proto se liší RF užívaná v Evropě a v USA. V ČR jsou v současné době pro lymfoscintigrafii registrována farmaka
- 99mTc-značený lidský serumalbuminový koloid (HSA)Nanocoll® (lymfoscintigrafie, scintiografie kostní dřeně)Senti-Scint® (detekce sentinelové uzliny)Nano Albumon® (scintigrafie kostní dřeně a lymfoscintigrafie)
- 99mTc-koloid sirníku rhenistéhoNanocis® (lymfoscintigrafie a gastrointestinální vyšetření)
Cílem lymfoscintigrafie sentinelové uzliny je zobrazit její lokalizaci a určit, které spádové uzliny drenují oblast primárního nádoru, a mohou tedy být místem výskytu lymfogenních metastáz. Důležitá je rovněž informace, zda je RF z primárního nádoru drenováno do jedné, nebo více spádových oblastí. Lymfoscintigrafie též umožňuje orientační vyšetření počtu sentinelových uzlin v jednotlivých spádových oblastech, zobrazit tzv. intenzitní uzliny a/nebo určit sentinelovou uzlinu v neobvyklé lokalizaci. Označení lokalizace uzliny v jedné nebo dvou projekcích na kůži usnadní operatérovi její vyhledání.
Před aplikací RF není nutná žádní speciální příprava. Absolutní kontraindikací je alergie na radiofarmakum. Před snímkováním je potřeba sejmout z těla všechny kovové předměty protože mohou absorbovat emitované záření.
Volba velikosti aplikované radioaktivity při lymfoscintigrafii sentinelové uzliny závisí na typu protokolu (jednodenní nebo dvoudenní), na místu aplikace (povrchová či hluboká) a závisí též na citlivosti detekční sondy. Ke snímkování se používají jedno - nebo vícedetektorové kamery.
V souladu s vyhláškou Státního úřadu pro jadernou bezpečnost (SUJB) č. 307/ /2002 Sb vyhlášky č. 499/2005 Sb., přílohy č. 9, je třeba dodržet úroveň apikované aktivity RF. Při detekci sentinelové uzliny je diagnostická referenční úroveň 150 MBq. Bezprostředně po aplikaci RF je třeba překrýt místo vpichu, aby nedošlo ke kontaminaci kůže radiofarmakem.
Tumory penisu
U tumorů penisu se při dvoudenním protokolu obvykle aplikuje podkožně 60 MBq v objemu 0,2 ml, při jednodenním protokolu 12–15 MBq. Radiofarmakum se aplikuje inzulinovou stříkačkou několika vpichy do okolí nádoru. Protože je injekce bolestivá je vhodné provedení v lokální anestezii. Sentinelová uzlina může být v jednom nebo obou tříslech a zobrazuje se do několika minut po aplikaci. Proto se okamžitě provádí dynamická scintigrafie a lokalizace uzliny se vyznačuje na kůži v přední projekci [21–23].
INGVINÁLNÍ A ILIOINGVINÁLNÍ LYMFADENEKTOMIE
Technika ingvinální lymfadenektomie
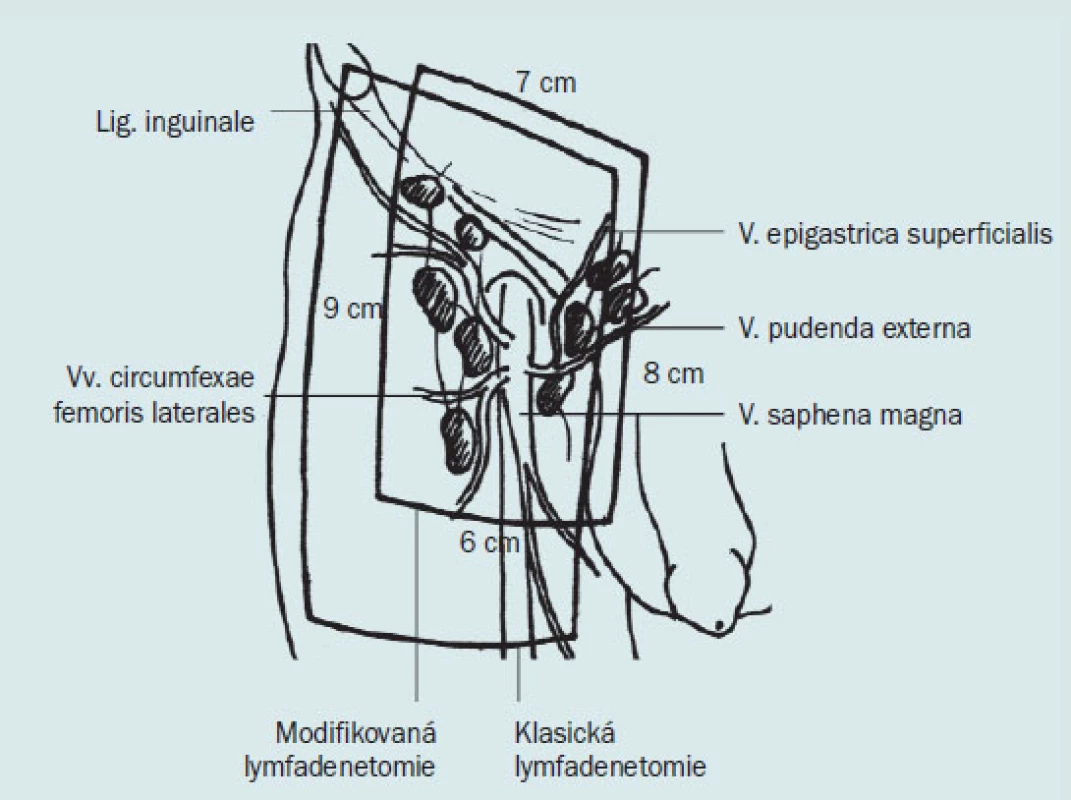
Obr. 6 ukazuje různé incize při provedení ingvinální a ilioingvinální lymfadenektomie. Nejčastěji používáme šikmý řez paralelně pod ingvinální řasou, protože šetří cévní zásobení, které probíhá ve směru poupartského vazu.
Obr. 6. Klasická a modifikovaná lymfadenektomie (Catalona). 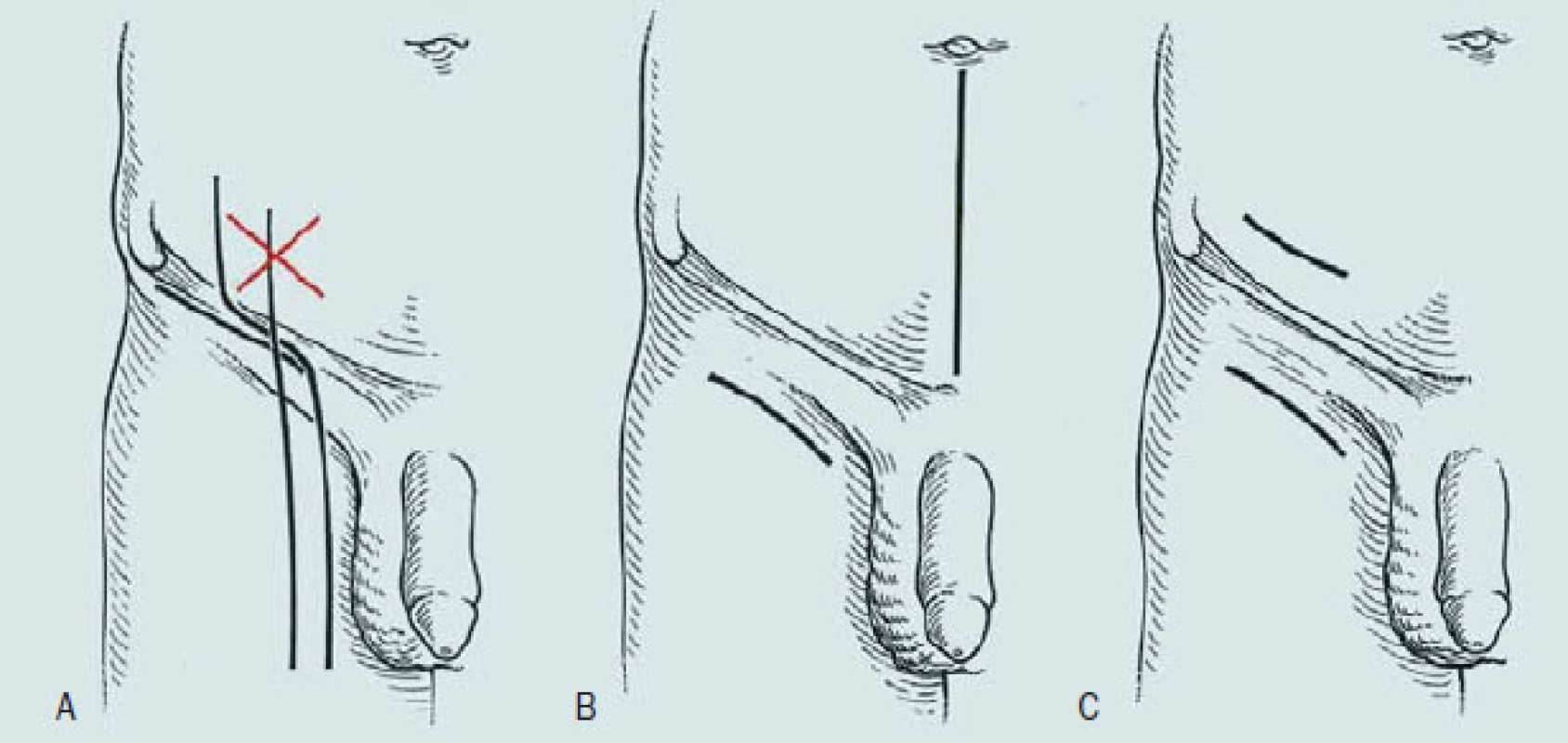
Kožní incize při radikální ingvinální lymfadenektomii.
- A: Jednoduchá incize
- šikmá
- tvaru S
- vertikální
Dříve doporučovaný vertikální řez [3] je nevhodný, dochází ke špatnému hojení, dehiscenci rány a k nutnosti sekundárního ošetření obvykle s překrytím pomocí kožního laloku. „S-type” řez je též méně výhodný z podobných důvodů, ale v některých pracích je doporučován z důvodu možnosti rozšíření incize a ke zjednání rozsáhlého přístupu k uzlinám.
- B: Dvojitá incize: dolní střední a ingvinální
- C: Jednostranná pánevní lymfadenektomie: šikmý abdominální řez kombinovaný s ingvinálním řezem, tzv. „skin bridge”
Modifikovaná ingvinální lymfadenektomie
Pacient je uložen v poloze na zádech. Anestezie je svodná, nebo celková. Předoperačně zavedeme Foleyův katétr. Skrotum a penis odsuneme a fixujeme mimo operační pole. Dolní končetiny jsou v abdukci s maximální zevní rotací, aby byla umožněna co nejlepší expozice stehna a třísla. Podkolenní jamka je podložena polštářem. Incizi vedeme v délce 6–8 cm, 3–4 cm distálně od poupartského vazu a paralelně s ním. Po protětí kůže pokračujeme v incizi a preparací pokračujeme ke Scarpově fascii.
Obr. 8. Klasická ingvinální lymfadenektomie 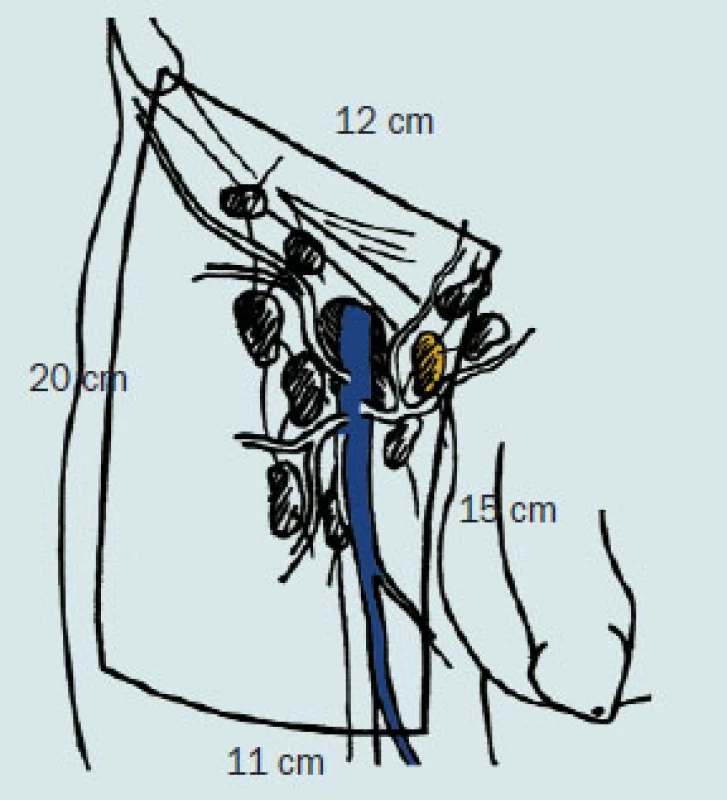
Obr. 9. Modifikovaná ingvinální lymfadenktomie – femorální oblast. 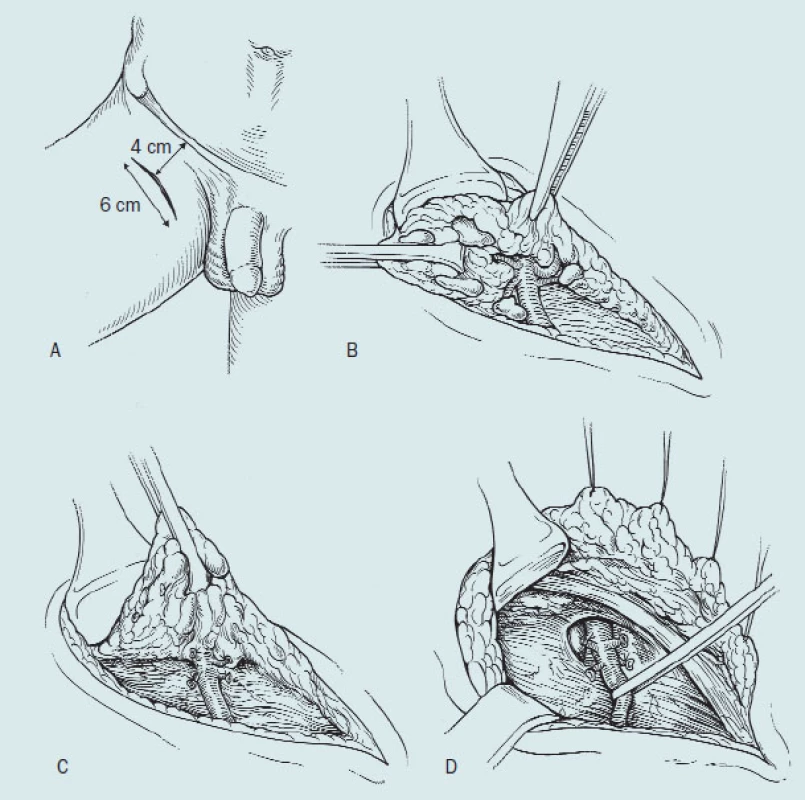
Ohraničení klasické a modifikované lymfadenektomie
Šetrně uvolníme podkoží. Jemným tahem oddálíme okraje rány. Identifikujeme v. saphenu i s jejími větvemi. Měkké tkáně i se sítí lymfatických uzlin šetrně uvolníme od v. saphena, kterou šetříme. Jednotlivé přívodné větvě v. saphena ligujeme a přerušíme.
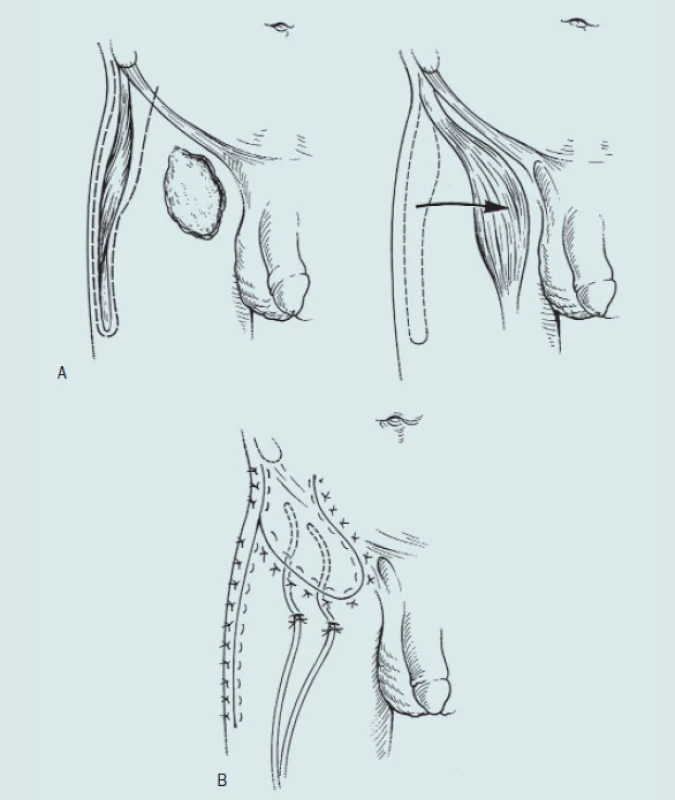
Technika modifikované ingvinální lymfadenektomie.
- A: Provedení ingvinálního řezu
- B: Preparace vena saphena, ligatura a přerušení žilních spojek
- C: En bloc disekce paketu uzlin proximálně. Vena saphena není přerušená
- D: Prostor po odstranění povrchových ingvinálních uzlin. Fascia lata je neporušená. Rozsah disekce je 2 cm proximálně nad incizi a 4 cm distálně od dolní hrany incize. Velkou péči věnujeme hornímu vnitřnímu kvadrantu okolo epigastrických žil tj. oblasti sentinelových uzlin. Důkladně ošetřujeme i lymfatické cévy, které musíme pečlivě ligovat. Preparaci provádíme proximálním směrem 2 cm nad ligamentum inguinale. Dále pokračujeme až k fascii m. obliqus abdominis externus. Směrem distálním pokračujeme asi 4 cm pod úroveň incize. V Catalonově modifikaci operace je distální hranice na úrovni fossa ovalis. Puras je radikálnější a doporučuje provést exstirpaci uzlin ještě distálněji. Odebraná tkáň uzlin je pozičně označena a odeslána na histologické vyšetření „nazmrzlo“ [24].
Modifikovaná ingvinální lymfadenektomie (podle Catalony)
Distální hranici disekce tvoří dolní okraj fossa ovalis. V případě negativního výsledku provedeme opakovaně proplach rány sterilní vodou a ránu uzavřeme po jednotlivých vrstvách. Redonův drén vyvedeme mimo operační ránu a ponecháme po dobu dokud trvá sekrece, minimálně 5–7 dnů.
Klasická ingvinální a ilioingvinální lymfadenektomie
V případě zvětšených, palpačně hmatných uzlin, nebo pokud je v preparátu „nazmrzlo“ z modifikované ingvinální lymfadenektomie detekováno nádorové postižení, provádíme klasickou radikání ingvinální lymfadenektomii.
Incize v délce 6–8 cm je vedena paralelně 3–4 cm distálně pod ligamentum inguinale až ke Scarpově fascii. Identifikujeme v. saphena, kterou izolujeme a ligujeme 2–0 silonovým stehem. Systematicky izolujeme lymfatickou tkáň od horního vnitřního kvadrantu až ke spojení v. saphena a v. femoralis ve fossa ovalis. Disekce uzlin je 2 cm nad ligamentum ingvinale a distálně pokračuje na úroveň fossa ovalis.
Žilní spojky v. saphena a větší lymfatické cévy ligujeme a přerušíme. V. saphenu pečlivě vypreparujeme, podvážeme nebo zaklipujeme a přerušíme. Incidujeme fascia lata a excidujeme s veškerou lymfatickou tkání, která na ni těsně superficiálně naléhá. Tím provedeme odkrytí femorální oblasti a Scarpova trojúhelníku. Laterální stranu vytvořeného prostoru tvoří mediální hrana m. sartorius a mediální stranu tvoří m. adductor longus.
Femorální oblast otevřeme od ligamentum inguinale proximálně až po apex femorálního trojúhelníku. V. a a. femoralis leží laterálně, tuková tkáň obsahující hluboké ingvinální uzliny leží mediálně. Nervus femoralis leží laterálně od arterie. Pro uvolnění a disekci tkáně šetrně odsuneme femorální žílu a uvolňujeme tkáň z laterální a ventrolaterální strany vény a z oblasti mezi arterií a vénou. Uzliny exstirpujeme od tříselného vazu až po Cloquetovu uzlinu, která je nejproximálnější uzlinou z řetězce hlubokých ingvinálních uzlin. Uzliny zde nalézáme ve variabilním počtu 1–5. Asi 5–8 cm pod ligamentum inguinale se větví a. femoralis interna z laterální strany a. femoralis. Obě musí být pečlivě izolovány a šetřeny, zvláště pokud předpokládáme pozdější krytí defektu myokutánním lalokem.
Technika klasické ingvinální lymfadenektomie (obr. 10)
Obr. 10. Ošetření defektu a krytí femorálních cév. 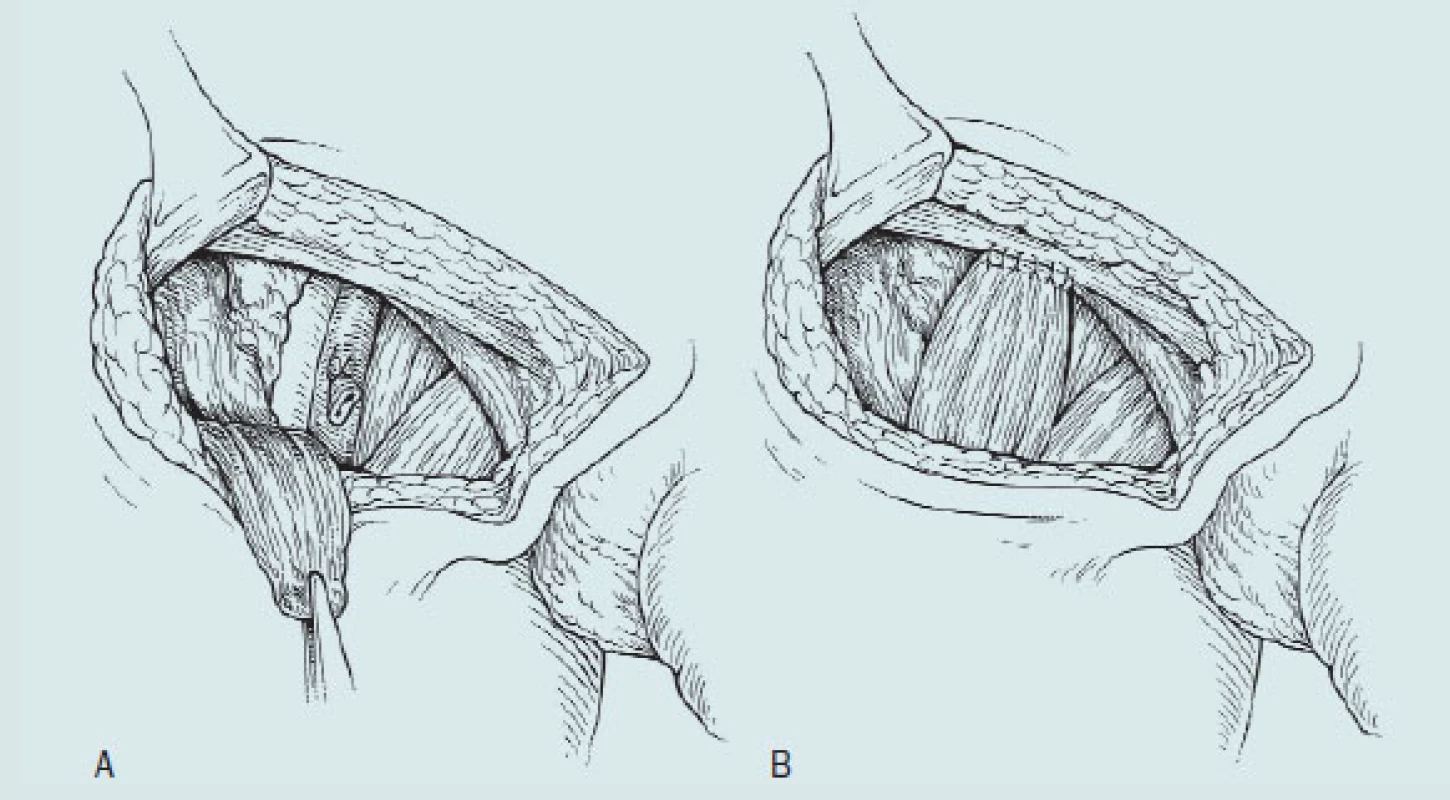
- A: Pohled na anatomické struktury po excizi fascia lata, přerušení vena saphena a disekce hlubokých ingvinálních uzlin. Musculus sartorius je přerušen v místě svého úponu
- B: Transpozice m. sartorius a překrytí femorálních cév
Ránu pečlivě propláchneme sterilní vodou a ošetřujeme i drobné krvácení a lymfatickou sekreci. Krytí defektu nad stehenními cévami. Ostře oddělíme m. sartorius od jeho úponu k spina iliaca anterior superior, transponujeme jej mediálně a překryjeme oblast defektu nad femorálními cévami [25,26]. Drenáž rány zajistíme sacími redonovými drény a ránu uzavíráme po vrstvách. Jednotlivými stehy fixujeme Camperovu fascii k ventrální straně svalu, aby se zamezilo vytvoření prostoru a následně formování lymfokély [26]. Pečlivě zhodnotíme kožní okraje a v případě pochybností o dostatečné vitalitě provádíme excizi do zdravé tkáně.
Po operaci zůstává pacient 5–7 dnů na lůžku, provádíme prevenci trombembolické nemoci. Foleyův katétr odstraňujeme během 24–48 hod, drenáž ponecháváme 5 dnů.
Pánevní lymfadenektomie
Pánevní lymfadenektomie zahrnuje
- zevní ilický lymfatický řetězec
- ilioobturátorový řetězec s následujícími hranicemi: proximální hranice: ilická bifurkace, laterální hranice: ileoingvinální nerv, mediální hranice: n. obturatorius
Léčba rozsáhlé ulcerace a penetrace metastáz do cévních struktur
Dlaždicobuněčný karcinom je charakteristický svou agresivitou a invazí okolních struktur. Objemné uzliny, pokud pacient přichází pozdě, nebo pokud došlo k prodlevě, infiltrují pokračujícím karcinomem kůži v třísle a v pokročilém stadiu vznikají rozsáhlé ulcerace. V takovém případě excidujeme tkáň a okolní kůži s lemem 2 cm zdravé kůže. Provedeme radikální ilioingvinální lymfadenektomii a kompletně resekujeme nádorové hmoty. V některých případech zjistíme invazi do cévních struktur, zvláště do žil. Je třeba provést resekci přední žilní stěny s vytvořením graftu nebo Gore-Texové záplaty [26]. Pokud je žíla celá infiltrovaná, je možno provést její ligaturu a excizi. Rozsáhlý kožní defekt lze uzavřít pomocí fascia lata nebo pomocí m. gracilit [27,28]. Kožní defekt může být překryt lalokem s bází nad kyčelním kloubem a s posunem mediálně nad defekt třísla.
Obr. 12. Ingvinální a pánevní lymfadenektomie. 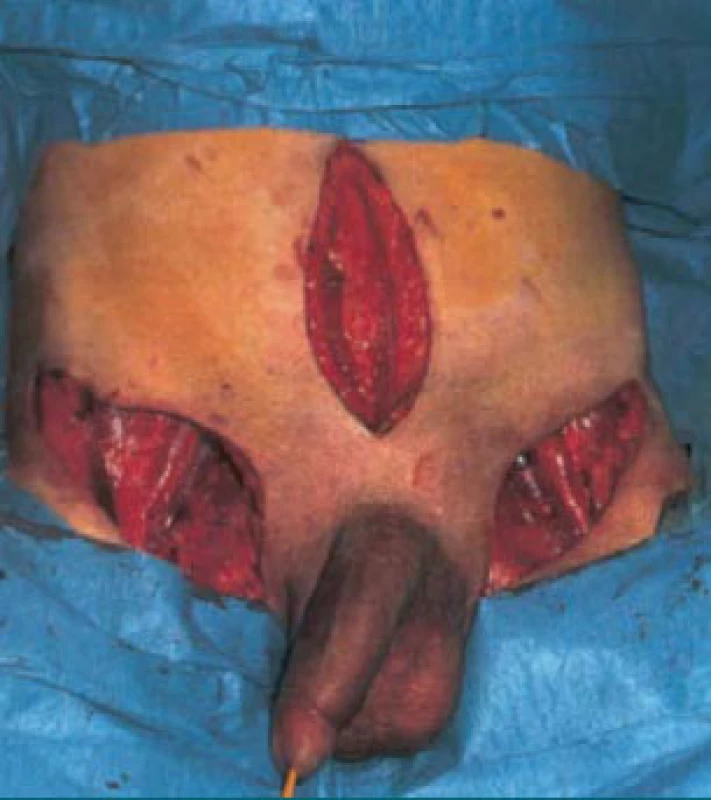
Doporučení – souhrn
I. Nehmatné lmyfatické uzliny
Analýza prognostických faktorů určila 3 rizikové skupiny pro vznik uzlinových metastáz
- skupina s nízkým rizikem vzniku uzlin mikrometastáz (pTis, pTaG1-2 nebo pT1G1)
program sledování
- Pravděpodobnost vzniku okultních mikrometastáz v ingvinálních LU < 16,5 %.
- Pravděpodobnost vzniku okultních mikrometastáz v ingvinálních LU < 16,5 %.
- Pokud jsou pacienti pro sledování považováni za nespolehlivé, je indikovaná „modifikovaná“ ingvinální lymfadenektomie (LND)
- skupina se středním rizikem vzniku (T1G2). V této skupině je nutné vzít v úvahu vaskulární a lymfatickou invazi a charakter růstu.
povinný program sledování
- Program sledování je možný u pacientů bez vaskulární nebo lymfatické invaze nebo u superficiálního charakteru růstu primárního tumoru.
modifikovaná LND
Modifikovaná LND je volbou u pacientů se špatnými histologickými nálezy.
relativně vysoká spolehlivost dynamické biopsie sentinelové LU pomocí izosulfanové modři a/nebo 99mTc-koloidního sulfuru je alternativní metoda pro indikaci LND/může nahradit užití prediktivních faktorů při indikování potřeby modifikované LND
Modifikovanou LND lze rozšířit na radikální lymfadenektomii, pokud jsou přítomny pozitivní lymfatické uzliny. Podmínkou je kvalitní zpracování dodaného materiálu peroperačně.
- skupina s vysokým rizikem (pT2 nebo G3)
Ve skupině s vysokým rizikem je při nehmatných uzlinách incidence okultních metastáz mezi 68–73 %.
modifikovaná LND
Při indikaci modifikované LND je nutné vzít v úvahu vaskulární a lymfatickou invazi a charakter růstu.
radikální LND
II. Hmatné lymfatické uzliny, uzliny s pozitivním histopatologickým nálezem
bilaterální radikální ingvinální LND
U pacientů s hmatnými lymfatickými uzlinami je standardní doporučení bilaterální, radikální, ingvinální LND.
pánevní lymfadenektomie
V případě nejméně dvou pozitivních LU nebo při extrakapsulární invazi se k bilaterální ingvinální LND přidává pánevní lymfadenektomie. Při hmatných uzlinách je pravděpodobnost postižení pánevních LU 23 %. Při 2–3 pozitivních ingvinálních uzlinách je pravděpodobnost postižení pánevních uzlin 30 %, u více než 3 LU se pravděpodobnost zvyšuje na 56 %. Metastázy jsou často mikroskopické a při dostatečně radikální léčbě je možné předpokládat vyléčení v 14–54 % případů.
III. Hmatné lymfatické uzliny a kontralaterálně nehmatné LU
Na kontralaterální straně nejprve zvažujeme modifikovanou LND, v případě, že jsou při biopsii „nazmrzlo“ přítomny pozitivní LU, je indikována radikální LND.
IV. Fixované ignvinální lymfatické uzliny, nebo detekce zvětšených pánevních uzlin na CT/MR
indukční chemoterapie + radikální ilioingvinální LND
Indukční fáze chemoterapie může poskytnout částečnou, nebo úplnou klinickou odpověď ve 21–60 % případů.
předoperační radioterapie + radikální ilioingvinální LND
Předoperační radioterapie je výkon technicky obtížný, je spojen s významným rizikem vážných komplikací a výraznými komplikacemi a prodlouženou dobou hojení.
V. Program sledování → objeví se hmatné ingvinální uzliny
- • bilaterální radikální ingvinální LND
- • ingvinální LND v místě pozitivní LU
Pokud je dlouhý interval bez onemocnění, je možné indikovat ingvinální LND v místě pozitivní LU. Pravděpodobnost vzniku pozdních metastáz do LU v kontralaterální ingvinální oblasti je při jedné pozitivní uzlině 10 %, u dvou a více dosahuje pravděpodobnost 30 %.
KOMPLIKACE LYMFADENEKTOMIE
Pacienti s metastázami v tříselných lymfatických uzlinách mají lepší onkologickou prognózu, pokud je provedena ingvinální nebo ilioingvinální lymfadenektomie.
Část chirurgů má stále odmítavý postoj k provádění lymfadenektomie z důvodu výskytu závažných komplikací (incidence 30–50 %). Nejčastější komplikace jsou lymfokéla, rozsáhlý lymfedém dolní končetiny, kožní nekrózy a infekce.
Riziko nekrózy kožního laloku minimalizujeme volbou správné incize, šetrnou manipulací s tkáněmi. Dbáme na zachování správné tloušťky kožního laloku, provádíme pečlivé ošetření s excizí všech nekrotických ischemických okrajů kožního laloku. Velmi důležité je provést transpozici hlavy m. sartorius s překrytím defektu nad femorálními cévami.
Lymfedému dolní končetiny se snažíme zabránit šetrnou preparací a pečlivým podvázáním jednotlivých lymfatických cév peroperačně, vyvedením redonova drénu s aktivním sáním, pooperačně správnou imobilizací dolních končetin. Ihned v pooperačním období by měly být naloženy elastické punčochy a pacient by je měl nosit dlouhodobě i v období rekonvalescence.
Infekčním komplikacím předcházíme předoperačně zahájenou intenzivní antibiotickou terapií, ve které pokračujeme i v pooperačním období.
Prevence trombembolické nemoci (TEN) spočívá v podávání nízkomolekulárních heparinů (LMWH) peroperačně i v pooperačním období. Zvláště vysoké riziko je spojeno s operacemi klasické ingvinální a pánevní lymfadenektomie. Nelze ji nikdy podcenit, a proto je vždy nutné přijmout preventivní nefarmakologická a farmakologická opatření. V případech delší pooperační imobilizace zůstává riziko TEN vysoké ještě během několika dalších týdnů. Profylaxe LMWH po dobu jednoho měsíce od operace snižuje frekvenci hluboké žilní trombózy ve srovnání s profylaxí LMWH podávanou pouze během prvního pooperačního týdne.
ZÁVĚR
Úspěch terapie karcinomu penisu souvisí kromě včasného ošetření primárního nádoru též se stavem a léčbou lymfatických uzlin. Pro pacienty s pozitivními uzlinami je úspěšnou léčebnou metodou lymfadenektomie. Racionální provedení LND vyžaduje pečlivé vyšetření třísla dostupnými metodami a uvědomění si prediktivních faktorů pozitivních lymfatických uzlin. Procedura je spojena s relativně vysokou mírou morbidity (30–50 %) při užití moderních technických modifikací. Vysoká morbidita zabraňuje profylaktickému užití LND, i když tento aspekt je stále kontroverzní.
MUDr. Aleš Čermák
Urologická klinika FN Brno
Jihlavská 20
acermak@fnbrno.cz
Zdroje
1. Crawford ED, Dawkins CA. Cancer of the penis. In: Skinner DG, Lieskovsky G (eds). Diagnosis and management of genitourinary cancer. Philadelphia: WB Saunders 1988 : 549–563.
2. Burgers JK, Badalament RA, Drago JR. Penile cancer. Clinical presentation, diagnosis and staging. Urol Clin N Am 1992; 19(2): 247–256.
3. Abeloff MA, Armitage JO, Lichter AS. Clinical Oncology, Second Edition, Philadelphia, 2000.
4. Ravi R. Correlation between the extent of nodal involvement and survival following groin dissection for carcinoma of the penis. Br J Urol 1993; 72(5 Pt 2): 817.
5. Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penis. Part 2: the role and technique of lymph node dissection, BJU Int 2001; 88(5): 473–483.
6. Misra S, Chaturvedi A, Misra NC. Penile carcinoma: a challenge for the developing world, Lancet Oncol 2004; 5(4): 240–247.
7. Doležel M, Petera J, Odrážka K. Brachyterapie v léčbě karcinomu penisu Urol List 2005; 3(4): 22–25.
8. Eliška O, Elišková M. Srdce a cévní systém. In:Petrovický P et al. Systematická, topografická a klinická anatomie. Praha: Karolinum 1995 : 3–207.
9. Rouviere H, Valette G. Formatio de la lymphe. Circulation lymphatique normale et pathologique. Paris 1937 : 1–160.
10. Páč L. Lymfatická drenáž penisu, Urol List 2005; 3(4): 5–9.
11. Pizzocaro G, Piva L, Nicolai N. Improved management of nodal metastases of squamous cell carcinoma (SCC) of the penis. J Urol 1995; 153 : 246A.
12. Ornelllas AA, Seixas AL, Morota A et al. Surgical treatment of invasive squamous cell carcinoma of the penis: retrospective analysis of 350 cases. J Urol 1994; 151 : 1244–1249.
13. Crawford D, Dawkins C. Cancer of the penis. in: Skinner, D., Lieskovsky, G.,(eds.): Diagnosis and management of Genito-urinary cancer. W. B. Saunders Company, Philadelphia 1988 : 549–563.
14. Scappini P, Piscioli F, Pusiol T et al. Penile cancer. Aspiration biopsy cytology for staging. Cancer 1986; 58(7): 1526–1533.
15. Novák J, Žídek I. Carcinoma of the penis. Publishing, Praha: 1996 : 93.
16. Riveros M, Garcia R, Cabanas RM. Lymph-angiography of the dorsal lymphatics of the penis: technique and results. Cancer 1967; 20(11): 2026–2034.
17. Cabanas RM. An approach for the treatment of penile carcinoma. Cancer 1997; 39 : 456–470.
18. Pepper MS, Tille JC, Nisato R et al. Lymphangiogenesis and tumor metastasis. Cell Tissue Res 2003; 314(1): 167–177. Epub 2003 Jul 18. Review.
19. Witte MH, Jones K, Wilting J et al. Structure function relationships in the lymphatic system and implications for cancer biology. Cancer Metastasis Rev 2006; 25(2): 159–184. Review.
20. Šimša J. Detekce sentinelové uzliny – vitální barvení, In Šimša et al. Sentinelová uzlina, Lymfadenektomie u solidních nádorů. Maxdorf Jessenius 2010, ISBN978-80-7345-213-1 : 30–34.
21. Křížová H. Radiačně navigovaná operace sentinelové uzliny, In Šimša et al. Sentinelová uzlina, Lymfadenektomie u solidních nádorů. Maxdorf Jessenius, 2010, ISBN978-80-7345-213-1 : 38–48.
22. Jarolím L. Lmyfatický systém penisu. In Šimša et al. Sentinelová uzlina, Lymfadenektomie u solidních nádorů. Maxdorf Jessenius, 2010, ISBN978-80-7345-213-1 : 240–248.
23. Pettaway CA, Jularbal FA, Babaian RJ et al. Intraoperative lymphatic mapping to detect inguinal metastases in penile carcinoma: Results of a pilot study. J Urol 1995; 161 : 159A.
24. Puras A, Rivera J. Inguinal and pelvic lymhadenectomy for penile cancer. Atlas Urol Clin North Am 1995; 3 : 105–122.
25. Baranofsky ID. Technique of inguinal node dissection. Surgery 1948; 24 : 555–561.
26. Ferrigni RG, Novicki DE. Complications of lymphadenectomy in urologic surgery. Atlas Urol Clin North Am 1995; 3 : 105–122.
27. Hill HL, Nahai F, Vasconez LO. The tensor fascia lata myocutanous free flap. Plast Reconstr Surg 1978; 61 : 517–523.
28. McCraw JB, Dibbell DG, Carrawya JH. Clinical definition of independent myocutaneous vascular territories. Plast Reconstr Surg 1977; 60 : 341–347.
Štítky
Detská urológia Urológia
Článek Úvodní slovoČlánek Ze zahraničních periodik
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2010 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Léčba tumoru varlete v časném stadiu
- Karcinom penisu v populaci nigerijských mužů
- Současné přístupy k inguinální lymfadenektomii při léčbě karcinomu penisu
- Karcinom penisu: terapeutická výzva
- Substituční terapie testosteronem po léčbě karcinomu prostaty: nové koncepty v současné urologické praxi
- Infertilní pár z perspektivy urologa: diagnostické vyšetření a medikamentózní léčba
- Úvodní slovo
- Moderní endokrinologické vyšetření infertilního muže
- Možnosti léčby Peyronieho choroby
- Co je považováno za erotické v neverbální komunikaci
- Léčba lokoregionálního onemocnění karcinomu penisu
- Vyšetřování a medikamentózní léčba benigní hyperplazie prostaty: přehledový článek
- Význam inhibice RANK ligandu v léčbě kostních komplikací u pacientů s metastazujícím karcinomem prostaty
- Ze zahraničních periodik
- Guidelines EAU pro karcinom penisu
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Co je považováno za erotické v neverbální komunikaci
- Léčba lokoregionálního onemocnění karcinomu penisu
- Substituční terapie testosteronem po léčbě karcinomu prostaty: nové koncepty v současné urologické praxi
- Možnosti léčby Peyronieho choroby
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy