-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
EAU Guidelines pro diagnostiku a léčbu uroteliálního karcinomu horních cest močových
aktualizace 2011
EUROPEAN GUIDELINES FOR THE DIAGNOSIS AND MANAGEMENT OF UPPER URINARY TRACT UROTHELIAL CELL CARCINOMAS: 2011 UPDATE
Context:
The European Association of Urology (EAU) Guideline Group for urothelial cell carcinoma of the upper urinary tract (UUT-UCC) has prepared new guidelines to aid clinicians in assessing the current evidence-based management of UUT-UCC and to incorporate present recommendations into daily clinical practice.Objective:
This paper provides a brief overviewof the EAU guidelines on UUT-UCC as an aid to clinicians in their daily practice.Evidence acquisition:
The recommendations provided in the current guidelines are basedon a thorough reviewof available UUT-UCC guidelines and papers identified using a systematic search of Medline. Data on urothelial malignancies and UUT-UCC in the literature were searched using Medline with the following keywords: urinary tract cancer, urothelial carcinomas, upper urinary tract, carcinoma, transitional cell, renal pelvis, ureter, bladder cancer, chemotherapy, nephroureterectomy, adjuvant treatment, neoadjuvant treatment, recurrence, risk factors, and survival. A panel of experts weighted the references.Evidence synthesis:
There is a lack of data in the current literature to provide strong recommendations due to the rarity of the disease. A number of recent multicentre studies are now available, whereas earlier publications were based only on limited populations. However, most of these studies have been retrospective analyses. The TNM classification 2009 is recommended. Recommendations are given for diagnosis as well as for radical and conservative treatment; prognostic factors are also discussed. Recommendations are provided for patient follow-up after different therapeutic options.Conclusions:
These guidelines contain information for the diagnosis and treatment of individual patients according to a current standardised approach. When determining the optimal treatment regimen, physicians must take into account each individual patient’s specific clinical characteristics with regard to renal function including medical comorbidities; tumour location, grade and stage; and molecular marker status.
Autoři: M. Roupręt 1; R. Zigeuner 2; J. Palou 3; A. Boehle 4; E. Kaasinen 5; R. Sylvester 6; M. Babjuk 7; W. Oosterlinck 8
Působiště autorů: Second Faculty of Medicine, Charles University, Praha, Czech Republic ; Faculty of Medicine Pierre et Marie Curie, University Paris VI, Paris, France ; Department of Urology, Pitié-Salpétričre Hospital, GHU Est, Assistance-Publique Hôpitaux de Paris 1; Department of Urology, Medical University of Graz, Graz, Austria 2; Department of Urology, Fundació Puigvert, Barcelona, Spain 3; Department of Urology, HELIOS Agnes Karll Hospital, 23 11 Bad Schwartau, Germany 4; Department of Urology, Hyvinkää Hospital, Hysinkää, Finland 5; European Organisation for Research and Treatment of Cancer Headquarters, Department of Biostatistics, 1200 Brussels, Belgium 6; Department of Urology, Hospital Motol 7; Department of Urology, University Hospital Ghent, De Pintelaan 185, 9000 Ghent, Belgium, morgan. roupret@psl. aphp. fr 8
Vyšlo v časopise: Urol List 2011; 9(4): 59-70
Kategorie: Guidelines
Souhrn
Kontext:
Výzkumná skupina (EAU Guideline Group for UUT-UCC) pro léčbu uroteliálního karcinomu horních cest močových (UUT-UCC) připravila tato guidelines s cílem pomoci klinickým lékařům při hodnocení údajů založených na důkazech pro klinickou léčbu UUT-UCC s cílem začlenit uváděná doporučení do běžné praxe.Cíl:
Tento dokument poskytuje stručný přehled EAU Guidelines pro léčbu UUT-UCC jako pomůcku pro každodenní praxi lékařů.Sběr důkazů:
Obsažená doporučení jsou založena na podrobném hodnocení UUT-UCC guidelines a studií na základě podrobného vyhledávání v databázi Medline. Publikované údaje týkající se uroteliálních maligních onemocnění a UUT-UCC byly vyhledávány v databázi Medline za pomoci následujících klíčových slov: karcinom močových cest, uroteliální karcinom, horní močové cesty, karcinom, přechodné buňky, ledvinná pánvička, močovod, karcinom močového měchýře, chemoterapie, nefroureterektomie, adjuvantní léčba, neoadjuvantní léčba, recidiva, rizikové faktory, doba přežití. Členové panelu posoudili význam publikací.Syntéza důkazů:
V současné literatuře není k dispozici dostatek údajů, a nelze tedy vzhledem k vzácnému výskytu tohoto onemocnění poskytnout jasná doporučení. K dispozici je řada nejnovějších multicentrických studií, starší publikace byly založeny pouze na omezené populaci pacientů. Ve většině případů se jedná o retrospektivní analýzy. Doporučuje se užívání TNM klasifikace z roku 2009. Dokument obsahuje doporučení týkající se jak diagnostiky, tak radikální a konzervativní léčby, rovněž je uveden výčet prognostických faktorů. Doporučení jsou stanovena rovněž pro sledování pacientů po nejrůznějších typech léčby.Závěr:
Tato guidelines poskytují informace pro diagnostiku a léčbu onemocnění u jednotlivých pacientů na základě nejnovějších standardizovaných přístupů. Při volbě optimálního terapeutického postupu je nutné rovněž zohlednit specifické parametry u individuálních pacientů s ohledem na renální funkci (včetně komorbidit), lokalizaci tumoru, grade a stadium a molekulární markery.1. ÚVOD
Poslední aktualizovaný souhrn EAU (Evropské urologické asociace) Guidelines pro léčbu uroteliálního karcinomu horních cest močových (UUT-UCC) byl uveřejněn v roce 2004 [1]. Výzkumná skupina (EAU Guideline Group for UUT-UCC) pro UUT-UCC připravila tato guidelines s cílem poskytnout informace založené na důkazech pro klinickou léčbu vzácně se vyskytujících tumorů a pomoci klinickým lékařům začlenit uváděná doporučení do běžné praxe. Tato aktualizovaná verze vychází ze strukturovaného průzkumu literatury.
2. SBĚR DŮKAZŮ
Autoři vyhledávali v databázi Medline publikace týkající se uroteliálních tumorů a léčby UUT-UCC na základě kombinace následujících výrazů: karcinom močových cest, uroteliální karcinom, horní močové cesty, karcinom, přechodné buňky, ledvinná pánvička, močovod, karcinom močového měchýře, chemoterapie, nefrourete-rektomie, adjuvantní léčba, neoadjuvantní léčba, recidiva, rizikové faktory a doba přežití. Publikace zabývající se UUT-UCC byly ve většině případů retrospektivní, a zahrnovaly několik velkých multicentrických studií. Vzhledem k nedostatku údajů z randomizovaných studií byly články pro tato guidelines vybírány na základě následujících kritérií: vývoj konceptů, střednědobé a dlouhodobé klinické výsledky, kvalita studie a relevance. Údaje ze starších studií byly zahrnuty do současných guidelines pouze v případě, že byly významné nebo v případě absence těchto údajů v současné literatuře. Pro snazší hodnocení kvality publikovaných údajů byly jednotlivé informace klasifikovány podle LE (úrovní důkazu) a GR (stupně doporučení) na základě obecných pravidel EBM – medicíny založené na důkazech [2].
3. SYNTÉZA DŮKAZŮ
3.1 Epidemiologie
Uroteliální karcinomy představují čtvrté nejčastější maligní onemocnění po karcinomu prostaty (nebo prsu), plic a kolorektálním karcinomu [3,4]. Uroteliální karcinomy mohou být lokalizovány v dolních cestách močových (močový měchýř a močová trubice) nebo horních cestách močových (pyelokaliceální dutiny a močovod). Karcinomy močového měchýře tvoří 90–95 % všech uroteliálních karcinomů [4] a představují nejčastější maligní onemocnění močových cest a druhé nejčastější maligní onemocnění močopohlavního traktu po karcinomu prostaty [5,6]. UUT-UCC je však vzácné onemocnění, které tvoří 5–10 % všech uroteliálních karcinomů [3,7–9]. Odhadovaná roční incidence UUT-UCC v západním světě činí přibližně 1–2/100 000 obyvatel. Incidence pyeolokaliceálních tumorů je přibližně dvojnásobná než incidence tumorů v močovodu. V 8–13 % případů je současně přítomen karcinom močového měchýře. Onemocnění recidivuje v močovém měchýři u 30–51 % pacientů s UUT-UCC [10,11] a v kontralaterálních horních cestách močových u 2–6 % pacientů [12,13].
Přirozený vývoj UUT-UCC se liší od karcinomu močového měchýře: 60 % UUT-UCC má při diagnostikování invazivní charakter, zatímco pouze 15 % karcinomů močového měchýře má invazivní charakter [5,7,9]. Nejvyšší incidence UUT-UCC je zaznamenána u pacientů v sedmé a osmé dekádě života, UUT-UCC je třikrát častější u mužů než u žen.
Existuje dědičná forma UUT-UCC související s dědičným nonpolypózním kolorektálním karcinomem (HNPCC) [14]. U pacientů s UUT-UCC lze tuto formu odhalit během odebírání anamnézy. Karcinom bude pravděpodobně dědičného charakteru, pakliže je pacient < 60 let a/nebo má anamnézu/rodinou anamnézu HNPCC [15,16]. Tito pacienti by měli podstoupit DNA test, který umožní identifikovat dědičné karcinomy, které byly na základě nedostatečných klinických údajů mylně klasifikovány jako vzácně se vyskytující karcinomy. Rovněž je třeba vyšetřit přítomnost dalších typů karcinomů souvisejících s HNPCC. Tyto pacienty je třeba pečlivě monitorovat, doporučuje se konzultace genetika [15,16].
3.2 Rizikové faktory
Ke vzniku UUT-UCC přispívá řada environmentálních faktorů. Některé jsou podobné jako faktory přispívajícími ke vzniku karcinomu močového měchýře, další jsou specifické pro UUT-UCC. Mezi hlavní exogenní rizikové faktory patří kouření a vystavení karcinogenům v rámci výkonu povolání. Kouření zvyšuje relativní riziko vzniku UUT-UCC z 2,5 na 7 [17,18]. UUT-UCC, takzvané „amino tumory“, vznikají v důsledku vystavení určitým aromatickým aminům. Tyto aromatické uhlovodíky se užívají v řadě průmyslových odvětví (např. výroba barviv, textilu, gumárenství, chemický průmysl, petrochemie a uhlí). Tyto látky jsou zodpovědné za karcinogenní charakter některých chemických látek jako benzidin a β-naftalen. Užívání těchto dvou chemikálií je ve většině vyspělých států od šedesátých let minulého století zakázáno. Ve většině případů vznikají UUT-UCC sekundárně k „amino tumoru“ v močovém měchýři. Průměrná délka vystavení karcinogenům nutná ke vzniku UUT-UCC je přibližně 7 let, s latentním obdobím (po přerušení expozici těmto látkám) přibližně 20 let. Odhadované riziko (poměr rizik) vzniku UCC po vystavení aromatickým aminům je 8,3 [17,19].
Po zákazu výroby fenacetinu v 70. letech minulého století tumory horních cest močových v důsledku konzumace této látky prakticky vymizely [17].
Ačkoli výskyt nefropatie typické pro oblast Balkánu (tzv. Balkánské nefropatie) je rovněž na ústupu [20,21], existují hypotézy připisující roli konzumace kyseliny aristocholové v rámci patofyziologie a požívání čínských bylin v rámci vyvolání tohoto typu nefropatie [22–24]. Několik studií odhalilo potenciálně karcinogenní účinek kyseliny aristolocholové v rostlinách Aristolochia fangchi a Aristolochia clematis (endemit na Balkánském poloostrově). Tato kyselina obsahuje skupinu vysoce toxických nitrofenolových derivátů, které vykazují silný mutagenní účinek díky jejich schopnosti vytvářet kovalentní vazby s buněčnou DNA. Derivát kyseliny aristocholové d-aristolaktam vyvolává specifické mutace na genu p53 v kodonu 139. Tato mutace je v populaci pacientů, kteří nebyli vystaveni této kyselině, velmi vzácná a vyskytuje se zejména u pacientů s nefropatií v důsledku konzumace čínských bylin nebo pacientů s Balkánskou nefropatií a UUT-UCC.
Vysoká incidence UUT-UCC byla rovněž zaznamenána v Thai-wanu, zejména v populaci na jihozápadě ostrova, představuje 20–25 % všech případů UCC v této oblasti [16]. Souvislost UUT-UCC s gangrénami a vystavením arzenu nebyla zatím v této populaci pacientů prokázána [25].
Rozdíly ve schopnosti vypořádat se s karcinogeny mohou přispívat k náchylnosti hostitele a riziku vzniku uroteliálního karcinomu. Vzhledem k souvislosti genetického polymorfizmu a vyšším rizikem karcinomu nebo rychlejší progrese onemocnění se liší rovněž náchylnost individuálních pacientů k výše zmiňovaným rizikovým faktorům. Dosud byl popsán pouze jediný typ polymorfizmu speci-fický pro vznik UUT-UCC. Variantní alela SULT1A1*2, jež snižuje účinek sulfotransferázy, zvyšuje riziko vzniku UUT-UCC [26]. Epidermoidní karcinom UUT je spojen s chronickým zánětem a infekčním onemocněním v důsledku litiázy v UUT [27,28].
3.3 HISTOLOGIE A KLASIFIKACE
3.3.1 Histologické typy
Více než 95 % uroteliálních karcinomů vzniká v urotelu a odpovídá UUT-UCC nebo tumorům močového měchýře [1,5,28]. S ohledem na UUT-UCC byly popsány morfologické varianty, které se častěji vyskytují u uroteliálních tumorů ledviny. Tyto varianty vždy odpovídají tumorům vyššího grade a jedná se o následující typy tumoru: mikropapilární tumory, tumory z jasných buněk, neuroendokrinní tumory a lymfoepiteliální tumory [9,27]. Karcinomy vývodných cest mají vzhledem k podobnému zárodečnému původu podobné vlastnosti jako UUT-UCC [29].
Výjimku představují tumory horních cest močových neuroteliálního histologického typu [30]. Epidermoidní karcinomy horních cest močových představují < 10 % všech pyelokaliceálních tumorů a jejich výskyt v močovodu je ještě vzácnější. Další histologické podtypy zahrnují adenokarcinomy (< 1 %), neuroendokrinní karcinomy a sarkomy.
3.3.2 Klasifikace
Klasifikace a morfologie UUT-UCC je velmi podobná jako u tumorů močového měchýře [5,28]. Rozlišujeme neinvazivní papilární tumory (papilární uroteliální tumory s nízkým maligním potenciálem, papilární uroteliální tumory nízkého grade, papilární uroteliální tumory vysokého grade), ploché léze (carcinoma in situ (CIS)) a invazivní karcinomy. Všechny varianty popsané v rámci močového měchýře se mohou vyskytovat i v horních cestách močových.
3.3.2.1 Určení TNM stadia
Tab. 1 prezentuje TNM klasifikaci 2009 podle Union Internationale Contre le Cancer, která je užívána v těchto guidelines [31]. Na základě TNM klasifikace je třeba vyšetřit následující regionální lymfatické uzliny: hilární, abdominální, paraaortické a parakavální uzliny a v případě karcinomu močovodu i intrapánevní uzliny. Lateralita nemá žádný vliv na stadium N.
Tab. 1. TNM klasifikace uroteliálního karcinomu horních cest močových z roku 2009 [31]. ![TNM klasifikace uroteliálního karcinomu horních cest močových z roku 2009 [31].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f6383a2192cfa4e368d4e97b383c4087.jpg)
Všechna EAU Guidelines doporučují užívání pouze TNM systému pro klasifikaci tumoru.
3.3.2.2 Grade tumoru
Do roku 2004 byla nejčastěji užívaným klasifikačním systémem klasifikace podle Světové zdravotnické organizace (WHO) z roku 1973, která rozlišovala pouze tři grade (G1, G2, a G3) [32]. Nejnovější molekulární a biologická data však umožnila jednotlivé druhy tumorů rozdělit na další skupiny a vyvinout nový klasifikační systém, který lépe odráží potenciální růstový charakter těchto tumorů [33]. WHO klasifikační systém z roku 2004 rozlišuje na základě histologického vyšetření tři skupiny neinvazivních tumorů: papilární uroteliální neoplazie s nízkým maligním potenciálem, karcinomy nízkého a vysokého grade. V horních cestách močových se nevyskytují prakticky žádné tumory s nízkým maligním potenciálem [9,27,28].
3.4 Symptomy
Diagnostika UUT-UCC může být jak náhodná, tak souviset s vyšetřováním symptomů [1,6]. Výskyt symptomů je obvykle omezen [34]. Nejčastěji se vyskytujícím symptomem UUT-UCC je makroskopická nebo mikroskopická hematurie (70–80 %). Bolest v boku se vyskytuje u 20–40 % pacientů, lumbární rezistence u 10–20 % pacientů [1,7]. Výskyt systémových symptomů (změna zdravotního stavu zahrnující anorexii, úbytek váhy, nevolnost, únavu, horečky, noční pocení nebo kašel) souvise-jící s UUT-UCC by měl být signálem pro pečlivější vyšetření potenciálního výskytu metastáz nebo pooperační indikaci chemoterapie [34].
3.5 DIAGNOSTIKA
3.5.1 Zobrazovací vyšetření
3.5.1.1 Multidetekční CT urografie
Multidetekční CT urografie (MDCTU) představuje zlatý standard pro vyšetřování horních cest močových, která nahradila intravenózní vylučovací urografii [35–38]. Toto vyšetření je nutné provádět za vhodných okolností, nejlépe během vylučovací fáze. Před aplikací kontrastní látky i po ní je nezbytné provedení několika protokolů spirálního CT (alespoň několik mm).
Míra detekce UUT-UCC při tomto typu zobrazovacího vyšetření je uspokojivá: 96% senzitivita a 99% specifita u polypoidních lézí o velikosti 5–10 mm. V případě polypoidních lézí < 5 mm klesá senzitivita na 89 % a na pouhých 40 % v případě polypoidních lézí menších než 3 mm [16,17]. MDCTU rovněž umožňuje detekovat zesílení stěny ledvinné pánvičky nebo močovodu, která je známkou UUT-UCC. Hlavní nevýhodou zůstává identifikace plochých lézí, které jsou nedetekovatelné až do stadia masivní infiltrace.
Rovněž bylo prokázáno, že nález hydronefrózy při předoperačním vyšetření souvisel s pokročilým patologickým onemocněním a horším onkologickým výsledkem [39].
3.5.1.2 Zobrazovací vyšetření magnetickou rezonancí
MRI urografie je indikována u pacientů, kteří nemohou podstoupit MDCTU [40]. Míra detekce pomocí MRI po aplikaci kontrastní látky u tumorů o velikosti < 2 cm činí 75 % [41]. MRI urografie s aplikací kontrastní látky však zůstává kontraindikována u vybraných pacientů s významným narušením funkce ledvin (< 30 ml/min clearance kreatininu) v důsledku rizika nefrogenní systémové fibrózy. MRI bez aplikace kontrastní látky je v rámci diagnostiky UUT-UCC méně účinná než MDCTU.
3.5.2 Cystoskopie a cytologické vyšetření
V případě normálního cystoskopického vyšetření a po vyloučení CIS močového měchýře, pozitivní cytologické vyšetření s velkou pravděpodobností svědčí o přítomnosti UUT-UCC. Cytologické vyšetření má menší senzitivitu při detekci UUT-UCC než při detekci karcinomu močového měchýře, dokonce v případě lézí vyššího grade. V ideálním případě je vhodné vyšetření provádět in situ (tj. v dutině dutého systému ledviny). Pozitivní výsledek cytologického vyšetření může být cennou pomůckou při určování stadia tumoru, protože je obvykle spojen s onemocněním invadujícím svalovinu nebo onemocněním neohraničeným na orgán [42].
Detekce molekulárních abnormalit pomocí fluorescenční in situ hybridizace (FISH) představuje čím dál oblíbenější metodu pro screening UCC, výsledky je však stále třeba považovat za předběžné [43,44]. Senzitivita FISH při identifikaci UUT-UCC je srovnatelná s výsledky dosahovanými u karcinomu měchýře; převaha recidivujících tumorů nižšího grade u této populace pacientů podstupujících sledování a minimálně invazivní léčbu UUT-UCC však může snižovat význam této metody [45]. FISH má pravděpodobně rovněž omezený význam při sledování pacientů s tumory horních cest močových [46,47].
3.5.3 Diagnostická ureteroskopie
Vhodnější metodou pro diagnostiku UUT-UCC představuje ureteroskopie [42,48,49]. Pomocí flexibilního ureteroskopu lze močovod vyšetřit makroskopicky a u 95 % pacientů dosáhnout do renálních dutin. Tato modalita rovněž umožňuje posoudit aspekt tumoru, odebrat biopsii a v 90 % případů stanovit grade tumoru s nízkou mírou pozitivně-falešných výsledků [50]. Ureteroskopie usnadňuje provedení selektivního cytologického vyšetření a retrográdního pyelogramu.
Flexibilní ureteroskopie je užitečná zejména v případě nejednoznačné diagnózy, v případě, že zvažujeme konzervativní léčbu nebo u pacientů se solitární ledvinou. Potenciální výhody ureteroskopie je třeba prodiskutovat s pacientem v rámci předoperačního vyšetřování jakéhokoli typu UUT-UCC. Kombinace grade tumoru určeného na základě biopsie (při ureteroskopii), nálezu ipsilaterální hydronefrózy a cytologického vyšetření může pomoci při rozhodování mezi radikální nefroureterektomií (RNU) versus endoskopickou léčbou [42]. Tab. 2 uvádí seznam doporučení.
Tab. 2. Guidelines pro diagnostiku uroteliálního karcinomu horních cest močových. 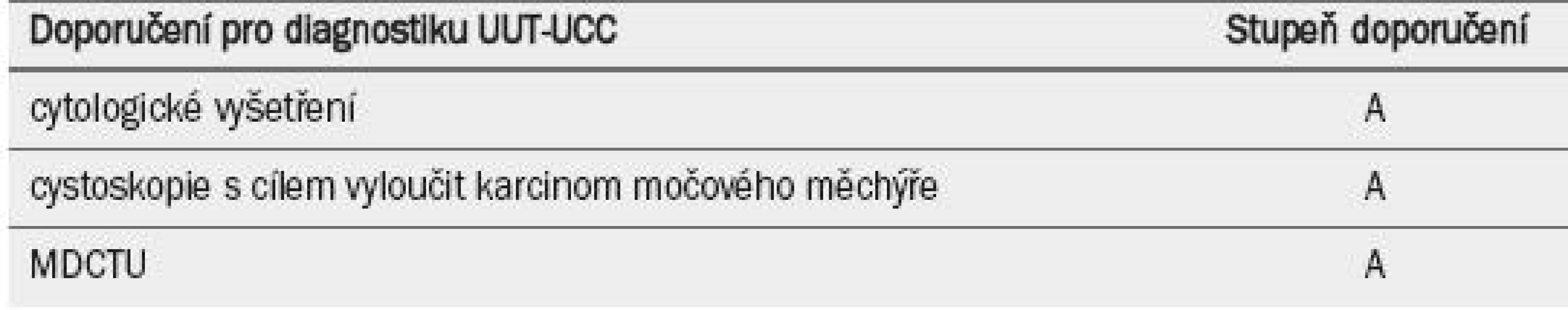
3.6 Prognostické faktory
UUT-UCC, jenž invaduje svalovinu, má obvykle velmi špatnou prognózu. Doba přežití 5 let specifická pro karcinom činí < 50 % pro karcinomy pT2/pT3 a < 10 % pro pT4 [51,52]. Tato kapitola představuje stručnou charakteristiku v současné době akceptovaných prognostických faktorů.
3.6.1 Stadium a grade tumoru
Podle nejnovější klasifikace primární prognostické faktory zahrnují stadium a grade tumoru [8,31,53–55].
3.6.2 Věk a pohlaví
Vliv pohlaví pacienta na mortalitu na UUT-UCC je v poslední době zpochybňován a již není považován za nezávislý prognostický faktor [56–58]. Naopak ovšem věk pacienta je stále považován za nezávislý prognostický faktor, vzhledem k tomu, že vyšší věk v době RNU souvisí s nižší dobou přežití specifickou pro karcinom (úroveň důkazu: 3) [59]. Vyšší věk však není vhodné považovat za kritérium pro vyloučení agresivní léčby potenciálně vyléčitelného UUT-UCC. U značného procenta starších pacientů lze tumor pomocí RNU vyléčit [59], což nasvědčuje tomu, že kalendářní věk sám o sobě není vhodným indikátorem výsledku léčby u starších pacientů s UUT-UCC [59].
3.6.3 Lokalizace tumoru
Nejnovější nálezy nasvědčují tomu, že počáteční lokalizaci tumoru v horních cestách močových (např. v močovodu a ledvinné pánvičce) již nelze považovat za prognostický faktor [11,60,61], ačkoli dřívější studie svědčily o opaku (úroveň důkazu: 3) [62]. Po započítání stadia tumoru nemá lokalizace tumoru (tj. ureterální vs pyelokaliceální tumory) pravdě-podobně žádný prognostický význam [11,63].
3.6.4 Lymfovaskulární invaze
Lymfovaskulární invaze je přítomna přibližně u 20 % pacientů s UUT-UCC. Tento faktor představuje nezávislý predikátor doby přežití. Informaci o statutu lymfovaskulární invaze by měla obsahovat patologická zpráva vzorku odebraného při RNU (úroveň důkazu: 3) [64–66]. Prognostickou informaci (mimo informace získané pomocí standardních technik) však lymfovaskulární invaze poskytuje pouze u pacientů s negativními lymfatickými uzlinami [64].
3.6.5 Další faktory
Rozsáhlá nekróza tumoru je nezávislým predikátorem klinického výsledku u pacientů, kteří podstoupí RNU. Rozsáhlou nekrózu lze definovat jako > 10 % plochy tumoru (úroveň důkazu: 3) [67–68].
Architektura tumoru (např. papilární vs široce nasedající) UUT-UCC pravděpodobně ovlivňuje prognózu po RNU. Široce nasedající růstový charakter souvisí s horším výsledkem (úroveň důkazu: 3) [8,63,69].
Současný výskyt CIS u pacientů s na orgán ohraničeným UUT-UCC souvisí s vyšším rizikem recidivy onemocnění a vyšší mortalitou specifickou pro karcinom (úroveň důkazu: 3) [70]. Podobně jako u uroteliálního karcinomu dolních cest močových představuje současný výskyt CIS u pacientů s na orgán ohraničeným tumorem nezávislý predikátor horšího výsledku [71].
3.6.6 Molekulární markery
Několik výzkumných skupin se v současné době zaměřuje na studium vlastností tumorů horních cest močových a patogeneze zhoubného nádoru. Rovněž byly zkoumány speciální markery, jež mohou pomoci při stanovení prognózy UUT-UCC. Mikrosatelitní nestabilita (MSIs) představuje nezávislý molekulární marker pro prognózu tumoru [72]. MSIs rovněž umožňuje detekovat mutace v zárodečné linii, užitečné pro detekci potenciálních dědičných tumorů [14,16,72].
Bylo prokáno, že E-kadherin je díky obsahu HIF-1α (hypoxií indukovaný faktor) a RNA telomerázy nezávislý marker užitečný pro prognózu [73]. HIF-1α pravděpodobně navíc úzce souvisí s grade tumoru a jeho růstovým charakterem a RNA telomerázu lze zřejmě užít pro diagnostiku UUT-UCC a stanovení prognózy. Žádný z výše uváděných markerů však dosud nebyl ověřen a žádný nesplňuje klinická a statistická kritéria opravňující jejich zavedení do běžné klinické praxe.
3.7 LÉČBA
3.7.1 Lokalizované onemocnění
3.7.1.1 Radikální nefroureterektomie
RNU s excizí manžety močového měchýře představuje zlatý standard léčby UUT-UCC, bez ohledu na lokalizaci tumoru v horních cestách močových (úroveň důkazu: 3) [8]. RNU operace musí dodržovat onkologická pravidla, zahrnující prevenci rozsevu tumoru zabráněním vstupu do močových cest během resekce tumoru [8,69].
Často se provádí rovněž resekce distálního močovodu a jeho ústí, protože tato část močových cest je spojena s vysokým rizikem recidivy. Po odstranění proximální části je během sledování pacienta téměř nemožné zobrazit tuto část nebo se k ní přiblížit pomocí endoskopického vyšetření. Nejnovější studie zabývající se délkou života pacientů po nefroureterektomii dospěly k závěru, že odstranění distálního ureteru a manžety močového měchýře přináší benefit [74–77].
McDonald et al v roce 1952 popsali tzv. pluck techniku, ale až v roce 1995 [78] byl užitek endoskopického přístupu k distálnímu ureteru dostatečně zdůrazněn. S cílem usnadnit resekci distálního močovodu bylo navrženo několik alternativních technik: sloupnutí (stripping), transuretrální resekce intramurálního močovodu a technika s intususcepcí [12]. Kromě sloupnutí (stripping) nebyl u žádné techniky prokázán horší výsledek než u excize manžety močového měchýře (úroveň důkazu: 3) [75,77,79]. Provedení resekce více než 45 dní po diagnostikování onemocnění s sebou nese riziko progrese (úroveň důkazu: 3) [80].
Preparace lymfatických uzlin souvisejících s RNU je žádoucí a umožňuje optimální stanovení stadia onemocnění (úroveň důkazu: 3) [81–83]. Lymfadenektomie u pacientů s onemocněním ve stadiu pN+ umožní zmenšit objem tumoru a usnadnit adjuvantní terapii (úroveň důkazu: 3) [82]. Přesná anatomická lokalizace pro lymfadenektomii však dosud nebyla jasně definována. Počet lymfatických uzlin, které je nutné odstranit, závisí na lokalizaci tumoru. Žádná studie dosud neprokázala přímý vliv na dobu přežití [82]. Provádění lymfadenektomie je pravděpodobně zbytečné u UUT-UCC ve stadiu Ta–T1, protože pozitivní lymfatické uzliny byly nalezeny u 2,2 % tumorů pT1 vs 16 % u tumorů pT2–4 [82]. Autoři navíc popisují kontinuální zvýšení pravděpodobnosti výskytu onemocnění invadujícího lymfatické uzliny v závislosti na pT klasifikaci [81]. V neposlední řadě lymfadenektomie pravděpodobně představuje prognostickou proměnnou v populaci pacientů s histologicky prokázaným onemocněním neinvadujícím lymfatické uzliny (pN0) [83]. Tyto údaje však pocházejí z retrospektivní studie, není tedy možné standardizovat ani indikaci ani rozsah lymfadenektomie. Rovněž je pravděpodobné, že studie neuvádějí skutečnou míru (tj. uvádějí nižší) výskytu pozitivních lymfatických uzlin.
Bezpečnost laparoskopické RNU rovněž ještě nebyla schválena s konečným rozhodnutím [84,85]. První studie popisují případy rozsevu metastáz v retroperitoneu a podél trokarů při manipulaci s velkými tumory v pneumoperitoneu [86,87].
Nejnovější studie však nasvědčují tomu, že onkologické výsledky laparoskopické RNU a otevřené operace jsou téměř srovnatelné. Laparoskopický přístup navíc dosahuje lepšího funkčního výsledku než otevřený přístup (úroveň důkazu: 3) [88–91]. Pouze jediná prospektivní randomizovaná studie zahrnující 80 pacientů neprokázala, že by laparoskopická RNU byla horší než otevřená RNU při léčbě neinvazivního UUT-UCC (úroveň důkazu: 2) [92].
Při výkonu v pneumoperitoneu je třeba se vyhnout následujícím krokům, které mohou zvyšovat rozsev tumoru:
- je třeba se vyhnout vstupu do močových cest
- je třeba se vyhnout přímému kontaktu instrumentů s tumorem
- laparoskopickou RNU je nutné provádět v uzavřeném systému
- je třeba se vyhnout morcelaci tumoru, pro extrakci tumoru je nezbytné použit endoskopický sáček
- ledvinu a močovod je nutné vyjmout en bloc spolu s manžetou močového měchýře
- invazivní, velké (T3/T4 a/ nebo N+/M+) nebo multifokální tumory představují kontraindikaci pro laparoskopickou RNU (dokud nebude prokázán opak)
Doporučení jsou uvedena v tab. 3.
Tab. 3. Guidelines pro radikální léčbu uroteliálního karcinomu horních cest močových: radikální nefroureterektomie. 
3.7.1.2 Konzervativní operace
Konzervativní operace UUT-UCC s nízkým rizikem umožňuje zachování horní části ledvinné jednotky při současné minimalizaci morbidity spojené s radikální operací [93,94]. Konzervativní léčbu UUT-UCC lze zvážit v nezbytných případech (renální insuficience, solitární funkční ledvina) a nebo ve vybraných případech (tj. v případě funkční kontralaterální ledviny) u tumorů nízkého grade a nízkého stadia (úroveň důkazu: 3) [76–95]. Volba techniky závisí na technických omezeních, anatomické lokalizaci tumoru a zkušenosti operatéra.
3.7.1.2.1 Ureteroskopie
Endoskopickou ablaci lze zvážit ve velmi pečlivě vybraných případech [96–98] a v následujících situacích:
- v případě, že máme k dispozici flexibilní (spíše než rigidní) ureteroskop, laserový generátor a kleště (pluck) pro biopsii (úroveň důkazu: 3) [96–99]
- pacient je informován o nutnosti pečlivějšího a přísnějšího sledování
- v případě, že je vhodná kompletní resekce
3.7.1.2.2 Segmentální resekce
Segmentální ureterální resekce se širokými okraji umožňuje získat adekvátní patologický vzorek pro definitivní stanovení stadia a grade při současném zachování ipsilaterální ledviny. Segmentální resekci je dále možné provádět u tumorů v distální části močovodu s nízkým a vysokým rizikem (úroveň důkazu: 3) [100–101]. Je však nutné zajistit, aby tkáň kolem karcinomu nebyla zasažena tumorem. Segmentální resekce ilické a lumbární části močovodu je spojena s vyšší mírou selhání než resekce distální části pánevního močovodu [100,102].
Otevřená resekce tumorů v ledvinné pánvičce nebo kalichu se již téměř neprovádí. Resekce pyelokaliceálních tumorů je technicky náročná a míra recidivy je vyšší než v případě tumorů lokalizovaných v močovodu.
3.7.1.2.3 Perkutánní přístup
Perkutánní přístup lze zvážit u pacientů s neinvazivními UUT-UCC v renální dutině nebo UUT-UCC nízkého grade (úroveň důkazu: 3) [97,103,104]. Tuto terapeutickou modalitu lze nabídnout pacientům s tumory nízkého grade v dolním kalichu, které jsou nedostupné nebo obtížně zvladatelné pomocí ureteroskopie. Teoretické riziko rozsevu existuje v místě vpichu a v perforacích, k nimž může dojít během výkonu. Od tohoto přístupu se však díky moderním materiálům a současným ureteroskopům s lepším ohybem distální špičky postupně ustupuje.
3.7.1.3 Adjuvantní topické látky
Instilace bacillus Calmette-Guérin nebo mitomycinu-C do horních cest močových pomocí perkutánní nefrostomie systémem tří chlopní otevřených ve 20 cm (po úplném odstranění tumoru) nebo dokonce prostřednictvím ureterálního stentu [105], je technicky proveditelná po konzervativní léčbě UUT-UCC anebo u pacientů s CIS. Střednědobé výsledky jsou srovnatelné s výsledky léčby tumorů močového měchýře, ovšem nebyly dosud potvr-zeny v dlouhodobém horizontu (úroveň důkazu: 3) [1,106,107]. Tab. 4 uvádí seznam doporučení.
Tab. 4. Guidelines pro konzervativní léčbu uroteliálního karcinomu horních cest močových. 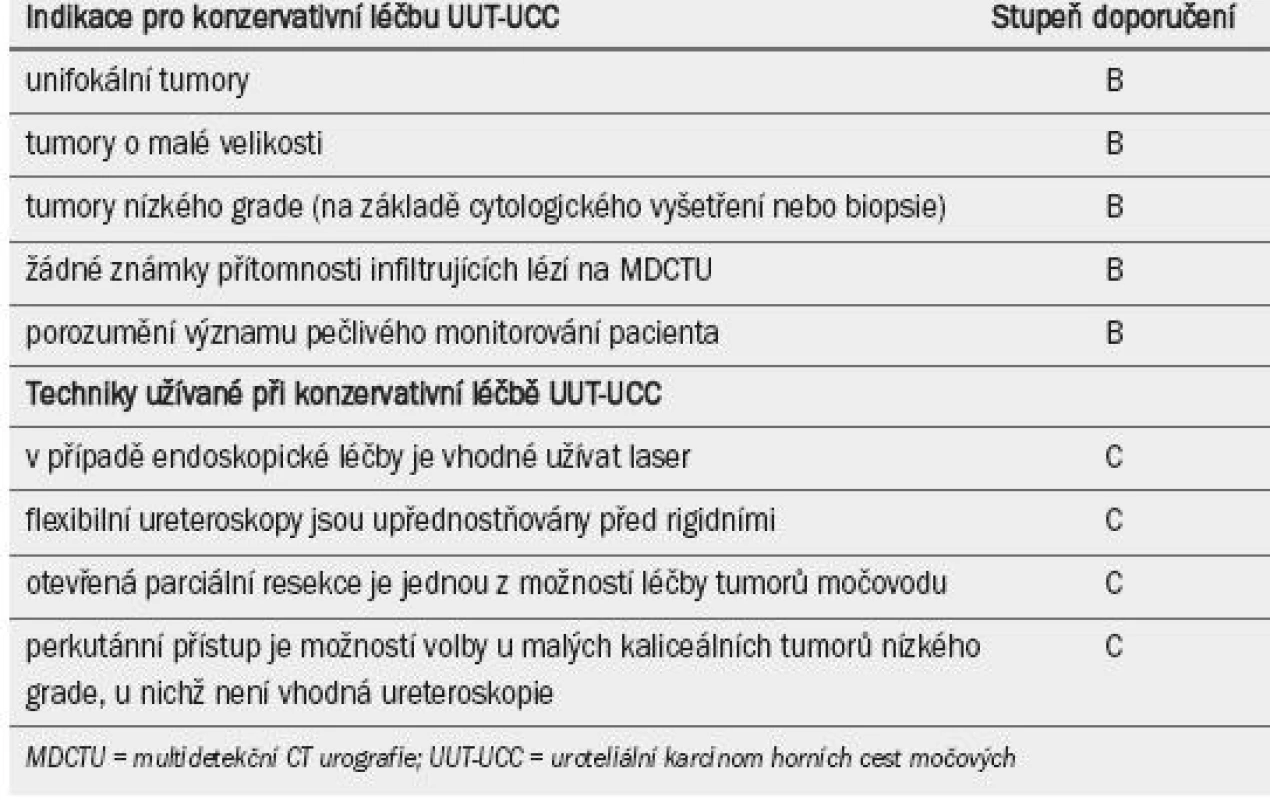
3.7.2 Onemocnění v pokročilém stadiu
3.7.2.1 Nefroureterektomie
Nebyl prokázán žádný benefit RNU u metastazujícího (M+) onemocnění, ačkoli tuto metodu lze považovat za paliativní (úroveň důkazu: 3) [8–81].
3.7.2.2 Chemoterapie
Vzhledem k tomu, že UUT-UCC jsou uroteliální tumory, lze předpokládat, že chemoterapie na bází platiny bude mít podobné výsledky jako v případě karcinomu močového měchýře. Bylo navrhováno několik chemoterapeutických protokolů na bázi platiny [108–111].
Pouze jediná studie uvádí účinnost neoadjuvantní chemoterapie (ve srovnání s močovým měchýřem). Ačkoli je nezbytné vyčkat na vyzrálejší data a výsledky delší doby sledování, předběžné výsledky podporují tuto strategii při léčbě UUT-UCC [112].
Adjuvantní chemoterapie dosahuje až 50% míry přežití bez recidivy, ovšem má pouze minimální dopad na dobu přežití [108–111]. Tato terapie není vzhledem ke komorbiditám a narušené renální funkci indikována u všech pacientů po radikální operaci. V současné době nemáme k dispozici dostatek důkazů, na jejichž základě by bylo možné stanovit jakákoli doporučení.
3.7.2.3 Radioterapie
Adjuvantní radioterapie může zlepšovat lokální kontrolu onemocnění [113]. V kombinaci s cisplatinou může adjuvantní radioterapie prodlužovat dobu přežití bez onemocnění i celkovou dobu přežití [114] (úroveň důkazu: 3). Radioterapie je v současné době pouze výjimečně užívána jako monoterapie i v kombinaci s chemoterapií (schéma 1).
Schéma 1. Navrhovaný postup při léčbě karcinomu horních cest močových (UUT-UCC). 
3.8 Sledování
Po operační léčbě vyžadují pacienti s UUT-UCC pečlivé sledování, které umožní detekovat metachronní tumory močového měchýře (ve všech případech), lokální recidivu a vzdálené metastázy (v případě invazivních tumorů).
Po RNU je míra lokální recidivy nízká a riziko vzniku distálních metastáz je přímo úměrné výskytu rizikových faktorů (uvedených výše). Míra recidivy onemocnění v močovém měchýři po léčbě primárního UUT-UCC se významně liší, od 15 % až po 50 % [10,115,116]. Močový měchýř je tedy nutné monitorovat v každém případě. Nejčastější rizikové faktory pro recidivu tumoru v močovém měchýři (UUT-UCC) zahrnují anamnézu karcinomu močového měchýře a multifokálního tumoru v horních cestách močových. Program sledování spočívá v cystoskopii a cytologickém vyšetření po dobu alespoň 5 let [10,115,116]. Recidivu v močovém měchýři není vhodné řadit mezi vzdálenou recidivu.
Po konzervativní terapii je nutné vzhledem k vysokému riziku recidivy provádět pečlivé sledování ipsilaterálních cest močových. Navzdory významným pokrokům v endourologické technologii je sledování pacientů po konzervativní terapii obtížné a často je nezbytné přistoupit k minimálně invazivním technikám [96,98,117,118]. Tab. 5 uvádí doporučení pro program sledování.
Tab. 5. Guidelines pro sledovaní pacientů s uroteliálním karcinomem horních cest močových po počáteční léčbě. 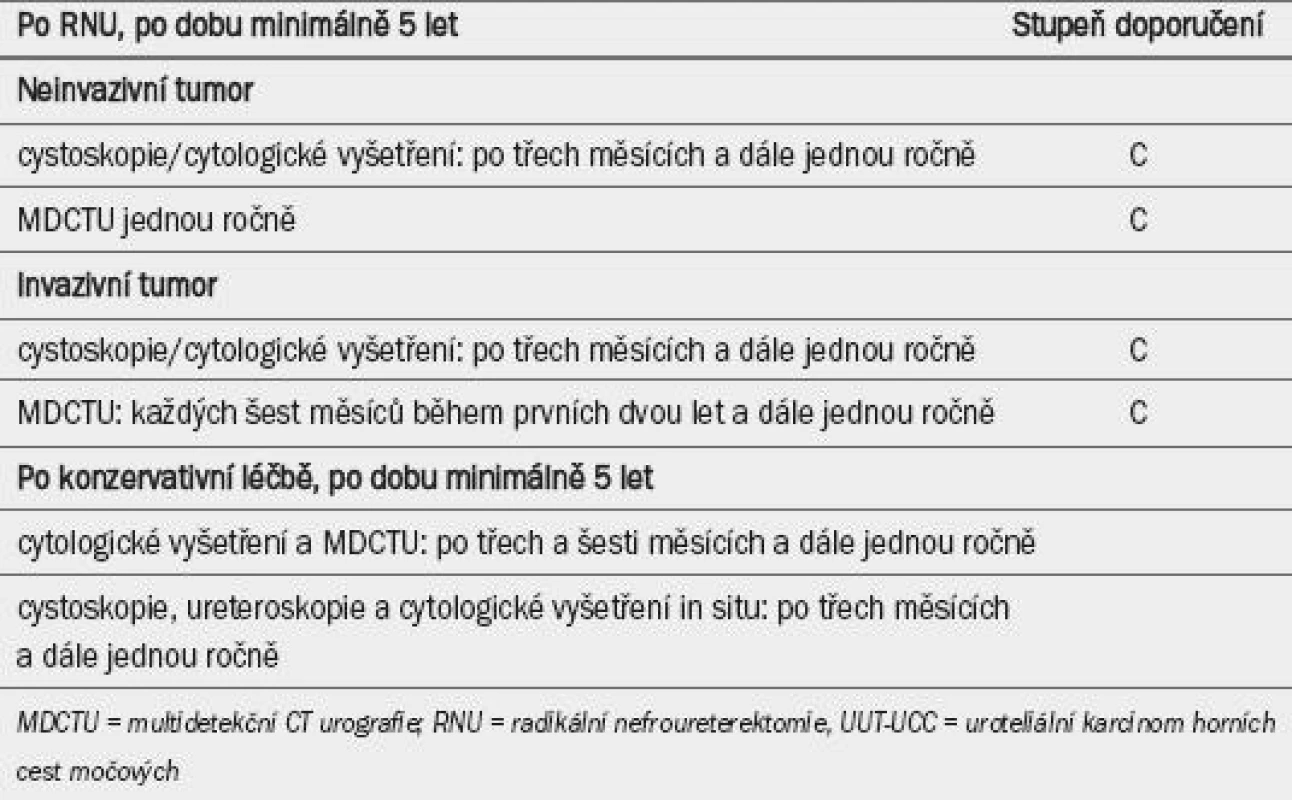
4. ZÁVĚR
Tato guidelines nabízejí informace týkající se diagnostiky a léčby na základě současného, standardizovaného přístupu. Při volbě nejvhodnějšího terapeutického postupu musí lékař zvážit specifické klinické proměnné každého pacienta s přihlédnutím k funkci ledviny a výskytu komorbidit, lokalizaci tumoru, grade a molekulárních markerů.
ZKRATKY UŽITÉ V TEXTU
- CIS Carcinoma in situ
- CT Počítačová tomografie
- EAU Evropská urologická asociace
- FISH Fluorescenční in situ hybridizace
- GR Stupeň doporučení
- HIF Hypoxií indukovaný faktor
- HNPCC Dědičný nepolypózní kolorektální karcinom
- LE Úroveň důkazu
- MDCTU Multidetekční CT urografie
- MRI Magnetická rezonance
- MSIs Mikrosatelitní nestabilita
- RNU Radikální nefroureterektomie
- TNM Tumor, uzlina, metastáza
- UUT-UCC Uroteliální karcinom v horních cestách močových
- WHO Světová zdravotnická organizace
Zdroje
1. Oosterlinck W, Solsona E, van der Meijden AP et al. EAU guidelines on diagnosis and treatment of upper urinary tract transitional cell carcinoma. Eur Urol 2004; 46(2): 147–154.
2. Phillips B, Ball C, Sackett D et al. Oxford Centre for Evidence-based Medicine – levels of evidence (March 2009). Centre for Evidence Based Medicine Web site. http://www.cebm.net/index.aspx?o=1025 Updated March 2009.
3. Munoz JJ, Ellison LM. Upper tract urothelial neoplasms: incidence and survival during the last 2 decades. J Urol 2000; 164(5): 1523–1525.
4. Ploeg M, Aben KK, Kiemeney LA. The present and future burden of urinary bladder cancer in the world. World J Urol 2009; 27(3): 289–293.
5. Babjuk M, Oosterlinck W, Sylvester R et al. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder. Eur Urol 2008; 54(2): 303–314.
6. Jemal A, Siegel R, Ward E et al. Cancer statistics, 2009. CA Cancer J Clin 2009; 59(4): 225–249.
7. Hall MC, Womack S, Sagalowsky AI et al. Prognostic factors, recurrence, and survival in transitional cell carcinoma of the upper urinary tract: a 30-year experience in 252 patients. Urology 1998; 52(4): 594–601.
8. Margulis V, Shariat SF, Matin SF et al. Outcomes of radical nephroureterectomy: a series from the Upper Tract Urothelial Carcinoma Collaboration. Cancer 2009; 115(6): 1224–1233.
9. Olgac S, Mazumdar M, Dalbagni G et al. Urothelial carcinoma of the renal pelvis: a clinicopathologic study of 130 cases. Am J Surg Pathol 2004; 28(12): 1545–1552.
10. Azemar MD, Comperat E, Richard F et al. Bladder recurrence after surgery for upper urinary tract urothelial cell carcinoma: Frequency, risk factors, and surveillance. Urol Oncol 2009 Sep. (Epub ahead of print)
11. Raman JD, Ng CK, Scherr DS et al. Impact of Tumor Location on Prognosis for Patients with Upper Tract Urothelial Carcinoma Managed by Radical Nephroureterectomy. Eur Urol 2010; 57(6): 1072–1093.
12. Li WM, Shen JT, Li CC et al. Oncologic Outcomes Following Three Different Approaches to the Distal Ureter and Bladder Cuff in Nephroureterectomy for Primary Upper Urinary Tract Urothelial Carcinoma. Eur Urol 2010; 57(6): 963–969.
13. Novara G, De Marco V, Dalpiaz O et al. Independent predictors of contralateral metachronous upper urinary tract transitional cell carcinoma after nephroureterectomy: multi-institutional dataset from three European centers. Int J Urol 2009; 16(2): 187–191.
14. Rouprêt M, Catto J, Coulet F et al. Microsatellite instability as indicator of MSH2 gene mutation in patients with upper urinary tract transitional cell carcinoma. J Med Genet 2004; 41(7): e91.
15. Acher P, Kiela G, Thomas K et al. Towards a rational strategy for the surveillance of patients with Lynch syndrome (hereditary non-polyposis colon cancer) for upper tract transitional cell carcinoma. BJU Int 2010; 106(3): 300–302.
16. Rouprêt M, Yates DR, Comperat E et al. Upper urinary tract urothelial cell carcinomas and other urological malignancies involved in the hereditary nonpolyposis colorectal cancer (lynch syndrome) tumor spectrum. Eur Urol 2008; 54(6): 1226–1236.
17. Colin P, Koenig P, Ouzzane A et al. Environmental factors involved in carcinogenesis of urothelial cell carcinomas of the upper urinary tract. BJU Int 2009; 104(10): 1436–1440.
18. Pommer W, Bronder E, Klimpel A et al. Urothelial cancer at different tumour sites: role of smoking and habitual intake of analgesics and laxatives. Results of the Berlin Urothelial Cancer Study. Nephrol Dial Transplant 1999; 14(12): 2892–2897.
19. Shinka T, Miyai M, Sawada Y et al. Factors affecting the occurrence of urothelial tumors in dye workers exposed to aromatic amines. Int J Urol 1995; 2(4): 243–248.
20. Markovic N, Ignjatovic I, Cukuranovic R et al. Decreasing incidence of urothelial cancer in a Balkan endemic nephropathy region in Serbia. A surgery based study from 1969 to 1998. Pathol Biol (Paris) 2005; 53(1): 26–29.
21. Grollman AP, Shibutani S, Moriya M et al. Aristolochic acid and the etiology of endemic (Balkan) nephropathy. Proc Natl Acad Sci U S A 2007; 104(29): 129–134.
22. Arlt VM, Stiborova M, vom Brocke J, et al. Aristolochic acid mutagenesis: molecular clues to the aetiology of Balkan endemic nephropathy-associated urothelial cancer. Carcinogenesis 2007; 28(11): 2253–2261.
23. Laing C, Hamour S, Sheaff M et al. Chinese herbal uropathy and nephropathy. Lancet 2006; 368(9532): 338.
24. Lord GM, Cook T, Arlt VM et al. Urothelial malignant disease and Chinese herbal nephropathy. Lancet 2001; 358(9292): 1515–1516.
25. Tan LB, Chen KT, Guo HR. Clinical and epidemiological features of patients with genitourinary tract tumour in a blackfoot disease endemic area of Taiwan. BJU Int 2008; 102(1): 48–54.
26. Rouprêt M, Cancel-Tassin G, Comperat E et al. Phenol sulfotransferase SULT1A1*2 allele and enhanced risk of upper urinary tract urothelial cell carcinoma. Cancer Epidemiol Biomarkers Prev 2007; 16(11): 2500–2503.
27. Perez-Montiel D, Wakely PE, Hes O et al. High-grade urothelial carcinoma of the renal pelvis: clinicopathologic study of 108 cases with emphasis on unusual morphologic variants. Mod Pathol 2006; 19(4): 494–503.
28. Stewart GD, Bariol SV, Grigor KM et al. A comparison of the pathology of transitional cell carcinoma of the bladder and upper urinary tract. BJU Int 2005; 95(6): 791–793.
29. Orsola A, Trias I, Raventos CX et al. Renal collecting (Bellini) duct carcinoma displays similar characteristics to upper tract urothelial cell carcinoma. Urology 2005; 65(1): 49–54.
30. Busby JE, Brown GA, Tamboli P et al. Upper urinary tract tumors with nontransitional histology: a single-center experience. Urology 2006; 67(3): 518–523.
31. Sobin L, Gospodarowicz M, Wittekind C. TNM Classification of Malignant Tumours. Urological Tumours. Renal Pelvis and Ureter. 7th revised edition, Wiley-Blackwell, uicc 2009 : 258–261.
32. Lopez-Beltran A, Bassi P, Pavone-Macaluso M et al. Handling and pathology reporting of specimens with carcinoma of the urinary bladder, ureter, and renal pelvis. Eur Urol 2004; 45(3): 257–266.
33. Sauter G, Algaba F, Amin M et al. Tumors of the urinary system in: World Health Organisation classification of tumors. Pathology and genetics of tumors of the urinary system and male genital organs. Lyon, France: IARC Press; 2004. 110–123.
34. Raman JD, Shariat SF, Karakiewicz PI et al. Does preoperative symptom classification impact prognosis in patients with clinically localized upper-tract urothelial carcinoma managed by radical nephroureterectomy? Urol Oncol 2010 Jan. (Epub ahead of print)
35. Dillman JR, Caoili EM, Cohan RH et al. Detection of upper tract urothelial neoplasms: sensitivity of axial, coronal reformatted, and curved-planar reformatted image-types utilizing 16-row multi-detector CT urography. Abdom Imaging 2008; 33(6): 707–716.
36. Van Der Molen AJ, Cowan NC, Mueller-Lisse UG et al. CT urography: definition, indications and techniques. A guideline for clinical practice. Eur Radiol 2008; 18(1): 4–17.
37. Wang LJ, Wong YC, Chuang CK et al. Diagnostic accuracy of transitional cell carcinoma on multidetector computerized tomography urography in patients with gross hematuria. J Urol 2009; 181(2): 524–531.
38. Wang LJ, Wong YC, Huang CC et al. Multidetector computerized tomography urography is more accurate than excretory urography for diagnosing transitional cell carcinoma of the upper urinary tract in adults with hematuria. J Urol 2010; 183(1): 48–55.
39. Ng CK, Shariat SF, Lucas SM, et al. Does the presence of hydronephrosis on preoperative axial CT imaging predict worse outcomes for patients undergoing nephroureterectomy for upper-tract urothelial carcinoma? Urol Oncol 2011; 29(1): 27–32.
40. Takahashi N, Glockner JF, Hartman RP, et al. Gadolinium enhanced magnetic resonance urography for upper urinary tract malignancy. J Urol. 2010; 183(4): 1330–1365.
41. Takahashi N, Kawashima A, Glockner JF et al. Small (<2-cm) upper-tract urothelial carcinoma: evaluation with gadolinium-enhanced three-dimensional spoiled gradient-recalled echo MR urography. Radiology 2008; 247(2): 451–457.
42. Brien JC, Shariat SF, Herman MP et al. Preoperative hydronephrosis, ureteroscopic biopsy grade and urinary cytology can improve prediction of advanced upper tract urothelial carcinoma. J Urol 2010; 184(1): 69–73.
43. Luo B, Li W, Deng CH et al. Utility of fluorescence in situ hybridization in the diagnosis of upper urinary tract urothelial carcinoma. Cancer Genet Cytogenet 2009; 189(2): 93–97.
44. Mian C, Mazzoleni G, Vikoler S et al. Fluorescence In Situ Hybridisation in the Diagnosis of Upper Urinary Tract Tumours. Eur Urol 2010; 58(2): 288–292.
45. Nieder AM, Soloway MS, Herr HW. Should we abandon the FISH test? Eur Urol 2007; 51(6): 1469–1471.
46. Johannes JR, Nelson E, Bibbo M et al. Voided urine fluorescence in situ hybridization testing for upper tract urothelial carcinoma surveillance. J Urol 2010; 184(3): 879–882.
47. Chen AA, Grasso M. Is there a role for FISH in the management and surveillance of patients with upper tract transitional-cell carcinoma? J Endourol 2008; 22(6): 1371–1374.
48. Lee KS, Zeikus E, DeWolf WC et al. MR urography versus retrograde pyelography/ureteroscopy for the exclusion of upper urinary tract malignancy. Clin Radiol 2010; 65(3): 185–192.
49. Ishikawa S, Abe T, Shinohara N et al. Impact of diagnostic ureteroscopy on intravesical recurrence and survival in patients with urothelial carcinoma of the upper urinary tract. J Urol 2010; 184(3): 883–887.
50. Tavora F, Fajardo DA, Lee TK et al. Small endoscopic biopsies of the ureter and renal pelvis: pathologic pitfalls. Am J Surg Pathol 2009; 33(10): 1540–1546.
51. Abouassaly R, Alibhai SM, Shah N et al. Troubling Outcomes From Population-level Analysis of Surgery for Upper Tract Urothelial Carcinoma. Urology 2010; 76(4): 895–901.
52. Jeldres C, Sun M, Isbarn H et al. A population-based assessment of perioperative mortality after nephroureterectomy for upper-tract urothelial carcinoma. Urology 2010; 75(2): 315–320.
53. Langner C, Hutterer G, Chromecki T et al. pT classification, grade, and vascular invasion as prognostic indicators in urothelial carcinoma of the upper urinary tract. Mod Pathol 2006; 19(2): 272–279.
54. Lehmann J, Suttmann H, Kovac I et al. Transitional cell carcinoma of the ureter: prognostic factors influencing progression and survival. Eur Urol 2007; 51(5): 1281–1288.
55. Li CC, Chang TH, Wu WJ et al. Significant predictive factors for prognosis of primary upper urinary tract cancer after radical nephroureterectomy in Taiwanese patients. Eur Urol 2008; 54(5): 1127–1134.
56. Fernandez MI, Shariat SF, Margulis V et al. Evidence-based sex-related outcomes after radical nephroureterectomy for upper tract urothelial carcinoma: results of large multicenter study. Urology 2009; 73(1): 142–146.
57. Lughezzani G, Sun M, Perrotte P et al. Gender-related differences in patients with stage I to III upper tract urothelial carcinoma: results from the Surveillance, Epidemiology, and End Results database. Urology 2010; 75(2): 321–327.
58. Shariat SF, Favaretto RL, Gupta A et al. Gender differences in radical nephroureterectomy for upper tract urothelial carcinoma. World J Urol 2010. (Epub ahead of print)
59. Shariat SF, Godoy G, Lotan Y et al. Advanced patient age is associated with inferior cancer-specific survival after radical nephroureterectomy. BJU Int 2010; 105(12): 1672–1677.
60. Favaretto RL, Shariat SF, Chade DC et al. The Effect of Tumor Location on Prognosis in Patients Treated with Radical Nephroureterectomy at Memorial Sloan-Kettering Cancer Center. Eur Urol 2010; 58(4): 574–580.
61. Isbarn H, Jeldres C, Shariat SF et al. Location of the primary tumor is not an independent predictor of cancer specific mortality in patients with upper urinary tract urothelial carcinoma. J Urol 2009; 182(5): 2177–2181.
62. van der Poel HG, Antonini N, van Tinteren H et al. Upper urinary tract cancer: location is correlated with prognosis. Eur Urol 2005; 48(3): 438–444.
63. Margulis V, Youssef RF, Karakiewicz PI et al. Preoperative multivariable prognostic model for prediction of nonorgan confined urothelial carcinoma of the upper urinary tract. J Urol 2010; 184(2): 453–458.
64. Kikuchi E, Margulis V, Karakiewicz PI et al. Lymphovascular invasion predicts clinical outcomes in patients with node-negative upper tract urothelial carcinoma. J Clin Oncol 2009; 27(4): 612–618.
65. Kim DS, Lee YH, Cho KS et al. Lymphovascular invasion and pT stage are prognostic factors in patients treated with radical nephroureterectomy for localized upper urinary tract transitional cell carcinoma. Urology 2010; 75(2): 328–332.
66. Novara G, Matsumoto K, Kassouf W et al. Prognostic Role of Lymphovascular Invasion in Patients with Urothelial Carcinoma of the Upper Urinary Tract: An International Validation Study. Eur Urol 2010; 57(6): 1064–1071.
67. Zigeuner R, Shariat SF, Margulis V et al. Tumour Necrosis Is an Indicator of Aggressive Biology in Patients with Urothelial Carcinoma of the Upper Urinary Tract. Eur Urol 2010; 57(4): 575–581.
68. Seitz C, Gupta A, Shariat SF et al. Association of tumor necrosis with pathological features and clinical outcome in 754 patients undergoing radical nephroureterectomy for upper tract urothelial carcinoma: an international validation study. J Urol. 2010; 184(5): 1895–1900.
69. Remzi M, Haitel A, Margulis V et al. Tumour architecture is an independent predictor of outcomes after nephroureterectomy: a multi-institutional analysis of 1363 patients. BJU Int 2009; 103(3): 307–311.
70. Wheat JC, Weizer AZ, Wolf JS Jr. et al. Concomitant carcinoma in situ is a feature of aggressive disease in patients with organ confined urothelial carcinoma following radical nephroureterectomy. Urol Oncol 2010. (Epub ahead of print)
71. Pieras E, Frontera G, Ruiz X et al. Concomitant carcinoma in situ and tumour size are prognostic factors for bladder recurrence after nephroureterectomy for upper tract transitional cell carcinoma. BJU Int. 2010; 106(9): 1319–1323.
72. Rouprêt M, Fromont G, Azzouzi AR et al. Microsatellite instability as predictor of survival in patients with invasive upper urinary tract transitional cell carcinoma. Urology 2005; 65(6): 1233–1237.
73. Eltz S, Comperat E, Cussenot O et al. Molecular and histological markers in urothelial carcinomas of the upper urinary tract. BJU Int 2008; 102(5): 532–535.
74. Lughezzani G, Sun M, Perrotte P et al. Should Bladder Cuff Excision Remain the Standard of Care at Nephroureterectomy in Patients with Urothelial Carcinoma of the Renal Pelvis? A Population-based Study. Eur Urol 2010; 57(6): 956–962.
75. Phé V, Cussenot O, Bitker MO et al. Does the surgical technique for management of the distal ureter influence the outcome after nephroureterectomy? BJU Int 2010.
76. Zigeuner R, Pummer K. Urothelial carcinoma of the upper urinary tract: surgical approach and prognostic factors. Eur Urol 2008; 53(4): 720–731.
77. Saika T, Nishiguchi J, Tsushima T et al. Comparative study of ureteral stripping versus open ureterectomy for nephroureterectomy in patients with transitional carcinoma of the renal pelvis. Urology 2004; 63(5): 848–852.
78. Palou J, Caparros J, Orsola A et al. Transurethral resection of the intramural ureter as the first step of nephroureterectomy. J Urol 1995; 154(1): 43–44.
79. Laguna MP, de la Rosette JJ. The endoscopic approach to the distal ureter in nephroureterectomy for upper urinary tract tumor. J Urol 2001; 166(6): 2017–2022.
80. Waldert M, Karakiewicz PI, Raman JD et al. A delay in radical nephroureterectomy can lead to upstaging. BJU Int 2010; 105(6): 812–817.
81. Lughezzani G, Jeldres C, Isbarn H et al. A critical appraisal of the value of lymph node dissection at nephroureterectomy for upper tract urothelial carcinoma. Urology 2010; 75(1): 118–124.
82. Roscigno M, Shariat SF, Margulis V et al. Impact of lymph node dissection on cancer specific survival in patients with upper tract urothelial carcinoma treated with radical nephroureterectomy. J Urol 2009; 181(6): 2482–2489.
83. Roscigno M, Shariat SF, Margulis V et al. The extent of lymphadenectomy seems to be associated with better survival in patients with nonmetastatic upper-tract urothelial carcinoma: how many lymph nodes should be removed? Eur Urol 2009; 56(3): 512–518.
84. Berger A, Haber GP, Kamoi K et al. Laparoscopic radical nephroureterectomy for upper tract transitional cell carcinoma: oncological outcomes at 7 years. J Urol 2008; 180(3): 849–854.
85. Rassweiler JJ, Schulze M, Marrero R et al. Laparoscopic nephroureterectomy for upper urinary tract transitional cell carcinoma: is it better than open surgery? Eur Urol 2004; 46(6): 690–697.
86. Ong AM, Bhayani SB, Pavlovich CP. Trocar site recurrence after laparoscopic nephroureterectomy. J Urol 2003; 170 (4 Pt 1): 1301.
87. Rouprêt M, Smyth G, Irani J et al. Oncological risk of laparoscopic surgery in urothelial carcinomas. World J Urol 2009; 27(1): 81–88.
88. Capitanio U, Shariat SF, Isbarn H et al. Comparison of oncologic outcomes for open and laparoscopic nephroureterectomy: a multi-institutional analysis of 1249 cases. Eur Urol 2009; 56(1): 1–9.
89. Favaretto RL, Shariat SF, Chade DC et al. Comparison Between Laparoscopic and Open Radical Nephroureterectomy in a Contemporary Group of Patients: Are Recurrence and Disease-Specific Survival Associated with Surgical Technique? Eur Urol 2010. (Epub ahead of print)
90. Kamihira O, Hattori R, Yamaguchi A, et al. Laparoscopic radical nephroureterectomy: a multicenter analysis in Japan. Eur Urol 2009; 55(6): 1397–1407.
91. Rouprêt M, Hupertan V, Sanderson KM et al. Oncologic control after open or laparoscopic nephroureterectomy for upper urinary tract transitional cell carcinoma: a single center experience. Urology 2007; 69(4): 656–661.
92. Simone G, Papalia R, Guaglianone S et al. Laparoscopic versus open nephroureterectomy: perioperative and oncologic outcomes from a randomised prospective study. Eur Urol 2009; 56(3): 520–526.
93. Chen GL, Bagley DH. Ureteroscopic management of upper tract transitional cell carcinoma in patients with normal contralateral kidneys. J Urol 2000; 164(4): 1173–1176.
94. Gadzinski AJ, Roberts WW, Faerber GJ et al. Long-term outcomes of nephroureterectomy versus endoscopic management for upper tract urothelial carcinoma. J Urol 2010; 183(6): 2148–2153.
95. Brown GA, Busby JE, Wood CG et al. Nephroureterectomy for treating upper urinary tract transitional cell carcinoma: Time to change the treatment paradigm? BJU Int 2006; 98(6): 1176–1180.
96. Bagley DH, Grasso M 3rd. Ureteroscopic laser treatment of upper urinary tract neoplasms. World J Urol 2010; 28(2): 143–149.
97. Rouprêt M, Hupertan V, Traxer O et al. Comparison of open nephroureterectomy and ureteroscopic and percutaneous management of upper urinary tract transitional cell carcinoma. Urology 2006; 67(6): 1181–1187.
98. Cornu JN, Rouprêt M, Carpentier X et al. Oncologic control obtained after exclusive flexible ureteroscopic management of upper urinary tract urothelial cell carcinoma. World J Urol 2010; 28(2): 151–156.
99. Rouprêt M, Wallerand H, Traxer O et al. Checkup and management of upper urinary tract tumours in 2010: An update from the committee of cancer from the French National Association of Urology. Prog Urol 2010; 20(4): 260–2671.
100. Jeldres C, Lughezzani G, Sun M et al. Segmental ureterectomy can safely be performed in patients with transitional cell carcinoma of the ureter. J Urol 2010; 183(4): 1324–1329.
101. Thompson RH, Krambeck AE, Lohse CM et al. Elective endoscopic management of transitional cell carcinoma first diagnosed in the upper urinary tract. BJU Int 2008; 102(9): 1107–1110.
102. Zungri E, Chechile G, Algaba F et al. Treatment of transitional cell carcinoma of the ureter: is the controversy justified? Eur Urol 1990; 17(4): 276–280.
103. Palou J, Piovesan LF, Huguet J et al. Percutaneous nephroscopic management of upper urinary tract transitional cell carcinoma: recurrence and long-term followup. J Urol 2004; 172(1): 66–69.
104. Rouprêt M, Traxer O, Tligui M et al. Upper urinary tract transitional cell carcinoma: recurrence rate after percutaneous endoscopic resection. Eur Urol 2007; 51 : 709–713.
105. Irie A, Iwamura M, Kadowaki K et al. Intravesical instillation of bacille Calmette-Guerin for carcinoma in situ of the urothelium involving the upper urinary tract using vesicoureteral reflux created by a double-pigtail catheter. Urology 2002; 59(1): 53–57.
106. Nonomura N, Ono Y, Nozawa M et al. Bacillus Calmette-Guerin perfusion therapy for the treatment of transitional cell carcinoma in situ of the upper urinary tract. Eur Urol 2000; 38(6): 701–704.
107. Thalmann GN, Markwalder R, Walter B et al. Long-term experience with bacillus Calmette-Guerin therapy of upper urinary tract transitional cell carcinoma in patients not eligible for surgery. J Urol 2002; 168 (4 Pt 1): 1381–1385.
108. Audenet F, Yates D, Cussenot O et al. The role of chemotherapy in the treatment of urothelial cell carcinoma of the upper urinary tract (UUT-UCC). Urol Oncol 2010. (Epub ahead of print)
109. Hellenthal NJ, Shariat SF, Margulis V et al. Adjuvant chemotherapy for high risk upper tract urothelial carcinoma: results from the Upper Tract Urothelial Carcinoma Collaboration. J Urol 2009; 182(3): 900–906.
110. Kaag MG, O'Malley RL, O'Malley P et al. Changes in Renal Function Following Nephroureterectomy May Affect the Use of Perioperative Chemotherapy. Eur Urol 2010; 58(4): 581–587.
111. Lane BR, Smith AK, Larson BT et al. Chronic kidney disease after nephroureterectomy for upper tract urothelial carcinoma and implications for the administration of perioperative chemotherapy. Cancer 2010; 116(12): 2967–2973.
112. Matin SF, Margulis V, Kamat A et al. Incidence of downstaging and complete remission after neoadjuvant chemotherapy for high-risk upper tract transitional cell carcinoma. Cancer 2010; 116(13): 3127–3134.
113. Hall MC, Womack JS, Roehrborn CG et al. Advanced transitional cell carcinoma of the upper urinary tract: patterns of failure, survival and impact of postoperative adjuvant radiotherapy. J Urol 1998; 160 (3 Pt 1): 703–706.
114. Czito B, Zietman A, Kaufman D et al. Adjuvant radiotherapy with and without concurrent chemotherapy for locally advanced transitional cell carcinoma of the renal pelvis and ureter. J Urol 2004; 172 (4 Pt 1): 1271–1275.
115. Raman JD, Ng CK, Boorjian SA et al. Bladder cancer after managing upper urinary tract transitional cell carcinoma: predictive factors and pathology. BJU Int 2005; 96(7): 1031–1035.
116. Terakawa T, Miyake H, Muramaki M et al. Risk factors for intravesical recurrence after surgical management of transitional cell carcinoma of the upper urinary tract. Urology 2008; 71(1): 123–127.
117. Chen GL, El-Gabry EA, Bagley DH. Surveillance of upper urinary tract transitional cell carcinoma: the role of ureteroscopy, retrograde pyelography, cytology and urinalysis. J Urol 2000; 164(6): 1901–1904.
118. Daneshmand S, Quek ML, Huffman JL. Endoscopic management of upper urinary tract transitional cell carcinoma: long-term experience. Cancer 2003; 98(1): 55–60.
Štítky
Detská urológia Urológia
Článek Úvodník
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2011 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Nefron šetřící operace bez zasvorkování renálního hilu
- Minimálně invazivní laparoskopická a roboticky asistovaná parciální resekce ledviny: stručná historie a přehled
- Laparoskopická a robotická heminefrektomie a ureteroureterostomie v rámci léčby zdvojeného vývodného systému horních cest močových
- Chirurgická léčba lokálně pokročilého karcinomu ledviny s nádorovým trombem v žilním řečišti T3b, T3c
- Co nabízí dnešní medicína, když selže diagnostika karcinomu ledviny ve stadiu lokalizovaném na orgán?
- Možnosti predikce karcinomu prostaty pomocí PCA3
- Možnosti klinické aplikace kombinované léčby benigní hyperplazie prostaty
- Indikace a výsledky ablace tumoru ledviny
-
EAU Guidelines pro diagnostiku a léčbu uroteliálního karcinomu horních cest močových
aktualizace 2011 - Úvodník
- Diagnostické možnosti časného zjištění nádorů ledvin, role nádorových markerů při stanovení dalšího postupu
- EAU Guidelines pro řešení močové inkontinence
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Možnosti predikce karcinomu prostaty pomocí PCA3
- Diagnostické možnosti časného zjištění nádorů ledvin, role nádorových markerů při stanovení dalšího postupu
- Chirurgická léčba lokálně pokročilého karcinomu ledviny s nádorovým trombem v žilním řečišti T3b, T3c
- Laparoskopická a robotická heminefrektomie a ureteroureterostomie v rámci léčby zdvojeného vývodného systému horních cest močových
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



