-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možnosti klinické aplikace kombinované léčby benigní hyperplazie prostaty
COMBINATION THERAPY OF BENIGN PROSTATIC HYPERPLASIA – CLINICAL APLLICATIONS
Benign prostatic hyperplasia (BPH) is the main cause of lower urinary tract symptoms in older men. Since introduction of α-adrenoreceptor antagonists (α-blockers) and 5α-reductase inhibitors, medical therapy has become the first-line treatment of BPH. Positive effect of either of the drug classes on relief of symptoms and clinical progression has led to combination therapy research, which, as proven by large clinical trials, is superior to monotherapy in terms of reducing the risk of acute urinary retention, BPH-related surgery and clinical progression in patients at risk. The article provides complex data on combination therapy with α-blockers and 5α-reductase inhibitors based on results of two long-term, randomized, double-blind trials: MTOPS (The Medical Therapy of Prostatic Symptoms) a CombAT (The Combination of Avodart® and Tamsulosin).
Key words:
benign prostatic hyperplasia, combination therapy
Vyšlo v časopise: Urol List 2011; 9(4): 49-53
Souhrn
Benigní hyperplazie prostaty (BHP) je nejčastější příčinou příznaků dolních močových cest u starších mužů. Od zavedení léčby antagonisty α-adrenergních receptorů (alfablokátorů) a inhibitory 5α-reduktázy se farmakoterapie stala léčbou první linie BHP. Pozitivní vliv těchto jednotlivých skupin léků na příznaky onemocnění a jeho další progresi vedl k výzkumu kombinované léčby, která, jak bylo prokázáno v rozsáhlých klinických studiích, je efektivnější než monoterapie z hlediska redukce rizika akutní močové retence, nutnosti operace a prevence klinické progrese u pacientů se zvýšeným rizikem. Článek přináší souhrnnou informaci o kombinované léčbě BHP alfablokátory a inhibitory 5α-reduktázy s důrazem kladeným na výsledky dlouhodobých randomizovaných dvojitě zaslepených studií MTOPS (The Medical Therapy of Prostatic Symptoms) a CombAT (The Combination of Avodart® and Tamsulosin).
Klíčová slova:
benigní hyperplazie prostaty, kombinovaná léčbaBenigní hyperplazie prostaty postihuje 40 % mužů v páté dekádě života a až 90 % mužů v deváté dekádě života [1]. Projevuje se příznaky dolních močových cest (LUTS – Lower Urinary Tract Symptoms), které jsou často velmi obtěžující a mají přímý vliv na každodenní životní aktivitu i celkovou kvalitu života [2]. Navzdory intenzivními výzkumu v posledních pěti dekádách není etiologie zbytnění prostaty u starších mužů spolehlivě objasněna [3]. V minulosti byly příznaky dolních močových cest u mužů vždy přímo, nebo nepřímo spojovány s BHP. Nejnovější poznatky nahradily původní simplistickou představu o tom, že LUTS jsou způsobeny pouhým zvýšením uretrální rezistence na podkladě zvětšení objemu prostaty. Signifikantní část LUTS je spojena s dysfunkcí detruzoru (hyperaktivita, hypoaktivita) a dalšími stavy, jako je noční polyurie, poruchy spánku nebo systémová onemocnění (obr. 1), a tak i pohled na léčbu pacientů (kteří hledají pomoc kvůli LUTS, nikoli BHP) se přeorientoval z léčby specifického onemocnění (BHP) na léčbu řízenou příznaky [4]. V souvislosti s histologickou diagnózou BHP je v klinické praxi používáno několik dalších termínů [5]: BPE (Benign Prostatic Enlargement) – zvětšení objemu prostaty na podkladě BHP, BOO (Bladder Outlet Obstruction) – obstrukce dolních močových cest bez specifikované příčiny a BPO (Benign Prostatic Obstruction) – BOO na podkladě BHP. Vzájemný vztah mezi BHP, LUTS, BPE a BOO znázorňuje obr. 2.
Obr. 1. Patofyziologie BHP – komplexní interakce mezi uretrální obstrukcí, funkcí detruzoru a produkcí moči [3]. ![Patofyziologie BHP – komplexní interakce mezi uretrální obstrukcí, funkcí detruzoru a produkcí moči [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5fe07b840b7ec53ac77ef85d17ca6233.jpeg)
Obr. 2. Vztah mezi histologickou diagnózou hyperplazie prostaty, příznaky dolních močových cest, zvětšením prostaty a obstrukcí dolních močových cest [5]. ![Vztah mezi histologickou diagnózou hyperplazie prostaty, příznaky dolních močových cest, zvětšením prostaty a obstrukcí dolních močových cest [5].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0679557e69d4d2619d41579de9be7680.jpeg)
BHP je progresivní onemocnění – progresi charakterizuje zhoršení nebo změna několika parametrů spojených s LUTS/BHP: pokles maximálního průtoku moči (Qmax), zvětšení postmikčního rezidua, zvětšení objemu prostaty, zhoršení symptomového skóre, výskyt akutní močové retence (AUR), operace v souvislosti s BHP. Za skupinu pacientů se zvýšeným rizikem progrese BHP jsou považováni pacienti se středně závažnými až závažnými LUTS, kteří mají objem prostaty ≥ 30 ml a PSA ≥ 1,5 ng/ml [6].
MEDIKAMENTÓZNÍ LÉČBA BHP
Cílem léčby BHP je zmírnění příznaků dolních močových cest, zmírnění BOO, zlepšení vyprazdňování močového měchýře, zmírnění instability detruzoru a zvrácení renální insuficience na podkladě BHP na jedné straně a prevence progrese onemocnění, která je charakterizovaná zhoršováním příznaků, opakovanými epizodami makroskopické hematurie, infekcemi močových cest, akutní močovou retencí a nutností operace na straně druhé [3]. Na základě Mezinárodního skóre prostatických symptomů (IPSS – The International Prostate Symptom Score) lze LUTS klasifikovat jako mírné (0–7), středně závažné (8–19) a závažné (20–35) [7]. Pacienti s mírnými LUTS, které nejsou obtěžující, jsou vhodní k sledování, farmakoterapie je indikovaná u pacientů s obtěžujícími LUTS bez absolutní indikace k operaci [8].
Skupiny léků používané v léčbě BHP/ /LUTS zahrnují antagonisty α-adrenergních receptorů (alfablokátory), inhibitory 5α-reduktázy, antimuskarinika, rostlinné extrakty (fytopreparáty), analogy vazopresinu a inhibitory fosfodiesterázy 5 [4]. Kromě monoterapie se doporučuje i kombinovaná léčba alfablokátory s inhibitory 5α-reduktázy, alfablokátory s antimuskariniky či alfablokátory s inhibitory fosfodiesterázy 5.
Článek je zaměřený na kombinovanou léčbu alfablokátory a inhibitory 5α-reduktázy (léky nejvíce zkoumané a nejvíce rozšířené).
ANTAGONISTÉ α-ADRENERGNÍCH RECEPTORŮ
Jejich použití v léčbě BHP je založeno na předpokladu spoluúčasti BOO způsobené kontrakcí hladké svaloviny prostaty (zprostředkované α-adrenergními receptory) na klinických projevech BHP. Na kontrakci hladké svaloviny prostaty se podílí predominantně (pokud ne výlučně) α1A-receptory [9]. I když je adrenergní inervace prostaty významná, její přímý vliv na klinický projev BHP nebyl prokázán – alfablokátory mají malý vliv na urodynamicky stanovenou subvezikální obstrukci a pozorované zlepšení LUTS nekoreluje s obstrukcí [10]. Vedlejší účinky alfablokátorů jsou způsobeny přítomností α-adrenergních receptorů v cévách, nonprostatické hladké svalovině a centrálním nervovém systému (hypotenze, astenie, závratě, somnolence, retrográdní ejakulace). V léčbě jsou upřednostňovány selektivní antagonisté α1A-receptorů.
Všechny používané alfablokátory mají srovnatelný efekt. Snižují IPSS o 35–40 % a zlepšují Qmax o 20–25 %. K nastoupení plného účinku je potřeba několika týdnů, k statisticky významnému zlepšení ve srovnání s placebem dochází během několika dnů. Percentuální snížení IPSS je ve skupinách pacientů s mírnými, středně závažnými a závažnými LUTS přibližně stejné, efekt není ovlivněn velikostí prostaty ani věkem pacientů [11]. Alfablokátory nesnižují objem prostaty a z dlouhodobého hlediska nesnižují riziko akutní močové retence. Klinický efekt je pozorován i po více než čtyřech letech léčby.
INHIBITORY 5α-REDUKTÁZY
Účinek androgenů na prostatu je daný působením dihydrotestosteronu (DHT), který vzniká konverzí testosteronu prostřednictvím enzymu 5α-reduktázy (5-AR). Inhibice tohoto enzymu a následné snížení hladin DHT vede k indukci apoptózy epiteliálních buněk prostaty, čímž dochází k redukci velikosti prostaty a snížení PSA [12]. Existují dvě izoformy 5α-reduktázy – typ 1 s predominantní aktivitou v extraprostatických tkáních (kůže, játra) a typ 2 s predominantní expresí a aktivitou v prostatě. Pro klinické využití jsou dostupné dva inhibitory 5α-reduktázy – finasterid (inhibuje pouze 5-AR typ 2) a dutasterid (inhibuje oba typy 5-AR s obdobnou potencí). Koncentraci DHT v prostatě snižují výše uvedené inhibitory 5-AR o 85–90 %, hladina DHT v séru je snížená o 70 % (finasterid), resp. 95 % (dutasterid).
Klinický efekt inhibitorů 5-AR ve srovnání s placebem je pozorován při trvání léčby minimálně 6–12 měsíců, doba do nástupu účinku je tedy delší než u alfablokátorů. Po 2–4 letech léčby snižují LUTS o 15–30 %, zmenšují objem prostaty o 18–28 % a zvyšují Qmax o 1,5–2,0 ml/s [13]. Snižují i riziko akutní močové retence a nutnosti operační léčby z dlouhodobého hlediska (> 1 rok). Efekt je závislý na výchozí velikosti prostaty, rozdíl ve srovnání s placebem nebyl pozorován u pacientů s objemem prostaty < 40 ml [14].
Vedlejší účinky se týkají zejména sexuální funkce – snížení libida, erektilní dysfunkce, poruchy ejakulace (retrográdní ejakulace, snížení objemu ejakulátu). Incidence je nízká a snižuje se při dlouhodobém užívání (viz kombinovaná léčba). Gynekomastie je popisovaná u 1–2 % pacientů.
KOMBINOVANÁ LÉČBA ANTAGONISTY α-ADRENERGNÍCH RECEPTORŮ A INHIBITORY 5α-REDUKTÁZY
První multicentrická randomizovaná dvojitě zaslepená studie srovnávající placebo, finasterid, terazosin a kombinovanou léčbu (finasterid + terazosin) v délce sledování jeden rok byla publikovaná v roce 1996 [15]. Vzhledem k délce studie byl kvůli nedostatečnému efektu finasteridu jediným statisticky významným rozdílem mezi skupinou s kombinovanou léčbou a terazosinem objem prostaty. Studie prokázala vyšší účinnost alfablokátoru než androgenní suprese v léčbě klinické BHP při délce sledování jeden rok. Prakticky stejné výsledky byly dosaženy i další studií s doxazosinem a finasteridem, opět při délce sledování jeden rok [16].
Studie MTOPS [17]
Tato dlouhodobá (medián sledování 4,5 roku) prospektivní randomizovaná multicentrická dvojitě zaslepená, placebem kontrolovaná studie přinesla důležité nové informace o klinickém potenciálu jak monoterapie inhibitory 5-AR, tak kombinované léčby.
Cílem této studie bylo zodpovědět otázku, zda medikamentózní léčba BHP dokáže z dlouhodobého hlediska zabránit klinické progresi onemocnění nebo ji oddálit. Celkově 3 047 mužů ve věku nad 50 let s AUA symptomovým skóre (AUA-SI) 8–30 a maximálním průtokem moči 4–15 ml/s při mikčním objemu alespoň 125 ml, bez omezení velikosti prostaty a s PSA < 10 ng/ml bylo randomizováno do čtyř skupin (placebo, doxazosin 4–8 mg 1× denně, finasterid 5 mg 1× denně, kombinace doxazosin + finasterid).
Riziko celkové klinické progrese – definované jako zvýšení o minimálně čtyři body na stupnici American Urological Association (AUA) symptomového skóre, epizoda akutní močové retence, močová inkontinence, renální insuficience (zvýšení hladin kreatininu o 50 %) nebo rekurentní infekce močových cest (≥ dvě epizody za rok nebo urosepse na podkladě BOO) – bylo signifikantně nižší ve skupině s kombinovanou léčbou než u pacientů s monoterapií nebo placebem. Doxazosin snížil riziko progrese o 39 %, finasterid o 34 %, kombinovaná léčba až o 67 %. Kumulativní incidence celkové klinické progrese v období čtyř let sledování byla ve skupině s placebem 17 %, kombinovaná léčba ji snížila na 5 %. Riziko akutní močové retence a nutnosti chirurgické léčby významně snížila kombinovaná léčba (o 81 a 67 %) a finasterid (o 68 a 64 %), ne však doxazosin, což autoři připisují snížení objemu prostaty ve skupinách pacientů s finasteridem. Doxazosin mírně oddálil akutní močovou retenci a operační léčbu, při dlouhodobém sledování však riziko těchto příhod nesnížil. Studie potvrdila snížení hladin PSA ve skupině pacientů s finasteridem a kombinovanou léčbou v průměru o 50 % a snížení objemu prostaty v těchto skupinách o 19 %, ve skupině s placebem a doxazosinem došlo naopak ke zvětšení objemu prostaty.
Počet pacientů, které je potřeba léčit k zabránění jednomu případu klinické progrese BHP, byl pro kombinovanou léčbu 8,4, monoterapii doxazosinem 13,5 a monoterapii finasteridem 15,0.
Celkový výskyt vedlejších účinků ve skupině s kombinovanou léčbou byl vyšší než u pacientů s monoterapií. Výskyt jednotlivých vedlejších účinků u pacientů s kombinovanou léčbou byl srovnatelný se zjištěným výskytem pro monoterapii oběma léky, s výjimkou vyššího výskytu abnormální ejakulace, periferních edémů a dušnosti (tab. 1).
Tab. 1. Deset nejčastějších vedlejších účinků zaznamenaných ve studii MTOPS. 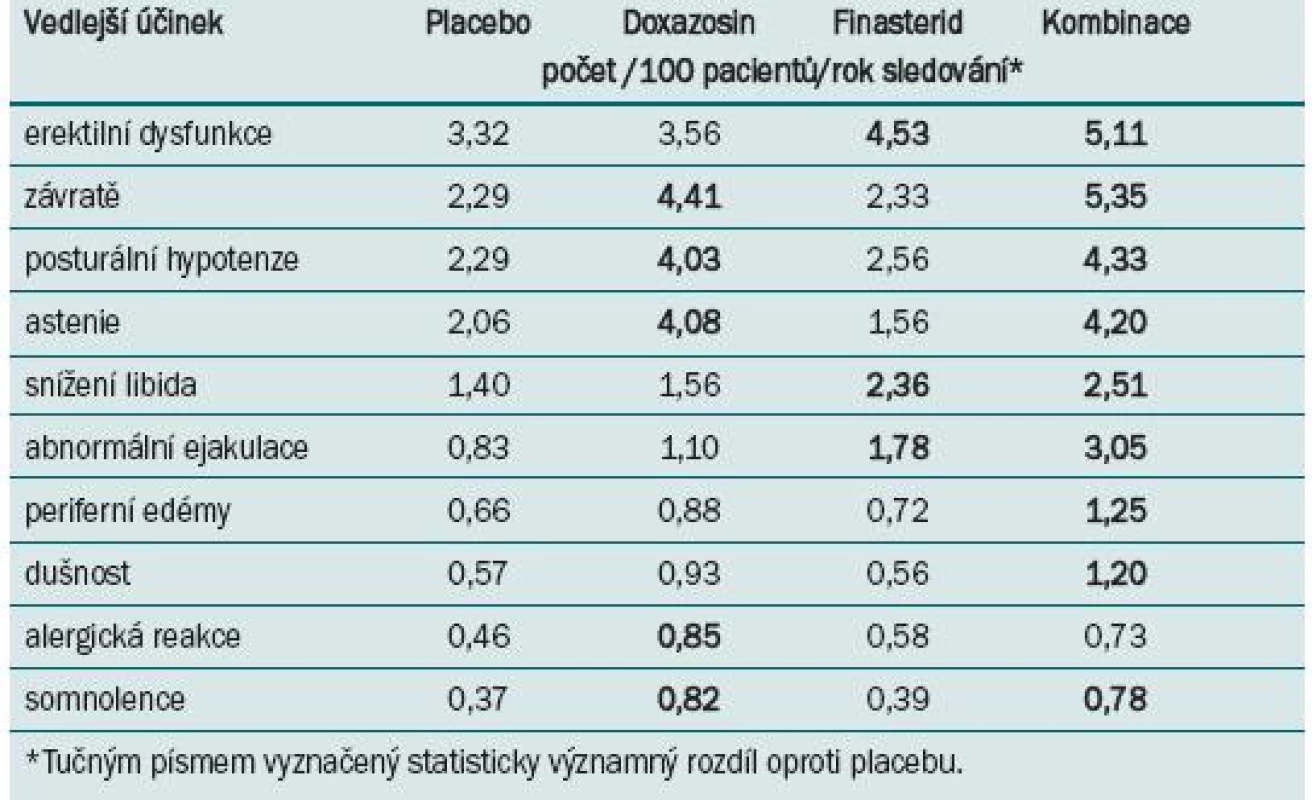
Závěrem autoři konstatují bezpečnost a lepší efekt kombinované léčby na riziko celkové klinické progrese než v případě monoterapie doxazosinem nebo finasteridem. Doporučují kombinovanou léčbu pro pacienty se zvýšeným rizikem progrese LUTS/BHP.
Studie CombAT [18]
Cílem této dlouhodobé multicentrické randomizované, dvojitě zaslepené studie bylo zjistit, zda je kombinovaná léčba dutasteridem 0,5 mg (Avodart®) a tamsulosinem 0,4 mg efektivnější než monoterapie z hlediska redukce rizika akutní močové retence, operace prostaty a klinické progrese v období čtyř let sledování u pacientů se zvýšeným rizikem progrese BHP.
4 844 mužů ve věku > 50 let s klinickou diagnózou BHP, IPSS ≥ 12, objemem prostaty ≥ 30 ml, PSA 1,5–10,0 ng/ml, Qmax 5–15 ml/s při mikčním objemu ≥ 125 ml bylo randomizováno do tří skupin – dutasterid + tamsulosin 1× denně, dutasterid + placebo 1× denně, tamsulosin + placebo 1× denně. Primárním cílem bylo stanovení času do vzniku AUR nebo operační léčby BHP, sekundárními cíly byly klinická progrese (definovaná jako zvýšení IPSS o ≥ 4 body, výskyt AUR, inkontinence moči spojená s BHP, rekurentní infekce močových cest nebo urosepse, renální insuficience na podkladě BHP), zhoršení příznaků, Qmax, změna objemu prostaty, bezpečnost a tolerance léčby.
První výsledky studie CombAT byly prezentovány po dvou letech sledování [19], kdy primárním cílem bylo zhodnocení efektu kombinované léčby na IPSS, Qmax a objem prostaty (tyto charakteristiky jsou zahrnuty v definitivních výsledcích po čtyřech letech jako sekundární cíle studie). Článek prezentuje definitivní výsledky po ukončení studie po čtyřech letech sledování.
Čas do AUR nebo operační léčby BHP byl signifikantně delší ve skupině pacientů s kombinovanou léčbou ve srovnání s tamsulosinem, nikoli však s dutasteridem. Ve srovnáním s tamsulosinem snížila kombinovaná léčba relativní riziko AUR a operace o 65,0 %, ve srovnání s dutasteridem o 19,6 %.
Kombinovaná léčba snížila riziko klinické progrese BHP o 44,0 % ve srovnání s tamsulosinem a o 31,2 % ve srovnání s dutasteridem. Obdobné hodnoty ve prospěch kombinované léčby (41,3 a 35,2 %) byly dosaženy i při redukci relativního rizika zhoršení příznaků o ≥ 4 body dle IPSS. Po čtyřech letech sledování snížila kombinovaná léčba hodnotu IPSS o 6,3, tamsulosin o 3,8 a dutasterid o 5,3 bodu. Výhoda kombinované léčby (ovlivnění symptomů) ve srovnání s léčbou tamsulosinem byla pozorovaná od devátého měsíce léčby a ve srovnání s dutasteridem po třech mesících a trvala po celou dobu studie.
Zvýšení hodnot Qmax po čtyřech letech oproti vstupným hodnotám bylo ve skupině s kombinovanou léčbou 2,4 ml/s, s tamsulosinem 0,7 ml/s a s dutasteridem 2,0 ml/s. Celkový objem prostaty zmenšila kombinovaná léčba o 27,3 % (dutasterid -28 %, tamsulosin +4,6 %), změna objemu tranzitorní zóny byla při kombinované léčbě -17,9 %, ve skupině s tamsulosinem +18,2 %, ve skupině s dutasteridem -26,5 %.
Efekt tamsulosinu na symptomy BHP je při dlouhodobé léčbě (2–4 roky) menší než v případě kombinované léčby nebo léčby dutasteridem, což je vysvětlováno zvětšením objemu prostaty při monoterapii tamsulosinem. Vzhledem k rozdílům mezi kombinovanou léčbou a dutasteridem po čtyřech letech (ve prospěch kombinované léčby) však tamsulosin výrazně přispívá k zlepšení příznaků – dutasterid umožňuje snížením objemu prostaty udržovat maximální možný efekt tamsulosinu.
Výskyt vedlejších účinků byl signifikantně vyšší ve skupině s kombinovanou léčbou, procento pacientů, kteří kvůli vedlejším účinkům přerušili léčbu, byl ve všech třech skupinách podobný (6 % kombinovaná léčba, 4 % tamsulosin, 4 % dutasterid). Syndrom plovoucí duhovky a maligní nádory prsu se nevyskytly v žádné ze sledovaných skupin. Ve skupině pacientů s kombinovanou léčbou byl častější výskyt srdečního selhání (0,9 %; ve skupině s tamsulosinem 0,6 %, ve skupině s dutasteridem 0,2 %).
Z etických důvodů neměla studie CombAT placebo větev (pacienti byli poučeni o tom, že dostávají aktivní léčbu), což mohlo zlepšit interpretaci subjektivních příznaků. Toto omezení se však týká všech tří sledovaných skupin pacientů, a proto dle autorů neovlivňuje klinické výsledky.
Výsledky CombAT studie po čtyřech letech opodstatňují použití dlouhodobé léčby dutasteridem a tamsulosinem u pacientů se středně závažnými a závažnými LUTS na podkladě BHP a se zvýšeným rizikem progrese BHP. Bezpečnost a tolerance léčby odpovídá předchozím zkušenostem s monoterapií dutasteridem a tamsulosinem.
ROZDÍLY MEZI STUDIEMI MTOPS A COMBAT
Dle vstupních kritérií zahrnovala studie CombAT pacienty s IPSS ≥ 12, objemem prostaty ≥ 30 ml a PSA 1,5–10,0 – tedy populaci se zvýšeným rizikem progrese BHP, na rozdíl od studie MTOPS zahrnující pacienty s AUA-SI ≥ 8, bez limitace objemu prostaty a minimální hodnoty PSA. Rozdílně definované primární a sekundární cíle obou studií umožňují ve studii CombAT detailnější zhodnocení vlivu kombinované léčby na jednotlivé parametry klinické progrese BHP. Studie CombAT je první dlouhodobou studií s duálním inhibitorem 5-AR. Limitací je absence placebo větve (na rozdíl od MTOPS studie).
KONZERVATIVNÍ LÉČBA BHP V PRAXI DLE PLATNÝCH DOPORUČENÍ [4,20]
Pacienti s mírnými LUTS (IPSS < 8) nebo LUTS, které nejsou obtěžující (i při IPSS ≥ 8), jsou vhodní ke sledování. Před zahájením farmakoterapie (nebo současně s ním) by měli být pacienti poučeni o změnách životního stylu, které příznivě ovlivňují LUTS.
Antagonisté α-adrenergních receptorů mají rychlý nástup účinku a významně zlepšují příznaky dolních močových cest u pacientů s BHP. Z dlouhodobého hlediska však neovlivňují riziko akutní močové retence a operace prostaty. Tato léčba by měla být nabídnuta všem pacientům s obtěžujícími LUTS.
Inhibitory 5α-reduktázy mají pomalejší nástup účinku, vedou však k redukci objemu prostaty a snižují riziko AUR i nutnosti operace. Léčba je vhodná pro pacienty se středně závažnými nebo závažnými LUTS a zvětšenou prostatou (objem prostaty ≥ 30 ml).
Kombinovaná léčba alfablokátorem a inhibitorem 5-AR umožňuje těžit z benefitů jednotlivých léků a ve srovnání s monoterapií je léčbou efektivnější – jak při ovlivnění příznaků, tak z hlediska snížení rizika progrese. Vzhledem k vyššímu výskytu vedlejších účinků by měla být nabídnuta jako dlouhodobá léčba vybrané skupině pacientů s obtěžujícími LUTS, objemem prostaty ≥ 30 ml a PSA ≥ 1,5 ng/ml.
ZÁVĚR
Ve srovnání s monoterapií alfablokátory nebo inhibitory 5α-reduktázy vede kombinovaná léčba BHP k výraznějšímu zlepšení LUTS, vyššímu Qmax a výraznějšímu snížení rizika progrese onemocnění. Současně je však spojená s vyšším výskytem vedlejších účinků, měla by být proto primárně použita u pacientů se středně závažnými až závažnými LUTS a se zvýšeným rizikem progrese.
Kombinovaná léčba má význam pouze jako léčba dlouhodobá (více než 12 měsíců).
Dostupnost jednoho preparátu obsahujícího dutasterid a tamsulosin (Duodart®) umožňuje zjednodušení léčby jako náhrada současné duální léčby dutasteridem a tamsulosinem.
MUDr. Michal Fedorko, FEBU
Urologická klinika FN Brno
Jihlavská 20, 625 00 Brno
misofed@seznam.cz
Zdroje
1. Berry SJ, Coffey DS, Walsh PC et al. The development of human benign prostatic hyperplasia with age. J Urol 1984; 132(3): 474–479.
2. Welch G, Weinger K, Barry MJ. Quality-of-life impact of lower urinary tract symptom severity: results from the Health Professionals Follow-up study. Urology 2002; 59(2): 245–250.
3. Roehrborn CG et al. Benign Prostatic Hyperplasia: Etiology, Pathophysiology, Epidemiology and Natural History. Campbell-Walsh Urology, 10th edition. Philadelphia: Saunders 2012 : 2570–610.
4. Oelke M, Bachmann A, Descazeaud A et al. Guidelines on the Treatment of Non-neurogenic Male LUTS. EAU Guidelines. Uroweb 2011. Available at: http://www.uroweb.org/gls/pdf/12_Male_LUTS.pdf. Accessed November 27, 2011.
5. Roehrborn CG. Pathology of Benign Prostatic Hyperplasia. Int J Impot Res 2008; 20: S11–18.
6. Emberton M, Andriole GL, de la Rosette J et al. Benign prostatic hyperplasia: a progressive disease of aging men. Urology 2003; 61(2): 267–273.
7. Abrams P, Chapple C, Khoury S et al. Evaluation and treatment of lower urinary tract symptoms in older men. J Urol 2009; 181(4): 1779–1787.
8. Kaplan SA. Update on the American Urological Association guidelines for the treatment of benign prostatic hyperplasia. Rev Urol 2006; 8(4): 10–17.
9. Michel MC, Vrydag W. α1-, α2 - and β-adrenoceptors in the urinary bladder, urethra and prostate. Br J Pharmacol 2006; 147 (Suppl 2): 88–119.
10. Barendrecht MM, Abrams P, Schumacher H et al. Do α1-adrenoceptor antagonists improve lower urinary tract symptoms by reducing bladder outlet resistance? Neurourol Urodyn 2008; 27(3): 226–230.
11. Michel MC, Mehlburger L, Bressel HU et al. Comparison of tamsulosin efficacy in subgroups of patients with lower urinary tract symptoms. Prostate Cancer Prost Dis 1998; 1(6): 332–335.
12. Rittmaster RS, Norman RW, Thomas LN et al. Evidence for atrophy and apoptosis in the prostates of men given finasteride. J Clin Endocrinol Metab 1996; 81(2): 814–819.
13. Naslund MJ, Miner M. A review of the clinical efficacy and safety of 5α-reductase inhibitors for the enlarged prostate. Clin Ther 2007; 29(1): 17–25.
14. Boyle P, Gould AL, Roehrborn CG. Prostate volume predicts outcome of treatment of benign prostatic hyperplasia with finasteride: meta-analysis of randomized clinical trials. Urology 1996; 48(3): 398–405.
15. Lepor H, Williford WO, Barry MJ et al. The efficacy of terazosin, finasteride, or both in benign prostatic hyperplasia. Veterans Affairs Cooperative Studies Benign Prostatic Hyperplasia Study Group. N Engl J Med 1996; 335(8): 533–539.
16. Kirby RS. A randomized, double-blind crossover study of tamsulosin and controlled-release doxazosin in patients with benign prostatic hyperplasia. BJU Int 2003; 91(1): 41–44.
17. McConnell JD, Roehrborn CG, Bautista O et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med 2003; 349(25): 2387–2398.
18. Roehrborn CG, Siami P, Barkin J et al. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombAT study. Eur Urol 2010; 57(1): 123–131.
19. Roehrborn CG, Siami P, Barkin J et al. The effects of dutasteride, tamsulosin and combination therapy on lower urinary tract symptoms in men with benign prostatic hyperplasia and prostatic enlargement: 2-year results from the ComAT study. J Urol 2008; 179(2): 616–621.
20. American Urological Association. Guideline on The Management of Benign Prostatic Hyperplasia (2010). Available at: http://www.auanet.org/content/ clinical-practice-guidelines/clinical-guidelines/main-reports/bph-management/chap_1_GuidelineManagementof%28BPH%29.pdf. Accessed November 30, 2011.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2011 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Nefron šetřící operace bez zasvorkování renálního hilu
- Minimálně invazivní laparoskopická a roboticky asistovaná parciální resekce ledviny: stručná historie a přehled
- Laparoskopická a robotická heminefrektomie a ureteroureterostomie v rámci léčby zdvojeného vývodného systému horních cest močových
- Chirurgická léčba lokálně pokročilého karcinomu ledviny s nádorovým trombem v žilním řečišti T3b, T3c
- Co nabízí dnešní medicína, když selže diagnostika karcinomu ledviny ve stadiu lokalizovaném na orgán?
- Možnosti predikce karcinomu prostaty pomocí PCA3
- Možnosti klinické aplikace kombinované léčby benigní hyperplazie prostaty
- Indikace a výsledky ablace tumoru ledviny
-
EAU Guidelines pro diagnostiku a léčbu uroteliálního karcinomu horních cest močových
aktualizace 2011 - Úvodník
- Diagnostické možnosti časného zjištění nádorů ledvin, role nádorových markerů při stanovení dalšího postupu
- EAU Guidelines pro řešení močové inkontinence
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Možnosti predikce karcinomu prostaty pomocí PCA3
- Diagnostické možnosti časného zjištění nádorů ledvin, role nádorových markerů při stanovení dalšího postupu
- Chirurgická léčba lokálně pokročilého karcinomu ledviny s nádorovým trombem v žilním řečišti T3b, T3c
- Laparoskopická a robotická heminefrektomie a ureteroureterostomie v rámci léčby zdvojeného vývodného systému horních cest močových
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



