-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možnosti predikce karcinomu prostaty pomocí PCA3
PROSTATE CANCER PREDICTION BASED ON PCA3 EVALUATION
New biomarkers of prostate cancer have been identified aiming to reduce the number of unnecessary biopsies as well as to increase the detection rate of prostate cancer. PCA3 as one of them, identified in 1999, is highly over-expressed in prostate cancer tissue. Evaluating PCA3 is supposed to help in guiding clinical decision towards biopsy in case of PSA 2,5–10 ng/ml („gray zone“) and where prostate cancer is suspect despite negative result of inicial biopsy. The article summarizes the current knowledge based on novel clinical trials regarding PCA3-based prostate cancer prediction and provides recommendation for use of PCA3 in common urological practice.
Key words:
prostate cancer, PCA3, PCA3 score, prostate biopsy
Autoři: V. Vyhnánková; M. Fedorko; M. Král; V. Študent; T. Jamaspishvili
Působiště autorů: Urologická klinika FN Brno LF MU Brno
Vyšlo v časopise: Urol List 2011; 9(4): 43-48
Souhrn
S cílem snížení počtu zbytečně prováděných biopsií prostaty a zvýšení míry detekce karcinomu prostaty jsou vyvíjeny nové biomarkery karcinomu prostaty. Jedním z nich je PCA3 (Prostate Cancer Antigen 3) identifikovaný v roce 1999. Tento marker je vysoce exprimován v nádorové prostatické tkáni. Stanovení PCA3 má pomoci při správném výběru pacientů pro biopsii prostaty zejména v případě hodnot PSA 2,5–10 ng/ml (tzv. šedá zóna) a v případě podezření na karcinom prostaty navzdory negativnímu výsledku první biopsie. Článek sumarizuje poznatky z nejnovějších klinických studií ohledně možností predikce karcinomu prostaty na základě PCA3 a na základě těchto poznatků přináší doporučení pro využití PCA3 v běžné urologické praxi.
Klíčová slova:
karcinom prostaty, PCA3, PCA3 skóre, biopsie prostatyKarcinom prostaty (KP) je v současné době nejčastějším solidním nádorem v Evropě (s incidencí vyšší než u karcinomu plic nebo kolorektálního karcinomu) [1] a po karcinomu plic druhou nejčastější příčinou úmrtí na nádorové onemocnění [2]. Představuje nejen závažný medicínský, ale i společenský a ekonomický problém. Celoživotní riziko vzniku karcinomu prostaty je 16 %, riziko úmrtí na karcinom prostaty pouze 2,9 %, tedy u značné části mužů roste KP tak pomalu, že tito muži umírají z jiných příčin předtím, než dojde ke klinickým projevům pokročilého onemocnění [3]. Je tedy na místě hledat účinnou metodu, která by vedla k identifikaci asymptomatických mužů s agresivními lokalizovanými tumory, kteří budou profitovat z aktivní léčby. Populační screening pomocí PSA s cílem detekce KP je kontroverzním tématem [4]. K tomu, abychom zabránili jednomu úmrtí na KP, musí být diagnostikovaných a léčených dalších 48 KP a celkově musí podstoupit screening 1 410 mužů [5,6]. K definitivnímu zhodnocení je nutná delší doba a posouzení jak ekonomické zátěže, tak vedlejších účinků intenzivního screeningu. Vhodnějším přístupem je tedy časná detekce (neboli „oportunistický screening“ – iniciovaný informovaným pacientem, který přichází k lékaři), která je založená na měření sérové hodnoty PSA a palpačním vyšetření prostaty (DRE).
DIAGNOSTIKA KARCINOMU PROSTATY
Hlavní metody pro diagnostiku karcinomu prostaty představují DRE, měření PSA a biopsie prostaty naváděná pomocí transrektálního ultrazvukového vyšetření (TRUS) [4]. Pozitivní prediktivní hodnota (PPV) abnormálního DRE pro detekci karcinomu prostaty je 5–30 %. Samotným DRE je odhaleno pouze 18 % nádorů, většina takto diagnostikovaných karcinomů jsou klinicky nebo patologicky pokročilé nádory. Hlavní význam DRE pro predikci karcinomu prostaty je v kombinaci s měřením PSA [7]. Pro samotné měření PSA je pozitivní prediktivní hodnota obecně pro hodnotu vyšší než 4 ng/ml (tradiční hraniční hodnota) přibližně 30 %, což znamená, že méně než jeden muž ze tří se zvýšenou hladinou PSA bude mít při biopsii pozitivní nález. Při hodnotě 4–10 ng/ml je PPV 25 %, při PSA nad 10 ng/ml se zvyšuje na 42–64 % [8], je tedy výrazně ovlivněna absolutní hodnotou PSA. Hlavním problémem PSA je jeho nedostatečná specificita (zvýšení může být způsobeno dalšími benigními stavy), vysoká míra falešné pozitivity tedy vede k zbytečným biopsiím prostaty. Snižování hladiny PSA jako indikačního kritéria k biopsii prostaty (kromě zvýšení senzitivity na úkor dalšího snížení specificity) vede k ještě vyššímu počtu biopsií a detekci většího množství karcinomů, avšak za cenu detekce vyššího počtu insignifikantních nádorů prostaty (tedy těch, které svého nositele pravděpodobně neohrozí na životě) a s tím spojené nadbytečné diagnostice a léčbě [9]. Kombinací DRE a PSA se zvyšuje celková míra detekce KP z 3,2 a 4,6 % pro jednotlivé testy na 5,8 % [8]. S cílem dosažení vyšší senzitivity a hlavně specificity v diagnostice KP, než je tomu u PSA (či jeho běžně používaných modifikací – f/t PSA, PSAV, PSADT), jsou zkoumány další biomarkery, jedním z nich je PCA3.
PCA3 – ZÁKLADNÍ CHARAKTERISTIKA
Diferential display 3 (DD3) nyní známý jako PCA3 (Prostate Cancer Antigen 3 gene) byl identifikován v roce 1999. Je lokalizován na chromozomu 9q21.1, přičemž jeho produktem není protein, ale nekódující RNA s nejasnou funkcí. V různé míře je exprimován v buňkách normální prostaty, BPH a neoplasticky změněných buňkách, exprese v nádorové tkáni je však 10–100násobně vyšší (medián 66násobně), navíc je omezená pouze na tkáň prostatickou. V jiných tkáních (jak normálních, tak nádorově postižených, včetně močového měchýře, varlat, ledviny, prsu či vaječníku) jsou jeho hodnoty nedetekovatelné [10]. Vzhledem k tomu, že je PCA3 exprimován epiteliálními buňkami prostaty, je jeho stanovení možné v ejakulátu nebo spontánně vymočené moči – jedná se tedy o neinvazivní diagnostickou metodu, výtěžnost je však mnohem vyšší, předchází-li odběru moči masáž prostaty při DRE – bez předchozího DRE jsou validní výsledky získány v 80 %, po DRE až v 98 % [11]. Technika odběru a přepravy vzorků je dobře definovaná [12]. Odebírá se 20–30 ml první vymočené moči po masáži prostaty. Tato moč je přepravována v nádobě obsahující buffer pro stabilizaci mRNA ve vzorku k další analýze (obr. 1). Po třech generacích testů na PCA3 je v současné době používaná metoda firmy Gen-Probe Inc. (komerční název Progensa). Analyzuje celou moč, zatímco předchozí metody analyzovaly pouze močový sediment (což vedlo k menšímu procentu reprezentativních vzorků ve srovnání s celou močí). Standardizaci DRE představují tři tahy prstem po obou lalocích prostaty (nebyl pozorován signifikantní rozdíl ve výtěžnosti při delší masáži prostaty).
Obr. 1. Odběr materiálu pro vyšetření PCA3 [13]. ![Odběr materiálu pro vyšetření PCA3 [13].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ec7a2c9e7954fee2b36e8982095d5911.jpeg)
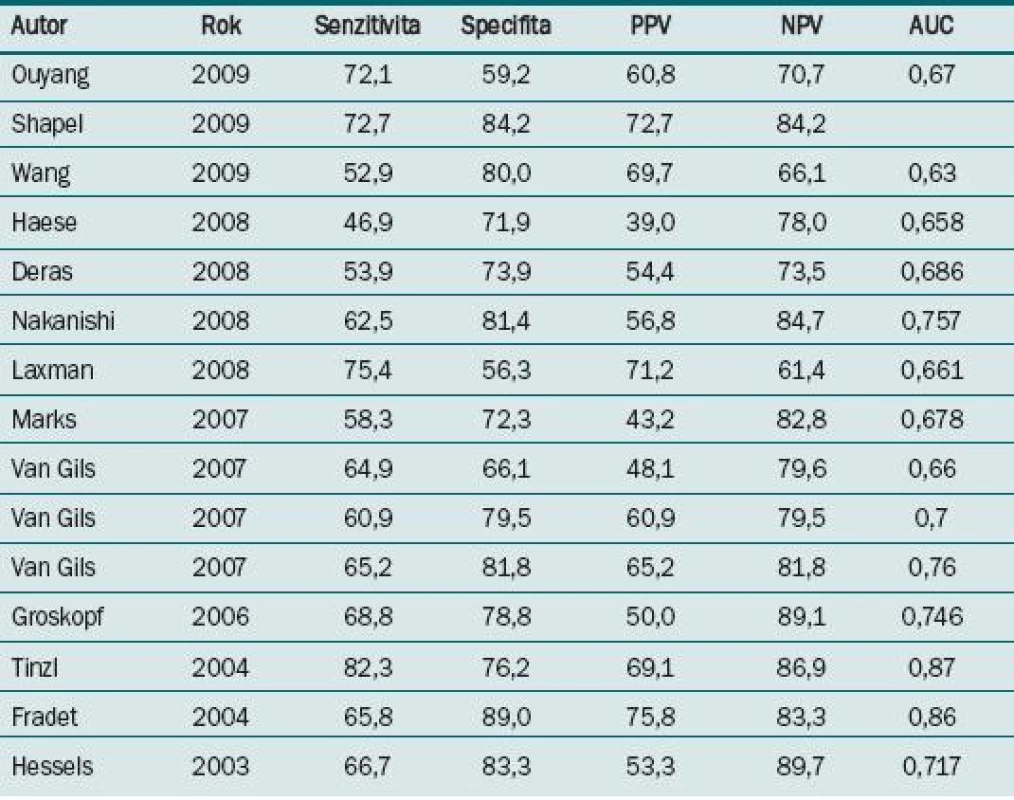
Detekci PCA3 mRNA umožňuje tzv. TMA (Transcription-Mediated Amplification), která nahradila flourescenční polymerázovou řetězovou reakci (PCR), přesněji tzv. FQ-RT-PCR (Real-Time Flourescent Quantitative Reverse Transcription-Polymerase Chain Reaction). Princip spočívá v izolaci specifické RNA, její amplifikaci a následně detekci a kvantifikaci izolované RNA [14]. Současně je stejnou metodou stanovena hladina PSA mRNA (tzv. „housekeeping“ gen) – potvrzuje přítomnost prostatických buněk v sedimentu (a tím reprezentativnost vzorku) a umožňuje tzv. normalizaci PCA3, tedy stanovení míry exprese PCA3 mRNA k celkovému množství prostatické RNA přítomné ve vzorku poměrem PCA3 mRNA / PSA mRNA [15]. Ve vzorku jsou totiž kromě nádorových prostatických buněk i prostatické buňky nenádorové a buňky uroteliální. Hladina PSA mRNA v prostatických buňkách uvolněných do moči je bez jakéhokoli vztahu k sérové hladině PSA a na rozdíl od sérových hladin PSA je exprese PSA mRNA prakticky konstantní bez ohledu na biologický stav prostatických buněk (nádorový, nebo nenádorový), resp. v nádorových buňkách je exprese pouze lehce snížená [16]. Hraniční hodnota testu PCA3 (tzv. cut-off value) může být stanovena buď na základě hodnoty PCA3 skóre, tedy poměru PCA3 mRNA / PSA mRNA násobenému 1 000 – obvykle hodnota 35 na základě původní práce Bussemakersové [10], tedy PCA3 skóre ≥ 35 je považováno za pozitivní, nižší hodnota je považována za negativní nález nebo je pro poměr PCA3 mRNA / PSA mRNA odvozena z křivky ROC (Receiver Operating Characteristic) jako hodnota pro dosažení optimální senzitivity a specificity, udává se jako AUC (Area Under Curve). V tab. 1 jsou uvedeny hodnoty senzitivity a specificity PCA3 při různých použitých hraničních hodnotách PCA3 skóre. Hladina PCA3 nekoreluje se sérovou hladinou PSA ani s objemem prostaty (na rozdíl od PSA) [17].
Tab. 1. Senzitivita a secificita PCA3 dle cut-off hodnoty PCA3 skóre [17]. ![Senzitivita a secificita PCA3 dle cut-off hodnoty PCA3 skóre [17].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8223c7a515e80339033c607a2014c1c9.jpeg)
VÝSLEDKY
Od roku 1999 je k dispozici množství studií, které hodnotí PCA3 jako možný nástroj pro diagnostiku karcinomu prostaty, navíc je k dispozici i několik metaanalýz, které umožňují komplexnější pohled a srovnání. K hodnocení PCA3 jako diagnostického testu slouží obvyklé parametry – senzitivita, specificita, pozitivní prediktivní hodnota, negativní prediktivní hodnota (NPV) a AUC odvozená z křivky ROC, přičemž zlatým standardem pro posuzování těchto parametrů je výsledek biopsie prostaty.
Metaanalýza od španělských autorů [18] srovnává 14 studií splňujících autory stanovená kritéria. Tab. 2 a 3 shrnují základní charakteristiku těchto studií, resp. metodologickou kvalitu, tab. 4 prezentuje výsledky.
Tab. 2. Charakteristiky vybraných studií [18]. ![Charakteristiky vybraných studií [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0e3da00eeb81a47f1874667d89facbc8.jpeg)
Tab. 3. Metodologická kvalita vybraných studií [18]. ![Metodologická kvalita vybraných studií [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/fe69ce0e9a3c08fd3835649bc38f43a7.jpeg)
Dle zkoumaných dat se specificita testu pohybuje mezi 56,3 a 89,0 %, senzitivita testu je o něco nižší, pohybuje se v rozmezí 46,9 a 82,3%. Nejlepších hodnot dosahuje negativní prediktivní hodnota – neklesá pod 60 %, naopak nejhorší výsledky jsou pozorovány u PPV – někde dosahuje pouze asi 40 %. Celková specificita je vyšší než senzitivita (74 vs 63 %). Hodnota AUC u ROC křivky pro uvedené studie je 0,73, což lze považovat za hodnotu přijatelnou.
Vlaeminck-Guillem v jiné metaanalýze jedenácti studií s PCA3 [19] udává obdobné hodnoty senzitivity i specificity. Ve čtyřech studiích bez ohledu na hodnotu PSA byla senzitivita PCA3 54–84 % a specificita 71–80 %. Ve třech studiích s počtem pacientů alespoň 200 po předchozí negativní biopsii prostaty byla senzitivita PCA3 47–58 % a specificita 71–72 %. Vysoká senzitivita (71 %) a specificita (přes 90 %) je udávána u pacientů s nižší hodnotou PSA 2–5 ng/ml [20], tito pacienti by tedy mohli být pouze sledováni a nemusela by se jim provádět opakovaná biopsie prostaty.
Srovnávací studie mezi PCA3 a PSA prokázaly lepší prediktivní hodnotu v případě PCA3. V Marksově studii s 233 muži s předchozí negativní biopsií prostaty a hodnotou PSA trvale nad 2,5 ng/ml byla AUC signifikantně vyšší pro PCA3 (0,678 vs 0,524) [21].
Diagnostickou hodnotu PCA3 testu potvrdila analýza výsledků opakované biopsie prostaty v placebo větvi rozsáhlé studie REDUCE (Reduction by Dutasteride of Prostate Cancer Events) [22]. Jedná se o zatím největší studii s opakovanými biopsiemi prostaty. Při analýze výsledků od 1 072 pacientů byla zjištěna v detekci KP AUC pro PCA3 ve druhém roce 0,693 (vs 0,612 pro PSA), navíc byla prokázána signifikantní hodnota predikce výsledku biopsie ve čtvrtém roce studie na základě PCA3 odebraného v roce 2 (AUC 0,634) a korelace hodnoty PCA3 s Gleasonovým skóre.
Při srovnání PCA3 a f/t PSA u pacientů s předchozí negativní biopsií prostaty a PSA 2,5–10 ng/ml byla prokázána lepší predikce KP u PCA3. Rozdělením pacientů do tří skupin na základě poměru f/t PSA (> 20 %, 10–20 %, < 10 %) byl při použití hraniční hodnoty PCA3 skóre 30 vysoce signifikantní rozdíl v míře detekce KP u prvních dvou skupin (tedy s poměremf/t PSA > 10). Pokud mají tito pacienti nízké hodnoty PCA3, lze je opakované biopsie prostaty ušetřit – při PCA3 skóre < 25 byla rebiopsie pozitivní biopsie pouze u 9 % v této skupině pacientů (NPV 91 %) [23].
Hodnota PCA3 u mužů s high-grade prostatickou intraepiteliální neoplazií (HG-PIN) je signifikantně vyšší než u mužů bez HG-PIN [24]. Ve stejné studii bylo navíc prokázáno, že hodnota PCA3 skóre je vyšší u pacientů v klinickém stadiu T2 a s Gleasonovým skóre ≥ 7.
U pacientů s hormonální nebo radiační léčbou KP je při opakovaném odběru PCA3 potvrzen pokles hodnoty PCA3 mRNA / PSA mRNA [15].
Novější studie zkoumají diagnostickou hodnotu PCA3 v kombinaci s dalšími molekulárními markery stanovenými v moči, jako slibná se jeví kombinace s detekcí TMSPRSS2:ERG fůze [25], kdy schopnost predikce KP je pro tuto kombinaci lepší než v případě jednotlivých parametrů.
DISKUZE
Na základě výsledků výzkumu lze říci, že PCA3 je metodou s přijatelnou diagnostickou hodnotou a může být použita pro časnou diagnostiku KP. Je však nutné vzít v úvahu několik limitujících faktorů.
Poměrně velké rozmezí v hodnotících parametrech PCA3 je dané různorodostí studií a jejich rozdílnou kvalitou. Zlatý standard představuje biopsie prostaty, není však provedena stejnou technikou nebo ve stejném časovém odstupu. Faktory, které snižují interní validitu studií, jsou nedostatečné zaslepení studií, způsob selekce pacientů (různá kritéria pro zařazení do studie), nedostatečné počty pacientů ve studiích, nedostatečně vysvětlení nebo objasnění neúspěchů v průběhu výzkumu. Heterogenita je dána i rozdílnou cut-off hodnotou určující pozitivní, nebo negativní výsledek testu (chybí konsenzus stran nejvhodnější hodnoty) a různými generacemi testu PCA3. Při srovnání PCA3 jako iniciálního screeningového testu s PSA (při následné sextantové biopsii prostaty, pokud hodnota PSA > 3 a hodnota PCA3 skóre > 10) jsou výsledky pouze marginálně lepší v případě PCA3, navíc nebyla detekována větší část nádorů s GS > 6 nebo stadia ≥ T2a, i když se jednalo pouze o 19 pacientů [26]. Navíc všichni pacienti již předtím postoupili tři cykly screeningu a 29 % mělo předchozí negativní biopsii. Pozitivní biopsie prostaty navzdory negativním hodnotám PCA3 jsou argumentem proti využití PCA3 při rozhodování o iniciální biopsii prostaty u pacientů se zvýšenou hodnotou PSA [27]. Není jasné, proč mohou být hladiny PCA3 skóre > 100 navzdory negativní následné biopsii prostaty [28]. Dále není zatím definitivně vyřešena otázka korelace mezi PCA3 na jedné straně a objemem nádoru, klinickým stadiem karcinomu prostaty, Gleasonovým skóre při biopsii prostaty či radikální prostatektomii a patologickým stadiem na druhé straně. Hessels tuto korelaci neprokázal [29], na druhé straně Nakanishi prokázal signifikantní zvyšování PCA3 skóre se zvětšujícím se objemem nádoru a vyšší hodnoty PCA3 skóre u pacientů s high-grade nádory (stanoveno na základě objemu nádoru v biopsii a Gleasonova skóre) [30]. Multicentrická studie Haeseho podporuje korelaci s předpokládanou agresivitou tumoru – ve skupině pacientů s nádory označenými jako indolentní (T1c, PSA denzita < 0,15 ng/ml, GS ≤ 6, ≤ 33 % pozitivních vzorků při biopsii) bylo PCA3 skóre signifikantně nižší [24].
Prakticky všichni autoři se shodují v tom, že je potřeba dalšího výzkumu, možnými cíli by mohlo být definitivní potvrzení korelace mezi hladinami PCA3 a potenciální agresivitou KP či stratifikace pacientů podle objemu nádoru [31]. Potvrzení této korelace by mohlo pomoci ve výběru kandidátů pro aktivní surveillance KP. Dále není vyřešena otázka postavení PCA3 v indikaci první biopsie prostaty, možnost diagnostiky relapsu KP po radikální prostatektomii nebo radioterapii, monitorování pacientů s léky ovlivňujícími sérovou hladinu PSA (inhibitory 5α-reduktázy) [12]. I když je prokázána signifikantní asociace mezi hodnotou PCA3 a rizikem KP, normální hodnota PCA3 v populaci mužů bez KP není stanovena [32].
Nelze opomenout ekonomické srovnání – vyšší cena je limitací vyšetření, v ČR navíc není toto vyšetření zatím hrazeno ze zdravotního pojištění.
ZÁVĚR
Výsledky v predikci pozitivní biopsie prostaty jsou v případě stanovení PCA3 obecně lepší než při použití PSA. Jedná se o slibný biomarker, který není ovlivněn věkem pacienta, objemem prostaty ani hladinou PSA. Jeho vlastnosti odpovídají požadavkům na biomarker použitelný v klinické praxi [14] – jednoduchý odběr biologického materiálu, reprodukovatelná technika s dostupností komerčního setu, dobrá diagnostická hodnota. Vyvodit jednoznačný závěr pro klinické využití PCA3 z dostupných studií je však na základě výše zmíněných limitací složité. Podle některých autorů je stanovení PCA3 dostačujícím vyšetřením pro screening karcinomu prostaty [33]. U mužů, u nichž opakovaná biopsie prokáže pozitivní výsledek, bylo zaznamenáno významně vyšší PCA3 skóre než u mužů s negativním výsledkem opakované biopsie, u těchto mužů je i vyšší výskyt HG-PIN v předchozí biopsii (46 vs 17 %), muži s pozitivním PCA3 a pozitivní biopsií prostaty mají vyšší hodnotu PCA3 skóre než muži s pozitivním PCA3 skóre a negativní biopsií, je tedy možné predikovat na základě pozitivní hodnoty PCA3 karcinom prostaty u mužů s předchozí negativní biopsií prostaty (případně nálezu HG-PIN v biopsii) [34]. Procento pozitivních rebiopsií na základě hodnoty PCA3 se pohybuje v rozmezí 27 a 34 % [24].
V současné době nelze stanovit pouze na základě PCA3 skóre, zda je nezbytné u pacienta provést iniciální biopsii prostaty k vyloučení karcinomu prostaty, nebo nikoli.
Klinické využití PCA3 je možné v několika situacích [16]:
- rozhodnutí o rebiopsii u pacientů s přetrvávajícím podezřením na karcinom prostaty (DRE nebo hodnota PSA) navzdory negativnímu výsledku první biopsie (snížení počtu opakovaných biopsií prostaty u těchto pacientů) a/nebo rodinná anamnéza či jiné faktory indikují zvýšené riziko KP
- posílení indikace (větší ujištění se) k iniciální biopsii prostaty u pacientů s PSA v „šedé zóně“ (2,5–10 ng/ml)
- u pacientů s pozitivní biopsií prostaty může být test nápomocný při volbě léčebného postupu (aktivní léčba vs aktivní surveillance)
Výhodou vyšetření je minimální invazivita (jedná se o první molekulárně diagnostický test na KP v biologických tekutinách), nevýhodou vyšší cena.
Dle platného doporučení EAU pro diagnostiku a léčbu karcinomu prostaty není pro doporučení k používání PCA3 v rutinní praxi zatím dostatek údajů a PCA3 je stále považována za metodu experimentální [4]. Kombinace s dalšími molekulárními markery KP by mohla vést ke zvýšení diagnostické hodnoty testu PCA3.
MUDr. Vlasta Vyhnánková
Urologická klinika FN Brno LF MU Brno
Jihlavská 20, 625 00 Brno
vlasta.vyhnankova@fnbrno.cz
Zdroje
1. Boyle P, Ferlay J. Cancer incidence and mortality in Europe 2004. Ann Oncol 2005; 16(3): 481–488.
2. Jemal A, Siegel R, Ward E et al. Cancer statistics, 2008. CA Cancer J Clin 2008; 58(2): 71–96.
3. Dorr VJ, Williamson SK, Stephens RL. An evaluation of prostate-specific antigen as a screening test for prostate cancer. Arch Intern Med 1993; 153(22): 2529–2537.
4. Heidenreich A, Bellmunt J, Bolla M et al. EAU guidelines on Prostate Cancer. In: EAU Guidelines, edition presented at the 25th EAU Annual Congress, Barcelona 2010.
5. Andriole GL, Crawford ED, Grubb RL 3rd et al. PLCO Project Team. Mortality results from a randomized prostate-cancer screening trial. N Engl J Med 2009; 360(13): 1310–1319.
6. Schröder FH, Hugosson J, Roobol MJ et al. ERSPC Investigators. Screening and prostate-cancer mortality in a randomized European study. N Engl J Med 2009; 360(13): 1320–1328.
7. Loeb S, Catalona WJ. What is the role of digital rectal examination in men undergoing seriál screening of serum PSA levels? Nat Clin Pract Urol 2009; 6(2): 68–69.
8. Catalona WJ, Richie JP, Ahmann FR et al. Comparison of digital rectal examination and serum prostate specific antigen in the early detection of prostate cancer: results of a multicenter clinical trial of 6,630 men. J Urol 1994; 151(5): 1283–1287.
9. Carter HB. Prostate cancers in men with low PSA levels-must we find them? N Engl J Med 2004; 350(22): 2292–2294.
10. Bussemakers MJ, van Bokhoven A, Gerald W et al. DD3: a new prostate-specific gene, highly overexpressed in prostate cancer. Cancer Res 1999; 59(23): 5975–5979.
11. Marks LS, Bostwick DG. Prostate Cancer Specificity of PCA3 Gene Testing: Examples from Clinical Practice. Rev Urol 2008; 10(3): 176–181.
12. Day J, Jost M, Reynolds M et al. PCA3: From basic molecular science to the clinical lab. Cancer Letters 2011; 301(1): 1–6.
13. de la Taille A. Progensa™ PCA3 test for prostate cancer detection. Expert Rev Mol Diag 2007; 7(5): 491–497.
14. Bourdoumis A, Papatsoris A, Chrisofos M et al. The Novel Prostate Cancer Antigen 3 (PCA3) Biomarker. Int Braz J Urol 2010; 36(6): 665–669.
15. Mo S, Wei Ch, Kaiyuan Y et al. The diagnostic value of PCA3 gene-based analysis of urine sediments after digital rectal examination for prostate cancer in a Chinese population. Exp Mol Pat 2011; 90(1): 97–100.
16. Kirby RS, Fitzpatrick JM, Irani J. Prostate cancer diagnosis in the new millennium: strengths and weaknesses of prostate-specific antigen and the discovery and clinical evaluation of prostate cancer gene 3 (PCA3). BJU Int 2009; 103(4): 441–445.
17. Deras IL, Aubin SM, Blase A et al. PCA3: A molecular urine assay for predicting prostate biopsy outcome. J Urol 2008; 179(4): 1587–1592.
18. Ruiz-Aragón J, Márquez-Peláez S. Assessment of the PCA3 test for prostate cancer diagnosis: A systematic review and meta-analysis. Actas Urol Esp 2010; 34(4): 346–355.
19. Vlaeminck-Guillem V, Ruffion A, Andre J et al. Urinary prostate cancer 3 test: toward the age of reason? Urology 2010; 75(2): 447–451.
20. Fradet Y, Saad F, Aprikian A et al. UPM3, a new molecular urine test for the detection of prostate cancer. Urology 2004; 64(2): 311–315.
21. Marks LS, Fradet Y, Deras IL et al. PCA3 molecular urine assay for prostate cancer in men undergoing repeat biopsy. Urology 2007; 69(3): 532–535.
22. Aubin S, Reid J, Sarno M et al. PCA3 molecular urine test for predicting repeat prostate biopsy outcome in populations at risk: Validation in the placebo arm of the dutasteride REDUCE trial. J Urol 2010; 184(5): 1947–1952.
23. Ploussard G, Haese A, van Poppel H et al. The prostate cancer gene 3 (PCA3) urine test in men with previous negative biopsies: does free-to-total prostate-specific antigen ratio influence the performance of the PCA3 score in predicting positive biopsies? BJU Int 2010; 106(8): 1143–1147.
24. Haese A, de la Taille A, van Poppel H et al. Clinical utility of the PCA3 urine assay in European men scheduled for repeat biopsy. Eur Urol 2008; 54(5): 1081–1088.
25. Salami S, Schmidt F, Laxman B et at. Combining urinary detection of TMPRSS2:ERG and PCA3 with serum PSA to predict diagnosis of prostate cancer. Urol Onc 2011 [Epub ahead of print].
26. Roobol MJ, Schroder FH, van Leeuwen P et al. Performance of the prostate cancer antigen 3 (PCA3) gene and prostate-specific antigen in prescreened men: exploring the value of PCA3 for a first-line diagnostic test. Eur Urol 2010; 58(4): 475–480.
27. Shappell SB, Fulmer J, Arguello D et al. PCA3 Urine mRNA Testing for Prostate Carcinoma: Patterns of Use by Community Urologists and Assay Performance in Reference Laboratory Setting. Urology 2009; 73(2): 363–368.
28. Roobol M, Schröder F, van Leenders G et al. Performance of Prostate Cancer Antigen 3 (PCA3) and Prostate-Specific Antigen in Prescreened Men: Reproducibility and Detection Characteristics for Prostate Cancer Patients with High PCA3 Scores (≥ 100). Eur Urol 2010; 58(6): 893–899.
29. Hessels D, van Gils M, Hooij O et al. PredictiveValue of PCA3 in Urinary Sediments in Determining Clinico-Pathological Characteristics of Prostate Cancer. Prostate 2010; 70(1): 10–16.
30. Nakanishi H, Groskopf J, Fritsche HA et al. PCA3 Molecular Urine Assay Correlates With Prostate Cancer Tumor Volume: Implication in Selecting Candidates for Active Surveillance. J Urol 2008; 179(5): 1804–1809.
31. Wang R, Chinnaiyan AM, Dunn RL et al. Rational Approach to Implementation of Prostate Cancer Antigen 3 Into Clinical Care. Cancer 2009; 115(17): 3879–3886.
32. Biganti A. Editorial Comment on: Prostate Cancer Gene 3 (PCA3): Development and Internal Validation of a Novel Biopsy Nomogram. Eur Urol 2009; 56(4): 667.
33. Groskopf J, Aubin S, Deras IL et al. APTIMA PCA3 molecular urine test: development of a method to aid in the diagnosis of prostate cancer. Clin Chem 2006; 52(6): 1089–1095.
34. Remzi M, Haese A, van Poppel H et al. Follow-up of men with an elevated PCA3 score and a negative biopsy: does an elevated PCA3 score indeed predict the presence of prostate cancer? BJU Int 2010; 106(8): 1138–1142.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2011 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Nefron šetřící operace bez zasvorkování renálního hilu
- Minimálně invazivní laparoskopická a roboticky asistovaná parciální resekce ledviny: stručná historie a přehled
- Laparoskopická a robotická heminefrektomie a ureteroureterostomie v rámci léčby zdvojeného vývodného systému horních cest močových
- Chirurgická léčba lokálně pokročilého karcinomu ledviny s nádorovým trombem v žilním řečišti T3b, T3c
- Co nabízí dnešní medicína, když selže diagnostika karcinomu ledviny ve stadiu lokalizovaném na orgán?
- Možnosti predikce karcinomu prostaty pomocí PCA3
- Možnosti klinické aplikace kombinované léčby benigní hyperplazie prostaty
- Indikace a výsledky ablace tumoru ledviny
-
EAU Guidelines pro diagnostiku a léčbu uroteliálního karcinomu horních cest močových
aktualizace 2011 - Úvodník
- Diagnostické možnosti časného zjištění nádorů ledvin, role nádorových markerů při stanovení dalšího postupu
- EAU Guidelines pro řešení močové inkontinence
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Možnosti predikce karcinomu prostaty pomocí PCA3
- Diagnostické možnosti časného zjištění nádorů ledvin, role nádorových markerů při stanovení dalšího postupu
- Chirurgická léčba lokálně pokročilého karcinomu ledviny s nádorovým trombem v žilním řečišti T3b, T3c
- Laparoskopická a robotická heminefrektomie a ureteroureterostomie v rámci léčby zdvojeného vývodného systému horních cest močových
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy