-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Bioekvivalenční studie s novými antihypertenzivy
Autori: T. Doležal; T. Hauser
Pôsobisko autorov: Korporátní oddělení klinických studií a vývoje, Zentiva, a. s. ; Ústav farmakologie 3. LF UK
Vyšlo v časopise: Vnitř Lék 2005; 51(1): 115-118
Kategória: Necenzurované příspěvky
Úvod
Stárnutí populace přináší vyšší konzumaci farmakoterapie v příslušných věkových skupinách, a tím rostou nároky na výdaje ze zdravotního pojištění. Léková politika stojí před úkolem zajistit ověřená a kvalitní léčiva pro co nejširší skupinu indikovaných pacientů a zároveň najít prostředky na nákladné inovativní farmakoterapeutické postupy (např. biotechnologická farmaka). Společně s tímto procesem sledujeme nárůst nákladů na vývoj originálních léčiv a opakované stažení finančně rozhodujících léčivých látek (např. mibefradil, cerivastatin, rofecoxib). Tyto procesy pracují zákonitě proti sobě.
Je nepochybné, že generika přinášejí značné úspory nákladů na léky a ve všech vyspělých zemích roste tlak na rozšíření jejich používání. Na druhou stranu je žádoucí, aby originální výrobce byl po dobu patentové ochrany schopen získat nazpět prostředky na nákladný a riskantní vývoj nových molekul. Jedná se o jakousi rovnováhu, jejíž vychýlení ve prospěch originálních výrobců vede k enormnímu čerpání nákladů na léky a přílišný výkyv na stranu generik může přinést krátkodobé úspory, ale v dlouhodobém horizontu vede k ochuzení palety používaných léčiv.
Po řádném vypršení patentové ochrany přichází generický ekvivalent, který musí přinést jasné snížení ceny, potažmo zvýšení dostupnosti léčby většímu počtu pacientů snížením nákladů na léčbu a též úsporu státních výdajů snížením úhrady ze zdravotního pojištění. Předepisující lékař musí mít jistotu, že dostává do ruky kvalitní produkt, který je plně ekvivalentní s originálním přípravkem.
Princip bioekvivalence
Generické přípravky jsou považovány za přípravky v zásadě podobné, mají-li stejné chemické složení, obsah účinné látky, stejnou lékovou formu a jsou podány stejnou aplikační cestou stejné cílové populaci. V rámci klinického zkoušení je vyžadován jeden typ klinické, tzv. Bioekvivalenční studie, která má za cíl prokázat absenci významného rozdílu v kinetice a množství účinné látky v místě účinku. Místem účinku se v této souvislosti rozumí tzv. Centrální farmakokinetický kompartment, tedy krevní oběh.
Dosažením stejného množství účinné látky v centrálním kompartmentu v daném čase se vytváří podmínky pro ekvivalentní farmakodynamické působení na cílové struktuře (receptor, enzym) v cílové tkáni. Tím, že je prokázána ekvivalence v absorpční fázi, se při stejné chemické struktuře (a tím také zaměnitelných chemicko-fyzikálních vlastnostech) předpokládá stejné chování léčiva při distribuci a eliminaci (graf 1).
Zjednodušeně řečeno, plazmatická koncentrace účinné látky determinuje počet interakcí na cílových receptorech, a tím také farmakodynamický a potažmo terapeutický účinek.
Při splnění výše uvedených podmínek jsou potom generické přípravky používány ve stejných indikacích a se stejnými preskripčními pravidly (souhrn údajů o přípravku – SPC, příbalový leták) jako originální přípravky.
Design bioekvivalenční studie
Bioekvivalenční studie, jako nepřímá metoda sledování expozice, sleduje farmakokinetický profil testovaného (generického) proti referenčnímu (originálnímu) přípravku. Jde v zásadě o měření plazmatické koncentrace v různých časových bodech a konstrukce koncentrační křivky (graf 2).
Testovanou populací jsou zdraví dobrovolníci, jejichž počet je většinou podle očekávané variability mezi 18 a 36. Léčiva jsou aplikována nalačno, bez konkomitantní medikace. Podání společně s potravou je požadováno u lékových forem s řízeným uvolňováním a u léčiv, kde je známo výrazné ovlivnění vstřebávání potravou. Účastníci jsou randomizováni do dvou skupin, které jsou ve druhé fázi studie překříženy (tzv. cross-over design). Tím je eliminována interindividuální variabilita a je možné použít menší počet účastníků studie.
Mezi jednotlivými částmi studie je tzv. wash-out perioda, která je stanovena na 5–10 biologických poločasů testovaného léčiva, aby nedošlo k překrývání účinku (tzv. carry-over effect). Kinetický profil vzniká na základě 10–15 odběrů.
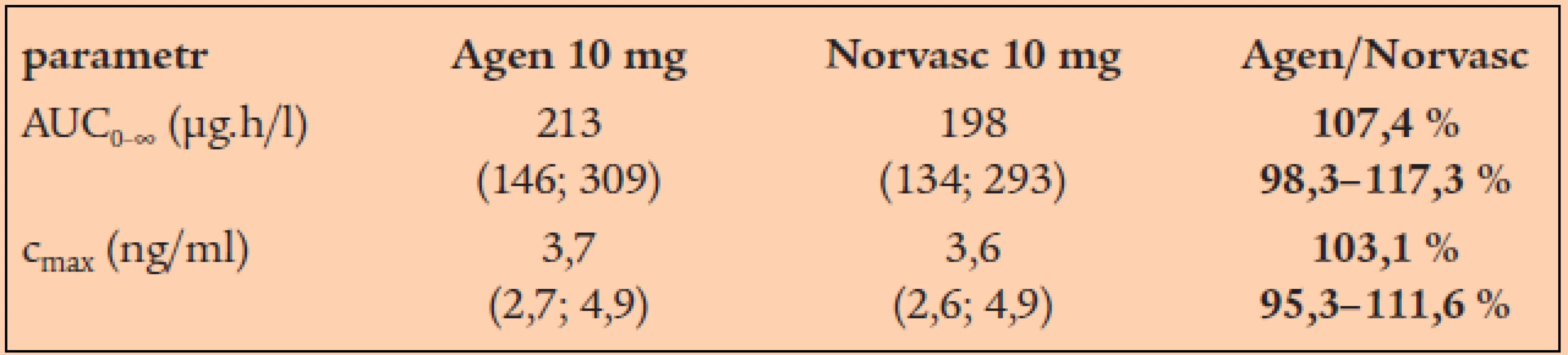
V současnosti jsou za primární farmakokinetické parametry prokazující bioekvivalenci považovány hodnota AUC (tzv. area under the curve; plocha pod křivkou plazmatické koncentrace), protože tento parametr vystihuje celkovou expozici organizmu léčivu. Druhým zásadním parametrem je hodnota cmax, tedy hodnota maximální plazmatické koncentrace, která určuje rychlost vstřebávání v čase. Statistická analýza (dle EU legislativy) musí prokázat, že hodnoty pro generický přípravek se pohybují s 90% spolehlivostí v rozmezí 80–125 % hodnot pro originální přípravek, což jinými slovy znamená, že se oba přípravky s pravděpodobností větší než 95% neliší o více jak 20%.
Příklady
Na příkladech nových antihypertenziv (amlodipin, ramipril, betaxolol), jejichž generické ekvivalenty byly do klinické praxe uvedeny v nedávné době, můžeme demonstrovat uspořádání, parametry a výsledky bioekvivalenčních klinických studií. Všechny uvedené molekuly jsou používány v rychle rozpustných (tedy neretardovaných) lékových formách a mají poměrně široké terapeutické rozmezí, jsou na ně proto aplikována standardní pravidla bioekvivalence.
Amlodipin
Amlodipin je jedním z nejpoužívanějších antihypertenziv vůbec a dnes referenční látkou ze skupiny dihydropyridinových blokátorů kalciového kanálu. Jeho farmakokinetika se vyznačuje pozvolným nástupem antihypertenzního účinku (maximální plazmatická koncentrace cmax nastupuje mezi 6.–9. hodinou) a dlouhým biologickým poločasem (mezi 35 a 50 hodinami). Vstřebávání není ovlivněno příjmem potravy, proto bylo dostatečné provést jednu bioekvivalenční studii nalačno.
Bioekvivalenční studie s generickým amlodipinem 10 mg (Agen firmy Zentiva) byla provedena ve srovnání s originálním produktem Norvasc firmy Pfizer. Studie se účastnilo 26 zdravých dobrovolníků, kteří dostali jednorázovou dávku léčiv nalačno. V následující tabulce je uvedeno srovnání rozhodujících farmakokinetických parametrů pro amlodipin (tab. 1, graf 3).
Graf 3. Průběh plazmatické koncentrace amlodipinu v přípravku Agen (plné body) a Norvasc (prázdné body). 
Ramipril
Ramipril jako zástupce inhibitorů angiotenzin konvertujícího enzymu (ACE) je při prvním průchodu játry konvertován na aktivní metabolit ramiprilat. Maximální plazmatické koncentrace
ramiprilatu, jako hlavního nositele farmakologického účinku, je dosaženo za 2–4 hodiny. Současný příjem potravy neovlivňuje významně vstřebávání ramiprilu. Biologický poločas eliminace ramiprilatu je v rozmezí 9–18 hodin.
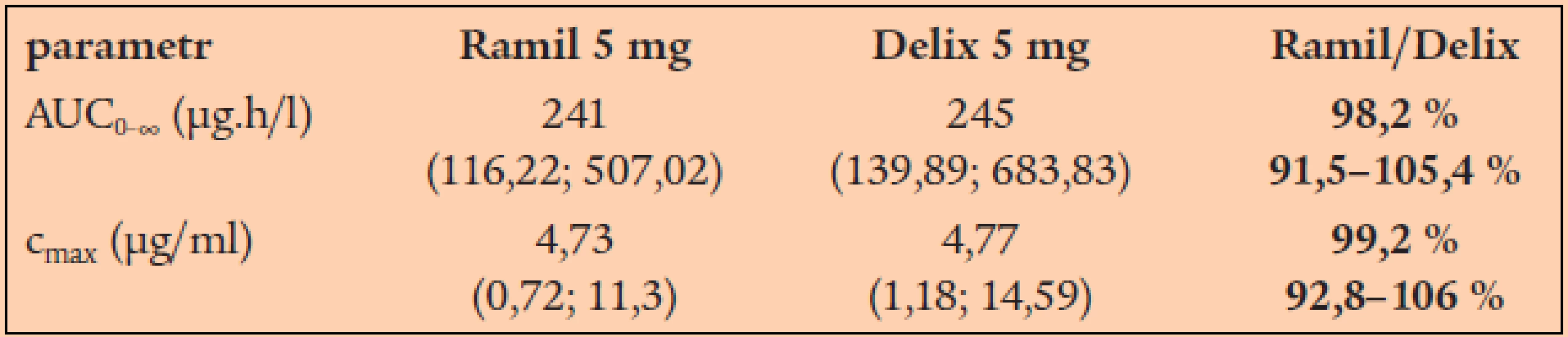
Bioekvivalenční studie s generickým ramiprilem (Ramil firmy Zentiva) byla provedena ve srovnání s originálním produktem Delix firmy Hoechst (v zemích východní Evropy dostupný též pod názvem Tritace). Byly provedeny dvě bioekvivalenční studie pro dávky 2,5 a 5 mg. Studie se účastnilo 36 zdravých dobrovolníků, kteří dostali jednorázovou dávku léčiv nalačno.
V následující tabulce je uvedeno srovnání rozhodujících farmakokinetických parametrů pro ramiprilat (tab. 2, graf 4).
Graf 4. Průběh plazmatické koncentrace ramiprilatu v přípravku Ramil (plné body) a Delix (prázdné body). 
Betaxolol
Betaxolol je velmi rozšířeným kardioselektivním beta-blokátorem. Je velmi dobře vstřebáván, bez vlivu potravy. Maximální plazmatické koncentrace dosahuje za 2–4 hodiny. Betaxolol je pomalu metabolizován, a proto má dlouhý biologický poločas (13–24 hodin).
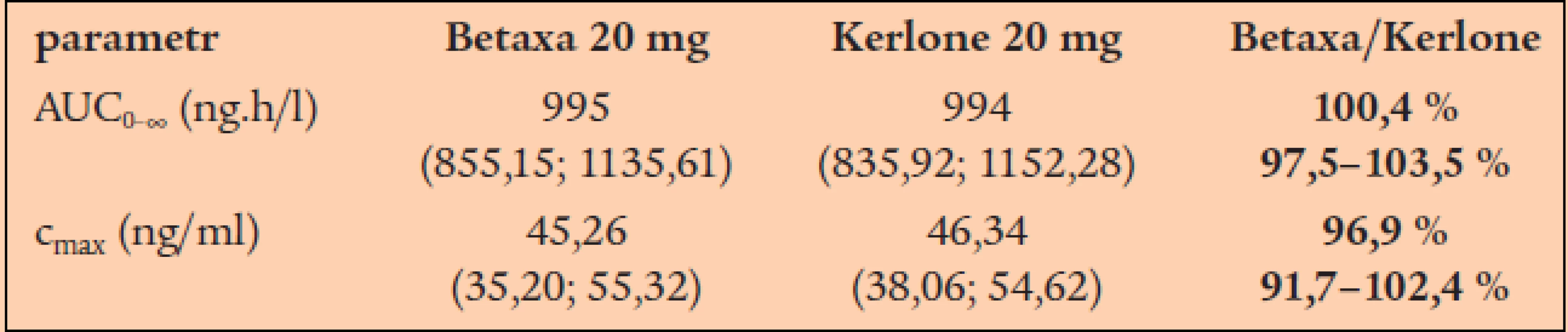
Bioekvivalenční studie s generickým betaxololem 20 mg (Betaxa firmy Zentiva) byla provedena ve srovnání s originálním produktem Kerlone firmy Synthelabo (v zemích východní Evropy dostupný též pod názvem Lokren). Studie se účastnilo 26 zdravých dobrovolníků, kteří dostali jednorázovou dávku léčiv nalačno. V následující tabulce je uvedeno srovnání rozhodujících farmakokinetických parametrů pro betaxolol (tab. 3, graf 5).
Graf 5. Průběh plazmatické koncentrace betaxololu v přípravku Betaxa (plné body) a Kerlone (prázdné body). 
Závěr
Výše uvedené bioekvivalenční studie splňují současné požadavky pro generické přípravky na průkaz zásadní podobnosti, tedy základní farmakokinetické parametry (AUC, cmax) uvnitř intervalu 80–125 % referenčního produktu.
Uvedená pravidla pro testování bioekvivalence jsou pro zjednodušení určená pro perorální rychle rozpustné lékové formy léčiv, která nemají úzkou terapeutickou šíři. V opačném případě je třeba uplatňovat přísnější pravidla testování. Speciální přístup vyžadují perorální lékové formy s řízeným uvolňováním (tzv. retardované přípravky) a non-perorální lékové formy (např. inhalační, transdermální, subkutánní nebo intramuskulární). Zcela novou oblastí jsou tzv. biogenerika, tedy generika biotechnologických produktů (např. inzuliny, interferony, růstové faktory).
Zdroje
1. Shargel L, Yu Andrew. Bioavailability and bioequivalence. In: Applied Biopharmaceutics and Pharmacokinetics. 4th edition. Appleton Lange1999 : 247–279.
2. Schuirmann DJ. A comparison of the two one–sided tests procedure and the power approach for assessing the equivalence of average bioavailability. J Pharmacokinet Biopharm 1987; 15 : 657–680.
3. Westlake WJ. Response to Kirkwood, TBL.: Bioequivalence testing – a need to rethink. Biometrics 1981; 37 : 589–594.
4. U.S. Food and Drug Administration, Center for Drug Evaluation and Research. Guidance for Industry: Bioavailability and Bioequivalence Studies for Orally Administered Drug Products – General Considerations, Office of Training and Communications, Division of Communications Management, Drug Information Branch, HFD–210, Rockville MD 20857, March 2003.
5. Committee for Proprietary Medicinal Products (CPMP), the European Agency for the Evaluation of Medicinal Products (EMEA). Note for Guidance on the Investigation of Bioavailability and Bioequivalence.
2001.
6. Boddy AW, Snikeris FC, Kringle RO, Wei GCG, Oppermann JA, Midha KK. An approach for widening the bioequivalence acceptance limits in the case of highly variable drugs. Pharm. Res. 1995; 12 : 1865–1868.
7. Pharmakl report. A two-way, randomized, single-dose, cross-over, balanced, fasted study of amlodipin 10 tablets in normal male volunteers. Prague: Pharmakl 1999.
8. Cepha report. A single dose, randomized, two period, two-treatment, two sequence, crossover bioequivalence study on ramipril 5 mg tablets versus Delix®
5 mg tablets (Hoechst AG) in healthy volunteers. Pilsen: Cepha 2002.
9. VULM report. Bioequivalence study with two preparations containing betaxolol hydrochlorid Betaxolol-20 SL and Kerlone® 20 mg tbl. (Synthelabo) after single dose to healthy volunteers. Modra: VULM 2002.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek ÚvodníkČlánek Slovo nakladateleČlánek Odkaz sira Williama OsleraČlánek Jan Lebl, Štěpánka Průhová et al. Abeceda diabetu. Příručka pro děti, mladé dospělé a jejich rodičeČlánek MyokarditidyČlánek Metabolický syndrom a sympatický nervový systém: je obstrukční spánková apnoe klíčem k pochopení?Článek Hypertenze a hyperurikemie
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2005 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Slovo nakladatele
- Jaterní postižení při deficitu alfa−1−antitrypsinu
- Akutní myokarditida manifestující se obrazem transmurálního infarktu myokardu provázená akutním renálním selháním
- Význam centralizace péče o nemocné s akutním krvácením do horní části trávicího traktu
- Za profesorem MUDr. Stanislavem Havelkou
- Otevřený dopis Jiřímu Vorlíčkovi
- Bioekvivalenční studie s novými antihypertenzivy
- Komentář k Doporučení American Heart Association/American College of Cardiology Foundation pro léčbu warfarinem
- Odkaz sira Williama Oslera
- Jan Lebl, Štěpánka Průhová et al. Abeceda diabetu. Příručka pro děti, mladé dospělé a jejich rodiče
- Jiří Vítovec, Jindřich Špinar et al. Farmakoterapie kardiovaskulárních onemocnění
- Petr Cetkovský et al. Intenzivní péče v hematologii
- Individuální výběr nemocných pro silový trénink po akutním infarktu myokardu se sníženou ejekční frakcí levé komory
- Viktor Chrobok, Jaromír Astl, Pavel Komínek et al. Tracheostomie a koniotomie, techniky, komplikace a ošetřovatelská péče
- Anna Jedličková. Antimikrobiální terapie v každodenní praxi
- David Cibula, Luboslav Stárka, Jana Vrbíková et al. Syndrom polycystických ovarií
- Tomáš Skalický, Vladislav Třeška, Jiří Šanjdauf et al. Chirurgie jater
- Zpráva o kurzu Hot topics in internal medicine, Alicante, Španělsko, 16.–22. 10. 2004
- Myokarditidy
- Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné?
- Efekt a tolerancia kombinovanej liečby fludarabinom s cyklofosfamidom u chorých s chronickou lymfocytovou leukémiou
- Naše zkušenosti s novou organizací péče o nemocné s akutním krvácením do horní části trávicího traktu
- Silový trénink u nemocných po akutním infarktu myokardu se sníženou ejekční frakcí levé komory srdeční
- Úvod do problematiky metabolického syndromu
- Metabolický syndrom a sympatický nervový systém: je obstrukční spánková apnoe klíčem k pochopení?
- Diabetes mellitus a metabolický syndrom
- Hypertenze jako součást metabolického syndromu
- Úvodník
- Obezita a metabolický syndrom
- Dyslipidemie u metabolického syndromu
- Hypertenze a hyperurikemie
- Role pohybové léčby a tělesné zdatnosti v prevenci a léčbě metabolického syndromu
- Akutní infarkt myokardu u pacienta s anamnézou infekční endokarditidy
- Extramedulární plazmocytom štítné žlázy - vzácná příčina solitární uzlové strumy s hypertyreózou
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Jaterní postižení při deficitu alfa−1−antitrypsinu
- Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné?
- Hypertenze a hyperurikemie
- Myokarditidy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy