-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Klidový energetický výdej při hemodialýze
Resting energy expenditure during hemodialysis
Very few studies have so far reported about resting energy expenditure (REE) in chronic renal failure and there is no information available on REE during hemodialysis (HD). Hypothetically, we can expect an increase in REE during HD procedure (due to the inflammatory response to extracorporeal blood circuit). However, such increase in REE could be modified by thermal balance of the procedure. In our study, REE was measured by indirect calorimetry (Deltatrac Datex) in a group of 13 HD patients (7 males and 6 females, mean age 59.8 ± 13.5 years). In each patient, REE was assessed during two HD sessions: one isothermic and one thermoneutral. All other HD parameters were kept constant. The control group consisted of 14 healthy subjects (4 males and 10 females, mean age 41.3 ± 20.5 years) with normal renal function. There was a significant difference in thermal balance between the two HD settings: –199 kJ/HD in isothermic and –4kJ/HD in thermoneutral HD sessions (p < 0.01). Measured REE values obtained in HD patients before HD session (7 316 ± 919 kJ/day/1.73 m2) did not differ significantly from those of the healthy controls (7 264 ± 1 016 kJ/day/1.73 m2). Similarly, there was no significant difference in calculated EE values (Harris - Benedict equation). In the 10th minute of the HD session, there was a slight, transitory decrease in REE (mean decrease by 3.2 % during isothermic and by 2.8 % during thermoneutral HD session, ns). In the 70th minute, REE returned to pre-dialysis values. After a light meal in the 110th minute REE increased by 8 % during isothermic and by 6.3 % during thermoneutral HD session. At the end of the HD session (i.e. in the 215th minute) REE again returned to pre-dialysis values. Intra-dialysis changes in REE were similar in both isothermic and thermoneutral HD sessions. The results of our study did not confirm the expected influence of HD procedure on REE in the two different thermal HD settings. We conclude that there is no significant difference between REE in HD patients and healthy controls and that REE values are not significantly influenced by hemodialysis procedure.
Key words:
resting energy expenditure – chronic renal failure – hemodialysis – indirect calorimetry – energy balance
Autoři: M. Fořtová 1; S. Dusilová Sulková 1,2; J. Horáček 3; F. Lopot 1; T. Zima 4; J. Bláha 1; V. Bednářová 1; V. Polakovič 1
Působiště autorů: Interní oddělení Strahov 1. lékařské fakulty UK a VFN, Praha, přednosta prim. MUDr. Vladimír Polakovič, MBA 1; I. interní klinika 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, přednosta prof. MUDr. Jiří Horák, CSc. 2; II. interní klinika Lékařské fakulty UK a FN, Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc. 3; Ústav klinické biochemie a laboratorní diagnostiky 1. lékařské fakulty UK a VFN, Praha, přednosta prof. MUDr. Tomáš Zima, DrSc., MBA 4
Vyšlo v časopise: Vnitř Lék 2006; 52(1): 26-33
Kategorie: Původní práce
Souhrn
Klidový energetický výdej (resting energy expenditure - REE) při selhání ledvin sledují jen ojedinělé studie. V dostupné literatuře jsme nalezli pouze jednu studii, která se zabývala průběhem hodnot REE při hemodialýze (HD). Hypoteticky lze očekávat zvýšení REE během HD (vliv zánětlivé odpovědi na mimotělní oběh), které by však mohlo být modifikováno tepelnou bilancí procedury. REE bylo měřeno metodou nepřímé kalorimetrie (Deltatrac Datex) u 13 HD pacientů (7 M, 6 Ž, věk 59,8 ± 13,5 let), a to opakovaně v průběhu izotermické (ΔT = 0) a termoneutrální (ΔE = 0) HD. Všechny ostatní parametry sledovaných 2 HD téhož pacienta byly shodné. Kontrolní soubor tvořili 4 muži a 10 žen (věk 41,3 ± 20,5 let) bez renálního poškození. Tepelná bilance byla při sledovaných tepelných režimech statisticky významně odlišná: -199 kJ/HD (ΔT = 0) oproti -4 kJ/HD (ΔE = 0; p < 0,001). Změřené hodnoty REE u HD pacientů (7316 ± 919 kJ/den/1,73 m2 před HD) byly srovnatelné s kontrolami (7264 ± 1016 kJ/den/1,73 m2), stejně jako vypočítané hodnoty základního energetického výdeje (rovnice podle Harrise a Benedicta). V 10. minutě HD hodnoty REE mírně a přechodně klesly (v průměru o 3,2 % při izotermické a o 2,8 % při termoneutrální HD, ns). V 70. minutě HD se opět významně nelišily od výchozích. Po „lehkém“ jídle ve 110. minutě byly vyšší o 8,0 % při izotermické (p = 0,06) a o 6,3 % při termoneutrální HD (ns), na konci HD (v 215. minutě) se vrátily k predialyzačním. Vývoj hodnot REE během HD byl analogický při obou tepelných režimech. Výsledky nepotvrdily vliv HD procedury ve sledovaných tepelných režimech na REE. Uzavíráme, že REE HD pacientů se signifikantně neliší od kontrol a není významně ovlivněn hemodialýzou.
Klíčová slova:
klidový energetický výdej - chronické selhání ledvin - hemodialýza - nepřímá kalorimetrie - energetická bilanceÚvod
Na celkovém energetickém výdeji se podílejí tři základní složky: klidový energetický výdej (resting energy expenditure - REE), postprandiální energetický výdej a energetický výdej spojený s pohybovou aktivitou. Energetický výdej závisí na věku (klesá s věkem) a pohlaví (je větší u mužů než u žen).
Klidový energetický výdej se podílí na celkovém denním energetickém výdeji 55 - 70 %. Je významně ovlivňován genetickými a neurohumorálními faktory. Měření REE je pro praktické účely vhodnější a snadněji realizovatelné než měření tzv. základního energetického výdeje. Základní energetický výdej odpovídá hodnotám naměřeným po 14 hodinách hladovění za podmínek naprostého tělesného klidu, duševní relaxace a v termoneutrálním prostředí. Oproti tomu REE měříme po podstatně kratší době lačnění (např. za 2 - 3 hod po posledním jídle) a po 30 min v klidu na lůžku. Hodnota REE je přibližně o 10 % vyšší než základní energetický výdej [1], výše rozdílu může být jiná v závislosti na podmínkách měření.
Energetický příjem by měl odpovídat energetickému výdeji. Stanovením REE můžeme tedy určit optimální potřebu energie pro nemocného. Při znalosti energetického výdeje ve vztahu k reálnému energetickému příjmu můžeme posuzovat riziko rozvoje malnutrice.
U pacientů s chronickou renální insuficiencí (CHRI) často zjišťujeme chronickou kalorickou malnutrici, která často vyústí v úbytek tělesné hmotnosti a v celkové neprospívání organizmu. Mohla by být způsobena nízkým energetickým příjmem, zvýšeným energetickým výdejem nebo kombinací obou těchto faktorů [2].
Nízký energetický příjem by mohl být u pacientů s CHRI adaptivní odpovědí na redukované energetické potřeby, ale též důsledkem příliš striktních dietních doporučení a/nebo anorexie, která je u selhání ledvin častá. Spotřeba kyslíku ledvinami u zdravých osob odpovídá přibližně 7 % z celkového bazálního metabolického obratu a zánik funkčního ledvinného parenchymu tuto potřebu redukuje. Náhrada parenchymu normálních ledvin fibrotickou tkání s podstatně menší metabolickou aktivitou u chronické renální nedostatečnosti by mohla být důvodem redukce energetické potřeby [3,4,5].
U pacientů s poškozením funkce ledvin se setkáváme s různými endokrinologickými a metabolickými odchylkami. Chronické selhání ledvin vede k inzulinové rezistenci, k rezistenci k růstovému hormonu, zvýšené hladině glukagonu a často i parathormonu, metabolické acidóze, akumulaci toxických „uremických“ metabolitů a k dalším změnám. Tyto okolnosti mohou narušit metabolizmus sacharidů a proteinů, vést k glukózové intoleranci a zvýšenému odbourávání proteinů. Odpovědí by pak mohlo být zvýšení klidového energetického výdeje u pacientů s poškozením funkce ledvin. Ke zvýšení by mohla hypoteticky přispět také zánětlivá odpověď, indukovaná vlastní hemodialyzační procedurou a uremickým stavem [5,6].
Cílem této studie bylo porovnat hodnoty REE hemodialyzovaných pacientů a zdravých osob bez poškození funkce ledvin, sledovat kontinuálně REE během hemodialýzy a porovnat hodnoty REE během 2 odlišných tepelných režimů hemodialýzy.
Soubor pacientů a metodika
Do prospektivní studie bylo zařazeno 13 hemodialyzovaných (HD) pacientů (7 mužů a 6 žen), průměrná délka dialyzačního léčení 3,4 ± 2,2 let, průměrný věk 59,8 ± 13,5 let. Kontrolní soubor osob bez onemocnění ledvin tvořili 4 muži a 10 žen průměrného věku 41,3 ± 20,5 let.
Hemodialyzované pacienty jsme sledovali při 2 odlišných tepelných dialyzačních režimech, a to při izotermické (tzv. studené) a při termoneutrální (tzv. teplé) hemodialýze. Izotermickou HD jsme definovali jako T = 0, kdy se tělesná teplota během hemodialýzy nemění, tj. vytvořené teplo nad předchozí klidovou produkci během hemodialýzy je odváděno z organizmu (energetická bilance procedury je negativní), a termoneutrální HD jako E = 0, tj. bez energetické ztráty v mimotělním oběhu, ovšem se vzestupem tělesné teploty [7].
Ostatní parametry obou sledovaných hemodialýz téhož pacienta byly stejné: „low flux“ polysulfonový dialyzátor F6, dialyzační roztok o následujícím složení: c(Na+) 140 mmol/l, c(K+) 3 mmol/l, c(Ca2+) 1,75 mmol/l a c(HCO3-) 32 mmol/l (bez obsahu glukózy), délka HD 4 hodiny, konstantní rychlost a velikost ultrafiltrace. Zvolené tepelné režimy byly zajištěny modulem BTM (Blood Temperature Monitor, Fresenius, Bad Homburg SRN) v aktivním zapojení.
Klidový energetický výdej jsme měřili nepřímou kalorimetrií (přístroj Deltatrac Datex). Během obou hemodialyzačních procedur (izotermické a termoneutrální) jsme REE měřili vždy v pěti časových úsecích: před HD, v 10. minutě HD, v 70. minutě HD, ve 110. minutě HD (měření po „lehkém jídle“ = 2 rohlíky a neslazený čaj) a v 215. minutě HD (před ukončením HD). U každého HD pacienta byla tedy hodnota REE stanovena celkem 10krát.
Měření trvalo vždy 10 minut čistého času (celkem 3 + 10 minut, první 3 minuty před vlastním měřením sloužily k adaptaci pacienta na přístroj a do výsledků nebyly zahrnuty). Ze změřených hodnot VO2 (spotřeba O2) a VCO2 (výdej CO2) byla velikost REE spočítána přístrojem v každé minutě a na závěr byla spočítána průměrná hodnota 10 minut, tj. „změřená hodnota REE“.
V souvislosti s vyšetřením neměli pacienti ani osoby z kontrolního souboru žádná speciální dietní omezení, měření bylo zahájeno s odstupem asi 3 hodin od posledního jídla a po 30 min v klidu na lůžku. Měření probíhalo v tichém, klidném prostředí, při teplotě místnosti mezi 24 a 25 °C, v poloze vleže, bez fyzického pohybu vyšetřované osoby.
Změřené hodnoty REE jsme porovnávali s hodnotami základního energetického výdeje vypočtenými z Harris-Benedictovy rovnice [8]:
ženy: REE = 655,0955 + 9,4634 (W) + 1,8496 (H) - 4,6756 (A),
muži: REE = 66,473 + 13,751 (W) + 5,0033 (H) - 6,7550 (A),
W = tělesná hmotnost v kg, H = výška v cm, A = věk v rocích.
Kromě REE a parametrů charakterizujících tepelné dialyzační režimy (tj. energetické bilance ΔE a změny tělesné teploty ΔT) jsme u HD pacientů před a při HD průběžně měřili krevní tlak (TK), tepovou frekvenci (TF), dechovou frekvenci (DF) a relativní změnu intravaskulárního objemu (ΔBV) [9].
Relativní změna intravaskulárního objemu byla vyhodnocována kontinuálně při HD přístrojem Critline (On-Line Diagnostic, Riverdale, USA) a průběh změn byl využit k posouzení optimální ultrafiltrace při HD.
Současně byly stanoveny vybrané metabolické a zánětlivé parametry (albumin, prealbumin, volný tyroxin, CRP), sérová koncentrace urey a její změny při HD, sérový kreatinin a koncentrace hemoglobinu krvi. Z hodnot tělesné hmotnosti a výšky jsme počítali „body mass index“ (BMI) a tělesný povrch („body surface area“, BSA).
Krev pro laboratorní analýzu byla odebírána ze zavedené dialyzační jehly vždy bezprostředně před hemodialýzou, dále z arteriálního dialyzačního setu v 70. minutě hemodialýzy a po ukončení hemodialýzy. Po odběru byla přibližně 30 minut uchovávána na tajícím ledu a poté odstředěna v chlazené centrifuze při -4 °C. Krevní sérum bylo až do analýzy uchováváno při -20 °C, analýza byla provedena do 1 měsíce po odběru.
Koncentrace urey, kreatininu a albuminu byly stanoveny rutinními metodami (automatický analyzátor Kodak Ektachem 700XR), koncentrace hemoglobinu přístrojem Critline. Koncentrace prealbuminu a CRP byly stanoveny imunoturbidimetricky (diagnostické soupravy: Tina-quant®-Prealbumin, Roche a C-Reactive Protein, K-Assay), koncentrace volného tyroxinu chemiluminiscenčně (ADVIA: Centaur FT4, Bayer).
Pro jednotlivé soubory dat byly vypočteny aritmetické průměry a výběrové směrodatné odchylky SD. Významnost rozdílů mezi soubory byla stanovena nepárovým t-testem (srovnávání pacientů a kontrol) nebo párovým t-testem (srovnávání dvou odlišných tepelných dialyzačních režimů). Významnost vzájemných vztahů mezi jednotlivými parametry byla posuzována korelační analýzou pomocí lineárních korelačních koeficientů „r“. Za hladinu statistické významnosti byla považována hodnota p < 0,05.
Výsledky
I. Porovnání REE: HD pacienti vs zdravé osoby
Hodnoty REE u HD pacientů při prvním měření před hemodialýzou byly 7 207 ± 983 kJ/den/1,73 m2, při druhém predialyzačním měření 7425 ± 876 kJ/den/1,73 m2 (ns). Intraindividuální rozdíl představoval 3 %, a proto pro srovnání se zdravými osobami byl použit průměr obou predialyzačních měření (7316 ± 919 kJ/den/1,73 m2).
Změřené hodnoty REE u HD pacientů byly srovnatelné s kontrolami, stejně jako hodnoty základního energetického výdeje vypočítané z Harris-Benedictovy rovnice (graf 1).
Graf 1. Základní energetický výdej (ZEV) vypočtený podle Harris-Benedictovy rovnice a klidový energetický výdej (REE) změřený nepřímou kalorimetrií u hemodialyzovaných pacientů a u zdravých kontrol. 
Procentuální navýšení změřených hodnot REE vůči vypočteným hodnotám základního energetického výdeje z Harris-Benedictovy rovnice u HD pacientů představovalo 23,2 ± 15,1 %, u zdravých osob 18,3 ± 8,5 %. Procentuální změna byla mezi soubory srovnatelná (p = 0,2; ns).
Hodnoty REE významně negativně korelovaly s věkem u HD pacientů (r = -0,52, p < 0,05) i u zdravých kontrol (r = -0,74, p < 0,01). Významné pozitivní korelační vztahy byly nalezeny v obou souborech mezi REE a BSA (HD pacienti: r = 0,80; p < 0,001; kontroly: r = 0,93; p < 0,001) a mezi REE a BMI (HD pacienti: r = 0,54; p < 0,05; kontroly: r = 0,69; p < 0,01).
U hemodialyzovaných pacientů změřené hodnoty REE před dialýzou (resp. procentuální navýšení vůči hodnotám vypočteným z Harris-Benedictovy rovnice) významně korelovaly s tělesnou teplotou (T) a s tepovou frekvencí (TF) (grafy 2 a 3), u zdravých osob nebyla T ani TF zjišťována.
Graf 2. Korelační vztah tělesné teploty před hemodialýzou a odchylky klidového energetického výdeje (REE) od Harris-Benedictovy rovnice před hemodialýzou, odchylka REE od H–B rovnice = procentuální navýšení REE vůči základnímu energetickému výdeji (z H–B rovnice), n = 26 (hodnoty před izotermickou a termoneutrální hemodialýzou). 
Graf 3. Korelační vztah tepové frekvence před hemodialýzou a odchylky klidového energetického výdeje (REE) od Harris-Benedictovy rovnice před hemodialýzou, odchylka REE od H–B rovnice = procentuální navýšení REE vůči základnímu energetickému výdeji (z H–B rovnice), n = 26 (hodnoty před izotermickou a termoneutrální hemodialýzou). 
II. Průběh hodnot REE při HD a porovnání obou dialyzačních režimů
Odezva organizmu na hemodialýzu byla následující: energetická bilance mimotělního oběhu izotermické HD byla výrazně záporná (v průměru téměř -200 kJ/HD), přitom však se hodnoty jednotlivých pacientů výrazně lišily (rozptyl -445 až +69,4 kJ/HD, medián -218 kJ/HD). Při termoneutrální HD byla v průměru jen mírně nižší než 0 kJ/HD, neboli neutrální (hodnoty byly poměrně vyrovnané, rozptyl -18,6 až +0,41) (graf 4).
Graf 4. Energetická bilance mimotělního oběhu v průběhu izotermické a termoneutrální hemodialýzy. 
Tělesná teplota po izotermické HD stoupla o 0,2 °C (p < 0,001), po termoneutrální o 0,5 °C (p < 0,001). Rozdíl mezi sledovanými tepelnými režimy HD byl statisticky významný (p < 0,001).
Ani systolický, ani diastolický krevní tlak se během hemodialýzy v odezvě na ultrafiltraci při obou sledovaných tepelných režimech statisticky významně neměnil. Oproti tomu tepová frekvence se během obou hemodialyzačních procedur statisticky významně zvýšila, a to o 5,2 tepů/min při izotermické HD (p < 0,05) a o 9,4 tepů při termoneutrální HD (p < 0,01). Rozdíl nárůstu tepové frekvence mezi sledovanými tepelnými režimy nebyl statisticky významný (p = 0,15, ns) (tab. 1). Dechová frekvence nebyla při izotermické a termoneutrální HD odlišná.
Tab. 1. Změna krevního tlaku (TK), tepové frekvence (TF) při izotermické a termoneutrální hemodialýze. 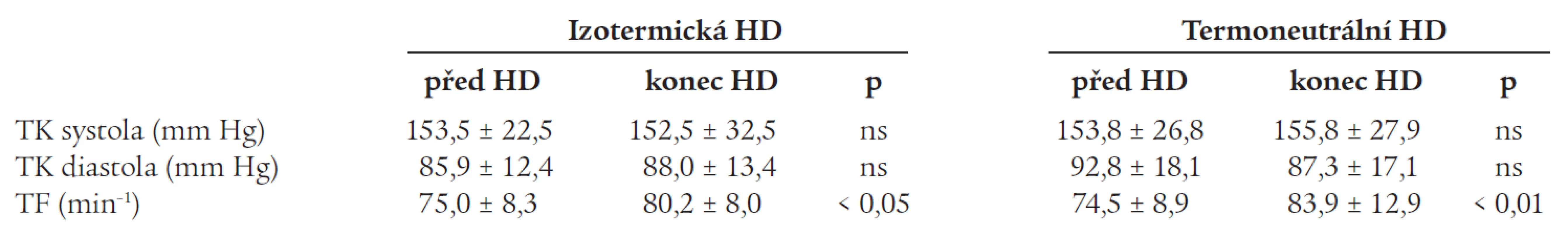
Hodnoty REE se během HD měnily jen nesignifikantně a jejich průběh byl analogický při obou tepelných režimech. V 10. minutě HD hodnoty REE mírně a přechodně poklesly (v průměru o 3,2 % při izotermické a o 2,8 % při termoneutrální HD, ns), v 70. minutě se opět významně nelišily od výchozích, po „lehkém” jídle ve 110. minutě byly vyšší o 8,0 % při izotermické (p = 0,06) a o 6,3 % při termoneutrální HD (ns), na konci HD (v 215. minutě) se vrátily k predialyzačním (graf 5).
Graf 5. Průběh hodnot klidového energetického výdeje (REE) při izotermické a termoneutrální hemodialýze. 
Změna tělesné teploty nebyla ve vztahu ke změně REE, avšak změna tepové frekvence významně korelovala se změnou REE, a to při obou tepelných režimech (izotermická HD: r = 0,58; p < 0,05; termoneutrální HD: r = 0,67; p < 0,01, „změna“ sledovaného parametru je definována jako hodnota na konci HD mínus hodnota predialyzační).
III. Ostatní výsledky
Výsledky biochemických parametrů a vypočtené hodnoty BMI a BSA u HD pacientů i u kontrolního souboru jsou uvedeny v tab. 2 a 3. Pokles koncentrace močoviny během HD (URR, „urea reduction ratio“) byl v obou režimech shodný a vyhovoval požadavkům na adekvátní hemodialýzu. Sérové koncentrace prealbuminu, CRP a volného tyroxinu byly v referenčním rozmezí, albumin měli všichni s výjimkou jedné pacientky v referenčním rozmezí. Hodnoty Hb ukazovaly odpovídající korekci anémie rekombinantním erytropoetinem.
Tab. 2. Sérové koncentrace sledovaných parametrů. 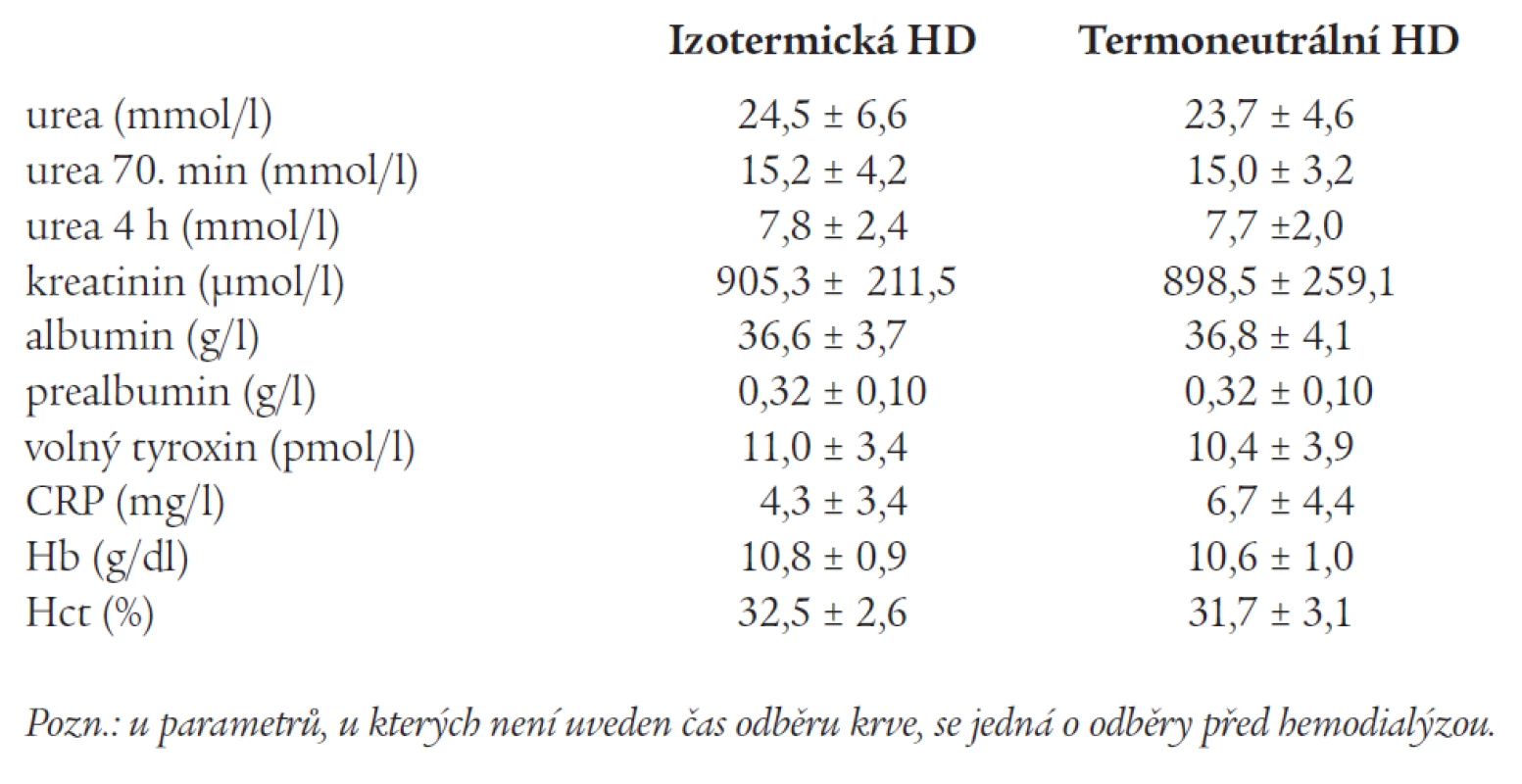
Tab. 3. BMI a BSA u HD pacientů a u kontrolního souboru. 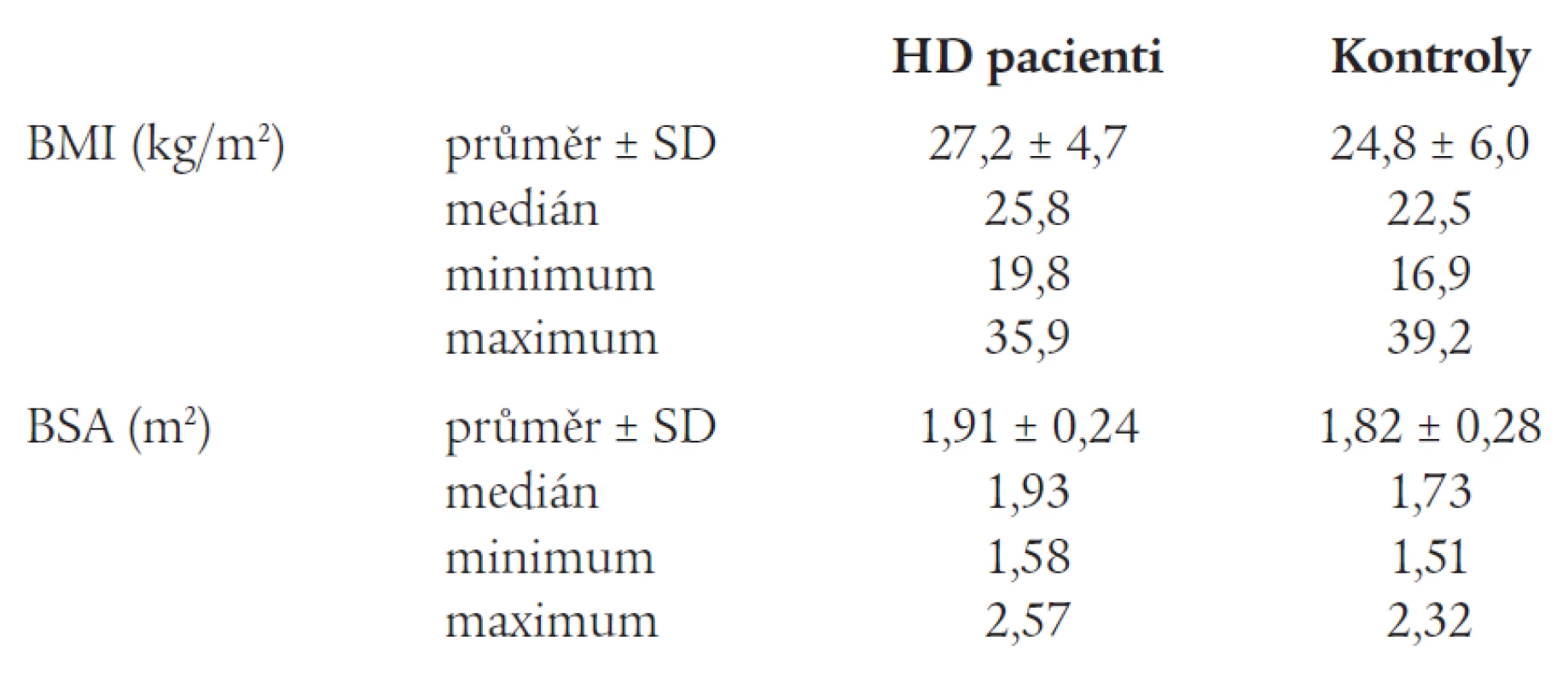
Diskuse
V naší studii jsme sledovali klidový energetický výdej hemodialyzovaných osob před HD i v jejím průběhu a zjistili jsme, že hodnoty REE se neliší od osob bez postižení funkce ledvin a že je zachována souvislost s věkem, BSA i BMI. Jsou tyto naše nálezy očekávané?
Hypoteticky bychom mohli očekávat při selhání ledvin snížení REE, a to z důvodu fibrosklerotických změn ledvinného parenchymu, které redukují energetickou spotřebu touto tkání. Toto zjištění jsme však v dostupné literatuře nenašli.
Naopak, Monteon (již v roce 1986), Schneeweis (v roce 1990) a později též Avesani (v roce 2001) došli k obdobnému závěru jako my (hodnoty REE HD pacientů se významně nelišily od kontrol) a uzavírají, že renální selhání nemá vliv na REE a neprospívání těchto pacientů tedy není dle jejich nálezů důsledkem hypermetabolizmu (to by hodnoty REE byly vyšší než u kontrol), ale spíše sníženého energetického příjmu [2,5,10].
Pokud při selhání ledvin není hodnota REE nižší ve srovnání s kontrolami, lze usuzovat, že metabolická aktivita organizmu se bude s progresí onemocnění ledvin zvyšovat. Sami jsme porovnávali pouze zdravé osoby s hemodialyzovanými pacienty, ale zvýšení hodnot REE s klesající činností ledvin jsme nalezli např. v práci Kuhlmanna z roku 2001 [4].
Pouze práce Ikizlera (1996) popisuje významně vyšší REE u hemodialyzovaných pacientů než u zdravých kontrol, a to jak hodnoty REE měřeného v průběhu HD procedury, tak i v „nedialyzační“ dny [11].
Hodnoty energetického výdeje vypočítané dle Harris-Benedictovy rovnice se významně liší od hodnot změřených, a to jak u HD pacientů, tak i u osob bez renálního poškození. Tyto významně vyšší hodnoty změřeného energetického výdeje jsou v souladu s definovanými podmínkami našeho měření (Harris-Benedictova rovnice slouží k výpočtu základního energetického výdeje - ZEV, v naší studii jsme stanovovali energetický výdej klidový). U kontrol jsme změřili REE o 18,3 % vyšší než ZEV u HD pacientů o 23,2 %. Tento 5% rozdíl mezi soubory není statisticky významný.
Hemodialyzovaní pacienti sledovaného souboru nebyli malnutriční (albumin, prealbumin v referenčním rozmezí) a nejevili ani klinické ani laboratorní známky zánětu.
Obě patogenetické dráhy (chybění metabolického podílu ledvin vs relativní hypermetabolizmus „zdravých ledvinných buněk“ a faktory akcelerující metabolizmus při selhání ledvin) působí protichůdně a mohou se ve svém důsledku v podstatě „vyrušit“. Při detailní analýze nalezl například Avesani (roku 2004) zvýšení REE jen u těch pacientů se selháním ledvin, kteří měli současně zvýšenou hodnotu CRP [12].
Protože naši pacienti nejevili známky malnutrice, ani zánětu, ani poruchy funkce štítné žlázy a měli dobře kompenzovanou anémii, lze považovat výsledek „normálních“ hodnot REE za očekávaný a současně lze konstatovat, že faktory, které ovlivňují chování REE u hemodialyzovaných pacientů, nejsou dány samotným selháním ledvin.
Neshledali jsme statisticky významné změny REE v průběhu HD procedury. To znamená, že dialyzační procedura sama o sobě neovlivnila rychlost metabolizmu posuzovanou podle REE.
V souvislosti s důsledkem HD na organizmus se zvažují důsledky bionekompatibility dialyzačních systémů - opakovaná subklinická stimulace zánětlivých dějů [3]. Hypoteticky bychom tedy mohli očekávat zvýšení REE, zejména v první hodině HD.
Měření REE v průběhu HD prováděly jen ojedinělé studie - a skutečně bylo nalezeno zvýšení zejména v prvních dvou hodinách HD [11].
Avšak na rozdíl oproti naší studii pacienti ve studii Ikizlera měli 1 hodinu před HD lehké jídlo (tj. pravděpodobně zastižen postprandiální vzestup REE), bylo jiné složení dialyzačního roztoku - obsahoval glukózu, c(HCO3-) 39 mmol/l, nebyla uvedena teplota dialyzačního roztoku ani hodnoty CRP.
Náš nález nezměněného REE během HD ukazuje, že bionekompatibilita (námi použitých) dialyzačních systémů není natolik výrazná či významná, aby se projevila klinicky hypermetabolizmem.
REE jsme měřili při různých tepelných režimech - při izotermické a při termoneutrální hemodialýze. Izotermická hemodialýza je spojována s vyšší hemodynamickou stabilitou v důsledku periferní vazokonstrikce, a tak podstatně redukuje intradialyzační hypotenzní příhody.
Obecně organizmus reaguje na pokles tělesné teploty prostým snížením REE, nebo však i jeho zvýšením, pokud se aktivita sympatiku regulačně zvýší natolik, že REE stoupá. Při zvýšení tělesné teploty lze očekávat, že se REE zvýší.
Rozdíl v přírůstku teplot mezi dvěma tepelnými režimy v naší studii byl malý, resp. nebyl natolik výrazný (izotermická HD: vzestup o 0,2 °C , termoneutrální HD: vzestup o 0,5 °C), aby vyvolal hemodynamickou odezvu organizmu a zvýšení REE. V daných podmínkách se průběh REE tedy nelišil. Možným vysvětlením je i poměrně nevelký rozdíl mezi odezvou obou procedur - energetická bilance byla sice mezi sledovanými tepelnými režimy významně rozdílná, ale zřejmě ne natolik, aby byla manifestní (tomu odpovídá i to, že se shodně chovaly hodnoty TK). Termoneutrální a izotermická hemodialýza v daném souboru pacientů tedy nejevily rozdíly v rychlosti metabolizmu.
Pro posouzení významnosti dopadu odlišných tepelných režimů hemodialýzy na hodnoty REE bude třeba dalších sledování. Izotermickou (studenou) a termoneutrání (teplou) hemodialýzu lze definovat různými způsoby. Většího rozdílu v hodnotách tělesné teploty na konci HD mezi tepelnými režimy lze docílit např. tzv. pasivním zapojením modulu BTM, kdy je teplota dialyzačního roztoku v průběhu celé HD procedury konstantní, předem definovaná a významně odlišná, např. 35 °C při izotermické a 37 °C při termoneutrální hemodialýze.
Studie, které sledují REE u pacientů se selháním ledvin (dialyzovaných i dosud nedialyzovaných) nejsou četné. Pro srovnání dosud publikovaných výsledků a snadnější orientaci v problematice jsme sestavili tabulku (tab. 4). Z celkem 14 prací bylo REE zvýšeno oproti kontrolám pouze v 1 studii, ve 2 studiích autoři shledali významný negativní korelační vztah mezi REE a funkcí ledvin vyjádřenou jako clearance kreatininu, 6 studií (včetně naší) neshledalo u pacientů s poškozením funkce ledvin statisticky významný rozdíl v hodnotách REE oproti kontrolnímu souboru, snížení hodnot REE jsme v dostupné literatuře nenašli. Zbývající studie sledovaly vliv dalších faktorů (DM, CRP, sepse atd) na REE. Z tabulky je patrné, že studie jsou velmi obtížně srovnatelné. Citovaní autoři sice ve většině případů měřili REE rovněž nepřímou kalorimetrií, avšak kalorimetrický přístroj shodný s námi byl použit pouze ve 3 studiích, jejichž protokol byl však od naší studie odlišný (autoři nesrovnávali hemodialyzované pacienty s kontrolním souborem osob bez poškození funkce ledvin).
Tab. 4. Přehled výsledků dosud publikovaných studií, jež sledují REE u pacientů se selháním ledvin. 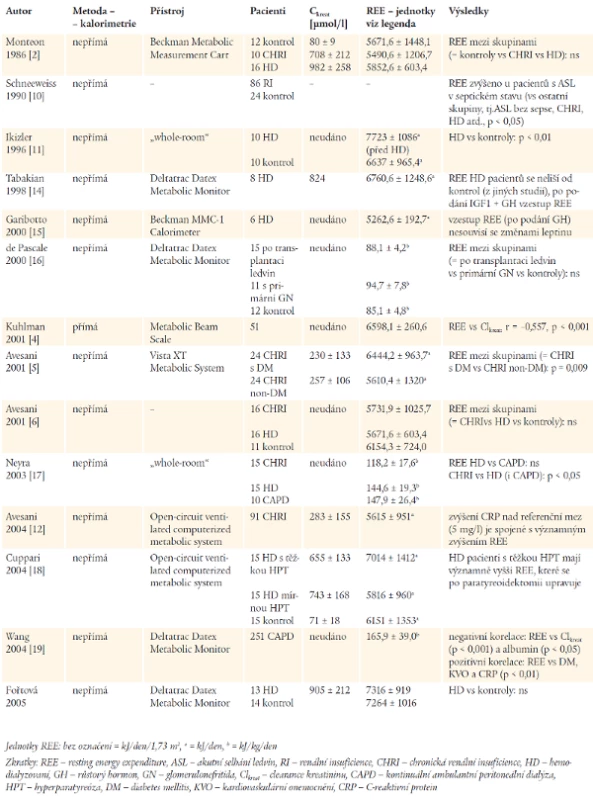
Závěr
Naše výsledky lze shrnout takto: klidový energetický výdej hemodialyzovaných pacientů bez známek malnutrice a zánětu se neliší od zdravých kontrol a není ovlivněn hemodialyzační procedurou.
Ing. Magdaléna Fořtová
www.vfn.cz
e-mail: MagdalenaFortova@seznam.cz
Doručeno do redakce: 21. 6. 2005
Přijato po recenzi: 6. 10. 2005
Zdroje
1. Klener P et al. Vnitřní lékařství. 2. ed. Praha: Galén 2001.
2. Monteon FJ, Laidlaw SA, Shaib JK et al. Energy expenditure in patients with chronic renal failure. Kidney Int 1986; 30 : 741-747.
3. Sulková S et al. Hemodialýza. Praha: Maxdorf Jessenius 2000.
4. Kuhlmann U, Schwickardi M, Trebst R et al. Resting metabolic rate in chronic renal failure. J Ren Nutr 2001; 11 : 202-206.
5. Avesani CM, Santos NSJ, Draibe SA et al. Resting energy expenditure (REE) of stable chronic renal failure patients with no signs of inflammation. J Am Soc Nephrol 2001; 12 : 2364-2370.
6. Avesani CM, Cuppari L, Silva AC et al. Resting energy expenditure in pre-dialysis diabetic patients. Nephrol Dial Transplant 2001; 16 : 556-560.
7. Sulková S, Lopot F, Ságová M et al. Klinický význam individualizace teplotní bilance během hemodialýzy. Aktuality v nefrologii 2001; 7 : 19-29.
8. Braunwald E, Fauci AS, Kasper DL et al. Harrison´s principles of internal medicine. 15. ed. McGraw-Hill 2001.
9. Lopot F, Nejedlý B, Sulková S. Continuous blood volume monitoring and ultrafiltration kontrol. Hemodial Int 2000; 4 : 8-14.
10. Schneeweiss B, Graninger W, Stockenhuber F et al. Energy metabolism in acute and chronic renal failure. Am J Clin Nutr 1990; 52 : 596-601.
11. Ikizler TA, Wingard RL, Sun M et al. Increased energy expenditure in hemodialysis patients. J Am Soc Nephrol 1996; 7 : 2646-2653.
12. Avesani CM, Draibe SA, Kamimura MA et al. Resting energy expenditure of chronic kidney disease patients: Influence of renal function and subclinical inflammation. J Am Kidney Dis 2004; 44 : 1008-1016.
13. Dickerson RN, Gervasio JM, Riley ML et al. Accuracy of predictive methods to estimate resting energy expenditure of thermally-injured patients. J Parenter Enteral Nutr 2002; 26 : 17-21.
14. Tabakian A, Juillard L, Laville M et al. Effects of recombinant growth factors on energy expenditure in maintenance hemodialysis patients. Miner Electrolyte Metab 1998; 24 : 273-278.
15. Garibotto G, Barreca A, Sofia A et al. Effects of growth hormone on leptin metabolism and energy expenditure in hemodialysis patients with protein-calorie malnutrition. J Am Soc Nephrol 2000; 11 : 2106-2113.
16. de Pascale E, Giordano M, Carone M et al. Impaired glucose oxidation and glucose-induced thermogenesis in renal transplant recipients. Nephrol Dial Transplant 2000; 15 : 1658-1662.
17. Neyra R, Chen KY, Sun M et al. Increased resting energy expenditure in patients with end-stage renal disease. J Parenter Enteral Nutr 2003; 27 : 36-42.
18. Cuppari L, de Carvalho AB, Avesani CM et al. Increased resting energy expenditure in hemodialysis patients with severe hyperparathyroidism. J Am Soc Nephrol 2004; 15 : 2933-2939.
19. Wang AYM, Sea MMM, Tang N et al. Resting energy expenditure and subsequent Mortality risk in peritoneal dialysis patients. J Am Soc Nephrol 2004; 15 : 3134-3143.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2006 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Polymorfizmus genu pro endotelin u pacientů se srdečním selháním
- Diastolická dysfunkce levé komory u populace vyššího věku
- Volumy štítné žlázy u dospělé populace
- Antikoagulační léčba u antifosfolipidového syndromu
- Vliv cílené intervence na výskyt rizikových faktorů kardiovaskulárních onemocnění u zdravotnických zaměstnanců
- Klidový energetický výdej při hemodialýze
- Má polymorfizmus G8002A v genu pro endotelin význam pro další rizika u pacientů se srdečním selháním?
- Je zvýšený enddiastolický tlak v levé komoře u populace staršího věku patologický?
- Intervalový a kontinuální trénink v kardiovaskulární rehabilitaci
- Úvodník
- Lokální cévní komplikace u pacientů s akutním infarktem myokardu řešeným direktní perkutánní koronární intervencí
- Volumy štítné žlázy u dospělé populace ve věku 18 - 65 let v České republice - stanovení norem
- AIP - Aterogenní index plazmy jako významný prediktor kardiovaskulárního rizika: od výzkumu do praxe
- Vliv cílené intervence na výskyt rizikových faktorů KV onemocnění – editorial
- Nefluoroskopické mapovacie techniky v súčasnej katétrovej ablačnej liečbe dysrytmií
- Studie FIELD přednesena a uveřejněna. Nepřesvědčivé výsledky fenofibrátu u diabetiků.
-
Diagnostika a léčba jaterní encefalopatie
Doporučený postup vypracovaný skupinou pro portální hypertenzi při České hepatologické společnosti České lékařské společnosti J. E. Purkyně a schválený výborem České hepatologické společnosti České lékařské společnosti J. E. Purkyně - „Nejasná“ příčina vzniku a recidivy venózního tromboembolizmu
- Antifosfolipidový syndrom - popisy dvou případů
- Prof. MUDr. Josef Marek, DrSc. sedmdesátníkem
- Špička I et al. Mnohočetný myelom a další monoklonální gamapatie. Praha: Galén 2005. 128 stran. ISBN 80-7262-330-3
- Samuel Vokurka et al. Ošetřovatelské problémy a základy hemoterapie. Praha: Galén 2005. 140 stran. ISBN 80-7262-299-4.
- Stárka L, Zamrazil V et al. Základy klinické endokrinologie. 2. rozšířené vydání. Praha: Maxdorf 2005. 378 stran. ISBN 80-7345-066-6.
- Václav Špičák, Petr Panzner et al. Alergologie. Praha, Galén a Karolinum 2004. 348 stran. ISBN 80-7262-265-X (Galén), 80-246-0846-4 (Karolinum).
- Marek J et al. Farmakoterapie vnitřních nemocí. 3.(zcela přepracované a doplněné) vydání. Praha: Grada 2005. 773 stran. ISBN 80-247-0839-6.
- Widimský Jiří, Malý Jaroslav et al. Akutní plicní embolie a žilní trombóza. 2. rozšířené a přepracované vydání. Praha: TRITON 2005. Počet stran 381. ISBN 80-7254-639-2.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- AIP - Aterogenní index plazmy jako významný prediktor kardiovaskulárního rizika: od výzkumu do praxe
- Volumy štítné žlázy u dospělé populace ve věku 18 - 65 let v České republice - stanovení norem
-
Diagnostika a léčba jaterní encefalopatie
Doporučený postup vypracovaný skupinou pro portální hypertenzi při České hepatologické společnosti České lékařské společnosti J. E. Purkyně a schválený výborem České hepatologické společnosti České lékařské společnosti J. E. Purkyně - Diastolická dysfunkce levé komory u populace vyššího věku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



