-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nefluoroskopické mapovacie techniky v súčasnej katétrovej ablačnej liečbe dysrytmií
Non fluoroscopic map techniques in contemporary catheter ablation therapy of dysrhythmias
Rapid development and clinical introduction of 3D techniques of intracardial mapping significantly extended the possibilities of catheter ablation therapy of dysrhythmias. Contemporary imaging techniques allow precise determination of the source and the way of propagation of dysrhythmia in myocardium, which is an evitable condition of a successful ablation therapy. Although the fluoroscopic image during electrophysiologic examination allows continuous check of the position of catheters in the heart, due to its low resolution it remains just rough estimation of their real position. The objective of the authors of this lucid work was to give a brief characteristic of the basic principles of the activity of 3D mapping systems used nowadays and to approximate their significance and advantages for ablation therapy of individual dysrhythmias in clinical practice.
Key words:
ventricular and atrial dysrhythmias – non fluoroscopic 3D mapping techniques – radio-frequency catheter ablation
Autoři: P. Olexa; B. Stančák
Působiště autorů: Arytmologické oddelenie Východoslovenského ústavu srdcových a cievnych chorôb, Košice, Slovenská republika, prednosta prim. MUDr. Branislav Stančák, CSc.
Vyšlo v časopise: Vnitř Lék 2006; 52(1): 72-79
Kategorie: Přehledný referát
Souhrn
Rýchly vývoj a klinické zavedenie trojrozmerných techník intrakardiálneho mapovania výrazne rozšírili možnosti katetrizačnej ablačnej liečby dysrytmií. Moderné zobrazovacie techniky umožňujú presné určenie miesta vzniku a spôsobu šírenia dysrytmie v srdcovom svale, čo je nevyhnutným predpokladom úspešnej ablačnej liečby. Aj keď fluoroskopický obraz počas elektrofyziologického vyšetrenia umožňuje priebežnú kontrolu polohy katétrov v srdci, pre svoju nízku rozlišovaciu schopnosť ostáva len hrubým odhadom ich skutočnej pozície. Cieľom autorov tejto prehľadnej práce bolo stručne charakterizovať základné princípy činnosti dnes používaných trojrozmerných mapovacích systémov a priblížiť ich význam a výhody pre ablačnú liečbu jednotlivých dysrytmií v klinickej praxi.
Kľúčové slová:
komorové a predsieňové dysrytmie – nefluoroskopické trojrozmerné mapovacie techniky – rádiofrekvenčná katétrová abláciaÚvod
Najčastejšie používaným nefarmakologickým prístupom v liečbe tachykardií je katétrová ablácia pomocou rádiofrekvenčnej (RF) elektrickej energie. Ide o aplikáciu striedavého prúdu s vysokou frekvenciou v rozsahu rádiových vĺn. RF energia vytvára v mieste styku ablačného katétra s endokardom teplo, čím dochádza k cielenej nekróze tkaniva. Pre svoju vysokú bezpečnosť a terapeutická úspešnosť sa RF ablácia stala metódou voľby v liečbe širokej palety dysrytmií. V prípade potreby tvorby dlhých lineárnych lézií alebo potreby hlbokej penetrácie do myokardu je efektivita RF ablácie nižšia, preto sa hľadajú alternatívne zdroje ablačnej energie. K nim patrí kryoablácia, laserová fotoablácia, ablácia ultrazvukom alebo mikrovlnná ablácia [1,2]. Výsledok ablácie úzko súvisí i s kvalitou zobrazovacích metód. Aj keď fluoroskopický obraz umožňuje priebežnú kontrolu polohy katétrov v srdci počas elektrofyziologického vyšetrenia, pre svoju nízku rozlišovaciu schopnosť a nemožnosť znázornenia nekontrastných srdcových štruktúr ostáva hrubým odhadom ich skutočnej pozície. Na presné mapovanie miesta vzniku a šírenia dysrytmií, navigáciu katétrov v srdci ako i na presné vedenie ablačných línií skiaskopické zobrazenie často nepostačuje, preto dochádza v posledných rokoch k zavádzaniu nových nefluoroskopických trojrozmerných zobrazovacích a mapovacích techník [3].
Cieľom tejto prehľadnej práce je stručne charakterizovať princípy činnosti jednotlivých nefluoroskopických zobrazovacích a mapovacích techník a priblížiť ich význam a výhody pre ablačnú terapiu dysrytmií.
Kontaktné elektroanatomické mapovanie systémom Carto
Podstatou činnosti systému CartoXP (Biosense Webster, USA) je využívanie princípu elektromagnetizmu [4,5]. Pod ležiacim pacientom sú uložené tri cievky fungujúce ako zdroj magnetických polí malej intenzity. Mapovací katéter má vo svojom hrote zabudovaný snímač schopný registrovať aj malé zmeny magnetického poľa. Z týchto údajov určí počítač presnú pozíciu katétra v srdci. Kontaktom špičky katétra so stenou srdca sa bod po bode vytvára trojrozmerný anatomický model vyšetrovanej štruktúry. V každom z bodov súčasne prebieha i registrácia vnútrosrdcových elektrických signálov, čím vzniká elektroanatomická mapa srdca. Cieľom postupu je vytvorenie anatomicky čo najpresnejšieho modelu dutiny myokardu, ako i získanie informácie o vzniku a spôsobe šírenia sa intrakardiálnych signálov. Vzniknutá aktivačná mapa odráža priebeh šírenia sa intrakardiálnych signálov vo vytvorenom modeli. CartoXP systém umožňuje i vytvorenie propagačnej mapy, ktorá je animáciou postupu aktivačného frontu v čase formou krátkej filmovej sekvencie. Na rozdiel od zdravého myokardu sa v jazve po prekonanom infarkte a v okolitej prechodnej zóne nezaznamenávajú žiadne, alebo len výrazne znížené a frakcionované intrakardiálne potenciály. Farebným kódovaním amplitúdy zaznamenaných potenciálov je možné odlíšiť zdravé tkanivo od jazvovito zmeneného myokardu, čím vzniká voltážová mapa (obr. 1).
Obr. 1. CartoXP – voltážová mapa oblasti hrotu a bázy ľavej komory. Sivé zóny – jazvovité tkanivo s minimálnou amplitúdou. Šípky označujú oblasti aplikácie RF ablačnej energie (červené body). Medzi dvoma oblasťami fibrózy je viditeľný kanál tkaniva so spomaleným vedením, ktorý je potrebné abláciou eliminovať – čierna línia (archív autorov). 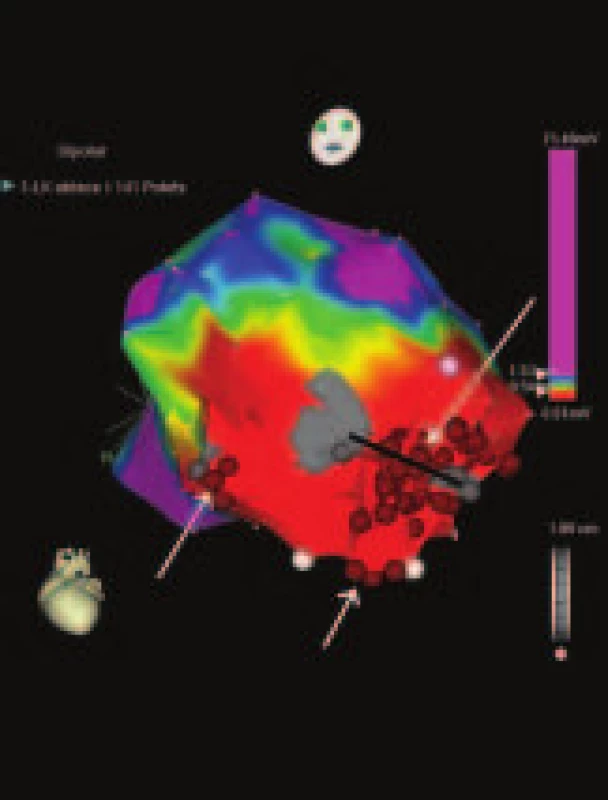
Mapovanie a ablácia predsieňových tachykardií (PT) pod skiaskopickou kontrolou má pre svoju zložitosť len obmedzenú úspešnosť. Najobtiažnejšou sa konvenčná ablácia stáva v prípadoch tzv. incizionálnej atriálnej tachykardie u chorých po kardiochirurgických operáciach. V jazvách po atriotómii a v ich okolí prežívajú pruhy tkaniva charakterizované pomalým vedením vzruchu, čo umožňuje vznik PT mechanizmom reentry. Systémom CartoXP možno určiť reentry okruh a cielene vytvárať longitudinálne ablačné lézie. Podstatne jednoduchšia je identifikácia miesta ektopickej aktivity u pacientov s fokálnou dysrytmiou prostredníctvom podrobnej aktivačnej mapy [6,7].
Typický flutter predsiení je charakteristický zónou pomalého vedenia v oblasti kavotrikuspidálneho istmu. Prerušenie tejto kritickej zóny eliminuje dysrytmiu. Na úspešnú ablačnú liečbu môže postačovať aj konvenčná skiaskopická kontrola pohybu katétrov alebo ďalšie nefluoroskopické systémy. Elektroanatomické mapovanie nemá pri typickom flutteri podstatný význam, ale jeho didaktická hodnota je pri zavádzaní metodiky vysoká. CartoXP sa dá využiť ako metóda voľby pri identifikácii medzier v pôvodnej ablačnej línii pri opakovanej ablácii [8,9,10].
Fibrilácia predsiení (FP) je pravdepodobne najčastejšou indikáciou použitia CartoXP systému. Podstatou ablačnej liečby FP je izolácia pľúcnych žíl a modifikácia arytmogénneho substrátu ľavej predsiene [6]. Izolácia pľúcnych žíl znamená elimináciu spúšťacích ohnísk PF. Tieto sa vyskytujú v oblasti prechodu svalových snopcov, tzv. rukávov myokardu predsiení do steny pľúcnych žíl. Ablácia priamo v pľúcnych žilách je spojená s rizikom následných stenóz pľúcnych žíl a nevykonáva sa. Bezpečnejším prístupom je distálna izolácia ústí pľúcnych žíl kruhovými ablačnými líniami (ta sa robí viacej na sieňovej strane kolem žilných ústí). Tie sa môžu kombinovať s dlhými ablačnými líniami rozdeľujúcich ľavú predsieň na niekoľko segmentov. Segmentácia predsiene modifikuje arytmogénny substrát, bráni šíreniu sa PF a vedie k jej ukončeniu. CartoXP naviguje celú ablačnú procedúru a umožňuje kontrolu kompletnosti lézie. Jej nekompletnosť má okrem recidív PF i proarytmický účinok, pretože často vedie k vzniku flutteru alebo PT v jazve.
Ablačná liečba pretrvávajúcej komorovej tachykardie (KT) ostáva v súčasnosti náročnou metódou aj pre elektrofyziologické centrá a veľkými skúsenosťami. Zložitosť anatomických pomerov v ľavej komore postihnutej štrukturálnym ochorením podmieňuje časté využitie systému CartoXP v tejto indikácii. Mapovanie elektrickej aktivity sťažujú viaceré reentry okruhy v jazve a v jej okolí, vedúce k striedaniu sa viacerých typov KT. Prekážkou mapovania je aj častá hemodynamická netolerovateľnosť pretrvávajúcej KT, hrúbka steny ľavej komory, prípadne subepikardiálna lokalizácia substrátu KT [10]. To vedie k obmedzenému efektu ablačnej liečby [11,12,13,14]. Elektroanatomické mapovanie dokáže presne popísať jednotlivé časti reentry okruhu, aktivačná mapa však musí byť vytvorená počas KT. U hemodynamicky netolerovateľných KT môže byť cestou k úspešnej ablácii vytvorenie voltážovej mapy pri sínusovom rytme. Abláciou vytvorené spojenie jazvy líniami k určitej anatomickej štruktúre eliminuje arytmiu [7]. V liečbe fokálnych KT použitie CartoXP systému nie je nevyhnutné, pretože sa s úspechom používajú konvenčné mapovacie prístupy pod skiaskopickou kontrolou, prípade iné menej finančne náročné nonfluoroskopické metódy. Porovnanie s ostatnými nefluoroskopickými trojrozmernými zobrazovacími systémami je uvedené v tab. 1. Mapovanie i ablácia sa vykonávajú prostredníctvom toho istého špecializovaného katétra Navistar. Určitou nevýhodou systému je nevyhnutnosť sekvenčného postupu, t.j. vytváranie mapy bod po bode, čím rastie časová náročnosť procedúry. V rukách skúseného elektrofyziológa sa však tento nedostatok relativizuje. Predpokladom použitia Carto systému je stabilita mapovanej tachykardie počas vyšetrenia, prípadne jej ľahká indukovateľnosť. Krátkotrvajúce alebo hemodynamicky netolerované arytmie sú pre túto techniku nevhodné.
Tab. 1. Porovnanie nefluoroskopických trojrozmerných zobrazovacích techník. Upravené podľa [5]. ![Porovnanie nefluoroskopických trojrozmerných zobrazovacích techník. Upravené podľa [5].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/48c19f88af192c7aef06420654c9dc23.png)
Elektroanatomické mapovanie pomocou CartoXP systému je v súčasnosti najrozšírenejším trojrozmerným mapovacím postupom v liečbe supraventrikulárnych i komorových tachykardií. Najnovšou črtou systému Carto je možnosť importu vloženia aktivačnej mapy do skutočného, nie virtuálneho modelu srdcovej štruktúry, získaného z digitálne spracovaného obrazu špirálového CT [15]. Táto možnosť by mala zvýšiť presnosť elektroanatomickej mapy a tým i spoľahlivosť navigácie vo veľmi premenlivom teréne vyústenia pľúcnych žíl do ľavej predsiene. Určitou nevýhodou je potreba CT vyšetrenia pacienta pri stabilnom sínusovom rytme, pretože PF alebo časté extrasystoly výrazne skresľujú anatomický model artefaktmi.
Nekontaktné mapovanie systémom EnSite
Nekontaktné mapovanie pomocou systému EnSite Array (Endocardial Solutions, Inc., USA) je založené na odlišnom princípe [16,17,18]. Snímaciu časť zariadenia tvorí špeciálny balónkový katéter, ktorého expandibilný balónik je pokrytý kovovou sieťkou tvorenou zo 64 izolovaných vodičov s hrúbkou 0,003 mm. Každých 0,025 mm je izolácia na vodičoch prerušená, toto miesto vodiča slúži následne ako bezkontaktná unipolárna elektróda (obr. 2). V hrote katétra sa nachádza súčasne i indiferentná elektróda, ktorá je nevyhnutná na zaznamenávanie jednotlivých unipolárnych potenciálov. Slúži však i ako lokátor ostatných katétrov napojených na mapovací systém. Princíp nekontaktného mapovania vychádza z poznatku, že ak vsunieme jeden vodivý povrch do dutiny v inom vodiči a poznáme pritom ich vzájomnú vzdialenosť a potenciál na jednom z povrchov, potenciál na druhom povrchu je možné vypočítať [5]. EnSite bez priameho kontaktu s endokardom zaznamenáva a vypočítava v reálnom čase súčasne takmer 3400 virtuálnych intrakardiálnych elektrogramov. Systém je schopný identifikovať miesto vzniku arytmie a smer jej propagácie z analýzy jediného srdcového sťahu. Údaje z mapovacieho katétra spracúva program, ktorý vytvára virtuálnu aktivačnú elektroanatomickú mapu.
Obr. 2. EnSite systém. 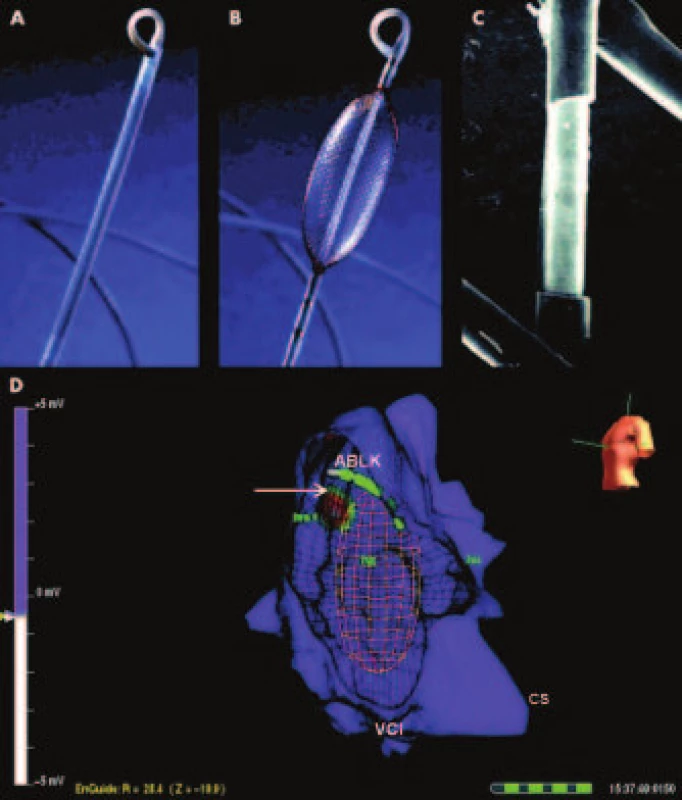
Panel A, B: nenaplnený a naplnený balónik s dobre viditeľnou multipolárnou elektródou na svojom povrchu. Panel C: Mikrofotografia znázorňujúca jednu z unipolárnych elektród mriežky EnSite systému. Panel D: 3D-mapa pravej predsiene pacienta v LAO projekcii s fokálnou ektopickou atriálnou tachykardiou. Miesto najvčasnejšej aktivácie znázorňuje biely stred farebného terčíka v 3D-modeli. V blízkosti fokusu sa nachádza ablačný katéter (ABLK) a zjednodušený obraz EnSite mriežky. Upravené podľa [5]. Použité skratky: CS – koronárny sínus, ABLK – ablačný katéter, VCI – vena cava inferior, tva – anulus trikuspidálnej chlopne Svoju efektivitu potvrdil EnSite pri navigácii ablácie PF [19]. Keďže až 30 % spúšťačov PF nemá pôvod v pľúcnych žilách, stráca u týchto pacientov izolácia pľúcnych žíl svoju efektivitu [5]. V týchto prípadoch môže nekontaktné mapovanie uplatniť svoju výhodu rýchlej tvorby aktivačnej mapy, čo umožňuje rýchlo odhaliť miesto ektopickej fokálnej atriálnej aktivity a následne jeho cielenú abláciu. Napriek uvedeným výhodám je použitie EnSite systému v tejto indikácii zriedkavé.
Mapovanie ektopických atriálnych tachykardií a flutteru predsiení pomocou EnSite umožňuje skrátenie doby potrebnej na abláciu fokusu spúšťajúceho PT [20,21,22]. Súčasné snímanie elektrokardiogramov z viac ako 3000 kanálov vyšetrovanej srdcovej dutiny umožňuje zmapovanie i krátkotrvajúcej tachykardie. Výhodou nekontaktného mapovania je možnosť rýchleho zmapovania i pri chýbaní štrukturálnych zmien v tkanive (fibróza, jazva apod), ktorých identifikácia je často nevyhnutná pri ablácii riadenej voltážovými mapami vytvorenými CartoXP systémom. Pri typickom flutteri predsiení sa EnSite používa len výnimočne, väčšinou len v prípade predchádzajúcej neúspešnej ablácie na identifikovanie medzery v nekompletnej ablačnej línii.
EnSite systém je vhodný aj na ablačnú liečbu komorových tachykardií, pričom výhodou je krátke časové trvanie vytvorenia celkovej elektroanatomickej mapy ľavej komory. Nakoľko pre vytvorenie mapy postačuje jeden srdcový cyklus, EnSite systém umožní potenciálne urýchliť mapovanie a abláciu aj pri hemodynamicky nestabilných arytmiach [21,22].
Dôležitou podmienkou presnej navigácie je vytvorenie verného anatomického modelu na začiatku vyšetrenia ešte počas sínusového rytmu. Ide o kľúčový krok procedúry, pretože navigácia katétrov v nepresnom anatomickom modeli je pre abláciu bezcenná. Kvalita virtuálnych elektrokardiogramov závisí i od vzájomnej vzdialenosti endokardiálneho povrchu a mapovacej sieťky. Ak činí viac ako 40 mm, je potrebná jej repozícia do vhodnejšej polohy. Určitou nevýhodou je i potreba dvoch katétrov - mapovacieho katétra Array a ablačného katétra. S tým je spojená vyššia technická náročnosť ablačných procedúr, napríklad potreba dvojitej transseptálnej punkcie pri liečbe tachykardií s ohniskom v ľavej predsieni.
Novšia verzia tohto mapovacieho a navigačného systému sa nazýva NavX. Možnosti jeho aplikácie sú zhodné s EnSite a CartoXP systémami [15,24]. NavX využíva niektoré mechanizmy práce CartoXP, EnSite-Array i LocaLisy. Na rozdiel od EnSite využíva NavX kontaktné mapovanie kontinuálnym ťahom mapovacieho katétra po endokarde, takže multipolárna mriežka EnSite katétra nie je potrebná. Systém využíva na mapovanie registráciu zmien elektrického napätia podobne ako LocaLisa, vytvára však navyše i anatomické modely srdcových oddielov. Niekoľko ťahov katétrom stačí skúsenému vyšetrujúcemu na zmapovanie celej vyšetrovanej srdcovej dutiny a vytvorenie aktivačnej mapy a virtuálneho modelu (obr. 3). Na zabezpečenie čo najväčšej podobnosti voči skutočnej anatómii ponúkajú nové verzie systému prenos aktivačnej mapy na model získaný špirálovým CT alebo NMR. Táto kombinácia sa označuje DIF („Digital Image Fusion“). Veľkou výhodou NavX je to, že nevyžaduje špeciálne katétre. To znižuje náklady a umožňuje použiť alternatívne zdroje ablačnej energie, napríklad kryoabláciu. Systém sa presadzuje predovšetkým pri izolácii pľúcnych žíl pri FP [15].
Obr. 3. Vľavo trojrozmerný model ľavej predsiene s vústením štyroch pľúcnych žíl vytvorený NavX systémom v PA projekcii. 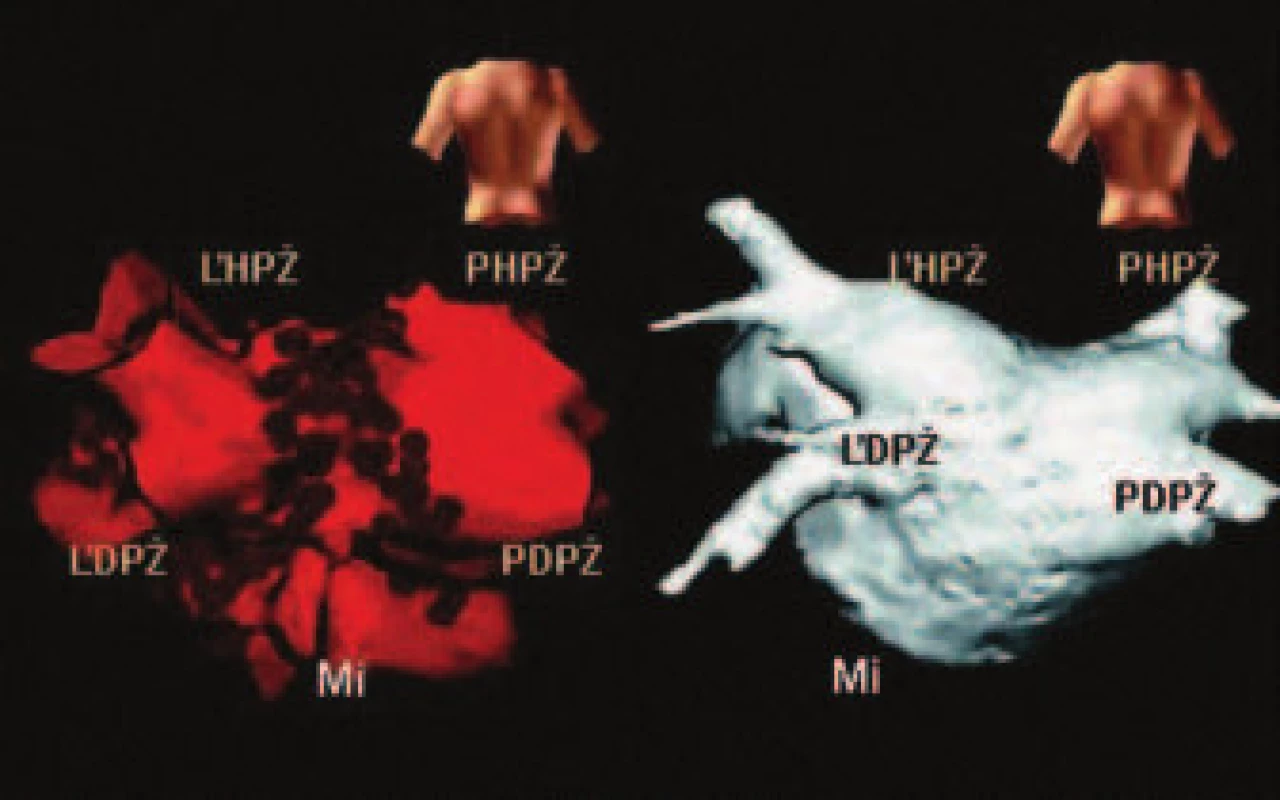
Na obrázku sú viditeľné dve kruhové ablačné lézie oddeľujúce od seba ústia pravých a ľavých pľúcnych žíl (tmavé body). Vpravo anatomický model ľavej predsiene získaný pomocou špirálového CT. Použité skratky: ĽHPŽ – ľavá horná, ĽDPŽ – ľavá dolná pľúcna žila, PHPŽ a PDPŽ – pravá horná a dolná pľúcna žila, Mi – anulus mitrálnej chlopne. Upravené podľa zdroja z webovskej stránky výrobcu – www.endocardial.com Mapovací systém LocaLisa
Mapovací systém LocaLisa (Medtronic, USA) umožňuje lokalizáciu katétrov pri elektrofyziologickom vyšetrení i počas RF ablácie, pričom na rozdiel od predchádzajúcich nevytvára trojrozmerný model vyšetrovanej srdcovej dutiny [24,25]. Princíp LocaLisy vychádza z Ohmovho zákona, podľa ktorého zmena napätia závisí od intenzity elektrického prúdu a hodnoty odporu. Ak hrudníkom pacienta preteká elektrický prúd, vytvára sa voltážový gradient v oblasti srdca. Zmena polohy elektródy v tomto gradiente vedie na nej k zmenám voltáže. Ak sa striedavý prúd o veľkosti 1 mA a mierne odlišnej frekvencii aplikuje v 3 na seba kolmých smeroch, umožní sa meranie pozície katétrových elektród v priestore [24]. Prúdy sú emitované a prijímané troma pármi elektród pripevnených na hrudníku, hlave a končatinách.
Výhodou LocaLisy je možnosť sledovať polohu ablačného katétra počas ablácie s vysokou presnosťou (rozlíšenie 1,5 mm) a do pamäti zaznamenať jednotlivé body ablačnej línie. V prípade potreby sa môže vyšetrujúci vrátiť ku ktorémukoľvek označenému bodu a vyplniť prípadnú medzeru v ablačnej línii. LocaLisa podľa literárnych údajov významne redukuje celkový skiaskopický čas a zjednodušuje priebeh ablačného zákroku [26,27,28,29,30]. Praktické využitie LocaLisy je čiastočne limitované chýbaním anatomickej mapy, takže sa prednostne využíva pri navigácii ablácie anatomicky dobre definovaných dysrytmií, ako je typický flutter predsiení (obr. 4) alebo reentry tachykardia pri duálnom vedení AV uzlom [27,28,29,30]. Literárne údaje sú v súlade s poznatkami získanými na našom pracovisku, kde systém LocaLisa pravidelne používame [27]. Viaceré pracoviská používajú LocaLisu s výbornými výsledkami i pri izolácii pľúcnych žíl pri ablačnej liečbe fibrilácie predsiení [31,32,33,34,35].
Obr. 4. LocaLisa. Panel A: Pohľad na 3 paralelné ablačné línie (červená, fialová, zelená) v oblasti kavotrikuspidálneho istmu – virtuálny model pravej predsiene v AP projekcii (vľavo) a v LAO projekcii (vpravo). Šípky znázorňujú pozíciu ablačného katétra. Panel B: Skiaskopický obraz rovnakého pacienta v AP projekcii. 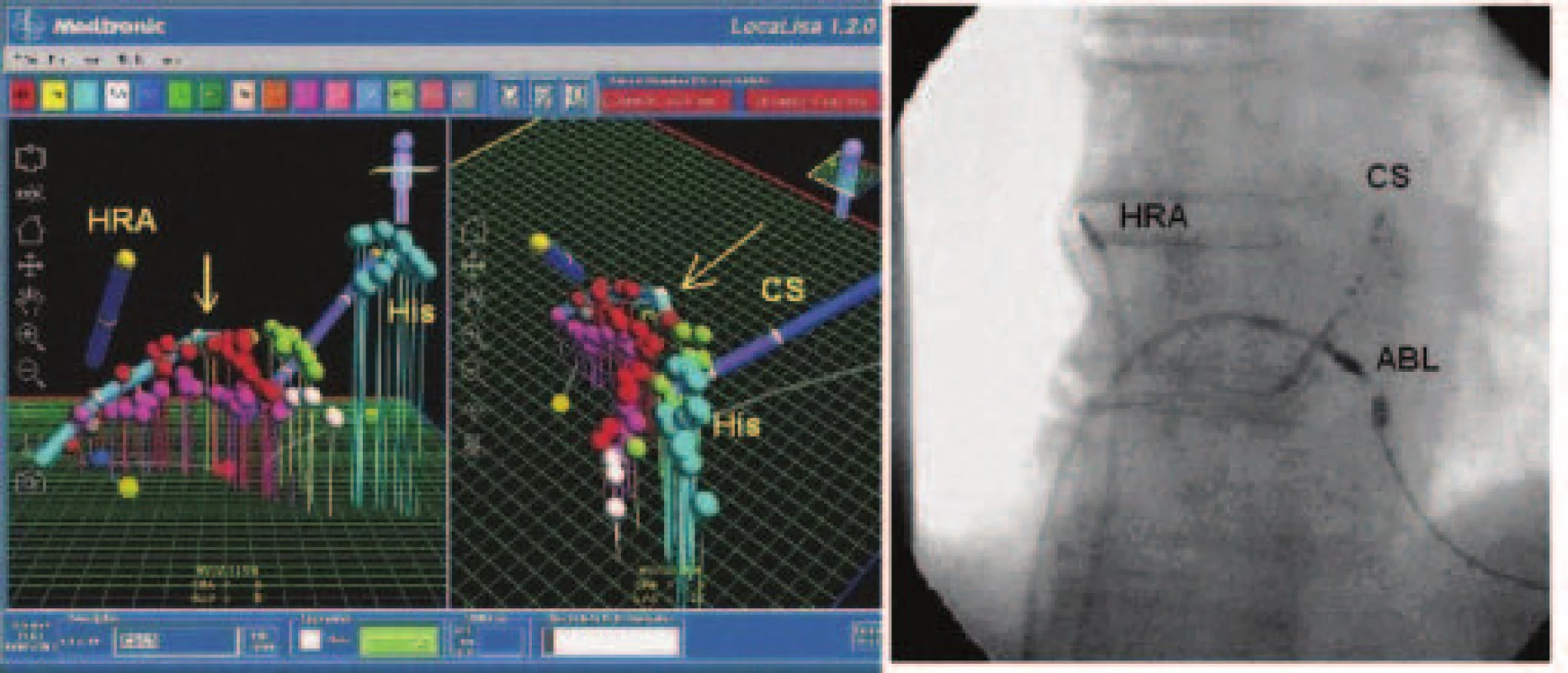
Použité skratky: CS – koronárny sínus, HRA – oblasť hornej pravej predsiene, His – oblasť hisovho zväzku (archív autorov). Multipolárny košíkový katéter
V prípade tejto metodiky nejde o vytváranie anatomických modelov, systém umožňuje znázorniť len šírenie sa akčného potenciálu v miestach dotyku katétra s endokardom. Systém využíva katéter schopný expanzie s multielektródovou hlavicou, ktorá má v rozvinutej forme tvar košíka priliehajúceho na endokard vyšetrovanej dutiny srdca. Pri dobrom umiestnení a optimálnom kontakte hlavice s endokardom ide o rýchle a jednoduché mapovanie, pričom sa vytvára mapa s prislúchajúcimi elektrokardiogramami a aktivačnými sekvenciami [36]. Tento systém sa využíva v praxi pomerne zriedkavo. Literárne údaje popisujú jeho použitie pri diagnostike a ablačnej liečbe supraventrikulárnych tachykardií [37]. Po nasnímaní intrakardiálnych elektrokardiogramov stačí umiestniť ablačný katéter čo najbližšie k elektróde s najvčasnejším potenciálom. Pri predsieňových tachykardiach s ohniskom v ľavej predsieni je košíčkové mapovanie nevhodné pre nemožnosť transeptálneho prechodu katétra do ľavej predsiene z dôvodu jeho tuhosti a slabej ovládateľnosti. Výhodou systému je rýchlosť a simultánnosť zaznamenávania endokardiálnych signálov, ako i rýchle vytvorenie endokardiálnej aktivačnej mapy. Metóda sa používa i pri navigácii počas katétrovej ablácie KT a peroperačnej kryoablácii KT [38,39,40], prípadne pri ablácii KT z výtokového traktu pravej komory [41].
Nevýhodou je relatívne nízka presnosť mapovania, vyplývajúca z veľkých vzdialeností medzi ramenami košíčkovej multipolárnej elektródy. Tým je i schopnosť presne určiť miesto efektívnej ablácie obmedzená.
Ultrazvukové mapovanie
Systém RPM (real position management) bol vyvinutý firmou Boston Scientific (USA). Je tvorený dvoma referenčnými katétrami zavedenými do koronárneho sínusu a hrotu pravej komory a ablačným mapovacím katétrom. Tieto špeciálne katétre pracujú ako miniatúrne ultrazvukové sondy emitujúce a prijímajúce ultrazvukové vlnenie. Zo zachytených odrazov počítač vytvára anatomický model vyšetrovanej srdcovej dutiny a simuluje polohu a pohyby ablačného katétra. Výsledkom je aktivačná mapa podobná mape pri CartoXP systéme. Experimentálne práce potvrdili prínos ultrazvukového RPM systému u chorých podstupujúcich rôzne ablačné procedúry - abláciu kavotrikuspidálneho istmu [42], atypického flutteru predsiení, atriálnych tachykardií a fibrilácie predsiení [36], WPW a monomorfných komorových tachykardií [43,44]. Systém má v súčasnosti stále experimentálny charakter a pre využitie v klinickej praxi vyžaduje ďalší vývoj a zdokonaľovanie.
Magnetická navigácia katétrov
Všetky uvedené mapovacie a zobrazovacie systémy vyžadujú manuálnu manipuláciu s katétrami. V ostatnom čase sa v niektorých špičkových elektrofyziologických centrách zavádza do praxe robotický navigačný a mapovací systém Niobe - Magnetic Navigation SystemTM (Stereotaxis Inc., USA) [45,46], ktorý v sebe integruje výhody modernej fluoroskopickej techniky a magnetického systému diaľkového ovládania a navigácie katétrov. Tvoria ho dva elektromagnety v krytoch po stranách pacienta v úrovni jeho hrudníka (obr. 5). Magnety vytvárajú homogénne magnetické pole so stabilnou intenzitou (0,08 T) približne 15 cm pod úrovňou hrudnej steny. NIOBE využíva špeciálny mapovací a ablačný katéter, v špičke ktorého je umiestnený magnet. Tento katéter je na rozdiel od konvenčných relatívne tuhých uni - alebo bidirekčných ablačných katétrov výrazne mäkší a ohybnejší. Môže sa otáčať okolo svojej osi v rozsahu 360°. Vyšetrujúci prostredníctvom počítača ovláda vzájomný pohyb a polohu magnetov v krytoch tak, aby vektor výsledného magnetického poľa získal žiadaný smer. Magnet v špičke katétra nasleduje pasívne vektor magnetického poľa, takže katéter ohýba potrebným smerom. Tento mechanizmus umožňuje zavedenie ablačného katétra do potrebnej polohy i jeho fixáciu aj v miestach, kde je prístup konvenčnými ablačnými katétrami obťažný [45]. Vektory magnetického poľa použité sa počas navigácie automaticky ukladajú do pamäti zariadenia. Vyšetrujúci sa dokáže s katétrom kedykoľvek opäť vrátiť do pozície uloženej v pamäti. Unikátnou črtou systému NIOBE je diaľkové ovládanie navigácie už pri zavádzaní katétra cievnym systémom po punkcii cievy. Operátor ho riadi a kontroluje od riadiaceho pultu ovládacou pákou diaľkového ovládania (počítačový zavádzací systém Cardiodrive, Stereotaxis Inc., USA). Magnetický navigačný systém bol s výbornými výsledkami použitý pri ablácii rôznych supraventrikulárnych arytmií, napríklad AV nodálnej reentry tachykardie, typického flutteru predsiení, ale i PT a fibrilácie predsiení [15,47]. V súčasnosti sa magnetický systém Niobe využíva aj v spojení s CartoXP. Spojenie Niobe s NavX je v súčasnosti v štádiu intenzívneho vývoja [15].
Obr. 5. Stereotaktický magnetický navigačný systém NIOBE. 
Záver
Súčasné trojrozmerné mapovacie systémy predstavujú významný pokrok a často nevyhnutnosť pri ablácii mnohých supraventrikulárnych a komorových tachykardií. Ich použitie umožňuje významnú redukciu aplikovanej dávky žiarenia pre lekára i pacienta a časové skrátenie zložitých ablačných procedúr. Ich najväčším prínosom je však umožnenie niektorej z foriem ablácie ako definitívnej intervenčnej liečby aj v prípadoch, kde doterajšie konvenčné mapovacie techniky zlyhávajú.
MUDr. Peter Olexa, Ph.D.
Arytmologické oddelenie Východoslovenského ústavu srdcových a cievnych chorôb, Košice, Slovenská republika
www.
e-mail: polexa@post.sk
Doručeno do redakce: 12. 2. 2005
Přijato po recenzi: 12. 10. 2005
Zdroje
1. Keane D. New catheter ablation techniques for treatment of cardiac arrhythmias. CEPR 2002; 6 : 341-346.
2. Lustgarten DL, Keane D, Ruskin J. Cryothermal ablation: Mechanism of tissue injury and current experience in the treatment of tachyarrhythmias. Prog Cardiovasc Dis 1999; 41 : 481-498.
3. Schmitt C, Ndrepepa G, Deisenhofer I et al. Recent advances in cardiac mapping techniques. Current Cardiology Reports 1999; I: 149-156.
4. Gepstein L, Evans SJ. Electroanatomical mapping of the heart: basic concepts and implications for the treatment of cardiac arrhythmias. PACE 1998; 21 : 1268-1278.
5. Friedman PA. Novel mapping techniques for cardiac electrophysiology. Heart 2002; 87 : 575-582.
6. Fiala M, Heinc P, Lukl J. Radiofrekvenční katetrová ablace levostranných skrytých síňokomorových přídatných drah. Bezprostřední a dlouhodobé výsledky při transaortálním přístupu. Vnitř Lék 2000; 46 : 92-95.
7. Marchlinski F, Callans D, Gottlieb C et al. Magnetic electroanatomical mapping for ablation of focal atrial tachycardias. PACE 1998; 21 : 1621-1635.
8. Shah DC, Jais P, Haissaguerre M et al. Three-dimensional mapping of the common atrial flutter circuit in the right atrium. Circulation 1997; 96 : 3904-3912.
9. Kottkamp H, Hugl B, Krauss B et al. Electromagnetic versus fluroscopic mapping of the inferior isthmus for ablation of typical atrial flutter: A prospective randomized study. Circulation 2000; 102 : 2082-2086.
10. Kautzner J, Peichl P, Čihák R et al. The spectrum of inter - and intraventricular conduction abnormalities in patients eligible for cardiac resynchronization therapy.
Pacing Clin Electrophysiol 2004; 27 : 1105-1112.
11. Kautzner J, Čihák R, Peichl P et al. Catheter ablation of ventricular tachycardia following myocardial infarction using three-dimensional electroanatomical mapping. Pacing Clin Electrophysiol 2003; 26 : 342-347.
12. Fiala M, Heinc P, Bulava A et al. Komorové tachyarytmie u pacientů bez strukturálního postižení srdce. Klinické a elektrofyziologické vlastnosti tachyarytmií a dlouhodobé výsledky katétrové ablace. Vnitř Lék 2001; 47 : 817-828.
13. Marchlinski FE, Callans DJ, Gottlieb CD et al. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation 2000; 101 : 1288-1296.
14. Studenčan M. Myocardial viability - clinical aspects. Cardiol 2000; 9 : 147-153.
15. Pappone C, Augello G, Santinello V. Atrial fibrillation ablaion. Ital Heart J 2005; 6 : 190-199.
16. Khoury DS, Berrier KL, Badruddin SM et al. Three-dimensional electrophysiological imaging of the intact left ventricle using a noncontact multielectrode cavitary probe: study of sinus, paced, and spontaneous premature beats. Circulation 1998; 97 : 399-409.
17. Khoury DS, Taccardi B, Lux RL et al. Reconstruction of endocardial potentials and activation sequences from intracavitary probe measurements. Localization of pacing sites and effects of myocardial structure. Circulation 1995; 91 : 845-863.
18. Schneider M, Schmitt C. Non-contact-Mapping - ein simultanes räumliches Lokalisationsverfahren in der Diagnostik von Herzrhythmusstörungen. Z Kardiol 2000; 89: Suppl 3: III/177-III/185.
19. Schneider M, Ndrepepa G, Zrenner B et al. Non-contact mapping-guided catheter ablation of atrial fibrillation associated with left atrial ectopy. J Cardiovasc Electrophysiol 2000; 11 : 475-479.
20. Schmitt H, Weber S, Schwab JO et al. Diagnosis and ablation of focal right atrial tachycardia using a new high-resolution, non contact mapping system. Am J Cardiol 2001; 87 : 1017-1021.
21. Schneider M, Ndrepepa G, Zrenner B et al. Non-contact mapping guided ablation of atrial flutter and enhanced-density mapping of the cavotricuspid isthmus. PACE 2001; 24 : 1755-1764.
22. Michael MJ, Haines DE, Dimarco JP et al. Elimination of focal atrial fibrillation with a single radiofrequency ablation: Use of a basket catheter in a pulmonary vein for computerized activation sequence mapping. J Cardiovasc Electrophysiol 2000; 11 : 1159-1164.
23. Betts TR, Roberts PR, Allen SA et al. Radiofrequency ablation of idiopathic left ventricular tachycardia at the site of earliest activation as determined by noncontact mapping. Cardiovasc Electrophysiol 2000; 11 : 1094-1101.
24. Krum D, Goel A, Hauck A et al. Catheter location, tracking, cardiac chamber Geometry creation and ablation using cutaneous patches. J Interv Card Electrophysiol 2005; 12 : 17-22.
25. Wittkampf FH, Wever EF, Vos K et al. LocaLisa - new technique for real-time 3-D localization of regular intracardiac electrodes. Circulation 1999; 99 : 1312-1317.
26. Stančák B, Spurný P, Olexa P et al. Navigačný systém Localisa v ablačnej liečbe supraventrikulárnych tachykardií (abstr.). Cardiol 2004; 13 : 28S-29S.
27. Wittkampf FHM, Wever EFD, Vos K et. al. Reduction of radiation exposure in the cardiac electrophysiology laboratory. PACE 2000; 23 : 1638-1644.
28. Kirchhof P, Loh P, Eckardt L et al. A novel nonfluoroscopic catheter visualization system (LocaLisa) to reduce radiation exposure during catheter ablation of supraventricular tachycardias. Am J Cardiol. 2002; 90 : 340-343.
29. Marrouche NF, Beheiry S, Tomassoni G et al. Three-Dimensional Nonfluoroscopic Mapping and Ablation of Inappropriate Sinus Tachycardia. Procedural Strategies and Long-Term Outcome. JACC 2002; 39 : 1046-1054.
30. Kottkamp H, Hugl B, Krauss B et al. Electromagnetic versus fluoroscopic mapping of the inferior isthmus for ablation of typical atrial flutter. A prospective randomized study. Circulation 2000; 102 : 2082-2086.
31. Inama G, Durin O, Agricola P et al. Pulmonary vein isolation in atrial fibrillation ablation: the role of LocaLisa three-dimensional navigation system. Ital Heart J 2004; 10: Suppl 1 S129-S131.
32. Ernst S, Ouyang F, Löber F et al. Catheter-induced linear lesions in the left atrium in patients with atrial fibrillation. An electroanatomic study. JACC 2003; 42 : 1271-1282.
33. Ernst S, Schluter M, Ouyang F et al. Modification of the substrate for maintenance of idiopathic human atrial fibrillation efficacy of radiofrequency ablation using nonfluoroscopic catheter guidance. Circulation 2001; 100 : 2085-2092.
34. Goya M, Ouyang F, Ernst S et al. Electroanatomic mapping and catheter ablation of breakthroughs from the right atrium to the superior vena cava in patients with atrial fibrillation. Circulation 2002; 106 : 1317-1320.
35. Macle L, Jais P, Scavee P et al. Pulmonary vein disconnection using the LocaLisa three-dimensional nonfluoroscopic catheter imaging system. J Cardiovasc Electrophysiol 2003; 14 : 693-697.
36. Jenkins KJ, Walsh EP, Colan SD et al. Multipolar endocardial mapping of the right atrium during cardiac catheterization: description of a new technique. JACC 1993; 22 : 1105-1110.
37. Ndrepepa G, Zrenner B, Deisenhofer I et al. Relationship between surface electrogram characteristics and endocardial activation sequence in patients with typical atrial flutter. Z Kardiol 2000; 89 : 527-537.
38. Eldar M, Ohad DG, Goldberger JJ et al. Transcutaneous multielectrode basket catheter for endocardial mapping and ablation of ventricular tachycardia in the pig. Circulation 1997; 96 : 2430-2437.
39. Greenspon AJ, Hsu SS, Datorre S. Successful radiofrequency catheter ablation of sustained ventricular tachycardia post myocardial infarction in man guided by a multielectrode „basket“ catheter. J Cardiovasc Electrophysiol 1997; 8 : 565-570.
40. Schalij MJ, van Rugge FP, Siezenga M et al. Endocardial activation mapping of ventricular tachycardia in patients: first application of a 32-site bipolar mapping electrode catheter. Circulation 1998; 98 : 2168-2179.
41. Aiba T, Shimuzu W, Taguchi A et al. Clinical usefulness of a multielectrode basket catheter for idiopathic ventricular tachycardia originating from right ventricular outflow tract. J Cardiovasc Electrophysiol 2001; 12 : 511-551.
42. De Groot N, Bootsma M, van der Velde ET et al. Three-dimensional catheter positioning during radiofrequncy ablation in patients: First application of the real-time position mangament system. J Cardiovasc Electrophysiol 2000; 11 : 1183-1192.
43. Spitzer SG, Karolyi L, Rammler C et al. Ablation of typical atrial flutter using a three-dimensional ultrasound mapping system. J Interv Card Electrophysiol 2003; 8 : 181-185.
44. Schreieck J, Ndrepepa G, Zrenner B et al. Radiofrequency ablation of cardiac arrhythmias using a three-dimensional real-time position management and mapping system. PACE 2002; 25 : 1699-1707.
45. Ernst S, Ouyang F, Linder Ch et al. Initial experience with remote cathether ablation using a novel magnetic navigation system. Circulation 2004; 109 : 1472-1475.
46. Tomassoni G. Magnetic Navigation in the EP Lab is now a reality. EP Lab Digest May 2003; 3 : 1-4.
47. Faddis MN, Blume W, Finney B et al. Novel, magnetically guided cathether for endocardial mapping and radiofrequency cathether ablation. Circulation 2002; 106 : 2980-2985.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2006 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Polymorfizmus genu pro endotelin u pacientů se srdečním selháním
- Diastolická dysfunkce levé komory u populace vyššího věku
- Volumy štítné žlázy u dospělé populace
- Antikoagulační léčba u antifosfolipidového syndromu
- Vliv cílené intervence na výskyt rizikových faktorů kardiovaskulárních onemocnění u zdravotnických zaměstnanců
- Klidový energetický výdej při hemodialýze
- Má polymorfizmus G8002A v genu pro endotelin význam pro další rizika u pacientů se srdečním selháním?
- Je zvýšený enddiastolický tlak v levé komoře u populace staršího věku patologický?
- Intervalový a kontinuální trénink v kardiovaskulární rehabilitaci
- Úvodník
- Lokální cévní komplikace u pacientů s akutním infarktem myokardu řešeným direktní perkutánní koronární intervencí
- Volumy štítné žlázy u dospělé populace ve věku 18 - 65 let v České republice - stanovení norem
- AIP - Aterogenní index plazmy jako významný prediktor kardiovaskulárního rizika: od výzkumu do praxe
- Vliv cílené intervence na výskyt rizikových faktorů KV onemocnění – editorial
- Nefluoroskopické mapovacie techniky v súčasnej katétrovej ablačnej liečbe dysrytmií
- Studie FIELD přednesena a uveřejněna. Nepřesvědčivé výsledky fenofibrátu u diabetiků.
-
Diagnostika a léčba jaterní encefalopatie
Doporučený postup vypracovaný skupinou pro portální hypertenzi při České hepatologické společnosti České lékařské společnosti J. E. Purkyně a schválený výborem České hepatologické společnosti České lékařské společnosti J. E. Purkyně - „Nejasná“ příčina vzniku a recidivy venózního tromboembolizmu
- Antifosfolipidový syndrom - popisy dvou případů
- Prof. MUDr. Josef Marek, DrSc. sedmdesátníkem
- Špička I et al. Mnohočetný myelom a další monoklonální gamapatie. Praha: Galén 2005. 128 stran. ISBN 80-7262-330-3
- Samuel Vokurka et al. Ošetřovatelské problémy a základy hemoterapie. Praha: Galén 2005. 140 stran. ISBN 80-7262-299-4.
- Stárka L, Zamrazil V et al. Základy klinické endokrinologie. 2. rozšířené vydání. Praha: Maxdorf 2005. 378 stran. ISBN 80-7345-066-6.
- Václav Špičák, Petr Panzner et al. Alergologie. Praha, Galén a Karolinum 2004. 348 stran. ISBN 80-7262-265-X (Galén), 80-246-0846-4 (Karolinum).
- Marek J et al. Farmakoterapie vnitřních nemocí. 3.(zcela přepracované a doplněné) vydání. Praha: Grada 2005. 773 stran. ISBN 80-247-0839-6.
- Widimský Jiří, Malý Jaroslav et al. Akutní plicní embolie a žilní trombóza. 2. rozšířené a přepracované vydání. Praha: TRITON 2005. Počet stran 381. ISBN 80-7254-639-2.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- AIP - Aterogenní index plazmy jako významný prediktor kardiovaskulárního rizika: od výzkumu do praxe
- Volumy štítné žlázy u dospělé populace ve věku 18 - 65 let v České republice - stanovení norem
-
Diagnostika a léčba jaterní encefalopatie
Doporučený postup vypracovaný skupinou pro portální hypertenzi při České hepatologické společnosti České lékařské společnosti J. E. Purkyně a schválený výborem České hepatologické společnosti České lékařské společnosti J. E. Purkyně - Diastolická dysfunkce levé komory u populace vyššího věku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



