-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
Glibenclamide site of in insuline: a new chance for MODY 3 type diabetes patients: case report
MODY 3 belongs to monogenic forms of diabetes mellitus and is caused by monoallelic mutation in gene for transcription factor HNF-1α, essential for regulation of β-cell function. Clinical presentation of MODY 3 is similar to that of type 1 diabetes. Although MODY 3 patients are not threatened by ketoacidosis, tight metabolic control is important for prevention of chronic diabetic complications. In the sibbling pair diabetes was manifested by osmotic symptoms resulting from hyperglycaemia at the age of 18 years (brother) resp. 15 years (sister) and both of them started being treated with intensified insulin treatment. Metabolic control of the brother was very tight with HbA1c 3.3 % but frequent hypoglycaemias occured. On the contrary metabolic control of the sister was very poor due to her non-compliance (HbA1c 10.9 %, IFCC). Molecular-genetic testing proved HNF-1α gene mutation (Arg200Gly). In accordance with the references treatment with sulphonylurea derivate glibenclamide was initiated [at the doses 1.25 (brother) resp. 7.5 (sister) mg/day] and insulin treatment was discontinued. The treatment change led to better quality of life and metabolic control in both the patients and suprisingly to the lower frequency of the hypoglycaemias in the brother (HbA1c decreased from 3.3 % to 2.8 % in three months in the brother resp. from 10.9 % to 10.0 % in two months in the sister). Molecular-genetic testing enables the change of treatment leading to better quality of life and metabolic control, although its longterm safety and efficacy will have to be confirmed.
Key words:
MODY 3 type diabetes - therapy - metabolic control - glibenclamide - quality of life
Autoři: doc. MUDr. Ludmila Brunerová, Ph.D. 1; L. Trešlová 1; Š. Průhová 2; J. Vosáhlo 2; J. Brož 1
; J. Lebl 2; M. Anděl 1
Působiště autorů: Diabetologické centrum II. interní kliniky 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, přednosta prof. MUDr. Michal Anděl, CSc. 1; Diabetologické centrum Kliniky dětí a dorostu 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, přednosta prof. MUDr. Jan Lebl, CSc. 2
Vyšlo v časopise: Vnitř Lék 2006; 52(3): 275-279
Kategorie: Kazuistika
Souhrn
MODY 3 diabetes patří mezi monogenně podmíněné formy diabetes mellitus. Je způsoben monoalelickou mutací genu HNF-1α, který kóduje transkripční faktor nezbytný pro regulaci funkce β-buněk. Klinicky se MODY 3 projevuje podobně jako diabetes mellitus 1. typu. I když postižení pacienti nejsou ohroženi ketoacidózou, kvalitní metabolická kontrola je zcela zásadní pro prevenci pozdních komplikací diabetu. U sourozeneckého páru se projevil diabetes mellitus v 18 letech (bratr) a v 15 letech (sestra) hyperglykemií s osmotickými příznaky. U obou byla zahájena léčba intenzifikovaným inzulinovým režimem. Kompenzace diabetu u bratra byla vynikající (HbA1c 3,3 %), ovšem za cenu častých hypoglykemií. U sestry se však vlivem nespolupráce dlouhodobě nedařilo dosáhnout uspokojivé kontroly glykemií (HbA1c 10,9 % dle IFCC). Molekulárně-genetické vyšetření u obou sourozenců následně prokázalo mutaci Arg200Gly v genu HNF-1α. Na základě literárních údajů byla u sourozenců ve věku 22 let (bratr), resp. 19 let (sestra) zahájena perorální léčba derivátem sulfonylurey glibenklamidem v dávce 1,25 mg/den (bratr) resp. 7,5 mg/den (sestra) a ukončeno podávání inzulinu. Hladina HbA1c po 3 měsících léčby glibenklamidem sice zůstala u bratra nízká, ale frekvence hypoglykemií kupodivu poklesla, u sestry došlo k významnému snížení HbA1c z 10,9 % na 10 % (po 2 měsících léčby glibenklamidem). Převod z parenterální na perorální medikaci vedl nepochybně ke zlepšení kvality života a dokonalejší metabolické kontrole. Molekulárně-genetická diagnostika může u těchto pacientů otevřít cestu k léčbě přinášející vyšší kvalitu života a lepší metabolickou kontrolu, i když její dlouhodobé účinky a bezpečnost bude nutné ověřit.
Klíčová slova:
MODY 3 diabetes - terapie - metabolická kontrola - glibenklamid - kvalita životaÚvod
MODY 3 je autozomálně dominantně dědičná forma diabetes mellitus způsobená mutacemi genu HNF-1α, který je umístěn na dlouhém raménku 12. chromozomu. Produktem tohoto genu je transkripční faktor HNF-1α (hepatocytární nukleární faktor), který je nezbytný pro funkci transkripční regulační sítě β-buněk [1,2]. Podle kvalifikovaných odhadů představují pacienti se všemi formami MODY diabetu 2-5 % z celkového počtu diabetických pacientů, což může představovat až 35 000 nemocných v ČR. Ze skupiny MODY diabetu reprezentuje typ 3 v různých zemích 21 % (Francie) až 64 % (Velká Británie, Spojené státy americké) a zdá se být nejčastějším typem MODY diabetu [3,4]. V České republice může na základě těchto údajů žít 7 000-24 500 pacientů s MODY 3.
Klinická manifestace se poněkud liší nejen mezi rodinami, ale také mezi členy jedné rodiny. Penetrance MODY 3 je silná, ale není kompletní a na fenotypu se podílejí ještě další faktory genetické [5] či faktory zevního prostřední, např. inzulinová rezistence z důvodu váhového přírůstku či během těhotenství [6].
Symptomy MODY 3 jsou také variabilní. Nejčastěji se MODY 3 manifestuje po pubertě (22-26 let) u štíhlých lidí (BMI < 25 kg/m2), bez známek metabolického syndromu. Objevují se osmotické příznaky z hyperglykemie, bez rozvoje ketoacidózy (ev. jen s mírnou ketoacidózou) [3]. Na diabetes mellitus typu MODY 3 je tedy vhodné myslet v případě mladého pacienta s hyperglykemií, bez ketoacidózy a se sugestivní rodinnou anamnézou charakteru autozomálně dominantní dědičnosti (optimálně přítomnost diabetu ve 3 generacích) [3,4,7].
Diferenciálně diagnosticky bychom měli vyloučit diabetes mellitus 1. typu (screeningem autoprotilátek), diabetes mellitus 2. typu a sekundární diabetes (na základě anamnézy a určitých klinických a laboratorních parametrů). Vhodnými diferenčními kritérii mezi MODY 3 a diabetem 2. typu mohou být mimo jiné normální hladiny triacylglycerolů a absence hypertenze u pacientů s MODY 3 [8,9].
Mezi mladými diabetickými pacienty s negativními autoprotilátkami (anti-GAD a anti-IA2) bylo zjištěno 5-10 % MODY 3 [9]. V dánské studii z 39 pacientů s předpokládaným diabetem 1. typu bez rizikového genotypu (nepřítomnost HLA DR3, DR4) a pozitivní rodinnou anamnézou diabetu měli 4 pacienti mutaci HNF-1α [10].
U pacientů s MODY 3 se často vyskytují mikrovaskulární komplikace. S ohledem na dobu trvání diabetu a úroveň glykemické kontroly je prevalence specifických komplikací u pacientů s MODY 3 srovnatelná jako u osob s diabetem 1. či 2. typu [11]. Makrovaskulární komplikace se naopak vyskytují s menší četností než při diabetu 2. typu [3,4,11].
Terapie pacientů s MODY 3 není dosud standardizovaná. Ve studii Hattersleyho čítající 100 pacientů s MODY 3 byla třetina léčena pouze dietou, třetina deriváty sulfonylurey a třetina inzulinem [12]. Ovšem mladí pacienti s MODY 3 diabetem jsou dosud obvykle léčeni intenzifikovaným inzulinovým režimem. Některé zahraniční studie prokázaly bezpečnost a účinnost terapie glibenklamidem (s naprostým vynecháním inzulinové léčby), která také vede ke zlepšení spolupráce pacientů a zvyšuje kvalitu jejich života [13,14,15]. Studie českých autorů hodnotící kvalitu života u pacientů s diabetem jednoznačně ukázala nižší kvalitu života všech diabetických pacientů bez ohledu na typ diabetu, pokud jsou léčeni inzulinem [16].
MODY 3 typ diabetu je charakterizován sníženou bazální a glukózou stimulovanou sekrecí inzulinu [6,17], zatímco inzulinová odpověď na deriváty sulfonylurey (glibenklamid, gliburid, tolbutamid, gliklazid) je dobře zachována [1,14,18,19,20].
Patogenetické mechanizmy MODY 3 typu diabetu vyplývají z porušené funkce mutantního transkripčního faktoru HNF-1α, který se exprimuje v buňkách pankreatických ostrůvků, jater, ledvin a tenkého střeva. Dysfunkce β-buňky u pacientů s MODY 3 způsobuje poruchu glukózou stimulované sekrece inzulinu, jež vede k chronické hyperglykemii. Uplatňuje se také následné snížení exprese GLUT 2 a některých glykolytických enzymů v β-buňkách v důsledku selhání transkripční regulační sítě [21,22].
Přes výrazně sníženou inzulinovou odpověď na stimulaci glukózou je dokumentovaná dobře zachovaná inzulinová odpověď na deriváty sulfonylurey (glibenklamid), která je teoretickým předpokladem pro úspěšnou léčbu pacientů s MODY 3 tímto perorálním antidiabetikem. Deriváty sulfonylurey zvyšují sekreci inzulinu z β-buněk prostřednictvím vazby na SUR1 receptor, podjednotku ATP dependentního kaliového kanálu [23]. Podstatou dobré účinnosti glibenklamidu u nosičů mutantní alely pro HNF-1α je pravděpodobně zachovalá citlivost vůči účinkům inzulinu u těchto jedinců a může se též uplatňovat vyšší účinek glibenklamidu při jeho zvýšené hladině z důvodu snížené hepatální clearance [18,19].
Kazuistika
Uvádíme kazuistiku mladého sourozeneckého páru - sestry (*1985) a bratra (*1982) s MODY 3 typem diabetu. Genealogické šetření prokázalo výskyt diabetu ve 3 generacích rodiny. Prarodiče z otcovy strany měli oba diagnostikován diabetes mellitus před 40. rokem, oba byli léčeni perorálními antidiabetiky, sestra otce má také diabetes a je léčena perorálními antidiabetiky. Sestřenice sourozeneckého páru byla od 15 let léčena intenzifikovaným inzulinovým režimem. Na základě detekce mutace HNF-1α genu (Arg200Gly) molekulárně genetickým vyšetřením byl u všech sledovaných členů rodiny diabetes překlasifikován na MODY 3. Otec našich probandů je jistě nositelem mutace, pro vyšetření však nebyl k dispozici. Proto je v rodokmenu je vyznačen pouze šrafovaně (obr. 1).
Obr. 1. Rodokmen. 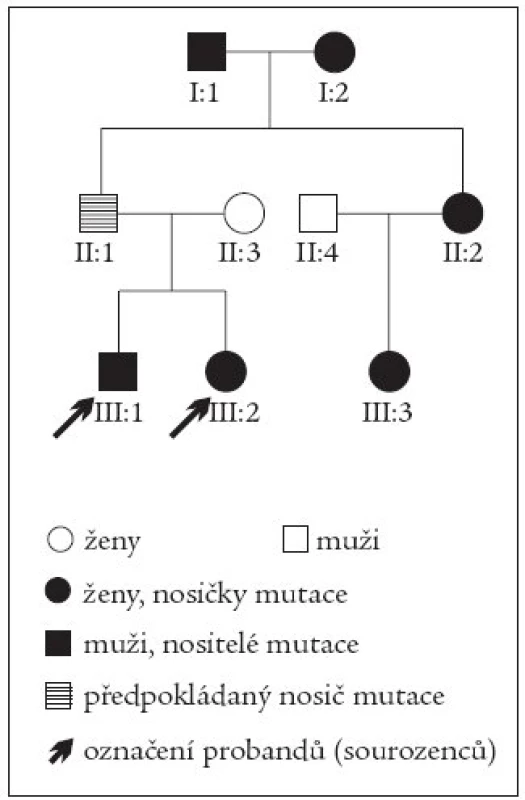
Genealogické šetření v rodině sourozenců prokázalo výskyt diabetu ve 3 generacích (prarodiče z otcovy strany, sestra otce a její dcera). Molekulárně geneticky byla u všech sledovaných členů prokázána mutace HNF-1α genu (Arg200Gly). Otec našich probandů je jistě nositelem mutace, protože však nebyl k dispozici pro vyšetření, je v rodokmenu je vyznačen pouze šrafovaně. Diabetes mellitus se u sestry manifestoval ve věku 15 let v časové koincidenci s krátkodobou léčbou Prednisonem pro infekční mononukleózu. Projevil se osmotickými příznaky (hyperglykemií a glykosurií), bez známek diabetické ketoacidózy. Léčba intenzifikovaným inzulinovým režimem byla od počátku vlivem nespolupráce pacientky problematická, přetrvávaly významné hyperglykemie vedoucí k neuspokojivé kompenzaci diabetu (tab. 1).
Tab. 1. Přehled vývoje HbA1c jako ukazatele kompenzace diabetu sestry v letech 2000–2003. 
Záhy došlo k rozvoji specifických mikrovaskulárních komplikací. Incipientní diabetická nefropatie s přetrvávající mikroalbuminurií a neproliferativní diabetická retinopatie byly diagnostikovány již po dvou letech trvání diabetu. V tomtéž roce potvrdilo EMG vyšetření diagnózu lehké distální senzorimotorické neuropatie. Největší terapeutický problém představovala recidivující a špatně se hojící kožní komplikace - rozpadlá a infikovaná nekrobióza levého bérce, která si vyžádala transplantaci kožního štěpu 3 roky po zjištění diabetu.
Z provedených antropometrických vyšetření (srpen roku 2004) jsou k diagnóze MODY 3 diabetu relevantní: BMI v pásmu normy (20,8 kg/m2, hmotnost 58 kg, výška 167cm) a normotenze (TK 120/70 mm Hg). Z laboratorních výsledků zaujme nativní hladina C-peptidu 187 pmol/l, tedy hluboce pod pásmem normy (90-1320 pmol/l), negativní autoprotilátky anti-GAD a anti-IA2, normální lipidogram (celkový cholesterol 3,95 mmol/l, HDL-cholesterol 1,44 mmol/l a triacylglyceroly 0,85 mmol/l), alarmující je glykemický profil: 12,9-12,5-16,1-14,7 mmol/l) a hladina HbA1c 10,9 % dle IFCC (norma HbA1c u léčených diabetiků je < 6 %).
Na základě literárních údajů o úspěšnosti terapie deriváty sulfonylurey u pacientů s MODY 3 jsme pacientku v srpnu roku 2004 (4 roky po stanovení diagnózy diabetu) převedli na perorální terapii glibenklamidem v dávce 7,5 mg/den (5 mg-0-2,5 mg). Změna terapie byla provedena za hospitalizace s pečlivou monitorací acidobazické rovnováhy (bez rozvoje acidózy) a ketolátek v moči (negativní). Současně došlo ke zvýšení hladiny C-peptidu do pásma normy (1152 pmol/l).
Při léčbě glibenklamidem došlo po 2 měsících ke zlepšení kompenzace diabetu (glykemický profil 9,6-4,7-10,7-8,5 mmol/l, HbA1c 10 % dle IFCC). Porovnání glykemických profilů, hladiny HbA1c a C-peptidu při léčbě inzulinem a glibenklamidem je shrnuto v tab. 2.
Tab. 2. Srovnání hodnot C-peptidu, glykemického profilu a HbA1c sestry při léčbě inzulinem a glibenklamidem. 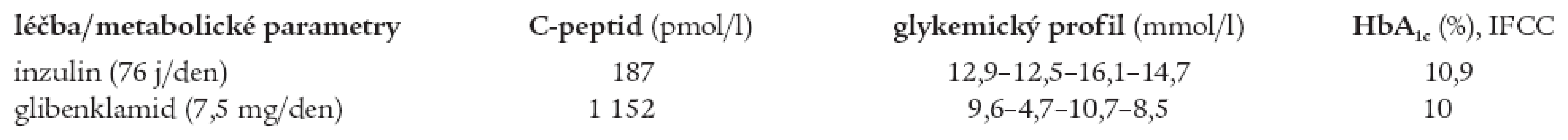
Další průběh byl komplikován recidivou nekrobiózy bérce s nutností antibiotické terapie (leden roku 2005). Během terapeutické hospitalizace byla pacientka převedena na intenzifikovaný inzulinový režim. Po zhojení defektu se pacientka opět vrátila k léčbě glibenklamidem v původní dávce, její spolupráce zůstala bohužel i nadále velmi špatná, kompenzace diabetu vyjádřená hodnotou HbA1c je sice téměř o 1 % lepší než při léčbě inzulinem, ovšem stále neuspokojivá (HbA1c 10 %).
U bratra naší pacientky byl diabetes mellitus zjištěn ve věku 18 let náhodně záchytem glykosurie (rok 2000). Na základě orálně glukózového tolerančního testu (oGTT) byla u našeho pacienta nejprve diagnostikována porucha glukózové tolerance, pacient byl dále ponechán na dietní terapii. Vzhledem k přetrvávajícím hyperglykemiím, pozitivní rodinné anamnéze a negativitě autoprotilátek byl po roce odeslán obvodním diabetologem k přesnému určení poruchy sacharidového metabolizmu. oGTT a intravenózní glukózový toleranční test (ivGTT), provedené na pediatrické klinice, ukázaly jasně patologickou křivku: glykemie 12,0 mmol/l ve 120. minutě oGTT a porušená časná fáze inzulinové sekrece se součtem v 1. a 3. minutě ivGTT (tab. 3 a 4). Byla zahájena terapie intenzifikovaným inzulinovým režimem v dávce 32 j/den.
Tab. 3. oGTT bratra s uvedením glykemií, inzulinemií a hladin C-peptidu v minutě 0, 30, 60, 120 a 180. 
Tab. 4. ivGTT bratra s uvedením glykemií, inzulinemií a hladin C-peptidu v minutě 0, 1, 3, 5, 10, 30 a 60. 
Ze specifických mikrovaskulárních komplikací byla roku 2004 diagnostikována incipientní diabetická nefropatie. Z antropometrických parametrů relevantních k diagnóze MODY typu diabetu lze uvést normální BMI (24,2 kg/m2, hmotnost 75 kg, výška 176 cm) a normotenzi (TK 130/80 mm Hg), z laboratorních parametrů normální lipidogram (celkový cholesterol 3,5 mmol/l, HDL-cholesterol 0,95 mmol/l, triacylglyceroly 0,95 mmol/l), normální acidobazické parametry, glykemický profil: 5,5-4,4-5,8-6,8 mmol/l a hladinu C-peptidu pod dolní hranicí normy (256 pmol/l). Kompenzace diabetu při léčbě inzulinem byla velmi těsná (HbA1c 3,3 % dle IFCC), ovšem za cenu opakovaných hypoglykemií několikrát týdně.
Pacienta jsme vzhledem k úspěchu nově zavedené léčby u jeho sestry a s ohledem na vyšší kvalitu života bez nutnosti aplikace inzulinu převedli na terapii glibenklamidem v počáteční denní dávce 1,25 mg/den, která byla po měsíci léčby zvýšena na dosud konečnou dávku 2,5 mg/den.
Po změně terapie zůstala kompenzace diabetu výborná (HbA1c 2,8 % po 3 měsících léčby, při další kontrole 3,3 %), glykemický profil se pohyboval v mezích normy (4,8-3,9-5,5-4,8 mmol/l). Během monitorace při hospitalizaci nebyly při léčbě glibenklamidem zachyceny ketolátky ani změny v acidobazické rovnováze a podle očekávání se zvýšila hladina C-peptidu (791 pmol/l). Porovnání glykemických profilů, HbA1c a hladiny C-peptidu při léčbě inzulinem a glibenklamidem je přehledně shrnuto v tab. 5.
Tab. 5. Srovnání hodnot C-peptidu, glykemického profilu a HbA1c bratra při léčbě inzulinem a glibenklamidem. 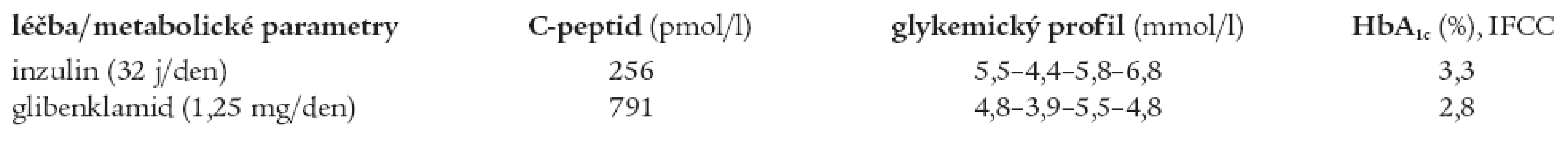
Důležitým aspektem nové léčby bylo i přes velmi těsnou kompenzaci diabetu snížení frekvence hypoglykemií (maximálně 1krát týdně) a zvýšení kvality života (pacientovo hodnocení). Udávaná hladina HbA1c po prvních 3 měsících léčby je velmi nízká, vzhledem k poklesu frekvence hypoglykemií nelze vyloučit, že se jednalo o laboratorní chybu. Při další kontrole již hladina HbA1c dosáhla 3,3 % a frekvence hypoglykemií se nezměnila.
Závěr
Kazuistika mladého sourozeneckého páru dokazuje význam molekulárně genetického vyšetření pro životní osudy konkrétních pacientů. Přesná diagnostika typu diabetu, založená na molekulárně genetických metodách, a evidence-based medicine, prokazující dlouhodobou bezpečnost a účinnost terapie deriváty sulfonyulrey u pacientů s MODY 3, umožnila převést mladé diabetiky z terapie intenzifikovaným inzulinovým režimem na léčbu glibenklamidem.
Změna terapie vedla ke zlepšení kvality života našich pacientů, aniž došlo ke zhoršení kompenzace jejich diabetu.
Práce byla podpořena VZ MSM 0021620814 a grantem IGA MZ ČR č. 7420-3/2003.
MUDr. Ludmila Brunerová
www.fnkv.cz
e-mail: brunerova@seznam.cz
Doručeno do redakce: 11. 10. 2005
Přijato po recenzi: 10. 1. 2006
Zdroje
1. Yamagata K, Oda N, Kausami PJ et al. Mutations in the hepatocyte nuclear factor-1α gene in maturity-onset diabetes of the zouny (MODY 3). Nature 1996; 384 : 455-458.
2. Brunerová L, Brož J, Průhová Š et al. Maturity-onset diabetes of the young 3. DMEV 2006; (rukopis).
3. Timsit J, Bellanné-Chantelot Ch, Dubois-Laforgue D et al. Diagnosis and management of Maturity-Onset Diabetes of the Young. Treat Endocrinol 2005; 4 : 9-18.
4. Mitchell S, Frayling T. The role of transcription factors in maturity-onset diabetes of the young. Mol Genet Metab 2002; 77 : 35-43.
5. Kim SH, Ma X, Klupa T et al. Genetic modifiers of the age at diagnosis of diabetes (MODY 3) in carriers of HNF-1α mutations map to chromosomes 5p15, 9q22 and 14q24. Diabetes 2003; 52 : 2182-2186.
6. Lehto M, Tupni T, Mahtani MM et al. Characterization of the MODY 3 phenotype: early onset diabetes caused by an insulin secretion defect. J Clin Invest 1997; 99 : 582-591.
7. Klimeš I, Gašperíková D, Michálek J. DNA diagnostika monogennych foriem diabetu na Slovensku: január 2005. DMEV 2005; 8 : 27.
8. Owen KR, Shepherd M, Stride A et al. Heterogenity in young adult onset diabetes - aetiology alters clinical characteristics. Diabet Med 2002; 19 : 758-761.
9. Owen KR, Stride A, Ellard S et al. Etiological investigation in young adults presenting with apparent type 2 diabetes. Diabetes Care 2003; 26 : 2088-2093.
10. Moller AM, Dalgaard LT, Pociot F et al. Mutations in the hepatocyte nuclear factor 1-α gene in Caucasian families originally classified as having type 1 diabetes. Diabetologia 1998; 41 : 1528-1531.
11. Isomaa B, Henricsson M, Lehto M et al. Chronic diabetic complications in patients with MODY 3 diabetes. Diabetologia 1998; 41 : 467-473.
12. Hattersley AT. Maturity onset diabetes of the young: clinical heterogenity explained by genetic heterogenity. Diabet Med 1998; 15 : 15-24.
13. Shepherd M, Hattersley A. I don´t feel like a diabetic any more: the impact of stopping insulin in patients with maturity-onset diabetes of the young following genetic testing. Clin Med 2004; 4 : 144-147.
14. Pearson E, Starkey B, Powell R et al. Genetic cause of hyperglycaemia and response to treatment in diabetes. Lancet 2003; 362 : 1275-1281.
15. Shepherd M, Pearson E, Houghton J et al. No deterioration in glycaemic control in HNF-1α Maturity-Onset Diabetes of the Young following transfer from long-term insulin to sulphonylureas. Diab Care 2003; 26 : 3191-3192.
16. www.dawnstudy.com
17. Vaxillaire M, Pueyo ME, Clément K et al. Insulin secretion and insulin sensitivity in diabetic and non-diabetic subjects with HNF-1α mutations. Eur J Endocrinol 1999; 141 : 609-618.
18. Pearson E, Liddell W, Shepherd M et al. Sensitivity to sulphonylureas in patients with HNF-1α gene mutations: evidence for pharmacogenetics in diabetes. Diabet Med 2000; 17 : 543-545.
19. Boileau P, Wolfrum Ch, Shih D et al. Decreased glibenclamide uptake in hepatocytes of HNF-1α defficient mice. Diabetes 2002; 51: S343-S348.
20. Sagen JV, Pearson ER, Johansen A et al. Preserved insulin response to tolbutamide in HNF-1alpha mutation carriers. Diabet Med 2005; 22 : 406-409.
21. Yamagata K, Nammo T, Moriwaki M et al. Overexpression of dominant-negative mutant HNF-1α in pancreatic β-cells causes abnormal islet architecture with decreased expression of E-cadherin, reduced β-cell proliferation and diabetes. Diabetes 2002; 51 : 114-123.
22. Richter S, Shih D, Pearson E et al. Regulation of apolipoprotein M gene expression by MODY3 gene hepatocyte nuclear factor-1alpha: haploinsufficiency is associated with reduced serum apolipoprotein M levels. Diabetes 2003; 52 : 2989-2995.
23. Dunne M, Cosgrove K, Shepherd M et al. Potassium channels, sulphonylurea receptors and control of insulin release. Trends Endocrinol Metab 1999; 10 : 146-152.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2006 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- PET - možnosti a limitace - editorial
- Molekulární biologie a diabetes: kam teď? - editorial
- Přínos fluorodeoxyglukózové pozitronové emisní tomografie (FDG-PET) u mnohočetného myelomu
- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Vliv vysokodávkované chemoterapie s následnou transplantací krvetvorných buněk na funkci levé komory srdeční u nemocných s maligními lymfomy léčenými doxorubicinem v primární chemoterapii
- Srovnání sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Neinvazivní ventilační podpora u pacientů s akutní exacerbací chronické obstrukční plicní nemoci (CHOPN)
- Asymetrický dimetylarginin - nový rizikový faktor kardiovaskulárních onemocnění
- Imunoglobulin A a choroby ledvin
- Hypertenze v těhotenství
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
- Jak vidí endokrinologové profesora MUDr. Josefa Marka, DrSc.
- Když přišel Josef Marek před 40 lety na 3. interní kliniku
- I. Žucha, I. Hulín: Myšlienky. Bratislava: Slovak Academic Press 2006. 255 stran. ISBN 80-89104-75-4.
- Sninčák M. Artériová hypertenzia: súčasné klinické trendy. Košice: TypoPress 2005. 284 stran. ISBN 80-89089-39-9.
- Hoffmann GF et al. Dědičné metabolické poruchy. Praha: Grada 2005. 416 stran. ISBN 80-247-0831-0.
- 130. internistický den v Olomouc věnovaný revmatologii
- Sdělení výboru České internistické společnosti
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Imunoglobulin A a choroby ledvin
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



