-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv vysokodávkované chemoterapie s následnou transplantací krvetvorných buněk na funkci levé komory srdeční u nemocných s maligními lymfomy léčenými doxorubicinem v primární chemoterapii
Effect of high-dose chemotherapy with subsequent transplantation of blood-forming cells on left ventricle function in patients with malignant lymphomas treated with doxorubicin in primary chemotherapy
Purpose of study:
The authors examined whether high-dose chemotherapy with hematogenic tissue transplantation might negatively affect function of left ventricle (LV) in oncology patients with malignant lymphomas initially treated with conventional chemotherapy consisting of doxorubicin (DOX) in contrast to patients treated without the transplantation in medium - term follow up.Patients and methodology:
The follow up group included 77 patients (39 women/38 men) at the age of 36 ± 15 (median 30, 16–67 years). All 77 patients were treated with initial chemotherapy with DOX, 22 out of that group later received high-dose chemotherapy with hematogenic tissue transplantation (HTT). 16 (73 %) patients of this subgroup underwent autologous transplantation and 5 (23 %) allogeneic transplantation. One female patient (4 %) underwent both autologous and allogeneic transplantation. The follow up period after completion of initial chemotherapy was 5–10 years (median 6 years). The patients were examined with rest echocardiography before start, after chemotherapy, and during follow-up examination. Spiroergometric test (SET) was only performed at the follow-up examination.Results:
Both subgroups showed significant decrease of ejection fraction (EF) after chemotherapy, with further decrease in the control examination period, without mutual difference. While the HTT (HTT+) group showed no EF drop below 50 %, in the non-HTT (HTT–) group EF dropped in two (4 %) patients after chemotherapy and in four (8%) patients at the control examination. Progressing decrease of EF > 10 % was reported with 25 % of the HTT – patients (p < 0.05), but with just 13 % of the HTT+ patients (non-significant). The diastolic insufficiency (DF) was present identically in both groups with 36 % of the patients, which represents a statistically significant increase in comparison to the pre-chemotherapy condition. SET did not show any differences in burden toleration and circulation indicators between the two groups. The drop of pVO2 < 20 ml/kg/min occurred with 22 patients of both groups. Linear regression data analysis revealed existence of a significant relationship between EF change, some diastolic function indicators, pVO2 and cumulative dose of DOX (p < 0.05). The current age significantly and negatively correlated with pVO2 (p < 0.001) and DF indicators (p < 0.001). The follow up period inversely correlates with the changes of EF (p < 0.05) and pVO2 (p < 0.05), not correlating with diastolic function indicators. Multi-variant analysis did not confirm any higher risk of administration of highdose chemotherapy with HTT for significant drop of EF or its drop down to the pathological zone below 50 % (OR = 0.46; nonsignificant), for discovery of reduced cardio-pulmonary performance (pVO2 < 20 ml/kg/min) (OR = 0.35; non-significant) or for development of diastolic dysfunction (OR = 1.0; non-significant).Conclusions:
Treatment with high-dose chemotherapy with HTT application within medium-term follow up does not result in any significant systolic or diastolic malfunction of myocardium and deterioration of cardiopulmonary performance in comparison to patients not undergoing this therapy. Treatment with cardiotoxic doxorubicin administered in the context of basic conventional chemotherapy is most likely to be responsible for occurrence of the pathological effects across the followed up group. Length of monitoring is a significant factor correlating with changed ejection fraction. This finding justifies the need for long-term prospective monitoring of ejection fraction of the left ventricle in adult patients treated with cardiotoxic chemotherapy.Key words:
cardiotoxicity – high-dose chemotherapy – hematogenic tissue transplantation
Autoři: L. Elbl 1; I. Vášová 2; M. Krejčí 2; M. Navrátil 2; I. Tomášková 1; F. Jedlička 1; V. Chaloupka 1; J. Mayer 2; J. Vorlíček 2
Působiště autorů: Oddělení funkčního vyšetřování FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Václav Chaloupka, CSc. 1; Interní hematoonkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 2
Vyšlo v časopise: Vnitř Lék 2006; 52(3): 221-231
Kategorie: Původní práce
Souhrn
Cíl práce:
Autoři si dali za úkol zjistit, zda vysokodávkovaná chemoterapie s podporou transplantace krvetvorné tkáně může po středně dlouhé době sledování 5-10 let negativně ovlivnit funkci levé komory srdeční (LK) u onkologických nemocných léčených pro maligní lymfomy iniciálně konvenční chemoterapií s doxorubicinem (DOX) oproti nemocným, kteří byli léčeni bez transplantace.Soubor nemocných a metodika:
Do sledování bylo zařazeno 77 nemocných (39 žen/38 mužů)ve věku 36 ± 15 let (medián 30, 16-67 let). Konvenční iniciální chemoterapií s DOX bylo léčeno všech 77 nemocných, z toho 22 nemocným byla podána v dalším průběhu vysokodávkovaná chemoterapie za podpory transplantace krvetvorné tkáně (TKT). U 16 (73 %) nemocných z této podskupiny byla provedena autologní a u 5 (23 %) alogenní transplantace. U jedné pacientky (4 %) byla provedena autologní i alogenní transplantace. Doba sledování od ukončení iniciální chemoterapie byla 5-10 let (medián 6 let). Nemocní byli vyšetřeni klidovou echokardiografií před zahájením chemoterapie, po jejím ukončení a při kontrolním vyšetření. Spiroergometrické vyšetření (SEM) bylo provedeno jen při kontrolním vyšetření.Výsledky:
V obou podskupinách došlo k významnému poklesu ejekční frakce (EF) po ukončení iniciální chemoterapie s dalším poklesem v období kontrolního vyšetření, ale bez vzájemného rozdílu. Ve skupině s TKT (TKT+) nedošlo u žádného nemocného k poklesu EF pod 50 %, zatímco ve skupině bez TKT (TKT-) u dvou (4 %) nemocných po chemoterapii a při kontrolním vyšetření u čtyř (8 %) nemocných. Progredující pokles EF > 10 % byla zaznamenám u 25 % nemocných TKT - (p < 0,05), ale jen u 13 % nemocných TKT+ (n.s.). Porucha diastolické funkce (DF) byla přítomna shodně v obou skupinách u 36 % nemocných, což představuje statisticky významný nárůst ve srovnání se stavem před chemoterapií. SEM nevykázala rozdíly v toleranci zátěže ani oběhových ukazatelích mezi skupinami. Pokles pVO2 < 20 ml/kg/min byl v obou skupinách u 22 % nemocných. Lineární regresní analýza dat ukázala, že existuje významný vztah mezi změnou EF, některými ukazateli diastolické funkce, pVO2 a kumulativní dávkou DOX (p < 0,05). Aktuální věk významně a negativně koreluje s pVO2 (p < 0,001) a ukazateli DF (p < 0,001). Doba sledování inverzně koreluje se změnou EF (p < 0,05) a pVO2(p < 0,05), ale nekoreluje s ukazateli diastolické funkce. Multivariační analýza nepotvrdila vyšší riziko podání vysokodávkované chemoterapie s TKT pro významné snížení EF nebo její pokles do patologického pásma pod 50 % (OR = 0,46; n.s.), pro nález snížené kardiopulmonální výkonnosti (pVO2< 20 ml/kg/min) (OR = 0,35; n.s.) nebo pro vývoj diastolické dysfunkce (OR = 1,0; n.s.).Závěry:
Léčba vysokodávkovanou chemoterapií s podáním TKT v období středně dlouhého sledování nevede k významnější poruše systolické, diastolické funkce myokardu a ke zhoršení kardiopulmonální výkonnosti ve srovnání s nemocnými, kteří tuto léčbu nepodstoupili. Léčba kardiotoxickým doxorubicinem podaným v základní konvenční chemoterapii je s největší pravděpodobností zodpovědná za výskyt zjištěných patologických nálezů v celé skupině sledovaných nemocných. Délka monitorování je významným faktorem korelujícím se změnou ejekční frakce. Tento nález zdůvodňuje nutnost dlouhodobého prospektivního monitorování ejekční frakce LK u dospělých nemocných léčených kardiotoxickou chemoterapií.Klíčová slova:
kardiotoxicita - vysokodávkovaná chemoterapie - transplantace krvetvorné tkáněÚvod
Doxorubicin je vysoce účinným cytostatikem, které je součástí základních léčebných režimů u nemocných s maligními lymfomy. U nemocných s ne-hodgkinským lymfomem je součástí nejužívanějšího režimu CHOP (cyklofosfamid, doxorubicin, vinkristin a prednison), u nemocných s Hodgkinovou nemocí je součástí režimu ABVD (doxorubicin, bleomycin, vinblastin a dakarbazin) a BEACOPP (bleomycin, etoposid, doxorubicin, cyklofosfamid, vinkristin, prokarbazin, prednison). Subklinická a klinická kardiotoxicita obou režimů byla v literatuře již popsána [1-6]. Pro nemocné s nedostatečnou léčebnou odpovědí na základní terapii nebo s progresí či relapsem po navození remise je standardní léčebnou možností podání vysokodávkované chemoterapie za podpory autologní či alogenní transplantace krvetvorné tkáně (TKT). Zavedení tohoto léčebného postupu zlepšilo léčebné výsledky u vybraných skupin pacientů s řadou onkologických diagnóz, maligní lymfomy nevyjímaje [7]. Kardiotoxicita tohoto léčebného postupu se vyskytuje jednak v souvislosti s procesem podání štěpů, ale zejména s souvislosti s podáním vysokodávkované chemoterapie. I když se postupně redukovala intenzita těchto režimů, aby se zmírnila jejich celková toxicita, kardiální komplikace byly popsány v řadě studií. Jejich incidence se pohybuje mezi 0-43 % s 9% mortalitou [8]. Navíc kardiotoxicitu transplantace může teoreticky podpořit předchozí podání antracyklinů v konvenční chemoterapii, i když přesvědčivé důkazy nemáme prozatím k dispozici.
V předložené práci jsme si dali za úkol zjistit, zda vysokodávkovaná chemoterapie s podporou transplantace krvetvorné tkáně může po středně dlouhé době sledování 5-10 let negativně ovlivnit funkci levé komory srdeční (LK) u nemocných léčených pro maligní lymfomy iniciálně konvenční chemoterapií s doxorubicinem (DOX) oproti nemocným, kteří byli léčeni bez transplantace.
Soubor nemocných
Do studie jsme zařadili nemocné, kteří byli přijati k léčbě na Interní hematoonkologickou kliniku LF MU a FN Brno, pracoviště Bohunice, s diagnózou maligní ne-Hodgkinův lymfom (NHL) nebo Hodgkinův lymfom (HL) v letech 1996-2000. Celkově bylo do sledování zařazeno 77 nemocných (39 žen/38 mužů) ve věku 36 ± 15 let (medián 30, 16-67 let). Konvenční iniciální chemoterapií bylo léčeno všech 77 nemocných, z toho 22 nemocným byla podána v dalším průběhu vysokodávkovaná chemoterapie za podpory TKT. Podání této léčby bylo indikováno z důvodu relapsu onemocnění, nedosažení remise nebo u vysoce rizikových pacientů. U 16 (73 %) nemocných z této podskupiny byla provedena autologní a u 5 (23 %) alogenní transplantace. U jedné pacientky (4 %) byla provedena autologní i alogenní transplantace. Charakteristika podskupin je uvedena v tab. 1. Podskupiny se nelišily ve věku, pohlaví, BMI (body mass index), době sledování a v zastoupení jednotlivých onkologických diagnóz. V konvenční iniciální chemoterapii byly podány celkové kumulativní dávky (KD) doxorubicinu bez statisticky významného rozdílu mezi podskupinami, stejně tak nebyl nalezen rozdíl v dávce ozáření mediastina a v počtu nemocných, kteří byli takto léčeni. Přítomnost doprovodných onemocnění, která mohou negativně ovlivnit funkci myokardu LK, je minimální a mezi podskupinami statisticky nevýznamná. Kardioprotektivní léčba vůči kardiotoxicitě doxorubicinu nebyla podána žádnému nemocnému.
Tab. 1. Charakteristika podskupin. 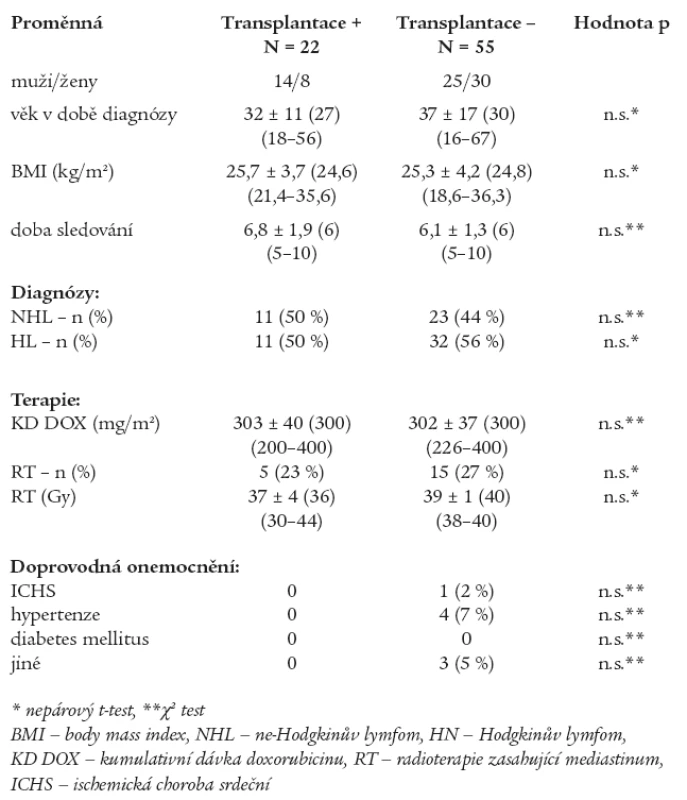
Zařazovací kritéria
Do studie byli zařazeni nemocní, kteří byli léčeni základním režimem s doxorubicinem. Dále ti, u kterých bylo provedeno echokardiografické vyšetření před iniciální konvenční léčbou a po ní, u kterých se dala kvalitně vyhodnotit funkce LK. Předpokladem byl též zachovalý sinusový rytmus. V době kontrolního vyšetření byli nemocní v remisi onemocnění, tedy neprobíhala žádná onkologická léčba minimálně půl roku před vyšetřením. Nikdo z nemocných nebyl sledován pro chronický anemický syndrom po terapii v době kontrolního vyšetření.
Nemocní v podskupině s TKT byli pozváni ke kompletnímu kardiologickému vyšetření po ukončení primární léčby za období 6,8 ± 1,9 let (medián 6; 5-10 let) a nemocní bez TKT za 6,1 ± 1,3 let (medián 6; 5-10 let) (n.s.). Během jednoho dne bylo provedeno základní klinické vyšetření, klidové echokardiografické vyšetření a spiroergometrie (SEM).
Metodika
Léčebné protokoly primární konvenční chemoterapie
Pacienti s diagnostikovaným HL byli léčeni základním režimem ABVD (doxorubicin 25 mg/m2 i.v. v den 1 a 15, bleomycin 10 mg/m2 i.v. v den 1 a 15, vinblastin 6 mg/m2 i.v. v den 1 a 15 a dakarbazin 375 mg/m2 i.v. v den 1 a 15).
Pro léčbu NHL byl použit režim CHOP (cyklofosfamid 750 mg/m2 i.v. v den 1, doxorubicin 50 mg/m2 i.v. v den 1, vinkristin 1,4 mg/m2 i.v. v den 1 a prednison 100 mg/m2 p.o. v den 1 - 5) [9,10].
Přípravné režimy před podáním TKT
Pro vysokodávkovanou chemoterapii před podáním alogenního štěpu byl použit režim BuCy2 (busulfan 14 mg/kg p.o. v den -7 až -4, cyklofosfamid 120 mg/kg i.v. ve dvou dávkách po 60 mg/kg v den -3 až -2), popřípadě nemyeloablativní přípravný režim (protokol dle Slavina et al: fludarabin 30 mg/m2/den i.v. ve dny -10 až -5, busulfan 8 mg/kg p.o. ve dny -6 až -5 a ATG Fresenius - antilymfocytární imunoglobulin - 10 mg/kg/den i.v. v dny -4 až -1). Před podáním autologního štěpu byl použit přípravný režim BEAM (carmustin BCNU 330 mg/m2 i.v. v den -7, cytosar 1000 mg/m2 i.v. v den -6 až -3, vepesid 1000 mg/m2 v den -6 až -3 a alkeran 140 mg/m2 i.v. v den -2) [7,11]. K podání štěpu krvetvorné tkáně došlo na aseptické jednotce v den 0 po předchozím podání vysokodávkované chemoterapie dle uvedeného schématu. Nemocným s autologní transplantací byly podány periferní kmenové buňky, u nemocných s alogenní transplantací byly podány periferní kmenové buňky od HLA identického sourozence. Zamrazené autologní štěpy byly aplikovány frakcionovaně i.v. s ohledem na toleranci pacientem, nezamrazené alogenní štěpy byly aplikovány pomalou i.v. infuzí za monitorování vitálních funkcí.
Echokardiografické vyšetření
Klidové echokardiografické vyšetření bylo provedeno na přístrojích ATL HDI 3000 nebo HDI 5000 SonoCT dle doporučení ASE [12]. Vyšetření bylo provedeno před zahájením konvenční chemoterapie, po jejím ukončení a další v kontrolním období 5 a více let. Jako ukazatel systolické funkce LK byla hodnocena ejekční frakce, která byla vypočtena metodou dle Simpsonova pravidla. K hodnocení diastolické funkce (DF) LK byla použita standardní metoda pulzní dopplerovské echokardiografie měřící parametry diastolického plnění LK z transmitrálního průtoku. Byly vyhodnoceny ukazatelé: index E/A obou rychlostí diastolického plnění, DT jako doba poklesu rychlosti časného plnění E k nulové linii a izovolumická relaxační perioda (IRP). Porucha DF byla definována jako porucha relaxace, pseudonormální typ plnění a restrikční typ plnění. Pro diagnózu pseudonormálního plnění bylo použito vyšetření toku v plicních žilách [12].
Spiroergometrické vyšetření
Spiroergometrické vyšetření (SEM) bylo provedeno na přístroji Oxycon Delta Jaeger pouze při kontrolním vyšetření po 5 a více letech sledování. Pacienti byli zatíženi rampovým testem 20 W/1 min do subjektivního maxima či vzniku symptomů. Stanovili jsme hodnotu vrcholového příjmu kyslíku (pVO2), metabolického ekvivalentu (MET), hodnotu tepového kyslíku (TF-O2). Dále jsme získali hodnoty zátěžové tolerance (TZ), klidové a vrcholové hodnoty tepové frekvence (TF) a krevního tlaku (TK). Hodnoty pVO2 < 20 ml/kg/min jsme považovali za patologicky snížené. Před testem a bezprostředně po něm bylo provedeno funkční vyšetření plic metodou průtok-objem k vyloučení vlivu poruchy plicní funkce na měřené parametry. Saturace kyslíku byla měřena nepřímo digitálním oxymetrem [13,14].
Diagnostika kardiotoxicty
Diagnostika kardiotoxicity se opírala o laboratorní kritéria (subklinická) a klinické příznaky. Klinická kardiotoxicita byla charakterizována známkami srdečního selhávání.
Laboratorní kritéria se opírala o nález vývoje poklesu EF LK > 10 % ve srovnání se vstupní hodnotou, a to i tehdy, když byl tento pokles zaznamenán ve fyziologickém pásmu hodnot EF. Všechny změny EF byly hodnoceny v kontextu aktuální TF a hodnot objemů LK. Jako patologickou hodnotíme v naší laboratoři EF pod 50 %. Hodnota 50-54 % je brána jako dolní hranice normy a hodnoty EF ≥ 55 % jako fyziologické. Za významný hodnotíme pokles již o 5 %, pokud současně poklesne EF pod hodnotu 50 %. U nemocných se vstupní hodnotou EF < 50 % je brán pokles EF ≥ 5 % taktéž jako významný.
Jako vedlejší kritérium byla hodnocena porucha DF, a to jen na základě současného patologického nálezu všech tří komponent charakterizujících plnění LK opět s ohledem na hodnoty TF.
Ukazatele naměřené při SEM jsme považovali jen za doplňující, které nás informovaly pouze o aktuální kardiopulmonální výkonnosti pacientů.
Statistická analýza dat
Předložené výsledky jsou uvedeny jako průměr ± 1 SD, relativní četnost, interval a medián. Naměřené ukazatele byly srovnány párovým a nepárovým Studentovým t-testem. Neparametrické hodnoty byly testovány χ2 testem. Vztahy mezi proměnnými jsme vyhodnotili lineární regresní analýzou a multiregresní analýzou dat. Hodnoty p < 0,05 byly považovány za statisticky významné. K analýze jsme použili statistický program NCSS 6.0 (Number Cruncher Statistical Systems, U.S.A.).
Výsledky
Klinické nálezy
V podskupině bez transplantace (TKT-) bylo 49 (88 %) nemocných v době kontrolního vyšetření v první kompletní remisi onemocnění. U 6 (12 %) nemocných došlo v průběhu sledování k relapsu onemocnění. Tito nemocní byli léčeni další záchrannou chemoterapií, přičemž dosáhli druhé až třetí kompletní remise v období kontrolního vyšetření.
16 nemocných s transplantací (TKT+) bylo léčeno před podáním autologního štěpu přípravným režimem BEAM. Nemocným, kterým byl podán alogenní štěp, byl ve 4 případech podán přípravný režim BuCy2 a ve 2 případech byli léčeni dle Slavínova protokolu. Jedna nemocná byla léčena autologní transplantací s přípravným režimem BEAM a v dalším období jí byl podán alogenní štěp po vysokodávkované chemoterapii režimem BuCy2. V této podskupině byla u 13 nemocných (59 %) podána vysokodávkovaná chemoterapie s transplantací po iniciální léčbě a všichni byli v době kontrolního vyšetření v první kompletní remisi onemocnění. U 9 (41 %) nemocných byla pro relaps nebo progresi onemocnění provedena záchranná léčba a následná léčba vysokodávkovanou chemoterapií s transplantací. Počet nemocných, kteří obdrželi po iniciální léčbě záchrannou léčbu, je tak v transplantované skupině statisticky významně vyšší oproti netransplantované skupině (p < 0,01).
U nemocných, kteří obdrželi záchrannou léčbu, se tak i zkrátila doba mezi ukončenou léčbou a kontrolním vyšetřením. Ve skupině TKT - byla 3 ± 0,7 roků (medián 4; 2-4), ve skupině TKT+ 5,8 ± 2,4 roků (medián 5; 3-9). Hodnota mediánu se mírně snížila ve srovnání s mediánem sledování 6,7 let u nemocných bez záchranné terapie.
U žádného nemocného nedošlo ke kardiálním komplikacím v souvislosti s podáním štěpu. Klinické známky kardiotoxicity v dalším období nebyly též diagnostikovány. V období od ukončení základní terapie po kontrolní vyšetření jsme nově diagnostikovali pouze u dvou nemocných z TKT+ podskupiny diabetes. Jiné nové kardiovaskulární onemocnění, které by mohlo negativně ovlivnit funkci LK, nebylo diagnostikováno.
Hodnocení systolické funkce
Před zahájením konvenční chemoterapie neměl nikdo z nemocných patologicky sníženou hodnotu EF < 50 %. Podskupiny se nelišily ve vstupní hodnotě EF (TKT-: 65 ± 4 %; medián 66 %, 51 - 74 % vs TKT+: 65 ± 4 %; medián 65 %, 54-70 %; n.s.). Po ukončení základní chemoterapie došlo v obou podskupinách k statisticky významnému poklesu EF. Ve skupině TKT - na hodnotu 63 ± 5 % (medián 63 %; 46-73 %; p < 0,01) a ve skupině TKT+ na hodnotu 63 ± 4 % (medián 62 %; 57-73 %; p < 0,03), přičemž hodnoty EF nebyly v podskupinách statisticky významně odlišné. Při kontrolním vyšetření po 5 a více letech byl v obou podskupinách zaznamenán další pokles opět bez významného rozdílu mezi podskupinami. U nemocných TKT - poklesla EF na hodnotu 61 ± 7 % (medián 64 %; 46-73 %; p < 0,001) a ve skupině TKT+ na hodnotu 60 ± 3 % (medián 60 %; 53-65 %; p < 0,001) (graf 1).
Graf 1. Vývoj změn ejekční frakce levé komory v podskupinách. 
Po podání iniciální konvenční chemoterapie došlo pouze v podskupině TKT - u dvou nemocných (4 %) k asymptomatickému poklesu EF < 50 % a při kontrolním vyšetření byl tento pokles zaznamenám u 4 (8 %) nemocných. Tento nález není statisticky významný jak pro vývoj v podskupině, tak ani ve srovnání s druhou podskupinou (graf 2).
Graf 2. Nález hodnot EF LK < 50 % v podskupinách v průběhu sledování. 
Pokles EF > 10 % ve srovnání s její vstupní hodnotou byl v obou podskupinách zaznamenán jako následek úvodní chemoterapie. Pět (9 %) nemocných z podskupiny TKT - a jeden (4 %) z podskupiny TKT+ nepředstavují statisticky významný nárůst, přičemž není přítomen významný rozdíl mezi podskupinami. Při kontrolním vyšetření je patrný nárůst počtu nemocných v obou podskupinách, ale bez statisticky významné změny ve srovnání s nálezem po iniciální chemoterapii (TKT-: 9 % vs 25 %; n.s./ TKT+: 4 % versus 13 %; n.s.). Tento trend je výraznější v podskupině TKT - (graf 3).
Graf 3. Vývoj poklesu EF LK > 10 % v podskupinách ve srovnání se vstupní hodnotou. 
Hodnocení diastolické funkce
Porucha DF byla přítomna již před zahájením konvenční chemoterapie pouze v podskupině, která nebyla dále léčena transplantací, a to u 9 (16 %) nemocných. Jednalo se o poruchu relaxace LK. Po ukončení základní chemoterapie se nevýznamně zvyšuje počet nemocných s poruchou DF na 22 %. V podskupině TKT+ jsme poruchu DF před a po základní chemoterapii nezaznamenali. Kontrolní vyšetření ukazuje na shodný nález u 36 % nemocných s poruchou DF (n.s.) v obou podskupinách charakterizovanou poruchou relaxace LK. Nárůst poruchy DF ve podskupině TKT - ve srovnání se vstupní hodnotou je již statisticky významný (p < 0,05), stejně tak i v podskupině TKT+ (p < 0,01) (graf 4).
Graf 4. Vývoj diastolické dysfunkce v průběhu sledování. 
Výsledky spiroergometrického vyšetření
Zátěžový test byl proveden pouze v rámci kontrolního vyšetření. Jak ukazuje tab. 2, nenalezli jsme statisticky významné rozdíly v TZ a ve sledovaných ukazatelích kardiopulmonální výkonnosti mezi podskupinami. Patologické nálezy sníženého pVO2 < 20 ml/kg/min byly zjištěny u malého počtu nemocných bez statisticky významného rozdílu mezi podskupinami. U žádného z nemocných jsme nenalezli významnou poruchu plicní funkce, která by ovlivnila měřené ventilační parametry při SEM, stejně tak v době vyšetření neměl nikdo z nemocných anémii. Zátěží indukovaná hypoxemie nebyla diagnostikována u žádného nemocného.
Tab. 2. Srovnání spiroergometrických kazatelů v podskupinách. 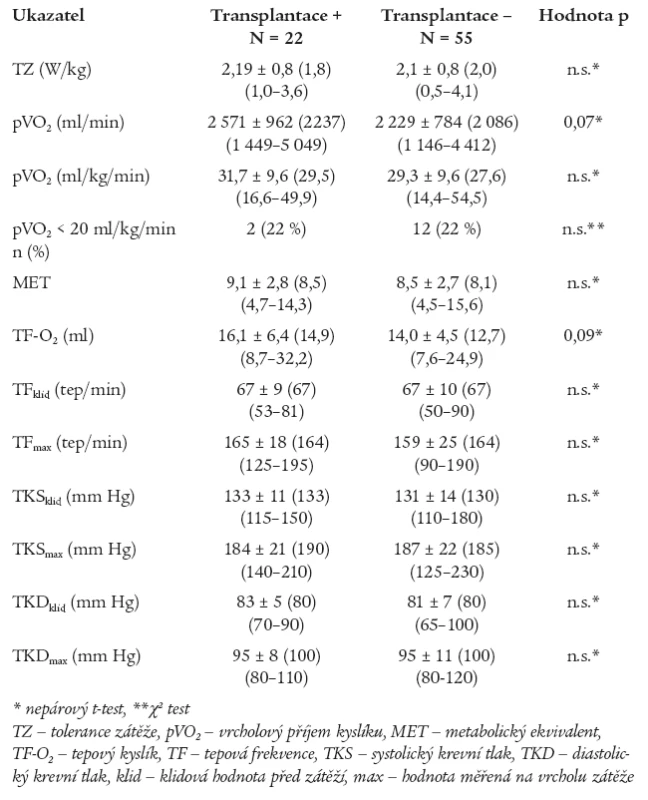
Regresní analýza
Provedli jsme multivariační analýzu, pomocí které jsme chtěli zjistit, zda podání vysokodávkované chemoterapie s TKT přináší vyšší riziko pro významné snížení EF nebo její pokles do patologického pásma pod 50 %, pro nález snížené kardiopulmonální výkonnosti (pVO2 < 20 ml/kg/min) nebo pro vývoj diastolické dysfunkce. Jak ukazuje tab. 3, tento předpoklad se nesplnil.
Tab. 3. Vliv podání vysokodávkované chemoterapie za podpory transplantace krvetvorné tkáně na změny funkce myokardu a sníženou kardiopulmonální výkonnost (multivariační analýza). 
Lineární regresní analýza ukázala, že existuje významný vztah mezi změnou EF, indexem E/A, IRP, pVO2 a KD podaného doxorubicinu (p < 0,05). Aktuální věk významně a negativně koreluje s pVO2 (p < 0,001) a ukazateli DF (p < 0,001). Doba sledování inverzně koreluje se změnou EF (p < 0,05) a pVO2 (p < 0,05), ale nekoreluje s ukazateli DF (tab. 4).
Tab. 4. Linerární regresní analýza mezi podanou kumulativní dávkou doxorubicinu, aktuálním věkem pacientů, délkou sledování a ukazateli funkce levé komory srdeční. 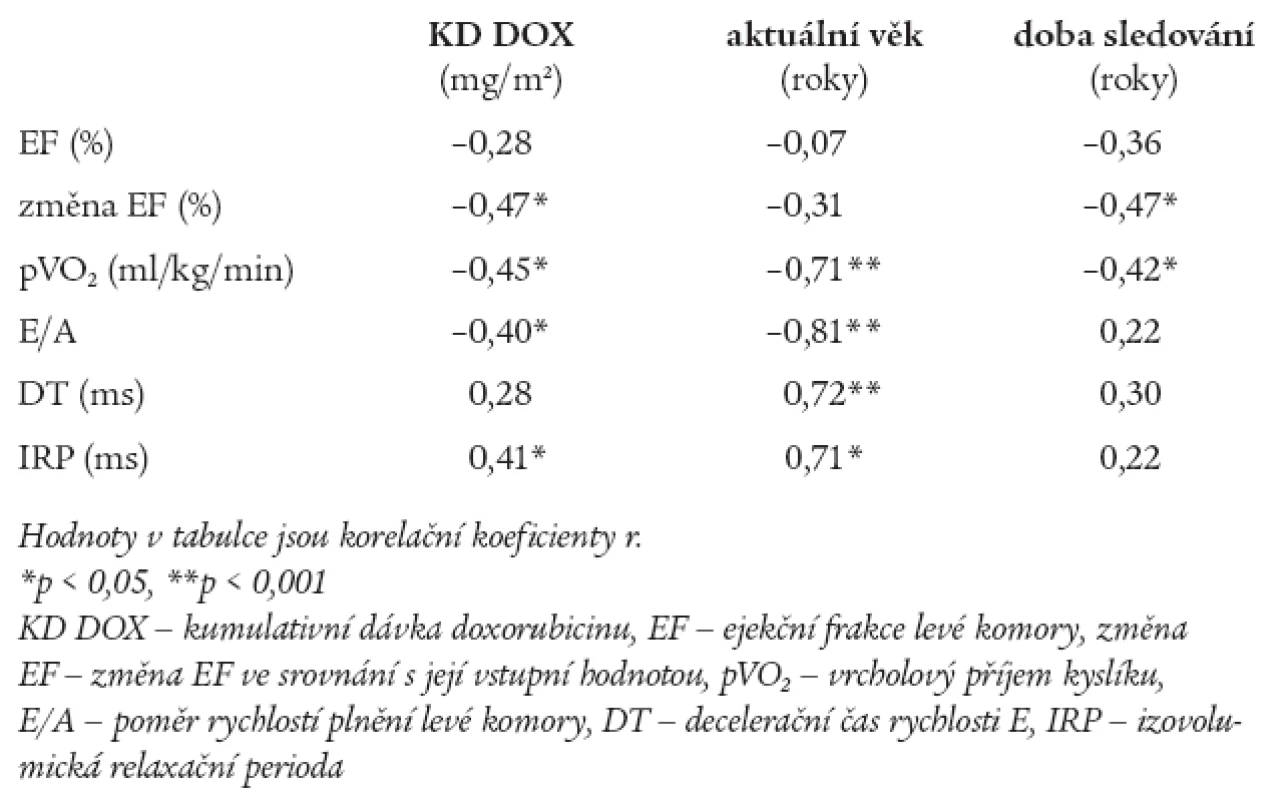
Vzhledem k nízké incidenci doprovodných onemocnění, která mohou ovlivňovat diastolickou, popřípadě i systolickou funkci LK v našem souboru, nebyly tyto zařazeny do statistické analýzy.
Diskuse
Vysokodávkovaná chemoterapie s TKT může vést k dlouhodobé remisi nebo vyléčení u některých typů hematologických malignit, nemocné s maligními lymfomy nevyjímaje [15,16]. Nicméně tento terapeutický přístup může být také doprovázen kardiálními komplikacemi, které mohou být závažné až smrtelné [8,17,18].
Výskyt kardiálních komplikací v souvislosti s touto léčbou je ovlivněn některými faktory. Prvním je kardiální nález před terapií a přítomnost rizikových faktorů kardiotoxicity. Tyto faktory je nutno vzít v úvahu již před zahájením iniciální konvenční chemoterapie obsahující antracykliny. Mezi rizikové faktory řadíme sníženou EF před léčbou, přítomnost onemocnění negativně ovlivňujících systolickou a diastolickou funkci LK bez ohledu na podání antracyklinů (např. hypertenze, ischemická choroba srdeční, diabetes, významné chlopenní vady), ale taktéž vyšší věk, který je již sám o sobě doprovázen poruchou diastolických vlastností LK [19,20].
Druhým faktorem je podání antracyklinů v iniciální konvenční chemoterapii. Tyto léky vedou k subklinickému poškození myokardu u dětí i dospělých za řadu měsíců a roků po ukončení chemoterapie v závislosti na podané KD cytostatika. Vznik chronické kardiotoxicity antracyklinů tak časově spadá do období podání transplantace. Výskyt chronického srdečního selhání je popisován v 3,3 % a asymptomatický pokles EF > 10 % u 15 % nemocných [21]. Subklinická kardiotoxicita charakterizovaná diastolickou dysfunkcí je popisována až u 50 % nemocných a porucha autonomní regulace u 85 % nemocných [22].
Asymptomatická diastolická a systolická dysfunkce indukovaná antracykliny může být teoreticky substrátem pro vývoj kardiálních komplikací v průběhu transplantace nebo může akcelerovat jako pozdní kardiotoxicita. Dodnes není jasné, zda antracykliny představují větší riziko pro vznik kardiálních komplikací transplantace. Některé studie tento fakt nepotvrdily [23,24]. Na druhé straně byl prokázán vyšší výskyt srdečního poškození u nemocných, kteří obdrželi v rámci vysokodávkované chemoterapie dávky cyklofosfamidu ≥ 120 mg/kg a KD antracyklinů v konvenční chemoterapii ≥ 100 mg/m2 [25,26].
Dalšími faktory potenciálně ovlivňujícími funkci myokardu je podání předtransplantační vysokodávkované chemoterapie, vlastní podání štěpu a celé období přihojování štěpu. Podání zamraženého štěpu včetně masivní hydratace může být provázeno objemovým přetížením srdce, hypotenzí a bradyarytmiemi. Jedná se o komplikace v průběhu podávání štěpu a vyskytující se velmi zřídka a nepřikládáme jim pro výskyt pozdních následků velký význam. V období reparace krvetvorby může být funkce myokardu ovlivněna řadou faktorů, jako je retence tekutin, anémie, infekční komplikace, porucha koagulačního systému, sepse, reakce štěpu proti hostiteli, apod. Všechny tyto faktory vedou obvykle k akutním komplikacím a jsou takto také řešeny. Nicméně nelze popřít jejich negativní vliv na funkci myokardu již poškozeného léčbou antracykliny či jiným kardiálním onemocněním v dalším období [27].
Vlastní přípravný režim před podáním TKT může být příčinou řady kardiovaskulárních komplikací, ať se již jedná o vysokodávkovanou chemoterapii nebo celotělové ozáření. Cytostatikem s nejzávažnější kardiotoxicitou, známou více než 30 let a popsanou dle studií až u 43 % nemocných, je cyklofosfamid. Klinická toxicita charakterizovaná perikardiálními hemoragickými výpotky, srdeční tamponádou, akutním selháním srdce a maligními arytmiemi byla popisována do tří týdnů po aplikaci vysokodávkované chemoterapie. Po snížení dávek do maximálních hodnot 7 g/m2 nebo do 200 mg/kg se výskyt kardiotoxicity rapidně snížil [8]. Nicméně i podání těchto relativně bezpečných dávek cyklofosfamidu vede k subklinické kardiotoxicitě i u nemocných bez předchozího kardiálního onemocnění. Poškození myokardu bylo popsáno na základě monitorování sérových hladin troponinu, změn EF LK, změn QT disperze na EKG křivce [28,29].
Kardiotoxicta je vzácněji popsána i u jiných cytostatik, která jsou kombinována v přípravných režimech. Podání cytosinarabinosidu může být doprovázeno vznikem arytmií a perikarditid a může zesílit toxický účinek cyklofosfamidu. Po podání fludarabinu byl popsán výskyt srdečního selhání ve 2,2 %. Kombinace s melfalanem zvýšila incidenci na 14 %. Isofosfamid vede k obdobným komplikacím jako cyklofosfamid, popsaným až v 15 %. Vývoj srdečního selhání byl též popsán po podání thoitépy ve 4 %. Karmustin může indukovat myokardiální ischemii. Většina těchto komplikací byla zvládnuta konvenční farmakoterapií. Podání doxorubicinu před vysokodávkovanou chemoterapií je považováno za rizikový faktor u podání cyklofosfamidu, popřípadě jeho kombinací s mitoxantronem a cytosinarabinosidem, dále před podáním samotného cytosinarabinosidu, fludarabinu, thiotépy a melfalanu [8].
I přes uvedené komplikace se v poslední době ukazuje, že výskyt závažné nebo život ohrožující kardiotoxicity v souvislosti s touto léčbou je nízký a pohybuje s v rozmezí 1/2 %. Výskyt subklinického poškození je ale mnohem vyšší a zůstává jen otázkou nakolik ovlivní další vývoj pozdních kardiálních komplikací [18,30].
V předložené studii jsme posuzovali vliv vysokodávkované chemoterapie a transplantace KTK na funkci komory jako léčebného celku bez ohledu na kardiotoxicitu jednotlivých cytostatik přípravného režimu. Navíc u všech nemocných byl přítomen další rizikový faktor, kterým byla vstupní chemoterapie obsahující doxorubicin. Naše výsledky prokázaly, že tato léčba v období středně dlouhého sledování nepřináší vyšší riziko pro vývoj poruchy systolické a diastolické funkce a pro sníženou kardiopulmonální výkonnost ve srovnání se standardní léčbou. S ohledem na nižší věk nemocných s maligními lymfomy v našem souboru byla přítomnost dalších rizikových faktorů ovlivňujících funkci LK velmi nízká a navíc jen ve skupině, která nebyla transplantována. Tím lze též vysvětlit větší výskyt poruchy diastolické funkce na začátku chemoterapie v této podskupině a stejně tak i po jejím ukončení. Kontrolní vyšetření ukazuje 36% výskyt poruchy relaxace LK v obou podskupinách. Dva ukazatelé diastolické funkce významně korelují s podanou KD doxorubicinu pro celou skupinu, což je jeden z faktorů vedoucí k vývoji diastolické dysfunkce v souvislosti s chemoterapií [31]. Věk je dalším významným faktorem korelujícím s diastolickou funkcí, neboť vyšší věk je doprovázen zhoršenou relaxací LK [32]. Tuto skutečnost potvrdila i významná korelace aktuálního věku pacientů s jednotlivými ukazateli diastolické funkce. Nicméně se nedomníváme, že za poměrně významný 36% výskyt diastolické dysfunkce v obou podskupinách je zodpovědný jen věk a zhoršení poddajnosti myokardu s ohledem na medián doby sledování. Navíc při kontrolním vyšetření je věk většiny pacientů dle našeho názoru pod věkovou hranicí „stárnoucího srdce“ a délka sledování s parametry DF nekorelovala.
Vývoj EF LK byl v obou podskupinách shodný a vykazoval v průběhu celého sledování významný pokles. I když absolutní hodnota EF nekorelovala s KD doxorubicinu, velmi zajímavé je chování vývoje změny EF ve srovnání se vstupní hodnotou. Na našem pracovišti považujeme progredující pokles EF > 10 % v důsledku onkologické léčby za významný, i když je ve fyziologickém rozmezí hodnot EF. V literatuře na tuto hodnotu nepanuje jednotný názor. Pokles EF je považován za významný dle jednotlivých autorů při změnách o 10-20 % [21,33,34]. Právě změna EF v naší studii významně korelovala s KD doxorubicinu a s délkou monitorování. Doba od ukončení chemoterapie je považována za významný rizikový faktor pozdní kardiotoxicity u dětí a je studována především v souvislosti se změnami systolické funkce LK [19]. U dospělých pacientů prozatím nemáme obdobná klinická data. Na rozdíl od ukazatelů DF nejsou ukazatelé systolické funkce u jedinců bez kardiovaskulárního onemocnění ovlivněny věkem [35]. Předpokládáme, že narůstající dotížení (afterload) LK bude s délkou monitorování negativně ovlivňovat systolickou funkci LK po chemoterapii, která vedla k subklinickému poškození myokardu, i u dospělých. Potvrzení tohoto předpokladu vyžaduje dlouhodobé monitorování, které je podmíněno dlouhodobým přežíváním dospělých onkologických nemocných. Nárůst poklesu EF samozřejmě ovlivní přítomnost doprovodných kardiovaskulárních onemocnění. Vzhledem k minimálnímu výskytu tohoto faktoru ve sledované skupině nemocných, považujeme na základě zjištěných výsledků léčbu DOX za hlavní faktor ovlivňující snížení systolické funkce.
Kardiopulmonální výkonnost je snížena u řady nemocných po onkologické léčbě v závislosti na typu léčby, věku a pohlaví. Kolem 70 % nemocných ztrácí fyzickou výkonnost v průběhu a bezprostředně po léčbě a asi u 30 % přetrvává po dlouhou dobu od ukončení léčby [36,37]. Vrcholový příjem kyslíku je komplexní ukazatel kardiopulmonální výkonnosti, funkce periferní cirkulace a metabolických změn [13,14]. Prací zabývajících se využitím SEM u onkologických nemocných zvláště po transplantaci není mnoho, přičemž porucha ventilačních parametrů při zátěži je popisována u 15-50 % nemocných v průběhu 6 až 12 měsíců sledování po transplantaci a je považována s poklesem EF za nejčastější nálezy po léčbě [38]. V naší práci jsme nesledovali vývoj ukazatelů kardiopulmonální výkonnosti v kratším časovém období po léčbě a neměli jsme ani data z období před terapií. Počet nemocných s výraznou redukcí pVO2 byl nízký a navíc naše výsledky nepodporují negativní vliv léčebného režimu s transplantací na ukazatele kardiopulmonální výkonnosti. 22 % pacientů z každé podskupiny nebo 18 % z celé skupiny představuje menší počet nemocných se sníženou kardiopulmonální výkonností než je udáváno v literatuře [37]. Tato čísla ovlivňuje dle našeho názoru jednak věk nemocných a dále dlouhodobé přežívání v důsledku úspěšné léčby lymfomů, které může pozitivně ovlivnit přístup k fyzické aktivitě u jednotlivců. Právě aerobní pravidelný trénink, k jehož stanovení a vyhodnocení je SEM optimální diagnostickou metodou, výrazně zlepšuje fyzickou výkonnost nemocných po onkologické léčbě včetně transplantace [39].
Limitace studie
Mezi faktory ovlivňující předložené výsledky je nutno vzít počet nemocných zařazených do hodnocení, zvláště pak při vytvoření podskupiny transplantovaných. Výsledky mohou ovlivnit i zařazovací kritéria pacientů, dle kterých se nejedná o konsekutivně zařazené pacienty.
V předložené práci jsme neanalyzovali vliv jednotlivých cytostatik použitých v přípravných režimech před podáním štěpu na myokard. Především počet nemocných, kteří dostali vysokodávkovaný cyklofosfamid, byl ve studii velmi malý, jednalo se jen o pacienty s alogenní transplantací s režimem BuCy2. Některé studie právě poukazují na prvotní význam tohoto cytostatika ovlivňujícího vznik kardiálních komplikací po transplantaci. Kardiotoxicita vysokodávkovaného cyklofosfamidu je předmětem našeho dalšího výzkumu.
Spiroergometrické vyšetření nebylo provedeno před terapií, a proto se nemůžeme vyjádřit k tak závažnému problému, jakým je označován v literatuře „cancer-related fatigue“. Výsledky vyšetření nám pouze pomohly objektivizovat aktuální kardiopulmonální výkonnost a doporučit pacientům vhodnou fyzickou zátěž.
V současné době nabízí echokardiografie jiné modality, které mohou velmi precizně stanovit systolickou a diastolickou funkci myokardu. Jedná se především o pulzní dopplerovskou tkáňovou echokardiografii. Tuto metodu jsme neměli v období zahájení chemoterapie k dispozici. Sledování biomarkerů (troponiny, BNP, NT-pro-BNP apod.) je v poslední době též používáno k detekci poškození myokardu po chemoterapii a transplantaci a představují nadějnou diagnostickou metodu, i když jejich použití v této indikaci je stále předmětem studií.
Závěry
Studie prokázala, že léčba vysokodávkovanou chemoterapií s podáním TKT v období středně dlouhého sledování nevede k významnější poruše systolické, diastolické funkce myokardu a ke zhoršení kardiopulmonální výkonnosti ve srovnání s nemocnými, kteří tuto léčbu nepodstoupili. Domníváme se, že léčba kardiotoxickým doxorubicinem podaným v základní konvenční chemoterapii je s největší pravděpodobností zodpovědná za výskyt patologických nálezů v celé skupině sledovaných nemocných. Délka monitorování je významným faktorem korelujícím se změnou ejekční frakce. Tento nález zdůvodňuje nutnost dlouhodobého prospektivního monitorování ejekční frakce LK u dospělých nemocných léčených kardiotoxickou chemoterapií.
Tato práce vznikla za podpory grantu IGA MZ ČR NC 7354-3.
doc. MUDr. Lubomír Elbl, CSc.
www.fnbrno.cz
e-mail: lelbl@seznam.cz
Doručeno do redakce: 27. 11. 2005
Přijato po recenzi: 29. 12. 2005
Zdroje
1. Limat S, Demesmay K, Voillat L et al. Early cardiotoxicity of the CHOP regimen in aggresive non-Hodgkin’s lymphoma. Annal Oncol 2003; 14 : 277-281.
2. Brice P, Tredaniel J, Monsuez JJ et al. Cardiopulmonary toxicity after three courses of ABVD and mediastinal irradiation in favorable Hodgkin’s disease. Annals Oncol 1991; 2 : 73-76.
3. Reena N, Ramakrishnan G, Nair NN et al. A randomized comparison of the efficacy and toxicity of epirubicin and doxorubicin in the treatment of patients with non-Hodgkin’s lymphoma. Cancer 1998; 82 : 2282-2288.
4. Nousianen T, Jantunen E, Vanninen E et al. Early decline in left ventricular ejection fraction predicts doxorubicin cardiotoxicity in lymphoma patients. Br J Cancer 2002; 86 : 1697-1700.
5. Nousianen T, Vanninen E, Jantunen E at al. Neuroendocrine changes during the evolution of doxorubicin-induced left ventricular dysfunction in adult lymphoma patients. Clin Science 2001; 101 : 601-607.
6. Hequet O, Le QH, Moullet I et al. Subclinical late cardiomyopathy after doxorubicin therapy for lymphoma in adults. J Clin Oncol 2004; 22 : 1864-1871.
7. Blume KG, Forman SJ, Appelbaum FR. Hematopoietic Cell Transplantation. 3rd ed. Boston: Blackwell Science 2004.
8. Morandi P, Ruffini PA, Benvenuto GM et al. Cardiac toxicity of high-dose chemotherapy. Bone Marrow Transplant 2005; 35 : 323-334.
9. Diehl V, Thomas RT, Re D. Hodgkin’s lymphoma-diagnosis and treatment. Lancet 2004; 5 : 19-26.
10. Messori A, Vaiani M, Trippoli S. Survival in patients with intermediate or high-grade non-Hodgkin’s lymphoma: meta-analysis of randomized studies comparing third generation regimens with CHOP. Br J Cancer 2001; 84 : 303-307.
11. Slavin S, Nagler A, Naprstek E et al. Nonmyeloablative stem cell transplantation and cell therapy as an alternative to conventional bone marrow transplantation with lethal cytoreduction for the treatment of malignant and nonmalignant hematologic diseases. Blood 1998; 91 : 756-763.
12. Otto CM. Echocardiographic evaluation of left and right ventricular systolic function. In: Otto CM Textbook of clinical echocardiography. 2nd ed. Philadelphia: WB Saunders 2000 : 100-131.
13. Beck KC, Weisman IM. Methods for cardiopulmonary exercise testing. In: Weisman IM, Zeballos RJ. Clinical exercise testing. Prog Respir Res. Basel: Karger 2002 : 43-5914.
14. Quigg RJ. Clinical utility of cardiopulmonary exercise testing data in heart failure. In: Balady GJ, Pina IL Exercise and heart failure. 1st ed. New York: Futura Publishing Company Armonk 1997 : 221-243.
15. Mayer J. Will transplantation of peripheral blood stem haematopoietic cells definitively replace bone marrow transplantation? Vnitř Lék 2000; 46 : 785-793.
16. Kmonicek M, Jebavy L, Lanska M et al. The treatment of multiple myeloma with an allogeneic peripheral blood stem cell transplantation using a non-myeloablative conditioning regimen. Vnitř Lék 2000; 46 : 377-383.
17. Vambera M, Jabali Y, Pesl L et al. Cardiac damage in a young woman with Hodgkin’s disease and long term survival after combination therapy and bone marrow transplantation. Vnitř Lék 2003; 49 : 77-81.
18. Hertenstein B, Stefanic M, Schmeiser T et al. Cardiac toxicity of bone marrow transplantation: predictive value of cardiologic evaluation before transplant. J Clin Oncol 1994; 12 : 998-1004.
19. Simbre VC, Duffy SA, Dadlani GH et al. Cardiotoxicity of cancer chemotherapy. Pediatr Drugs 2005; 7 : 187-202.
20. Chanan-Khan A, Srinivasan S, Czuczmen S. Prevention and management of cardiotoxicity from antineoplastic therapy. J Support Oncol 2004; 2 : 251-266.
21. Youssef G, Links M. The prevention and management of cardiovascular complications of chemotherapy in patients with cancer. Am J Cardiovasc Drugs 2005; 5 : 233-243.
22. Tjeerdsma G, Meinardi MT, van der Graaf WT et al. Early detection of anthracycline induced cardiotoxicity in asymptomatic patients with normal left ventricular systolic function: autonomic versus echocardiographic variables. Heart 1999; 81 : 419-423.
23. Fujimaki K, Maruta A, Yoshida M et al. Severe cardiac toxicity in hematological stem cell transplantation: predictive value of reduced left ventricular ejection fraction. Bone Marrow Transplant 2001; 27 : 307-310.
24. Lehman S, Isberg B, Ljungman P et al. Cardiac systolic function before and after hematopoietic stem cell transplantation. Bone Marrow Transplant 2000; 26 : 187-192.
25. Steinherz LJ, Steinherz PG, Mangiacasale D et al. Cardiac changes with cyclophosphamide. Med Pediatr Oncol 1981; 9 : 417-422.
26. Brockstein BE, Smiley C, Al-Sadir J et al. Cardiac and pulmonary toxicity in patients undergoing high-dose chemotherapy for lymphoma and breast cancer: prognostic factors. Bone Marrow Transplant 2000; 25 : 885-894.
27. Kubešová H, Elbl L. Problematika kardiálních komplikací v souvislosti s transplantací krvetvorných buněk. In: Elbl et al. Poškození srdce protinádorovou léčbou. Praha: Grada Publishing 2002 : 118-130.
28. Auner HW, Tinchon C, Brezinschek RI et al. Monitoring of cardiac function by serum cardiac troponin T levels, ventricular repolarisation indices, and echocardiography after conditioning with fractional total body irradiation and high-dose cyclophosphamide. Eur J Hematol 2002; 69 : 1-6.
29. Cardinale D, Sandri MT, Martinoni A et al. Left ventricular dysfunction predicted by early troponin T release after high-dose chemotherapy. J Am Coll Cardiol 2000; 36 : 517-522.
30. Murdych T, Wiesdorf DJ. Serious cardiac complications during bone marrow transplantation at the University of Minesota, 1977 - 1997. Bone Marrow Transplant 2001; 28 : 283-287.
31. Elbl L, Chaloupka V, Vášová I et al. Poškození funkce levé komory srdeční po léčbě doxorubicinem u nemocných s maligními lymfomy. Vnitř Lék 2000; 46 : 768-775.
32. Bejnamin EJ, Levy D, Keaven M et al. Determinants of Doppler indexes of left ventricular diastolic function in normal subjects (the Framingham Heart Study). Am J Cardiol 1992; 70 : 508-515.
33. Steinherz LJ, Graham T, Hurwitz R et al. Guidelines for cardiac monitoring of children during and after anthracycline therapy: Report of the Cardiology Committee of the Childrens Cancer Study Group. Pediatrics 1992; 89 : 942-949.
34. Schwartz RG, McKenzie WB, Alexander J et al. Congestive heart failure and left ventricular dysfunction complicating doxorubicin therapy: sever-year experience using serial radionuclide angiocardiography. Am J Med 1987; 82 : 1109-1118.
35. Henein M, Lindqvist P, Francis D et al. Tissue Doppler analysis of age-dependency in diastolic ventricular behaviour and filling. Eur Heart J 2002; 23 : 162-171.
36. Irvine DM, Vincent L, Graydon J et al. The prevalence and correlates of fatigue in patients receiving treatment with chemotherapy and radiotherapy. A comparison with fatigue experienced by healthy individuals. Cancer Nurs 1994; 17 : 367-378.
37. Mock V. Fatigue management. Cancer 2001; 92 : 1699-1707.
38. Carlson K, Smedmyr B, Backlund L et al. Subclinical disturbances in cardiac function at rest and in gas exchange during exercise are common findings after autologous bone marrow transplantation. Bone Marrow Transplant 1994; 14 : 949-954.
39. Dimeo FC, Timan MHM, Bertz H et al. Aerobic exercise in the rehabilitation of cancer patients after high dose chemotherapy and autologous peripheral stem cell transplantation. Cancer 1997; 79 : 1717-1722.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2006 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Metabolit živočišné stravy produkovaný střevní mikroflórou zvyšuje riziko závažných kardiovaskulárních příhod
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- PET - možnosti a limitace - editorial
- Molekulární biologie a diabetes: kam teď? - editorial
- Přínos fluorodeoxyglukózové pozitronové emisní tomografie (FDG-PET) u mnohočetného myelomu
- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Vliv vysokodávkované chemoterapie s následnou transplantací krvetvorných buněk na funkci levé komory srdeční u nemocných s maligními lymfomy léčenými doxorubicinem v primární chemoterapii
- Srovnání sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Neinvazivní ventilační podpora u pacientů s akutní exacerbací chronické obstrukční plicní nemoci (CHOPN)
- Asymetrický dimetylarginin - nový rizikový faktor kardiovaskulárních onemocnění
- Imunoglobulin A a choroby ledvin
- Hypertenze v těhotenství
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
- Jak vidí endokrinologové profesora MUDr. Josefa Marka, DrSc.
- Když přišel Josef Marek před 40 lety na 3. interní kliniku
- I. Žucha, I. Hulín: Myšlienky. Bratislava: Slovak Academic Press 2006. 255 stran. ISBN 80-89104-75-4.
- Sninčák M. Artériová hypertenzia: súčasné klinické trendy. Košice: TypoPress 2005. 284 stran. ISBN 80-89089-39-9.
- Hoffmann GF et al. Dědičné metabolické poruchy. Praha: Grada 2005. 416 stran. ISBN 80-247-0831-0.
- 130. internistický den v Olomouc věnovaný revmatologii
- Sdělení výboru České internistické společnosti
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Imunoglobulin A a choroby ledvin
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



