-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dysfunkce transjugulární intrahepatální portosystémové spojky (TIPS) a její řešení
Dysfunction of transjugular intrahepatic portosystemic shunt (TIPS) and applicable solutions
A synoptic article providing a comprehensive view of TIPS dysfunction. The article covers current terminology, definition, etiology, pathogenesis, diagnostics, therapy and prevention of TIPS dysfunction.
Key words:
TIPS – portal hypertension therapy – stentgraft
Autoři: V. Jirkovský 1; P. Hůlek 1; T. Fejfar 1; V. Šafka 1; V. Chovanec 2; A. Krajina 2
Působiště autorů: II. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc. 1; Radiologická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Pavel Eliáš, CSc. 2
Vyšlo v časopise: Vnitř Lék 2007; 53(2): 157-163
Kategorie: Přehledný referát
Souhrn
Přehledový článek zabývající se komplexně problematikou dysfunkce TIPS. Ze současného hlediska uvádí terminologii, definici, etiologii, patogenezi, diagnostiku, terapii a prevenci dysfunkce TIPS.
Klíčová slova:
TIPS - terapie portální hypertenze - stentgraftÚvod
Transjugulární intrahepatální portosystémová spojka (TIPS) je perkutánní, minimálně invazivní radiologická metoda, která vede ke snížení portálního tlaku u nemocných se symptomatickou portální hypertenzí vytvořením spojky mezi jaterní žilou a intrahepatální větví portální žíly. Vytvoření TIPS se provádí v lokální anestezii a analgosedaci. Vzhledem k nízké zátěži pro nemocného může být použit v urgentních situacích i u starších pacientů, u pacientů s horší, ale dostatečnou jaterní funkcí či u pacientů s masivním ascitem, kteří často nejsou vhodnými kandidáty k vytvoření chirurgické portosystémové spojky [1]. V současnosti jsou uznávanými indikacemi TIPS akutní či rekurentní krvácení z varixů při selhání endoskopické léčby, někteří pacienti s krvácením při portální hypertenzní gastropatii, refrakterním ascitem, hydrotoraxem při portální hypertenzi a s portální hypertenzí při Buddově-Chiariho syndromu [2,3]. Hlavním problémem TIPS je jeho limitovaná a dopředu neodhadnutelná průchodnost. U malé části pacientů se stenóza zkratu vůbec nevyvine, ale u většiny případů je sporadická nebo opakovaná stenóza či okluze zkratu pravidlem, což vede k potenciální recidivě závažných komplikací portální hypertenze. V posledních 5 letech jsou na trhu dostupné dedikované ePTFE potahované stenty, s jejichž použitím došlo k významnému snížení výskytu stenóz či okluzí TIPS.
Terminologie [4,5]
Stenóza - zúžení zkratu
Okluze - úplný uzávěr zkratu (nepřítomnost toku při ultrazvukovém či angiografickém vyšetření)
Intervence - všechny výkony, které změní stav již existujícího zkratu
Revize - všechny intervence prováděné v průchodném zkratu (zahrnuje balónovou dilataci, mechanickou či farmakologickou léčbu stenózy, zavedení dalšího stentu a výkony redukující velikost zkratu)
Rekanalizace - všechny intervence, které řeší okluzi zkratu
Primární průchodnost TIPS - stav, kdy zkrat je průchodný a nebyla provedena žádná intervence
Primární asistovaná průchodnost TIPS - stav, kdy zkrat je průchodný, ale už byla provedena revize, nikdy však nenastala okluze zkratu
Sekundární průchodnost TIPS - stav, kdy zkrat je průchodný, ale byla nutná rekanalizace pro okluzi zkratu; sekundární průchodnost končí v momentě úplné ztráty průchodnosti zkratu, kterou již nelze obnovit další intervencí
Stentgraft - kovový stent potažený umělým biokompatibilním materiálem [3]
Definice dysfunkce TIPS
Dysfunkce TIPS je dána klinicky znovuobjevením příznaků portální hypertenze nebo morfologicky přítomností okluze či hemodynamicky významné stenózy. Ačkoli neexistuje jednotně uznávaná definice dysfunkce TIPS, většina autorů ji definuje jako zúžení zkratu o více než 50 % a/nebo vzestup PSG nad 12-15 mm Hg. Při použití nepotahovaného stentu je publikovaná primární průchodnost TIPS 55-75 % za 6 měsíců, 48-50 % za 1 rok, 26-32 % za 2 roky, primární asistovaná průchodnost TIPS 85 % za 1 rok a sekundární průchodnost TIPS 99 % za 1 rok, 92 % za 2 roky a 89 % za 3 roky od vytvoření TIPS [6-10]. Z toho vyplývá, že dlouhodobou průchodnost TIPS lze udržet jen za cenu pravidelné dispenzarizace s nutností opakovaných revizí či rekanalizací zkratu, což je příčinou relativně vyšší ekonomické náročnosti ve srovnání s endoskopickou či chirurgickou léčbou.
Podle časového hlediska se dělí dysfunkce TIPS na časnou, která je dána výskytem do 30 dnů od výkonu, a pozdní, vyskytující se za více než 30 dnů od vytvoření spojky [11].
Podle lokalizace se dělí stenózy TIPS na vtokovou (inflow), intraparenchymovou a výtokovou (outflow) stenózu (obr. 1). Inflow stenóza se nachází v portální žíle a je velmi vzácná. Intraparenchymová stenóza má více či méně tendenci být difuzní v celé intraparenchymové části zkratu, způsobuje převážně časnou dysfunkci TIPS a častěji vede k recidivě projevů portální hypertenze. Outflow stenóza je lokalizována ve výtokové části TIPS, obvykle v nestentované, ale i stentované jaterní žíle, je častá, vyskytuje se hlavně v pozdní fázi a méně často vede k recidivě klinických projevů portální hypertenze. Výtoková a intraparenchymová stenóza se často vyskytují současně. Dle Saxona není rozdíl v manifestaci klinických příznaků portální hypertenze u časné a pozdní dysfunkce TIPS (55 % vs 56 %), ale tento rozdíl je patrný u intraparenchymové a výtokové stenózy (75 % vs 32 % případů), což platí hlavně pro pozdní dysfunkci TIPS [10].
Dělení dysfunkce (stenózy) TIPS:
A) dle časového hlediska:
- časná - do 30 dnů od vytvoření TIPS
- pozdní - po 30 dnech od vytvoření TIPS
B) dle lokalizace:
- výtoková (outflow) stenóza
- stenóza intraparenchymové části zkratu
- vtoková (inflow) stenóza
Patofyziologie dysfunkce TIPS [1]
Maturace zkratu je komplexní proces, který je zahájen ihned po vytvoření zkratu intrahepatální balonovou dilatací se zavedením stentu. Fibrin a ostatní plazmatické proteiny se ukládají podél kovových drátků stentu a podél obnaženého jaterního parenchymu a připravují tak povrch zkratu k buněčné kolonizaci. Během 15 minut po implantaci stentu adherují trombocyty a leukocyty a vytvoří tenkou vrstvu primárního trombu. Vznik primárního trombu neovlivňuje pouze intraluminární povrchová trombogenicita, ale i schopnost krve se srážet a mechanické síly krevního proudu ve zkratu. Velikost primárního trombu ovlivňuje aktivitu následného pseudointimálního růstu. Po několika dnech po zavedení nepotahovaného stentu jsou ve vrstvě trombu pokrývající stent nejdříve patrny myointimální buňky, polymorfonukleáry a makrofágy. Po 2 týdnech je již celý zkrat pokryt fibrózní vrstvou, která je na povrchu tvořena kontinuální vrstvou endotelu. Tuto vrstvu nazýváme pseudointima. Její tloušťka se může pohybovat od 50 do 3500 µm, pokud přesáhne 1000 µm, mluvíme o pseudointimální hyperplazii. Hypertrofická pseudointima je charakterizovaná výraznější zánětlivou infiltrací a volnějšími neuspořádanými kolagenními depozity. Zdá se, že pseudointimální přerůstání je jev, který se sám zpomalí a zastaví. Vzestupná fáze trvá prvních 6 měsíců po zavedení TIPS, a poté následuje fáze plató [12].
Mezi hlavní příčiny dysfunkce TIPS patří akutní trombóza zkratu, pseudointimální hyperplazie v intraparenchymové části zkratu a intimální hyperplazie v oblasti jaterní žíly.
Pacienti s Buddovým-Chiariho syndromem na podkladě protrombotického stavu mají vyšší riziko trombózy či stenózy zkratu než ostatní nemocní léčení metodou TIPS [13]. Naopak nemocní s pokročilejší jaterní cirhózou mohou mít díky trombocytopenii a hypoalbuminemii nižší riziko trombózy a díky menší velikosti primárního trombu i nižší riziko pseudointimální hyperplazie.
Dilatace intraparenchymové části způsobuje laceraci žlučových kanálků, které mohou mít různý průměr, a proto je jejich vliv na vytvoření lokálního trombu různý. Opakovaně byla prokázána přítomnost biliární píštěle u pacientů s akutní nebo opakující se trombózou TIPS [14-18]. Dále je biliární sekrece z hyperplastického biliárního epitelu spojována se značným zánětlivým potenciálem, který může způsobit chronickou intraparenchymální stenózu [15]. Přesný patofyziologický mechanizmus vlivu poškození žlučovodů a žluče na vznik intraluminálního trombu či stenózy TIPS není znám. Při histologickém vyšetření bylo zjištěno, že v některých případech přítomnost žluči ve zkratu nebyla doprovázena významnou stenózou či akutním uzávěrem [18,19] a proliferace buněk hladké svaloviny byla prokázána jak u stenotických, tak nestenotických spojek nezávisle na přítomnosti komunikace žlučovodů se zkratem [18]. Zásadní se zdá být práce Tenga et al [20], která prokazuje, že žluč je paradoxně silným inhibitorem proliferace hladkých svalových buněk in vitro a že inhibuje vyzrávání endoteliálních buněk, což ve svých důsledcích může vést k růstu trombu a následné hyperplazii pseudointimy. Týž autor později prokázal, že inhibiční vliv žluči na endoteliální buňky je významný, pokud je koncentrace žluči vyšší než 20 % (tab. 1) [21].
Tab. 1. Historie vztahu biliárního poškození a dysfunkce TIPS. 
Výtoková stenóza TIPS vzniká na podkladě hyperplazie intimy v úrovni výtokového traktu, tedy v oblasti jaterní žíly (obr. 1). Její vznik se dává do souvislosti s chronicky zvýšeným průtokem krve jaterní žilou po vytvoření TIPS, což vede k tzv. shear stressu, který je známým mechanizmem vzniku stenóz v tepenném řečišti u chirurgických anastomóz (AV píštěle pro dialýzu, bypassy) [23,24].
Obr. 1. Schéma výskytu jednotlivých stenóz TIPS dle lokalizace. 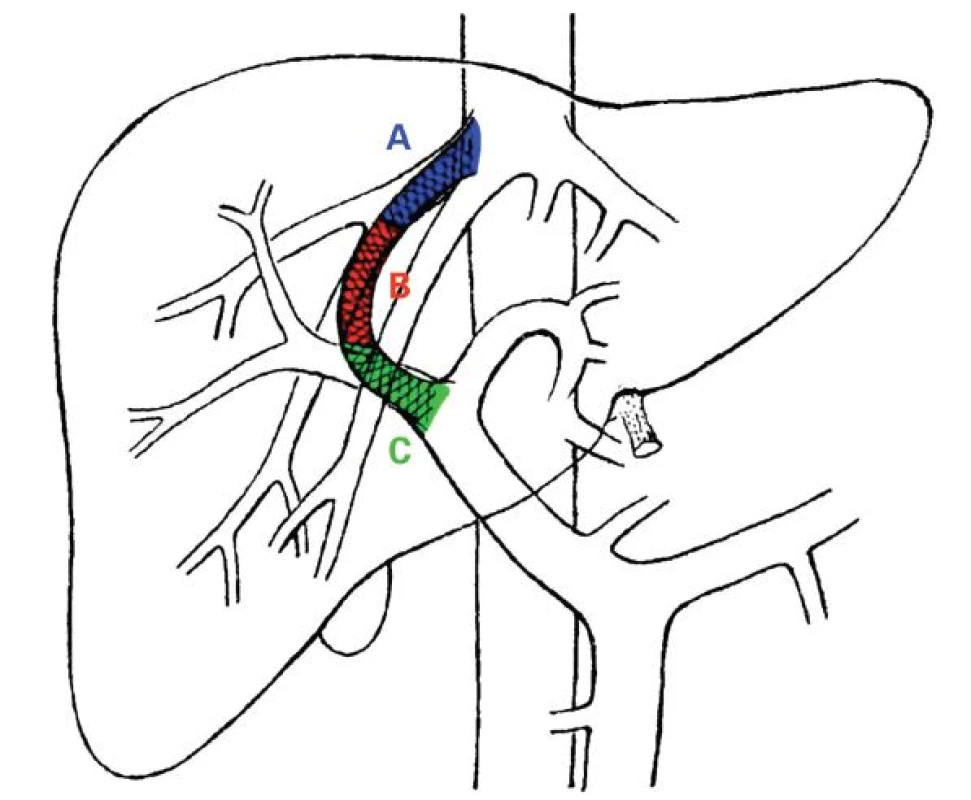
A (modrá) – výtokové stenózy, B (červená) – intraparenchymové stenózy, C (zelená) – vtokové stenózy Vtoková stenóza může být způsobena vrůstáním hepatocelulárního karcinomu do portální žíly nebo její hlavních větví nebo technickou chybou při zavedení TIPS, kdy je stent umístěn příliš kraniálně.
Z dalších parametrů, které mohou ovlivnit průchodnost TIPS, jde např. o šíři portální žíly, anatomickou lokalizaci a angulaci (zalomení) stentu, krevní obraz (počet trombocytů); pouze u věku byl prokázán statisticky významný rozdíl mezi skupinou pacientů s dlouhodobě dobrou a dlouhodobě špatnou průchodností TIPS. Pacienti se špatnou průchodností TIPS byli statisticky významně mladší [25].
Diagnostika dysfunkce TIPS
Ačkoli méně než 1/3 nemocných s dysfunkcí TIPS má klinické příznaky, při recidivě klinických známek portální hypertenze, pro které byl TIPS vytvořen (krvácení z jícnových varixů, ascites, hydrotorax), bývá prakticky u všech nemocných přítomna významná stenóza či okluze zkratu. Protože dysfunkce TIPS je častá, opakující se a dopředu neodhadnutelná, je nutná rutinní dispenzarizace všech pacientů se zavedeným TIPS.
Nejlepší dispenzarizační schéma není známo, proto se mezi jednotlivými centry liší. U každého pacienta se zavedeným TIPS by měla být pravidelně sledována průchodnost TIPS, jaterní funkce, jaterní encefalopatie a možnost vzniku hepatocelulárního karcinomu. Průchodnost TIPS lze monitorovat portální venografií, dopplerovským ultrazvukem, spirální CT angiografií, scintigrafií a nebo nepřímo endoskopicky (pouze u pacientů léčených pro krvácení z varixů). Taktika dispenzarizace je založena na získání základních údajů (např. portogram a PSG bezprostředně po vytvoření TIPS a parametry sledované při dopplerovském ultrazvuku během prvních několika dnů po vytvoření TIPS), které jsou porovnávány s následujícími vyšetřeními.
Portální venografie je stále zlatým standardem při vyšetření průchodnosti TIPS, protože poskytuje přímé zobrazení stenózy či ev. zobrazení plnících se jícnových varixů a zároveň poskytuje možnost přímého změření PSG a současně i intervenci. Nicméně vzhledem k její ceně a invazivitě, i když v některých centrech je prováděna i ambulantně, jsou jiná neinvazivní vyšetření (hlavně dopplerovský ultrazvuk) užívána jako její alternativa.
Dopplerovský ultrazvuk je pokládán za hlavní neinvazivní vyšetření při sledování průchodnosti TIPS, ale jeho přesnost v detekci dysfunkce není dobře stanovena. Jeho význam je jasně definován pro detekci okluze zkratu (senzitivita 85-100 %, specificita 96-100 %), ale už ne tak dobře pro detekci stenózy a/nebo zvýšení PSG [3]. Dřívější studie uvádějící více než 90% přesnost predikce dysfunkce TIPS se bohužel ukázaly pod světlem rozsáhlejších prospektivních i retrospektivních studií jako chybné. V jedné sérii, kde bylo použito několik ultrazvukových charakteristik zahrnujících reverzi toku, pokles rychlosti v TIPS nebo portální žíle, byla zjištěna pro každou z těchto charakteristik senzitivita 10-26 % a specificita 88-100 %. Tudíž negativní prediktivní hodnota byla špatná a pozitivní prediktivní hodnota akceptabilní [26]. V jiné prospektivní randomizované dvojitě slepé studii, ve které byla srovnávána akceptovaná ultrazvuková kritéria dysfunkce TIPS s portální venografií, byla senzitivita ultrazvuku pouze 35 % a specificita 88 % [27]. Z těchto výsledků vyplývá, že dopplerovský ultrazvuk nemůže zcela nahradit portální venografii v dispenzarizačním schématu. Nicméně vzhledem k jeho neinvazivnosti je na našem pracovišti primárně prováděn u všech pacientů, vyjma těch, kteří již mají klinické symptomy recidivy závažných komplikací portální hypertenze.
Na našem pracovišti je při každé kontrole pacienta se zavedeným TIPS rutinně proveden dopplerovský ultrazvuk zkratu, dále je zhodnocen celkový klinický stav (encefalopatie, recidiva komplikací portální hypertenze, laboratorní nález). V některých sporných případech může pomoci i horní endoskopie (velikost jícnových varixů, tíže portální gastropatie). Při suspekci na dysfunkci TIPS je indikována za hospitalizace portální venografie se změřením PSG a ev. intervencí. Základní ultrazvukové charakteristiky jsou většinou měřeny první nebo druhý den po zavedení TIPS a slouží k porovnání s hodnotami získanými při další dispenzarizaci. Další již ambulantní kontroly jsou obvykle časovány 1, 3 a 6 měsíců po zavedení TIPS a dále dle potřeby po 3 až 6 měsících. Základní dopplerovská kritéria pro zhodnocení funkce TIPS jsou uvedena v tab. 2 [28].
Tab. 2. Základní dopplerovská kritéria pro zhodnocení funkce TIPS [28]. ![Základní dopplerovská kritéria pro zhodnocení funkce TIPS [28].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9b283737d31f6687bcdf7fd8b2f60d71.jpg)
Řešení a prevence dysfunkce TIPS
Pokud je jednou dysfunkce TIPS zjištěna, měla by být provedena intervence (revize či rekanalizace, ev. vytvoření nového TIPS). Stenóza může být dilatována pomocí balonové angioplastiky samostatně nebo v kombinaci se zavedením dalšího stentu [29]. Akutní trombóza TIPS může být řešena mechanickou fragmentací, aspirací nebo dislokací trombu a u pacientů s nízkým rizikem krvácení i lokální trombolýzou. Plicní embolizace vzniklá při těchto manévrech nebývá klinicky významná. V současnosti je akutní trombóza TIPS indikací k zavedení ePTFE potahovaného stentu [30-33].
Jak již bylo řečeno, dysfunkce TIPS má různé příčiny a bývá lokalizována v různých místech zkratu, proto by měl preventivní zásah vedoucí k prodloužení průchodnosti TIPS ideálně postihovat všechny možné příčiny. Z toho vyplývá, že hledání prostředků, které by vedly primárně či sekundárně k prodloužení průchodnosti TIPS, je zaměřené několika směry (farmakoterapie, brachyterapie, lokální použití antiproliferativní látky, použití stentgraftu).
U pacientů s normální krevní srážlivostí (Child-Pugh A) nebo u pacientů s hyperkoagulačním stavem (Buddův-Chiariho syndrom při myeloproliferativním syndromu) můžeme předejít časné trombóze zkratu podáním heparinu či warfarinu. Antikoagulační terapie však neovlivní výskyt pozdních stenóz zkratu, proto dlouhodobá léčba není, vyjma nemocných s hyperkoagulačním stavem, indikována [34].
Podávání antiagregační terapie (kyselina acetylsalicylová) neovlivní průchodnost TIPS [35]. Výskyt výtokové stenózy TIPS však může být redukován podáním trapidilu (látka s anti-PDGF aktivitou) v kombinaci s tiklopidinem [36].
Preventivní brachyterapie (intraluminální ozařování zkratu) může být bezpečně provedena jako součást revize TIPS [37,38]. Dlouhodobé výsledky, doposud známé pouze z malého počtu nemocných, se jeví slibně spíše u pacientů s jaterní cirhózou etylické etiologie [38]. Studie s větším souborem pacientů doposud nejsou k dispozici.
V experimentu na prasatech se jeví úspěšně lokální podání paklitaxelu (látka blokující mitotickou aktivitu buněk) v době vytvoření TIPS na inhibici pseudointimální hyperplazie [39].
Jako nejslibnější v prevenci, jak časné tak i pozdní dysfunkce TIPS se zdá použití stentgraftu, který vytvoří bariéru mezi krví a jaterním parenchymem. V experimentu byly zkoušeny stentgrafty pokryté různým materiálem nebo stejným materiálem s různou permeabilitou. Nejlepší výsledky byly dosaženy se stentgraftem potaženým ePTFE. Ostatní materiály nevedly ke zlepšení průchodnosti TIPS ve srovnání s nepotahovanými stenty hlavně díky jejich porozitě, vyšší trombogenicitě a zánětlivé reakci (tab. 3).
Tab. 3. Stentgraft pro TIPS v experimentu. 
Poprvé byl u člověka použit stengraft (Palmaz stent potažený ePTFE) v roce 1996 při rekanalizaci trombotizovaného TIPS u pacienta s dokumentovanou biliární píštělí [48]. Od té doby se začaly používat, nejprve podomácku vyráběné a později komerčně dostupné, ePTFE stentgrafty jak pro revizi, tak i primoimplantaci TIPS, se zlepšením dlouhodobé průchodnosti zkratu [49-56]. U prvních stengraftů, které měly potah pouze v oblasti intraparenchymálního traktu zkratu, došlo k poklesu výskytu intraparenchymových stenóz a okluzí zkratu, ale nebyl zaznamenán efekt na výskyt výtokových stenóz [57,58]. V současnosti je nejčastěji používaným stentgraftem pro TIPS komerčně dostupný stent Viatorr od firmy W. L. Gore & Associates (obr. 2). Základem je flexibilní nitinolový samoexpandibilní stent, který tvoří kostru pro ePTFE protézu s redukovanou permeabilitou. Na konci stentu, který směřuje směrem do portální žíly, je nepotažená část v délce 2 cm, zbylá část stentu je již potažená. Délka této části se pohybuje od 4 do 8 cm a vždy by měla dosahovat až k ústí jaterní žíly do dolní duté žily [59,60]. Podle současných studií je při použití ePTFE stentgraftu dosaženo primární průchodnosti TIPS 87,4 % za 6 měsíců, 80,8-85,6 % za 1 rok a sekundární průchodnost TIPS 98,1 % za 1 rok [61-64].
Obr. 2. Dedikovaný ePTFE potahovaný stent Viatorr. 
Závěr
V současnosti má TIPS své pevné místo v léčbě některých závažných komplikací portální hypertenze. Díky dispenzarizaci s morfologickým zhodnocením funkce zkratu je dysfunkce TIPS často diagnostikována ještě před klinickou manifestací recidivy komplikací portální hypertenze. Použití ePTFE stentgraftů významně zlepšuje krátkodobou i dlouhodobou průchodnost TIPS a je v současnosti nejlepší primární i sekundární prevencí dysfunkce TIPS, což ale neeliminuje nutnost dispenzarizace.
Použité zkratky
ePTFE - expandovaný polytetrafloretylén,
PCU - polykarbonuretan,
PDGF - růstový faktor produkovaný destičkami,
PET - polyester,
PETP - polyetylentereftalát,
TIPS - transjugulární intrahepatální portosystémová spojka,
PSG - portosystémový gradient,
PU - polyuretan
Poděkování
Práce byla podpořena Výzkumným záměrem MZO 00179906 a IGA MZČR NR 8419-4.
MUDr. Václav Jirkovský
www.fnhk.cz
e-mail: vrtula@post.cz
Doručeno do redakce: 28. 8. 2006
Přijato po recenzi: 11. 10. 2006
Zdroje
1. Krajina A, Lojik M, Chovanec V et al. Stent-grafts in TIPS. Abdom Imaging 2004; 29 : 53-59.
2. Haskal ZJ, Martin L, Cardella JF et al. Quality Improvement Guidelines for Transjugular Intrahepatic Portosystemic Shunts. J Vasc Interv Radiol 2001; 12 : 131-136.
3. Bilbao JI, Quirita J, Herrero JI et al. Transjugular Intrahepatic Portosystemic shunt (TIPS): Current Status and Future Possibilities. Cardiovasc Intervent Radiol 2002; 25 : 251-269.
4. Haskal ZJ, Rees CR, Ring EJ et al. Reporting Standards for Transjugular Intrahepatic Portosystemic Shunts. J Vasc Interv Radiol 2003; 14 : 419-426.
5. ter Borg PCJ, Hollemans M, van Buuren HR et al. Transjugular Intrahepatic Portosystemic Shunts: Long-term Patency and Clinical Results in Pacient Cohort Observed for 3-9 Years. Radiology 2004; 231 : 537-545.
6. Haskal ZJ, Pentecost MJ, Soulen MC et al. Transjugular Intrahepatic Portosystemic Shunt Stenosis and Revision: Early and Midterm Results. AJR 1994; 163 : 439-444.
7. Chong WK et al. Incidence of Shunt Occlusion or Stenosis Following Transjugular Intrahepatic Portosystemic Shunt Placement. Gastroenterology 1994; 106 : 1277-1283.
8. Narazian GK, Ferral H, Castaneda-Zunica WR et al. Development of Stenoses in Transjugular Intrahepatic Portosystemic Shunts. Radiology 1994; 192 : 231-234.
9. Sterling KM, Darcy MD Stenosis of Transjugular Intrahepatic Portosystemic Shunts: Presentation and Management. ARJ 1997; 168 : 239-244.
10. Saxon RR, Ross PL, Mendel-Hartving J et al. Transjugular Intrahepatic Portosystemic Shunt Patenty and The Importace of Stenosis Location in The Development of Recurrent Symptoms. Radiology 1998; 207 : 683-693.
11. Saxon RR, Barton RE, Keller FS et al. Prevention, Detection and Treatment of TIPS Stenosis and Occlusion. Sem Interv Radiol 1995; 12 : 375-383.
12. Ducoin H, El-Khoury J, Rousseau H et al. Histopathologic Analysis of Transjugular Intrahepatic Portosystemic Shunts. Hepatology 1997; 25 : 1064-1069.
13. Cejna M, Peck-Radosavljevic M, Schroder M et al. Repeat Interventions for Maintenance of Transjugular Intrahepatic Portosystemic Shunt Function in Patients with Budd-Chiari Syndrome. J Vasc Iterv Radiol 2002; 13 : 193-199.
14. LaBerge JM, Ferrell LD, Ring EJ et al. Histopathologic Study of Stenotic and Occluded Transjugular Portosystemic Shunts. J Vasc Interv Radiol 1993; 4 : 779-786.
15. Stout LC, Lyon RE, Murray GB et al. Pseudointimal Biliary Epithelial Proliferation and Zahn’s Infarkt Associated with a 6 1/2-month-old Transjugular Intrahepatic Portosystemic Shunt. Am J Gastroenterol 1995; 90 : 126-130.
16. Saxon RR, Timmermans HA, Uchida BT. Stent-grafts for Revision of TIPS Stenoses and Occlusions: A Clinical Pilot Study. J Vasc Interv Radiol 1997; 8 : 539-548.
17. Jalan R, Harrison DJ, Redhead DN et al. Transjugular Intrahepatic Portosystemic Stent-shunt (TIPSS) Occlusion and The Role of Biliary Venous Fistulae. J Hepatol 1996; 24 : 169-176.
18. Sanyal AJ, Contos MJ, Yager D et al. Development of Pseudointima and Stenosis after Transjugular Intrahepatic portosystemic Shunts: Characterization of Cell Phenotype and Function. Hepatology 1998; 28 : 22-32.
19. Rossi P, Ricci P, Broglia L. Portal Hypertension. Diagnostic maging and Imaging - Guided Therapy. Springer-Verlag Berlin Heidelberg 2000.
20. Teng GJ, Bettmann MA, Hoopes PJ et al. Transjugular Intrahepatic Portosystemic Shunt: Effect of Bile Leak on Smooth Muscle Cell Proliferation. Radiology 1998; 208 : 799-805.
21. Teng GJ, Lu Q. Bile Leakage in Transjugular Intrahepatic Portosystemic Shunt: Effect on Human Umbilical Vein Endothelium (Abstrakt). J Vasc Interv Radiol 2003; 14(Suppl): S74.
22. Ducoin H, El-Khoury J, Rousseau H et al. Histopathologic Analysis of Transjugular Intrahepatic Portosystemic Shunts. Hepatology 1997; 25 : 1064-1069.
23. Zarins CK, Zatina MA, Giddens DP et al. Shear Stress Regulation of Artery Lumen Diameter in Experimental Atherogenesis. J Vasc Surg 1987; 5 : 413-420.
24. Mattsson EJ, Kohler TR, Vergel SR et al. Increased Blood Flow Induced Regression of Intimal Hyperplasia. Arterioscler Thromb Vasc Biol 1997; 17 : 2245-2249.
25. Chovanec V, Krajina A, Skrabkova Z et al. Potential Factors Influencing TIPS Patency (Abstract). Cardiovasc Intervent Radiol 2001; 24(Suppl 1): 137.
26. Sanyal AJ, Freedman AM, Luketic VA et al. The Natural History of Portal Hypertension after Transjugular Intrahepatic Portosystemic Shunts. Gastroenterology 1997; 112 : 889-898.
27. Owens CA, Bartolone C, Warner DL et al. The Inaccuracy of Duplex Ultrasonography in Predicting Patenty of Transjugular Intrahepatic Portosystemic Shunts. Gastroenterology 1998; 114 : 975-980.
28. Hůlek P, Krajina A et al. Current Practice of TIPS. Hradec Králové: Olga Štambergová Publishing House 2001; 12 : 164-171.
29. Ferral H, Banks B, Wholey M et al. Techniques for Transjugular Intrahepatic Portosystemic Shunt Revision. AJR 1998; 171 : 1041-1047.
30. Saxon RR, Timmermans HA, Uchida BT et al. Stent-grafts for Revision of TIPS Stenoses and Occlusions: A Clinical Pilot Study. J Vasc Interv Radiol 1997; 8 : 539-548.
31. DiSalle RS, Domatch BL. Treatment of TIPS Stenosis with ePTFE Graft-covered Stenos. Cardiovasc Intervent Radiol 1998; 21 : 172-175.
32. Haskal ZJ. Improved Patency of Transjugular Intrahepatic Portosystemic Shunts in Humans: Creation and Revision with PTFE Stent-grafts. Radiology 1999; 213 : 759-766.
33. Hůlek P, Krajina A et al. Current Practice of TIPS. Hradec Králové: Olga Štambergová Publishing House 2001; 14 : 183-197.
34. Sauer P, Theilmann L, Richter G et al. Phenprocoumon for Transjugular Intrahepatic Portosystemic Shunt (TIPS): Results of A Randomized Trial (Abstract). Gastroenterology 1995; 108: A1164.
35. Theilmann L, Bauer P, Rowen T et al. Acetyl Salicylic Acid in The Prevention of Early Stenosis and Occlusion of TIPS: A Controlled Study. Hepatology 1994; 20 : 592-597.
36. Siegerstetter V, Huber M, Ochs A et al. Platelet Aggregation and Platelet-Derived Growth Factor Inhibition for Prevention of Insufficiency of the Transjugular Intrahepatic Portosystemic Shunt: A Randomized Study Comparing Trapidil Plus Ticlopidine with Heparin Treatmant. Hepatology 1999; 29 : 33-38.
37. Dvorak J, Hulek P, Raupach J et al. Endovascular Brachytherapy of Transjugular Intrahepatic Portosystemic Shunt. Cardiovasc Radiat Med 2000; 2 : 3-6.
38. Pokrajac B, Cejna M, Kettenbach J et al. Intraluminal 192Ir Brachyterapy Following Transjugular Intrahepatic Portosystemic Shunt Revision: Long-Term Results and Radiotherapy Parameters. Cardiovasc Radiat Med 2001; 2 : 133-137.
39. Park SV, Cha IH, Lee SH et al. Inhibition of Pseudointimal Hyperplasia in Swine TIPS Model: The Efficacy of Local Delivery of Paclitaxel (Abstract). J Vasc Interv Radiol 2003; 14: S113.
40. Otal P, Rousseau H, Vinel JP. High Occlusion Rate in Experimental Transjugular Intrahepatic Portosystemic Shunt Created with a Dacron-Covered Nitinol Stent. J Vasc Interv Radiol 1999; 10 : 183-188.
41. Haskal ZJ, Brennecke LH Transjugular Intrahepatic Portosystemic Shunts Formed with Polyethylene Terephthalate-Covered Stenos: Experimental Evaluation in Pigs. Radiology 1999; 213 : 853-859.
42. Bloch R, Pavcnik D, Uchida BT et al. Polyuretane-coated Dacron-covered Stent-grafts for TIPS: Results in Swine. Cardiovasc Intervent Radiol 1998; 21 : 497-500.
43. Nishimine K, Saxon RR, Kichikawa K et al. Improved Transjugular Intrahepatic Portosystemic Shunt Patenty with PTFE-covered Srent-grafts: Experimental results in Swine. Radiology 1995; 196 : 341-347.
44. Haskal ZJ, Davis A, McAllister A et al. PTFE-encapsulated Endovascular Stent-grafts for Transjugular Intrahepatic Portosystemic Shunts: Experimental Evaluation. Radiology 1997; 205 : 682-688.
45. Tanihata H, Saxon RR, Kubota Y et al. Transjugular Intrahepatic Portosystemic Shunt with Silicone-covered Wallstents: Results in a Swine Model. Radiology 1997; 205 : 181-184.
46. Haskal ZJ, Brennecke LH. Porous and Nonporous Polycarbonate Urethane Stent-grafts for TIPS Formation: Biologic Response. J Vasc Interv Radiol 1999; 10 : 1255-1263.
47. Zhuang ZW, Hoopes PJ, Kontras PC et al. Transjugular Intrahepatic Portosystemic Shunt with a Autologus Vein-covered Stent: Results in a Swine Model. J Vasc Interv Radiol 2001; 12 : 1333-1342.
48. Cohen GS, Young HY, Ball DS. Stent-graft as Treatment for TIPS-biliary Fistula. J Vasc Interv Radiol 1996; 7 : 665-668.
49. Saxon RR, Timmermans HA, Uchida BT. Stent-grafts for Revision of TIPS Stenoses and Occlusions: A Clinical Pilot Study. J Vasc Interv Radiol 1997; 8 : 539-548.
50. Beneshti MV, Dolmach BL, Jones MP. Technical Considerations in Covering and Deploying a Wallstent Endoprothesis for the Salvage of a Failing Transjugular Intrahepatic Portosystemic Shunt. J Vasc Interv Radiol 1998; 9 : 289-293.
51. DiSalle RS, Dolmach BL. Treatment of TIPS stenosis with ePTFE Graft-covered Stents. Cardiovasc Intervent Radiol 1998; 21 : 172-175.
52. Patel NH, McLennan G, Shah H. Introduction of a ePTFE-covered Long, Spiral-articulated Palmaz Stent Through a 10F Sheat Using Umbilical Wrapping Technique. J Vasc Interv Radiol 1999; 10 : 1063-1066.
53. Boyvat F, Cekirge S, Balkanci F et al. Treatment of a TIPS-biliary Fistula by Stent-graft in a 9-yard-old Boy. Cardiovasc Intervent Radiol 1999; 22 : 67-68.
54. Sze DY, Vestring T, Liddell RP et al. Recurrent TIPS Failure Associated with Biliary Fistulae: Treatment with PTFE-covered Stenos. Cardiovasc Intervent Radiol 1999; 22 : 298-304.
55. Haskal ZJ. Improved Patenty of Transjugular Intrahepatic Portosystemic Shunts in Humans: Creation and Revision with PTFE Stentgrafts. Radiology 1999; 213 : 759-766.
56. Haskal ZJ, Weintraub JL, Susman J. Recurrent. TIPS Thrombosis After Polyethylene Stent-grafts Use and Salvage with Polytetrafluoroethylene Stent-grafts. J Vasc Interv Radiol 2002; 13 : 1255-1259.
57. Krajina A, Hulek P, Lojik M et al. Creation of TIPS with The Use of ePTFE Stent-graft (Abstract). Cardiovasc Intervent Radiol 1999; 22(Suppl 2): S122.
58. Andrews RT, Saxon RR, Bloch RD. Stent-grafts for De Novo TIPS: Technique and Early Results. J Vasc Interv Radiol 1999; 10 : 1371-1378.
59. Cejna M, Peck-Radosavljevic M, Thurnher SA et al. Creation of Transjugular Intrahepatic Portosystemic Shunts with Stent-grafts: Initial Experiences with a Polytetraflorethylene-covered Nitinol Endoprosthesis. Radiology 2001; 221 : 437-446.
60. Otal P, Smayra T, Burelu C et al. Preliminary Results of a New Expanded-polytetrafluoroethylene-covered Stent-grafts for Transjugular Intrahepatic Portosystemic Shunts Procedures. AJR 2002; 178 : 141-147.
61. Hausegger KA, Karnel F, Georgieva B et al. Transjugular Intrahepatic Portosystemic Shunt Creation with the Viatorr Expanded Polytetrafluoroethylene-Covered Stent-Graft. J Vasc Interv Radiol 2004; 15 : 239-248.
62. Bureau C, Garcia-Pagan JC, Otal P et al. Improved Clinical Outcome Using Polytetrafluoroethylene-Coated Stenos for TIPS: Results of a Randomized Study. Gastroenterology 2004; 126 : 469-475.
63. Charon JPM, Alaeddin FH, Pimpalwar SA et al. Results of a Retrospective Multicenter Trial of the Viatorr Expanded Polytetrafluoroethylene-Covered Stent-Grafts for Transjugular Intrahepatic Portosystemic Shunt Cr eation. J Vasc Interv Radiol 2004; 15 : 1219-1230.
64. Rossi P, Salvatori FM, Fanelli F et al. Polytetrafluoroethylene-Covered Nitinol Stent-Graft for Transjugular Intrahepatic Portosystemic Shunt Creation: 3-year Experience. Radiology 2004; 231 : 820-830.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Pankreatikopleurální píštěleČlánek Indrák K et al. Hematologie.
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2007 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Pankreatikopleurální píštěle - editorial
- Chirurgická ablace fibrilace síní: budoucnost kardiochirurgie? - editorial
- Reziduální echokardiografické nálezy a NT-proBNP u asymptomatických dospělých pacientů po radikální korekci Fallotovy tetralogie
- Vliv sekundárního zavedení ePTFE potahovaného stentu na udržení průchodnosti TIPS
- Nízkodávkovaný talidomid u refrakterního a relabujícího mnohočetného myelomu
- Pankreatikopleurální píštěle
- Paradoxní embolizace při foramen ovale patens u potápěčů: možnosti screeningu
- Klinicky manifestní gastrointestinální krvácení u koronarografovaných nemocných
- Dlouhodobá účinnost chirurgické kryoablace chronické fibrilace síní provedené při operaci pro závažnou mitrální regurgitaci
- Dysfunkce transjugulární intrahepatální portosystémové spojky (TIPS) a její řešení
- Enkapsulující peritoneální skleróza
- Teplota nejasné etiologie: příčiny a diagnostický postup
- Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu
- Dialog hematologa a internisty: problém specializace a informací v medicíně
- Kalita Z et al. Akutní cévní mozkové příhody. Diagnostika, patofyziologie, management.
- Safar ME, O’Rourke MF (eds). Arterial stiffness in hypertension.
- Veselka J et al. Hypertrofická kardiomyopatie a příbuzná témata.
- Válek V, Kala Z, Kiss I et al. Maligní ložiskové procesy jater. Diagnostika a léčba včetně minimálně invazivních metod.
- Krajsová I. Melanom. Klasifikace, diagnostika, terapie, prevence.
- Tesař V, Schück O et al. Klinická nefrologie.
- Klener P et al. Propedeutika ve vnitřním lékařství.
- Goldberg E. Paradox moudrosti. Jak být duševně výkonnější, přestože mozek stárne.
- Štejfa M et al. Kardiologie. 3. přepracování a doplněné vydání.
- Indrák K et al. Hematologie.
- Šafránková A, Nejedlá M. Interní ošetřovatelství I a II.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Teplota nejasné etiologie: příčiny a diagnostický postup
- Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu
- Enkapsulující peritoneální skleróza
- Dlouhodobá účinnost chirurgické kryoablace chronické fibrilace síní provedené při operaci pro závažnou mitrální regurgitaci
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



