-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Časná diagnostika invazivních mykotických infekcí u hematoonkologických nemocných pomocí sérologických metod
Early diagnosis of invasive fungal infections in hematooncological patients by serological methods
Invasive fungal infections have become one of the major causes of morbidity and mortality in hematooncological patients over the past 2 decades. Even there is an increasing incidence of invasive fungal infections caused by rare filamentous fungi, the majority of infections are caused by Candida sp. and especially Aspergillus sp. Early diagnosis and prompt initiation of antifungal treatment are leading factors influencing prognosis of patients with invasive fungal infection. Important advances in the field of early diagnosis of invasive fungal infections have been realized over the last years. Beside of new radiological methods the major progress has been done in serological methods. In this paper we review the most important of these serological methods and their position in routine clinical practice.
Key words:
hematological malignancies - invasive fungal infections - serological methods - galactomannan - mannan - antimannan - 1,3-β-D-glucan
Autoři: Z. Ráčil 1; I. Kocmanová 2; B. Wagnerová 1; M. Lengerová 1; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 1; Oddělení klinické mikrobiologie FN Brno, pracoviště Bohunice, přednosta prim. MUDr. Alena Ševčíková 2
Vyšlo v časopise: Vnitř Lék 2007; 53(9): 990-999
Kategorie: Přehledný referát
Souhrn
Invazivní mykotické infekce se během posledních dvou dekád staly jedním z důležitých faktorů ovlivňujících morbiditu a mortalitu nemocných s hematologickou malignitou. Přestože se v posledních několika letech setkáváme s nárůstem incidence invazivních mykóz způsobených vzácně se vyskytujícími houbami, absolutní většina oportunních mykotických infekcí je způsobena kmeny kandid a především pak kmeny aspergilů. Časná diagnóza a zahájení účinné antimykotické léčby má zásadní vliv na prognózu nemocných. V poslední době došlo k výraznému pokroku právě na poli časné diagnostiky invazivních mykóz - vedle nových zobrazovacích metod je to především rozvoj nových sérologických metod. V následující souhrnné práci přinášíme základní informace o nejdůležitějších z nich a zejména o jejich využití v rutinní klinické praxi.
Klíčová slova:
hematologické malignity - invazivní mykotické infekce - sérologické metody - galaktomannan - mannan - antimannan - 1,3-β-D-glukanDůvody pro vývoj a používání sérologických metod v diagnostice invazivních mykotických infekcí
Invazivní mykotické infekce představují závažnou infekční komplikaci imunokompromitovaných nemocných s nádorovým onemocněním. Ve srovnání s bakteriálními infekcemi je jejich výskyt jednoznačně méně častý, na druhou stranu incidence invazivních mykotických infekcí narůstá a morbidita a mortalita s nimi spojená je výrazně vyšší, než je tomu u infekcí bakteriálních. Přestože invazivní mykózy postihují celou skupinu nemocných s nádorovým onemocněním, je jejich výskyt u pacientů se solidními nádory spíše vzácný. Naopak velice časté jsou u nemocných s hematologickými malignitami, a to především, je-li součástí léčebného režimu transplantace krvetvorné tkáně [1,2].
Během posledních dvou dekád došlo k signifikantnímu nárůstu frekvence výskytu těchto infekcí u hematoonkologických nemocných [1]. U této skupiny pacientů se v závislosti na charakteru onemocnění, respektive charakteru a intenzitě protinádorové léčby, pohybuje incidence invazivních mykóz od 2 % (např. autologní transplantace krvetvorné tkáně) až po 15-25 % (např. indukční léčba akutní leukemie nebo alogenní transplantace krvetvorné tkáně) [3]. Vedle zvýšení incidence invazivních mykotických infekcí však dochází i ke změně ve spektru vyvolávajících patogenů. Od začátku 90. let minulého století, kdy se u hematoonkologických nemocných rozšířila masivní profylaxe flukonazolem, trvale klesá incidence invazivních kandidóz, zejména vyvolaných na flukonazol citlivými kmeny kvasinek [4-6]. Naopak ve stejném období dochází k výraznému nárůstu incidence invazivních infekcí vyvolaných vláknitými houbami [4-6]. Absolutní většinu představuje invazivní aspergilóza, která je v současné době nejčastější mykózou u nemocných po alogenní transplantaci krvetvorné tkáně [7,8]. Incidence infekcí vyvolaných ostatními vláknitými houbami, a to především invazivní zygomykóza a invazivní fusarióza, je naštěstí sice stále nízká, ale i tato během posledních několika let zvláště ve velkých transplantačních centrech významně narostla [9].
Tab. 1. Nejvýznamnější studie sledující význam detekce GM pro diagnostiku invazivní aspergilózy (IA) u hematoonkologických nemocných. 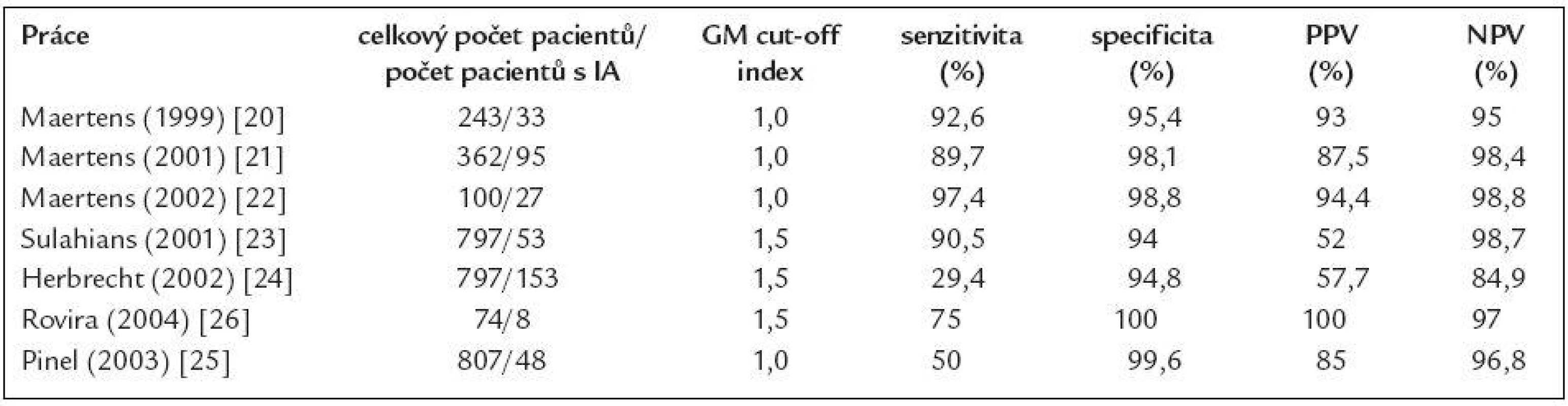
GM – galaktomannan, IA – invazivní aspergilóza, PPV – pozitivní prediktivní hodnota, NPV – negativní prediktivní hodnota Vysoká mortalita na tato onemocnění, anebo naopak úspěch léčby jsou ovlivňovány celou řadou faktorů. Nicméně klíčový vliv na zlepšení přežití pacientů s invazivní mykotickou infekcí má časné zahájení účinné antimykotické léčby ještě v době, kdy je nálož mykotického patogenu malá a poškození tkání omezené [10,11]. Bohužel včasné zahájení léčby, které vyžaduje včasnou a co možná nejpřesnější diagnózu, zůstává největší překážkou a nejednou se stává, že je definitivní diagnóza stanovena až ante mortem. Klinické symptomy těchto infekcí jsou totiž velmi variabilní a nespecifické a často se rozvíjejí až velmi pozdě. Konvenční mikrobiologické metody (mikroskopie, kultivace) jsou většinou v časných stadiích nevýtěžné. Histologický průkaz infekce (přestože stále zůstává základním kamenem pro definitivní potvrzení diagnózy), vyžaduje invazivní výkon, který je často u trombocytopenických pacientů neproveditelný. Konvenční radiologické metody jsou málo senzitivní. Výjimku představuje pouze vysoce rozlišovacího CT (HR CT) v časné diagnostice plicních forem invazivních mykóz způsobených vláknitými houbami, nicméně RTG nález nám ani v tomto případě nedokáže přinést informaci o původu, eventuálně změnách v plicním parenchymu [12,13].
Z výše uvedeného vyplývá potřeba nových přístupů k časné diagnostice invazivních mykotických infekcí, zvláště pak v souvislosti se skupinou nejvíce ohrožených nemocných pacientů s hematologickou malignitou. Období mezi vznikem infekce a rozvojem klinických příznaků představuje terapeutické okno - pokud je ovšem v tomto období infekce pravidelným screeningem detekována, může být časně zahájena agresivní antimykotická léčba s následným zlepšením prognózy nemocných.
Tento takzvaný preemptivní přístup vyžaduje rychlé, neinvazivní, senzitivní a specifické diagnostické metody.
Tyto požadavky splňují v posledních letech se rozvíjející nekultivační diagnostické metody, které obecně dělíme na molekulárně biologické a sérologické.
Metody molekulárně biologické využívají detekce nukleových kyselin mykotických patogenů pomocí různých variant polymerázové řetězové reakce (PCR). Bohužel přestože se zdá PCR detekce invazivních mykóz velmi perspektivní, doposud nebyla nalezena standardní a optimální metodika, která by byla všeobecněji rozšířena, a tak do dnešního dne nelze výsledky mezilaboratorně srovnávat. PCR metody tedy zatím není možno využít jako diagnostické kritérium pro invazivní mykotické infekce [14,15].
Druhá skupina nekultivačních metod využívá imunologických nebo biochemických postupů k detekci cytoplazmatických antigenů, antigenů buněčné stěny nebo protilátek proti nim v séru nebo jiných tělesných tekutinách. Tyto metody se souhrnně označují jako sérologické. V rámci sérologické diagnostiky invazivních mykóz byla zkoušena celá řada postupů. Nicméně většího uplatnění a klinického významu dosáhlo pouze několik z nich: detekce antigenu galaktomannanu pro invazivní aspergilózu, obdobně detekce mannanu a protilátek proti němu (antimannanu) v diagnostice invazivní kandidózy a nově pak detekce antigenu 1,3-β-D-glukanu, který umožňuje „panfungální“ diagnostiku.
V této souhrnné práci bychom chtěli informovat o možnostech laboratorní diagnostiky pomocí sérologických metodik a o klinickém využití takto získaných výsledků v časné diagnostice invazivních mykotických infekcí u hematoonkologických pacientů.
Galaktomannan - marker invazivní aspergilózy (IA)
Galaktomannan (GM) je polysacharid buněčné stěny aspergilů a některých dalších hub, který se uvolňuje do tělesných tekutin při růstu a invazi aspergilových hyf do tkání [16,17]. Pro detekci tohoto antigenu v séru a ostatních tělesných tekutinách se využívá krysích monoklonálních protilátek EB-A2, které jsou vysoce specifické pro β-1,5 - galaktofuranozylové konce aspergilového galaktomannanu. První komerční kit pro detekci GM byl postaven na principu latexové aglutinace a uveden na trh v roce 1990 (Pastorex Aspergillus). Vzhledem k relativně vysokému detekčnímu limitu (15-20 ng/ml) je však jeho používání spojeno s nízkou senzitivitou. V roce 1995 byl proto na trh uveden nový produkt firmy BioRad, který využívá ELISA metodiku (Platelia Aspergillus). Jeho detekční limit je výrazně nižší (0,5-1 ng/ml), což odpovídá výrazně vyšší senzitivitě [18,19]. Reakce je semikvantitativní - výsledek je udáván jako index pozitivity (IP) - poměr mezi naměřenou optickou denzitou a optickou denzitou kontrolního séra obsahujícího přibližně 1 ng GM/ml.
Prospektivní studie sledující detekci galaktomannanu jako markeru invazivní aspergilózy u nemocných s vysokým rizikem vzniku této infekce ukázaly, že Platelia Aspergillus test má vysokou specificitu pohybující se v rozmezí 81 %-100 %. Extrémně vysoká je také negativní prediktivní hodnota testu, která je v absolutní většině studií nad 95 %. Negativní výsledek testu tedy s velmi vysokou pravděpodobností vylučuje invazivní aspergilózu a falešné negativity jsou vzácné [12,19-26]. Na druhou stranu senzitivita a pozitivní prediktivní hodnota jsou bohužel do určité míry slabými místy tohoto testu.
Senzitivita testu v různých pracích totiž značně kolísá, a to v rozmezí 30 %-100 % [12,19-26]. Příčin kolísající senzitivity, a tedy faktorů, které senzitivitu testu ovlivňují, je několik. Prvním bodem je hodnota tzv. cut-off indexu pozitivity (cut-off IP), tedy hodnoty indexu pozitivity, od které je vzorek označen jako pozitivní. Maertens et al, ale i další autoři prokázali, že snížení cut-off z hodnoty IP = 1,5 na hodnotu IP = 0,5 vede k výraznému zvýšení senzitivity testu při současném jen mírném zhoršení jeho specificity (82,7 % vs 96,5 %) [27]. Toto snížení cut-off indexu pozitivity je důležité především u nemocných, kteří dostávají profylakticky antimykotika s efektem na vláknité houby a u nemocných po transplantaci krvetvorné tkáně s reakcí štěpu proti hostiteli (GvHD). U obou těchto skupin pacientů je mykotická nálož nízká a proto při užití vyšších hodnot cut-off IP by tito nemocní byli falešně označeni za negativní a naopak při cut-off IP = 0,5 je test dokáže správně označit za pozitivní [28,29]. Druhým faktorem ovlivňujícím senzitivitu je frekvence a pravidelnost vyšetřování. Maximální senzitivity je u vysoce rizikových nemocných (pacienti s akutní leukemií podstupující indukční nebo reindukční léčbu, nemocní podstupující alogenní transplantace krvetvorné tkáně, zvláště pak při rozvoji reakce štěpu proti hostiteli) dosaženo, jestliže jsou odběry krve pro detekci GM prováděny pravidelně a to 2 - 3krát týdně a potom minimálně 1krát týdně po propuštění z hospitalizace, jestliže riziko invazivní aspergilózy trvá (např. při přítomnosti chronické reakce štěpu proti hostiteli) [19,30].
Druhým slabým místem je pozitivní prediktivní hodnota (PPV) testu (čili pozitivní výsledek správně označí nemocného s invazivní aspergilózou). PPV kolísá v různých pracích v rozmezí 50 %-100 % [12,19-26]. Opět se setkáváme s celou řadou faktorů, které PPV testu ovlivňují. Prvním z těchto faktorů je incidence IA ve vyšetřované skupině pacientů. Pravděpodobnost, že pozitivní výsledek testu označí skutečně nemocného pacienta, je nejvyšší ve skupinách nemocných s nejvyšší incidencí invazivní aspergilózy a těmi jsou především nemocní s akutní leukemií a pacienti po alogenní transplantaci krvetvorné tkáně (incidence IA je zde 10 % resp. 20 %). U ostatních skupin pacientů, kde je incidence IA nízká (nemocní s lymfomy, mnohočetným myelomem, chronickými leukémiemi a nebo po autologní transplantaci krvetvorné tkáně), je významně nižší i PPV testu [18]. Druhým faktorem ovlivňujícím PPV a specificitu Platelia Aspergillus testu, je kritérium, které označí pacienta jako pozitivního (jednorázová vs opakovaná/konsekutivní pozitivita vzorku). Maertens et al využil test k prospektivnímu sledování nemocných s vysokým rizikem invazivní aspergilózy a prokázal, že jak při použití cut-off indexu pozitivity 1,0, tak 0,5 specificita testu významně narůstá, pokud je nemocný označen za skutečně pozitivního až při pozitivitě 2 vzorků jdoucích za sebou (85,4 % vs 98,8 % a 98,6 % vs 85,1 %) [22,27]. Konečně nejvýznamnějším faktorem ovlivňujícím PPV testu je přítomnost falešných pozitivit. I přes používání konsekutivní pozitivity, je až 20 % pozitivních výsledků falešně pozitivních [18]. Příčin falešných pozitivit Platelia Aspergillus testu je celá řada a mohou být rozděleny do 3 skupin:
- a) kontaminace vzorku při odběru nebo zpracování,
- b) průnik antigenu (pravého nebo zkříženě reagujícího) přes poškozenou nebo nezralou sliznici zažívacího traktu,
- c) reakce s antigenem (pravým nebo zkříženě reagujícím) v cirkulaci [18,31,32].
Nejvýznamnější příčiny falešné pozitivity ukazuje tab. 2. Odlišení falešné pozitivity od pozitivity skutečné je často nesnadné. Kontaminaci vzorku nám pomůže identifikovat jednak retest pozitivního vzorku a jednak již výše zmíněný požadavek na nutnost minimálně 2 pozitivních vzorků pro označení nemocného jako skutečně pozitivního. V ostatních případech je nutná jednak znalost možných příčin falešné pozitivity lékařem, který provádí interpretaci výsledků, ale především přítomnost jiných známek invazivní aspergilózy (klinický stav, zobrazovací metody) a nebo alespoň přítomnost rizika pro její vznik (např. nemocný po alogenní transplantaci krvetvorné tkáně). Klinicky nejvýznamnější příčiny možných falešných pozitivit testu jsou pozitivita při podávání penicilinových antibiotik (piperacilin/tazobactam, ampicilin, některé co-amoxiciliny) a pozitivita při postižení zažívacího traktu [18].
Tab. 2. Příčiny falešné pozitivity Platelia Aspergillus testu. 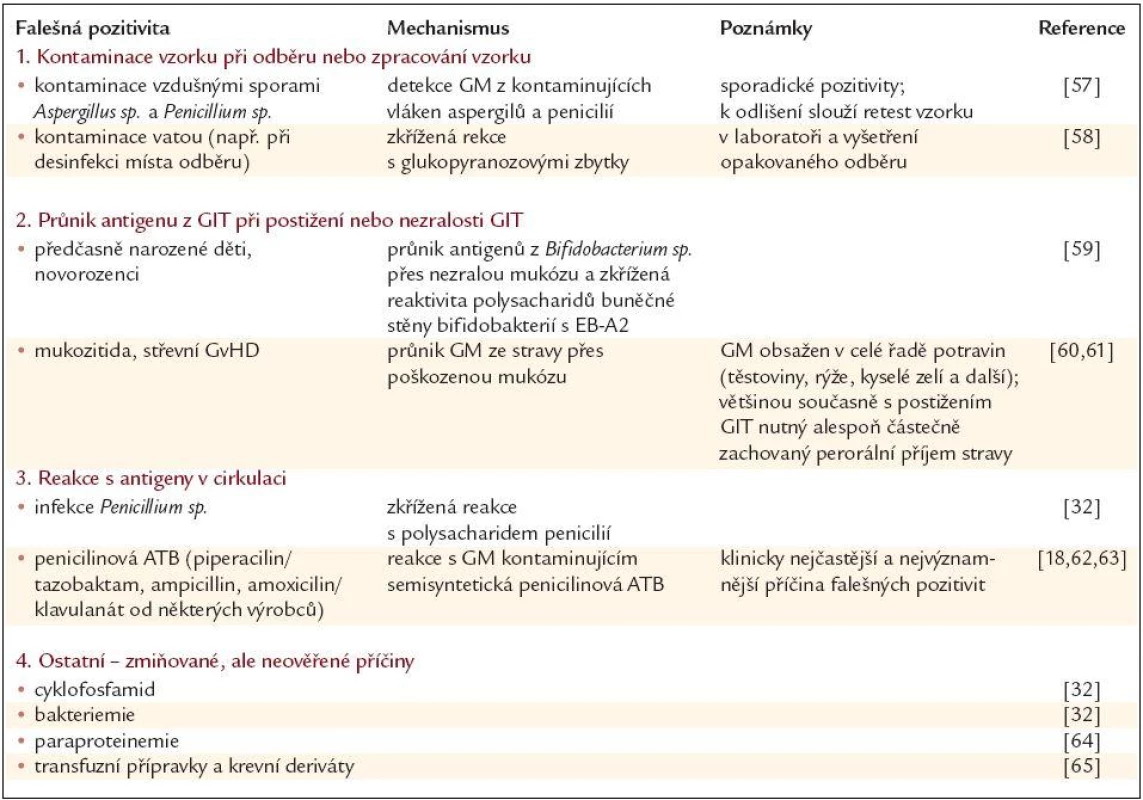
GM – galaktomannan, GIT – gastrointestinální trakt, ATB – antibiotika Detekce GM pomocí testu Platelia Aspergillus přináší několik klinicky velmi důležitých výhod.
GM může být při pravidelně prováděném monitoringu zachycen v séru nemocných s invazivní aspergilózou ve velmi časném stádiu infekce, často před rozvojem symptomů nebo podezřelých radiologických abnormalit. V práci Maertense et al předcházela pozitivita GM v séru u 55 % nemocných rozvoj febrilií, a to s mediánem 3,5 dne, u 80 % pacientů abnormalitu na RTG a nebo CT plic s mediánem 8 resp. 6 dnů. Pravděpodobně nejdůležitějším faktem však zůstává, že pozitivita GM předcházela u téměř 90 % pacientů s mediánem 6 dnů zahájení účinné antimykotické léčby. Pravidelně prováděné vyšetřování GM u nemocných s vysokým rizikem IA tedy umožní o řadu dní zkrátit interval do stanovení diagnózy a do zahájení podávání účinného antimykotika a tak výrazně zlepšit prognózu těchto pacientů [11,12].
Další velkou výhodou GM je možnost diferenciální diagnostiky abnormalit na HR CT plic. Obraz invazivní aspergilózy na HR CT, přestože jsou popisované některé charakteristické známky (halo sign, air crescent sign), může být velmi variabilní a při negativitě konvenčních mikrobiologických metod (kultivace, mikroskopie ze sputa nebo tekutiny z bronchoalveolární laváže) je zjištění mykotické etiologie procesu velmi obtížné, ne-li nemožné [33]. Je-li však abnormalita na HR CT doplněna současnou pozitivitou GM ze séra, pak jsou již splněna kritéria pravděpodobné invazivní aspergilózy dle EORTC/MSG (European Organisation for Research and Treament of Cancer/Mycosis Study Group), a mohou tak být ihned podána antimykotika s účinkem na kmeny aspergilů [30,34]. Konečně, na rozdíl od HR CT, může GM detekovaný v séru (resp. vývoj indexu pozitivity) sloužit jako marker léčebné odpovědi a nebo naopak selhávání zvolené antimykotické léčby [30]. Při efektivní antimykotické léčbě hodnota IP v průběhu léčby klesá, a naopak při jejím selhávání hodnota IP intenzivně narůstá, a dojde-li k více než dvojnásobnému nárůstu IP po 1 týdnu antimykotické léčby, je s více než 90% jistotou zvolený léčebný postup neúčinný [35].
Přestože je Platelia Aspergillus test určen primárně k vyšetřování séra, lze pomocí něj detekovat GM i v jiných tělesných tekutinách, eventuálně v tkáních [36]. Protože invazivní aspergilóza je ve většině případů inhalační infekcí a primárně jsou postiženy plíce, není překvapení, že nejčastěji vyšetřovaným materiálem jiným než sérum je tekutina získaná bronchoalveolární laváží (BAL). Detekce GM z tekutiny získané BAL je spojena se senzitivitou pohybující se od 60 - 100 %. Senzitivita je opět vyšší, jestliže je použit jako cut-off dnes doporučovaný IP = 0,5, přičemž specificita testu zůstává stále vysoká (94 %) [37]. Výhodou detekce GM z tekutiny získané BAL je především významně vyšší senzitivita a časnější pozitivita ve srovnání s konvenčními mikrobiologickými metodami používanými k detekci IA z materiálu získaného BAL (kultivace, mikroskopie). Jsou popsány případy, kdy pozitivita GM z tekutiny získané BAL předcházela pozitivitu GM v séru. Tyto nálezy odpovídají patogenezi plicní formy invazivní aspergilózy. V běžné klinické praxi, kdy většinou provádíme BAL v případě nálezu plicních infiltrátů na zobrazovacích metodách, je časový rozdíl mezi pozitivním záchytem GM z krve a z BAL většinou minimální.
Dalším materiálem, ve kterém je často GM detekován, je mozkomíšní mok. Postižení centrálního nervového systému je většinou součástí diseminace plicní formy IA, spíše výjimečně jde o izolované postižení. Detekce GM z mozkomíšního moku u nemocných s postižením CNS je spojena, na rozdíl od velmi často negativní kultivace, s velmi vysokou senzitivitou pohybující se mezi 80 - 100 % [38,39]. Pozitivita GM z mozkomíšního moku (samotná nebo spolu s pozitivitou GM v séru) je tak vedle klinického a případně i radiologického nálezu jediný mikrobiologický marker, který může vést k diagnóze postižení CNS invazivní aspergilózou [38]. Je však nutné si uvědomit, že i při plicní formě IA (bez postižení CNS) může část sérového GM pronikat přes hematoencefalickou bariéru stejně tak jako může dojít k „kontaminaci“ mozkomíšního moku GM z krve při hemoragickém odběru vzorku likvoru. IP pozitivity GM v mozkomíšním moku však v těchto případech bývají výrazně nižší [30,38].
Tab. 3. Detekce galaktomannanu – Platelia Aspergillus – souhrn. 
IA – invazivní aspergilóza, HSCT – transplantace krvetvorné tkáně, GvHD – reakce štěpu proti hostiteli, AML – akutní myeloidní leukemie, IP – index pozitivity, BAL – bronchoalveolární laváž, CNS – centrální nervový systém Detekce GM z jiných tělesných tekutin eventuelně z tkání byla sice testována, nicméně interpretace výsledků není v současné době jednotná (30).
Mannan a antimannan - diagnostika invazivní kandidózy (IC)
Sérologická diagnostika invazivní kandidózy (IC) je na rozdíl od invazivní aspergilózy (IA) mnohem složitější. Přestože různé metodiky pro sérologickou diagnostiku IC byly testovány již od 80. let minulého století, jsou publikované zkušenosti mnohem sporadičtější, než je tomu u invazivní aspergilózy (IA). Hlavním problémem je složitá interpretace výsledků, která souvisí s patofyziologií IC, která je dynamickým procesem. U hematoonkologických nemocných představuje vznik invazivní kandidózy kontinuum od kolonizace nemocného přes postupný průnik kvasinek různým stupněm poškozenou mukózou až k jednoznačné infekci krevního řečiště a tkání [40]. V průběhu vývoje byla testována řada markerů využitelných pro časnou diagnostiku IC (enoláza, heat shock proteiny, arabinitol a další), nicméně širšího klinického využití dosáhly jen dva testy (komerčně dostupné) - detekce mannanu a protilátek proti němu, tzv. antimannanu.
Polysacharid mannan je spolu s glukany hlavní komponentou buněčné stěny kvasinek. Na rozdíl od glukanů je však vázán kovalentními vazbami na proteiny buněčné stěny a je vysoce imunogenní [40]. V průběhu invazivní kvasinkové infekce dochází k uvolňování mannanu do tělesných tekutin, kde pak může být detekován. Jeho biologický poločas v krvi je však velmi krátký (pohybuje se v hodinách) a pokud tedy má být zachycen, je nutný frekventní odběr vzorků krve (41). Pro detekci mannanu je využívána monoklonální protilátka EB-CA1, rozpoznávající α-oligomanosové zbytky. Iniciálně (podobně jako u galaktomannanu) byla tato protilátka použita v latexové aglutinaci (Pastorex Candida). Ovšem detekční limit této soupravy je opět relativně nízký (1,5 ng/ml) a senzitivita testu tak nedostatečná. V současné době se mannan detekuje pomocí senzitivnější ELISA metodiky (Platelia Candida Ag) s limitem 0,1 - 0,5 ng/ml a za pozitivní je považován vzorek s koncentrací mannanu větší než 0,5 ng/ml. Izolovaná detekce tohoto antigenu pro diagnózu invazivní kandidózy je však i přes použití ELISA metodiky limitována nízkou senzitivitou, která se pohybuje v rozmezí 30 %-70 % (tab. 4).
Tab. 4. Nejvýznamnější studie sledující význam detekce mannanu, antimannanu a jejich kombinace pro diagnostiku invazivní kandidózy. 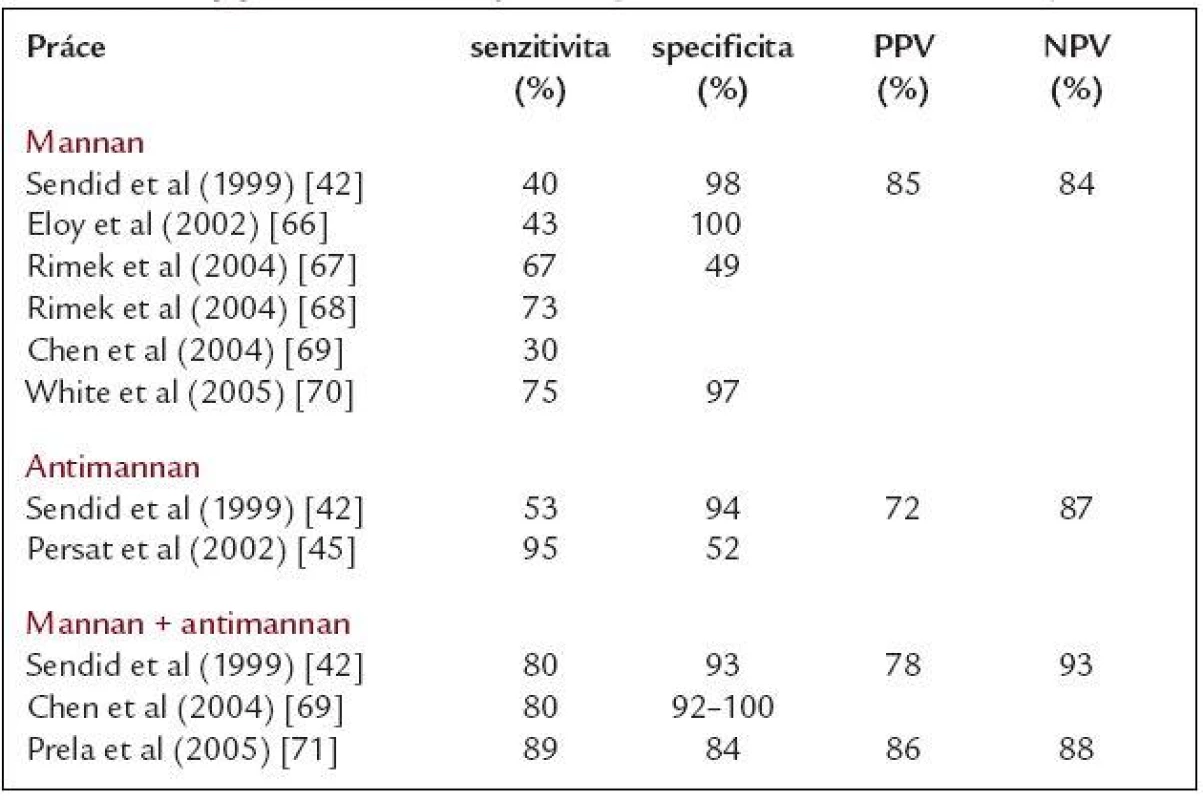
PPV – pozitivní prediktivní hodnota, NPV – negativní prediktivní hodnota Existují dvě hlavní příčiny.
Především je to tranzientnost a rychlá eliminace mannanu z cirkulace a tak nejsou-li odběry prováděny dostatečně často, nemusí být mannan vůbec zachycen. Příkladem může být práce Sendida et al, kde byl mannan ve skupině nemocných s IC, u kterých bylo k dispozici několik odběrů, zachycen ve 40 % případů. Ale pokud byl od pacientů k dispozici pouze jeden vzorek krve, byla senzitivita testu pouze 11 % [42].
Druhým faktorem, ovlivňujícím senzitivitu, je rozdílná schopnost testu rozpoznávat různé druhy kvasinek. Monoklonální protilátka EB-CA1 se váže α-oligomanózové zbytky složené z více jak 4 manóz. Tyto jsou prezentovány ve velkém počtu na povrchu Candida albicans, Candida glabrata a Candida tropicalis, ale v daleko menším množství na povrchu Candida parapsilosis, Candida krusei a Candida kefyr. Z těchto důvodů je senzitivita testu pro detekci IC způsobené posledními třemi jmenovanými druhy velmi malá a pohybuje se pouze kolem 30 % [40]. Specificita testu pro detekci mannanu kolísá, ale ve většině prací se pohybuje nad 90 %. Přestože falešná pozitivita nebývá častá, může existovat u neutropenických nemocných s mukozitidou v důsledku průniku antigenů kolonizujících kvasinek přes poškozenou bariéru zažívacího traktu [43].
Podobně jako galaktomannan lze i mannan detekovat pomocí Platelia Candida Ag testu také v jiných tělesných tekutinách než v séru. Dosavadní zkušenosti jsou však jen omezené. Nejvíce je využívána detekce z mozkomíšního moku pro diagnózu kandidové meningitidy, kdy je test pozitivní až ve 100 % případů [44].
Mannan je vysoce imunogenní molekulou a v organizmu vede k rychlé tvorbě protilátek všech tříd - tzv. antimannanů. Antimannan pak opět může být využit v diagnostice invazivní kandidózy. K detekci antimannanu slouží nejčastěji ELISA metodika. Přestože jsou komerčně dostupné testy pro stanovení protilátek jednotlivých tříd (IgG, IgA, IgM), větší senzitivitu přináší a tak i rozšířenější je test detekující celkové protilátky proti mannanu (Platelia Candida Ab) [45]. Výsledek je označován za pozitivní, jestliže koncentrace protilátek přesáhne 10 AU/ml (Arbitrary Units). Senzitivita i specificita samostatně použitého Platelia Candida Ab pro diagnostiku invazivní kandidózy však v různých pracích značně kolísá (od 50 do 90 %) [42]. Nízká senzitivita testu je dána především omezenou schopností tvorby protilátek u imunokompromitovaných hematoonkologických nemocných [40]. Druhým faktorem snižujícím senzitivitu je opět (podobně jako u detekce mannanu) omezená schopnost detekovat infekci vyvolanou kmeny Candida parapsilosis, Candida krusei a Candida kefyr (test používá jako antigen mannan z kmenů Candida albicans, který má jen omezenou reaktivitu s protilátkami vznikajícím při infekci těmito kmeny kvasinek) [40]. Hlavním problémem je však nízká specificita testu. Velká část nemocných i přes svou imunosupresi reaguje na zvýšenou kolonizaci kvasinkami (především v oblasti GIT) právě tvorbou antimannanu, a to i ve vysokém titru, a to bez klinických známek invazivní kandidózy. Jednoznačné označení těchto výsledků za striktně falešně pozitivní je však spornou otázkou. Vznik invazivní kandidózy je, jak výše zmíněno, dynamický proces a kolonizace nemocného kvasinkami je nezávislým rizikovým faktorem pro vznik infekce. Je tedy spíše otázkou, zda od metody očekáváme časnou a nebo jistou diagnózu invazivní kvasinkové infekce a dle toho to bude cut-off hodnoty výsledku testu, které bude dělící čarou mezi dobrou senzitivitou nebo dobrou specificitou testu [40].
S cílem zvýšit senzitivitu obou testů publikovali v roce 1999 Sendid et al práci, ve které vycházejí z biologického výskytu mannanu a antimannanu v krvi během infekce a pro časnou diagnostiku použili současnou kombinovanou detekci těchto markerů [42]. Zatímco senzitivita při detekci izolovaného mannanu nebo antimannanu byla velmi nízká (40 % resp. 53 %), pokud byl pacient monitorován současně oběma testy a za pozitivního byl označen nemocný s pozitivitou buď mannanu, nebo antimannanu, případně obou, pak senzitivita narostla až na 80 % při stále uspokojivé specificitě (94 %) [42]. Podobných výsledků pak později dosáhly i další autoři (tab. 4). I přes nesporné výhody tohoto přístupu se zde stále setkáváme s již zmiňovanými slabými místy obou testů:
- a) falešnou negativitou mannanu i antimannanu při infekci vyvolané některými nonalbicans kmeny kvasinek,
- b) falešnou pozitivitou antimannanu u kolonizovaných nemocných.
Je tedy zřejmé, že jednoznačné postavení (byť kombinované) detekce mannanu a antimannanu v diagnostice invazivní kandidózy není možné v dnešní době bez dalších rozsáhlejší prací pevně stanovit.
Detekce 1,3-β-D-glukanu - „panfungální“ diagnostika
1,3-β-D-glukan (BG) je jedním z hlavních polysacharidů, který obsahuje buněčná stěna prakticky všech mykotických patogenů. Je specifickým antigenem hub a nevyskytuje se v buňkách baktérií, virů ani buňkách lidských. Jako integrální součást skeletu buněčné stěny hub je zde daleko pevněji vázán, než např. galaktomannan nebo mannan a do tělesných tekutin se proto uvolňuje jen ve fázi růstu mykotického agens, a to navíc ve velmi malém množství [46]. BG může být detekován v tělesných tekutinách při invazivní infekci způsobené jak kmeny kandid a aspergilů, tak také při infekci způsobené vzácnými patogeny, jako je Fusarium sp., Acremonium sp., Trichosporon sp., Sacharomyces sp., ale také například Pneumocystis jiroveci. Bohužel vzhledem k malému množství BG v stěně a především k minimálnímu uvolňování z ní není BG v tělesných tekutinách detekovatelný při infekci vyvolané kryptokoky a zygomycetami (Mucor sp., Rhizopus sp., Rhizomucor sp.) [47-49]. K záchytu antigenu v tělesných tekutinách se používá kolorometrického testu založeného na vlastnosti BG aktivovat tzv. faktor G, který je součástí amébocytů získaných z klepítkatců Ostrorepa amerického (Limulus polyphemus) nebo Ostrorepa východoasijského (Tachypleus tridentatus). Faktor G se v přítomnosti BG aktivuje a krátká kaskádová reakce je vizualizovaná pomocí chromogenního substrátu. Následně je měřena změna optické denzity v čase (kinetická reakce) a nebo koncová optická denzita (endpoint reakce) [19]. Existuje několik komerčně dostupných testů k detekci BG, které se mírně technicky liší, nicméně v Evropě a USA je nejrozšířenější FungitellTM (Cape Code). Vzhledem ke své „panfungalitě“ se FungitellTM test jeví jako velice zajímavý pro časnou diagnostiku invazivních mykóz. Na druhou stranu nejsou zatím zkušenosti s testem takové, aby mohl být jednoznačným kritériem pro stanovení diagnózy invazivní mykotické infekce v běžné klinické praxi.
Senzitivita FungitellTM testu kolísá od 64 % do 100 % [50-53], a to zejména v závislosti na hodnotě cut-off, od které je vzorek označen jako pozitivní (tab. 5). V současné době se doporučuje jako pozitivní označit vzorek s naměřenou hodnotou vyšší než 80 pg/ml a naopak za negativní vzorek s hodnotou pod 60 pg/ml. Přestože detailní kinetika BG při invazivní mykóze není známa, jsou popsány případy, kdy k významnému nárůstu BG došlo během 5 dnů. Z těchto důvodů je pro časný záchyt invazivní mykotické infekce doporučován odběr krve minimálně 2krát týdně [19]. Pravidelný monitoring vysoce rizikových nemocných ve výše zmíněném intervalu může významně zkrátit dobu do stanovení diagnózy. V práci Pazose et al pozitivita BG předcházela rozvoj febrilií s mediánem 5 dnů, první klinické příznaky mykózy s mediánem 11 dnů, nález na HR CT s mediánem 9 dnů a zahájení antimykotické léčby dokonce s mediánem 14 dnů [52].
Tab. 5. Nejvýznamnější studie sledující význam detekce 1,3-β-D-glukanu (Fungitell) pro diagnostiku invazivních mykotických infekcí. 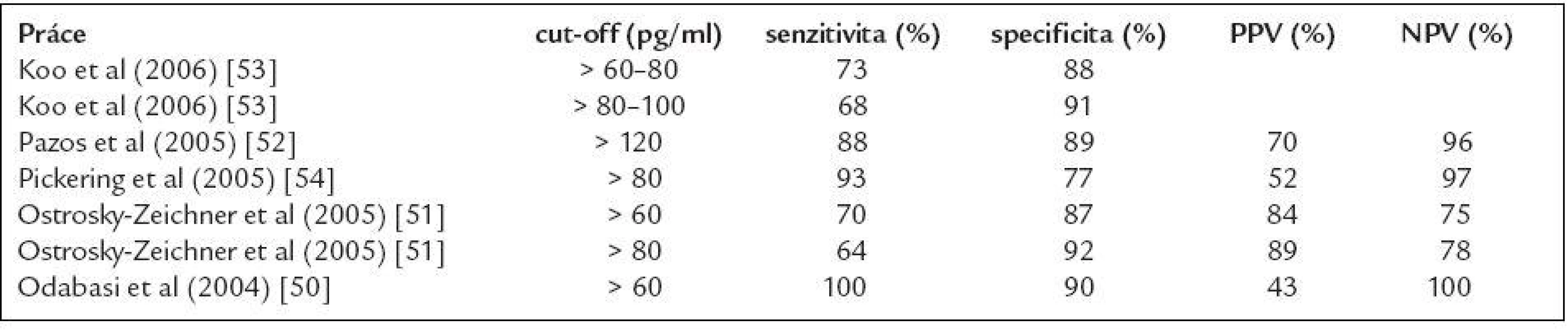
PPV – pozitivní prediktivní hodnota, NPV – negativní prediktivní hodnota Uspokojivá je specificita a především NPV testu, které se pohybují kolem 90 % resp. 95 % (50-53). Při negativním výsledku tedy můžeme s velkou pravděpodobností invazivní mykózu (s výjimkou zygomykózy a kryptokokové infekce) vyloučit.
Podobně jako u detekce GM i v tomto testu se setkáváme s velmi kolísavou PPV (od 40 % do 90 %) a opět je hlavní příčinou možnost falešných pozitivit [50-53]. Jako možné příčiny falešné pozitivity byly popsány: hemodialýza s celulózovou kapslí [19], Gram-pozitivní bakteriemie [54], transfuzní přípravky a krevní deriváty (především intravenózní globuliny, albumin, koagulační faktory a přípravky s použitím filtrace při výrobě) [54], kontaminace gázou [54] a podávání některých antibiotik (amoxicilin/klavulenát, ev. imipenem, gentamicin) [53,55]. Nutno však připomenout, že jen v některých z výše uvedených případů byla jednoznačně prokázána přítomnost kontaminujícího glukanu. Naopak nelze (vzhledem k panfungalitě a vysokému detekčnímu limitu testu) s jistotou vyloučit, že mohlo jít v řadě případů o pacienty se subklinickou invazivní mykotickou infekcí. Test je obecně velmi náchylný na kvalitu laboratorního zpracování. Vyšetření se provádí z minimálního množství séra (přibližně 5 μl) a doporučuje se používat speciální odběrové sety a laboratorní materiál neobsahující glukan. Pickering et al také popsal postupně narůstající pozitivitu vzorku způsobenou pouze opakovaným přenášením vzorku séra do transportních zkumavek [54]. Všechny zmíněné faktory pak mohou relativně snadno ovlivnit výsledek testu a vyšetření je tedy vhodné provádět v laboratoři se zkušenostmi s touto metodikou.
BG v diagnostice invazivních mykotických infekcí přináší několik významných výhod. Podobně jako u galaktomannanu i zde lze pomocí vývoje hodnot BG sledovat léčebnou odpověď na podaná antimykotika. Navíc však tato korelace byla vedle invazivní aspergilózy popsána i u invazivní kandidózy [54-56]. Dále je nespornou výhodou testu jeho panfungalita. Teoreticky by nám jediný test dokázal zachytit jak invazivní aspergilózu, kandidózu a fuzariózu, tak i některé další vzácné invazivní mykotické infekce včetně pneumocystové pneumonie [19]. Na druhou stranu je nutno opět připomenout, že test nezachytí nemocné s invazivní zygomykózou a kryptokokovou infekcí. Při pozitivitě je navíc nutné provést další laboratorní (kultivace, mikroskopie, vyšetření galaktomannanu, mannanu, ev. PCR), RTG a klinické vyšetření s cílem maximálně zpřesnit etiologii infekce a tak maximálně zacílit antimykotickou léčbu. Pozitivita by tedy měla být signálem k zahájení cíleného pátrání po invazivní mykóze. Naopak negativita testu nám s vysokou pravděpodobností (s výjimkou výše zmíněných případů) systémovou mykotickou infekci vyloučí [19]. Konečně se zdá být velice zajímavé použít detekce BG ke konfirmaci pozitivního výsledku Platelia Aspergillus (tzn. galaktomannanu) a tak vyloučit nebo naopak potvrdit falešnou pozitivitu galaktomannanu. V práci Pazose et al měli pacienti s invazivní aspergilózou pozitivitu v obou testech. Naopak pozitivita pouze BG nebo pouze GM svědčila pro falešnou pozitivitu jednoho z testů [52].
Závěr
Časná diagnostika invazivních mykotických infekcí u hematoonkologických nemocných pomocí sérologických metod zaznamenala v posledních letech velký pokrok. Sérologickými metodami jsme schopni detekovat nejen invazivní kandidózu a aspergilózu, ale i celou řadu dalších vzácných invazivních mykóz. Bohužel stále není k dispozici sérologická metoda, která by umožňovala diagnostiku systémových zygomykóz - infekcí, jejichž incidence v posledních letech zvláště pak na hematoonkologických pracovištích postupně narůstá.
Zcela jednoznačné místo v časné diagnostice invazivní aspergilózy si vybudovala detekce galaktomannanu pomocí Platelia Aspergillus testu. Umožňuje zkrácení doby do stanovení diagnózy, diferenciální diagnostiku plicních infiltrátů a především časné zahájení účinné antimykotické léčby, jejíž efekt napomáhá monitorovat. Hlavním problémem však zůstává relativně velký počet falešných pozitivit. Kombinace s 1,3-β-D-glukanem nebo s PCR však tyto falešné pozitivity pravděpodobně dokáže odlišit.
Detekce mannanu a antimannanu v diagnostice invazivní kandidózy má bohužel celou řadu limitů a podobně jako „panfungální“ diagnostika pomocí 1,3-β-D-glukanu bude pro určení jednoznačného místa v klinické praxi vyžadovat většího počtu velkých prospektivních studií.
Práce byla podpořena IGA MZ ČR NR8452-3/2005.
MUDr. Zdeněk Ráčil
www.fnbrno.cz
e-mail: zracil@fnbrno.cz
Doručeno do redakce: 26. 2. 2006
Přijato po recenzi: 28. 3. 2007
Zdroje
1. Pfaller MA. Invasive Fungal Pathogens: Current Epidemiological Trends. Clin Infect Dis 2006; 43(Suppl 1): S3-S14.
2. Ruhnke M, Maschmeyer G. Management of mycoses in patients with hematologic disease and cancer - review of the literature. Eur J Med Res 2002; 7 : 227-235.
3. O’Brien SN, Blijlevens NMA, Mahfouz TH et al. Infections in Patients with Hematological Cancer: Recent Developments. Hematology 2003; 2003 : 438-472.
4. van Burik JH, Leisenring W, Myerson D et al. The effect of prophylactic fluconazole on the clinical spectrum of fungal diseases in bone marrow transplant recipients with special attention to hepatic candidiasis. An autopsy study of 355 patients. Medicine (Baltimore) 1998; 77 : 246-254.
5. Groll AH, Shah PM, Mentzel C et al. Trends in the postmortem epidemiology of invasive fungal infections at a university hospital. J Infect 1996; 33 : 23-32.
6. Yamazaki T, Kume H, Murase S et al. Epidemiology of visceral mycoses: analysis of data in annual of the pathological autopsy cases in Japan. J Clin Microbiol 1999; 37 : 1732-1738.
7. Morgan J, Alexander B, Wannemuehler K. Quantification of Risk for Invasive Fungal Infection (IFI) among Transplant (TX) Recipients Reporting to TRANSNET. Program and abstracts of the 45th ICAAC Ocober 30-November 2, 2004; Washington, D.C., USA: Abstract M-1058.
8. Marr KA, Carter RA, Boeckh M et al. Invasive aspergillosis in allogeneic stem cell transplant recipients: changes in epidemiology and risk factors. Blood 2002; 100 : 4358-4366.
9. Marr KA, Carter RA, Crippa F et al. Epidemiology and outcome of mould infections in hematopoietic stem cell transplant recipients. Clin Infect Dis 2002; 34 : 909-917.
10. Nolla-Salas J, Sitges-Serra A, Leon-Gil C et al. Candidemia in non-neutropenic critically ill patients: analysis of prognostic factors and assessment of systemic antifungal therapy. Study Group of Fungal Infection in the ICU. Intensive Care Med 1997; 23 : 23-30.
11. von Eiff M, Roos N, Schulten R et al. Pulmonary aspergillosis: early diagnosis improves survival. Respiration 1995; 62 : 341-347.
12. McLintock LA, Jones BL. Advances in the molecular and serological diagnosis of invasive fungal infection in haemato-oncology patients. Br J Haematol 2004; 126 : 289-297.
13. Shao PL, Huang LM, Hsueh PR. Invasive fungal infection - laboratory diagnosis and antifungal treatment. J Microbiol Immunol Infect 2006; 39 : 178-188.
14. Alexander BD, Pfaller MA. Contemporary Tools for Diagnosis and Management of Invasive Mycoses. Clin Infect Dis 2006; 43(Suppl 1): S15-S27.
15. Maertens J, Deeren D, Dierickx D et al. Preemptive antifungal therapy: still a way to go. Curr Opin Infect Dis 2006; 19 : 551-556.
16. Lehmann PF, Reiss E. Invasive aspergillosis: antiserum for circulating antigen produced after immunization with serum from infected rabbits. Infect Immun 1978; 20 : 570-572.
17. Reiss E, Lehmann PF. Galactomannan antigenemia in invasive aspergillosis. Infect Immun 1979; 25 : 357-365.
18. Wheat LJ. Galactomannan antigenemia detection for diagnosis of invasive aspergillosis, part I. Clin Microbiol Newsl 2005; 27 : 51-57.
19. Quindos G New microbiological techniques for the diagnosis of invasive mycoses caused by filamentous fungi. Clin Microbiol Infect 2006; 12(Suppl 7): 40-52.
20. Maertens J, Verhaegen J, Demuynck H et al. Autopsy-controlled prospective evaluation of serial screening for circulating galactomannan by a sandwich enzyme-linked immunosorbent assay for hematological patients at risk for invasive Aspergillosis. J Clin Microbiol 1999; 37 : 3223-3228.
21. Maertens J, Verhaegen J, Lagrou K et al. Screening for circulating galactomannan as a noninvasive diagnostic tool for invasive aspergillosis in prolonged neutropenic patients and stem cell transplantation recipients: a prospective validation. Blood 2001; 97 : 1604-1610.
22. Maertens J, Van Eldere J, Verhaegen J et al. Use of circulating galactomannan screening for early diagnosis of invasive aspergillosis in allogeneic stem cell transplant recipients. J Infect Dis 2002; 186 : 1297-1306.
23. Sulahian A, Boutboul F, Ribaud P et al. Value of antigen detection using an enzyme immunoassay in the diagnosis and prediction of invasive aspergillosis in two adult and pediatric hematology units during a 4-year prospective study. Cancer 2001; 91 : 311-318.
24. Herbrecht R, Letscher-Bru V, Oprea C et al. Aspergillus galactomannan detection in the diagnosis of invasive aspergillosis in cancer patients. J Clin Oncol 2002; 20 : 1898-1906.
25. Pinel C, Fricker-Hidalgo H, Lebeau B et al. Detection of circulating Aspergillus fumigatus galactomannan: value and limits of the Platelia test for diagnosing invasive aspergillosis. J Clin Microbiol 2003; 41 : 2184-2186.
26. Rovira M, Jimenez M, De La Bellacasa JP et al. Detection of Aspergillus galactomannan by enzyme immunoabsorbent assay in recipients of allogeneic hematopoietic stem cell transplantation: a prospective study. Transplantation 2004; 77 : 1260-1264.
27. Maertens J, Theunissen K, Verbeken E et al. Prospective clinical evaluation of lower cut-offs for galactomannan detection in adult neutropenic cancer patients and haematological stem cell transplant recipients. Br J Haematol 2004; 126 : 852-860.
28. Marr KA, Balajee SA, McLaughlin L et al. Detection of galactomannan antigenemia by enzyme immunoassay for the diagnosis of invasive aspergillosis: variables that affect performance. J Infect Dis 2004; 190 : 641-649.
29. Marr KA, Laverdiere M, Gugel A et al. Antifungal therapy decreases sensitivity of the Aspergillus galactomannan enzyme immunoassay. Clin Infect Dis 2005; 40 : 1762-1769.
30. Wheat L. Galactomannan antigenemia detection for diagnosis of invasiveaspergillosis, Part II. Clin Microbiol Newsl 2005; 27 : 59-63.
31. Mennink-Kersten MA, Donnelly JP, Verweij PE. Detection of circulating galactomannan for the diagnosis and management of invasive aspergillosis. Lancet Infect Dis 2004; 4 : 349-357.
32. Wheat LJ. Rapid diagnosis of invasive aspergillosis by antigen detection. Transpl Infect Dis 2003; 5 : 158-166.
33. Lee YR, Choi YW, Lee KJ et al. CT halo sign: the spectrum of pulmonary diseases. Br J Radiol 2005; 78 : 862-865.
34. Ascioglu S, Rex JH, de Pauw B et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus. Clin Infect Dis 2002; 34 : 7-14.
35. Boutboul F, Alberti C, Leblanc T et al. Invasive aspergillosis in allogeneic stem cell transplant recipients: increasing antigenemia is associated with progressive disease. Clin Infect Dis 2002; 34 : 939-943.
36. Klont RR, Mennink-Kersten MA, Verweij PE. Utility of Aspergillus antigen detection in specimens other than serum specimens. Clin Infect Dis 2004; 39 : 1467-1474.
37. Musher B, Fredricks D, Leisenring W et al. Aspergillus galactomannan enzyme immunoassay and quantitative PCR for diagnosis of invasive aspergillosis with bronchoalveolar lavage fluid. J Clin Microbiol 2004; 42 : 5517-5522.
38. Viscoli C, Machetti M, Gazzola P et al. Aspergillus galactomannan antigen in the cerebrospinal fluid of bone marrow transplant recipients with probable cerebral aspergillosis. J Clin Microbiol 2002; 40 : 1496-1499.
39. Kami M, Ogawa S, Kanda Y et al. Early diagnosis of central nervous system aspergillosis using polymerase chain reaction, latex agglutination test, and enzyme-linked immunosorbent assay. Br J Haematol 1999; 106 : 536-537.
40. Sendid B, Poirot JL, Tabouret M et al. Combined detection of mannanaemia and antimannan antibodies as a strategy for the diagnosis of systemic infection caused by pathogenic Candida species. J Med Microbiol 2002; 51 : 433-442.
41. Kappe R, Muller J. Rapid clearance of Candida albicans mannan antigens by liver and spleen in contrast to prolonged circulation of Cryptococcus neoformans antigens. J Clin Microbiol 1991; 29 : 1665-1669.
42. Sendid B, Tabouret M, Poirot JL et al. New enzyme immunoassays for sensitive detection of circulating Candida albicans mannan and antimannan antibodies: useful combined test for diagnosis of systemic candidiasis. J Clin Microbiol 1999; 37 : 1510-1517.
43. Greenfield RA, Troutt DL, Rickard RC et al. Comparison of antibody, antigen, and metabolite assays in rat models of systemic and gastrointestinal candidiasis. J Clin Microbiol 1988; 26 : 409-417.
44. Verduyn Lunel FM, Voss A, Kuijper EJ et al. Detection of the Candida antigen mannan in cerebrospinal fluid specimens from patients suspected of having Candida meningitis. J Clin Microbiol 2004; 42 : 867-870.
45. Persat F, Topenot R, Piens MA et al. Evaluation of different commercial ELISA methods for the serodiagnosis of systemic candidosis. Mycoses 2002; 45 : 455-460.
46. Latge JP. Aspergillus fumigatus and aspergillosis. Clin Microbiol Rev 1999; 12 : 310-350.
47. Miyazaki T, Kohno S, Mitsutake K et al. (1-->3)-beta-D-glucan in culture fluid of fungi activates factor G, a limulus coagulation factor. J Clin Lab Anal 1995; 9 : 334-339.
48. Miyazaki T, Kohno S, Mitsutake K et al. Plasma (1-->3)-beta-D-glucan and fungal antigenemia in patients with candidemia, aspergillosis, and cryptococcosis. J Clin Microbiol 1995; 33 : 3115-3118.
49. Yoshida M, Obayashi T, Iwama A et al. Detection of plasma (1 --> 3)-beta-D-glucan in patients with Fusarium, Trichosporon, Saccharomyces and Acremonium fungaemias. J Med Vet Mycol 1997; 35 : 371-374.
50. Odabasi Z, Mattiuzzi G, Estey E et al. Beta-D-glucan as a diagnostic adjunct for invasive fungal infections: validation, cutoff development, and performance in patients with acute myelogenous leukemia and myelodysplastic syndrome. Clin Infect Dis 2004; 39 : 199-205.
51. Ostrosky-Zeichner L, Alexander BD, Kett DH et al. Multicenter clinical evaluation of the (1-->3) beta-D-glucan assay as an aid to diagnosis of fungal infections in humans. Clin Infect Dis 2005; 41 : 654-659.
52. Pazos C, Ponton J, Del Palacio A Contribution of (1->3)-beta-D-glucan chromogenic assay to diagnosis and therapeutic monitoring of invasive aspergillosis in neutropenic adult patients: a comparison with serial screening for circulating galactomannan. J Clin Microbiol 2005; 43 : 299-305.
53. Koo S, Bryar J, Page JH et al. Clinical utility of the (1-3)-ß-D-Glucan Assay. Program and abstracts of the 45th ICAAC Semptember 27-30, 2006; San Francisco, California, USA: Abstract M-1600.
54. Pickering JW, Sant HW, Bowles CA et al. Evaluation of a (1->3)-beta-D-glucan assay for diagnosis of invasive fungal infections. J Clin Microbiol 2005; 43 : 5957-5962.
55. Mennink-Kersten MA, Warris A, Verweij PE. 1,3-beta-D-glucan in patients receiving intravenous amoxicillin-clavulanic acid. N Engl J Med 2006; 354 : 2834-2835.
56. Sims CR, Mohr J, Paetznick V. Correlation of Clinical Outcome with ß-glucan (BG) Levels in Pts With Invasive Candidiasis. Program and abstracts of the 45th ICAAC Semptember 27-30, 2006; San Francisco, California, USA: Abstract M-1599.
57. Kappe R, Schulze-Berge A. New cause for false-positive results with the Pastorex Aspergillus antigen latex agglutination test. J Clin Microbiol 1993; 31 : 2489-2490.
58. Dalle F, Lopez J, Caillot D et al. False-positive results caused by cotton swabs in commercial Aspergillus antigen latex agglutination test. Eur J Clin Microbiol Infect Dis 2002; 21 : 130-132.
59. Mennink-Kersten MA, Ruegebrink D, Klont RR et al. Bifidobacterial lipoglycan as a new cause for false-positive platelia Aspergillus enzyme-linked immunosorbent assay reactivity. J Clin Microbiol 2005; 43 : 3925-3931.
60. Ansorg R, van den Boom R, Rath PM. Detection of Aspergillus galactomannan antigen in foods and antibiotics. Mycoses 1997; 40 : 353-357.
61. Blijlevens NM, Donnelly JP, Meis JF et al. Aspergillus galactomannan antigen levels in allogeneic haematopoietic stem cell transplant recipients given total parenteral nutrition. Transpl Infect Dis 2002; 4 : 64-65.
62. Viscoli C, Machetti M, Cappellano P et al. False-positive galactomannan platelia Aspergillus test results for patients receiving piperacillin-tazobactam. Clin Infect Dis 2004; 38 : 913-916.
63. Adam O, Auperin A, Wilquin F et al. Treatment with piperacillin-tazobactam and false-positive Aspergillus galactomannan antigen test results for patients with hematological malignancies. Clin Infect Dis 2004; 38 : 917-920.
64. Knight F, Mackenzie DW. Aspergillus antigen latex test for diagnosis of invasive aspergillosis. Lancet 1992; 339 : 188.
65. Swanink CM, Meis JF, Rijs AJ et al. Specificity of a sandwich enzyme-linked immunosorbent assay for detecting Aspergillus galactomannan. J Clin Microbiol 1997; 35 : 257-260.
66. Eloy O, Tabella C, Harzic M et al. Detection of circulating Candida albicans mannan and antimannan antibodies: useful for diagnosis of deep seated candidiasis. Ann Biol Clin (Paris) 2002; 60 : 711-714.
67. Rimek D, Redetzke K, Steiner B et al. Experience with the Platelia Candida ELISA for the diagnostics of invasive candidosis in neutropenic patients. Mycoses 2004; 47: Suppl 1 : 27-31.
68. Rimek D, Redetzke K, Singh J et al. Performance of the Candida mannan antigen detection in patients with fungemia. Mycoses 2004; 47(Suppl 1): 23-26.
69. Chen Y, Sun H, Wang J et al. Usefulness of Combined Detection of Mannanemia and Antimannan Antibodies for the Diagnosis of Invasive Candidiasis. Program and abstracts of the 44th ICAAC October 30-November 2, 2004; Washington, D.C., USA: Abstract M-264.
70. White PL, Archer AE, Barnes RA. Comparison of non-culture-based methods for detection of systemic fungal infections, with an emphasis on invasive Candida infections. J Clin Microbiol 2005; 43 : 2181-2187.
71. Prella M, Bille J, Pugnale M et al. Early diagnosis of invasive candidiasis with mannan antigenemia and antimannan antibodies. Diagn Microbiol Infect Dis 2005; 51 : 95-101.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2007 Číslo 9- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Primárny aldosteronizmus
- Inkretinová strategie léčby diabetes mellitus 2. typu - DPP-IV
- 5. medzinárodný kongres o výskume uremického syndrómu a uremickej toxicity, 7. nefrologická konferencia baltických štátov.
- Prof. MUDr. Jaromír Hradec, CSc., šedesátníkem
- Vzpomínka na emeritního primáře interního oddělení Krajské nemocnice T. Bati, a.s., ve Zlíně, prim. MUDr. Rostislava Lukaštíka
- Novák Z, Chrastina J, Říha I. Atlas of Endoscopic Neurosurgery. Atlas endoskopické neurochirurgie.
- Úvodník
- Výsledek celotělového FDG-PET vyšetření predikuje osud nemocných s difuzním velkobuněčným lymfomem - editorial
- Jaká je role katétrové ablace A-V junkce a trvalé kardiostimulace v době, kdy lze fibrilaci síní všech forem léčit selektivní katetrovou ablací? - editorial
- Léčba fibrilace síní v době katétrové ablace - editorial
- Možnosti imunomodulační terapie u kriticky nemocných - lepší diagnostika znamená účinnější léčbu - editorial
- Tuková buňka stále plodnější - editorial
- Únavový syndrom v onkologii - editorial
- Invazivní houbové infekce u nemocných po transplantaci kmenových buněk krvetvorby: vývoj v diagnostice, prevenci a léčbě v posledním desetiletí - editorial
- Inkretinová strategie léčby diabetes mellitus 2. typu - DPP-IV - editorial
- Výsledek celotělového FDG-PET vyšetření predikuje osud nemocných s difuzním velkobuněčným lymfomem jak při použití v intermediárním stagingu, tak při použití na konci standardní chemoterapie
- Dlouhodobé sledování pacientů s klinickými známkami krvácení do horní části trávicího traktu a negativním endoskopickým nálezem
- Včasné hemodynamické zmeny po rádiofrekvenčnej ablácii predsieňovokomorového spojenia
- Immodin v léčbě imunoparalýzy nemocných v intenzivní péči
- Sérová hladina retinol-binding proteinu 4 u obéznych s inzulínovou rezistenciou a jedincov s diabetom 2. typu liečených metformínom
- QT dynamicita v rizikové stratifikaci u pacientů po infarktu myokardu
- Endoskopické nálezy v horním trávicím traktu u pacientů s jaterní cirhózou
- Intraabdominální hypertenze na jednotkách intenzivní péče
- Únavový syndrom u onkologického pacienta: možnosti diagnostiky a léčby
- Současné možnosti robotické kardiochirurgie
- Časná diagnostika invazivních mykotických infekcí u hematoonkologických nemocných pomocí sérologických metod
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Intraabdominální hypertenze na jednotkách intenzivní péče
- Únavový syndrom u onkologického pacienta: možnosti diagnostiky a léčby
- Primárny aldosteronizmus
- Včasné hemodynamické zmeny po rádiofrekvenčnej ablácii predsieňovokomorového spojenia
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



