-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Intraabdominální hypertenze na jednotkách intenzivní péče
Intraabdominal hypertension at intensive care units
Intraabdominal hypertension is frequently observed both in surgical and non-surgical patients hospitalised at intensive care units. This clinical syndrome of multifactorial etiology is characterised by increased intraabdominal tension with subsequent development of organ dysfunctions. It is reflected in impaired cardiovascular, pulmonary, renal, splanchnic and neurological functions which improve after the abdominal decompression. Patients with intraabdominal hypertension can be relatively easily identified by measuring tension in the bladder the primary purpose of which is early detection of clinically less severe stages and also the detection of the most sever forms of abdominal compartment syndrome. The objective of subsequent surgical or conservative treatment is to prevent organ dysfunction and subsequent multi-organ failure.
Key words:
intraabdominal hypertension – intraabdominal tension – abdominal compartment syndrome – multi-organ dysfunction/ failure syndrome – continuous venovenous hemofiltration
Autoři: P. Szturz; V. Chýlek; R. Kula
Působiště autorů: Anestesiologicko-resuscitační klinika FN Ostrava-Poruba, přednosta prim. MUDr. Jan Jahoda
Vyšlo v časopise: Vnitř Lék 2007; 53(9): 972-978
Kategorie: Přehledné referáty
Souhrn
Intraabdominální hypertenze je frekventně pozorována jak u chirurgických, tak i nechirurgických pacientů hospitalizovaných na jednotkách intenzivní péče. Tento klinický syndrom multifaktoriální etiologie je charakterizován zvýšením nitrobřišního tlaku s následným rozvojem orgánových dysfunkcí. Projeví se zhoršením kardiovaskulárních, plicních, renálních, splanchnických a neurologických funkcí se zlepšením po provedení abdominální dekomprese. Pacienty s intraabdominální hypertenzí lze poměrně snadno identifikovat měřením tlaku v močovém měchýři, které by mělo především sloužit k časné detekci klinicky méně závažných stadií, ale také k průkazu nejtěžší formy abdominal compartment syndromu. Následná chirurgická nebo konzervativní léčebná intervence slouží k prevenci rozvoje orgánových dysfunkcí a následného multiogánového selhávání.
Klíčová slova:
intraabrominální hypertenze - intraabdominální tlak - abdominal compartment syndrom - syndrom multiorgánové dysfunkce/selhávání - kontinuální veno-venózní hemofiltraceÚvod
Intraabdominální hypertenze (IAH) je klinická jednotka charakterizovaná zvýšeným intraabdominálním tlakem (IAP) o různém stupni závažnosti (tab. 1). Projeví se v situaci, kdy zvýšený tlak v anatomicky ohraničeném prostoru (dutině břišní) omezí průtok krve kapilárním řečištěm. Následkem pak je tkáňová hypoperfuze s ischemií a případným reperfuzním postižením, kupříkladu v rámci tekutinové resuscitace těžkého šoku. Současné literární údaje naznačují, že abdominální compartment syndrom (ACS), který je nejtěžším stádiem IAH, lze považovat za ,,second hit“ u dvoukrokového modelu rozvoje syndromu multiorgánové dysfunkce/selhání (MODS/MOF) u kriticky nemocných pacientů [1]. Zvýšení tlaku v dutině břišní je zde v přímé souvislosti s rozvojem abdominálních i extraabdominálních orgánových dysfunkcí.
Tab. 1. Stupně intraabdominální hypertenze. 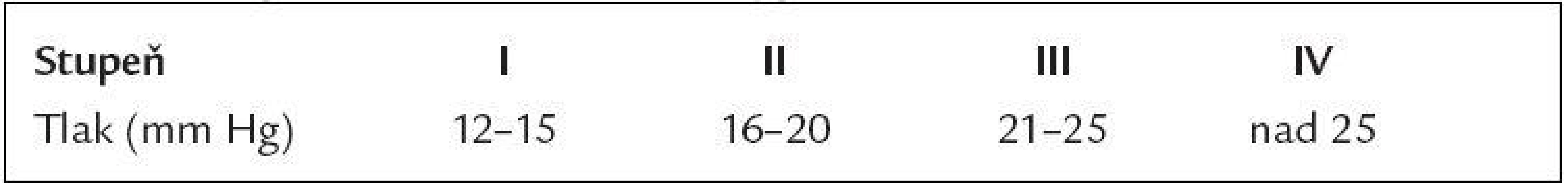
Definice a prevalence
Intraabdominální tlak (IAP) je tlak naměřený v dutině břišní, jehož hodnoty se v běžné klinické praxi většinou udávají v milimetrech Hg. Za normu je považováno 0-5 mm Hg, u kriticky nemocných pacientů pak rozmezí 5-7 mm Hg, a u pacientů vyžadujících umělou plicní ventilaci je uznávána norma IAP do 10 mm Hg.
Abdominální perfuzní tlak (APP) je dán rozdílem středního arteriálního tlaku a intraabdominálního tlaku. Za normální jsou považovány hodnoty okolo 60 mm Hg.
Intraabdominální hypertenze (IAH) je definována jako zvýšení IAP nad hodnotu 12 mm Hg bez projevů orgánových dysfunkcí.
Abdominal compartment syndrom (ACS) je stav, při němž je zvýšení IAP nad 20 mm Hg současně doprovázeno orgánovými dysfunkcemi/selháváním.
ACS pak klasifikujeme jako primární, sekundární nebo rekurentní ve vztahu k trvání a příčinám rozvoje orgánových dysfunkcí/selhávání na podkladě intraabdominální hypertenze. Přestože jsou klinické projevy totožné, možnosti terapeutického ovlivnění se různí.
Primární ACS souvisí s traumatem či jiným onemocněním břišní a pánevní oblasti. Je časnou komplikací chirurgických a invazivních radiologických zákroků nebo proběhlého chirurgického nitrobřišního výkonu [2].
Sekundární ACS se rozvíjí u patologických stavů, které nejsou v přímém vztahu k oblasti břicha a pánve [2]. Souvisí s rozvojem těžkých šokových stavů a následným ischemicko-reperfuzním (I/R) postižením, kde hraje podstatnou roli masivní tekutinová resuscitace (především krystaloidními roztoky), která vede k rozvoji edému střevní stěny, případně progresi retroperitoneální patologie. Jinými slovy, vyvíjí se za absence nitrobřišního poranění či proběhlého chirurgického operačního výkonu [3].
Rekurentní ACS zaznamenáváme v případech, v nichž se ACS objeví navzdory předcházející chirurgické nebo nechirurgické léčbě [2].
V případě neúspěchu léčebných intervencí dojde k alteraci tkáňové perfuze, dodávky kyslíku a postupnému selhávání intraabdominálních i extraabdominálních orgánů a ACS se stane motorem rozvoje MODS/MOF [1] (tab. 2).
Tab. 2. Indikace pro měření IAP (dle Kimball E et al. Crit Care Med 2006; 34: 2340–2348). 
Rozdíly v definicích vedly v minulosti k nepřesnostem v interpretaci a obtížím při snahách porovnávat výsledky jednotlivých klinických studií na dané téma. Proto byla v roce 2004 uspořádána mezinárodní konference, na níž byly definice výše zmíněných klinických jednotek standardizovány [2].
Dle standardů byla na jednotkách intenzívní péče zaznamenána IAH u 50,5 % pacientů, přičemž 8,2 % nemocných mělo IAP nad 20 mm Hg spolu s vyjádřenými orgánovými dysfunkcemi, tedy splňovalo kritéria ACS [4].
Měření a metodika
Měření IAP je důležité nejen pro stanovení samotné diagnózy, ale také umožňuje sledovat efektivitu léčebného postupu u pacientů s IAH/ACS. Intraabdominální tlak můžeme měřit buď přímo (za pomoci punkčních jehel například během peritoneální dialýzy nebo laparoskopie) nebo nepřímo (např.v močovém měchýři , žaludku, rektu, vagině). Nejčastěji užívanou nepřímou metodou, popsanou poprvé Kronem v roce 1980, je detekce tlaku v močovém měchýři cestou močového katétru. Výsledky dobře korelují s metodami měření přímého.
Během měření je nutné nezapomínat na možný vliv poddajnosti močového měchýře (MM) na hodnoty IAP ve vztahu k objemu aplikované tekutiny. Doporučená dávka je mezi 25-50 ml fyziologického roztoku a frekvence měření závisí na závažnosti IAH. Zvyšování objemu instilované tekutiny v rozmezí 50-400 ml vede ke zvyšování lokálního tlaku až o 0,5 cm H2O/ml [5], což může agravovat chybu v rámci měření. Neméně důležité je také určení nulové referenční hodnoty vztažené nejčastěji k pánevní symfýze nebo případně střední axilární čáře, obzvláště v situaci, kdy se naměřené hodnoty IAP u stejného pacienta výrazně liší [6]. Vliv na hodnotu IAP mohou také mít změny polohy těla, kontrakce svalů močového měchýře i břicha.
Souhrnně lze říci, že z metodického hlediska se doporučuje měření v mm Hg, na konci výdechu, v přísně supinní poloze, s vyvarováním se vlivu kontrakce břišních svalů. Nulová referenční hodnota je definována ve výši střední axilární čáry. V současnosti lze využít široké nabídky otevřených i uzavřených měřících systémů [7], se zřejmým trendem používat metody kontinuálního měření [8]. Mimo močového měchýře se zkouší systémy zaváděné do žaludku nebo přímo do dutiny břišní [9]. Informace získávané těmito metodami jsou příslibem do budoucnosti.
Patofyziologie IAH/ACS
Patofyziologickým podkladem IAH/ACS je zhroucení kompenzatorních mechanizmů při změnách intraabdominálního objemu a tlaku. V situaci, kdy objem přesáhne kapacitu břišní dutiny, následuje vzestup tlaku, který je příčinou přerušení kapilárního, následně arteriálního krevního průtoku a zhoršení venózního návratu. Obecně se zde uplatní poruchy Starlingovy rovnováhy na kapiláře, tedy zvýšení filtračního gradientu, dále vyšší propustnosti endotelu, snížení transkapilárního onkotického gradientu, zhoršení lymfatické drenáže a konečně postkapilární vazokonstrikce a mikrotrombotizace. Důsledkem je sekvestrace tekutin do intersticia, čemuž odpovídají nálezy edému střevní stěny při provedených dekompresních laparotomiích [10].
Důležitým prvkem, který se při vzniku ACS může uplatnit, je intersticiální edém střev a dalších orgánů dutiny břišní během masivní objemové resuscitace zvláště u pacientů se septickým nebo hemoragickým šokem. Objemové přetížení tekutinami dále vede ke zhoršení tkáňové oxygenace v oblasti střevní anastomózy, její možné insuficienci, intoleranci enterální výživy a v neposlední řadě i translokaci endotoxinu a bakterií se zvýšením rizika progrese MODS/MOF a rozvoje sepse [11,12].
Konečně, na rozvoji této nozologické jednotky se významnou měrou podílí faktory, jako je body-mass index (BMI), přidružené komorbidity pacienta a aktuální celkový stav, daný stupněm selhávání orgánových systémů, především oběhového [4]. Zde se pak celý bludný kruh uzavírá, protože samotná IAH, resp. ACS mohou rozvoj MODS/MOF samy potencovat, či způsobit.
IAH a orgánové dysfunkce
Jak jsme zmínili, intraabdominální hypertenze vede k rozvoji orgánových dysfunkcí odlišnými mechanizmy. Koncept abdominálního perfuzního tlaku (APP), vzorec 1, s normou okolo 60 mm Hg, umožňuje v klinické praxi lépe hodnotit nejen splanchnickou perfuzi, ale i cíle hemodynamické optimalizace a také efektivněji předpovídá pravděpodobnost přežívání kriticky nemocných pacientů, než samotné hodnoty středního arteriální tlaku (MAP) a nitrobřišního tlaku (IAP) [13]. Krevní průtok orgánů dutiny břišní je závislý na obou parametrech a vnímání APP zde - s přihlédnutím ke zřejmým odlišnostem - vychází z modelu mozkové perfuze, který se používá během monitorování ICP v neurointenzivní péči (obr. 1).
Obr. 1. Závislost intraabdominálního tlaku (IAP) na intraabdominálním objemu (IAV). 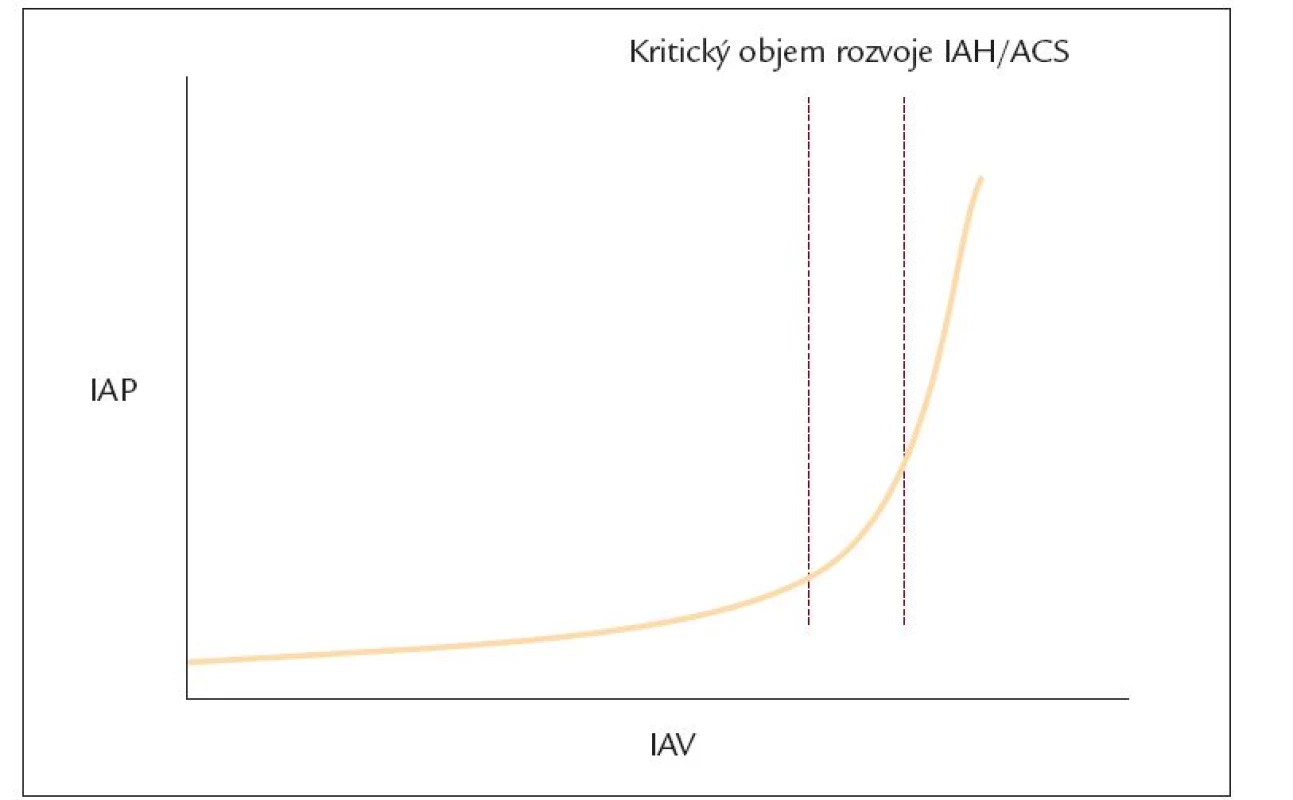
Vzorec 1: APP = MAP – IAP
Hemodynamické funkce
Intraabdominální hypertenze komplexně ovlivňuje hemodynamické funkce a projevuje se jak poruchou preloadu, kontraktility, tak i afterloadu. Jednotlivé patofyziologické mechanizmy, které se při alteraci oběhu uplatní, jsou uvedeny níže.
IAH je příčinou posunu bránice s důsledky v přímé kompresi a redukci objemu dutiny hrudní, která v kombinaci s umělou plicní ventilací (UPV) zvyšuje nitrohrudní tlak (ITP), čímž se snižuje průtok krve ve vena cava inferior. Dochází k retenci krve v pánevní oblasti a distálních částech těla, které se rychle projeví zvláště u hypovolemických pacientů [14]. Je příčinou snížení venosního návratu do srdce [15], tedy poklesu preloadu a následně i srdečního výdeje (CO) [14].
Komprese plic se vzrůstem ITP také zvyšuje plicní vaskulární rezistenci (PVRI). Vzniklá plicní hypertenze dilatuje pravou komoru s následným posunem komorového septa doleva, které vede ke zvýšení práce pravé komory. Zvýšené nároky na spotřebu kyslíku pravé komory, při současně sníženém CO, vede k poklesu koronárního průtoku a k riziku rozvoje subendokardiální ischemie [16], která potencuje myokardiální dysfunkci.
Redukovaný CO zvyšuje systémovou vaskulární rezistenci (SVRI), narůstá srdeční práce a vede ke snížení krevního průtoku v oblasti střev s důsledky v rozvoji I/R poškození a kapilárního leaku tekutin, čímž se opět zvyšuje riziko IAH a následná progrese srdeční dysfunkce [17].
Tradiční tlakové hemodynamické parametry - centrální venózní tlak (CVP) a tlaky v a. pulmonalis a zaklínění (PAOP, PCWP) - u pacientů s ACS přesně nevyjadřují reálnou objemovou náplň krevního řečiště. Naproti tomu objemové parametry, jako index pravostranného enddiastolického objemu (RVEDVI) a index globálního enddiastolického objemu (GEDVI), mají ve vztahu k tekutinové resuscitaci hemodynamiky vyšší výpovědní hodnotu [18,19].
Respirační funkce
Příčinou zhoršených plicních funkcí u pacientů s IAH je posun bránice kraniálním směrem, které při zvýšení intratorakálního tlaku redukuje funkční reziduální kapacitu, celkovou plicní kapacitu, reziduální objem a poddajnost hrudní stěny. Dochází ke zhoršení ventilačně-perfuzního (V/Q) poměru, hypoxii, hyperkapnii a rozvoji respirační acidózy, což v konečném důsledku během UPV vede mimo jiné také k vyšším tlakům v dýchacích cestách. Důsledkem přímého postižení plícních kapilár může být vznik intersticiálního plicního edému pod obrazem akutního plicního poškození - ALI/ARDS - potencovaný zvýšenými hladinami pro - a protizánětlivých cytokinů, které jsou při ACS hojně uvolňovány z oblasti gastrointestinálního traktu [20].
ALI/ARDS se rozvíjí jako kombinace kolapsu alveolů, vysokého ITP a intersticiálního edému, kdy „protektivní ventilační strategie“, volba optimálního endexpiračního tlaku (PEEP) a pronační poloha mohou vést ke zlepšení výměny plynů, otevření kolabovaných alveolů a redukci plicního postižení.
Renální funkce
Oligurie a anurie - navzdory adekvátní tekutinové resuscitaci - jsou typickou komplikací IAH při hodnotách nad 15-20 mm Hg. Příčiny jsou multifaktoriální a ovlivňují rozsah renálního selhávání. Uplatní se zde především nedostatečný renální perfuzní tlak (RPP) vedoucí k redukci filtračního gradientu (FR), tedy mechanické síly působící napříč glomerulem, vyjadřující rozdíl mezi glomerulárním filtračním tlakem (GFP) a tlakem v proximálním tubulu (PTP), vzorec 2. V neposlední řadě je průtok renálními artériemi a vénami ovlivněn aktivací renin-angiotenzin-aldosteronového systému a také zvýšením sérových hladin antidiuretického hormonu [21].
Vzorec 2: FR = GFP - PTP = MAP - 2 × IAP
Mozková perfuze
Zvýšený IAP je nezávislým rizikovým faktorem rozvoje sekundárního poškození mozku u pacientů s kraniotraumatem [22]. Posun bránice kraniální směrem snižuje objem dutiny hrudní a zvyšuje nitrohrudní tlak s následným vzestupem jugulárního venózního tlaku a zhoršením venózního návratu krve z mozku, což vede k přímému vzestupu nitrolebního tlaku a alteraci mozkové perfuze [23].
GIT a jaterní funkce
Intraabdominální hypertenze má přímý vliv na gastrointestinální a jaterní funkce. Rozsah postižení je dán mírou komprese kapilár mezenteria a jater, snížením krevního průtoku, dále přímým stlačením velkých cév žilního řečiště dutiny břišní, kongescí a rozvojem intersticiálního edému [24]. Při progresi tkáňové ischemie se také uplatní redukce CO při zvýšeném afterloadu s důsledkem snížení průtoku a dodávky kyslíku ve splanchnické oblasti. Rizikové jsou již hodnoty IAP okolo 8-12 mm Hg. Poškození GIT vede také k translokaci bakterií a uvolnění zánětlivých mediátorů, které jsou v přímé souvislosti s rozvojem MODS [25].
Břišní stěna a končetiny
Infekce, případně i rozpad operační rány, jsou častými komplikacemi u pacientů s IAH, která může vést až k ischemii svalů břišní stěny spolu s projevy myoglobinemie. Zvýšený intraabdominální tlak může také, spolu se všemi důsledky, způsobit až 65% snížení průtoku arterií femoralis [26].
Terapeutický přístup k ACS
Léčebný postup musí být vždy volen s ohledem na patofyziologii vzniku ACS, tedy, zda se jedná o primární či sekundární formu nebo jejich kombinaci. Nejefektivnější je samozřejmě prevence, založená na časné identifikaci klinicky méně závažných stadií IAH, podmíněna časným a frekventním měřením IAP. Časná identifikace IAH a snížení IAP je nejúčinnější prevencí rozvoje ACS a vede k lepší prognóze pacientů [27,28]. Oproti tomu je primární ACS, nezaznamenaný v prvních 24 hodinách po příjmu k hospitalizaci, zatížen závažnějším stupněm orgánového selhávání a vyšší mortalitou.
Především v traumatologických a chirurgických indikacích je standardem léčby ACS provedení dekompresní laparotomie (DL). Snížení IAP zde efektivně zmírní rozsah pozorovaných orgánových dysfunkcí [10]. Avšak pouze zvýšení srdečního indexu, redukce base-excess a úprava renálních funkcí prokazují přímou souvislost se zlepšením výsledků léčebných intervencí [29].
V návaznosti na chirurgickou léčebnou intervenci ACS můžeme využít postupy, které umožňují přechodný uzávěr dutiny břišní se zachováním dekompresního efektu, jako jsou zipové techniky, síťky atd [22]. Péče o takto ošetřenou dutinu břišní je však komplikovaná především velkou rannou plochou s rizikem ztrát tekutin, infekčními komplikacemi a herniací břišních orgánů. Jinou experimentální možností, která efektivně snižuje IAH, je aplikace extraabdominálního podtlaku (systém NEXAP) [30,31].
Časování a indikace DL ovšem nadále zůstávají kontroverzními nejenom ve vztahu k hodnotám IAP a orgánovým dysfunkcím, ale především i k rizikům vyplývajícím z jejího provedení. Literární údaje upozorňují na vysokou incidenci výskytu fulminantního hemodynamického selhávání, nereagujícího na následnou resuscitaci a krvácivé komplikace po provedení DL [32].
Primárním terapeutickým úkonem při stabilizaci pacienta v šoku je tekutinová resuscitace. Zde je nutno zmínit riziko plynoucí z nadměrného přívodu náhradních roztoků při rozvoji tkáňové ischemie a následném reperfuzním poškození. Zvýšení propustnosti kapilár vede k úniku tekutin do intersicia, edému tkání s pochopitelným zvýšením IAP a rizikem rozvoje MODS/MOF. Optimální míra a způsob objemové resuscitace při snaze dosáhnout adekvátní intravaskulární náplně je tedy důležitou součástí péče o pacienty s rizikem rozvoje ACS a měla by tedy být vedena za podmínek rozšířeného hemodynamického monitorování.
Diskuse, která porovnává vhodnost použití krystaloidních anebo koloidních roztoků při objemové resuscitaci pacientů v těžkém šoku, se vede několik desetiletí. V laboratorních podmínkách sice na jedné straně vede masivní tekutinová resuscitace Ringer-laktátovým roztokem k lepšímu přežívání u hypovolemických stavů [33], ale na straně druhé je také příčinou rozvoje edému mozku, plic a střev, což je v plném souladu s klinickými pozorováními a zkušenostmi. Prioritní užití krystaloidních roztoků také nepřímo podporuje progresi I/R poškození a aktivuje prozánětovou složku imunitní odpovědi [34,35]. Klinická studie u pacientů, podrobujících se kolorektální chirurgii, prokázala v „krystaloidní“ skupině při snížení koloidně-osmotického tlaku vyšší predispozici ke vzniku intersticiálních edémů, ve srovnání se skupinou „koloidní“, kde koloidně-osmotický tlak zůstal nezměněn [36].
Jako alternativu v situaci, kdy se ACS nerozvine jako důsledek krvácení či jiné chirurgicky řešitelné příčiny, lze tedy využít i nechirurgické postupy, které povedou k redukci intraabdominálního tlaku.
U pacientů s terminálním hepatálním selháním a ascitem může jeho drenáž zlepšit hemodynamické a renální funkce.
Pacienti s poruchou propustnosti kapilár a rozvojem intersticiálních edémů mohou profitovat z úpravy koloidně-onkotického tlaku, pokud použijeme syntetických a přírodních koloidních roztoků. Jako efektivní se ukazují také aplikace mineralokortikoidů [37]. Lze využít také dekomprese žaludku cestou odsátí ze sondy, provedení rektální enemy, aplikaci prokinetik (cistaprid, metoklopramid, domperidon, erytromycin, prostigmin).
Jako efektivní při pokusu snížit IAP se mohou uplatnit také látky se sedativním účinkem či myorelaxancia, avšak je nutno poznamenat, že v některých případech mohou obleněním až paralýzou peristaltiky naopak IAP zvýšit (především opioidy).
Konečně příslibem do budoucna mohou být také postupy či kombinace postupů, které ve finálním důsledku vedou k docílení negativní tekutinové bilance (forzírovaná diuréza, užití kombinace přírodní/syntetický koloid/diuretikum, CVVH, případně hemodialýza při nedostupnosti kontinuální metody). Avšak nutno zmínit, že přes velmi dobré výsledky v jednotlivých případech či aplikaci na malých skupinách pacientů prozatím nejsou dostupné velké studie, které by z hlediska EBM podpořily jejich paušální užívání. Zanedbatelný není ani problém správného časování při zahájení těchto terapeutických intervencí, kdy při adekvátní objemové resuscitaci časné fáze šoku je někdy naopak nutné a žádoucí připustit u pacienta bilanční pozitivitu a zmíněné postupy tedy naleznou uplatnění především v jeho pozdní fázi [38,39] (tab. 3).
Tab. 3. Algoritmus monitorování IAP (dle Kimball E et al. Crit Care Med 2006; 34: 2340–2348. 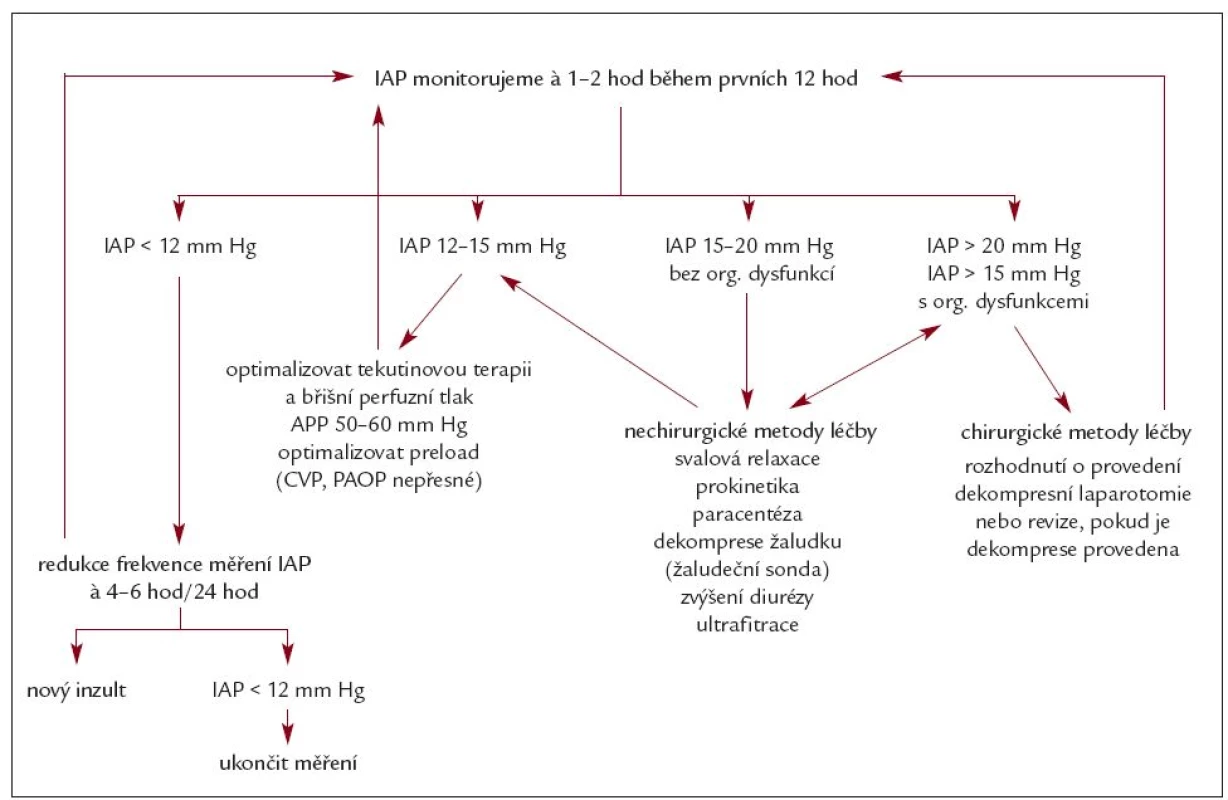
Závěr
Intraabdominální hypertenze je častým nálezem u široké populace pacientů hospitalizovaných na jednotkách intenzivní péče. Terapeutické postupy zaměřené na agresivní tekutinovou resuscitaci s cílem optimalizovat orgánovou a tkáňovou perfuzi kriticky nemocných mohou při absenci monitorování IAP zvýšit riziko rozvoje ACS, a následně díky rozvoji multiorgánové dysfunkce a selhávání vést až ke smrti pacienta. V tomto případě umožní časná identifikace rozvoje IAH/ACS zahájit efektivní terapeutická opatření a je samozřejmě nejlepší prevencí rozvoje následných komplikací.
MUDr. Pavel Szturz
www.fnspo.cz
e-mail: szturz@post.cz
Doručeno do redakce: 3. 1. 2007
Přijato po recenzi: 28. 2. 2007
Zdroje
1. Rezende-Neto J, Moree EE et al. Systemic inflamantory response secondary to abdominal compartment syndrome: stage for multiple organ failure. J Trauma 2002; 52 : 1121-1128.
2. Malbrain ML, Cheathem ML, Kirkpatrick A et al. Results from the international conference of exparts on intra-abdominal hypertension and abdominal compartment syndrome. Intensive Care Med 2006; 32 : 1722-1732.
3. Maxwell RA, Fabian TC et al. Secondary abdominal compartment syndrome: an uderappreciated manifestation severe hemorhagic shock. J Trauma 1999; 47 : 995-999.
4. Malbrain M, Chiumelo D et al. Prevalence of intra-abdominal hypertension in critically ill patients: a multicentre epidemiological study. Int Care Med 2004; 5 : 822-829.
5. Pelosi P, Brazzi L, Gattinoni L. Measuring intra-abdominal pressure in intensive care setting. In: Vincent J L Yearbook of intensive care and emergency medicine. Berlin: Springer 2001; 586-599.
6. Malbrain M, Jones F. Intra-abdominal pressuremeasurement techniques. In: Ivatury R, Chaetman M, Malbrain M et al (ed). Abdominal Compartment Syndrome. Georgetown: Landes Bioscinence 2006; 19-68.
7. Malbrain M. Different techniques to measure intra-abdominal pressure (IAP): time for a critical re-appriasal. Intensive Care Med 2004; 30 : 357-371.
8. BaloghZ, Jones F et al. Continuous intra-abdominal pressure measurement technique. Am J Surg 2004;188 : 679-684.
9. De Potter TJ, Dits H, Malbrain ML. Intra and interobserver variability during in vitro validation of two novel methods for intra-abdominal pressure monitoring. Intensive Care Med 2005; 31 : 747-751.
10. Balogh Z, McKinley BA et al. Abdominal compartment syndrome: The cause or effect of postinjury multiple organ failure. Shock 2003; 6 : 483-492.
11. Chan ST, Kapadia CR et al. Extracelular fluid volume expansion and third space seguestration at the site of small bowel anastomoses. Br J Surg 1983; 70 : 36-39.
12. Diebel LN, Dulchavsky SA et al. Splanchnic ischemia and bacterial translocation in the abdominal compartment syndrome. J Trauma 1998; 43 : 852-855.
13. Cheatham ML et al. Abdominal perfusion pressure: a superior parameter in the assessment of intra-abdominal hypertension. J Trauma 2000; 49 : 621-626.
14. Kashtan J et al. Hemodynamic effect of increased abdominal pressure. J Surg Res 1981; 30 : 249-255.
15. Barnes GE et al. Cardiovascular responses to elevation of intra-abdominal hydrostatic pressure. Am J Physiol 1985; 248 : 208-213.
16. Cullen DJ et al. Cardiovascular, pulmonary, and renal effects of massively increased intra-abdominal pressure in critically ill patients. Crit Care Med 1989; 17 : 118-121.
17. Ridings PC et al. Cardiopulmonary effects of raised intra-abdominal pressure before and after intravascular volume expansion. J Trauma 1995; 39 : 1071-1075.
18. Cheatham ML et al. Right ventricular end-diastolic volume index as a predictor of preload status in patients on positive end-expiratory pressure. Crit Care Med 1998; 26 : 1801-1806.
19. Cheatham ML et al. Preload assessment in patients with an open abdomen. J Trauma 1999; 46 : 16-22.
20. Pelosi P et al. Pulmonary and extrapulmonary acute respiratory distress syndrome are different. Eur Respir J Suppl 2003; 42 : 48-56.
21. Sugrue M et al. Intra-abdominal hypertension is an independent cause of postoperative renal impairment. Arch Surg 1999; 134 : 1082-1085.
22. Hunter JD, Damani Z. Intra-abdominal hypertension and the abdominal compartment syndrome. Anaesthesia 2004; 59 : 899-907.
23. Citerio G et al. Induced abdominal compartment syndrome increases intracranial pressure in neurotrauma patients: a prospective study. Crit Care Med 2001; 29 : 1466-1471.
24. Diebel LN, Dulchavsky SA, Wilson RF. Effect of increased intra-abdominal pressure on mesenteric arterial and intestinal mucosal blood flow. J Trauma 1992; 33 : 45-48.
25. Diebel LN, Dulchavsky SA, Brown WJ. Splanchnic ischemia and bacterial translocation in the abdominal compartment syndrome. J Trauma 1997; 43 : 852-855.
26. Biffl WL, Moore EE et al. Femoral arterial graftfailure caused by the acendary abdominal syndrome. J Trauma 2001; 50 : 740-742.
27. Schein M et al. The abdominal compartment syndrome: the physiological and clinical consequences of elevated intra-abdominal pressure. J Am Coll Surg 1995; 180 : 745-753.
28. Morken J, West MA. Abdominal compartment syndrome in the intensive care unit. Curr Opin Crit Care 2001; 7 : 268-274.
29. Balogh Z, Mc Kinley BA, Cocanour CS et al. Both primary and secondary abdominal compartment syndrome can be predicted earlyand areharbingers of multiple organ failure. J. Trauma 2003 ; 54 : 848-859.
30. Suliburk JW, Ware DN, Balogh Z et al. Vacuumassited wound closure acheves early fascial closure of open abdomens after severe trauma. J Trauma 2003; 55 : 1155-1160.
31. Valenza F, Bottin N, Canavesi K et al. Intra-abdominal pressure may by decreased non-invasively by continuous negative extra-abdominal pressure (NEXAP). Intensive Care Med 2003; 29 : 2063-2067.
32. Shelly MP, Robinson AA et al. Haemodynamic effects following surgical release of increased intra-abdominal pressure. Br J Anaesth 1987; 59 : 800-805.
33. Healey MA, Samphire J et al. Irreversible shock is not irreversible: new model of massive hemorrhage and resuscitation. J Trauma 1975; 50 : 670-674.
34. Rhee P, Wang D et al. Human neutrophil activationand increased adhesion by various resuscitation fluids. Crit Care Med 2001; 28 : 74-78.
35. Silliman CC, Voelke NK et al. Plasma and lipids from stored packet red blood cells cause acute lung injury in an animal model. J Clin Invest 1998; 101 : 1458-1467.
36. Prien T, Backhaus N et al. Effect on intraoperative fluid administration and colloid osmotic pressure on the formation of intestinal edema during gastrointestinal surgery. J Clin Anesth 1990; 2 : 317-323.
37. Standl T, Gottschalk A et al. The abdominal compartment syndrome in the critically ill patients. In: Vincent JL Yearbook of intensive care and emergency medicine. Berlin: Springer 2005, 315-324.
38. Malbrain ML. Is it wise not to think about intrabdominal hypertensioniv the ICU? Curr Opin Crit Care 2004; 10 : 132-145.
39. Kula R, Szturz P et al. A role for negative fluid balance in septic patients with abdominal compartment syndrome. Int. Care Med 2004; 30 : 2138-2139.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2007 Číslo 9- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Primárny aldosteronizmus
- Inkretinová strategie léčby diabetes mellitus 2. typu - DPP-IV
- 5. medzinárodný kongres o výskume uremického syndrómu a uremickej toxicity, 7. nefrologická konferencia baltických štátov.
- Prof. MUDr. Jaromír Hradec, CSc., šedesátníkem
- Vzpomínka na emeritního primáře interního oddělení Krajské nemocnice T. Bati, a.s., ve Zlíně, prim. MUDr. Rostislava Lukaštíka
- Novák Z, Chrastina J, Říha I. Atlas of Endoscopic Neurosurgery. Atlas endoskopické neurochirurgie.
- Úvodník
- Výsledek celotělového FDG-PET vyšetření predikuje osud nemocných s difuzním velkobuněčným lymfomem - editorial
- Jaká je role katétrové ablace A-V junkce a trvalé kardiostimulace v době, kdy lze fibrilaci síní všech forem léčit selektivní katetrovou ablací? - editorial
- Léčba fibrilace síní v době katétrové ablace - editorial
- Možnosti imunomodulační terapie u kriticky nemocných - lepší diagnostika znamená účinnější léčbu - editorial
- Tuková buňka stále plodnější - editorial
- Únavový syndrom v onkologii - editorial
- Invazivní houbové infekce u nemocných po transplantaci kmenových buněk krvetvorby: vývoj v diagnostice, prevenci a léčbě v posledním desetiletí - editorial
- Inkretinová strategie léčby diabetes mellitus 2. typu - DPP-IV - editorial
- Výsledek celotělového FDG-PET vyšetření predikuje osud nemocných s difuzním velkobuněčným lymfomem jak při použití v intermediárním stagingu, tak při použití na konci standardní chemoterapie
- Dlouhodobé sledování pacientů s klinickými známkami krvácení do horní části trávicího traktu a negativním endoskopickým nálezem
- Včasné hemodynamické zmeny po rádiofrekvenčnej ablácii predsieňovokomorového spojenia
- Immodin v léčbě imunoparalýzy nemocných v intenzivní péči
- Sérová hladina retinol-binding proteinu 4 u obéznych s inzulínovou rezistenciou a jedincov s diabetom 2. typu liečených metformínom
- QT dynamicita v rizikové stratifikaci u pacientů po infarktu myokardu
- Endoskopické nálezy v horním trávicím traktu u pacientů s jaterní cirhózou
- Intraabdominální hypertenze na jednotkách intenzivní péče
- Únavový syndrom u onkologického pacienta: možnosti diagnostiky a léčby
- Současné možnosti robotické kardiochirurgie
- Časná diagnostika invazivních mykotických infekcí u hematoonkologických nemocných pomocí sérologických metod
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Intraabdominální hypertenze na jednotkách intenzivní péče
- Únavový syndrom u onkologického pacienta: možnosti diagnostiky a léčby
- Primárny aldosteronizmus
- Včasné hemodynamické zmeny po rádiofrekvenčnej ablácii predsieňovokomorového spojenia
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



