-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Transplantace srdce
Heart transplantation
The first heart transplantation (SHT) was performed by Professor Ch. Barnard in 1967 but it was not until 1980s that this method became an established approach to treatment of patients with end-stage heart failure. Considering the limited number of donor organs and the number of potential post-transplantation complications, the decision to perform heart transplantation at the right time in an indicated patient is difficult and complex. Subsequent pharmacological management with immunosuppressive agents and other medication becomes everyday life reality. Knowledge of drug interactions and collaboration with cardiologists are necessary in order to maintain long-term treatment success. Despite the current developments in surgical methods, examination methods and immunosuppressant therapy, a range of complications has to be dealt with. The future of care for patients with transplants will rely on the development of new immunosuppressive drugs with a minimum of adverse effects and discovery of a non-invasive technique for graft rejection diagnosis.
Key words:
heart failure – transplantation – indication – immunosuppressive therapy
Autoři: P. Hude 1; L. Špinarová 1; J. Krejčí 1; H. Bedáňová 2; P. Němec 2; J. Vítovec 1
Působiště autorů: I. interní kardio-angiologická klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta prof. MUDr. Jiří Vítovec, CSc., FESC 1; Centrum kardiovaskulární a transplantační chirurgie Brno, ředitel doc. MUDr. Petr Němec, CSc. 2
Vyšlo v časopise: Vnitř Lék 2009; 55(9): 711-717
Kategorie: 80. narozeniny prof. MUDr. Miloše Štejfy, DrSc., FESC, člena redakční rady časopisu Vnitřní lékařství
Souhrn
První transplantace srdce (OTS) byla provedena prof. Ch. Barnardem v roce 1967, ale až od 80. let 20. století se stala klinicky zavedenou metodou léčby pacientů s terminálním srdečním selháním. Vzhledem k omezenému počtu dárcovských orgánů a množství možných potransplantačních komplikací je rozhodnutí k provedení srdeční transplantace u indikovaného pacienta ve správný okamžik komplexní a složité. Následná farmakologická léčba imunosupresivy a dalších preparátů se stává každodenní životní realitou. Pro dlouhodobý léčebný úspěch je znalost lékových interakcí a spolupráce s ošetřujícími kardiology absolutní nutností. Přes jednoznačné pokroky v operačních technikách, vyšetřovacích metodách i imunosupresivní léčbě je potřebné řešit množství komplikací. Budoucnost péče o transplantované nemocné bude spočívat ve vyvinutí nových imunosupresiv s minimem nežádoucích účinků a nalezení neinvazivní diagnostiky rejekce štěpu.
Klíčová slova:
srdeční selhání – transplantace – indikace – imunosupresivní léčbaHistorie transplantace srdce
Srdeční transplantace je v současnosti běžně klinicky užívanou metodou léčby pacientů s těžkým srdečním selháním. Cesta k uplatnění této metody nebyla lehká a trvalo řadu let, než si našla své místo v lékařské praxi.
Chirurgickou techniku ortotopické transplantace, která se používá dodnes, popsali v roce 1960 R. R. Lower a N. E. Shumway. První transplantaci srdce u člověka provedl 3. 12. 1967Christiaan Neethling Barnard v Kapském Městě v Jihoafrické republice [1,2].
V následujících několika letech byly výsledky přežívání transplantovaných pacientů velmi špatné, především pro nedostačující imunosupresivní léčbu a častý rozvoj rejekce.
Po přechodném útlumu dochází k výraznému zvýšení zájmu o srdeční transplantaci a zlepšení výsledků po roce 1976 po ověření imunosupresivního účinku cyklosporinu A. Jeho zavedení do rutinní imunospuresivní léčby se přežívání pacientů po srdeční transplantaci výrazně zlepšilo [1,2,24].
První úspěšná transplantace v Československu byla provedena v IKEM Praha v roce 1984 [9]. Druhé transplantační centrum v České republice zahájilo svou činnost v roce 1992 v Brně v Centru kardiovaskulární a transplantační chirurgie (CKTCH) ve spolupráci s I. interní kardio-angiologickou klinikou. Po počátečním vzestupu počtu transplantovaných pacientů došlo v České republice i celosvětově ke stagnaci počtu srdečních transplantací, způsobené zejména nedostatkem dárců. Ročně se ve světě provádí kolem 3 500 až 4 000 srdečních transplantací. Počty transplantací v posledních letech v České republice ukazuje tab. 1.
Tab. 1. Počty transplantací srdce v České republice. 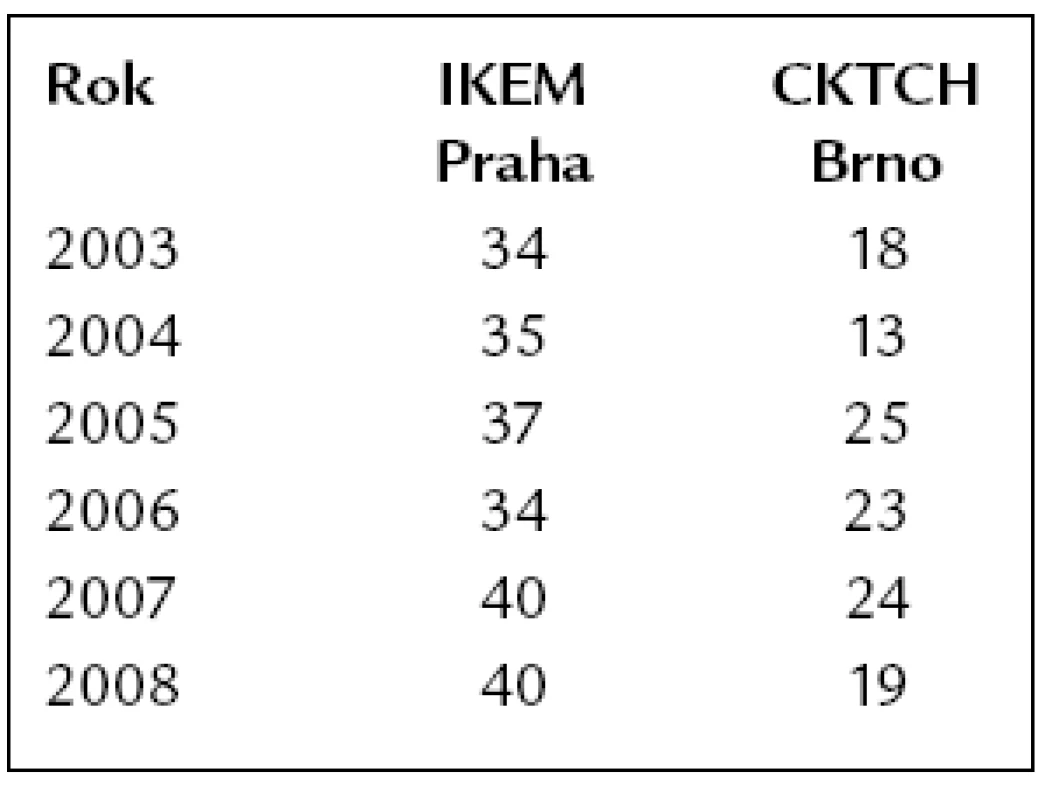
I přes tento nepříznivý trend si Česká republika udržuje velmi dobré místo v rámci srovnání s ostatními evropskými zeměmi.
Výběr nemocného k srdeční transplantaci
Léčba srdečního selhání v posledních letech dosáhla obrovského pokroku ve smyslu zlepšení kvality a/nebo prodloužení délky života. Přesto žádná jiná léčba srdečního selhání nemůže tak zásadně změnit prognózu nemocného, jinak nezvratně odsouzeného k smrti, jako právě transplantace srdce.
Vybrat vhodného pacienta a zvolit optimální okamžik pro zařazení na čekací listinu a následné provedení srdeční transplantace je komplexní a složité rozhodování. Pacient musí splňovat jednak indikační kritéria, tj. prokázat, že jeho stav srdeční funkce je natolik závažný bez možnosti jiného způsobu léčby (farmakologicky i přístrojově), na druhé straně nesmí mít nemocný kontraindikace, které by limitovaly jeho další přežívání po výkonu. Maximální léčba chronického srdečního selhání u nemocného je samozřejmostí [2,24].
Indikace k transplantaci srdce
- pokročilé stadium chronického srdečního selhání NYHA III. nebo IV. stupněpři prognóze kratší než 12 měsíců, vyčerpání všech dalších farmakologických či nefarmakologických postupů a nemožnost konvenční kardio-chirurgické léčby
- detekce výrazně snížené systolické funkce levé komory s ejekční frakcí nižší než 20 %
- výrazné omezení funkční zdatnosti – maximální spotřeba kyslíku při spiroergometrii méně než 14 ml/kg/min a současně je pod 50 % predikovaných hodnot
- závažná ischemie refrakterní na léčbua neřešitelná revaskularizací
- opakované maligní arytmie, refrakterní na všechny léčebné postupy
- věk pod 65 let
Kontraindikace srdeční transplantace
Absolutní
- fixovaná plicní hypertenze (plicní vaskulární resistence více než 3,5 W j. a/nebo transpulmonální gradient – TPG – více než 15 mm Hg, které neklesnou ani po aplikaci vazodilatační látky)
- maligní onemocnění včetně léčeného nemocného v remisi, pokud doba sledování je kratší než pět let
- systémové onemocnění s multiorgánovým postižením
- akutní nebo chronické infekční onemocnění (např. HIV)
- tromboembolická komplikace před dobou kratší než tři měsíce
- významné plicní parenchymatózní onemocnění, které výrazně omezuje plicní funkci (FVC méně než 50 % predikované hodnoty nebo FEV1 menší než 50 %)
- alkoholová nebo drogová závislost
- psychosociální nestabilita nebo chronické psychické onemocnění
- nespolupracující nemocný
Relativní
- orgánové komplikace diabetes mellitus (samotný DM na inzulinu není kontraindikací)
- těžké ledvinné selhání (glomerulární filtrace pod 0,8 ml/s nebo sérový kreatinin více než 175 µmol/l) (nebo úvaha o kombinované transplantaci srdce a ledvin)
- těžké poškození jaterních funkcí (s výjimkou změn způsobených městnáním anebo kombinovaná transplantace srdce a jater)
- věk nad 60–65 let (individuální posouzení)
- povšechná ateroskleróza
- vředová choroba gastroduodena v aktivní fázi
- těžká osteoporóza
- těžká kachexie
- nadváha více než 20 %
Pacient musí být komplexně vyšetřen, včetně ošetření infekčních fokusů. Pokud vyloučíme jiné způsoby léčby, splňuje-li pacient indikační kritéria a nemá kontraindikace, je zařazen na čekací listinu (waiting list). Vyžaduje-li pacient hospitalizaci s trvalou farmakologickou podporou inotropními látkami, kontinuální nitrožilní podávání diuretik, či dokonce balonkovou kontrapulzaci nebo mechanickou srdeční podporu, je zařazen na urgentní čekací listinu. Naopak při výrazném zlepšení klinického stavu pacienta může dojít i k jeho vyřazení z čekací listiny [2,13].
Potransplantační období
Na brněnském pracovišti v časném potransplantačním období je pacient v péči kardiochirurgického pracoviště, které ho zhruba po 4 týdnech předává do dlouhodobého sledování na kardiologickou kliniku. Pacienti jsou pravidelně hospitalizováni, s provedením endomyokardiální biopsie (EMB), která i v dnešní době zůstává jedinou spolehlivou metodou ke stanovení rejekce. Při pravidelných hospitalizacích jsou mimo EMB prováděny EKG, ECHO srdce, laboratorní vyšetření, stanovení hladin imunosupresiv, sérologie na cytomegalovirus (CMV) a virus Ebstein-Barrové (EBV), kultivace moči a event. sputa, výtěr z krku. Koronarografické vyšetření se provádí po 1. roce a následně dle indikace lékaře. Pokud je u pacientů hospitalizační interval delší než tři měsíce, jsou pravidelně sledovaní i ambulantně s kontrolou klinického stavu a hladin imunosupresiv [11].
Imunosupresivní léčba pacientů po srdeční transplantaci
Imunosupresiva tvoří základ léčby nemocných po ortotopické transplantaci srdce (OTS). V průběhu posledních 15 let můžeme pozorovat významné změny v imunosupresivních režimech. Objevem nových imunosupresiv dochází k rozšíření kombinačních terapeutických možností. Dochází k poklesu užívání cyklosporinu a azathioprinu, na rozdíl od vzestupu používání mykofenolátu a tacrolimu. V kombinační léčbě je na ústupu kombinace cyklosporin a azathioprin, naopak vzrůstá počet pacientů s kombinací mykofenolát + cyklosporin nebo mykofenolát + tacrolimus [19]. Svoje místo v léčbě pacientů po transplantaci srdce si hledají také nejnovější preparáty sirolimus a everolimus.
Tab. 2 shrnuje možné imunosupresivní režimy.
Tab. 2. Imunosupresivní režimy. 
U nekomplikovaných pacientů je ve všech režimech snaha o vysazení kortikoidů v průběhu 6–12 měsíců po OTS a ponechání trvalé dvojkombinační terapie. Problematika kombinační terapie po srdeční transplantaci zahrnuje velmi široké spektrum preparátů, které tito pacienti užívají, proto je nutné věnovat výraznou pozornost lékovým interakcím. Nejvíce interakcí s dalšími preparáty mají kalcineurinové inhibitory (cyklosporin, tacrolimus), které se metabolizují cestou CYP 450 3A4, stejně jako mnoho léků užívaných u transplantovaných pacientů [4,10].
Dlouhodobý úspěch této léčby pro pacienty závisí nejenom na práci transplantačních center a klinických pracovišť, ale také na dobré spolupráci s ošetřujícími kardiology, kteří se s těmito pacienty dnes již běžně setkávají.
Cyklosporin
Cyklosporin se v buňkách váže na cyklofiliny, s nimiž tvoří komplex, který zasahuje do procesu intracelulárních signálních cest. Jeho konečným efektem je inhibice transkripčních faktorů nutných k aktivaci některých cytokinových genů, zejména genu pro IL-2, IL-3, IL-4 a interferon γ, čímž dochází k inhibici časné fáze aktivace T-lymfocytů, potlačení sekrece IL-2 zamezuje aktivaci dalších lymfocytů [16].
Nežádoucí účinky jsou: hyperplazie dásní (je obvykle reverzibilní během 6 měsíců po ukončení terapie), hirzutizmus, hypertenze, nefrotoxicita (projevující se jako intersticiální fibróza s tubulární atrofií), třes (jeho výskyt je závislý na dávce), hyperkalemie, hypomagnezemie, hyperurikemie, hyperlipidemie [11].
Při terapii statiny (především lovastatinu, simvastatinu a atorvastatinu)je třeba opatrnosti. Cyklosporin i tacrolimus se metabolizují cestou CYP 450 3A4, stejně jako atorvastatin, lovastatin, simvastatin či nový rosuvastastin a na základě jejich lékové interakce dochází ke zvýšení plazmatických koncentrací těchto statinů s možným nebezpečím vzniku myopatií až rabdomyolýzy [4,25]. Fluvastatin i pravastatin se metabolizují jinými cestami, proto se jeví farmakologicky vhodnější u nemocných po OTS, protože nebezpečí lékových interakcí na CYP 450 3A4 je minimální [20]. Další lékové interakce cyklosporinu ukazuje tab. 3.
Tab. 3. Lékové interakce cyklosporinu. 
Azathioprin
Azathioprin je derivát cytostaticky účinného mercaptopurinu s vysokou účinností na potlačení imunity zprostředkované především lymfocyty T.
Jeho nežádoucí účinky jsou: nechutenství, nauzea, zvracení, megaloblastická anémie, leukopenie, trombocytopenie, alergické kožní reakce [12].
Prednison
Prednison je kortikosteroid s vystupňovanou glukokortikoidní účinností a nízkým mineralokortikoidním působením. Dávka 5 mg odpovídá asi 20 mg hydrokortizonu. Má nespecifické protizánětlivé účinky. Blokuje produkci cytokinů T-lymfocyty a makrofágy, inhibuje tvorbu prostaglandinů a leukotrienů (inhibicí fosfolipázy A2), tlumí tvorbu interleukinů a zasahuje do celulární imunitní odpovědi.
Mezi jeho četné nežádoucí účinky patří: diabetes mellitus, obezita, hyperlipidemie, hirzutizmus, retence sodíku a vody, deplece draslíku, myopatie, osteoporóza, vředová choroba gastroduodena, pankreatitida, hypertenze, poruchy chování, porucha hojení ran, nedostatečnost nadledvin [24].
Tacrolimus (FK 506)
Tacrolimus je makrolidové antibiotikum s výrazným imunosupresivním účinkem. Inhibicí kalcineurinu se váže na cytoplazmatický receptor FK binding protein (FKBP-12). Je značně podobný mechanizmu účinku cyklosporinu: brání aktivaci lymfocytů T vyvolané mitogenní a antigenní stimulací (in vitro) přibližně 100krát účinněji než cyklosporin. Je velmi účinný zejména u chronických kortikorezistentních rejekcí [8].
Nežádoucí účinky jsou: nauzea, zvracení, bolesti břicha, průjem, nechutenství, neurotoxicita (úzkost, zmatenost, deprese, závratě, halucinace, poruchy spánku, epileptické paroxyzmy, parestézie), periferní otoky, nefrotoxicita, anémie, hyperglykemie, hyperkalemie, hypomagnezemie, svědění, alergické kožní reakce; méně často hypertenze, neuropatie, tinnitus, poruchy vidění, osteoporóza, hyperlipidemie, vzácně lymfoproliferativní onemocnění [3].
Mykofenolát Mofetil (MMF)
Mykofenolát Mofetil je účinné imunosupresivum ze skupiny antiproliferativních látek. Vlastní účinnou látkou je kyselina mykofenolová. Inhibuje syntézu guanozinových nukleotidů inhibicí inozinmonofosfátdehydrogenázy. Má výraznější efekt na lymfoidní buňky než na myeloidní, způsobený odlišnou závislostí těchto dvou buněčných linií na syntéze nukleotidů de novo. Nemá vliv na časné fáze aktivace lymfocytů (neinhibuje syntézu interleukinu 2), ale zřejmě zasahuje až do pozdějších proliferativních a diferenciačních pochodů. Dochází k potlačení produkce protilátek i ke snížení buněčné imunitní reakce [3,21].
Nežádoucí účinky jsou: zažívací potíže, dyspnoe, periferní otoky, hematurie, poruchy krevního obrazu, méně často poruchy srdečního rytmu, závratě, nespavost, bolest svalů, kostí a kloubů, třes, krvácení do trávicího ústrojí, hyperplazie dásní, gingivitida, stomatitida, pankreatitida, alergické kožní reakce; vzácněji vznik lymfoproliferativního onemocnění.
Sirolimus (Rapamycin) a Everolimus
Sirolimus je makrolidové antibiotikum s výrazným imunosupresivním účinkem, jehož podrobný mechanizmus není zcela znám. Brání aktivaci T-lymfocytů vyvolané mitogenní a antigenní stimulací (in vitro), přitom blokuje na vápníku závislé i nezávislé intracelulární signální transdukce. Derivátem sirolimu je everolimus (RAD 001). Sirolimus a everolimus inhibují progresi T-lymfocytů do S-fáze buněčného cyklu. Experimentální data ukazují, že by sirolimus mohl zabraňovat chronické rejekci, a tím i vývoji vaskulopatie štěpu.
Nežádoucí účinky sirolimu jsou zažívací potíže, hypertenze, poruchy srdečního rytmu, dyspnoe, bolesti kostí a kloubů, periferní otoky, poruchy krevního obrazu, hypercholesterolemie, hyperlipidemie, hyperkalemie, nebo naopak hypokalemie, akneiformní erupce, alergické kožní reakce; epistaxe, otoky obličeje, hemolyticko-uremický syndrom, vzácněji lymfoproliferativní onemocnění.
Důvody převodu na sirolimus u pacientů po srdeční transplantaci jsou chronická cyklosporinová nefrotoxicita [6], refrakterní rejekce [23], vaskulopatie štěpu [15], myopatie či cyklosporinová neurotoxicita a vznik malignity.
Indukční terapie
Indukční terapie zahrnuje krátký interval prvních dnů po transplantaci, dokud nejsou dosaženy terapeutické hladiny kalcineurinových inhibitorů. Existují různé protokoly používající monoklonální nebo polyklonální protilátky.
Polyklonální protilátky (ATG – antithymocytární nebo ALG – antilymfocytární globulin) suprimují jak T, tak B-lymfocyty, a tím mohou vést ke zvýšenému výskytu zejména oportunních infekcí. Muromonab (OKT3) je monoklonální protilátka namířená speciálně proti T-lymfocytům, a tak šetří ostatní části imunitního systému příjemce. Jako nadějné se jeví protilátky přímo proti receptoru interleukinu 2: basiliximab (Simulect) nebo daclizumab (Zenapax). Tyto léky se podávají jako čtvrté do základní trojkombinace imunosupresiv [3].
Komplikace po srdeční transplantaci
U pacientů po transplantaci srdce se setkáváme s četnými komplikacemi, které rozdělujeme do dvou hlavních skupin. Komplikace po srdeční transplantaci ukazuje tab. 4.
Tab. 4. Komplikace po srdeční transplantaci. 
Rejekce
Imunitní systém se přirozeně brání přijetí cizího orgánu a jeho reakci je třeba potlačovat imunosupresivní léčbou. I když v dnešní době existuje řada účinných imunosupresiv, přesto se s rejekčními epizodami stále setkáváme. Podle mechanizmu vzniku se dělí na rejekci celulární a humorální, podle rychlosti nástupu na hyperakutní, akutní a chronickou.
Hyperakutní rejekce
Hyperakutní rejekce se objevuje jen velmi zřídka, nejčastěji do 24 hod od transplantace. Jedná se o protilátkami způsobenou rejekci, při které dochází k trombotizaci srdečních venul, což vede k obstrukci drenáže transplantovaného srdce.
Akutní celulární rejekce
Akutní celulární rejekce je zprostředkovaná T-lymfocyty a dochází při ní k lymfocytární infiltraci myokardu. V případě progrese dochází k rozpadu buněk a infiltraci polymorfonukleáry. Zánik buněk se děje nekrózou a/nebo apoptózou [5].
Různý stupeň akutní rejekce je relativně častá komplikace vyskytující se nejčastěji v prvních měsících po srdeční transplantaci. Může proběhnout asymptomaticky, ale těžší stupně rejekce mohou vést až k selhání štěpu. Časný záchyt možné rejekce štěpu je proto velmi důležitý. Zatím jedinou suverénní metodou rozpoznání rejekce štěpu je endomyokardiální biopsie. Vzorky myokardu se odebírají z pravé komory, nejlépe ze septa či hrotu. V časném období po srdeční transplantaci jsou srdeční biopsie prováděny v týdenních intervalech, které se postupně prodlužují až na intervaly roční. Přes maximální snahu nebyla prozatím nalezena neinvazivní metoda detekce akutní rejekce myokardu, která by mohla biopsii myokardu nahradit [2,26].
Pokud nejsou ve vzorcích z endomykoardiální biopsie nalezeny histologické známky rejekce (stupeň 0 a 1A), není nutné měnit udržovací imunosupresivní léčbu. V případě známek mírné rejekce (stupeň 1B nebo 2) podáváme nárazové dávky kortikosteroidů – metylprednisolonu 10 mg/kg/den nitrožilně po dobu tří dnů za sebou nebo přechodně zvyšujeme dávku prednisonu. Pokud se rejekce objeví při účinném rozmezí hladin cyklosporinu, je možné zvýšení dávky mykofenolátu mofetilu na 3 g/den nebo převedení z cyklosporinu na tacrolimus. Při závažných rejekcích (stupeň 3 a 4) je někdy nutné kromě vysokých dávek kortikoidů použít polyklonální protilátky – ATG v dávce 5 mg/kg/den po dobu 7–10 dnů, ojediněle monoklonální protilátky. Převod z cyklosporinu na tacrolimus je v těchto případech nutností [3].
Akutní buněčná rejekce je zobrazena na obr. 1 [23].
Obr. 1. Histologický obraz akutní buněčné rejekce grade 2 podle Billinghamové et al. 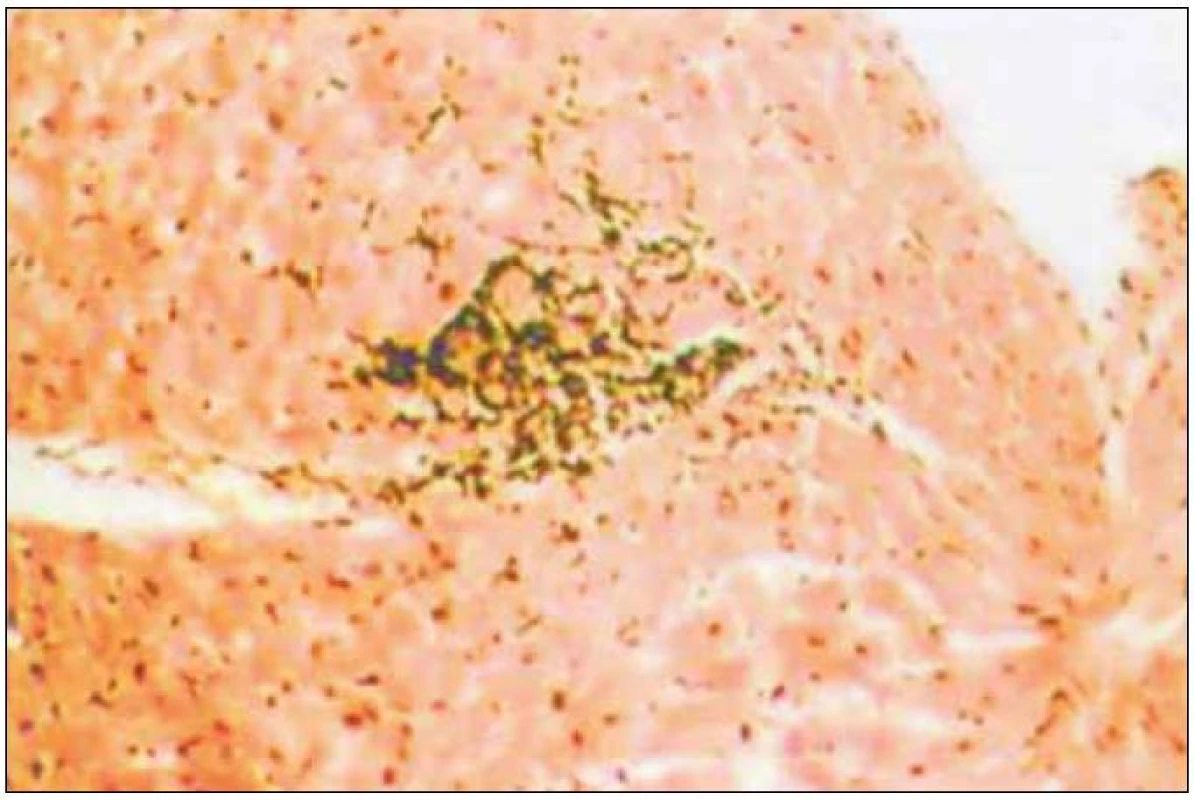
Echokardiografický obraz akutní rejekce je od cyklosporinové doby mnohem méně vyjádřen, protože celulární rejekce je spojena s menším rozsahem infiltrace a edému tkáně, stejně tak i menším postižením funkce komor. Při pokročilejších stadiích rejekce můžeme pozorovat ztluštění stěn srdečních komor (infiltrace a edém). Kromě změn diastolických parametrů dochází ke zhoršování i systolické funkce myokardu. Může se objevit i perikardiální výpotek či další změny [26].
Chronická rejekce (vaskulární)
Chronická rejekce bývá označována také jako koronární nemoc štěpu (CAV). Je charakterizována intimálními změnami na věnčitých tepnách. Jedná se o difuzní charakter postižení na koronárních tepnách. Na rozdíl od klasické aterosklerózy jde o difuzní intimální hyperplazii, při které lamina elastika interna zůstává intaktní. U CAV nebývají přítomny kalcifikace a postižení se může často vyvíjet velmi rychle. Koronární nemoc štěpu postihuje asi 15–20 % pacientů po transplantaci srdce a je po akutní rejekci a infekci třetí nejčastější příčinou smrti. Jedinou spolehlivou detekční metodou koronární nemoci štěpu je intravaskulární ultrazvukové vyšetření (IVUS). Koronarografii považujeme za nespolehlivou, neboť se většinou nenajdou lokalizovaná zúžení. Jako příčina koronární nemoci štěpu se předpokládá kombinace imunologických a neimunologických vlivů, které vedou k poškození endoteliálních buněk s následnou myointimální proliferací. K imunologickým vlivům patří opakované akutní rejekce, humorální rejekce, imunokompatibilita DR systému. K neimunologickým vlivům řadíme dobu studené ischemie, věk a přítomnost ICHS dárce, věk, ICHS, obezitu, diabetes mellitus a dyslipidemie příjemce. Změny na koronárních cévách nemají vztah k původní diagnóze, ale udává se vztah k CMV a EBV infekci, k imunosupresivům, k ischemicko-reperfuznímu poškození a k počtu rejekčních epizod. Difuzní charakter postižení koronárních tepen neumožňuje ve většině případů řešení perkutánní nebo chirurgickou revaskularizací, proto často končí náhlou srdeční smrtí nebo infarktem myokardu. Pokročilá forma, která může vést až k dysfunkci štěpu, se může řešit jedině retransplantací srdce, ale její indikaci je nutno pro horší výsledky velmi dobře uvážit. Hlavním směrem v problému CAV je její prevence [2,11,14].
Humorální rejekce
Humorální rejekce je způsobena specifickými cytotoxickými protilátkami. Histologicky je definována lineárními depozity imunoglobulinů a komplementu v myokardiálních kapilárách. Humorální rejekce může probíhat ve formě hyperakutní (viz výše) nebo chronické. Hyperakutní humorální rejekce je pravděpodobně hlavní příčinou akutní ztráty štěpů. Rizikové faktory humorální rejekce a vliv na výskyt koronární nemoci štěpu popisuje ve svých pracích Michaels. Diagnózu stanovoval histologicky (edém buněk, dilatované kapiláry, intersticiální edém a hemoragie), imunofluorescenčně (depozita imunoglobulinu a komplementu v kapilárách dohromady s HLA-DR pozitivitou) nebo imunoperoxidázovým barvením do parafínu zalité tkáně (četné CD 68-pozitivní makrofágy a méně edematózních endoteliálních buněk v dilatovaných kapilárách) [17].
Humorální rejekce nereaguje na běžnou léčbu akutní buněčné rejekce, ale může se použít plasmaferéza, intravenózní podávání imunoglobulinů, anti CD 20.
Infekce
Časné infekce do 1 měsíce jsou nejčastěji nozokomiálního původu způsobené Pseudomonas aeruginosa, Staphylococcus aureus a jinými gramnegativními kmeny.
Pozdní infekce se nejčastěji objevují mezi 1. měsícem a koncem 1. roku. Nejčastěji bývají způsobeny oportunními patogeny. Mezi tyto patří herpetické viry, zejména pak Cytomegalovirus a virus Ebstein-Barrové. Mezi další patří Pneumocystis carinii a mykózy.
Léčba spočívá v podávání antibiotik dle citlivosti, event. antivirotik nebo antimykotik. První 3 měsíce po transplantaci srdce je podáváme jako profylaxi infekcí. Velmi pečlivě je třeba léčit prokázanou CMV infekci gancyklovirem či novějším valgancyklovirem, protože CMV může přispívat k rozvoji vaskulopatie štěpu a v indikovaných případech se antivirotika podávají i preventivně [14].
Vaskulopatie štěpu
Jedná se o zvláštní formu koronární nemoci cév štěpu, na jejímž vzniku se podílí více rizikových faktorů. Patří k nim kromě klasických rizikových faktorů ischemické choroby srdeční, jako je hyperlipoproteinemie, hypertenze či obezita, také podíl chronické rejekce – tedy imunitní mechanizmy. Na koronární nemoci štěpu se také podílí cytomegalovirová infekce a cyklosporin. Spolehlivá diagnostika vaskulopatie je možná jen intravaskulárním ultrazvukem. Její prevalence je vysoká, udává se 10% první rok po srdeční transplantaci se vzrůstajícím počtem v dalších letech. Po pěti letech je již přítomná u 30–50 % pacientů.
Typické změny při vaskulopatii štěpu ukazuje obr. 2.
Obr. 2. Vaskulopatie koronární tepny štěpu. 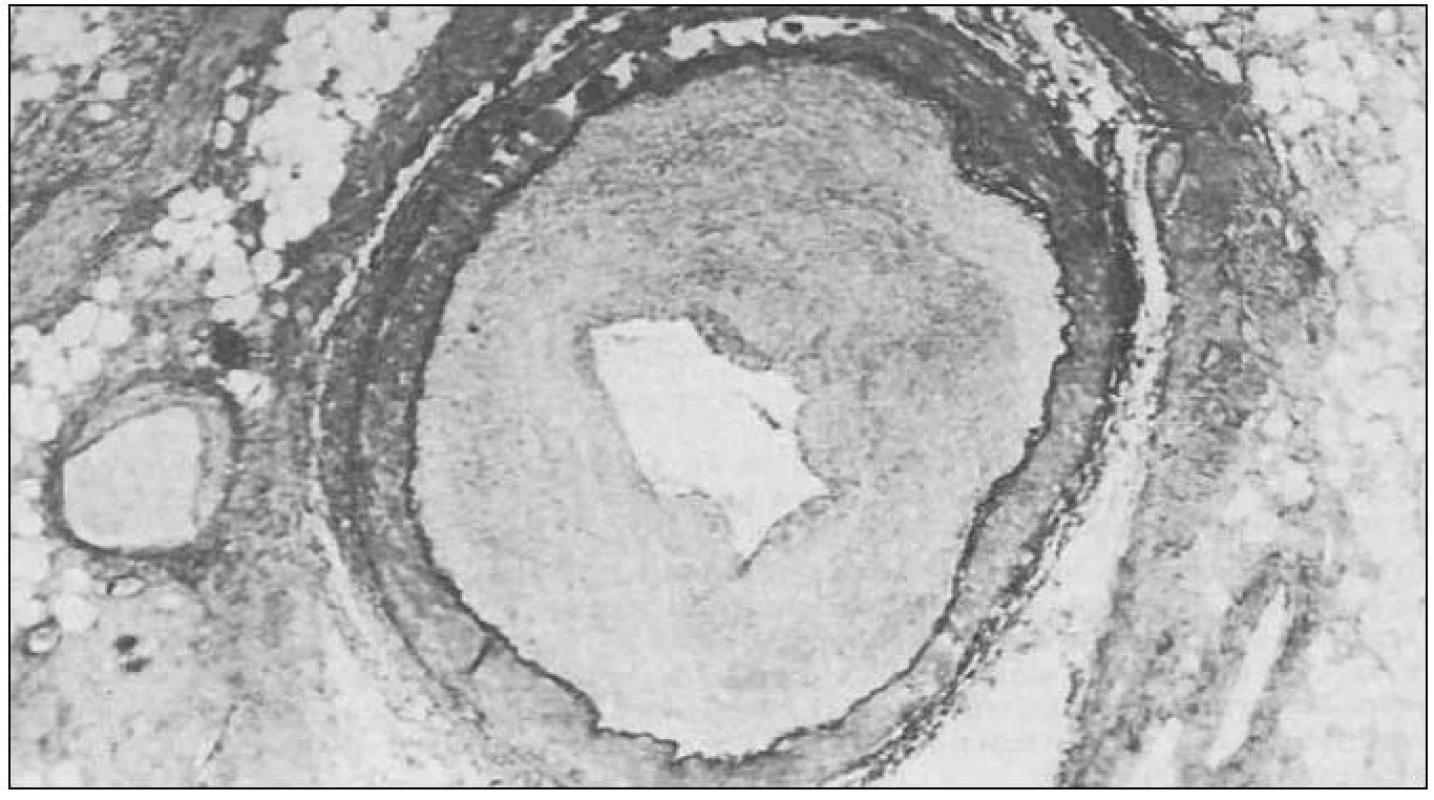
Rozdíly mezi klasickou ischemickou chorobou srdeční a vaskulopatií štěpu ukazuje tab. 5.
Tab. 5. Rozdíly mezi ICHS a vaskulopatií štěpu. 
Léčba je komplikovaná, kromě režimových opatření, z nichž dominuje především nekuřáctví, se doporučuje podávání statinů jako rutinní součást všech imunosupresivních kombinací [18]. Mezi dalšími léky je vhodné podávání antiagregačních léků, kalciových antagonistů a ACE-I. Nadějně se jeví kombinace některých novějších imunosupresiv (MMF, sirolimus), jejichž výhodou je jejich antiproliferativní efekt [8].
Komplikace imunosuprese
Každé imunosupresivum může způsobovat různé nežádoucí účinky. Nežádoucí účinky, jako jsou nefrotoxicita, diabetes mellitus, hypertenze, hyperlipoproteinemie a malignity, přímo ovlivňují dlouhodobé přežívaní pacientů po srdeční transplantaci a přímo souvisí s imunosupresivní medikací. Jiné nežádoucí účinky ovlivňují kvalitu života. Mezi tyto patří např. neurotoxicita, porucha krvetvorby, gastrointestinální a jaterní toxicita, kosmetické změny, efekt na kostní metabolizmus a další [3,14].
Přežívání a kvalita života pacientů po OTS
Po zavedení cyklosporinu A do rutinní imunosupresivní léčby se přežívání pacientů po srdeční transplantaci výrazně zlepšilo. I v dalších letech dochází k určitému zlepšení v přežívání pacientů, především snížením časné mortality po OTS a rozšířením terapeutickým možností ve smyslu výhodnějších imunosupresivních režimů.
V dnešní době se roční přežívání pohybuje kolem 80–85 %, pětileté 70 % a desetileté 50–55 % [19]. Nejčastější příčinou smrti pacientů po OTS jsou infekční komplikace, koronární nemoc štěpu a malignity [22].
Závěr
Srdeční transplantace je v dnešní době zavedenou klinicky užívanou metodou léčby pacientů s těžkým srdečním selháním. Přes stálé zkvalitňování farmakologické či nefarmakologické terapie těžkého srdečního selhání je pro některé pacienty OTS jedinou možností. Transplantační program je stále částečně limitován počtem dárců, takže se někteří pacienti přes všechnu snahu operace nedožijí. Zavedení programu mechanických srdečních podpor je jistě světlem na cestě k OTS u pacientů na urgentní čekací listině s nezadržitelnou progresí srdečního selhání.
Pacienti po transplantaci srdce potřebují celoživotní péči. Dlouhodobý úspěch této léčby pro pacienty závisí nejenom na kvalitní práci transplantačních center, ale také na dobré spolupráci s ošetřujícími kardiology.
Pohled do budoucna se zaměřuje na vývoj nových imunosupresiv, u kterých by byl zachován či zlepšen antirejekční efekt a došlo ke snížení jejich nežádoucích účinků. Celosvětově se stále více stupňuje snaha o nalezení neinvazivní diagnostiky rejekce štěpu, ať již echokardiografickou metodou, stanovením genové exprese či laboratorními metodami, stanovující různé humorální působky.
Práce byla vypracována v rámci Výzkumného záměru MŠMT – MSM0021622402.
MUDr. Petr Hude, Ph.D.
www.fnusa.cz
e-mail: petr.hude@fnusa.cz
Doručeno do redakce: 7. 7. 2009
Zdroje
1. Černý J. Historie srdečních transplantací – krátké zamyšlení. Vnitř Lék 2000; 46 : 741–742.
2. Fabián J, Gonçalvesová E, Štefanková I. Zlyhávanie a transplatácia srdca. Bratislava: Herba 2007.
3. Hegarová M, Málek I. Imunosupresiva po transplantaci srdce. Kardioforum 2005; 3 : 16–21.
4. Hošková L, Málek I, Šedivý J et al. Lékové interakce cyklosporinu A. Cor Vasa 2002; 44 : 481–488.
5. Hude P, Horký M, Krejčí J et al. Apoptosis plays role in cellular rejection after human heart transplantation. Eur J Heart Fail 2004; 3 (Suppl 9).
6. Hunt J, Lerman M, Dewey T et al. Conversion to sirolimus lessens renal dysfunction in heart transplant patients. J Heart Lung Transpl 2004; 23 (Suppl 2): 113.
7. Kobashigawa JA, Katznelson S, Laks H et al. Effect of pravastatin on outcomes after cardiac transplantation. N Engl J Med 1995; 333 : 621–627.
8. Kocík M, Dufková B, Málek I. Koronární nemoc srdečního štěpu. Kardioforum 2005; 3 : 25–28.
9. Kočandrle V, Fabián J, Firt P. Transplantace srdce. Čas Lék Čes 1984; 123 : 1425–1429.
10. Kousalová L, Baranová J, Anzenbacher P. Lékové interakce na úrovni cytochromů P450–CYP3A4. Klin Farmakol Farm 2003; 17 : 151–157.
11. Krejčí J, Hude P, Špinarová L et al. Transplantace srdce – indikace, komplikace, terapie – naše zkušenosti ze sledování 100 pacientů po srdeční transplantaci. Vnitř Lék 2000; 46 : 750–755.
12. Lácha J. Úskalí imunosupresivní léčby. Vnitř Lék 2003; 49 : 430–433.
13. Málek I. Indikace k transplantaci srdce. Cor Vasa 2008; 50 : 129–132.
14. Málek I. Péče o nemocné po transplantaci srdce. Interv Akut Kardiol 2006; 5 : 116–121.
15. Mancini D, Pinney S, Burkhoff D et al. Use of rapamycin slows progression of cardiac transplantation vasculopathy. Circulation 2003; 108 : 48–53.
16. Martínek V, Matoušovic K, Špatenka J. Objev a užití cyklosporinu v klinické praxi. Prakt Lék 2002; 82 : 14–20.
17. Michaels PJ, Espejo ML, Kobashigawa Jet al. Humoral rejection in cardiac transplantation: risk factors, hemodynamic consequences and relationship to transplant coronary artery disease. J Heart Lung Transplant 2003; 22 : 58–69.
18. Rinaldi M, Pellegrini C, Martinelli L et al. FK506 effectiveness in reducing rejection after heart transplantation: a prospective randomised study. J Heart Lung Transplant 1997; 16 : 1001–1010.
19. Špinarová L, Hude P, Krejčí J et al. Vývoj imunosupresivních režimů v průběhu 10 let u pacientů po transplantaci srdce. Sborník abstrakt 6. kongresu České transplantační společnosti, Praha, 14.–16. 10. 2004.
20. Špinarová L, Toman J. Fluvastatin u pacientů po transplantaci srdce. Vnitř Lék 1998; 44 : 13–16.
21. Špinarová L, Toman J. Pharmacotherapy after heart transplantation. Cor Vasa 2000; 42 : 335–340.
22. Špinarová L, Hude P, Krejčí J et al. Osud pacientů přežívajících deset let po transplantaci srdce se zřetelem k výskytu maligního onemocnění. Cor Vasa 2009; 51 : 415–418.
23. Viklický O, Matl I. Rapamycin: nové imunosupresivum schopné potlačit chronickou rejekci? Čas Lék Čes 2001; 140 : 22–25.
24. Vítovec J, Špinar J. Farmakoterapie kardiovaskulárních onemocnění. Praha: Grada Publishing 2004.
25. Vítovec J, Špinarová L. Jaký statin po srdeční transplantaci? Farmakologická teorie a klinická praxe. Cor Vasa 2004; 46 : 463–464.
26. Vymětalová Y, Málek I. Akutní rejekce po transplantaci srdce. Kardioforum 2005; 3 : 12–15.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2009 Číslo 9- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
-
Prof. MUDr. Miloš Štejfa, DrSc., FESC
(*28. 5. 1929) - Zamyšlení nad interno u
- Myokarditidy
- Transplantace srdce
- Kombinační léčba hypertenze blokátory osy renin-angiotenzin
- Hladiny cholesterolu v závislosti na věku
- Echokardiografie u nemocných s ischemickou chorobou srdeční
- Transplantace krvetvorných buněk
- Chronická B-lymfatická leukemie a jí podobné stavy
- Význam autologní transplantace u mnohočetného myelomu
- Jaterní cirhóza a její léčba
- Chirurgická léčba plicní embolie
- Nejčastější chlopenní vady srdce: aortální stenóza a mitrální regurgitace. Několik poznámek ke guidelines a k doporučením kardiologických společností
- Diabetes a vaskulárne poškodenie
- Tako-tsubo kardiomyopatie
- Snížení obsahu soli v potravě – opomíjený postup v prevenci a léčbě hypertenze v populaci
- Léčit, či neléčit nemocné s chronickým srdečním selháním statiny?
- Jak zlepšit odpověď na srdeční resynchronizační léčbu?
- Kontrola kardiovaskulárních rizikových faktorů u diabetiků 2. typu
- Prediabetes – 2009
- Některé současné názory na chronickou ischemickou srdeční chorobu
- Cílové hodnoty léčby hypertenze. Budou platit i u starších hypertoniků, diabetiků a u pacientů s ICHS?
- AT1-blokátory u arteriální hypertenze
- Konsenzuální stanovisko k poskytování paliativní péče u nemocných s nezvratným orgánovým selháním
-
XVI. kongres České internistické společnosti ČLS J. E. Purkyně
Praha, 13.–16. 9. 2009
-
Prof. MUDr. Miloš Štejfa, DrSc., FESC
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Hladiny cholesterolu v závislosti na věku
- Chronická B-lymfatická leukemie a jí podobné stavy
- Jaterní cirhóza a její léčba
- Transplantace krvetvorných buněk
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



