Hyperlipoproteinemie a dyslipoproteinemie I.
Klasifikace, diagnostika, kardiovaskulární, kardiometabolické a reziduální riziko
Hyperlipoproteinaemia and dyslipoproteinaemia I. Classification, diagnostics, cardiovascular, cardiometabolic and residual risk
Cardiovascular diseases remain the most important cause of death worldwide. The situation in the Czech Republic is one of the best when compared to the other countries of the former socialist block; on the other hand, we significantly lack behind when the comparison is made to south and southwest European countries. The concept of risk factors (RF) and multifactorial character of atherosclerosis as the main cause of cardiovascular diseases (CVD) is fully accepted at present. Hyperlipoproteinaemia (HLP) and dyslipidemia (DLP) are a group of high incidence metabolic diseases characterised by increased levels of lipids and lipoproteins in plasma or, in case of DLP, by unsuitable, atherogenic composition of lipids and lipoproteins in plasma. HLP and DLP are among the most important RF for the development of CVD. Mainly LDL‑cholesterol (LDL‑C) is perceived as a very important risk factor; successful reduction of LDL‑C is linked to a reduction in cardiovascular risk. Even when LDL‑C is decreased and the so- called “target values” achieved, patients are still at risk of a CV event. This remnant risk is the so called “residual risk”. The most important “rival” to LDL‑cholesterol among the risk factors is the metabolic syndrome, or rather the DLP associated with the metabolic syndrome, characterised from the perspective of DLP by low levels of HDL‑cholesterol and increased triglycerides with concurrent occurrence of “small dense LDL”. The issue of heterogeneity and atherogenicity of lipoprotein particles in general then becomes topical. Lipoprotein (a) – Lp(a) is another important lipid risk factor that is getting a significant attention.
Key words:
hypercholesterolaemia – LDL‑cholesterol – metabolic syndrome – HDL‑cholesterol – hypertriglyceridaemia – heterogeneity of lipoprotein particles – residual risk – Lp(a)
Autoři:
R. Češka; M. Kvasilová; R. Procházková; G. Šmelková; M. Vráblík
Působiště autorů:
Centrum preventivní kardiologie III. interní kliniky 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise:
Vnitř Lék 2010; 56(6): 526-531
Kategorie:
65. narozeniny vedoucího redaktora
časopisu Vnitřní lékařství prim. MUDr. Petra Svačiny
Souhrn
Kardiovaskulární onemocnění představují stále nejvýznamnější příčinu úmrtnosti v celém světě. Situace v naší zemi je sice jedna z nejlepších, pokud jde o srovnání se zeměmi dřívějšího socialistického bloku, na druhé straně ve srovnání zejména se zeměmi jižní a jihozápadní Evropy výrazně zaostáváme. V současné době je plně akceptována koncepce rizikových faktorů (RF) a multifaktoriální podmíněnosti aterosklerózy jako základní příčiny kardiovaskulárních onemocnění (KVO). Hyperlipoproteinemie (HLP) a dyslipidemie (DLP) představují skupinu metabolických onemocnění hromadného výskytu, která jsou charakterizována zvýšenou hladinou lipidů a lipoproteinů v plazmě, nebo, v případě DLP, nevhodným aterogenním složením lipidů a lipoproteinů v plazmě. Význam HLP a DLP spočívá v tom, že představují jeden z nejvýznamnějších RF pro rozvoj KVO. Za velmi významný rizikový faktor je považován především LDL‑cholesterol (LDL‑C), jeho úspěšné snížení je pak spojováno s poklesem kardiovaskulárního rizika. I po snížení LDL‑C a dosažení tzv. „cílových hodnot“ však zůstává u nemocných významné riziko, že dostanou KV příhodu. Toto „zbytkové riziko“ je nazýváno reziduálním rizikem. Největším „rivalem“ LDL‑cholesterolu je mezi rizikovými faktory metabolický syndrom, resp. DLP u metabolického syndromu, charakterizovaná z hlediska DLP nízkým HDL‑cholesterolem a zvýšenými triglyceridy za současného zvýšeného výskytu „malých denzních LDL“. Do popředí se pak dostává i problematika heterogenity a aterogenicity lipoproteinových částic obecně. Dalším významným lipidovým rizikovým faktorem, kterému je věnována velká pozornost, je lipoprotein (a) – Lp(a).
Klíčová slova:
hypercholesterolemie – LDL‑cholesterol – metabolický syndrom – HDL‑cholesterol – hypertriglyceridemie – heterogenita lipoproteinových částic – reziduální riziko – Lp(a)
Úvod
Problematika hyperlipoproteinemie (HLP) a dyslipidemie (DLP) se v posledních letech stala z libůstky podivínů, zabývajících se metabolickými abnormalitami, zcela běžnou, obecně akceptovanou součástí prevence i léčby ischemické choroby srdeční (ICHS) a dalších manifestací aterosklerózy. Odborným podkladem pro tuto změnu pohledu jsou výsledky nejen epidemiologických, ale především intervenčních studií. Kromě snahy o snížení LDL‑cholesterolu (LDL‑C) a celkového cholesterolu (TC) je nyní kladen důraz na ovlivnění hladiny HDL‑cholesterolu (HDL‑C), jehož zvýšení je považováno za významný pozitivní krok v prevenci aterosklerózy a léčbu zvýšených hladin triglyceridů (TG). Především je pak v současnosti zdůrazňován komplexní přístup k nemocnému ve vztahu k jeho celkovému riziku. Novou, někdy samostatně probíranou jednotkou, je DLP u metabolického syndromu (MS), která je zdrojem tzv. reziduálního rizika.
Hyperlipoproteinemie a dyslipoproteinemie
HLP a DLP představují skupinu metabolických onemocnění hromadného výskytu, která jsou charakterizována zvýšenou hladinou lipidů a lipoproteinů v plazmě, nebo, v případě DLP, nevhodným, aterogenním poměrem jednotlivých lipidů a lipoproteinů v plazmě. Jsou důsledkem zvýšené syntézy nebo sníženého katabolizmu lipoproteinových částic, které transportují tuky [cholesterol (CH), triglyceridy (TG), fosfolipidy, mastné kyseliny] v plazmě. Dovolíme si používat oba termíny – HLP a DLP – bez preference, protože dosud neexistuje terminologická jednota.
HLP jsou buď primární, geneticky podmíněné, kterých je většina, nebo sekundární, kdy jsou průvodním znakem jiného, základního onemocnění (např. hypotyreózy, nefrotického syndromu, diabetes mellitus) a dalších.
Při pohledu na tuto schematickou klasifikaci se každému asi vnucuje otázka podílu faktorů zevního prostředí, které tato klasifikace, alespoň na první pohled, pomíjí. Nechceme v tomto článku rozvíjet diskuze o vhodnosti té či oné klasifikace, ale s ohledem na to, že je to významné pro praxi, dovolíme si jednu poznámku. Další skupinu by měly tvořit HLP a DLP smíšené etiologie, s jistým podílem vrozené vlohy, která by se ale u štíhlého sportovce nemanifestovala poruchou tukového metabolizmu. U člověka, který však žije nezdravým životním stylem, povede k vzestupu hladin lipidů a v důsledku k výraznému zvýšení kardiovaskulárního rizika.
Význam HLP a DLP spočívá v tom, že stojí v pozadí, často po dlouhá léta zcela bez příznaků, jako rizikové faktory řady onemocnění, z nichž za nejzávažnější a někdy fatální jsou považovány předčasná ateroskleróza (především koronární, manifestující se různými formami ICHS, ale i ateroskleróza periferních tepen a karotid) a akutní pankreatitida.
Klasifikace HLP a DLP
HLP je možno rozdělovat podle řady hledisek a kritérií. Nejjednodušším, praktickým a užitečným rozdělením je klasifikace dle doporučení EAS. Ta dělí HLP do 3 skupin:
I. Hypercholesterolemie
II. Kombinované (smíšené) hyperlipidemie
III. Hypertriglyceridemie
Podle výše uvedeného dělení uveďme alespoň několik základních zástupců geneticky podmíněných HLP a v tabulce pak přehledně HLP sekundární.
Geneticky podmíněné HLP
Současné znalosti především z oblasti molekulární biologie umožňují dnes poměrně přesnou identifikaci genetického defektu, zodpovědného za konkrétní metabolickou poruchu a přesnou klasifikaci HLP. I z praktického hlediska a pro pochopení účinku některých hypolipidemik je vhodné uvést několik geneticky podmíněných HLP, u kterých je metabolický defekt přesně určen.
Familiární hypercholesterolemie (FH)
FH je autozomálně dominantně přenášeným onemocněním, jehož příčinou je porucha funkce (snížení počtu) LDL receptorů. Postižení jedinci buď netvoří žádné LDL receptory, nebo je tvoří normálně, receptory však nejsou transportovány na povrch buňky a nemohou se funkčně uplatnit. Další možnou poruchou je porucha vazby LDL receptoru na lipoproteinovou částici a konečně může váznout internalizace.
FH se vyskytuje ve 2 formách, raritní homozygotní (ve frekvenci 1 : 1 000 000), nebo heterozygotní, která je podstatně častější a vyskytuje se ve frekvenci 1 : 500.
Typickým laboratorním nálezem při FH je izolované zvýšení hladiny CH v plazmě při normální nebo jen hraničně zvýšené koncentraci TG. CH se pohybuje u dospělých heterozygotů v průměrných hodnotách 7– 10 mmol/ l, výjimkou však není ani nález CH 15 mmol/ l nebo vyšší! Hladiny CH u homozygotů se obvykle pohybují v rozmezí 15– 30 mmol/ l.
Stejně jako laboratorní odlišuje se i klinický obraz homozygotní a heterozygotní formy FH.
Homozygoti jsou těžce postiženi již od dětství. ICHS se u nich manifestuje v útlém dětství a většina z nich umírá na AIM do 20 let (výjimkou není AIM ani ve věku do 10 let). Klinicky zjevným projevem homozygotní formy FH je přítomnost šlachových i kožních xantomů v dětském věku.
Heterozygoti FH nemusí mít po dlouhá léta žádné zjevné příznaky choroby. Klinicky se u nich manifestuje ve věku okolo 30 let arcus senilis corneae, xanthelasma palpebrarum nebo šlachová xantomatóza. K nejzávažnějším projevům manifestace FH patří výskyt ICHS ve věku 30– 50 let. K akceleraci aterosklerózy dochází nejen na koronárním řečišti, ale i na velkých tepnách dolních končetin a na karotidách.
Terapie FH je obtížná. Pacienti reagují na dietní opatření poklesem CH pouze o 5 %, maximálně o 10 %. Většina nemocných je proto kandidátem farmakoterapie, včetně vysokého procenta pacientů v dětském věku. V léčbě používáme vyšší dávky statinů, často v kombinaci s pryskyřicí. Těžká familiární hypercholesterolemie je indikována k léčbě LDL‑aferézou.
Familiární defekt apo B- 100 (FDB)
FDB je nedávno objevené onemocnění, které je prakticky zrcadlovým obrazem FH. Je způsobeno záměnou jediné aminokyseliny v molekule apo B‑ 100, která vede k neschopnosti vázat LDL částici na LDL receptor. Důsledkem je hromadění LDL a zvýšená koncentrace celkového i LDL‑CH. Klinický obraz FDB je velmi podobný klinickému obrazu FH včetně xantomatózy a především časné manifestace aterosklerózy. Rovněž léčba je prakticky stejná jako u FH, i když se na počátku studia tohoto onemocnění obávali nedostatečného efektu léčby statiny.
Polygenní hypercholesterolemie
Koncentrace plazmatického CH je ovlivňována řadou genů a navíc i faktory zevního prostředí. Kombinace nepříznivých genetických i zevních faktorů vede k mírné hypercholesterolemii do 8 mmol/ l. Nelze podat jednoznačný klinický obraz tohoto onemocnění, je však jistě spojeno s vyšším výskytem ICHS. V terapii tohoto onemocnění jsou indikovány na prvém místě statiny, event. pryskyřice.
Familiární kombinovaná hyperlipidemie (FKH)
FKH představuje nejčastější geneticky determinovanou poruchu metabolizmu lipidů (výskyt 1 : 50– 1 : 100).
Tato choroba je definována jako dědičná nemoc, projevující se zvýšenou hladinou CH a/ nebo TG. U členů rodiny můžeme prokázat různé lipoproteinové fenotypy. Obvyklým nálezem je zvýšení koncentrace LDL a VLDL v plazmě a zvýšení hladiny apolipoproteinu B.
Příčinou FKH je pravděpodobně především abnormálně vysoká syntéza apolipoproteinu B v játrech provázená zvýšenou produkcí VLDL a vznik tzv. „malých denzních“, aterogenních LDL.
Z klinického hlediska je podstatné to, že FKH je velmi častou příčinou ICHS. Nejméně 10 % nemocných, kteří prodělají AIM do 60 let, má FKH.
V léčbě FKH po terapii dietní následuje léčba, kterou řídíme podle převládajícího typu metabolické odchylky. Při převažující zvýšené koncentraci triglyceridů nebo snížení HDL‑CH podáme fibráty, při převažující elevaci LDL‑CH a nižší koncentraci TG statiny. U těžší poruchy je plně indikována kombinace statin a fibrát.
Familiární dysbetalipoproteinemie (HLP typ III)
HLP typ III je vrozenou poruchou metabolizmu lipoproteinů, charakterizovanou vysokou hladinou CH i TG. Podkladem tohoto onemocnění je defekt genu pro apolipoprotein E. Apo E je zodpovědný za receptory zprostředkovanou clearence lipoproteinových částic bohatých na TG.
Nejzávažnější klinickou komplikací HLP typu III je předčasná ateroskleróza, která postihuje spíše tepny periferní, nevyhýbá se však ani koronárnímu řečišti. Nemocní s tímto typem hyperlipoproteinemie mohou být postiženi prakticky všemi typy xantomatózy. Léčbu začínáme přísnou dietou, z medikamentů jsou na prvém místě fibráty. Není‑li léčba dostatečně efektivní, přidáme k fibrátu statin.
Familiární hyperlipoproteinemie typ I
Pod pojmem hyperlipoproteinemie typu I se skrývají nejméně 2 metabolické poruchy.
Deficit lipoproteinové lipázy nebo deficit apo C II, který je kofaktorem nutným k aktivaci tohoto enzymu.
Obě tyto metabolické poruchy se projevují hyperchylomikronemií. Sérum odebrané nalačno je vždy chylózní a po 24hodinovém stání v lednici při teplotě 4 °C se vytvoří na povrchu séra silná chylomikronová vrstva, tvořící 20– 50 % výšky sloupce.
V klinickém obraze dominuje nález abdominálních kolik, u vysokého procenta nemocných lze prokázat pankreatitidu.
Familiární hypertriglyceridemie (FHTG)
FHTG je autozomálně dominantně přenášené onemocnění, které se v populaci vyskytuje v poměrně vysokém procentu (0,2– 0,3 % populace).
V rodinách probandů s FHTG je 2krát vyšší úmrtnost na AIM než v normolipidemické populaci. Rovněž výskyt ICHDK je u nemocných s FHTG vyšší a odhaduje se na 5 %.
Při terapii FHTG je nutná především dietní léčba. Kromě omezení tuků je nezbytná i restrikce sacharidů, nutný je přísný zákaz alkoholu včetně piva. Z hypolipidemik jsou lékem volby fibráty.
Sekundární hyperlipoproteinemie
Sekundární hyperlipoproteinemie vznikají jako důsledek určitého základního onemocnění, které alteruje metabolizmus lipidů a lipoproteinů. Po kompenzaci základního onemocnění dochází ke kompenzaci HLP. Pozor! Některé sekundární HLP, stejně jako primární HLP jsou onemocnění častá. Mohou se vyskytovat současně a „sekundární“ je jen zhoršení průběhu. Často léčíme např. hypotyreózu, po dosažení eutyreózního stavu se lipidy zlepší, ale k normálu mají stále daleko a je třeba intenzivní hypolipidemické léčby! Sekundární hyperlipoproteinemie jsou vyjmenovány v tab. 1.

Biochemické vyšetření u HLP a DLP
K přesnému stanovení diagnózy HLP/ /DLP je nutné provést alespoň na počátku opakované vyšetření alespoň ze 2 odběrů krve, v intervalu 1– 8 týdnů.
Žilní krev musí být odebrána bez dlouhé venostázy po 5– 10 min v klidu, vsedě po 14hodinovém lačnění.
Pozor! U nemocných s infarktem myo-kardu lze výsledky považovat za validní do 24 hod od počátku stenokardie. Jinak lze další vyšetření provést minimálně po 6, ale optimálně po 12 týdnech od infarktu. Hodnoty LDL‑CH i celkového CH po IM významně klesají! Velký význam rovněž nemá vyšetření parametrů lipidového metabolizmu v období probíhajícího interkurentního onemocnění (např. při vyšetření nemocného, který se dostavil na vyšetření pro febrilní onemocnění, virózu apod.).
U nemocných stanovujeme celkový a HDL‑CH, triglyceridy. Dále se vypočítá LDL‑CH podle Friedewaldovy rovnice. Výpočet LDL‑CH lze provést pouze tehdy, nepřesahuje‑li koncentrace TG 4,5 mmol/ l. V současné době je již dostupné (metodicky i finančně) přímé stanovení LDL‑CH, které je významně přesnější než dosud doporučovaný výpočet dle Friedewalda. Dále lze vypočítat aterogenní index, poměr celkového a HDL‑CH. Levným parametrem je tzv. non HDL‑cholesterol, který vypočteme odečtem LDL‑CH od celkového CH. Vyšetření apo B, apo A‑ I nebo Lp(a) jistě zpřesní riziko a má být dostupné ve specializovaném centru, pro běžnou klinickou praxi však není nezbytné – některé podrobnosti viz níže.
Naopak je vhodné, aby u nemocného s diagnostikovanou HLP bylo provedeno vyšetření TSH, glykemie a zejména před zahájením farmakoterapie vyšetření CK a enzymů jaterního souboru.
Vyšetření krevních lipidů metodami suché chemie je možno použít pouze jako orientační screeningové vyšetření a není možné z něho vycházet při stanovování rizika ani při rozhodování o léčbě nemocných s HLP.
Lipidy jako RF kardiovaskulárních onemocnění
Význam DLP a HLP spočívá především v tom, že jsou významnými rizikovými faktory kardiovaskulárních onemocnění. O dominantním DLP postavení mezi rizikovými faktory svědčí výsledek INTERHEART study (obr. 1).
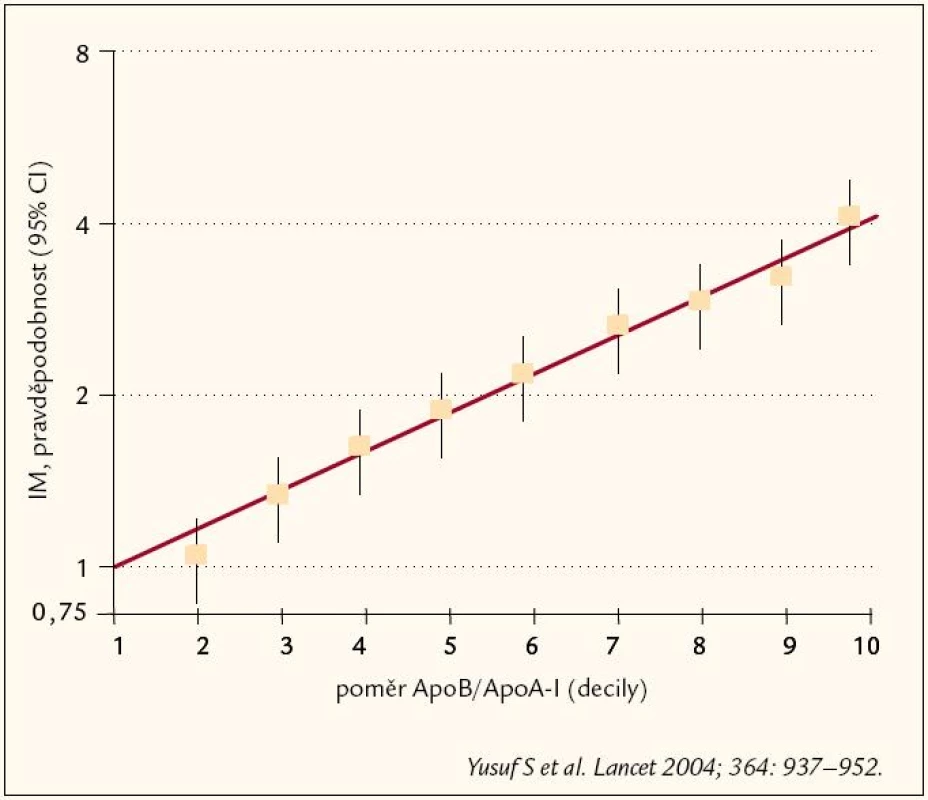
Tato studie zasadila velkou ránu stálým „hledačům“ nových, zajímavých rizikových faktorů. Přes 90 % KV příhod je totiž možno predikovat na základě těch klasických, všem známých rizikových faktorů, DLP, hypertenze, diabetes mellitus a kouření cigaret. Přitom právě DLP hrála zcela dominantní úlohu. I když byla v INTERHEART studii HLP reprezentována poměrem ApoB/ ApoAI (který bychom mohli pro srozumitelnost přeložit jako poměr LDL/ HDL), je stále považován za základní lipidový rizikový faktor LDL‑cholesterol. Se zvýšením LDL‑C se setkáváme u FH – familiární hypercholesterolemie, ale i u dalších poruch tukového metabolizmu.
Reziduální kardiovaskulární riziko
Bohužel, i po dosažení cílové hodnoty LDL‑C mnoho nemocných prodělá KV příhodu. A právě proto, že u pacientů přetrvává stále navzdory léčbě KV riziko, vznikl koncept reziduálního rizika a současně i snaha o jeho redukci. Reziduální KV riziko je definováno jako KV riziko, které zůstává po léčbě statiny a dosažení cílové hodnoty LDL‑C.
Zdrojem reziduálního rizika jsou samozřejmě další, neovlivněné rizikové faktory (hypertenze, diabetes, kouření cigaret atd.), ale i HLP a DLP – zejména jejich neovlivněné, nebo nedostatečně ovlivněné složky. Jedná se především o patologické koncentrace HDL‑C a triglyceridů. Z hlediska nemocných s obezitou, především centrálního typu, stejně jako z hlediska nemocných s metabolickým syndromem, je důležitý fakt, že právě u nich se typicky vyskytuje „diabetická“ DLP, charakterizovaná nízkou hladinou HDL‑C a zvýšenými hladinami triglyceridů, navíc pak i změnou kvality lipoproteinových částic (ve prospěch malých denzních LDL, ale i aterogenních malých denzních HDL částic).
Redukce reziduálního rizika se dostává v současné době mezi nejdůležitější úkoly v preventivní kardiologii, především pak právě u nemocných s metabolickým syndromem, abdominální obezitou a diabetes mellitus 2. typu. V souvislosti s redukcí i významem reziduálního rizika je stále více diskutována otázka variability lipoproteinových částic.
Variabilita a heterogenita lipoproteinových částic („Small dense LDL/ HDL particles“)
V posledních letech je věnována velká pozornost variabilitě lipoproteinových částic, které netvoří zcela homogenní skupinu, ale liší se především svou velikostí a denzitou (obr. 2).
Do popředí zájmu se dostávají „malédenzní (nedokázali jsme se smířit s českým překladem husté) částice LDL“. Jak je uvedeno výše, právě zvýšený výskyt malých denzních částic je typický u nemocných s metabolickým syndromem.
Velké částice označované LDL‑I mají velikost 26– 27,5 nm a denzitu 1,02– 1,03 kg/ l.
Intermediární LDL částice označované jako LDL‑II mají velikost 25– 26 nm a denzitu 1,03– 1,04 kg/ l.
Malé denzní („small dense“) částice, tzv. LDL‑III, jsou menší než 25 nm a mají denzitu 1,04– 1,06 kg/ l. Právě tyto částice mají velký aterogenní potenciál.
Vyšší riziko ICHS je u DLP při metabolickém syndromu spojováno se zvýšením sérové koncentrace apolipoproteinu B a snížením hladiny apolipoproteinu A‑ I.
Je třeba si ale také uvědomit, že nejen malé denzní LDL částice představují zvýšené KV riziko. Rizikové jsou i vyšší koncentrace malých denzních HDL. Tyto částice nemají obvyklý protektivní charakter, jsou afunkční nebo dysfunkční z hlediska reverzního transportu cholesterolu a v konečném důsledku jsou aterogenní.
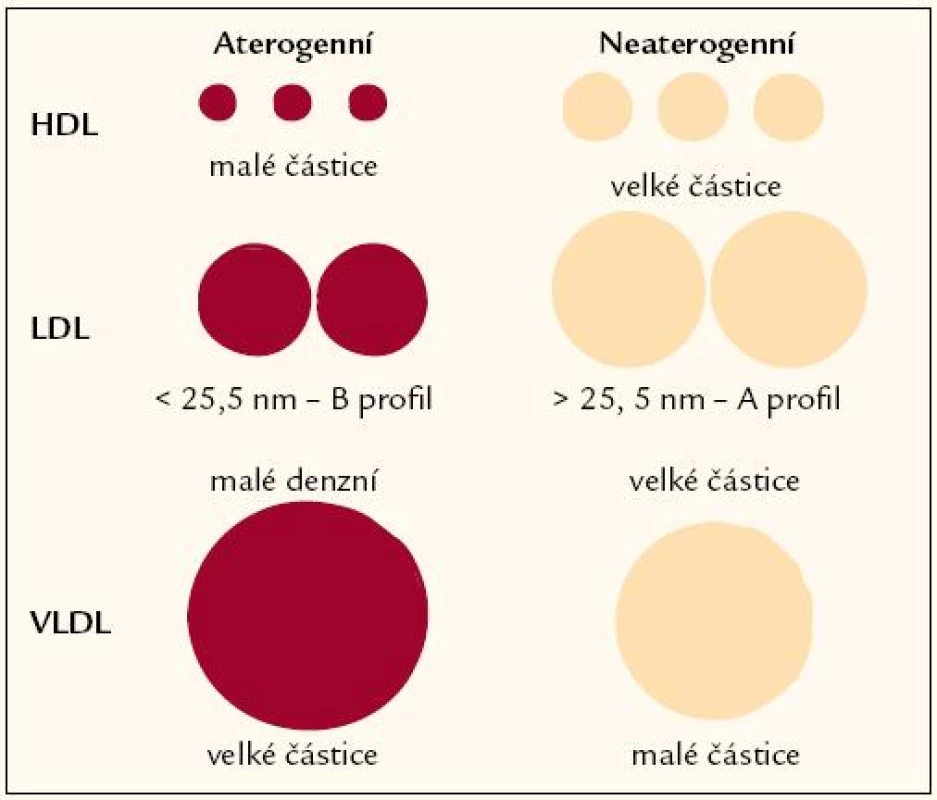
Aterogenitu jednotlivých lipoproteinových tříd znázorňuje obr. 3.
Lipoprotein(a)
Mezi nové, tzv. „emerging“ RF, je často zařazován lipoprotein(a), resp. správněji jeho bílkovinná složka apolipoprotein(a). Zvýšený zájem o Lp(a) přinesl průkaz, že zvýšené koncentrace tohoto lipoproteinu v plazmě představují samostatný, na ostatních parametrech lipidového a lipoproteinového metabolizmu zcela nezávislý rizikový faktor pro rozvoj ICHS. Pravděpodobným vysvětlením jeho nepříznivého vlivu je jeho účinek na koagulaci. Molekula Lp(a) je částečně homologní s plazminogenem, kompetuje s ním o receptors následným snížením fibrinolytické aktivity. Na druhé straně však lze Lp(a) také prokázat v aterosklerotických lézích. Aterogenita (i hladina) Lp(a) pravděpodobně souvisí s polymorfizmem v genu pro tento lipoprotein. I když názory na Lp(a) se vyvíjejí, velmi přesvědčivé výsledky u více než 6 000 osob publikované v prosinci roku 2009 v NEJM obrátily k tomuto lipoproteinu znovu pozornost.
Dovolíme si jen připomenout, že v tehdejším Československu stanovoval Šobra semikvantitativně Lp(a) již před 30 lety při ELFO lipoproteidů (obr. 4).

Samozřejmě, že v současné době měříme Lp(a) přesně a kvantitativně.
Ve druhé části článku věnovaného problematice HLP a DLP se pokusíme shrnout současné názory na možnosti ovlivnění a léčby těchto metabolických poruch.
Práce byla podpořena granty IGA MZ ČR č10589- 3, 10579- 3 a záměrem MŠMT 0021620807.
prof. MU Dr. Richard Češka, CSc.
www.vfn.cz
e‑mail: richard.ceska@vfn.cz
Doručeno do redakce: 19. 5. 2010
Zdroje
1. Kastelein JJ, van Leuven SI, Burgess L et al. Effect of torcetrapib on carotid atherosclerosis in familial hypercholesterolemia. N Engl J Med 2007; 356: 1620– 1630.
2. Mazzone T. HDL cholesterol and atherosclerosis. Lancet 2007; 370: 107– 108.
3. Clarke R, Peden JF, Hopewell JC et al. Genetic variants associated with Lp(a) lipoprotein level and coronary disease. N Engl J Med 2009; 361: 2518– 2528.
4. ADA, NHLBI, AHA et al. Diabetes mellitus: A major risk factor for cardiovascular disease. Circulation 1999; 100: 1132– 1133.
5. O’Keefe JH Jr, Miles JM, Harris WH et al. Improving the adverse cardiovascular prognosis of type 2 diabetes. Mayo Clin Proc 1999; 74: 171– 180.
6. Češka R. Cholesterol a ateroskleróza. Léčba dyslipidémií. Praha: Triton 2005.
7. Shepherd J. Combined lipid lowering drug therapy for the effective treatment of hypercholesterolemia. Eur Heart J 2003; 24: 685– 689.
8. Brousseau ME, Schaefer EJ, Wolfe ML et al. Effects of an inhibitor of cholesteryl ester transfer protein in HDL cholesterol. N Engl J Med 2004; 350: 1505– 1515.
9. Mazzone T. HDL cholesterol and atherosclerosis. Lancet 2007; 370: 107– 108.
10. Qin S, Koga T, Ganji SH et al. Rosuvastatin selectively stimulates apolipoprotein A‑ I but not apolipoprotein A‑ II synthesis in Hep G2 cells. Metabolism 2008; 57: 973– 979.
11. Ballantyne C, Raichlen JS, Nicholls SJ et al. Effect of rosuvastatin therapy on coronary artery stenoses assessed by quantitative coronary angiography: a study to evaluate the effect of rosuvastatin on intravascular ultrasound‑ derived coronary atheroma burden. Circulation 2008; 117: 2458– 2466.12. Robins SJ, Collins D, Wittes JT et al. Relation of gemfibrozil treatment and lipid levels with major coronary events. VA‑ HIT: a randomized controlled trial. JAMA 2001; 285: 1585– 1591.
13. Jones PH, Davidson MH, Stein EA et al. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin and pravastatin across doses (STELLAR Trial). Am J Cardiol 2003; 93: 152– 160.
14. Law MR, Wald NJ, Rudnicka AR. Quantifying effect of statins on low density lipoprotein cholesterol, ischaemic heart disease and stroke: systematic review and meta‑analysis. BMJ 2003; 326: 1423.
15. Sacks FM. Low‑ density lipoprotein lowering therapy: an analysis of the options. J Am Coll Cardiol 2002; 40: 2135– 2138.
16. Shepherd J. Combined lipid lowering drug therapy for the effective treatment of hypercholesterolemia. Eur Heart J 2003; 24: 685– 689.
17. Davidson MH, McGarry T, Bettis R et al. Ezetimibe coadministered with simvastatin in patients with primary hypercholesterolemia. J Am Coll Cardiol 2002; 40: 2125– 2134.
18. Keating GM, Robinson DM. Rosuvastatin: a review of its effect on atherosclerosis. Am J Cardiovasc Drugs 2008; 8: 127– 146.
19. Fruchart JC, Sacks F, Hermans MP et al. Residual Risk Reduction Initiative (R3i). The Residual Risk Reduction Initiative: a call to action to reduce residual vascular risk in patients with dyslipidemia. Am J Cardiol 2008; 102 (Suppl 10): 1K– 34K.
20. Fruchart JC, Sacks F, Hermans MP et al. Residual Risk Reduction Initiative (R3i). The Residual Risk Reduction Initiative: a call to action to reduce residual vascular risk in dyslipidaemic patient. Diab Vasc Dis Res 2008; 5: 319– 325.
Štítky
Diabetológia Endokrinológia Interné lekárstvoČlánok vyšiel v časopise
Vnitřní lékařství

2010 Číslo 6
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Role praktického lékaře v péči o pacienta s familiární hypercholesterolémií
- Nech brouka žít… Ať žije astma!
Najčítanejšie v tomto čísle
- Sepse a septický šok u onkologických a imunokompromitovaných pacientů – diagnostika, terapie
-
Hyperlipoproteinemie a dyslipoproteinemie I.
Klasifikace, diagnostika, kardiovaskulární, kardiometabolické a reziduální riziko - Esenciální trombocytemie a jiné myeloproliferace s trombocytemií léčené Thromboreductinem. Výstupy z databáze Registru k 1. čtvrtletí roku 2010
- Odlišné průběhy recidivující anebo multisystémové formy histiocytózy z Langerhansových buněk u dospělých osob – popis 22 případů z jednoho pracoviště
