-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Přínos celotělové magnetické rezonance v diagnostice monoklonální gamapatie nejistého významu, mnohočetného myelomu a stanovení stadia pokročilosti nemoci s pomocí systému Durie‑ Salmon Plus
Contribution of whole ‑ body magnetic resonance in the diagnostics of monoclonal gammopathy of undetermined significance, multiple myeloma, and the assessment of Durie ‑ Salmon Plus staging system
Background:
The aim of the study was to assess the contribution of the whole body MRI (WB ‑ MRI) in the diagnostics of monoclonal gammopathy of undetermined significance (MGUS) and initial, asymptomatic form of multiple myeloma (MM), as well as the evaluation of practical usefulness of the Durie ‑ Salmon Plus staging system (D‑S Plus).Materials and methods:
The analyzed 86 - patient cohort consisted of 28 patients with MGUS and 54 patients with newly diagnosed multiple myeloma and 4 patients with solitary plasmocytoma (SP). WB ‑ MRI was evaluated using Magnetom Avanto 1.5 T with the use of virtual whole body coil with sequential acquisition on 7 levels and 2 sequentions – T2 STIR and T1. Based on the number of lesions and the degree of diffuse involvement we assessed the D‑S Plus stage, and compared it to the results of standard staging systems according to Durie Salmon (D‑S) and International Staging System (ISS). Statistical estimation was done using the Cohen κ test and McNemara‑Bowker test at p < 0.05.Results:
In the group of 28 individuals with MGUS, there were 17 (61%) patients fulfilling the IMWG criteria and/ or WB ‑ MRI criteria of incipient MM. In 4/ 17 (23%) patients we described a more advanced stage when comparing D‑S Plus to D‑S. Nine out of fourteen (64%) patients with MGUS transforming into MM with negative radiological assessment had positive findings on WB ‑ MRI. The character of WB ‑ MRI findings lead in 9/ 17 (53%) of the patients to the initiation of induction treatment. Stratification according to D‑S Plus divided the 54 newly diagnosed patients with MM into stage 1 (16.7%), stage 2 (33.3%) and stage 3 (50%). In 22 % there was a shift into a higher stage using DS ‑ Plus in comparison with D‑S, in 9% of the patients the shift lead to downstaging. When comparing the results of ISS vs D‑S Plus we found that the system based on WB ‑ MRI showed in 41% of the patients higher stage and only in 9% of the patients lower stage. In 13% of MM patients we described extramedulary masses of the tumor, especially in paraspinal region. In 1 of the 4 SP patients the WB ‑ MRI changed the diagnosis into multifocal plasmocytoma.Conclusion:
WB ‑ MRI is a very contributive imaging method with substantially higher resolution than conventional radiography. It is able to evaluate the grade and the extent of myeloma bone disease. It improves the diagnostic approach in the differentiation of stable MGUS from the phase of malignant transformation into MM. The D‑S Plus system proved to be contributive and is competent to become a routine part of diagnostic and stratification algorithms in MGUS and MM.Key words:
monoclonal gammopathy of undetermined significance – multiple myeloma – whole - body MRI – Durie ‑ Salmon Plus – Durie Salmon Staging System – International Staging System
Autoři: V. Ščudla 1; M. Heřman 2; J. Minařík 1; T. Pika 1; J. Hrbek 2; J. Bačovský 1; V. Heinzová 3
Působiště autorů: III. interní klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MU Dr. Vlastimil Ščudla, CSc. 1; Radiologická klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MU Dr. Miroslav Heřman, Ph. D. 2; Hematologické a transfuzní oddělení Slezské nemocnice Opava, přednostka prim. MU Dr. Dagmar Adamová 3
Vyšlo v časopise: Vnitř Lék 2011; 57(1): 52-60
Kategorie: Původní práce
Souhrn
Východiska:
Náplní studie bylo posouzení přínosu celotělové formy magnetické rezonance (WB ‑ MRI) v diagnostice monoklonální gamapatie nejistého významu (MGUS) v odlišení od iniciální, asymptomatické formy mnohočetného myelomu (MM) a ověření praktického přínosu stážovacího systému Durie ‑ Salmon PLUS (D‑S Plus) u MM.Materiál a metody:
Analyzovaný 86členný soubor sestával z 28 jedinců s MGUS a z 54 nemocných s nepředléčenou formou MM vyšetřených při rozpoznání nemoci a ze 4 pacientů se solitární formou plazmocytomu (SP). WB ‑ MRI vyšetření bylo prováděno na přístroji Magnetom Avanto 1,5 T s pomocí virtuální celotělové maticové cívky s postupnou akvizicí v 7 etážích a ve 2 sekvencích – T2 STIR a T1. Na základě počtu ložisek a stupně difuzních změn bylo určeno stadium pokročilosti nemoci podle klasifikace D‑S Plus a srovnáno s výsledky standardních stážovacích systémů dle Durieho‑Salmona (D‑S) a International Staging System (ISS). Statistické šetření bylo provedeno s pomocí koeficientu Cohenovo κ a McNemarova ‑ Bowkerova testu rozdílnosti s hranicí významnosti p < 0,05.Výsledky:
Ze souboru 28 jedinců s MGUS byla u 17 (61 %) splněna IMWG (International Myeloma Working Group) a/ nebo WB ‑ MRI kritéria přechodu v MM, přičemž u 4/ 17 (23 %) jedinců bylo zaznamenáno při použití stratifikačního systému D‑S Plus vyšší stadium nežli podle D‑S. Devět ze 14 (64 %) jedinců s MGUS v transformaci v MM s negativitou radiografického vyšetření skeletu mělo pozitivní obraz při použití WB ‑ MRI. Charakter zjištěných WB ‑ MRI změn vedl u 9/ 17 (53 %) nemocných s takto diagnostikovaným MM k zahájení indukční chemoterapie. Stratifikace dle D‑S Plus rozčlenila 54 doposud neléčených nemocných s MM do stadia 1 (17 %), stadia 2 (33 %) a stadia 3 (50 %), přičemž u 22 % došlo při srovnání se systémem D‑S při použití D‑S Plus k posunu do vyššího stadia nemoci, u 9 % ale naopak k zařazení do stadia nižšího. Při srovnání výsledků ISS vs D‑S Plus bylo zjištěno, že posléze jmenovaný systém, založený na WB ‑ MRI, vedl u 41 % nemocných k zařazení do vyššího stadia a pouze u 9 % pacientů do nižšího stadia. U 13 % nemocných s MM bylo s pomocí WB ‑ MRI rozpoznáno extramedulární, především paraspinální šíření myelomového procesu. Ze 4 nemocných s diagnózou SP byla u 1 nemocného rozpoznána s pomocí WB ‑ MRI multifokální forma plazmocytomu.Závěr:
WB ‑ MRI je vysoce přínosná zobrazovací metoda s podstatně vyšší citlivostí, nežli poskytuje konvenční radiografie skeletu, umožňující citlivé zhodnocení tíže a rozsahu myelomové kostní nemoci. Významně zpřesňuje diagnostické možnosti v odlišení stabilní formy MGUS od fáze její maligní transformace v MM. Stratifikační režim dle D‑S Plus se prakticky osvědčil a má slibný potenciál k začlenění do standardního algoritmu diagnostických a stratifikačních metod používaných u MGUS a MM.Klíčová slova:
monoklonální gamapatie nejistého původu – mnohočetný myelom – celotělová MRI – Durie ‑ Salmon Plus – stážovací systém dle Durieho‑Salmona – International Staging SystemÚvod
Mnohočetný myelom (MM) je plazmocelulární neoplazie, způsobená monoklonální proliferací a akumulací myelomových elementů v kostní dřeni (KD) provázená rozvojem myelomové kostní nemoci (MKN), s přítomností osteolytických lézí a případných zlomenin převážně v axiální části skeletu (80 – 90 %), zatímco samotná difuzní osteoporóza se vyskytuje pouze u 10 – 20 % jedinců [1,2]. Rozpoznání přítomnosti a rozsahu MKN je integrální součástí nejen International Myeloma Working Group (IMWG) diagnostických kritérií MM, ale i kritérií klinického stážovacího systému dle Durieho-Salmona (D-S) [1 – 4]. Přesné hodnocení umístění a stupně osteodestruktivních lézí ovlivňuje nejen prognózu MM, ale i volbu terapie, včetně léčby bisfosfonáty, ložiskové aktinoterapie a/ nebo chirurgického zákroku [1,2,4]. Stále sofistikovanější léčebné postupy s „personalizací“ medicíny zvyšují i nároky na precizní odlišení monoklonální gamapatie nejistého významu (MGUS) od iniciální/ asymptomatické fáze MM (AMM, stadium I) a na přesné určení klinického stadia nemoci jako stěžejního východiska léčebného plánu. Vzhledem k nízké senzitivitě konvenční radiografie skeletu (KRS) se ztrátou postavení „zlatého standardu“ se staly přirozenou pomocí v řešení složitých, nevyhraněných stavů moderní zobrazovací metody, tj. CT (včetně multidetektorové „low dose“ formy), 99mTc - MIBI scintigrafie, MRI a 18F - FDG - PET/ CT, vyznačující se podstatně vyšší citlivostí v rozpoznání diskretních změn kostní struktury, v odhalení mimodřeňového šíření, a dokonce i v hodnocení aktivity myelomového procesu [5 – 9]. MRI a 18F - FDG PET/ CT se staly východiskem anatomicko-funkčního stážovacího systému Durie - Salmon PLUS (D-S Plus), založeného na kalkulaci počtu ložiskových lézí a tíži difuzních změn v kostní dřeni, který se ukázal podstatně citlivější v hodnocení iniciální/ asymptomatické fáze MM (AMM), včetně jejího odlišení od MGUS a v úspěšnější diferenciaci mezi stadii 2 a 3 rozvinuté formy MM [10 – 12]. Dosavadní zkušenosti s použitím MRI prokázaly zejména při vyšetření páteře, pánve a hrudní kosti vysokou citlivost s možností časné detekce drobnoložiskových lézí (> 3 mm), odlišení čerstvé „osteoporotické“ a „myelomové“ komprese obratlů i odhalení extraoseálního, nejčastěji epidurálního šíření myelomu [9,13 – 16].
Vzhledem k doposud jen dílčím zkušenostem s využitím celotělové formy MRI (WB - MRI) u MM, zaměřila se předložená studie na zhodnocení diagnostického přínosu této zobrazovací techniky v odlišení MGUS od iniciální/ asymptomatické formy MM, diagnostiky solitárního plazmocytomu a na praktický přínos hodnocení stupně pokročilosti nemoci s pomocí stratifikačního systému D-S Plus s porovnáním dosažených výsledků se standardními stážovacími systémy dle D-S a International Staging Systém (ISS) [4,10,17].
Soubor nemocných a použité metody
Analyzovaná, 86členná sestava s monoklonální gamapatií (MG) byla tvořena 28 jedinci s MGUS, 54 nemocnými s MM vyšetřenými při diagnóze před zahájením chemoterapie a 4 pacienty se SP (3 s kostní a 1 s extramedulární formou), splňujícími IMWG diagnostická kritéria [1,3]. Věkový medián MGUS (včetně MGUS v maligní transformaci) byl 64 (50 – 83) let, poměr M/ Ž byl 0,5, imunochemický typ IgG byl zastoupen v 82,1 % (n – 23), IgA v 17,9 % (n – 5) a poměr κ/λ byl 2,5. Nemocní se SP měli medián věku 53,5 (42 – 65) let, poměr M/ Ž byl 1,0, MIg typu IgG byl zastoupen u 3, IgM u 1 nemocné, vesměs s velmi nízkými sérovými hladinami MIg (stopy, 2,0, 2,6 a 6,0 g/ l). V souboru 54 nemocných s MM byl věkový medián 64 (31 – 81) let, poměr M/ Ž 1,4, imunochemický typ IgG byl zastoupen v 64,8 % (n – 35), IgA v 16,6 % (n – 9), Bence - Jonesův ve 14,8 % (n – 8) a IgD typ ve 3,7 % (n – 2), poměr κ/ λ byl 1,2. K ostážování MM byl použit jednak standardní systém dle Durieho-Salmona, vycházející z hodnoty Hb, vápníku MIg v séru a z radiografického vyšetření axiálního skeletu [1,4] a jednak ISS stratifikační systém [17], založený na sérových koncentracích β2 - mikroglobulinu (β2 - M) a albuminu. Nemocní s AMM byli ponecháni bez léčby („wait and see“), nemocní se symptomatickou nebo progredující formou MM byli léčeni thalidomidem v kombinaci s melfalanem, cyklofosfamidem nebo doxorubicinem a/ nebo vysokodávkovanou chemoterapií s autologní transplantací krvetvorných buněk dle Souboru doporučení České myelomové skupiny [1,2].
Obr. 1. Celotělová magnetická rezonance (WB-MRI) u nemocného s prvotní diagnózou solitární formy plazmocytomu hrudní kosti vycházející z histologického vyšetření materiálu odebraného při parciální resekci sterna. Histologie kostní dřeně z lopaty kosti kyčelní byla negativní, zaznamenána i negativita MIg a normální hodnoty volných lehkých řetězců κ a λ v séru, negativita konvenční radiografie skeletu, <sup>99m</sup>TcMIBI scintigrafie a <sup>18</sup>F-FDG PET/CT. WB-MRI prokázala na rozdíl od konvenčního radiografického vyšetření pravého humeru a pánve (obr. 1A a 1D) ložiskové léze v hlavici pravého humeru (obr. 1B a 1C) a difuzní postižení pánve a kosti křížové s přítomností 2 ložisek v sousedství sakroiliakálního skloubení (1E a 1F). 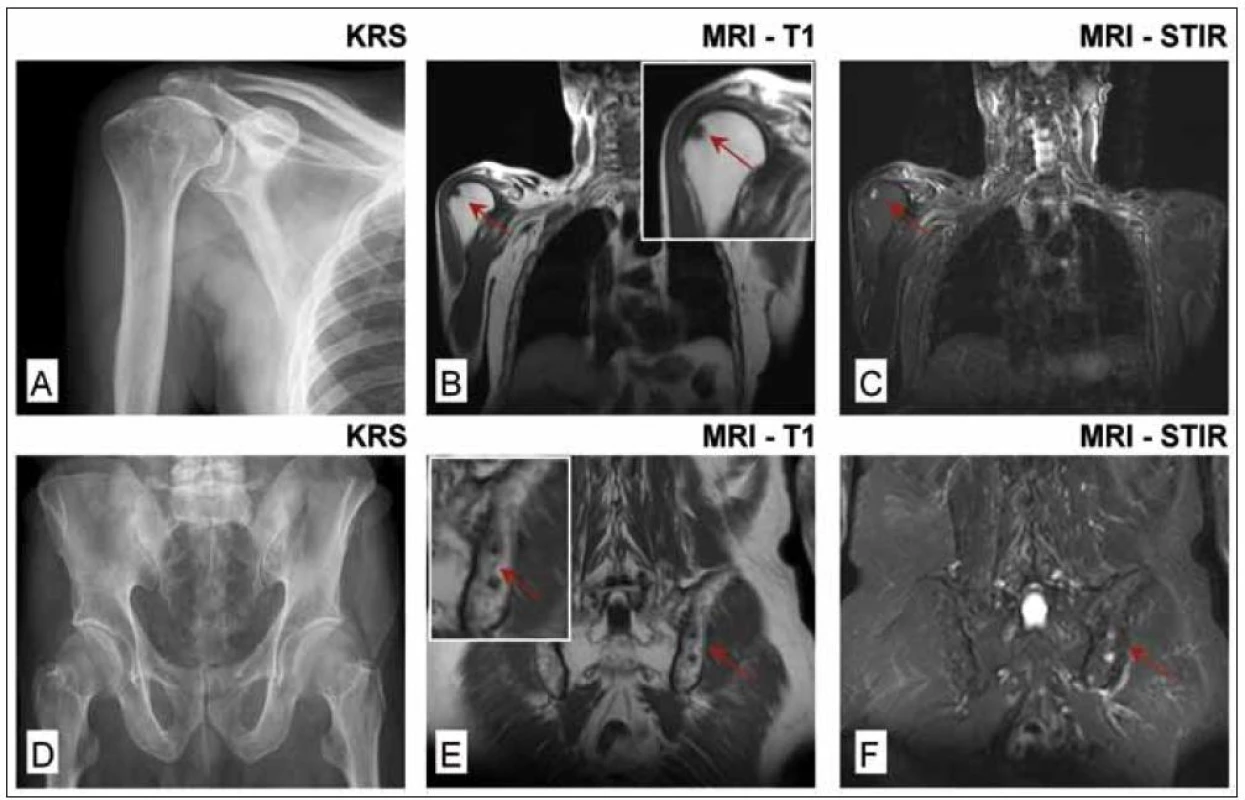
Celotělové MR vyšetření bylo prováděno na přístroji Magnetom Avanto 1,5 T (Siemens, Erlangen, SRN) za pomoci virtuální celotělové maticové cívky (TIM – total imaging matrix). Postupná akvizice byla prováděna ve 4 etážích od bérců dolních končetin po kraniální část hrudníku v koronální rovině, dále byla zobrazena ve 2 úsecích celá páteř v sagitální rovině a v jedné etáži lebka v koronální i transverzální rovině. Ve všech 7 etážích byly zhotoveny 2 sekvence – T2 STIR (T2 „short tau inversion recovery“) a T1 („fast spin-echo“) sekvence. Kontrastní látka použita nebyla. Při hodnocení se vycházelo z originálních doporučení, byly hodnoceny ložiskové léze a difuzní změny [10,12,18]. Za myelomové byly považovány všechny léze hypersignální na STIR a hyposignální na T1 sekvencích, pokud nebyla zřejmá jejich jiná etiologie (např. degenerativní změny na páteři) (obr. 1). Byl sledován celkový počet ložiskových lézí, ovšem při > 20 lézích v jedné etáži již nebyly numericky hodnoceny. Na páteři byla hodnocena jednotlivá ložiska, pokud byla ohraničitelná. Plošné postižení obratlového těla bylo hodnoceno jako jedno ložisko. Difuzní změny byly hodnoceny ve stupních: normální nález – homogenní intenzita signálu na obou sekvencích odpovídající věku nemocného; osteopenie – plošné, skvrnité a nepravidelné zvýšení intenzity signálu na STIR a snížení na T1 sekvencích bez náznaku tvorby jednotlivých ohraničených drobných ložisek; pestrý obraz – výraznější změny intenzity signálu než při osteopenii s náznakem ohraničování jednotlivých drobných ložisek nebo mnohočetná, drobná, „nepočítatelná“ ložiska (do průměru 3 mm) nebo obraz charakteru „sůl a pepř“; výrazné postižení – celková výrazná difuzní změna intenzity signálu na obou typech sekvencí. Na základě kombinace počtu ložisek a stupně difuzních změn bylo určeno stadium Durie - Salmon Plus klasifikace (tab. 1) [10,11,18]. Ke statistickému vyhodnocení shody byl použit koeficient Cohenovo κ, ke zhodnocení rozdílnosti McNemarův - Bowkerův test s hranicí významnosti p < 0,05.
Tab. 1. Stážovací systém Durie/Salmon Plus. Podle [10]. ![Stážovací systém Durie/Salmon Plus. Podle [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7c5122e4215b937c5281fd2df5419c48.jpeg)
MR – magnetická rezonance, MGUS – monoklonální gamapatie nejistého významu Výsledky
Analýza jedinců s MGUS s mediánem sledování 56 (6 – 392) měsíců prokázala přínos provádění WB - MRI zejména v období, kdy změna klinického stavu nebo laboratorních ukazatelů vzbudila podezření na rozvoj maligní transformace. Standardní algoritmus biochemických testů, zahrnující vyšetření hemogramu, hladiny vápníku, urey, kreatininu, albuminu a β2-M v séru, elektroforézu séra, vyšetření hladiny volných lehkých řetězců (sFLC – „free light chain“), aspirační biopsii a/ nebo histobiopsii kostní dřeně a konvenční radiografické vyšetření axiálního skeletu byl doplněn o WB - MRI.
Z 28 jedinců s diagnózou MGUS splňovalo i nadále IMWG kritéria stabilní formy MGUS, potvrzené zcela negativním obrazem WB - MRI 11 (39 %), zatímco 17 jedinců (61 %) bylo přeřazeno do skupiny MGUS v transformaci v MM (tab. 2). S výjimkou 2 (7 %) nemocných, splňujících kritéria stadia 2A dle D-S se nacházelo ostatních 15 nemocných (53 %) v iniciální/ asymptomatické fázi MM, tedy stadium 1A dle D-S. Na podkladě WB - MRI byli nemocní ohodnoceni podle systému D-S Plus (tab. 2). Nejčastěji bylo zastoupeno stadium 1A (n – 9), méně často stadium 1B (n – 4) a stadium 2A (n – 3) a v jednom případě negativita WB - MRI (n – 1) vedla i nadále k hodnocení MGUS (tab. 2). Jak patrno, u 9 nemocných byla zaznamenána při použití systému D-S a D-S Plus shoda stadia 1A, u 4 nemocných vedlo použití systému D-S Plus k posunu do vyššího stadia (2krát ze stadia 1A do stadia 1B a 2krát ze stadia 1A do stadia 2A), zatímco u 3 nemocných byl zjištěn přesun do nižšího stadia (2krát ze stadia 2A do 1B a 1krát ze stadia 1A v důsledku negativity WB - MRI do MGUS). Z 9 ze 14 (64 %) nemocných s negativním výsledkem KRS mělo 6 (67 %) vyjádřeny ložiskové změny při WB - MRI. Ložiskové změny při použití WB - MRI mělo ve fázi transformace MGUS v MM 14 ze 17 nemocných, tj. 82 %. Výjimkou v tomto pozitivním hodnocení WB - MRI byl ale radiografický průkaz osteolytického postižení lebky u 7 (41 %) nemocných s nepřítomností ložiskových změn při WB - MRI. Při srovnání výsledků 3stupňového stážování dle D-S a ISS vůči stážovacímu systému D-S PLUS nebyl zjištěn v souboru MGUS statisticky významný rozdíl při použití koeficientu Cohenovo κ i McNemarova - Bowkerova testu.
Tab. 2. Analýza laboratorních nálezů v období transformace monoklonální gamapatie nejistého významu v mnohočetný myelom. 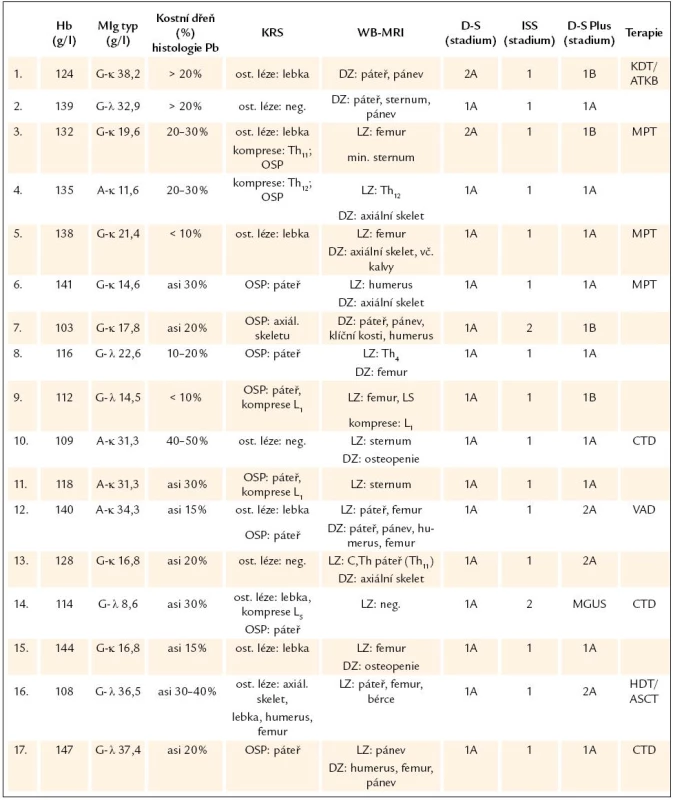
Hb – hemoglobin, MIg – monoklonální imunoglobulin, Pb – plazmatická buňka, KRS – konvenční radiografie skeletu, WB- MRI – celotělová forma, magnetické rezonance (whole body magnetic resonance), D-S stážování dle Durieho- Salmona, ISS – International Staging System, DZ – difuzní, změny, LZ – ložiskové změny, HDT/ ASCT – vysoce dávkovaná terapie s podporou autologních krvetvorných buněk, OSP – osteoporóza, MPT – melfalan, prednison a thalidomid, CTD – cyklofosfamid, thalidomid a dexametazon, VAD – vinkristin, adriablastin a dexametazon, MGUS – onoklonální gamapatie nejistého významu Výsledky stratifikace v souboru 54 nemocných s MM vyšetřených při diagnóze s aplikací všech 3 stážovacích systémů vyplývají z tab. 3. Devět nemocných (16,7 %) bylo při stratifikaci D-S Plus ve stadiu 1, 18 (33,3 %) ve stadiu 2 a 27 (50 %) bylo ve stadiu 3, tedy podstatně častěji nežli při zhodnocení dle D-S a ISS. Podrobnější analýza, zaměřená na srovnání systému D-S vs D-S Plus, ukázala, že u 12 nemocných z celého souboru MM, tj. ve 22,2 %, došlo po vyšetření WB - MRI k přesunu do vyššího stadia, a to 2 nemocných ze stadia 1A do 2A a u 10 nemocných ze stadia 2 do stadia 3. U 37 nemocných, tj. v 68,5 %, se výše stadia nezměnila, i když ze 7 nemocných přešlo 6 ze stadia 1A do podstadia 1B a ze 13 nemocných 1 ze stadia 2A do podstadia 2B a ze 17 nemocných stadia 3 přešel 1 ze stadia 3A do podstadia 3B. U 5 nemocných, tj. v 9 %, vedla stratifikace dle D-S Plus naopak ke snížení klinického stadia (u 2 ze stadia 2A do 1B a u 3 ze stadia 3 na stadium 2). Statistické vyhodnocení na podkladě uspořádání stadií MM do kontingenční tabulky (tab. 4) prokázalo významný stupeň neshody mezi systémy D-S a D-S Plus při použití koeficientu Cohenovo κ (p < 0,0001), nikoliv ale při použití McNemarova - Browkerova testu (p = 0,152). Při srovnání stážování D-S vs D-S Plus byla zjištěna odlišnost v případě hodnocení podstadií A v B u 14, tj. u 25,9 % nemocných (tab. 4), tj. statisticky významná změna vyplývající z použití koeficientu Cohenovo κ (p = 0,0001) i McNemarova - Bowkerova testu (p = 0,0001). Při srovnání stážování 54 nemocných s MM dle ISS vs D-S Plus (tab. 5) vyzněly rozdíly statisticky významně jak při použití koeficientu Cohenovo κ (p = 0,015), tak při použití McNemarova - Bowkerova testu (p = 0,008). Důležitým, prakticky významným nálezem bylo nižší podchycení osteolytických lézí s pomocí WB - MRI ve srovnání s KRS v oblasti lebky u 4 nemocných s MM, ale i drobných osteolytických ložisek v oblasti dlouhých kostí, tj. femuru, humeru a klíčku u dalších 4 pacientů z 54 nemocných s MM.
Tab. 3. Srovnání stratifikace mnohočetného myelomu s pomocí systému Durie- Salmon Plus a konvenčními stážovacími systémy dle Durieho- Salmona a International Staging System. 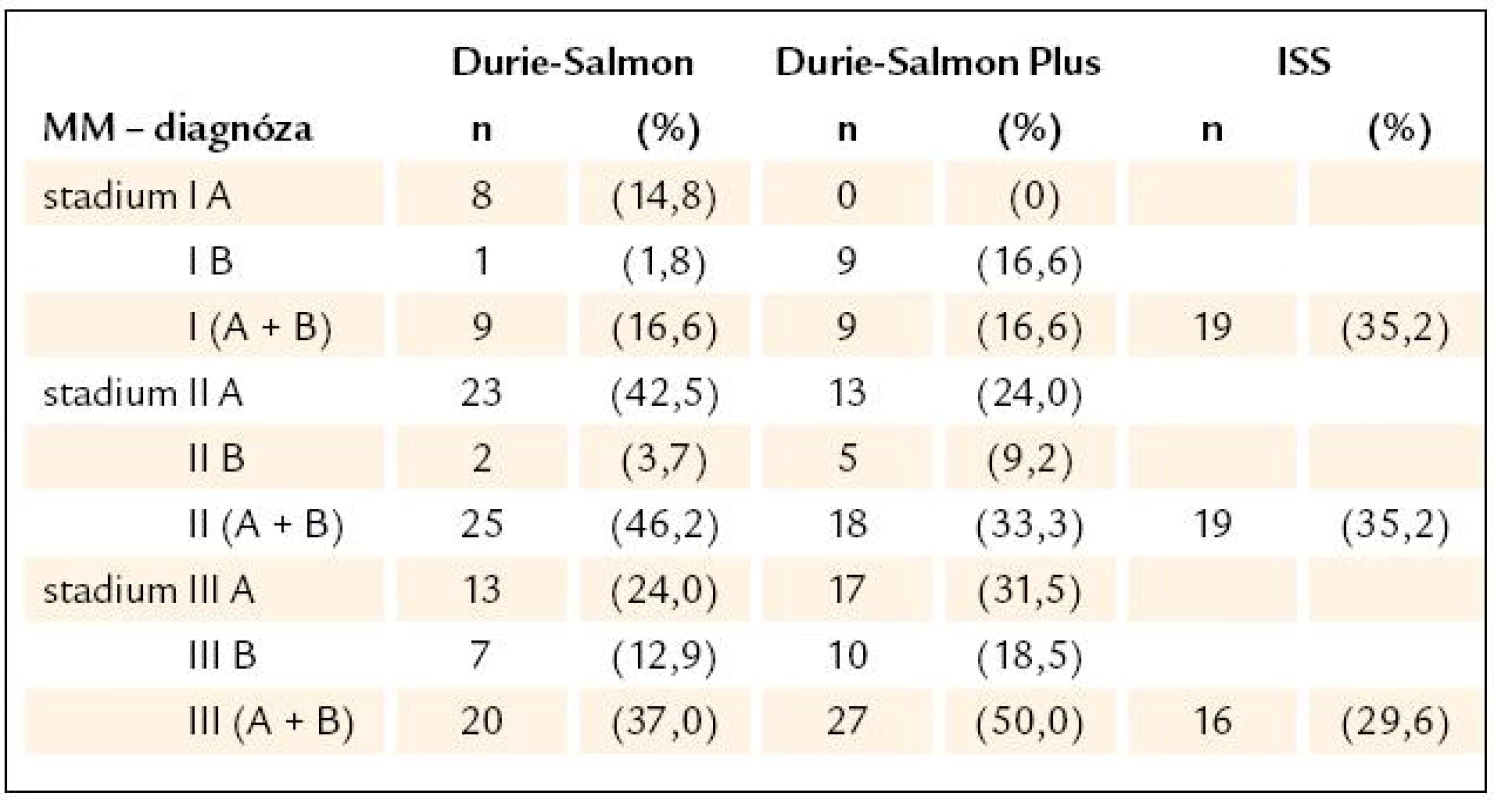
MM – mnohočetný myelom, ISS – International Staging System Tab. 4. Kontingenční tabulky jednotlivých stadií 1–3 a podstadií A–B, vyhodnocených podle Durieho-Salmona a Durie-Salmon Plus. 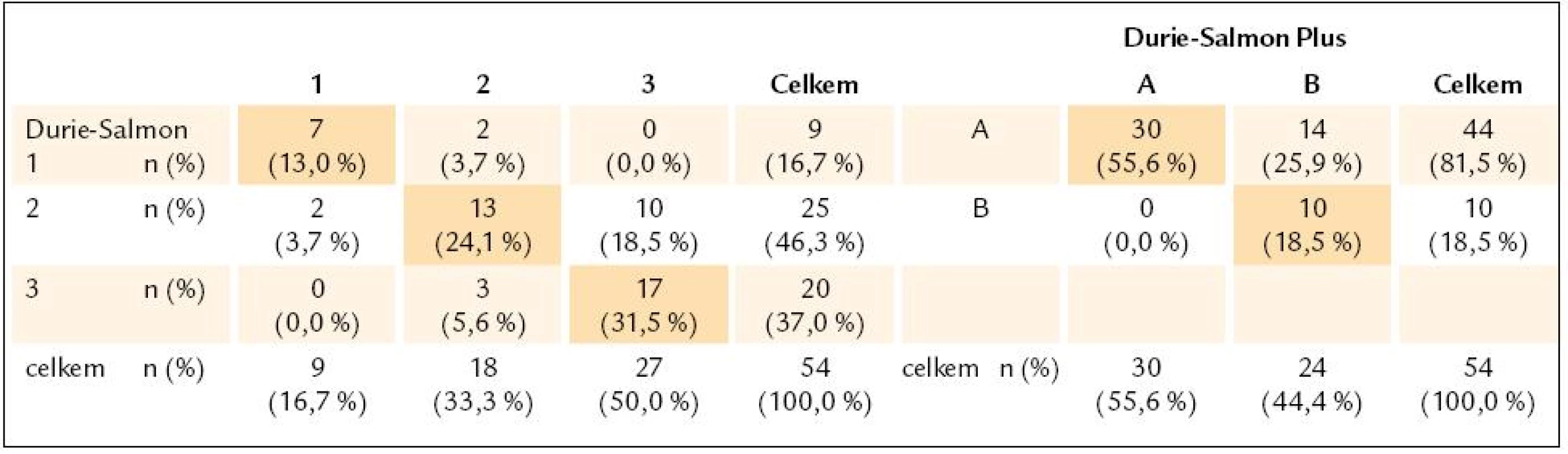
n – počet nemocných Údaje na diagonále kontingenční tabulky (barevné pozadí) vyjadřují shodu v jednotlivých typech klasifikace. Tab. 5. Kontingenční tabulky zastoupení stadií 1-3 vyhodnocených podle Durie-Salmona Plus a International Staging System. 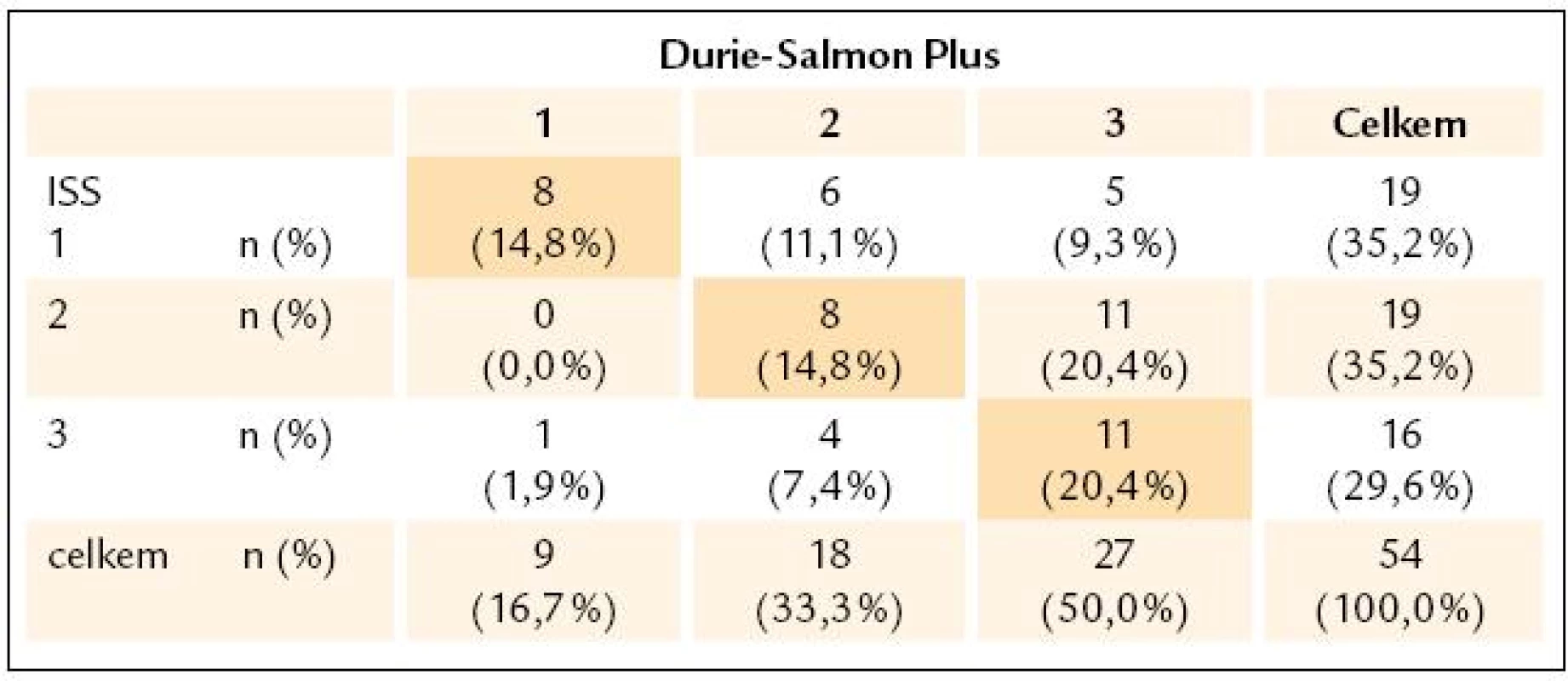
ISS – International Staging System Údaje na diagonále kontingenční tabulky (barevné pozadí) vyjadřují shodu v jednotlivých typech klasifikace. U 7 z 54 nemocných s MM, tj. ve 13 %, bylo zjištěno s pomocí WB - MRI různě rozsáhlé mimodřeňové šíření v různých oblastech axiálního skeletu:
- MM IgG - λ, stadium 1B (D-S Plus): presakrální propagace plazmocytomu křížové kosti a intra - i extrakraniální propagace plazmocytomu parietookcipitální oblasti;
- MM BJ - κ, stadium 3A (D-S Plus): plazmocytom orbity s propagací do střední jámy lební;
- MM IgA - κ, stadium 3A (D-S Plus): intrakraniální propagace plazmocytomu temporoparietální krajiny a paraspinální šíření při kompresivní zlomenině Th2;
- MM IgG - λ, stadium 3A (DS - Plus): paraspinální propagace při patologické kompresi obratlového těla L2 a L5 a plazmocytom křížové kosti s šířením do páteřního kanálu;
- MM IgG - κ, stadium 3A (DS - Plus): extramedulární prevertebrální a paraspinální propagace s postižením přilehlých svalových struktur v důsledku kompresivní destrukce obratle Th11 a presakrální propagace v oblasti levého acetabula;
- MM IgG - κ, stadium 2A (DS - Plus): paraspinální propagace plazmocytomu v oblasti obratlů C1,2;
- MM IgG - κ, stadium 2A (DS - Plus): nitropánevní propagace plazmocytomu křížové kosti a přilehlé lopaty kyčelní.
S pomocí WB - MRI podchycené změny byly východiskem neurochirurgického zákroku a/ nebo ložiskové aktinoterapie s intenzivní chemoimunoterapií.
WB - MRI byla přínosná i při vyšetření 4 nemocných s diagnózou solitárního plazmocytomu [18]. U 3 nemocných, vyznačujících se solitárním postižením 6. hrudního obratle (stabilizační operace obratlů Th5–7 s ložiskovou aktinoterapií), plazmocytomem 6. žebra vpravo (resekce a ložisková aktinoterapie) a extramedulárním plazmocytomem levé orbity a maxilární dutiny s propagací do příušní žlázy (operační řešení, ložisková aktinoterapie a vysokodávkovaná chemoterapie s autologní transplantací kmenových buněk) byl i v odstupu 1, 1 a 69 měsíců od rozpoznání SP potvrzen s pomocí WB - MRI solitární charakter procesu. U 4. nemocného s původně solitárním nediferencovaným plazmocytomem nosohltanu (extirpace, ložisková aktinoterapie a chemoterapie) s dosažením kompletní remise byl v odstupu 78 měsíců prokázán ložiskový relaps s přítomností 2 ložiskových lézí v oblasti levého bérce a levé stehenní kosti, tj. multifokální plazmocytom, navíc i šíjová lymfadenopatie s histologickým průkazem Castlemannova lymfomu.
Diskuze
Vyšetření s pomocí MRI je v současnosti nedílnou součástí vyšetření nemocných s MM, neboť má oproti KRS řadu neopominutelných výhod [9,18]. Umožňuje přímé zhodnocení charakteru a stupně myelomové infiltrace KD před vývinem kostní destrukce a dříve, nežli lze kostní změny odhalit s pomocí radiografického vyšetření skeletu, a to bez radiační expozice [21]. Jde o vyšetření volby při podezření na kompresi míšní, útlak míšních kořenů a odhalení přítomnosti a stupně extramedulární epidurální extenze [22]. MRI přispívá k predikci rizika zlomenin obratlových těl s odlišením benigní a maligní etiologie a k zobrazení defigurace obratlových těl před perkutánní vertebroplastikou [23]. Ve srovnání s KRS jde o mnohem citlivější metodu zobrazení axiálního skeletu umožňující odlišení normální kostní dřeně od KD postižené myelomovým procesem, pozitivní u asi 80 % nemocných při diagnóze MM. Řada autorů považuje MRI za „nový zlatý standard“ a metodu volby při vyšetření páteře, pánve a hrudní kosti a při podezření na extraoseální šíření myelomových mas [13,25]. Horší výsledky MRI oproti KRS byly ale i v naší studii zaznamenány v oblasti žeber a dlouhých kostí, k nevýhodám MRI patří nízká specifita s „nepatognomonickým obrazem“ v případě reaktivní hyperplazie KD v rámci septického stavu, závažné anémie, po léčbě granulocytárními růstovými působky (G-CSF), určitým nedostatkem MRI je i podhodnocení nálezu v oblasti lbi, žeber a klíčních kostí [9,18,26]. Významným pokrokem v diagnostice MKN se stalo zavedení WB - MRI s možností celotělové sekvenční multidetektorové analýzy umožňující uplatnění skórovacího systému (0 – 3) pro 10 oblastí těla [27]. WB - MRI je mnohem citlivější nežli KRS se senzitivitou 70 – 89 % a specificitou 80 – 83 % [19,28 – 31] a umožňující detekci 3 – 5 mm velikých lézí. Za indikaci k WB - MRI je považován normální radiografický obraz skeletu při podezření na MM s pozitivitou 80 vs 54 %.
Nejčastější indikací WB - MRI je diferenciace MGUS vs AMM (stadium 1A dle D-S), s pozitivitou u asi 10 % nemocných [9,18]. Z analýzy našeho souboru 28 jedinců s MGUS vyplynulo, že WB - MRI je vhodnou metodou, zlepšující možnosti odlišení stabilní formy MGUS od MGUS v transformaci v MM. WB - MRI se uplatnila v kontextu dalších ukazatelů na vyčlenění 39 % nemocných s MGUS ve stabilní fázi s rozpoznáním 61 % nemocných s AMM (50 %, stadium 1 dle D-S) a u 11 % pacientů s rozvinutou formou MM (stadium 2 dle D-S). Vysoký záchyt maligní transformace MGUS v MM v naší studii byl podmíněn cílenou indikací WB - MRI u nemocných s naléhavým podezřením na tento stav. Pouze v 1 případě vyzněla WB - MRI negativně i přes splnění ostatních diagnostických kritérií AMM, u 2 nemocných došlo při použití systému D-S Plus dokonce k posunu do nižšího stadia. Potvrdilo se, že systém D-S Plus, založený na WB - MRI je oproti D-S zřetelně citlivější, neboť u 28 % jedinců vedl k posunu do vyššího stadia MM. WB - MRI tedy přispívá k rozpoznání přechodu MGUS v MM mnohem citlivěji nežli konvenční kritéria včetně KRS, neboť umožňuje časnou detekci nejen drobnoložiskových změn skeletu, ale i přítomnost difuzních změn v KD. Je tedy v kontextu ostatních kritérií vyšetřením volby při podezření na transformaci MGUS v MM, u 1/ 2 nemocných k náhradě postoje „wait and see“ zahájením indukční terapie. I v našem souboru byla ověřena podstatně vyšší citlivost MRI v oblasti páteře a pánve oproti KRS s nižší záchytností i při rozpoznání osteolytických změn v oblasti lbi. Hlavním problémem rozlišení MGUS od iniciálního/ asymptomatického stadia MM je v případě hraničních hodnot MIg a plazmocytů v KD necharakteristický nález pouhé osteoporózy, která je navíc v seniorském věku běžná a u MGUS častější nežli v normální populaci [32]. Časné rozpoznání drobnoložiskových osteolytických lézí a/ nebo infiltrativní postižení KD v rámci myelomového procesu s pomocí WB - MRI se jeví jako jeden z klíčových diferenciálně-diagnostických znaků v odlišení MGUS a MM [33]. Z předchozích studií vyplynulo, že patologický MRI nález se vyskytuje u 19 % jedinců s MGUS a je provázen zkrácením doby do progrese v MM [34]. V případě AMM se nachází abnormální struktura KD s pomocí MRI u 30 – 50 % jedinců [21], s nutností zahájení terapie v mediánu 16 měsíců, zatímco v případě normálního MRI obrazu v mediánu až 43 měsíců [36]. Abnormální nález při MRI vyšetření je tedy prediktorem délky do progrese vyžadující nastolení chemoterapie [37].
V rámci stratifikace souboru 54 nepředléčených nemocných s MM bylo zjištěno, že stávající systém D-S Plus, založený na WB - MRI, se vyznačoval podstatně vyšším, 50% zastoupením nemocných v nejpokročilejší fázi nemoci, tj. ve stadiu 3 nežli u systému D-S (37 %) a ISS (30 %), což potvrzuje vysokou senzitivitu systému založeného na WB - MRI. Do tohoto hodnocení zapadá i posun 22 % nemocných do vyššího stadia („upstanding“), především ze stadia 2 dle D-S do stadia 3 dle D-S Plus, potvrzující vysokou citlivost WB - MRI, což spolu s celotělovým rozsahem vyšetření je z hlediska preciznosti hodnocení rozsahu a tíže postižení skeletu a KD v rámci MM přínosné a projevující se vyšší senzitivitou nežli klasický systém D-S založený na KRS. To, že u 9 % nemocných vedl systém D-S Plus ke snížení stadia nemoci, nasvědčuje, že tíže MKN nemusí odpovídat kritériím standardních stážovacích systémů. Systém D-S Plus se ukázal v citlivějším světle i vůči v současnosti nejpoužívanějšímu, ISS stážovacímu systému, vyznačujícím se absencí kterékoliv zobrazovací metody. V rozpoznání transformace MGUS v MM i v rámci stážování rozvinuté formy MM se jevil systém D-S Plus účelnější nežli ISS. Nepochybně slabou stránkou WB - MRI je detekce osteolytického postižení lebky a pažních i stehenních kostí, u nichž se jeví v příznivějším světle konvenční radiografie, a proto by se měla v těchto lokalizacích KRS nadále používat [9,13,18]. U 13 % nemocných s MM odhalila WB - MRI v oblasti lbi, páteře a pánve mimodřeňové šíření myelomového procesu. Jde bezpochyby o jeden z největších přínosů MRI, unikající při izolovaném použití KRS a absenci klinických příznaků v detekci, a tím i časné radiační terapie nebo neurochirurgické intervenci [38,39].
Diagnóza solitárního plazmocytomu (SP) je založena na průkazu solitární léze s biopticky verifikovanou infiltrací patologickými plazmocyty s negativitou klonálních plazmocytů v KD s nepřítomností příznakového komplexu CRAB. WB - MRI je v potvrzení diagnózy oseální i extramedulární formy SP zcela zásadním vyšetřením. U 3 ze 4 nemocných s diagnózou SP WB - MRI potvrdila nejen solitárnost, ale i přesnou lokalizaci ložiskového procesu, a tím i taktiku cílené ložiskové aktinoterapie. U 1 nemocného vedla WB - MRI k rozpoznání multifokální formy plazmocytomu se současnou přítomností Castlemannova lymfomu. Klíčovým přínosem WB - MRI je detekce okultních, KRS nepodchytitelných ložisek, a jde tedy o preferenční zobrazovací metodu nejen v rámci iniciální diagnostiky SP, ale i pro monitorování případné oseální či extraoseální progrese. WB - MRI je v současnosti naprosto integrální součástí stážovacího procesu u nemocných s podezřením na SP [40,41].
Závěr
Ze studie vyplývá, že WB - MRI je velmi citlivá celotělová zobrazovací metoda, nahrazující díky schopnosti časného rozpoznání strukturálních ložiskových lézí skeletu a kostní dřeně zejména v oblasti páteře, pánve a hrudní kosti doposud standardně používanou KRS. Celotělová forma magnetické rezonance (WB - MRI) je v současnosti plně indikována v následujících situacích: rozlišení MGUS s podezřením na maligní transformaci od iniciální/ asymptomatické fáze MM (stadium 1 dle D-S); odlišení asymptomatické fáze MM (stadium 1 dle D-S) od fáze rozvinuté/ aktivní vyžadující bezprostřední zahájení léčby; při podezření na extramedulární šíření myelomového procesu (zejména v oblasti páteře a pánve); k potvrzení diagnózy solitární formy plazmocytomu (SP) s vyloučením víceložiskového postihu a MM. V prakticky použitelné a přínosné rovině se jeví i stratifikační systém MM dle D-S Plus, vedoucí u značné části nemocných s asymptomatickou i s rozvinutou/ symptomatickou formou MM oproti dosavadním stážovacím systémům (D-S a ISS) k posunu do vyššího stadia („upstanding“), což je důležité pro hodnocení prognózy, i volbu optimálního léčebného postupu.
Podpora IGA MZ ČR NR 9489, VVZ MSM 6198959205.
prof. MU Dr. Vlastimil Ščudla, CSc.
www.fnol.cz
e-mail: vlastimil.scudla@fnol.czDoručeno do redakce: 21. 7. 2010
Přijato po recenzi: 16. 9. 2010
Zdroje
1. Hájek R, Adam Z, Maisnar V et al, Česká myelomová skupina. Souhrn doporučení 2009 „Diagnostika a léčba mnohočetného myelomu“. Transfuze Hematol dnes 2009; 15 (Suppl 2): 1 – 80.
2. Ščudla V. Současné možnosti léčby mnohočetného myelomu. Remedia 2009; 19 : 410 – 419.
3. International Myeloma Working Group. Criteria for the clasification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121 : 749 – 757.
4. Durie BGM, Salmon SE. A clinical staging system for multiple myeloma. Cancer 1975; 36 : 842 – 854.
5. Shortt CP, Gleeson TG, Breen KA et al. Whole - body MRI versus PET in assessment of multiple myeloma disease activity. AJR 2009; 192 : 980 – 986.
6. Fonti R, Salvatore B, Quarantelli M et al. 18F - FDG PET/ CT, 99mTc - MIBI, and MRI in evaluation of patients with multiple myeloma. J Nucl Med 2008; 49 : 195 – 200.
7. Hur J, Yoon CS, Ryu YH et al. Comparative study of fluorodeoxyglucose positron emission tomography and magnetic resonance imaging for the detection of spinal bone marrow infiltration in untreated patients with multiple myeloma. Acta Radiologica 2008; 46 : 427 – 435.
8. Mulligan ME, Badros AZ. PET/ CT and MR imaging in myeloma. Skeletal Radiol 2007; 36 : 5 – 16.
9. Lütje S, de Rooy WJ, Croockewit S et al. Role of radiography, MRI and FDG - PET/ CT in diagnosing, staging and therapeutical evaluation of patients with multiple myeloma. Ann Hematol 2009; 88 : 1161 – 1168.
10. Durie BGM. The role of anatomic and functional staging in myeloma: Description of Durie/ Salmon Plus staging system. European Journal of Cancer 2006; 42 : 1539 – 1543.
11. Baur A, Stäbler A, Nagel D et al. Magnetic resonance imaging as a supplement for the clinical staging system of Durie and Salmon? Cancer 2002; 95 : 1334 – 1345.
12. Bäuerle T, Hillengass J, Fechtner K et al. Multiple myeloma and monoclonal gammopathy of undetermined significance: Importance of whole - body versus spinal MR imaging. Radiology 2009; 252 : 477 – 485.
13. Zamagni E, Nanni C, Patriarca F et al. A prospective comparison of 18F - fluorodeoxyglucose positron emission tomography - computed tomography, magnetic resonance imaging and whole - body planar radiographs in the assessment of bone disease in newly diagnosed multiple myeloma. Haematologica 2007; 92 : 50 – 55.
14. Lecouvet FE, Malghem J, Michaux L et al. Skeletal survey in advanced multiple myeloma: radiographic versus MR imaging survey. Brit J Haematol 1999; 106 : 35 – 39.
15. Nekula J, Mysliveček M, Bačovský J et al. Magnetická rezonance a scintigrafie 99mTc - MIBI v diagnostice a sledování terapie mnohočetného myelomu. Čes Radiol 2004; 58 : 65 – 70.
16. Weininger M, Lauterbach B, Knop S et al. Whole - body MRI of multiple myeloma: Comparison of different MRI sequences in assessment of different growth patterns. Eur J Radiol 2009; 69 : 339 – 345.
17. Greipp PR, San Miguel J, Durie BGM et al. International Staging System for multiple myeloma. J Clin Oncol 2005; 23 : 3412 – 3420.
18. Dimopoulos M, Terpos E, Comenzo RL et al. International myeloma working group consensus statement and guidelines regarding the current role of imaging techniques in the diagnosis and monitoring of multiple myeloma. Leukemia 2009; 23 : 1545 – 1556.
19. Kreuzberg B, Ferda J. Celotělové vyšetření magnetickou rezonancí. Ces Radiol 2007; 61 : 351 – 363.
20. Mysliveček M, Nekula J, Bačovský J. Zobrazovací metody v diagnostice a sledování mnohočetného myelomu. Vnitř Lék 2006; 52 : 46 – 54.
21. Baur - Melnyk A, Buhmann S, Dürr HR et al. Role of MRI for the diagnosis and prognosis of multiple myeloma. Eur J Radiol 2005; 55 : 56 – 63.
22. Dimopoulos MA, Moulopoulos A, Smith T et al. Risk of disease progression in asymptomatic multiple myeloma. Am J Med 1993; 94 : 57 – 61.
23. Diamond TH, Hartwell T, Clarke W et al. Percentaneous vertebroplasy for acute vertebral body fracture and deformity in multiple myeloma: a short report. Brit J Haematol 2004; 124 : 485 – 487.
24. Moulopoulos LA, Dimopoulos MA, Vourtsi A et al. Bone lesions with soft - tissue mass: magnetic resonance imaging diagnosis of lymphomatous involvement of the bone marrow versus multiple myeloma and bone metastases. Leuk Lymph 1999; 34 : 179 – 184.
25. Walker R, Barlogie B, Haessler J et al. Magnetic resonance imaging in multiple myeloma: diagnostic and clinical implications. J Clin Oncol 2007; 25 : 1121 – 1128.
26. Mechl M, Neubauer J, Krejčiřík P et al. Celotělové vyšetření pomocí magnetické rezonance se zobrazením difuze u nemocných s mnohočetným myelomem – první zkušenosti. Ces Radiol 2007; 61 : 364 – 369.
27. Baur - Melnyk A, Buhmann S, Becker Ch et al. Whole - body MRI versus whole - body MDCT for staging of multiple myeloma. AJR 2008; 190 : 1097 – 1103.
28. Hur J, Yoon CS, Ryu YH et al. Efficacy of multidetector row computed tomography of the spine in patients with multiple myeloma: Comparison with magnetic resonance imaging and fluorodeoxyglucose – positron emission tomography. J Comput Assist Tomogr 2007; 31 : 342 – 347.
29. Piekarek A, Sosnowski P, Nowicki A et al. Whole body MR in patients with multiple myeloma. Rep Pract Oncol Radiother 2009; 14 : 80 – 84.
30. Hillengass J, Fechtner K, Weber MA et al. Prognostic significance of focal lesions in whole - body magnetic resonance imaging in patients with asymptomatic multiple myeloma. J Clin Oncol 2010; 28 : 1606 – 1610.
31. Ghanem N, Lahrmann C, Engelhardt M et al. Whole - body MRI in the detection of bone marrow infiltration in patients with plasma cell neoplasms in comparison to the radiological skeletal survey. Eur Radiol 2006; 16 : 1005 – 1014.
32. Pepe J, Petrucci MT, Nafroni I et al. Lumbar bone mineral density as the major factor determininy increased prevalence of vertebral fractures in monoclonal gammopathy of undetermined significance. Br J Haematol 2006; 134 : 485 – 490.
33. Bellaiche L, Laredo JD, Lioté F et al. Magnetic resonance appearance of monoclonal gammopathies of unknown significance and multiple myeloma. Spine 1997; 22 : 2551 – 2557.
34. Vande Berg BC, Michaux L, Lecouvet FE et al. Nonmyelomatous monoclonal gammopathy: correlation of bone marrow MR images with laboratory findings and spontaneous clinical outcome. Radiology 1997; 202 : 247 – 251.
35. Terpos E, Ratemtulla A, Dimopoulos A et al. Risk of disease progression in asymptomatic multiple myeloma. Eyert Opin Pharmacother 2005; 6 : 1127 – 1142.
36. Moulopoulos LA, Dimopoulos MA, Smith TL et al. Prognostic singnificance of magnetic resonance imaging in patients with asymptomatic multiple myeloma. J Clin Oncol 1995; 13 : 251 – 256.
37. Mariette X, Zagdanski AM, Guernazi A et al. Prognostic value of vertebral lesions detected by magnetic resonance imaging in patients with stage I multiple myeloma. Brit J Haematol 1999; 104 : 723 – 729.
38. Vytřasová M, Ščudla V, Nekula J et al. Význam magnetické rezonance při vyšetření páteře u nemocných s mnohočetným myelomem. Vnitř Lék 2001; 47 : 694 – 698.
39. Adam Z, Bednařík J, Neubauer J et al. Doporučení pro časné rozpoznání postižení skeletu maligním procesem a pro časnou diagnostiku mnohočetného myelomu. Vnitř Lék 2006; 52 (Suppl 2): 9 – 13.
40. Vaníček J, Krupa P, Adam Z. Přínos jednotlivých zobrazovacích metod pro diagnostiku a sledování aktivity mnohočetného myelomu. Vnitř Lék 2010; 56 : 585 – 590.
41. Dimopoulos MA, Moulopoulos LA, Maniatis A et al. Solitary plasmocytoma of bone and asymptomatic multiple myeloma. Blood 2000; 96 : 2037 – 2044.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Opoždění diagnózy HELLP syndromu
- Prípad vlajúceho infikovaného trombu v. jugularis interna, septických pneumónií a heparínom indukovanej trombocytopénie
- MU Dr. Václav Jedlička se dožil 85 let
- Terapeutická hypotermie po srdeční zástavě: proč a na jak dlouho? – editorial
- Geny a osteoporóza – editorial
- Obezita, body mass index, obvod pasu a mortalita – editorial
- Obezita, body mass index, obvod pasu a mortalita – editorial
- Charakteristika reziduálních tachykardií spojených s koronárním sinem během ablace dlouhodobé perzistentní fibrilace síní
- Akutní srdeční selhání a časný rozvoj dysfunkce levé komory u pacientů s akutním infarktem myokardu s elevacemi ST léčených primární perkutánní koronární intervencí
- Diagnostika a léčba akutní plicní embolie v roce 2010
- Přínos celotělové magnetické rezonance v diagnostice monoklonální gamapatie nejistého významu, mnohočetného myelomu a stanovení stadia pokročilosti nemoci s pomocí systému Durie‑ Salmon Plus
- Faktory ovlivňující přítomnost varixů a varikózního krvácení u pacientů s jaterní cirhózou
- Terapeutická hypotermie po srdeční zástavě na 12 hodin: Karlovy Vary 2006– 2009
- Význam genetiky v predikci rizika osteoporózy
- Obezita, body mass index, obvod pasu a mortalita
- Prečo vzniká fibrilácia predsiení po kardiochirurgických operáciách?
- Schnitzler‑ syndrom: popis případu, zkušenosti s léčbou glukokortikoidy a preparátem anakinra (KineretTM) a sledování cytokinové odpovědi organizmu
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Opoždění diagnózy HELLP syndromu
- Diagnostika a léčba akutní plicní embolie v roce 2010
- Obezita, body mass index, obvod pasu a mortalita
- Prípad vlajúceho infikovaného trombu v. jugularis interna, septických pneumónií a heparínom indukovanej trombocytopénie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



