-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Selhání ledvin u pacientky s chronickou B-lymfocytární leukemií (B-CLL) vzniklé na podkladě tvorby odlitkových válců v tubulech ledvin z monoklonálních volných lehkých řetězců (cast nephropathy). Přínos stanovení volných lehkých řetězců imunoglobulinů pro
Kidney failure in a patient with chronic B-lymphocytic leukaemia (B-CLL) with underlying cast nephropathy. The value of free immunoglobulin light chain identification for early diagnosis of this complication
We describe a case of an untreated female patient monitored over 8 years for chronic B-lymphocytic leukaemia (B-CLL). Over the 8 years, the patient has gradually developed severe kidney failure, even though the criteria for B-CLL treatment had not been fulfilled. Kidney biopsy revealed renal damage due to λ free light chains cast nephropathy as well as an infiltration of renal parenchyma with B-CLL cells. It was not before this biopsy that the presence of monoclonal immunoglobulins has been investigated. Immunofixation identified free monoclonal λ light chains in the serum and urine. Their serum concentration, quantified by densitometry, was 2.6 g/ l and urine concentration was 0.5 g/ l. A specific evaluation of free light chains in the serum revealed an extremely high concentration of free λ light chains, over 4,500 mg/ l, and normal concentration of κ free light chains, 10 mg/ l. The aim of this report is to emphasise that monoclonal immunoglobulin may be present in B-CLL as well as other lymphoprolipherative diseases and that it may cause damage to organs, similar to multiple myeloma or monoclonal gammopathy of undetermined significance. The described case confirms poor prognostic value of monoclonal immunoglobulin free light chains in patients with B-CLL and usefulness of an evaluation of their presence in patients with B-CLL, particularly if the patients have increased creatinine level. The described case also highlights the need for evaluation of the presence of free light chains in the serum of all patients with unclear cause of renal failure.
Key words:
cast nephropathy – monoclonal gammopathy – multiple myeloma – chronic B-lymphocytic leukemia – electrophoresis with immunofixation – light chain of immunoglobulin – renal failure
Autoři: Z. Adam 1; S. Štěpánková 2; A. Sirotková 3; Z. Čermáková 4; L. Pour 1; M. Krejčí 1; L. Zahradová 1; Z. Kořístek 1; J. Lenz 3; R. Hájek 1; J. Vorlíček 1; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; Interní gastroenterologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Aleš Hep, CSc. 2; I. patologicko-anatomický ústav Lékařské fakulty MU a FN u sv. Anny Brno, přednostka prof. MUDr. Markéta Hermanová, Ph. D. 3; Oddělení klinické biochemie FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Milan Dastych, CSc. 4
Vyšlo v časopise: Vnitř Lék 2011; 57(2): 214-221
Kategorie: Kazuistiky
Souhrn
Popisujeme pacientku 8 let sledovanou bez léčby pro chronickou B-lymfocytární leukemii (B-CLL). Po 8 letech trvání této nemoci, aniž by byla naplněna kritéria pro léčbu B-CLL, se rozvinulo postupně závažné selhání ledvin. Jeho příčinu objasnila biopsie ledviny, která prokázala poškození ledviny tvorbou odlitkových válců v tubulech z volných lehkých řetězců λ (cast nephropahty), ale také infiltrace ledvinného parenchymu buňkami B-CLL. Teprve po této biopsii bylo provedeno vyšetření přítomnosti monoklonálního imunoglobulinu. Metodou imunofixace byly prokázány monoklonální lehké řetězce λ v séru i v moči. Jejich koncentrace v séru, stanovená denzitometricky, byla 2,6 g/ l, a moči 0,5 g/ l. Speciální vyšetření volných lehkých řetězců v séru prokázalo extrémně vysokou hodnotu volných lehkých řetězců λ, nad 4 500 mg/ l, při normální koncentraci volných řetězců κ, 10 mg/ l. Cílem tohoto sdělení je upozornit na skutečnost, že monoklonální imunoglobulinu se může objevit u B-CLL a u dalších lymfoproliferativních chorob a že může způsobit poškození orgánů podobně jako u mnohočetného myelomu anebo monoklonální gamapatie nejistého významu (MGUS). Popisovaný případ potvrzuje nepříznivý prognostický význam monoklonálních volných lehkých řetězců imunoglobulinů u pacientů s B-CLL a důležitost jejich vyšetření u pacientů s B-CLL, zvláště pokud mají pacienti zvýšenou hodnotu kreatininu. Dále popisovaný případ upozorňuje na nutnost vyšetření volných lehkých řetězců v séru u všech pacientů s nejasnou příčinou selhání ledvin.
Klíčová slova:
odlitková nefropatie (cast nephropathy) – monoklonální gamapatie – mnohočetný myelom – chronická B-lymfocytární leukemie – imunofixační elektroforéza – volné lehké řetězce imunoglobulinů – selhání ledvinÚvod
Chronická B-lymfocytární leukemie (B-CLL) je charakterizována pozvolným průběhem, postupným úbytkem počtu všech fyziologických typů krvinek, přítomností lymfadenopatie a případně splenomegalie. Pro pacienty s chronickou lymfatickou leukemií je typický postupně narůstající imunodeficit se závažnými infekčními nemocemi, vznik autoimunitních fenoménů typu hemolytické anémie či imunitní trombocytopenie. Defekt imunity a dlouhý medián přežití nemocných s touto chorobou (10 let) je příčinou zvýšené incidence sekundárních maligních chorob, po nichž je třeba cíleně pátrat při kontrolách těchto pacientů [1–3].
Málo se však myslí na to, že pacienti s chronickou lymfocytární leukemií mohou tvořit monoklonální imunoglobulin, který pak může vytvářet další poškození organizmu. A mimo jiné může způsobit poškození ledvin s nutností chronické dialýzy. Respektovaná je skutečnosti, že B-CLL se může transformovat do agresivního velkobuněčného B-lymfomu. Méně známý je občasně pozorovaný souběh B-CLL a mnohočetného myelomu, případně časově oddělená manifestace těchto nemocí u jednoho pacienta. Skutečnost, že u pacientů s B-CLL bývá výjimečně přítomný monoklonální imunoglobulin, je však znám již dlouho [4–7].
Na tyto výjimečné případy B-CLL s tvorbou monoklonálního imunoglobulinu chceme poukázat popisem případu nemocné s B-CLL, kterou provázela nerozpoznaná tvorba monoklonálních lehkých řetězců. Teprve až biopsie ledviny informovala ošetřující lékaře, že tato pacientka tvoří lehké řetězce. V té době však již pacientka vyžadovala dialyzační léčbu, čili šlo o pozdě rozpoznanou velmi vzácnou komplikaci B-CLL.
Vzhledem k tomu, že vzácně se vyskytující nemoci provázené přítomností monoklonálního imunoglobulinu jsou diagnostikovány často velmi pozdě, až ve stavu pokročilé nemoci, zorganizovala Česká myelomová skupina edukační akci zvanou CRAB s cílem přispět k časnějšímu stanovení diagnózy mnohočetného myelomu a dalších monoklonálních gamapatií a následující text patří také k této aktivitě České myelomové skupiny.
Popis případu
Žena, narozená 1941, měla v roce 2002 diagnostikovanou chronickou B-lymfocytární leukemii (B-CLL). Diagnóza byla stanovena histologickým vyšetřením válečku kostní dřeně a potvrzena histologickým vyšetřením lymfatické uzliny. V době stanovení diagnózy nebyla přítomna anémie, trombocytopenie či jiná indikace k zahájení léčby. Proto byla pacientka pouze pravidelně kontrolována v hematologické ambulanci.
V únoru roku 2010 nemocná prodělala akutní bronchitidu a od té doby se cítila unavená, slabá, s nechutenstvím. Od začátku roku 2010 do dubna roku 2010 zhubla 10 kg. Začátkem dubna roku 2010 byly u praktické lékařky provedeny odběry s nálezem vysoké koncentrace kreatininu v séru, 640 μmol/ l, a urea 32 mmol/ l. Koncem roku 2009 byla pacientka u svého praktického lékaře a měla normální hodnoty urey i kreatininu. Nemocná byla odeslána k hospitalizaci na kliniku s nefrologickým zaměřením. Při přijetí do nemocnice 12. 4. 2010 byla hodnota kreatininu 839 μmol/ l a urey 40,5 mmol/ l, v moči bílkovina 11 g/24 hod. Byla zahájena akutní dialyzační léčba, indikována renální biopsie a provedeny komplexní odběry v rámci diferenciální diagnostiky. Biopsie byla komplikována velkým perirenálním hematomem s anemizací. Stav si vyžádal radiointervenční výkon se selektivní embolizací (coiling) větve renální artérie. Na angiografii byl průkaz extravazace z anomální duplicitní větve levé renální artérie. Následkem této komplikace přešlo neoligurické selhání ledvin v anurické. Etiologicky mohlo sehrát hlavní roli podání radiokontrastní látky při angiografii.
Imunofixační elektroforéza bílkovin prokázala monoklonální lehké řetězce λ v krvi i v moči.
Tab. 1. Popis biopsie ledviny. 
Histologické hodnocení biopsie ledvin prokázalo jak infiltraci intersticia lymfocyty B-CLL, tak odlitkové válce v tubulech. Podrobně uvádíme popis histologie v tab. 1 a na obr. 1–3.
Obr. 1–3. Kůra ledviny s několika dilatovanými tubuly, které jsou vyplněny fragmentovanými válci tvořenými amorfním materiálem s obrovskobuněčnou reakcí na periferii. V intersticiu je hustý lymfoidní infiltrát. 
V nemocničním informačním systému jsou dostupné laboratorní hodnoty z poslední předchozí kontroly v roce 2008 a pak až ze dne přijetí na lůžkové oddělení pro selhání ledvin (tab. 2).
Tab. 2. Základní laboratorní hodnoty v době přijetí na lůžkové oddělení nemocnice a jejich srovnání s předchozími laboratorními hodnotami, dostupnými v nemocničním informačním systému. 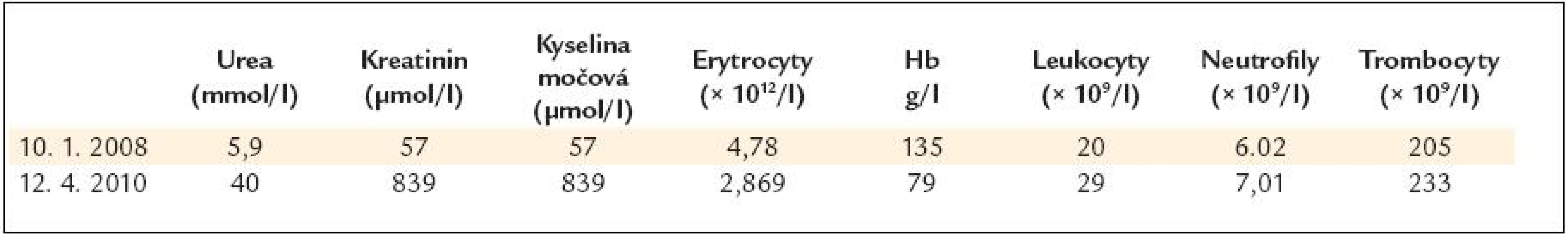
Hb – hemoglobin Z uvedených hodnot v tab. 2 je zřetelné, že se neprojevila progrese B-CLL poklesem počtu trombocytů ani zásadním vzestupem počtu leukocytů (lymfocytů) či poklesem počtu neutrofilů. Anémii tedy nelze jednoznačně interpretovat jako známku závažné progrese B-CLL, protože na anémii se podílelo selhání ledvin.
Nepřítomnost poklesu trombocytů a neutrofilů oproti roku 2008 a nepřítomnost splenomegalie či lymfadenopatie znamená, že se nejednalo o prudkou progresi B-CLL.
Zda se tvorba monoklonálního imunoglobulinu objevila až v posledním roce či zda byla již zpočátku nemoci, nelze zjistit.
V návaznosti na tento nález bylo rozšířeno vyšetření bílkovin (tab. 3). Základní parametry, albumin a celková bílkovina, byly bez větších odchylek od normy. Imunofixační elektroforéza neprokázala kompletní molekulu monoklonálního imunoglobulinu, ale prokázala přítomné monoklonální volné lehké řetězce λ, a to jak v krvi, tak i v moči. Speciální metodou pro stanovení volných lehkých řetězců v krvi byla prokázána velmi vysoká hodnota volných lehkých řetězců λ, přesahující horní hranici pro kvantitativní stanovení, proto v tab. 3 uvádíme vyšší než 4 500 mg/ l.
Tab. 3. Základní a rozšířené vyšetření bílkovin provedené po obdržení výsledku biopsie ledviny. 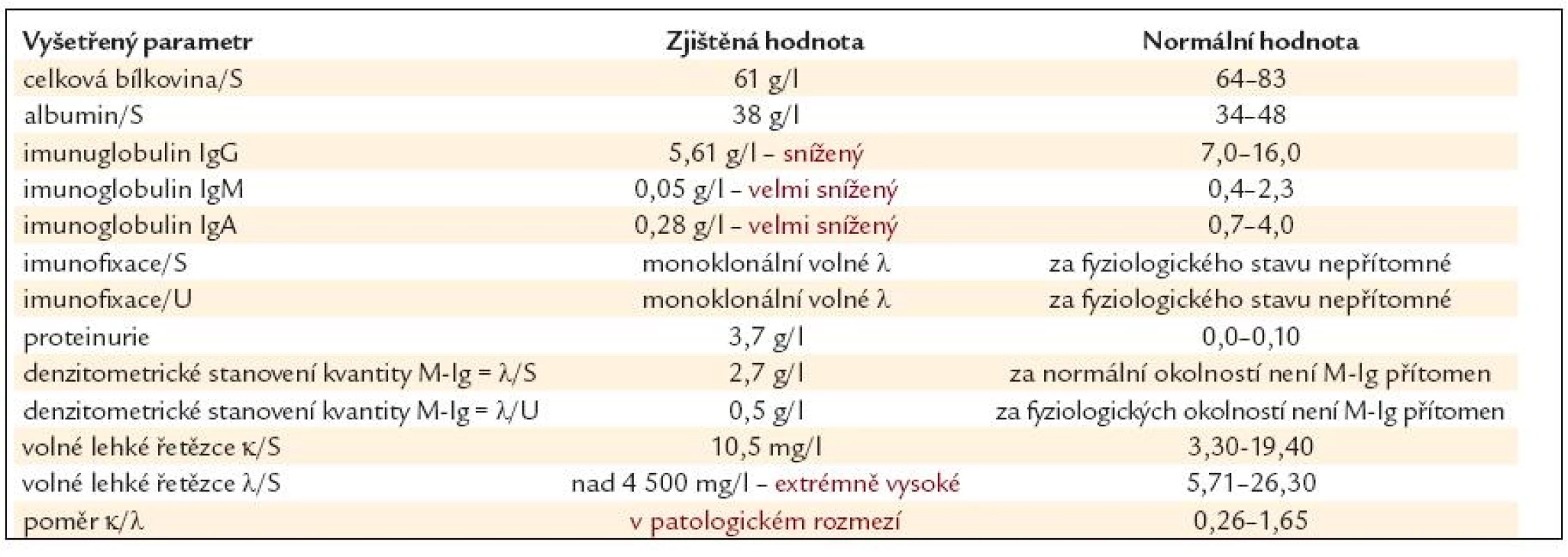
Přítomnost monoklonálního imunoglobulinu budí vždy podezření na mnohočetný myelom. Proto byla provedena sternální punkce. Trepanobiopsii jsme po komplikace s perirenálním krvácením považovali za příliš rizikovou z hlediska dalšího krvácení. Cytologické a flowcytometrické vyšetření aspirátu kostní dřeně nepotvrdilo patologické navýšení počtu plazmocytů, i když jejich morfologie nebyla zcela normální. Dle flowcytometrie byla kostní dřeň masivně infiltrována buňkami B-CLL.
Po provedené biopsii ledviny byla pacientka dále závislá na chronickém dialyzačním programu. Pacientka měla mimo selhání ledvin a B-CLL také ischemickou nemoc srdeční a chlopenní vadu – klinicky závažnou aortální stenózu. Při první hemodialýze a pak v následujících dnech měla paroxyzmy fibrilace síní reagující na nitrožilně podaný amiodaron, ten byl proto nasazen do trvalé perorální medikace. Při jedné z dalších dialýz došlo k zástavě srdce. Okamžitá resuscitace sice obnovila oběh, byla však nutná dlouhodobá umělá plicní ventilace. K popsanému závažnému stavu se přidala pneumonie a této infekční komplikaci pacientka podlehla.
Diskuze
Přehled krevních chorob, které mohou poškozovat ledviny
Na otázku, která onemocnění krvetvorby mohou poškodit ledviny, se obvykle vynoří z paměti jen jedno onemocnění, mnohočetný myelom. Život, a tím i nemoci, které jej komplikují, jsou však nepřeberně pestré, a tak je pravda, že existuje mnohem více hematologických chorob, které mohou poškozovat ledviny.
První skupinou krevních onemocnění, které pravidelně poškozují ledviny, jsou trombotické mikroangiopatie, obvykle provázené mikroangiopatickou hemolytickou anémií [8].
Druhá skupina krevních nemocí, které poškozují ledviny, zahrnuje zejména hypereozinofilní syndrom [9].
Třetí skupinu tvoří choroby, které často či méně často tvoří monoklonální imunoglobulin [10–12] (tab. 4).
Tab. 4. Krevní nemoci, které vedou poškození ledviny. 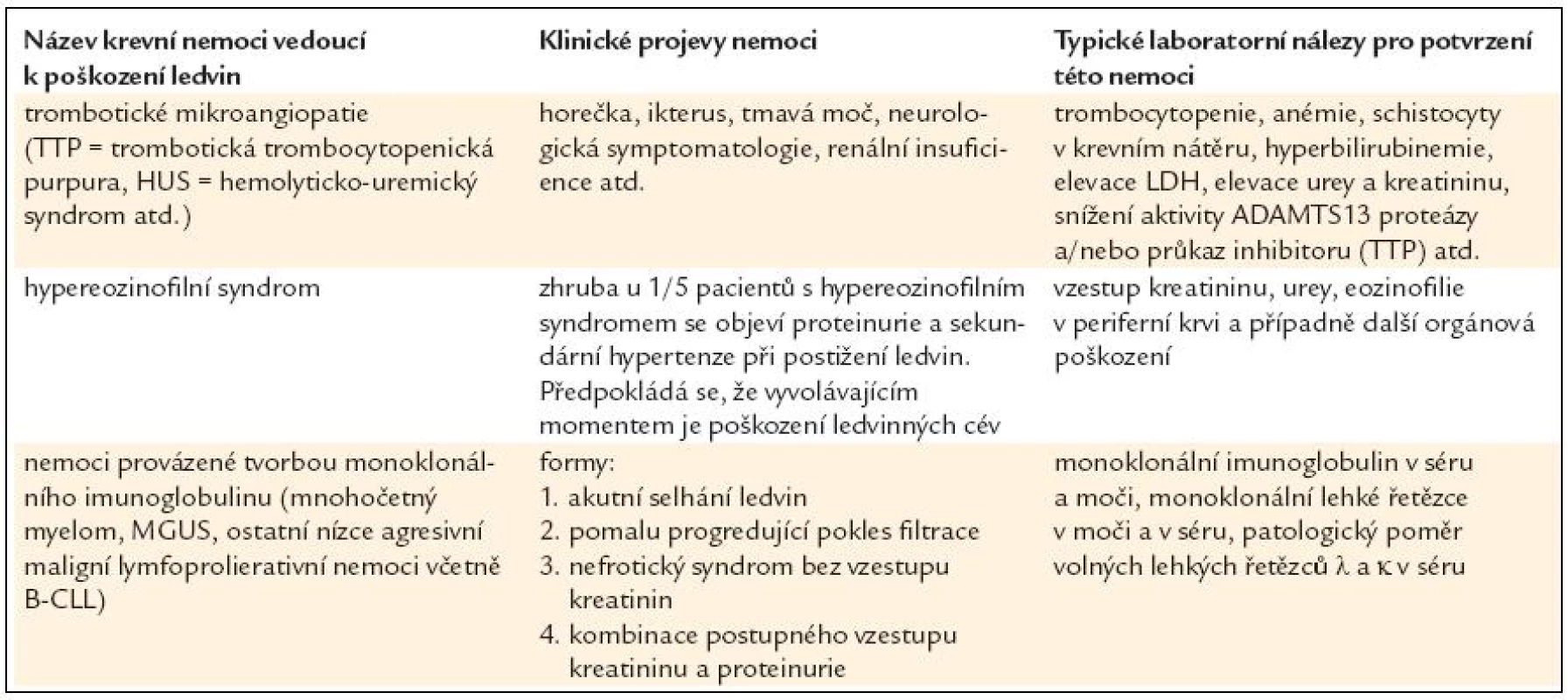
Proč fyziologické imunoglobuliny nepoškozují ledviny, zatímco monoklonální imunoglobuliny mohou poškozovat ledviny i jiné orgány?
Odlišnost monoklonálního a fyziologického imunoglobulinu
Fyziologické imunoglobuliny pomáhají lidem přežít, brání jejich těla před invazí mikroorganizmů z vnějšího prostředí. Tyto fyziologické imunoglobuliny, produkované zdravým organizmem, nepoškozují ledviny ani jiné tkáně. O něco odlišnější je situace u autoimunitních chorob, ale v tom případě již imunoglobuliny nejsou tvořeny zdravým organizmem.
Monoklonální imunoglobulin je tvořen klonem plazmocytů neboli plazmocyty, jejichž proliferace se vymkla fyziologické regulaci, takže proliferují nezávisle na potřebách imunitního systému. To, že se tento klon vymknul fyziologické regulaci, je způsobeno určitými genetickými změnami, které vedly k tomu, že změněný plazmocyt nastoupil na cestu autonomní benigní nebo maligní proliferace. A s těmito klonogenními genetickými změnami mohou být spojeny změny ve struktuře imunoglobulinu (monoklonálního imunoglobulinu), který je tvořen autonomním klonem plazmocytů.
Klonální plazmatické buňky mohou produkovat:
- buď kompletní molekulu monoklonálního imunoglobulinu
- nebo kompletní molekulu monoklonálního imunoglobulinu a současně ve zvýšené míře i volné monoklonální lehké řetězce
- anebo pouze monoklonální lehké řetězce
- a jen zcela výjimečně se stávají nesekrečními.
Kompletní molekula monoklonálního imunoglobulinu ve většině případů není zaměřena proti žádnému antigenu vlastního těla, ale jsou výjimky, kdy kompletní molekula je zaměřená proti určitým tělesným antigenům, a tím monoklonální imunoglobulin poškozuje tělo nemocného.
Monoklonální lehké řetězce mohou být fyziologické anebo mohou mít různě změněnou molekulu. To, zda tyto monoklonální lehké řetězce poškodí organizmus, pak záleží na formě aberace jejich molekuly. Tyto aberace jsou zodpovědné za to, že tyto lehké řetězce mají tendenci se ukládat v tom či onom orgánu (orgánový tropizmus). Odchylky ve struktuře monoklonálního lehkého řetězce jsou zodpovědné také za to, zda se ukládají ve formě lineární struktury amyloidových depozit nebo ve struktuře amorfních depozit, či zda se ukládají ve formě krystalů, které jsou fagocytovány histiocyty [10,11].
Dva parametry, na nichž závisí tvorba odlitkových válců v ledvině z monoklonálního lehkého řetězce
V případech poškození ledviny tvorbou odlitkových válců v tubulech ledvin je zřejmé, že rychlost tvorby odlitkových válců závisí na dvou parametrech:
- na výši koncentrace volných lehkých řetězců v tubulech,
- ale také na chemické struktuře lehkého řetězce, zda má vysokou či nízkou tendenci vytvářet odlitkové válce.
Tím se vysvětluje, proč někteří pacienti mají intenzivní produkci monoklonálních lehkých řetězců, gramové odpady monoklonálních lehkých řetězců močí za 24 hod a vysoké plazmatické hladiny volných lehkých řetězců, a přesto u nich nevznikne poškození ledvin, zatímco jiní mají málo intenzivní tvorbu monoklonálních lehkých řetězců a přece k poškození ledvin dojde.
Tím chceme zdůraznit, že určitá odchylka ve struktuře monoklonálního imunoglobulinu vede k poškození ledviny nezávisle na tom, zda je produkována benigním nebo maligním klonem [10,11].
Které choroby jsou spojeny s tvorbou monoklonálního imunoglobulinu?
Některé lymfoproliferativní nemoci produkují monoklonální imunoglobulin pravidelně, jiné typy maligních lymfoproliferativních onemocnění produkují monoklonální imunoglobulin vzácně.
Krevní nemoci s pravidelnou tvorbou monoklonálního imunoglobulinu
Tvorba monoklonálního imunoglobulinu (buď kompletní molekuly, nebo jenom lehkých řetězců) je typická pro mnohočetný myelom a monoklonální gamapatii nejistého původu (monoclonal gammopathy of undetermined significance – MGUS), dříve se pro ni používal termín benigní gamapatie.
Lymfoplazmocytární lymfom (histologický pojem) s tvorbou monoklonálního imunoglobulinu typu IgM tvoří jednotku zvanou Waldenströmova makroglobulinemie.
Krevní nemoci ojediněle provázené tvorbou monoklonálního imunoglobulinu
Sem patří všechny nízce agresivní (indolentní) B-lymfoproliferativní nemoci, chronická B-lymfocytární leukemie, folikulární lymfom či lymfom marginálního zóny a další. A pokud je u těchto nízce agresivních maligních lymfoproliferativních chorob monoklonální imunoglobulin přítomen, může poškozovat organizmus podobným způsobem, jako je tomu u mnohočetného myelomu [13–15].
Nepříznivý prognostický význam volných lehkých řetězců imunoglobulinů u B-CLL
Dle posledních prací má přítomnost monoklonálních volných lehkých řetězců imunoglobulinů u pacientů s B-CLL nepříznivý prognostický význam [16–19], což jen zdůrazňuje přínos jejich vyšetřování.
Společný výskyt B-CLL plazmocelulární proliferace typu mnohočetného myelomu
B-CLL se někdy může transformovat do difuzního velkobuněčného lymfomu, který má obvykle pak špatnou prognózu (Richterův syndrom). To je obecně známé.
Fakt také ale je, že jsme na našem pracovišti pozorovali přechody B-CLL v mnohočetný myelom, případně u pacientky dlouhodobě léčené pro B-CLL vznik mnohočetného myelomu, jeho remisi po léčbě a posléze progresi B-CLL. Popisy nemocných se souběhem B-CLL a mnohočetného myelomu jsme zatím nezveřejnili.
Popis patofyziologického mechanizmu, proč tomu tak je, jsme v literatuře nenašli, i když v literatuře jsou četné zprávy o společném výskytu těchto chorob či o jejich přechodech u jednoho pacienta [20]. Patofyziologický mechanizmus této souvislosti přesně neznáme, obě nemoci, ačkoliv mají odlišný morfologický nález v kostní dřeni, mají následující společné znaky:
- postupně se prohlubující deficit B-buněčné imunity, a tedy postupně se snižující koncentrace fyziologických imunoglobulinů; tento jev není u ostatních maligních lymfoproliferací tak zřetelný,
- obě choroby (B-CLL i mnohočetný myelom) mohou způsobovat osteolýzu.
Pro rozhodnutí, zda jde o souběh B-CLL s mnohočetným myelomem, arbitrárně vyžadujeme splnění oficiálních kritérií pro tyto nemoci. V případě, kdy u pacienta s B-CLL není splněno arbitrární kritérium mnohočetného myelomu, hodnotíme formálně stav jako B-CLL s tvorbou monoklonálního imunoglobulinu.
Adherencí k publikovaným diagnostických kritériím si vynahrazujeme nedostatečné patofyziologické pochopení tohoto jevu a nedostatek laboratorních postupů pro diagnostiku nejčasnějších stadií nemoci.
V popsaném případě byly nápadné atypické plazmocyty v kostní dřeni, ačkoliv jejich počet nesplnil klasické 10% Durieho a Salomonovo kritérium. Rádi bychom znali histologii kostní dřeně s výsledkem analýzy klonality plazmocytů, ale provedení trepanobiopsie jsme považovali za rizikové.
Zbývá zde ještě možnost flowcytometrického hodnocení plazmocytů a to také neprokázalo mnohočetný myelom.
Poškození ledvin u pacientů s B-CLL
Poškození ledvin u pacientů s B-CLL není vůbec výjimečnou situací, jak vyplývá z citované literatury. Pokud je přítomen monoklonální imunoglobulin, může být ledvina těchto pacientů poškozená touto bílkovinou stejně jako u pacientů s mnohočetným myelomem [10–12]. Ale i v případě, že monoklonální imunoglobulin přítomen není, může k renálnímu selhání dojít na podkladě infiltrace ledviny buňky B-CLL [21–36].
Vyšetření, z nichž lze nepřímo usuzovat na přítomnost monoklonálního imunoglobulinu
V případech, kdy vyšetřujeme kvantitu imunoglobulinů IgG, IgA a IgM, můžeme na přítomnost monoklonálního imunoglobulinu usoudit, pokud je koncentrace jednoho imunoglobulinu (např. koncentrace celkového IgG) vysoce nad fyziologickou hranicí, zatímco koncentrace IgA a IgM je pod fyziologickou hranicí. Také hodnota celkové bílkoviny výrazně přesahující horní hranici normy je vysoce suspektní z přítomnosti kompletní molekuly monoklonálního imunoglobulinu.
Popisovaná pacientka však měla sníženou koncentraci imunoglobulinů IgG, IgA i IgM (tab. 1). Jak lze tento biochemický nález interpretovat? Snížení koncentrace všech 3 základních tříd imunoglobulinů může signalizovat:
- primární deficit imunity, a je-li tomu opravdu tak, pak by tento pacient měl být monitorován klinickými imunology,
- anebo sekundární supresi B imunitní odpovědi typicky provázející B-CLL. Pak to může znamenat již symptomatickou nemoc a nutnost hematologické léčby. Na přítomnost B-CLL by měla upozornit lymfocytóza v krevním obraze.
- třetím vysvětlením pro biochemický nález snížení všech tříd vyšetřovaných imunoglobulinů (IgG, IgM, IgA) je mnohočetný myelom, který tvoří pouze monoklonální lehké řetězce a má pro myelom typický útlum tvorby všech fyziologických imunoglobulinů.
Proto klinický imunolog u pacienta se sníženým hodnotami imunoglobulinů typu IgG, IgM a IgA musí myslet nejen na primární deficit imunity, ale také na uvedené maligní krevní nemoci.
Vyšetření, která prokazují přítomnost monoklonálních imunoglobulinů v séru a v moči
Při odchylce kvantity obvykle vyšetřovaných imunoglobulinů (IgA, IgA, IgM) od normálních hodnot či při jakémkoliv dalším podezření na přítomnost monoklonálního imunoglobulinu je nutné provést cílené vyšetření na detekci monoklonálního imunoglobulinu:
- imunofixační elektroforézu moče,
- imunofixační elektroforézu séra
- a při pozitivitě denzitometrické stanovení kvantity monoklonálního imunoglobulinu v moči a v séru
- kvantitativní vyšetření koncentrace volných lehkých řetězců v séru.
Tyto speciální vyšetřovací metody nejsou automatizovány, výsledek vždy závisí také na hodnotícím biochemikovi. Proto je žádoucí provádět tato vyšetření ve specializovaných laboratořích s vysokou zkušeností s interpretací nálezů. A hlavně, pokud se sleduje dynamika koncentrace monoklonálního imunoglobulinu, měla by být vyšetření prováděna v jedné laboratoři!
Je prokázán monoklonální imunoglobulin. A co dále?
Pokud se prokáže přítomnost monoklonálního imunoglobulinu a současně je přítomno poškození ledvin, je nutno uvažovat o příčinné souvislosti. Formy poškození ledvin monoklonálním imunoglobulinem byly ve Vnitřním lékařství opakovaně popsány, a proto na ně pouze odkazujeme [10–12].
To, že je ledvina poškozena některou z forem depozit monoklonálního imunoglobulinu, může jednoznačně prokázat pouze patolog na základně biopsie ledviny.
U pacientů s progredujícím mnohočetným myelomem s poškozením ledvin není bezpodmínečně nutné ověřovat poškození ledvin biopsií
U pacienta s progredujícím myelomem a s progresí poškození ledvin lze z vývoje nemoci nepřímo soudit na souvislost mezi gamapatií a poškozením ledvin, bez nutnosti ověřovat biopsií ledviny tuto domněnku. V tomto případě je léčba indikována léčba pro progresi mnohočetného myelomu a ověření typu poškození ledviny biopsií je možné, ale většinou není nezbytné.
U monoklonální gamapatie nejistého významu (MGUS) s poškozením ledvin je vhodné ověřit příčinu poškození ledvin biopsií
Naopak je tomu v případě pacientů s benigní proliferací plazmocytů typu MGUS, u nichž se objeví poškozením ledvin. V těchto případech je vhodné provedení biopsie ledviny, aby se prokázalo, zda je ledvina poškozena monoklonálním imunoglobulinem, nebo zda nefropatie má zcela jiné příčiny. MGUS je hodnocen jako laboratorní odchylka a ne jako nemoc vyžadující léčbu. Léčba MGUS je indikována pouze v případech, kdy monoklonální imunoglobulin, tvořený benigním klonem plazmocytů, poškozuje organizmus. V těchto případech potenciální přínos z adekvátní léčby převáží rizika biopsie ledviny.
A biopsie ledviny u ostatních maligních lymfoproliferativních chorob s monoklonální gamapatií a poškozením ledviny, tedy v případě naší pacientky s B-CLL?
V těchto případech záleží na zvážení potenciálního přínosu biopsie ledviny pro rozhodování o léčebné intervenci, o nutnosti chemoterapie nebo o jiné léčbě poškození ledviny. Pomocníkem pro rozhodnutí o zahájení léčby může být časová souvislost vývoje hodnot kreatininu v séru a renální filtrace a kvantity monoklonálního imunoglobulinu. Pokud je jasná souvislost, je možné podat odpovídající chemoterapii, zvláště pokud se i ostatní parametry blíží k definici symptomatického onemocnění, tedy k indikaci pro chemoterapeutickou léčbu nízce agresivní lymfoproliferace.
Pokud není tato souvislost doložitelná, jak tomu bylo v našem případě, je vhodné provedení biopsie ledviny v rámci široké diferenciální diagnostiky všech možností poškození ledvin.
Námi popsaná pacientka měla 8 let stabilní formu B-CLL bez poklesu hemoglobinu pod 100 g/ l či poklesu trombocytů pod 100 × 109/ l a bez naplnění dalších obecně platných indikací k léčbě B-CLL. Nerozpoznaná však byla tvorba volných lehkých řetězců λ poškozujících ledviny. Tato skutečnost by byla jednoznačnou indikací k léčbě B-CLL. Po časně potlačené tvorbě monoklonálních lehkých řetězců se postupně reparují orgánová poškození a po několika měsících od vymizení monoklonálních lehkých řetězců se obvykle zlepšují funkce ledvin, dochází k takzvané orgánové léčebné odpovědi.
Závěry pro praxi
- U všech nízce agresivních B-lymfoproliferativních chorob (chronická B-lymfocytární leukemie a další) může být přítomna tvorba monoklonálního imunoglobulinu.
- Pokud není vyšetření přítomnosti monoklonálního imunoglobulinu (imunofixační elektroforéza v krvi a v moči a vyšetření kvantity volných lehkých řetězců v séru) prováděno u všech nízce agresivních B-lymfoproliferativních chorob, je nutné je provést ve všech případech s nejasným orgánovým poškozením (ledviny, zažívací trakt, srdce atd.).
- Forma poškození organizmu monoklonálním imunoglobulinem tedy nezávisí na proliferační charakteristice, čili na tom, zda jde o benigní či o maligní plazmocelulární populaci, ale pouze na strukturálních odlišnostech monoklonálního imunoglobulinu či monoklonálního lehkého řetězce.
- Pokud se prokáže poškození organizmu monoklonálním imunoglobulinem, je indikována léčba s cílem eradikovat tvorbu tohoto monoklonálního imunoglobulinu, nezávisle na tom, zda je tento pro organizmus toxický monoklonální imunoglobulin tvořen benigním nebo maligním klonem z hlediska proliferační charakteristiky plazmocytů.
- Vyšetření přítomnosti monoklonálního imunoglobulinu v moči a v krvi by mělo být provedeno časně v rámci diferenciální diagnostiky příčin poškození ledviny a ve vybraných připojit i biopsii ledviny.
Tato publikace byla připravena v rámci projektu MUNI/A/1012/2009 s názvem „Optimalizace diagnostiky a terapie maligních chorob a komplikací, které tyto maligní nemoci provázejí, s využitím nových molekulárně biologických metod“, a také je součástí aktivit v rámci grantů IGA MZ: NR9225, NS10387 a NS10406 a projektu CRAB České myelomové skupiny.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.czDoručeno do redakce: 18. 10. 2010
Přijato po recenzi: 1. 12. 2010
Zdroje
1. Krejčí M, Adam Z, Pour L et al. Chronická B-lymfatická leukemie a jí podobné stavy. Vnitř Lék 2009; 55 : 746–766.
2. Mayer J, Doubek M, Brychtová Y et al. Využití rituximabu v léčbě chronické lymfatické leukemie. Klin Onkol 2003; 16 : 178–183.
3. Panovská A, Doubek M, Brychtová Y et al. Chronic lymphocytic leukemia and focusing on epidemiology and management in everyday hematologic practice: recent data from the Czech Leukemia Study Group for Life (CELL). Clin Lymphoma Myeloma Leuk 2010; 10 : 297–300.
4. Papajík T, Jarošová M, Pikalová Z et al. Chronická B-lymfocytární leukemie. Část II. Diagnostická kritéria a význam stanovení individuální prognózy nemocného. Transfuze Hematol Dnes 2006; 12 : 132–139.
5. Papajík T, Jarošová M, Plachý R et al. Chronická B-lymfocytární leukemie. Část I. Pohled na původ, biologii a genetické změny leukemických buněk. Transfuze Hematol Dnes 2006; 12 : 53–61.
6. Papajík T, Urbanová R, Kubová Z et al. Chronická B-lymfocytární leukemie. Část IV. Možnosti léčby s použitím monoklonálních protilátek alemtuzumabu a rituximabu. Transfuze Hematol Dnes 2007; 13 : 48–55.
7. Papajík T, Urbanová R, Procházka V et al. Chronická B-lymfocytární leukemie. Část III. Současné konvenční možnosti primární léčby. Transfuze Hematol Dnes 2006; 12 : 249–256.
8. Kořístek Z. Trombotické mikroangiopatie. In: Penka M, Buliková A et al (eds). Neonkologická hematologie. Praha: Grada Publishing 2009.
9. Adam Z, Tomíška M, Krejčí M et al. Diferenciální diagnostika eozinofilie. Vnitř Lék 2009; 55 (Suppl 1): S125–S144.
10. Adam Z, Pour L, Krejčí M et al. Poškození ledvin při mnohočetném myelomu a dalších monoklonálních gamapatiích. Vnitř Lék 2008; 54 : 847–861.
11. Adam Z, Krejčí M, Tichý M et al. Léčba selhání ledvin u mnohočetného myelomu. Vnitř Lék 2009; 55 : 570–582.
12. Adam Z, Nedbálková M, Krejčí M et al. Více než 10 let trvající kompletní remise monoklonální gamapatie nejistého významu a vymizení nefrotického syndromu vzniklého na podkladně light chain depositon disease po léčbě vinkristinem, adriamycinem a vysokými dávkami dexametazu (VAD). Vnitř Lék 2010; 56 : 240–247.
13. Noel P, Kyle RA. Monoclonal proteins in chronic lymphocytic leukemia. Am J Clin Pathol 1987; 87 : 385–388.
14. Pezzoli A, Pascali E. Monoclonal Bence Jones proteinuria in chronic lymphocytic leukaemia. Scand J Haematol 1986; 36 : 18–24.
15. Deegan MJ, Abraham JP, Sawdyk M et al. High incidence of monoclonal proteins in the serum and urine of chronic lymphocytic leukemia patients. Blood 1984; 64 : 1207–1211.
16. Yegin ZA, Ozkurt ZN, Yağci M. Free light chain: a novel predictor of adverse outcome in chronic lymphocytic leukemia. Eur J Haematol 2010; 84 : 406–411.
17. Pratt G, Harding S, Holder R et al. Abnormal serum free light chain ratios are associated with poor survival and may reflect biological subgroups in patients with chronic lymphocytic leukaemia. Br J Haematol 2009; 144 : 217–222.
18. Martin W, Abraham R, Shanafelt T et al. Serum-free light chain-a new biomarker for patients with B-cell non-Hodgkin lymphoma and chronic lymphocytic leukemia. Transl Res 2007; 149 : 231–235.
19. Bakshi NA, Gulbranson R, Garstka D et al. Serum free light chain (FLC) measurement can aid capillary zone electrophoresis in detecting subtle FLC-producing M proteins. Am J Clin Pathol 2005; 124 : 214–218.
20. Aktan M, Akkaya A, Doğan O et al. Chronic lymphocytic leukemia and multiple myeloma in the same patient: case report. Leuk Lymphoma 2003; 44 : 1421–1424.
21. Preud’homme JL, Bauwens M, Dumont G et al. Cast nephropathy in mu heavy chain disease. Clin Nephrol 1997; 48 : 118–121.
22. Al-Jehani F, Alsousou J, Gover P. Nephrotic syndrome associated with chronic lymphocytic leukaemia. Hematology 2004; 9 : 401–403.
23. Comerma-Coma MI, Sans-Boix A, Tuset-Andújar E et al. Reversible renal failure due to specific infiltration of the kidney in chronic lymphocytic leukaemia. Nephrol Dial Transplant 1998; 13 : 1550–1552.
24. Erten N, Saka B, Caliskan YK et al. Acute renal failure due to leukaemic infiltration in chronic lymphocytic leukaemia: case report. Int J Clin Pract Suppl 2005; 147 : 53–55.
25. Ferreira AC, Brum S, Carvalho D et al. Renal dysfunction due to leukemic infiltration of kidneys in a case of chronic lymphocytic leukemia. Hemodial Int 2010; 14 : 87–90.
26. Hadj-Moussa M, Brown JA. Reversible renal insufficiency secondary to extrinsic splenic compression of the kidney in a patient with chronic lymphocytic leukemia. Scientific World Journal 2010; 10 : 796–798.
27. Hewamana S, Pepper C, Jenkins C et al. Acute renal failure as the presenting feature of leukaemic infiltration in chronic lymphocytic leukaemia. Clin Exp Nephrol 2009; 13 : 179–181.
28. Kamat AV, Goldsmith D, O’Donnell P et al. Renal failure with granulomatous interstitial nephritis and diffuse leukemic renal infiltration in chronic lymphocytic leukemia. Ren Fail 2007; 29 : 763–765.
29. Kiewe P, Tepel M, Loddenkemper C et al. Extensive leukemic kidney infiltration with membranoproliferative glomerulonephritis in a patient with B-cell chronic lymphocytic leukemia. Ann Hematol 2007; 86 : 691–692.
30. Lentaigne C, Craig C, Cwynarski K et al. Chronic lymphocytic leukemia can cause acute renal failure even in early stage patients. Leuk Lymphoma 2010; 51 : 333–334.
31. Martinez-Vea A, Herranz MJ, Llorente A et al. Acute renal failure with chronic lymphocytic leukaemia. Postgrad Med J 1996; 72 : 763–765.
32. Nasr SH, Snyder RW, Bhagat G et al. Chronic lymphocytic leukemia and cryoglobulinemic glomerulonephritis. Kidney Int 2007; 71 : 93.
33. Rockx MA, Rizkalla K, Clark WF. Acute renal failure and chronic lymphocytic leukaemia. Nephrol Dial Transplant 2008; 23 : 770–771.
34. Rosado MF, Morgensztern D, Abdullah S et al. Chronic lymphocytic leukemia-associated nephrotic syndrome caused by focal segmental glomerulosclerosis. Am J Hematol 2004; 77 : 205–206.
35. Vilayur E, Trevillian P, Walsh M. Monoclonal gammopathy and glomerulopathy associated with chronic lymphocytic leukemia. Nat Clin Pract Nephrol 2009; 5 : 54–58.
36. Da’as N, Polliack A, Cohen Y et al. Kidney involvement and renal manifestations in non-Hodgkin’s lymphoma and lymphocytic leukemia: a retrospective study in 700 patients. Eur J Haematol 2001; 67 : 158–164.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Chronická tromboembolická plicní hypertenze – editorial
- Výskyt infekční endokarditidy a některé problémy její diagnostiky – editorial
- Genetická determinace věku diagnózy diabetes mellitus 2. typu? Revidovaná koncepce „střádavého genotypu“ – editorial
- Pankreatický karcinom – vztah k diabetes mellitus a kouření – editorial
- Význam a možnosti screeningu v diagnostice celiakie – editorial
- Diagnostika a léčba BCR/ABL-negativních myeloproliferativních onemocnění – editorial
- Chronická tromboembolická pľúcna hypertenzia v spádovej nemocnici
- Endokarditidy 2007: Výsledky multicentrické studie o výskytu a vlastnostech infekční endokarditidy
- Vzťah polymorfizmov génov CDKAL1 a KCNQ1 k veku diagnózy diabetu 2. typu v populácii Slovenska
- Pankreatický karcinom – vztah k diabetes mellitus a kouření
- Alkoholová kardiomyopatia – diagnóza stále aktuálna
- Hodnotenie kvality života a funkčného stavu u pacientov s reumatoidnou artritídou
- Bikuspidální aortální chlopeň – etiopatogeneze a přirozený vývoj
- Význam a možnosti skríningu v diagnostike celiakie
- Diagnostika a léčba BCR/ABL-negativních myeloproliferativních onemocnění – principy a východiska doporučení CZEMP
- Selhání ledvin u pacientky s chronickou B-lymfocytární leukemií (B-CLL) vzniklé na podkladě tvorby odlitkových válců v tubulech ledvin z monoklonálních volných lehkých řetězců (cast nephropathy). Přínos stanovení volných lehkých řetězců imunoglobulinů pro
- Profesor Pavel Bravený jubilant
- Nedožité devadesátiny prof. MUDr. Jiřího Šonky, DrSc.
- Haškovcová H. Fenomén stáří (vydání druhé, podstatně přepracované a doplněné). Praha: Havlíček Brain Team 2010, 365 s. ISBN 978-80-87109-19-9.
- Češka R et al. Interna 1. vydání. Praha/Kroměříž: Triton 2010, 855 stran. ISBN: 978-80-387-423-0.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Bikuspidální aortální chlopeň – etiopatogeneze a přirozený vývoj
- Alkoholová kardiomyopatia – diagnóza stále aktuálna
- Diagnostika a léčba BCR/ABL-negativních myeloproliferativních onemocnění – principy a východiska doporučení CZEMP
- Hodnotenie kvality života a funkčného stavu u pacientov s reumatoidnou artritídou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



