-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Infekce močového traktu a chronické selhání ledvin
Urinary tract infections and chronic renal failure
The paper briefly summarizes issues related to urinary tract infections in adults:
predispositions and risk factors, classification, assessment of pathogenicity of bacterial agents, the role of bacteriuria and leucocyturia, interpretation of findings, treatment principles and an association with chronic renal failure. Urinary tract infections are the second most frequent infectious disease in the population. They most often affect women of childbearing potential and then seniors of both sexes who have multiple risk factors. Escherichia coli and Staphylococcus saprophyticus are the most pathogenic towards urinary tract; they are responsible for 85% and 10–15% of cases of acute uncomplicated urinary infections, respectively. Chronic pyelonephritis, a chronic interstitial nephritis, is the fourth most frequent cause of chronic renal failure. Chronic renal failure is a risk factor for the development of urinary infections due to metabolic disorders resulting in secondary immunodeficiency with a disorder of all components of immunity. In patients with chronic renal failure, urinary tract infections occur most frequently after kidney transplantation when graft pyelonephritis is a life-threatening complication. Therefore, urinary tract infection prevention with co-trimoxazole once daily over at least 6 months is recommended in renal allograft recipients.Key words:
urinary tract infections – pathogenicity of bacterial agents – significant bacteriuria – significant leucocyturia – chronic renal failure – renal transplantation
Autoři: D. Sobotová
Působiště autorů: II. interní klinika Lékařské fakulty MU a FN u sv. Anny v Brně, přednosta prof. MUDr. Miroslav Souček, CSc.
Vyšlo v časopise: Vnitř Lék 2011; 57(7&8): 626-630
Kategorie: 136. internistický den, XXIV. Vanýskův den, Brno 2011
Souhrn
Článek stručně shrnuje problematiku infekcí močového traktu u dospělých:
predispoziční a rizikové faktory, dělení, hodnocení patogenity bakteriálních původců, závažnost bakteriurie a leukocyturie, interpretaci nálezů, zásady léčby a vztah k chronickému selhání ledvin. Infekce močového traktu jsou druhou nejčastější infekcí v populaci. Nejvíce postihují ženy ve fertilním věku a poté seniory obou pohlaví, u kterých se kumulují rizikové faktory. Nejvyšší stupeň patogenity vůči močovému traktu vykazují Escherichia coli a Staphylococcus saprophyticus, odpovídající za 85, resp. 10–15 % případů akutních nekomplikovaných močových infekcí. V žebříčku nejčastějších příčin chronického selhání ledvin je chronická pyelonefritida v rámci skupiny chronických intersticiálních nefritid na 4. místě. Chronické selhání ledvin je rizikovým faktorem pro vznik močových infekcí v důsledku metabolických poruch, jejichž následkem je sekundární imunodeficit s narušením všech složek imunity. U osob s chronickým selháním ledvin jsou infekce močového traktu nejčastější po transplantaci ledviny, kdy představuje pyelonefritida štěpu život ohrožující komplikaci. U příjemců ledvinového štěpu se proto doporučuje profylaxe močových infekcí co-trimoxazolem v jedné denní dávce po dobu nejméně 6 měsíců.Klíčová slova:
infekce močového traktu – patogenita bakteriálních původců – signifikantní bakteriurie – signifikantní leukocyturie – chronické selhání ledvin – transplantace ledvinyDefinice
Infekce močového traktu (IMT) jsou zánětlivá onemocnění močového ústrojí způsobená patogenními mikroorganizmy. Z anatomického hlediska jde o infekce:
- vývodných močových cest (močová roura, močový měchýř, močovody),
- ledvin,
- sousedících tkání (prostata, peri - a pararenální tkáň).
IMT jsou druhou nejčastější infekcí v populaci, hned za infekcemi dýchacích cest.
Predispoziční a rizikové faktory
- anatomické odchylky močového ústrojí, vrozené či získané,
- ženské pohlaví (krátká močová roura ústící v blízkosti poševního vchodu a anusu, také tzv. tanga, která působí jako cizorodé spojení mezi těmito vyústěními),
- metabolické a hormonální změny (zejména cukrovka, těhotenství, postmenopauza, snížená funkce ledvin),
-
fertilní věk u žen (20–40 let)
a seniorský věk u obou pohlaví, kdy se uplatňují:
- získané poruchy transportu moči v dolních močových cestách (u mužů nejčastěji při hyperplazii a nádoru prostaty, u žen následkem ochablosti pánevního svalstva, spojené s různým stupněm inkontinence, nebo obstrukcí po gynekologických operacích a radiační léčbě),
- neurogenní měchýř (u neurologických onemocnění specifických pro vyšší věk – cerebrovaskulární příhody, Alzheimerova demence, Parkinsonova nemoc),
- retence moči v důsledku medikace (některá antidepresiva, sedativa),
- u žen snížená produkce estrogenů, u mužů snížená baktericidní aktivita prostatického sekretu,
- hygienická nedostatečnost (omezená pohyblivost, porucha motorické koordinace, nesoběstačnost, ztráta náhledu),
- časté hospitalizace nebo pobyt v pečovatelských zařízeních (nozokomiální infekce),
- cizí materiály v odvodných močových cestách (stenty, katetry).
- imunodeficience, zejména získaná (imunosuprese, chronické selhání ledvin),
- rizikové sexuální chování [1,2].
Diagnóza je souhrnem příznaků močových a klinických.
Močový syndrom
- průkaz patogenu v moči v signifikantním množství,
- významná leukocyturie,
- hematurie – může scházet či být mikro - nebo makroskopická, důležitá je izomorfie erytrocytů, která svědčí o původu z dolních močových cest.
Klinické příznaky závisí na anatomické lokalizaci močové infekce a jejím trvání, mohou ale i zcela scházet (asymptomatická bakteriurie).
- příznaky IMT dolního typu: strangurie, urgence, polakisurie, cystalgie, postmikční tenezmy, výtok z močové roury, bolesti v podbřišku, palpační bolestivost nad symfýzou;
- příznaky IMT horního typu: bolest v bederní krajině nebo podžebří a celkové příznaky (teplota, zimnice, třesavka, nauzea, zvracení, bolest hlavy).
Dělení
Podle etiologického agens: infekce bakteriální, virové, plísňové, parazitární a sexuálně přenosné.
Podle anatomické lokalizace:
- infekce dolního močového traktu, které jsou slizničního typu (uretritida, cystitida),
- infekce horního močového traktu, spojené s invazí do tkání (prostatitida, pyelonefritida, perirenální a pararenální absces).
Podle časového průběhu:
- akutní – ojedinělé nebo opakované (relaps, reinfekce, superinfekce),
- chronické, akutně exacerbující.
Podle preexistujících anomálií močového traktu:
- nekomplikované (močový trakt anatomicky a funkčně bez patologie),
- komplikované v opačném případě.
Podle prostředí, ve kterém k IMT došlo:
- komunitní,
- nozokomiální.
Vyšetřovací metody
Základní: moč + sediment a kultivace moči; při celkových příznacích FW krevní obraz, hemokultivace, CRP, základní biochemické vyšetření.
Zobrazovací metody: sonografie, počítačová tomografie, vylučovací nebo ascendentní urografie, speciální vyšetření při podezření na virové, atypické, oportunní, mykotické nebo parazitární infekce a TBC.
Kdy je bakteriurie signifikantní?
Při hodnocení bakteriurie zohledňujeme patogenitu mikrobiologického agens, metodu odběru močového vzorku (střední proud moči do sterilní nádobky, z močového katetru, suprapubická punkce), pohlaví a přítomnost klinické symptomatologie, která má velkou váhu.
Podle European Urinalysis Guidelines: Summary, 2000 se bakterie zjišťované v moči dají rozdělit podle patogenity vůči močovému traktu na 4 stupně (I.–IV.) a podle frekvence výskytu v kultivačních nálezech na 4 skupiny (A–D) (tab. 1).
Tab. 1. Dělení bakteriálních původců IMT dle stupně patogenity vůči močového traktu a výskytu v kultivačních nálezech [2]. GBS – β-hemolytické streptokoky skupiny B, CNS – koaguláza negativní stafylokoky. ![Dělení bakteriálních původců IMT dle stupně patogenity vůči močového traktu a výskytu v kultivačních nálezech
[2]. GBS – β-hemolytické streptokoky skupiny B, CNS – koaguláza negativní stafylokoky.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a633594df2217e3a5b37b7af88d9e400.jpg)
Primární patogeny mají schopnost způsobit infekci v anatomicky i funkčně zcela normálním močovém traktu, jsou nejvíce patogenní. Sekundární patogeny vyvolávají infekce na predisponovaném terénu, zjišťujeme je u nozokomiálních a komplikovaných infekcí. Nejisté patogeny jsou často součástí kolonizující flóry a za příčinu močové infekce je označujeme jen při průkazu v moči ze suprapubické punkce. Bakterie ze čtvrté skupiny jsou znakem kontaminace moči [3].
Interpretace:
- suprapubický odběr: signifikantní je jakákoli koncentrace zjištěného patogenu.
- střední proud moči:
signifikantní bakteriurie je při nálezu:
- ≥ 105 CFU/1 ml moči,
- 104–5 CFU/1 ml při izolaci sekundárního i nejistého patogenu při klinických příznacích u obou pohlaví,
- 104 CFU/1 ml u mužů, těhotných a podezření na pyelonefritidu,
- 103 CFU/1 ml při izolaci primárního patogenu (Escherichia coli, Staphylococcus saprophyticus) a klinických příznacích u obou pohlaví; u mužů i při izolaci sekundárního patogenu.
- bakteriurie z moči získané přes katetr: při klinických příznacích je významná od 104, jinak od 105 CFU/1 ml moči.
Kdy je leukocyturie významná?
Tradovaným kritériem významné leukocyturie je ≥ 10 leukocytů/1 zorné pole v mikroskopu. V současnosti se ale moč vyšetřuje v analyzátorech a počty elementů se vyjadřují v arbitrárních jednotkách (arb. j.) ve standardizovaném objemu moči, kterým je 1 µl. V případě leukocytů je norma 0–1 arb. j.
Za signifikantní proto pokládáme leukocyturii ≥ 2 arb. j., které dle přepočtu odpovídá ≥ 51 leukocytů v 1 µl moči (tab. 2).
Tab. 2. Tabulka ukazuje přiřazení arbitrárních jednotek počtu elementů v 1 μI moči. 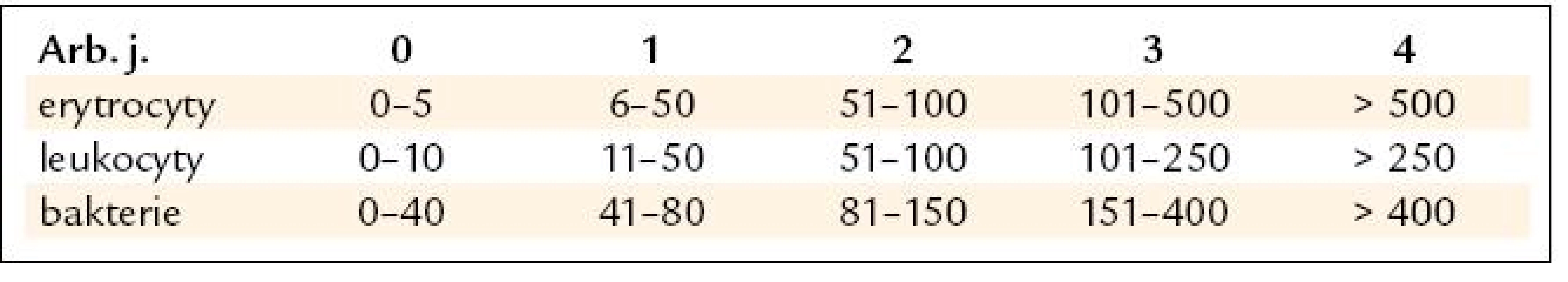
Interpretace močového nálezu
- Významná leukocyturie v přítomnosti signifikantní bakteriurie svědčí pro IMT.
- Izolovaná, též sterilní leukocyturie se vyskytuje
při:
- infekci atypickými patogeny (mykoplazmata, ureaplazmata, chlamydie, Neisseria gonorrhoeae),
- infekci viry (Adenovirus sérotyp 8, 11, 21, Polyoma virus BK, Cytomegalovirus – CMV, Herpes simplex, papilomaviry),
- TBC, urolitiáze, analgetické nefropatii, kontaminaci z vaginální oblasti,
- krátkém časovém odstupu od ukončení léčby antibiotiky (ATB).
Infekce močového traktu a chronické selhání ledvin
IMT jsou v převážné většině případů akutní a nekomplikované a k chronickému selhání ledvin (CHSL) nevedou. Chronické a komplikované IMT mohou být primární příčinou CHSL nebo přispívat ke vzniku CHSL etiologicky jiného původu (např. při polycystické degeneraci ledvin, diabetické nefropatii). Na druhé straně je CHSL rizikovým faktorem pro vznik močových infekcí.
IMT jako primární příčina CHSL není v současnosti častá. V žebříčku nejčastějších příčin CHSL jsou chronické tubulointersticiální nefritidy, mezi které patří chronická bakteriální pyelonefritida, na 4. místě – po nefropatiích diabetických, hypertenzních a ischemických a glomerulopatiích. K CHSL vede oboustranná neobstrukční chronická pyelonefritida trvající roky až desetiletí, chronická PN spojená s anatomickými odchylkami močového traktu (urolitiáza, VUR, obstrukce apod.) nebo chronická PN s náhlou redukcí funkčního renálního parenchymu (renální abscesy, papilární nekrózy, resekce ledvin, jednostranná nefrektomie).
CHSL jako obecný rizikový faktor infekcí, včetně IMT
Infekce jsou druhou nejčastější příčinou úmrtí nemocných s CHSL, hned po kardiovaskulárních onemocněních. CHSL provází dysbalance aminokyselin, minerálů, vitaminů, stopových prvků a hormonů, která může vést k rozvoji proteino-energetické malnutrice, hypalbuminemii a oslabení imunity. Důsledkem je sekundární imunodeficit s narušením všech složek imunity – nespecifické, specifické, humorální a zejména buněčné [4–8].
IMT a metoda náhrady ledvinové funkce
Frekvenci výskytu IMT při CHSL ovlivňuje i metoda náhrady ledvinové funkce. Při dialyzačních metodách nejsou močové infekce dominující komplikací. U mimotělních náhrad jsou nejzávažnější bakteriemie v souvislosti s centrálními žilními katetry [7], infekce cévní spojky a dýchacího traktu a při peritoneální dialýze peritonitida. Po transplantaci ledviny jsou naopak nejčastější infekční komplikací právě IMT.
IMT a transplantace ledviny
Specifickými rizikovými faktory jsou:
- imunosupresivní léčba,
- v časném potransplantačním období operační trauma a močový katetr,
- v pozdním období stenózy ureteru, zejména na úrovni pyeloureterální junkce.
Nejčastějšími původci IMT po transplantaci ledviny jsou bakterie, a to s vyšším zastoupením nozokomiálních kmenů a oproti běžné populaci i původců oportunních infekcí, zejména cytomegaloviru a BK-polyomaviru.
Stanovisko KDIGO Clinical Practise Guideline for the Care of Kidney Transplant Recipients 2009 je následující:
- IMT jsou častou a potenciálně významnou komplikací transplantací ledvin,
- pyelonefritida štěpu může vést k sepsi, metastatickému rozsevu, zhoršení funkce štěpu i smrti příjemce,
- podle observačních studií dlouhodobá profylaxe ATB po transplantaci ledvin významně snížila riziko všech infekcí, včetně rizika IMT.
Doporučuje se proto:
- profylaxe IMT co-trimoxazolem v 1 denní dávce nejméně po dobu 6 měsíců u všech příjemců ledvin,
- v případě PN štěpu hospitalizace a intravenózní podávání ATB,
- při alergii na co-trimoxazol či jeho nesnášenlivosti aplikovat alternativní nitrofurantoin. Profylaxe ciprofloxacinem po transplantaci ledviny je spojena s rizikem pneumonie vyvolané Pneumocystitis jiroveci, a není proto vhodná [9]. Navíc je ciprofloxacin jako jediný ze skupiny fluorochinolonů dostupný i ve formě pro nitrožilní podání, a měl by být proto vyčleněn pro léčbu nejzávažnějších infekcí.
Nekomplikované IMT
Vyskytují se převážně u mladých, sexuálně aktivních žen, u mužů zřídka, vyšší riziko je u homosexuálů a diabetiků. Uropatogenem je Escherichia coli v 80 %, Staphylococcus saprophyticus v 10–15 % případů.
Léčba
Akutní uretrocystitida:
- 3denní režim: jen u žen (co-trimoxazol, fluorochinolony, ne nitro-furantoin),
- 7denní režim v ostatních případech (nitrofurantoin, co-trimoxazol, fluorochinolony).
Akutní nekomplikovaná pyelonefritis:
- 10–14denní léčba ATB perorálně (p.o.) při podezření na pyelonefritidu nebo v lehkých případech (co-trimoxazol, fluorochinolony, amoxicilin klavunalát v úvodu, poté dle citlivosti patogenu),
- hospitalizace v těžších případech, těhotenství a podezření na sepsi; úvodem ATB nitrožilně (ciprofloxacin, cefalosporiny II. a III. generace, gentamycin + ampicilin, dle citlivosti mikroba), následně co-trimoxazol nebo fluorochinolony 2–3 týdny, nitrofurantoin neproniká do tkání, a je proto v této indikaci nevhodný.
Atypické IMT
Podezření: nový nebo více sexuálních partnerů, partner má podobné obtíže.
- Gonorhoická uretritida: jednorázově ofloxacin 200–400 mg.
- Chlamydia trachomatis a Ureaplasma urealyticum: 7 dní doxycyklin 2krát 100 mg nebo makrolidová ATB II. generace, např. jednorázově azitromycin 1 g.
Komplikované IMT
Vznikají na anatomicky nebo funkčně predisponovaném terénu, nejvíce ohroženy jsou osoby na imunosupresivní léčbě, diabetici a senioři pro kumulaci rizikových faktorů. V kultivačních nálezech narůstají sekundární patogeny, mohou až převažovat. Zvyšuje se riziko infekcí rezistentními bakteriálními kmeny, které může mít původ i v neracionálních léčebných postupech. V léčbě dáváme přednost antibiotikům s minimální nefrotoxicitou, vysokou koncentrací v moči a dobrým průnikem do tkání (lipofilní), prakticky jde o co-trimoxazol, fluorochinolony, doxycyklin, makrolidy, cefalosporiny či aminopeniciliny kombinované s inhibitory β-laktamáz. Nitrofurantoin vykazuje laboratorně vysokou antimikrobiální citlivost, ale neproniká do tkání a je kontraindikován při významnějším omezení renální funkce. Výběr ATB pro léčbu komplikovaných IMT se zásadně neliší od postupů při nekomplikovaných infekcích, hlavní rozdíl je v prodloužení jejich podávání.
Léčba
Asymptomatická bakteriurie (ABU): ATB dle zjištěné mikrobiální citlivosti:
- u těhotných žen, jde-li o opakovaný nález (nejméně ve 2 po sobě jdoucích vzorcích moči) stejného patogenu v množství ≥ 105 CFU/1 ml, léčba trvá 3–7 dní,
- u mužů při nálezu signifikantní bakteriurie před transuretrální prostatektomií, kdy léčbu zahajujeme krátce před zákrokem a pokračujeme v ní až do vytažení močového katetru,
- u obou pohlaví před jiným urologickým zákrokem s předpokládaným slizničním krvácením,
- léčbu zvážíme u asymptomatických žen, jestliže bakteriurie ≥ 105 CFU/1 ml vznikla prokazatelně v souvislosti se zavedeným močovým katetrem a přetrvává déle než 48 hod po jeho vytažení, nebo u obou pohlaví před kloubní náhradou [10].
Katetrová infekce: většinou postačí vytažení katétru nebo jeho výměna. U trvalých katetrů je léčba ABU nepřínosná.
Akutní komplikovaná uretrocystitida: ATB – nitrofurantoin nebo co-trimoxazol, alternativně fluorochinolony nebo cefalosporiny II. generace, při nálezu enterokoků ampicilin. Léčba trvá 7–14 dní.
Akutní prostatitida: ATB – co-trimoxazol, fluorochinolony, alternativně aminopeniciliny s inhibitory β-laktamáz, cefalosporiny nebo aminoglykosidy v kombinaci s β-laktamovými ATB. Léčba trvá 3–4 týdny, vede ji urolog.
Akutní komplikovaná pyelonefritida: hospitalizace, úvodem nitrožilní podání ATB, po zlepšení stavu fluorochinolony nebo co-trimoxazol p.o. po dobu 2–3 týdnů.
Závěr
- Nejčastějšími původci IMT jsou bakterie a ty můžeme řadit dle frekvence výskytu do 4 skupin (A–D) a dle patogenity vůči močovému traktu do 4 stupňů (I–IV).
- Nejvíce patogenní jsou Escherichia coli a Staphylococcus saprophyticus, tzv. primární patogeny, které způsobují infekci v anatomicky i funkčně zcela normálním močovém traktu.
- Závažnost bakteriurie závisí na patogenitě mikrobiologického agens, metodě odběru močového vzorku, pohlaví a přítomnosti či absenci klinické symptomatologie. Vždy je signifikantní bakteriurie ≥ 105 CFU/1 ml moči a jakákoli koncentrace patogenu ve vzorku moči ze suprapubického odběru.
- Leukocyturie se v současnosti vyjadřuje v arbitrárních jednotkách na 1 µl moči a významná je od ≥ 2 arb. j.
- IMT jsou v převážné většině případů akutní a nekomplikované a k CHSL nevedou.
- CHSL je naopak rizikovým faktorem pro vznik infekcí.
- U osob s CHSL jsou IMT nejčastější po transplantaci ledviny, kdy představuje pyelonefritida štěpu život ohrožující komplikaci.
- Dlouhodobá profylaxe co-trimoxazolem u příjemců ledvin významně snižuje riziko všech infekcí i infekcí močového traktu, a doporučuje se proto provádět po dobu nejméně 6 měsíců u všech příjemců ledvin.
MUDr. Doris Sobotová, CSc.
www.fnusa.cz
e-mail: doris.sobotova@fnusa.czDoručeno do redakce: 31. 3. 2011
Zdroje
1. Horáčková M. Infekce močového traktu u dospělých. In: Teplan V, Horáčková M, Bébrová E et al (eds). Infekce ledvin a močových cest. Praha: Grada Publishing 2004; 63–91.
2. Horáčková M. Infekce močových cest u rizikových nemocných. In: Teplan V, Horáčková M, Bébrová E et al (eds). Infekce ledvin a močových cest. Praha: Grada Publishing 2004; 183–200.
3. Bébrová E. Mikrobiologické aspekty patogeneze infekcí močových cest. In: Teplan V, Horáčková M, Bébrová E et al (eds). Infekce ledvin a močových cest. Praha: Grada Publishing 2004, 31–43.
4. Bartůňková J. Imunitní poruchy u pacientů s chronickým renálním selháním. In: Sulková S et al (eds). Hemodialýza. Praha: Maxdorf 2000 : 432–439.
5. Vanholder R, Van Loo A, Dhondt AM et al. Influence of uraemia and hemodialysis on host defence and infection. Nephrol Dial Transplant 1996; 11 : 593–598.
6. Allon M, Radeva M, Bailey J et al. HEMO Study Group. The spectrum of infection-related morbidity in hospitalized haemodialysis patients. Nephrol Dial Transplant 2005; 20 : 1180–1186.
7. Ponticelli C. New recommendation in the treatment of Gram-positive bacteraemia in dialysis patients. Nephrol Dial Transplant 2008; 23 : 27–32.
8. Teplan V. Problematika nutrice u hemodialyzovaných nemocných. In: Sulková S et al (eds). Hemodialýza. Praha: Maxdorf 2000; 318–384.
9. Kidney Disease: Improving Global Outcomes (KDIGO) Transplant Work Group. KDIGO Clinical Practice Guideline for the Care of Kidney Transplant Recipients. Am J Transplant 2009; 9 (Suppl 3): S59–S62.
10. Nicolle LE, Bradley S, Colgan R et al. Infectious Diseases Society of America; American Society of Nephrology; American Geriatric Society. Infectious Diseases Society of America Guidelines for the diagnosis and treatment of asymptomatic bacteriuria in adults. Clin Infect Dis 2005; 40 : 643–654.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Hemodialýza – současná praxe
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 7&8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Minulost, současnost a budoucnost náhrady funkce ledvin
- Etiologie a klinický obraz chronického selhání ledvin
- Hypertenze a kardiovaskulární komplikace chronického selhání ledvin
- Kostní choroba u chronického selhání ledvin a její moderní terapie
- Infekce močového traktu a chronické selhání ledvin
- Anémie u chronického selhání ledvin
- Peritoneální dialýza a její modifikace v léčbě chronického selhání ledvin
- Hemodialýza – současná praxe
- Přehled výsledků transplantací ledvin v České republice
- Biologická léčba po transplantaci ledviny
- Imunosupresivní terapie a její úskalí
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Hemodialýza – současná praxe
- Anémie u chronického selhání ledvin
- Imunosupresivní terapie a její úskalí
- Etiologie a klinický obraz chronického selhání ledvin
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



