-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kostní choroba u chronického selhání ledvin a její moderní terapie
Bone disease in chronic renal failure and its modern therapy
Renal bone disease is one of the most serious complications of chronic renal failure. Secondary hyperparathyreosis is decisive for its pathogenesis. Current prevention and treatment emphasises pathogenetic and clinical interrelationships between bone tissue involvement and cardiovascular complications (CKD-MBD, bone and venous involvement associated with chronic renal disease). The treatment should first correct hyperphosphatemia and, subsequently, hyperreactivity of parathyroid glands through vitamin D receptor (VDR) and calcium receptor (CaR) modulation. Three groups of drugs play a fundamental role here (GIT phosphate binders, calcimimetics and vitamin D receptor activators). Certain other therapeutic approaches are used in some specific situations such as, among others, refractory hyperparathyreosis or calciphylaxis.
Key words:
chronic renal failure – bone disease – secondary hyperparathyreosis
Autoři: S. Dusilová Sulková
Působiště autorů: Klinika nefrologie, Transplantační centrum IKEM Praha, přednosta prof. MUDr. Ondřej Viklický, CSc.
Vyšlo v časopise: Vnitř Lék 2011; 57(7&8): 620-625
Kategorie: 136. internistický den, XXIV. Vanýskův den, Brno 2011
Souhrn
Renální kostní nemoc představuje jednu z nejzávažnějších průvodních komplikací chronického selhání ledvin. V patogenezi je rozhodující sekundární hyperparatyreóza. V prevenci a léčbě choroby se v současné době klade důraz na vzájemné patogenetické i klinické souvislosti mezi postižením kostní tkáně a kardiovaskulárními komplikacemi (CKD-MBD, kostní a cévní postižení při chronickém onemocnění ledvin). Základním požadavkem pro léčbu je korekce hyperfosfatemie, na ni navazují postupy korigující hyperaktivitu příštítných tělísek ovlivněním receptoru pro vitamin D (VDR) a receptoru pro kalcium (CaR). V rámci těchto postupů mají význam především 3 skupiny léčiv (vazače fosfátů v zažívacím traktu, kalcimimetika, aktivátory receptorů pro vitamin D). V některých specifických situacích, ke kterým patří mimo jiné refrakterní hyperparatyreóza či kalcifylaxe, se uplatňují i další terapeutické postupy.
Klíčová slova:
chronické selhání ledvin – kostní choroba – sekundární hyperparatyreózaÚvod
V průběhu 60 let existence chronického hemodialyzačního programu lze pozorovat nejen, jak se zdokonaluje účinnost i bezpečnost dialyzační techniky, ale rovněž i jak se rozšiřují možnosti prevence a cílené léčby doprovodných komplikací při selhání ledvin. Patří k nim renální kostní choroba, renální anémie a mnohé další. Zatímco renální anémie byla po zavedení rekombinantního erytro-poetinu do klinické praxe téměř skokově upravena a v současné době se jedná jen o detailech optimalizace léčby, kostní nemoc zůstává stále problémem, a to přes nesporný pokrok ve farmakoterapii. Příčinou diskrepance mezi kontrolou obou hlavních doprovodných komplikací, anémie a osteopatie, není chybějící farmakologická možnost léčby, ale zcela zásadní odlišnost v patogenezi.
Renální anémie má jednu základní příčinu (deficit erytropoetinu) a ostatní (např. deficit železa) jsou doplňující. Proto je rekombinantní erytropoetin u většiny pacientů dobře účinný. Patogeneze renální kostní choroby je mnohem komplexnější. Kombinují se důsledky retence látek při chybějící renální eliminaci (retence fosfátů při selhání ledvin) i nedostatečná endogenní syntetická aktivita (deficit kalcitriolu) [1–3]. Rozdíl je i v podstatě projevů: zatímco při anémii klesá určitá biologická funkce (erytropoéza), při renální kostní nemoci dochází naopak k hyperfunkci jiné tkáně (hyperfunkce příštítných tělísek neboli sekundární hyperparatyreóza – SHPT), která má někdy dokonce i morfologický korelát (hyperplazie příštítných tělísek) a znamená poruchu kostního metabolizmu i kostní tkáně.
Moderní farmakoterapie SHPT umožňuje cílený a účinný farmakoterapeutický zásah prakticky ve všech místech, která se účastní patogeneze. Cílem textu je podat aktuální přehled léčebných postupů, a to zejména s důrazem na aktuální pravidla jejich aplikace. Detailní informace o jednotlivých lékových skupinách nejsou předmětem sdělení stejně jako informace o konkrétních preparátech.
Od kostní nemoci k CKD-MBD
V tradičním pojetí je kostní nemoc (renální osteopatie) chápána jako postižení kostní tkáně v důsledku složitých a dlouhotrvajících odchylek metabolizmu vápníku, fosforu a vitaminu D a řady dalších dysregulací. Podle výsledného vektoru jejich působení v čase lze pak rozlišit vysokoobratovou formu (high-turnover), nízkoobratovou formu (low-turnover) a formy smíšené [4]. Klasická forma se zvýšeným, resp. vysokým kostním obratem je důsledkem vystupňované aktivity příštítných tělísek (sekundární hyperparatyreóza – SHPT). Kostní postižení s nízkým kostním obratem může být projevem příliš vysoké suprese příštítných tělísek či řady jiných (a dosud ne zcela prozkoumaných) příčin (včetně akumulace aluminia, která se však dnes u nás nevyskytuje) či spojitostí s chronickým zánětem.
Po prohloubení poznatků získaných z epidemiologických i patogenetických dat je dnes zřejmé, že kostní nemoc není jen izolované postižení kostní tkáně (ať již zprvu bez symptomů, či v pokročilých formách s významnými problémy – omezení hybnosti, zhoršení funkční zdatnosti, fraktury a deformity kostí), ale má úzký vztah k dalším orgánům, zejména kardiovaskulárnímu systému [5].
V roce 2006 byly tyto komplexní souvislosti zohledněny v novém pojetí poruchy metabolizmu vápníku, fosforu a vitaminu D při selhání ledvin. Byl zaveden nový termín, CKD-MBD (chronic kidney disease – mineral bone disorder), který se v nefrologické komunitě rychle rozšířil a je dnes všeobecně akceptován [6].
Definice CKD-MBD se opírá o 3 skupiny ukazatelů. Prvním jsou laboratorní změny. Druhým je změna kostní tkáně. Třetím je cévní postižení, resp. kalcifikace cév (event. i kalcifikace v jiných lokalizacích). V celkovém pojetí CKD-MBD je kladen velký důraz na vzájemné souvislosti, a to nejen z hlediska patogeneze, ale i z praktického hlediska volby a kontroly terapeutických postupů. Platí totiž, že jakkoli se léčebnými postupy snažíme ovlivnit a upravit kostní tkáň a její metabolizmus, o indikaci i výsledku se přesvědčujeme pouze nepřímo, a to prostřednictvím laboratorních ukazatelů.
Škála klinických manifestací CKD--MBD je velmi široká a zahrnuje nejen změny kostního systému (a jejich klinické projevy) a postižení cév a myokardu (opět s klinickou symptomatologií, totožnou s manifestací srdečních onemocnění obecně), ale i např. poruchu funkce a morfologie příštítných tělísek (hyperfunkce a hyperplazie).
Principy léčby CKD-MBD
Farmakoterapie CKD-MBD se v současné době opírá o 3 základní skupiny léků, které konkrétním způsobem zasahují do patogenetických mechanizmů s cílem snížit přívod fosfátů do organizmu a upravit nepřiměřeně vysokou aktivitu příštítných tělísek [7]. Mechanizmus účinku jednotlivých lékových skupin je dobře definován, což velmi usnadňuje rozhodování o strategii léčby.
V prevenci a terapii CKD-MBD jsou aplikovány tyto skupiny léčiv:
- vazače fosfátů v zažívacím traktu (resp. postupy, které minimalizují nálož fosfátů při selhání ledvin),
- VDR aktivátory (metabolity vitaminu D, event. jeho analoga; obecně preparáty s cíleným efektem na receptor pro vitamin D) a
- kalcimimetika (látky zvyšující citlivost calcium-sensing receptoru v příštítných tělískách na extracelulární koncentraci kalcia).
Nezbytnou součástí léčby je komplex doprovodných opatření, která jsou u jednotlivých nemocných různá. Patří k nim např. suplementace kalcia (pokud je indikována – cave, koncentrace kalcia v krvi není spolehlivým ukazatelem potřeby doplnění kalcia do organizmu), úprava acidobazické rovnováhy, korekce metabolizmu magnézia a řada dalších doplňujících postupů, které lékař indikuje podle kompletního laboratorního i klinického obrazu (včetně např. nutriční podpory, léčby zánětu apod.). Zásadní je i volba koncentrace kalcia v dialyzačním roztoku. Doplňkovými postupy jsou i adekvátní nutriční podpora a minimalizace zánětu.
Při volbě léčebného postupu zvažujeme nejen to, kterou lékovou skupinu zvolit (samostatně či v kombinaci), ale i který preparát z dané skupiny je pro konkrétního pacienta vhodný. Preparáty se shodným cílovým efektem (vazače fosfátů v zažívacím traktu) se sice neliší v mechanizmu svého účinku (vyvázání fosfátů přijatých v potravě a jejich vyloučení stolicí neboli snížení nálože fosfátů pro organizmus), ale jsou značně rozdílné v doprovodných účincích (viz dále).
Při léčbě renální kostní nemoci, resp. CKD-MBD v novém pojetí, je základem laboratorní komponenta CKD-MBD (tzv. cílové koncentrace kalcia, fosforu a PTH, případně i hladina 25D a alkalická fosfatáza, resp. její kostní izoenzym) [6]. Nezanedbatelným hlediskem je však i doprovodný účinek lékové skupiny, resp. léku samotného (rozdíly mezi vazači fosfátů, rozdíly mezi selektivními a neselektivními aktivátory VDR).
Jedním ze základních pravidel při rozhodování o postupu léčby je pravidlo posloupnosti (tzv. „treatment pyramid“). Vždy začínáme korekcí hyperfosfatemie. Platí pravidlo „phosphate first“, a to z mnoha důvodů, z nichž hlavní jsou dva: fosfor samotný je rizikovým faktorem stimulace aktivity příštítných tělísek (která se po úpravě hyperfosfatemie může zmírnit) a léčba ostatními postupy není bez korekce fosfatemie účinná (rezistence vůči účinku VDR aktivátorů při hyperfosfatemii) [8].
Po úpravě fosfatemie je vždy třeba zvažovat, jak co nejúčinněji a nejcíleněji korigovat aktivitu příštítných tělísek. V zásadě existují 2 linie farmakologických zásahů – ovlivnění VDR (aktivátory VDR receptorů, které primárně snižují přepis genetické informace v příštítných tělískách, tj. snižují tvorbu parathormonu (PTH)) a ovlivnění CaR (receptor pro kalcium, tzv. calcium-sensing receptor). Léky, které zvyšují citlivost calcium-sensing receptoru na extracelulární koncentraci kalcia, snižují primárně sekreci PTH z buněk příštítných tělísek (pozor, je tedy nutno rozlišovat pojem tvorba a pojem sekrece PTH).
Tvorba a sekrece PTH jsou dva samostatné děje, které ovšem v kterémkoli okamžiku podmiňují koncentraci PTH v krvi. K nim přistupuje ještě třetí aspekt, a sice velikost tělísek (přítomnost hyperplazie), její rozsah, a zejména její schopnost reagovat na regulační podněty. Regulace aktivity příštítných tělísek se uskutečňuje prostřednictvím VDR a CaR receptorů a platí, že čím větší je velikost příštítných tělísek při jejich hyperplazii při selhání ledvin, tím nižší je denzita těchto receptorů a odpověď na aktivaci receptorů [9]. Jinými slovy – pokročilá autonomní hyperplazie může být rezistentní i proti cílené a kauzální kombinované léčbě VDR aktivátory a kalcimimetiky. Orientační hranici nelze stanovit z koncentrace PTH, ale lze ji odhadnout z velikosti tělísek (rozměr jakéhokoli tělíska nad 1 cm v průměru či velikost jakéhokoli tělíska nad 0,5 ml).
K principům moderní farmakoterapie tedy patří nejen volba preparátu s respektováním posloupnosti a respektováním cílových koncentrací, ale i zohlednění dynamiky hodnot a doprovodných účinků léků a znalost vzájemných kombinací [7,8,10]. Základním pravidlem je však léčba zahájená včas, léčba modifikovaná podle vývoje ukazatelů v čase a léčba dlouhodobá (v případě zvětšených příštítných tělísek de facto léčba trvalá).
Oporu pro moderní farmakoterapii poskytují cílové koncentrace vápníku, fosforu a PTH. Byly vypracovány iniciativami KDOQI (2003) a KDIGO (2009) [11,12] a cílové koncentrace PTH jsou i blíže zdůvodněny v samostatných publikacích [13]. Pro implementaci KDIGO doporučení v našich podmínkách sestavila pracovní skupina České nefrologické společnosti komentovaný návod [10]. Je v něm zdůrazněn ten aspekt, že posouzení léčebné strategie se nemůže opírat o jednotlivou laboratorní hodnotu, ale o vývoj laboratorních ukazatelů v čase, tj. o dynamiku změn. Každá výchylka sérové koncentrace PTH o více než 100 pg/ ml má být důvodem k přehodnocení léčebné strategie, případně k její úpravě.
Základní charakteristika jednotlivých lékových skupin
Kalcimimetika jsou v současné době zastoupena jediným preparátem (cinacalcet hydrochlorid; název Mimpara, v USA název Sensipar). Principem jejich účinku je zvýšení citlivosti kalciových receptorů (v příštítných tělískách, ale zřejmě i v jiných orgánech, např. v ledvinách, pokud jsou ledviny funkční) na kalcium. Tím nastává snížení sekrece PTH a koncentrace PTH v krvi klesá. Paralelně klesá i kalcium. Pokles PTH i kalcemie se nejvýrazněji projeví 2–4 hod po podání, poté se hodnoty zvyšují, avšak zůstávají nižší než výchozí. Lék se podává jednou denně, rozmezí dávek je 30–180 mg. Začínáme obvykle s dávkami nižšími. U některých pacientů se vyskytují gastrointestinální obtíže. Vzhledem k časové dynamice laboratorní odpovědi je potřeba při monitorování účinku zajistit, aby odběr krve proběhl nejméně 12 hod po podání, jinak je laboratorní nález zkreslený (hypokalcemie; koncentrace PTH snížená více, než odpovídá dlouhodobému efektu léčby). Podmínkou dlouhodobého supresivního účinku kalcimimetik při sekundární hyperparatyreóze je aktivace VDR. V současné době existuje velký počet literárních dokladů o efektu kalcimimetik, a to nejen laboratorním.
U dialyzovaných pacientů kalcimimetika snižují koncentraci PTH v séru, kalcemii a rovněž i fosfatemii, což je považováno za velice příznivé. Přibývají doklady o komplexním účinku na CKD-MBD (např. snížení progrese kalcifikací cév) a objevily se i zprávy o možné regresi hyperplastické tkáně tělísek [14,15]. U pacientů s pokročilým onemocněním ledvin, dosud nedialyzovaných, se účinkem kalcimimetik v ledvinách zvyšuje kalciurie a klesá fosfaturie, což znamená, že koncentrace fosforu v krvi stoupá. Používání kalcimimetik v léčbě sekundární hyperparatyreózy není u těchto pacientů schváleno.
V současné době jsou zvažovány určité účinky kalcimimetik v klinické praxi, ke kterým patří tyto patologické situace: rekurující sekundární hyperparatyreóza a paratyromatóza, hyperkalcemie z různých příčin, hyperparatyreóza perzistující po transplantaci ledviny, jiné formy sekundární hyperparatyreózy (např. SHPT indukovaná lithiem), familiární benigní hypokalciurická hyperkalcemie, tzv. „phosphate wasting“ syndromy (spojené s nadměrnými ztrátami fosfátů ledvinami) a kalcifylaxe a prevence/léčba cévních kalcifikací.
Aktivátory receptoru pro vitamin D (VDRA) jsou skupinou přípravků, do které patří nativní vitamin D, aktivní vitamin D (kalcitriol, přípravek Rocaltrol a jeho generika) a syntetická analoga vitaminu D. Jejich zástupcem je u nás registrovaný paricalcitol, dnes vzhledem ke svým vlastnostem označovaný jako selektivní VDR aktivátor.
Porucha metabolizmu vitaminu D je při snížené funkci ledvin a jejich selhání komplexní a poměrně složitá [16]. V konečném důsledku znamená značné oslabení účinku vitaminu D nejen v klasických orgánech (kost, střevo, příštítná tělíska), ale i ve smyslu tzv. netradičních účinků vitaminu D (obecně je lze označit jako antiproliferativní a podporující buněčné zrání a diferenciaci).
Své opodstatnění má podle aktuálních poznatků i suplementace nativním vitaminem D. Jeho hydroxylace v nativních ledvinách sice nemůže probíhat, a není tedy pro systémovou koncentraci kalcitriolu přínosný, zajišťuje ale substrát pro lokální (autokrinní a parakrinní) přeměnu na kalcitriol (např. buňky imunitního systému aj). Není stále objasněno, při jakých koncentracích kalcidiolu (25D) a v jakých dávkách a časovém schématu nativní vitamin D aplikovat. Při hodnocení koncentrací 25D v krvi se doporučuje postupovat stejně jako u pacientů bez onemocnění ledvin.
Aktivní vitamin D (kalcitriol) byl dlouho považován za základní prvek prevence a léčby sekundární hyperparatyreózy. Pokud byla cílem léčby substituce chybějícího aktivního metabolitu, byla (a stále je) doporučena denní aplikace malých dávek (0,25–0,5 μg per os). Pro supresi aktivity příštítných tělísek byla výhodnější aplikace intermitentní. Pro tento způsob prevence a léčby byl dříve k dispozici injekční kalcitriol, avšak postupně byl zcela nahrazen parikalcitolem.
Parikalcitol, neboli podle dnešní klasifikace selektivní VDR aktivátor, je syntetickým analogem vitaminu D2. V injekční formě je hemodialyzovaným pacientům aplikován intravenózně (tj. do návratového krevního setu dialyzačního okruhu). Suprimuje tvorbu parathormonu v příštítných tělískách. Při srovnatelném efektu na příštítná tělíska je jeho účinek v gastrointestinálním traktu (vstřebávání vápníku a fosforu) v porovnání s kalcitriolem přibližně třetinový. Zkušenosti s tímto přípravkem, registrovaným již více než 10 let, jsou bohaté a umožňují i retrospektivní analýzy. V nich byl opakovaně zjištěn benefit pro prognózu pacientů, a to dokonce po zohlednění koncentrací kalcia a fosforu. Nejednalo se však o prospektivní sledování. Nicméně byly provedeny početné experimenty, které dokumentují přinejmenším teoretické opodstatnění pro tento přínos [17].
V kontextu léčby VDRA a kalcimimetiky je potřeba ještě doplnit, že léčba sekundární hyperparatyreózy vyžaduje aktivaci obou typů receptorů, CaR i VDR. Pokud je léčba cílena jen na jeden z nich a druhý zůstává nepokryt, není možné očekávat trvalejší efekt na koncentrace PTH. Dále je třeba zdůraznit, že s léčbou negativně interferují zvýšené koncentrace fosforu. Rezistence příštítných tělísek vůči léčbě při hyperfosfatemii je velkým klinickým problémem a v současné době je úpravě hladiny fosfátů v krvi věnována v dialyzační nefrologii velká pozornost.
Vazače fosfátů v zažívacím traktu jsou skupinou léků, která na rozdíl od VDRA či kalcimimetik provází chronický hemodialyzační program od svého počátku před 60 lety. Zprvu byl krátce užíván kalcium karbonát. Později byl velmi široce nahrazen hydroxidem hlinitým, ale po prokázání výrazné až fatální klinické toxicity byl tento přípravek prakticky opuštěn a následoval automatický návrat k uhličitanu vápenatému, neboť jiná volba ani nebyla k dispozici. Kalcium karbonát je užíván i v současnosti (je levný a poměrně účinný), avšak jeho postavení přestává být dominantní, a to oprávněně. Své místo postupně získaly nekalciové vazače fosfátů, které nepůsobí pozitivní kalciovou bilanci (ve vztahu mezi kostním systémem a cévní komponentou CKD-MBD je pozitivní kalciová bilance významným negativním faktorem, spojeným s kalcifikacemi cév) [18,19].
Nekalciové vazače fosfátů v zažívacím traktu lze rozdělit na kovové (reprezentantem je lanthanum karbonát) a na vazače na bázi pryskyřice (sevelamer hydrochlorid, v některých zemích je již registrován i sevelamer karbonát). Rozebírat bližší specifikace, výhody a nevýhody jednotlivých preparátů by bylo nad rámec tohoto textu. V zásadě však platí, že účinné jsou všechny. Konečný efekt je silně podmíněn nikoli typem vazače, ale správným a dlouhodobým užíváním spolu s dietními pravidly (vazače se zásadně užívají s jídlem, potraviny s vysokým obsahem fosfátů jsou nevhodné – ryby, mléčné výrobky, sýry). Denní povolený příjem fosfátů v dietě se pohybuje kolem 1 000 mg. Roli v eliminaci fosfátů hraje pochopitelně i dialyzační eliminace.
V kontextu moderní farmakoterapie je potřeba zdůraznit ještě dvě další okolnosti: ochranu cévního systému a výběr léčebné kombinace tak, aby byly dosaženy nejen cílové laboratorní koncentrace, ale aby byla ochráněna cévní stěna, minimalizovány doprovodné účinky a v konečném efektu bylo dosaženo co nejvyšší kvality života s co nejmenším výskytem komplikací (tzv. hard-data).
Poznámky k farmakoterapii vybraných stavů v souvislosti s CKD-MBD
Klinické spektrum poruchy fosfokalciového metabolizmu je velmi pestré a mění se v čase i u téhož pacienta. V určitých situacích jsou potom postupy aktivně upravovány, jsou zařazovány jiné léky a celá léčebná strategie se přizpůsobuje tak, aby co nejvíce postihla patogenezi dané komplikace.
K situacím se změnou postupu patří hyperparatyreóza refrakterní na konzervativní léčbu, kalcifylace, rozsáhlé kalcifikace cév a dalších orgánů, tzv. syndrom hladové kosti. Zcela specifickým okruhem je osteoporóza ve vztahu k pokročilým nemocem ledvin, popis této problematiky je však nad rámec textu a pro další poznatky odkazujeme na příslušnou literaturu [20]. Jen uvádíme, že denzitometrický nález u dialyzovaných pacientů nelze interpretovat v klasickém pojetí a postupy užívané v léčbě osteoporózy u osob bez onemocnění ledvin jsou rozdílné. Rozdílný je zejména přístup k bisfosfonátům. Obecně jsou bisfosfonáty při selhání ledvin kontraindikovány [21]. Zcela kontraindikovány jsou v situacích s nízkým kostním obratem (kdy může být hodnota kostního minerálu v krvi nízká).
U části nemocných v dialyzačním programu (odhaduje se asi 7 %) je hyperparatyreóza natolik pokročilá, že je indikována paratyreoidektomie [22]. Příprava k operačnímu výkonu i pooperační péče mají svá specifika, z nichž upozorňujeme na riziko rekurence onemocnění v případě, že byla in situ ponechána část tělíska (prevence pooperační hypoparatyreózy) a zároveň nebyla dostatečně intenzivně kontrolována koncentrace kalcia v krvi, resp. byl po operaci pacient hypokalcemický (byť zdánlivě asymptomaticky). Hypokalcemie, resp. stimulace CaR je totiž nejmohutnějším stimulem proliferace buněk příštítných tělísek a vyvolává hyperplazii, která může být až autonomní [23]. Další komplikací je tzv. syndrom hladové kosti, který opět vyžaduje velkou substituci kalcia (až 10–20 ampulí kalcium gluconicum denně přísně intravenózně) spolu s doplněním vitaminu D.
Cévní stěna je u dialyzovaných pacientů výrazně více kalcifikována než u zdravých osob [24]. V kontrole kalcifikačního děje se kromě prevence a kontroly sekundární hyperparatyreózy uplatňují následující postupy: úprava fosfatemie (zabránění hyperfosfatemie), doplnění magnezia a titrace VDRA a kalcimimetik. Důležitá je i prevence a léčba malnutrice a zánětu, které snižují koncentrace fetuinu A, hlavního cirkulujícího inhibitoru fetuinu A. V kontextu ochrany cév před kalcifikacemi je třeba zmínit i antikoagulační léčbu warfarinem, resp. její možný nepříznivý efekt (souvislost s kalcifylaxí). Kalcifylaxe je sice vzácná, avšak mimořádně závažná [25]. Její léčba je specifická a náročná, bližší informace je třeba hledat v textech cíleně zaměřených na tuto problematiku.
V neposlední řadě patří ke komplexu terapeutických postupů i kontrola acidobazické rovnováhy (acidóza stimuluje aktivitu příštítných tělísek, avšak pozor, alkalóza je spojena s vyšším rizikem kalcifikací) a kontrola metabolizmu magnezia (hypomagnezemie stimuluje příštítná tělíska podobně jako hypokalcemie, doplnění magnezia má ochrannou funkci i z hlediska kalcifikací).
Závěr
Závěrem rekapitulujeme principy rozvahy o terapeutickém postupu v praxi. Po stanovení laboratorních ukazatelů a jejich vyhodnocení (nejen aktuální hodnoty, ale i vývoj v čase a vztah k aplikované medikaci) přichází klinická rozvaha (tab. 1). Ta má stanovit, co je klinickým problémem a co se očekává od léčby. V současné době se cíl léčby určuje podle laboratorní komponenty CKD-MBD (tzv. cílové koncentrace Ca, P a PTH).
Tab. 1. Léčba sekundární hyperparatyreózy při CKD-MBD (dialyzovaní pacienti) – základní postup. 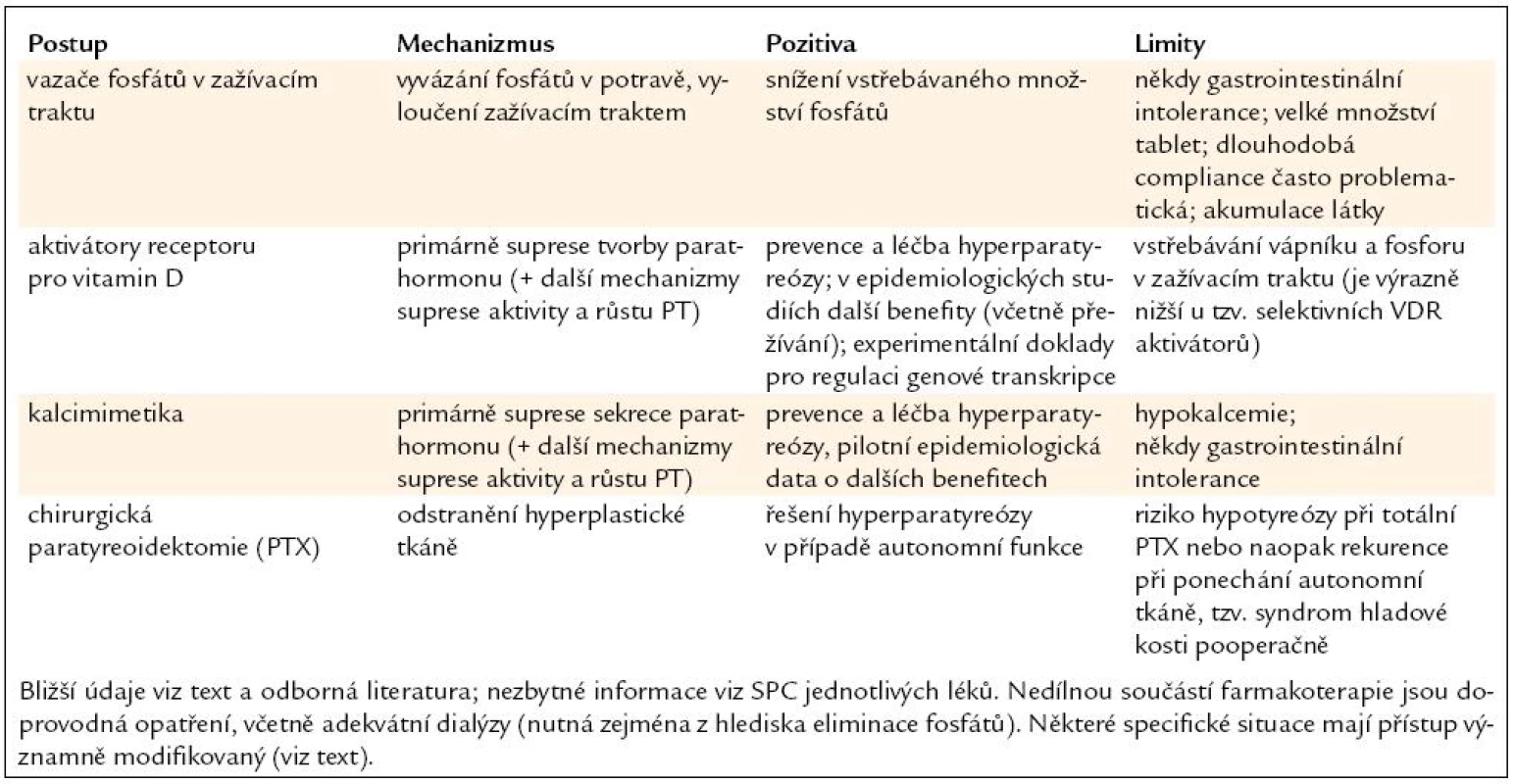
V případě sekundární hyperparatyreózy vždy platí pravidlo „phosphate first“, tj. v první řadě se zaměřujeme na úpravu predialyzační koncentrace fosforu. V návaznosti pak cíleně volíme další léky (kalcimimetika a/nebo VDR aktivátory) tak, abychom zajistili inhibici tvorby i sekrece PTH. Pokud se již vyskytne hyperplazie tělísek (detekovaná zkušeným sonografistou), je léčba trvalá, i když v čase proměnlivá podle výsledku laboratorního monitorování.
I přes pokroky ve farmakologii zůstává renální osteopatie (jako jedna z komponent CKD-MBD) klinickým problémem. Zvýšené koncentrace PTH jsou navíc spojeny i s celkově nepříznivou prognózou [26,27]. Současná farmakoterapie je sice cílena na všechny dosud známé patogenetické mechanizmy rozvoje hyperparatyreózy (pokrytí VDR i CaR), neřeší ovšem celý komplex kostních a cévních změn. Navíc se opírá jen o zprostředkované ukazatele (biochemické nálezy). Z hlediska dlouhodobého osudu pacienta je zásadní, aby monitorování, prevence a léčba CKD-MBD byly zahájeny včas, respektive co nejdříve, a to již ve fázi ambulantní nefrologické dispenzarizace.
Podpořeno Výzkumným záměrem MSM 0021620819.
prof. MUDr. Sylvie Dusilová Sulková, DrSc., MBA
www.ikem.cz
e-mail: sulkovas@volny.czDoručeno do redakce: 30. 5. 2011
Zdroje
1. Dusilová Sulková S a kol. Renální osteopatie. Praha: Maxdorf Jessenius 2007.
2. Dusilová Sulková S. Kostní a minerálová porucha při chronickém onemocnění ledvin – přehled problematiky. Osteol Bull 2008; 13 : 144–151.
3. Martin KJ, González EA. Metabolic bone disease in chronic kidney disease. J Am Soc Nephrol 2007; 18 : 875–835.
4. Martin KJ, Olgard K, Coburn JW et al. Bone Turnover Work Group. Diagnosis, assessment and treatment of bone turnover abnormalities in renal osteodystrophy. Am J Kidney Dis 2004; 43 : 558–565.
5. London GM, Guerin AP, Marchais SJ et al. Arterial media calcification in end-stage renal disease: impact on all-cause and cardiovascular mortality. Nephrol Dial Transplant 2003; 18 : 1731–1740.
6. Moe SM, Drüeke TB, Cunningham J et al. Kidney Disease: Improving Global Outcomes (KDIGO). Definition, evaluation and classification of renal osteodysstrophy. A position statement from kidney disease: Improving Global Outcomes (KDIGO). Kidney Int 2006; 69 : 1945–1953.
7. Cunningham J, Locatelli F, Rodriguez M. Secondary hyperparathyroidism: pathogenesis, disease progression and therapeutic options. Clin J Am Soc Nephrol 2011; 6 : 913–921.
8. Martin KJ, González EA. Prevention and control of phosphate retention/hyperphosphatemia in CKD-MBD: What is normal, when to start and how to treat. Clin J Am Soc Nephrol 2011; 6 : 440–446.
9. Rodriguez M, Canalejo A, Garfia B et al. Pathogenesis of refractory secondary hyperparathyroidism. Kidney Int 2002; 61: S155–S160.
10. Dusilová Sulková S, Opatrná S, Ryšavá R et al. KDIGO doporučení pro diagnostiku a léčbu CKD-MBD: komentovaný návod pro klinickou praxi. Aktuality v nefrologii 2010; 16 : 113–126.
11. Kidney Disease: Improving Global Outcome (KDIGO) CKD-MBD working group. KDIGO clinical practice guideline for the diagnosis, evaluation, preventive and treatment of chronic kidney disease – mineral bone disorder (CKD-MBD). Kidney Int 2009; 76 (Suppl 113): S1–S130.
12. National Kidney Foundation: K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis 2003; 42 (4 Suppl 3): S1–S201.
13. Komaba H, Nakanishi S, Fujimori A et al. Cinacalcet effectively reduces parathyroid hormone secretion and gland volume regardless of pretreatment gland size in patients with secondary hyperparathyroidism. Clin J Am Soc Nephrol 2010; 5 : 2305–2314.
14. Block GA, Zaun D, Smits G et al. Cinacalcet hydrochloride treatment significantly improves all-cause and cardiovascular survival in a large cohort of hemodialysis patients. Kidney Int 2010; 78 : 578–589.
15. Souberbielle JC, Cavaleire E, Jean G. Interpretation of serum parathyroid hormone concentrations in dialysis patients: what do the KDIGO guidelines change for clinical laboratory? Clin Chem Lab Med 2010; 48 : 769–774.
16. Dusso AS, Tokumoto M. Defective renal maintenance of the vitamin D endocrine system impairs vitamin D renoprotection: a downeard spiral in kidney disease. Kidney Int 2011; 79 : 715–729.
17. Szeto CC, Li PKT. The use of vitamin D analogues in chronic kidney diseases: possible mechanisms betone bone and mineral metabolism. NDT Plus 2009; doi.10.1093/ndtplus/sfp034.
18. Emmet M. A comparison of clinically useful phosphorus binders for patients with chronic kidney failure. Kidney Int 2004; 66 (Suppl 90): S25–S32.
19. McIntyre CW. New developments in the management of hyperphosphatemia in chronic kidney disease. Semin Dial 2007; 20 : 337–341.
20. Gordon PL, Frassetto LA. Management of osteoporosis in CKD stages 3 to 5. Am J Kidney Dis 2010; 55 : 941–956.
21. Toussaint ND, Elder GJ, Kerr PG. Bisphosphonates in chronic kidney disease; balancing potential benefits and adverse effects on bone and soft tissue. Clin J Am Soc Nephrol 2009; 4 : 221–233.
22. Tominaga Y, Matsuoka S, Uno N et al. Parathyreoidectomy for secondary hyperparathyroidism in the era of calcimimetics. Ther Apher Dial 2008; 12 (Suppl 1): S21–S26.
23. Rodriguez M, Nemeth E, Martin D. The calcium-sension receptor: a key factor in the pathogenesis of secondary hyperparathyroidism. Am J Physiol Renal Physiol 2005; 288 : 253–264.
24. Moe SM, Chen NX. Pathophysiology of vascular calcification in chronic kidney disease. Clin Res 2004; 95 : 560–567.
25. Dusilová Sulková S, Válek M. Skin wounds associated with calciphylaxis in end-stage renal disease patients on dialysis. Nutrition 2010; 26 : 910–914.
26. Floege J, Kim J, Ireland E et al. ARO Investigators. Serum iPTH, calcium, phosphate, and the risk of mortality in a European hemodialysis population. Nephrol Dial Transplant 2010. [Epub ahead of print].
27. Kalantar-Zadeh K, Shah A, Duoung U et al. Kidney bone disease and mortality in CKD: revisiting the role of vitamin D, calcimimetics, alkaline phosphatase, and minerals. Kidney Int 2010; 78 (Suppl 117): S10–S21.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Hemodialýza – současná praxe
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 7&8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Minulost, současnost a budoucnost náhrady funkce ledvin
- Etiologie a klinický obraz chronického selhání ledvin
- Hypertenze a kardiovaskulární komplikace chronického selhání ledvin
- Kostní choroba u chronického selhání ledvin a její moderní terapie
- Infekce močového traktu a chronické selhání ledvin
- Anémie u chronického selhání ledvin
- Peritoneální dialýza a její modifikace v léčbě chronického selhání ledvin
- Hemodialýza – současná praxe
- Přehled výsledků transplantací ledvin v České republice
- Biologická léčba po transplantaci ledviny
- Imunosupresivní terapie a její úskalí
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Hemodialýza – současná praxe
- Anémie u chronického selhání ledvin
- Imunosupresivní terapie a její úskalí
- Etiologie a klinický obraz chronického selhání ledvin
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



