-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Anémie u chronického selhání ledvin
Anemia and chronic kidney failure
Anaemia is a common manifestation of a chronic kidney failure. It is caused by a relative shortage of erythropoetine (EPO) and iron deficite with its metabolism defect. The most important factor in the pathogenesis of iron metabolism defects is hepcidin. Hepcidin maintains the iron homeostasis in the organism. The therapy of renal anaemia is based on the iron substitution and erythropoiesis stimulating agents (ESA) application. The most common reasons for the resistance to ESA are (after iron deficiency) inflammation and malnutrition.
Key words:
chronic kidney failure – iron deficiency – hepcidin – erythropoiesis stimulating agents
Autoři: S. Štěpánková
Působiště autorů: Centrum kardiovaskulární a transplantační chirurgie Brno, ředitel doc. MUDr. Petr Němec, CSc.
Vyšlo v časopise: Vnitř Lék 2011; 57(7&8): 631-634
Kategorie: 136. internistický den, XXIV. Vanýskův den, Brno 2011
Souhrn
Anémie je častým projevem chronického selhání ledvin. Je způsobena relativním nedostatkem erytropoetinu (EPO) a deficitem železa s poruchou jeho metabolizmu. V patogenezi poruch metabolizmu železa hraje rozhodující roli hepcidin. Udržuje homeostázu železa v organizmu. Léčba renální anémie je založena na substituci železa a aplikaci erytropoézu stimulujících přípravků (ESA). Zánět a malnutrice jsou po deficitu železa nejčastějšími příčinami rezistence na ESA.
Klíčová slova:
chronické selhání ledvin – deficit železa – hepcidin – erytropoézu stimulující agensÚvod
Anémie je jedním z nejčastějších projevů chronického selhání ledvin (CHSL). V terminální fázi selhání je její prevalence až 75 %.
Renální anémie je způsobena především relativním nedostatkem erytropoetinu a deficitem železa s poruchou jeho metabolizmu. CHSL bývá často provázeno zánětem (tzv. syndrom MIA – malnutrition, inflammation, atherosclerosis), a renální anémie se tak kombinuje s anémií chronických chorob.
Deficit erytropoetinu (EPO) je relativní. Plazmatické hladiny EPO jsou v mezích normy, ale jeho potřeba k udržení normálního počtu erytrocytů je několikanásobně vyšší. Anémie spouští hypoxii, která vede ke zvýšení produkce endogenního EPO, ale tato reakce je při selhání ledvin oslabená. Navíc se může vyskytovat snížená odpověď na EPO, jejíž příčinou je nejčastěji deficit železa, zánět a malnutrice. Hladiny EPO se u těchto nemocných běžně nevyšetřují.
Deficit železa
Nemocní s CHSL trpí deficitem železa a poruchou jeho utilizace ke krvetvorbě. Příčinou deficitu je nedostatečný přísun železa v potravě, např. při neadekvátní dietě nebo při zhoršené resorpci z GIT, a také zvýšené ztráty této látky. Zejména dialyzovaní nemocní mívají časté odběry krve, dochází ke ztrátám v mimotělním okruhu (srážení krve v dialyzátoru a setech), mnohdy také dochází k prolongovanému krvácení z arteriovenózní fistule po skončení dialýzy. Roční ztráta krve, způsobená těmito mechanizmy, se u dialyzovaného pacienta odhaduje na 500–700 ml.
Potřeba substituce železa je při středně snížené funkci ledvin poloviční oproti terminální fázi selhání vyžadující dialýzu. Spotřeba železa navíc výrazně stoupá při léčbě erytropoetinem (zvýšená erytropoéza). Železo se po perorálním podávání u CHSL omezeně vstřebává. Se substitucí ve formě tablet vystačíme zpravidla u středně těžkého selhání (dávkování do 200 mg železa na den), zatímco k dosažení uspokojivých zásob u dialyzovaných nemocných bývá nutná parenterální aplikace. Přehled nejčastěji užívaných preparátů železa na českém trhu podává tab. 1.
Tab. 1. Přehled přípravků s obsahem železa. 
Intravenózní (i.v.) aplikace železa je obecně velmi dobře tolerována. Interval podání je zpravidla od 1 dávky měsíčně až po 2 dávky týdně (při hemodialýze). V minulosti se vyskytovaly anafylaktické reakce u sloučenin železa s dextranem. Dnešní i.v. preparáty železa mají dobrý bezpečnostní profil a zejména Ferinject (carboxymaltosum ferricum), který je v České republice dostupný od roku 2008, má velmi nízké riziko imunogenicity. Nemá zkříženou reakci s antidextranovými protilátkami a díky neutrálnímu pH a izoosmolalitě s krví je minimalizována lokální reakce v místě vpichu. Jednotlivá dávka do 200 mg železa může být podána bolusovou i.v. injekcí, 500 mg pak v 15minutové infuzi (Ferinject SPC).
Zásoby železa v organizmu musí být pravidelně monitorovány. Sérová koncentrace železa nevypovídá o jeho aktuálních zásobách a už vůbec ne o jeho využitelnosti ke krvetvorbě. Řídíme se saturací transferinu a koncentrací ferritinu. Saturace transferinu by měla být minimálně 20 % a cílem je 30–40 %. Minimální požadovaná koncentrace ferritinu je 100 μg/ l, cílová pak 200–500 μg/ l (tab. 2). Horní hranice je stanovena na 800 μg/ l. Vyšší hladiny signalizují riziko přetížení železem s možností vzniku hemosiderózy. Ferritin je však také proteinem akutní fáze, a tudíž je ovlivněn zánětem, který jeho hodnoty zvyšuje. Interpretace hodnoty ferritinu má být vždy vztažena k přítomnosti či nepřítomnosti zánětu (CRP) [1].
Tab. 2. Cílové hladiny ukazatelů saturace železa organizmu. 
Porucha metabolizmu železa
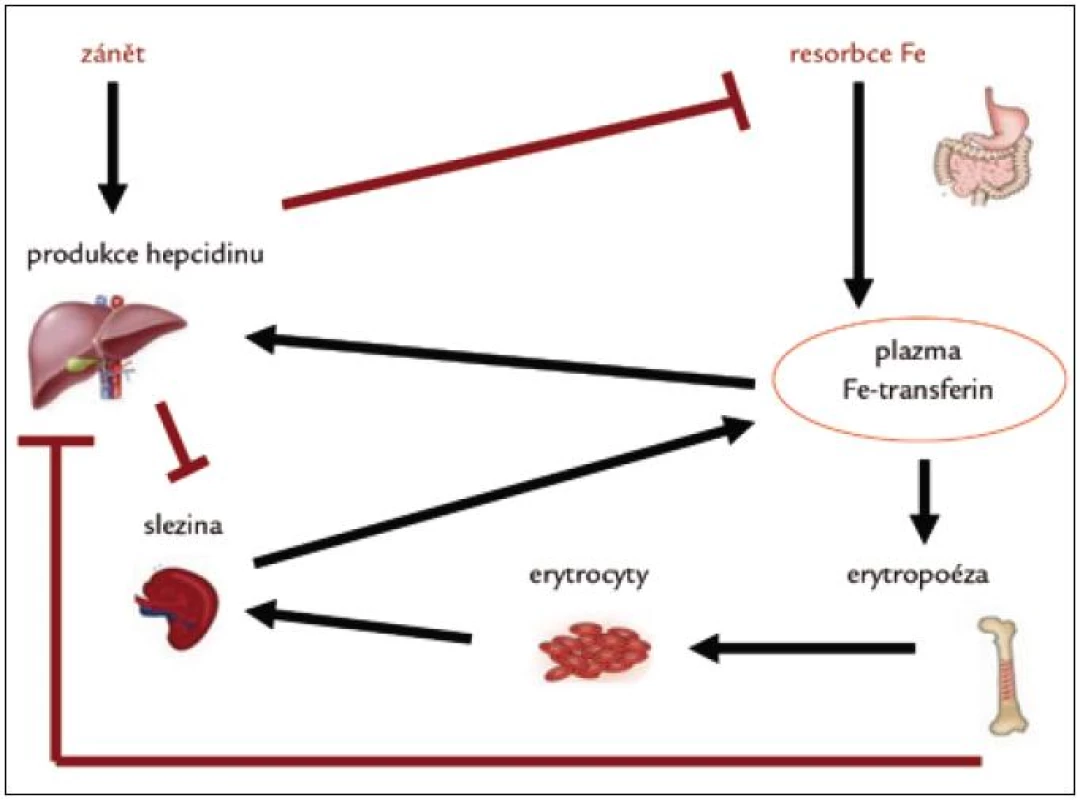
V patogenezi renální anémie (a anémie chronických chorob) je hlavním faktorem omezená dostupnost železa k erytropoéze. Rozhodující roli v regulaci metabolizmu železa má hepcidin. Jedná se o peptid, který je produkován v játrech. Objeven byl v roce 2000 [2–4].
Dlouhodobě kontroluje množství železa v organizmu. Zvýšený přísun železa (ať již perorální či intravenózní) a jeho zvýšené uvolňování z makrofágů vede ke zvýšení sérové hladiny železa, což má za následek indukci syntézy hepcidinu. Ten následně blokuje resorpci železa z trávicího traktu a jeho uvolňování z makrofágů, čímž brání přesycení organizmu železem.
Rovněž zánět (vlivem prozánětlivých cytokinů, zejména IL-6) stimuluje vyšší syntézu hepcidinu. Proto se u zánětlivých stavů vyskytuje porucha metabolizmu železa s jeho nedostupností pro erytropoézu. Objev hepcidinu pomohl vysvětlit patogenezi anémie u chronických chorob [5].
Naopak anémie, hypoxie a zvýšená potřeba železa při akcentované erytropoéze inhibuje produkci hepcidinu, což vede ke zvýšené střevní absorpci železa a jeho uvolňování ze zásobáren (makrofágy) (obr. 1).
Kongenitální deficit hepcidinu je příčinou hereditární hemochromatózy.
Dle současných poznatků je vlastním místem účinku hepcidinu ferroportin. Jedná se o transportní protein na membráně enterocytů a makrofágů, který zajišťuje transfer železa z buňky (enterocyt, makrofág) do krve (obr. 2).
Obr. 2. Postavení ferroportinu. 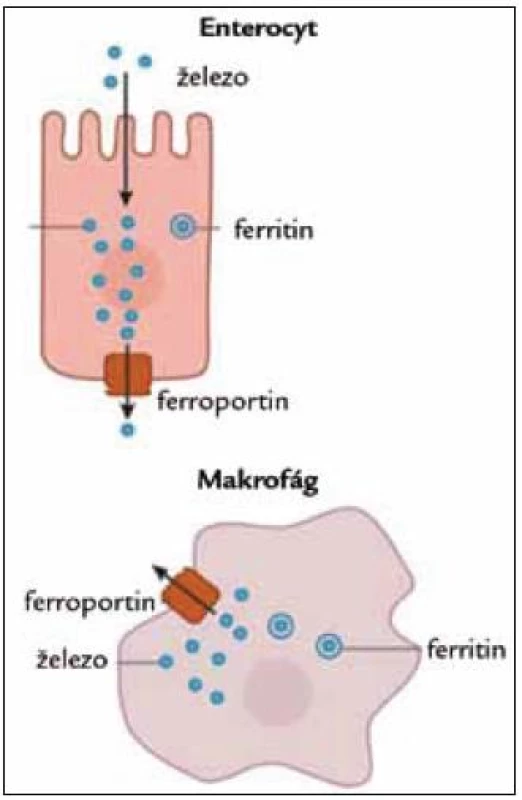
Ve světle současných znalostí se diskutuje o možnosti stanovení sérové koncentrace hepcidinu. Znalost jeho hladin by přispěla k diagnostice renální anémie i anémie chronických chorob. U nemocných se selháním ledvin je jeho koncentrace zvýšená. Příčinou je spíše prozánětlivý stav než porucha jeho vylučování [6]. Sledování dynamiky by mohlo odlišit akutní zánětlivé stavy (hepcidin jako protein akutní fáze) od stacionárního zvýšení při chronickém zánětu a napomoci při diagnostice rezistence na erytropoetin. Problém je ovšem ve značné náročnosti laboratorního stanovení a jeho širší využití v praxi zatím není možné.
Erytropoézu stimulující přípravky
Základním prostředkem léčby renální anémie je v současné době skupina léků odvozená od rekombinantního humánního erytropoetinu (r-Hu EPO). Společný název pro tuto skupinu je Erythropoiesis Stimulating Agents (ESA). Po izolaci genu pro lidský erytropoetin v roce 1983 mohl být zahájen vývoj a výroba epoetinu. Je tvořen ovariálními buňkami čínského křečka, do jejichž DNA byl genovým inženýrstvím inkorporován gen lidského erytropoetinu. Epoetin je v naší zemi používán od let 1988–1989.
Nejstaršími zástupci této skupiny jsou epoetin α a epoetin β (v ČR pod názvy Eprex a Neo Recormon). Epoetin α se podává 2–3krát týdně, epoetin β 1–3krát týdně (průměrné dávky jsou asi 6 000 IU týdně). Novějším zástupcem je darbepoetin α (Aranesp), který má 3krát delší poločas a hodí se k podávání v týdenních intervalech (v predialýze i 14denních).
Nejnověji je na trhu Metoxy-polyetylenglykol-epoetin β (Mircera). Tento lék má odlišnou interakci s EPO receptorem na progenitorových buňkách červené krevní řady. Má nižší vazebnou afinitu k receptoru, déle přetrvává v plazmě a vede k pomalejší degradaci receptoru. Je trvalým aktivátorem receptoru pro erytropoetin (continuous erythropoietin receptor activator – CERA). K vyzrávání retikulocytu je nutná přítomnost EPO nebo aktivátoru EPO receptoru po celou jeho dobu. Biologický poločas Mircery je 130 hod, je stejný po i.v. i s.c. podání (všechny ESA mají schválenou aplikaci s.c. nebo i.v.), podává se 1krát měsíčně. Hlavní výhodou tohoto léku je, že snižuje výkyvy hladiny hemoglobinu (Hb) při léčbě, méně často se u něj mění dávky a hladina Hb se snáze udržuje v doporučeném rozmezí.
PRCA
V letech 1998–2002 byl zaznamenán u asi 250 pacientů výskyt aplazie červené řady (pure red cell aplasia – PRCA) ve vztahu k subkutánní aplikaci epoetinu α. U těchto nemocných byl detekován výskyt antierytropoetinových protilátek, které zablokovaly účinek jak rHu-EPO, tak i endogenního EPO. Zvýšený výskyt PRCA se časově překrýval se změnou výrobní technologie epoetinu α, během které došlo ke změně stabilizátoru. Právě tento moment a subkutánní forma podání pravděpodobně souvisely se zvýšenou imunogenicitou. Navzdory raritnímu výskytu doporučují i v současné době výrobci ESA pomýšlet na tuto příčinu, pokud dojde k náhlému poklesu hemoglobinu a retikulocytů. Diagnostický je nález v kostní dřeni a průkaz protilátek. Při průkazu PRCA je základním opatřením ukončení léčby ESA (anti-EPO protilátky reagují se všemi ESA, není možná náhrada jiným přípravkem) a u popsaných případů byla často nezbytná i imunosupresivní léčba (kortikosteroidy, cyklofosfamid) [7,8].
Rezistence na ESA
Nikoli ojediněle se setkáváme s nedostatečnou terapeutickou odpovědí na léčbu ESA. Jestliže chybí klinická odezva i na vysokou dávku (zpravidla > 300 IU/ kg/týden epoetinu), hovoříme o rezistenci na ESA. Nejčastější příčinou je deficit železa. Měl by být odstraněn ještě před zahájením léčby, ale i během terapie je nutné sledovat a případně suplementovat jeho nedostatek (potřeba železa stoupá se zvýšenou krvetvorbou). Velmi častou příčinou rezistence je zánět či infekce [9]. U dialyzovaných pacientů bývá zdrojem biofilm na dialyzační kanyle, periodontitida, chronická obstrukční uropatie, kalcifylaxe, selhání štěpu in situ u pacientů po předchozí transplantaci a další. Malnutrice, která může signalizovat poddialyzování, je další – často skrytou – příčinou rezistence na ESA. Obdobný vliv mají hyperparatyreóza (fibróza kostní dřeně), metabolická acidóza, nedostatek vitaminu B12 a/nebo kyseliny listové. U nemocných s rezistentní anémií se mnohdy nevyhneme podání transfuzí. U čekatelů na transplantaci ledviny ale omezujeme indikaci jen na nezbytné případy a pro riziko tvorby antileukocytárních protilátek používáme deleukotizované přípravky.
Diferenciální diagnostika anémie
Před zahájením léčby renální anémie bychom měli vyloučit jiné příčiny anémií. Diferenciálně diagnostické schéma obsahuje vyšetření stolice na okultní krvácení, sérové hladiny železa, ferritinu, saturace transferinu, vitaminu B12, foláty, parametry hemolýzy a imunofixaci bílkovin v séru i moči. Monoklonální gamapatie může být příčinou nejen anémie, ale i dosud „etiologicky nediagnostikovaného“ selhání ledvin!
Cílový hemoglobin
Dlouho diskutovanou otázkou je hladina cílového hemoglobinu při léčbě ESA. V roce 2006 byly publikovány výsledky 2 studií, zabývajících se vztahem mezi hladinou dosaženého hemoglobinu a kardiovaskulárními (KV) komplikacemi u nemocných v predialýze, tedy dosud nedialyzovaných. Studie CHOIR proběhla v USA, pacienti byli léčeni epoetinem α a randomizováni k cílovému Hb 135 g/ l nebo 113 g/ l [10]. Evropská studie CREATE randomizovala pacienty k cílovému Hb 130–150 g/ l vs 105–115 g/ l. Podávanou látkou byl epoetin β [11].
Výsledky studií byly obdobné. Ve větvi s úplnou normalizací hemoglobinu nebyl prokázán příznivý efekt na kardiovaskulární mortalitu/morbiditu ani na rychlost progrese selhání ledvin. Naopak bylo pozorováno vyšší KV riziko (vlivem vyšší viskozity krve, akcelerace hypertenze, vyšší riziko trombóz). Bohužel ani jedna studie neposuzovala změnu hemoglobinu v čase. Případná příliš rychlá úprava hemoglobinu mohla být nežádoucím jevem a spolupříčinou těchto výsledků.
Obdobné závěry přinesla studie TREAT. Výsledky byly publikovány v listopadu roku 2009. Byla testována hypotéza, zda normalizace hemoglobinu (cíl 130 g/ l) dosažená léčbou darbepoetinem α (DA) oproti placebu (s průměrným Hb 106 g/ l) přinese u dosud nedialyzovaných diabetiků 2. typu zlepšení KV či renální prognózy. Placebová skupina dostala DA jen při poklesu Hb < 90 g/ l. Ani zde nedošlo v léčené skupině ke zlepšení sledovaných ukazatelů, léčená skupina vykazovala naopak vyšší riziko vzniku CMP [12]. Ačkoli se objevily určité kritické připomínky k metodice studie (rychlý nárůst hemoglobinu, pravděpodobná rezistence na DA u části pacientů, což by svědčilo na přítomnost dalších komorbidit atd.), jsou výsledky jednoznačné.
Na základě dosavadních zkušeností se mnoho mezinárodních doporučení (EBPG, KDOQI, OPTA, KDIGO) shoduje na cílovém Hb > 110 g/ l (jak u dialyzovaných, tak i dosud nedialyzovaných nemocných), ideálně 110–120 g/ l. Vzestup hemoglobinu by měl být pozvolný, ne o více než 20 g/ l za měsíc.
Anémie po transplantaci ledviny
Při časném nástupu funkce štěpu se renální anémie upravuje zpravidla do 3., nejpozději do 6. měsíce po transplantaci. Přesto je výskyt anémie u transplantovaných nemocných poměrně vysoký, prevalence se udává kolem 30 %. Četnost výskytu a zejména analýzu příčin přinesla studie TRESAM, která byla založena na sběru dat získaných v letech 2000–2001 od více než 4 000 transplantovaných pacientů ze 16 zemí [13]. Nejvýznamnějšími faktory v etiologii anémie jsou: snížená funkce ledvinného štěpu, rejekční epizody, vyšší věk dárce, deficit železa, infekce CMV a jeho profylaxe či léčba (toxický vliv gancikloviru), imunosupresiva (sirolimus, mykofenolát), podávání inhibitorů ACE či sartanů a infekce parvovirem B 19. Podobně vypadají i výsledky dalších prací. Léčba se řídí obdobnými pravidly jako u chronického selhání ledvin, včetně indikace ESA.
Závěr
Anémie je při CHSL velmi častá a v rámci léčby nemocných na dialyzačních střediscích a nefrologických ambulancích je jí zpravidla věnována dostatečná pozornost. Strategie léčby je poměrně jasná a v dnešní době jsou i ESA dostupné všem nefrologickým pacientům, u nichž je jejich podání indikováno. Shrnutí ve formě „take home message“ podává tab. 3.
Tab. 3. Shrnutí léčby renální anémie v bodech. 
MUDr. Soňa Štěpánková
www.cktch.cz
e-mail: sona.stepankova@cktch.czDoručeno do redakce: 6. 5. 2011
Zdroje
1. Singh AK, Coyne DW, Shapiro W et al. Predictors of the response to treatment in anemic hemodialysis patients with high serum ferritin and low transferrin saturation. Kidney Int 2007; 71 : 1163–1171.
2. Park CH, Valore EV, Waring AJ et al. Hepcidin, a urinary antimicrobial peptide synthesized in the liver. J Biol Chem 2001; 276 : 7806–7810.
3. Ganz T. Hepcidin, a key regulator of iron metabolism and mediator of anemia in inflammation. Blood 2003; 102 : 783–788.
4. Nemeth E, Ganz T. Hepcidin and iron-loading anemias. Haematologica 2006; 91 : 727–732.
5. Ganz T, Nemeth E. Iron sequestration and anemie of inflammation. Semin Hematol 2009; 46 : 387–393.
6. Nemeth E, Valore EV, Territo M et al. Hepcidin, a putative mediator of anemia of inflammation, is a type II acute phase protein. Blood 2003; 101 : 2461–2463.
7. Rossert J, Casadevall N, Eckardt KU. Anti-erythropoietin antibodies and pure cell aplasia. J Am Soc Nephrol 2004; 15 : 398–406.
8. Verhelst D, Rossert J, Casadevall N et al. Treatment of antibody-mediated pure red cell aplasia. J Am Soc Nephrol 2003; 14 : 27A.
9. Macdougall IC, Cooper AC. Erythropoietin resistance: the role of inflammation and proinflammatory cytokines. Nephrol Dial Transplant 2002; 17 (Suppl II): 39–43.
10. Singh AK, Szczech L, Tang KL et al. CHOIR Investigators. Correction of anemia with epoetin alfa in chronic kidney disease. N Engl J Med 2006; 355 : 2085–2098.
11. Drüeke TB, Locatelli F, Clyne N et al. CREATE Investigators. Normalization of hemoglobin level in patients with chronic kidney disease and anemia. N Engl J Med 2006; 355 : 2071–2084.
12. Pfeffer MA, Burdmann AE, Chen CY et al. A trial of Darbepoetin Alfa in Type 2 Diabetes and Chronic Kidney Disease. N Engl J Med 2009; 361 : 2019–2032.
13. Goldsmith D, Al-Khoury S, Shah N et al. Anemia after renal transplantation – role of immunosuppressive drugs and a pathophysiological appraisal. Nephron Clin Pract 2006; 104: c69–c74.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Hemodialýza – současná praxe
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 7&8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Minulost, současnost a budoucnost náhrady funkce ledvin
- Etiologie a klinický obraz chronického selhání ledvin
- Hypertenze a kardiovaskulární komplikace chronického selhání ledvin
- Kostní choroba u chronického selhání ledvin a její moderní terapie
- Infekce močového traktu a chronické selhání ledvin
- Anémie u chronického selhání ledvin
- Peritoneální dialýza a její modifikace v léčbě chronického selhání ledvin
- Hemodialýza – současná praxe
- Přehled výsledků transplantací ledvin v České republice
- Biologická léčba po transplantaci ledviny
- Imunosupresivní terapie a její úskalí
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Hemodialýza – současná praxe
- Anémie u chronického selhání ledvin
- Imunosupresivní terapie a její úskalí
- Etiologie a klinický obraz chronického selhání ledvin
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy