-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
Therapeutic approach to the bleeding in association with “old” and “new” anticoagulants
There are a several new anticoagulants emerging in the clinical medicine in the last a few years. Rivaroxaban, an oral direct F Xa inhibitor has been already approved in more than 100 countries worldwide, and Dabigatran etexilate, an oral direct thrombin inhibitor is also routinely used in thromboprophylaxis of venous thromboembolism. These agents possess many of the characteristic of the “ideal” anticoagulant but a lack of specific antidotes may be a potentional disadvantage in the therapy of bleeding complications. We assume, this lack of antidote does not represent a significant problem. In comparison with established anticoagulants (unfractionated heparin – UFH, low molecular weight heparin – LMWH, vitamin K antagonists – VKAs), only UFH has a specific and affective reversal agent. LMWH does not have the full proven antidote and the reversal agents recommended for the effects of VKAs have several safety and practical limitations. In the article we propose the basic principles of the management of bleeding complications in association with the newer anticoagulans. To manage bleeding episodes, we recommend delaying the next dose or discontinuing of treatment, mechanical compression, surgical interventions and the administration of the blood products. In the case of life-threatening bleeding, Novosen – rF VII is indicated.
Key words:
rivaroxaban – dabigatran – bleeding – therapy
Autori: P. Ďulíček
Pôsobisko autorov: Oddělení klinické hematologie II. interní kliniky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc.
Vyšlo v časopise: Vnitř Lék 2012; 58(7 a 8): 123-127
Kategória: 60. narozeniny prof. MUDr. Miroslava Penky, CSc.
Súhrn
V posledních několika letech se na klinice objevilo několik nových antikoagulans. Rivaroxaban, přímý inhibitor F Xa, byl již schválen ve více 100 zemích světa, a také dabigatran etexilate, přímý inhibitor trombinu, se rutinně používá v prevenci venózního tromboembolizmu. Tyto léky mají řadu vlastností „ideálního“ antikoagulans, ale nepřítomnost specifického antidota může být potenciální nevýhodou v léčbě krvácivých komplikací. Domníváme se, že jeho nepřítomnost nepředstavuje signifikantní problém. Ve srovnání s dlouho užívanými antikoagulans (nefrakcionovaný heparin – UFH, nízkomolekulární heparin – LMWH, antagonisté vitaminu K – VKA) pouze UFH má specifické a účinné antidotum. LMWH nemají antidotum a eliminace účinku antagonistů vitaminu K má několik bezpečnostních a praktických limitů. V článku navrhujeme základní principy léčby krvácivých komplikací v souvislosti s novými antitrombotiky. Léčba krvácení spočívá ve vynechání další dávky, ukončení léčby, mechanické komprese, chirurgické intervence či podání krevních komponent. V případě život ohrožujícího krvácení je indikováno použití přípravku Novoseven – rF VII.
Klíčová slova:
rivaroxaban – dabigatran – krvácení – terapieÚvod
Venózní tromboembolizmus (VTE) představuje závažný zdravotnický a sociálně-ekonomický problém, protože postihuje každoročně více než milion lidí v Evropské unii (EU). Incidence VTE se dnes v USA udává 1/1 000 [1,2]. Jednou z možných cest, jak snížit incidenci VTE, je provádění správné tromboprofylaxe, a to i s nově dostupnými antitrombotiky. Po letech „stagnace“ na poli antikoagulační a antitrombotické léčby se v posledních letech objevilo několik nových antitrombotik, a to zejména ze skupiny xabanů (rivaroxaban – Xarelto, apixaban – Eliquis) a gatranů (dabigatran etexilate – Pradaxa). I v našem písemnictví jim bylo
věnováno hodně pozornosti, zejména ohledně mechanizmu účinku a klinických studií. Tyto léky splňují řadu požadavků kladených na „ideální antitrombotikum“ (perorální podání, není nutné monitorování, fixní dávkování, minimální potravinové a lékové interakce aj.) [3,4].
Nicméně, nedostupnost antidota bývá uváděna jako největší limit nových antitrombotik. Cíle článku jsou následující: zhodnocení současné možnosti léčby krvácení nejen při běžně používaných antikoagulans, ale i možnosti léčby krvácení u nových antitrombotik, a tím si zodpovědět otázku, zda absence specif ického antidota znamená skutečně velký klinický problém. V tab. 1 shrnujeme vlastnosti dnes používaných antikogulans.
Tab. 1. Charakteristiky dnes používaných antikoagulans. 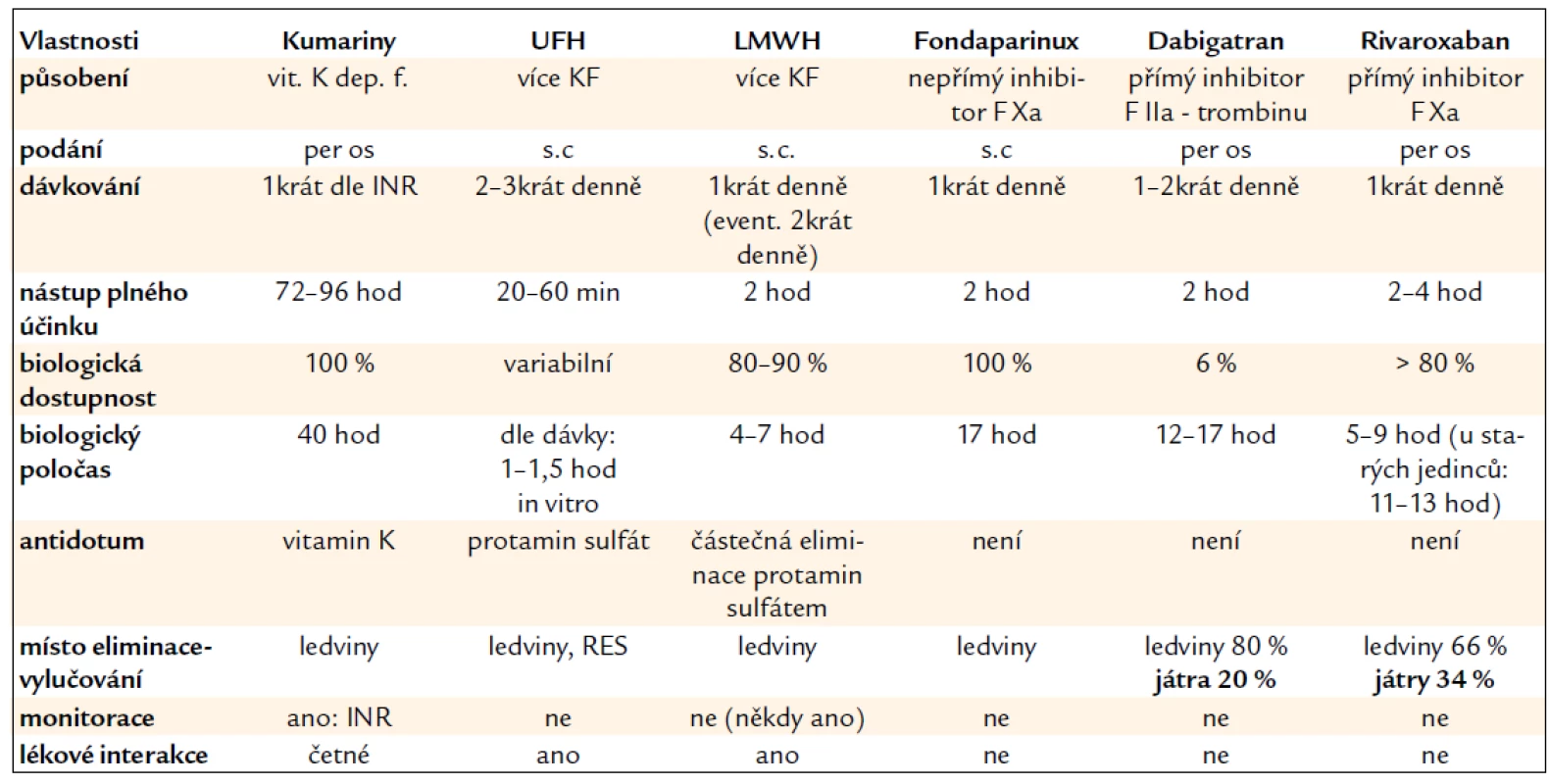
Postup při řešení krvácení v souvislosti s terapií UFH a LMWH
UFH byl po mnoho let lékem volby v prevenci a léčbě VTE. Jeho efekt může být v případě potřeby rychle a kompletně eliminován podáním protamin sulfátu [5]. Protamin je kompetitorem k antitrombinu ve vazbě na UFH, což má za následek uvolnění antitrombinu z UFH [6]. Jen malý, na arginin bohatý fragment protaminu je nezbytný k elektrostatické disociaci antitrombinu od UFH [6], a to v poměru 1 mg protaminu/ 100 U UFH [7]. Aplikace protaminu může být spojena s vedlejšími reakcemi, které kolísají od mírné hypotenze až k fatální srdeční zástavě [6]. Incidence a závažnost kolísají nejen v jednotlivých sděleních, ale také dle definice reakce, typu pacientů aj. [8]. Anafylaktické, imunologicky podmíněné jsou vzácné, ale nepředvídatelné, a mohou také být pro nemocného fatální [6]. Doporučuje se proto protamin podávat pomalu, během 1–3 min jako prevence hypersenzitivní reakce [7].
UFH byl nejen u nás, ale i ve valné většině indikací nahrazen heparinem nízkomolekulárním na základě lepšího farmakologického profilu [5]. LMWH mají větší biologickou dostupnost (f > 90 %) po subkutánním podání, předvídatelnější odpověď [5] a 3–4krát delší biologický poločas ve srovnání s UFH [7]. Terapii také není nutné rutinně monitorovat či upravovat dávku na základě laboratorního měření [5]. V případě velkého (závažného) či život ohrožujícího krvácení (ŽOK) se dle ACPP (the American College of Chest Physicians) doporučení má podat protamin sulfát k eliminaci účinku [5]. Na rozdíl od UFH nedojde ke kompletní eliminaci účinku LMWH [5]. Protamin sulfát plně eliminuje F IIa, ale ne F Xa [9]. Původně se myslelo, že je to díky přítomnosti řetězců o délce kratší než 14 polysacharidových jednotek v molekule LMWH, které jsou příliš malé pro vazbu k protaminu [10,11], ale nyní se udává, že je to nižším obsahem sulfátu [10]. Jednotlivé LMWH obsahují různé množství sulfátu, proto odpověď na podání protaminu je u jednotlivých LMWH rozdílná, jak ukazuje tab. 2 [10].
Tab. 2. Neutralizace F Xa protamin sulfátem u jednotlivých LMWH [10]. ![Neutralizace F Xa protamin sulfátem u jednotlivých LMWH [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/001a4209d3b0722a24dd0468c9af8080.png)
Podání protaminu se dle ACCP doporučuje dle následujících pravidel. Pokud byl LMWH podán během posledních 8 hod, protamin sulfát se doporučuje v dávce 1 mg/100 anti-F Xa jednotek LMWH [5]. Druhá dávka – 0,5 mg protaminu/100 anti-F Xa jednotek se aplikuje v případě přetrvávajícího krvácení. Nižší dávky protaminu se mohou podat v případě, že LMWH byl aplikován před více než 8 hod [5].
Postup při krvácení při terapii antagonisty vitaminu K
Antagonisté vitaminu K (VKA, nejznámějším lékem v této skupině je Warfarin) jsou nepochybně nejrozšířenějším antikoagulans v medicíně v posledních 60 letech [12]. Účinek VKA je dobře znám, inhibují karboxylaci faktorů II, VII, IX a X, což má za následek produkci proteinů se sníženým prokoagulačním potencionálem [12]. Warfarin je účinný lék, nicméně jeho podávání je spojeno s řadou problémů (nepředvídatelná dávka, lékové a potravinové interakce, nutnost laboratorního monitorování aj.) [12]. Protrombinový čas, udávaný jako INR, slouží k monitorování léčby VKA [12]. K eliminaci efektu účinku warfarinu máme k dispozici: vynechání léku, podání vitaminu K1, podání plazmy či koncentrátů protrombinového komplexu (PCC) [12]. Dle ACCP lze podat i rekombinantní faktor VIIa (rF VIIa). Nicméně pokud se podrobněji podíváme na jednotlivé postupy, nejsou vždy ideální a bez event. vedlejších účinků. Účinek warfarinu přetrvává po vysazení po mnoho dnů, podání vitaminu K1 (Kanavitu) může být provázeno (i když vzácně) alergickou až anafylaktickou reakcí [12]. Navíc po intravenózním podání začne účinkovat nejdříve po 2 hod, s maximálním efektem za 12–16 hod [13]. Vitamin K1 má být podán v dávce, která sníží INR do bezpečných hodnot, ale nevyvolá rezistenci k dalšímu podání (2–5 mg). Podání plazmy může být spojeno s alergickou reakcí, přípravek není virucidně ošetřen (i když riziko přenosu infekce je malé) [13,14] a hlavně je nutné podat určité množství plazmy (dle zvýšení INR,tíže krvácení, hmotnosti nemocného), což vyžaduje čas, a eliminace účinku VKA tím není okamžitá. Také množství potřebné k aplikaci (od 10–20 ml/kg
nemocného) může být spojeno s oběhovou zátěží nemocného. PCCs jsou t.č. nejvíce používané v případě potřeby rychlé eliminace účinku warfarinu (urgentní operace, ŽOK). Objemově malé množství přípravku vede
k rychlé eliminaci účinku VKA [15]. Současně dostupné přípravky jsou spojeny s nízkým trombogenním potencionálem [15], pokud nejsou předávkovány. Podání rF VIIa vede také k rychlé a velmi účinné eliminaci účinku VKA, ačkoli tento přípravek není v této indikaci registrován. Doporučuje se podat zejména v případě krvácení do centrálního nervového systému (CNS). Otázkou je optimální dávka rF VIIa [14,15]. Trombotické komplikace byly také popsány, ale jsou vzácné [16,17]. Nevýhodou je však hlavně krátký biologický poločas rF VII, a tak je často nutno dávku opakovat a cena terapie pak značně vzrůstá.
Postup při řešení krvácení v souvislosti s novými antitrombotiky
V současné době jsou u nás z nových antitrombotik nejvíce rozšířeny 2 přípravky – přímý inhibitor F Xa – rivaroxaban (Xarelto) a přímý inhibitor trombinu – dabigatran etexilate (Pradaxa) [18]. Používají se v primární profylaxi VTE po náhradě nosných kloubů, v léčbě a sekundární prevenci VTE, u jedinců s fibrilací síní. Neexistence přímého antidota je některými autorypovažováno za velký klinický problém. Nicméně se nedomníváme, že jeho nedostatek představuje zásadní klinický problém. Nakonec tomu ani není v případě LMWH, jak vyplývá z výše uvedeného.
Běžně používaná antikoagulans (UFH, LMWH, kumariny) jsou po mnoho let rutinně používána a jen opravdu malá část nemocných dostává vitamin K, plazmu nebo protamin sulfát v případě krvácení. U pacientů léčených s VTE pomocí LMWH nebo UFH s následným převodem na warfarin pouze 14 % dostávalo v případě klinicky významného krvácení vitamin K, plazmu nebo protamin z důvodu krvácení [19]. Výskyt závažného krvácení také není veliký. V případě tromboprofylaxe pomocí LMWH po totální endoprotéze kyčelního kloubu je výskyt velkého krvácení 2 % [20] a podobný je výskyt i u nových antitrombotik [21,22]. Také biologický poločas léku je velmi důležitý, protože antitrombotika s krátkým či středně dlouhým poločasem nepotřebují antidotum tak často vzhledem k rychlému vymizení účinku po vysazení. Rivaroxaban má biologický poločas 7–11 hod [23], abigatran 12–14 hod [24] a apixaban 8–15 hod [25].
K neutralizaci efektu nových antitrombotik bylo zkoušeno podání rF VIIa a aktivovaného koncentrátu protrombinového kompexu (aPCC), které částečně neutralizují vysoké dávky rivaroxabanu na zvířecích modelech krvácení [26–28]. Také bylo zkoušeno podání PCC, ale pro klinické použití je třeba dalších studií [29,30].
V případě podezření na předávkování dabigatranem mohou koagulační testy (Hemoclot) pomoci při určení rizika krvácení. Nadměrná antikoagulace si může vyžádat přerušení léčby.
V případě krvácení musí být léčba přerušena a zjištěn zdroj krvácení. Protože se dabigatran vylučuje převážně renální cestou, musí být udržována adekvátní diuréza a vzhledem k vazbě na bílkoviny lze dabigatran dialyzovat. S dialýzou jsou však omezené klinické zkušenosti v klinických studiích. Dle rozhodnutí ošetřujícího lékaře je možné zahájit vhodnou standardní léčbu, tj. chirurgickou hemostázu a náhradu krevního objemu. Je třeba zvážit podání plazmy [24]. Jak bylo uvedeno výše, existují určité experimentální důkazy s použitím přípravků, jako jsou koncentráty aPCC (např. FEIBA), PCC nebo rF VIIa. Užitečnost za klinických podmínek nebyla ještě systematicky prokázána. Nutné je také zvážení podání koncentrátu trombocytů v případech, kdy je přítomna trombocytopenie nebo pokud byly podány protidestičkové léky s dlouhodobým účinkem. Veškerá symptomatická léčba musí být podávána na základě rozhodnutí lékaře. Schéma postupu u podezření na předávkování či krvácení v souvislosti s dabigatranem je ve schématu 1.
Schéma 1. Postup u podezření na předávkování či krvácení v souvislosti s dabigatranem. 
V případě krvácení při podání rivaroxabanu a vyloučení lokální příčiny krvácení opět doporučujeme vynechání další dávky a podání plazmy. Pokud se jedná o ŽOK, je nutno zvážit podání rF VIIa [23]. Doporučený postup není striktní, vždy je potřeba jednat na základě klinického stavu, popisů případů a dle opatření v tab. 3.
Tab. 3. Navrhovaná taktika léčby krvácení u nemocných s rivaroxabanem. 
Závěr
Krvácení je vždy hlavním nežádoucím účinkem antikoagulační terapie a dostupnost specifického antidota je vždy velkou výhodou. Nicméně ani jeho nepřítomnost nemusí být závažnou překážkou při užívání antitrombotik. Nakonec ani LMWH nemají specif ické antidotum, které by okamžitě a rychle vyvázalo jeho účinek, a jsou u nás v klinické praxi užívány 20 let. Navíc frekvence výskytu krvácení, které by vyžadovalo
podání antidota, není tak časté a tak je tomu i v případě nových antitrombotik. Jejich výhodou je navíc
krátký poločas, takže řadu situací lze vyřešit pouhým přechodným přerušením léčby. Nepřítomnost specifického antidota by tak nemělo být zásadní překážkou při jejich používání v klinické praxi.
Práce byla podpořena výzkumným záměrem No. 00179906 Ministerstva zdravotnictví České republiky.
doc. MUDr. Petr Dulíček, Ph.D.
www.fnhk.cz
e-mail: PetrDulicek@seznam.cz
Doručeno do redakce: 15. 5. 2012
Zdroje
1. Cohen AT, Agnelli G, Anderson FA et al. VTE Impact Assessment Group in Europe (VITAE). Venous thromboembolism (VTE) in
Europe. The number of VTE events and associated morbidity and mortality. Thromb Haemost 2007; 98 : 756–764.
2. White RH. The epidemiology of venous thromboembolism. Circulation 2003; 107 (Suppl): I4–I8.
3. Phillips KW, Ansell J. The clinical implications of new oral anticoagulants: will the potential advantages be achieved? Thromb Haemost 2010; 103 : 34–39.
4. Haas S. New oral Xa and IIa inhibitors: updates on clinical trial results. J Thromb Thrombolysis 2008; 25 : 52–60.
5. Hirsh J, Bauer KA, Donati MB et al. American College of Chest Physicians. Parenteral anticoagulants: American College of Chest Physicians evidence-based clinical practice guidelines (8th Ed.). Chest 2008; 133 : 141S–159S.
6. Byun Y, Singh VK, Yang VC. Low molecular weight protamine: a potential nontoxic heparin antagonist. Thromb Res 1999; 94 : 53–61.
7. Harder S, Klinkhardt U, Alvarez JM. Avoidance of bleeding during surgery in patients receiving anticoagulant and/or antiplatelet therapy: pharmacokinetic and pharmacodynamic considerations. Clin Pharmacokinet 2004; 43 : 963–981.
8. Seifert HA, Jobes DR, Ten Have T et al. Adverse events after protamine administration following cardiopulmonary bypass in infants and children. Anesth Analg 2003; 97 : 383–389.
9. Holst J, Lindblad B, Bergqvist D et al. Protamine neutralization of intravenous and subcutaneous low-molecular-weight heparin (tinzaparin, Logiparin). An experimental investigation in healthy volunteers. Blood Coagul Fibrinolysis 1994; 5 : 795–803.
10. Crowther MA, Berry LR, Monagle PT et al. Mechanisms responsible for the failure of protamine to inactivate low-molecular-weight heparin. Br J Haematol 2002; 116 : 178–186.
11. Harenberg J, Gnasso A, de Vries JX et al. Inhibition of low molecular weight heparin by protamine chloride in vivo. Thromb Res 1985; 38 : 11–20.
12. Ansell J, Hirsh J, Hylek E et al. American College of Chest Physicians. Pharmacology and management of the vitamin K antagonists: American College of Chest Physicians evidence-based clinical practice guidelines (8th ed.). Chest 2008; 133 : 160S–198S.
13. Baker RI, Coughlin PB, Gallus AS et al. Warfarin Reversal Consensus Group. Warfarin reversal: consensus guidelines, on behalf of the Australasian Society of Thrombosis and Haemostasis. Med J Aust 2004; 181 : 492–497.
14. Crowther MA, Warkentin TE. Bleeding risk and the management of bleeding complications in patients undergoing anticoagulant therapy: focus on new anticoagulant agents. Blood 2008; 111 : 4871–4879.
15. Leissinger CA, Blatt PM, Hoots WK et al. Role of prothrombin complex concentrates in reversing warfarin anticoagulation: a review of the literature. Am J Hematol 2008; 83 : 137–143.
16. Aledort LM. Comparative thrombotic event incidence after infusion of recombinant factor VIIa versus factor VIII inhibitor bypass activity. J Thromb Haemost 2004; 2 : 1700–1708.
17. Fishman PE, Drumheller BC, Dubon ME et al. Recombinant activated factor VII use in the emergency department. Emerg Med J 2008; 25 : 625–630.
18. Weitz JI, Hirsh J, Samama MM. American College of Chest Physicians. New antithrombotic drugs: American College of Chest Physicians evidence-based clinical practice guidelines (8th ed.). Chest 2008; 133 : 234S–256S.
19. Haverkamp D, Hutten BA, Büller HR et al. The use of specific antidotes as a response to bleeding complications during anticoagulant therapy for venous thromboembolism. J Thromb Haemost 2003; 1 : 69–73.
20. Freedman KB, Brookenthal KR, Fitzgerald RH Jr et al. A meta-analysis of thromboembolic prophylaxis following elective total hip arthroplasty. J Bone Joint Surg Am 2000; 82-A: 929–938.
21. Wolowacz SE, Roskell NS, Plumb JM et al. Efficacy and safety of dabigatran etexilate for the prevention of venous thromboembolism following total hip or knee arthroplasty. A meta-analysis. Thromb Haemost 2009; 101 : 77–85.
22. Eriksson BI, Kakkar AK, Turpie AGG et al. Oral rivaroxaban for the prevention of symptomatic venous thromboembolism after elective hip and knee replacement. J Bone Joint Surg Br 2009; 91 : 636–644.
23. Bayer Schering Pharma. Xarelto® Summary of Product Characteristics. 2009. Available at: http://www.xarelto.com/html/downloads/Xarelto_Summary_of_Product_Characteristics_May2009.pdf. Accessed 26 August 2010.
24. Boehringer Ingelheim. Pradaxa® Summary of Product Characteristics. 2008. Available at: http://www.pradaxa.com/Include/media/pdf/Pradaxa_SPC_EMEA.pdf. Accessed 26 August 2010.
25. Frost C, Yu Z, Moore K et al. Apixaban, an oral direct factor Xa inhibitor: multiple-dose safety, pharmacokinetics, and pharmacodynamics in healthy subjects. J Thromb Haemost 2007; 5 (Suppl 2): Abstract P-M-664.
26. Perzborn E, Harwardt M. Recombinant Factor VIIa partially reverses the effects of the Factor Xa inhibitor rivaroxaban on thrombin generation, but not the effects of thrombin inhibitors, in vitro. J Thromb Haemost 2007; 5 (Suppl 2): Abstract P-W-640.
27. Gruber A, Marzec UM, Buetehorn U et al. Potential of activated prothrombin complex concentrate and activated Factor VII to reverse the anticoagulant effects of rivaroxaban in primates. Blood (ASH Annual Meeting Abstracts) 2008; 112: Abstract 3825.
28. Perzborn E, Tinel H. FEIBA reverses the effects of a high dose of rivaroxaban in rats. Pathophysiol Haemost Thromb 2008; 36: A40.
29. Lu G, DeGuzman FR, Lakhotia S et al. Recombinant antidote for reversal of anticoagulation by Factor Xa inhibitors. Blood
(ASH Annual Meeting Abstracts) 2008; 112: Abstract 983.
30. Perzborn E, Trabandt A, Selbach K et al. Prothrombin complex concentrate reverses the effects of high-dose rivaroxaban in rats. J Thromb Haemost 2009; 7 (Suppl 2): 379.
31. Samama MM, Martinoli JL, Leflem L et al. Assessment of laboratory assays to measure rivaroxaban – an oral, direct factor
Xa inhibitor. Thromb Haemost 2010; 103 : 815–825
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 7 a 8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Jubilant prof. Miroslav Penka, CSc.
- Profesor Miroslav Penka – jeden z běžců Maratónu pro hemofilii
- CZEMP – děcko prof. Penky
- Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna
- Změny kalcium-fosfátového metabolizmu při chronických nefropatiích
- Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
- Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
- Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
- Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
- Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
- Megakaryopoéza a geneze destiček
- Získaná hemofilie A
- Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi
- Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
- Refeeding syndrom u mladého pacienta s anxiózně-depresivní poruchou
- K životnímu jubileu prof. MUDr. Miroslava Součka, CSc.
- Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
- Syndróm nepokojných nôh u dialyzovaných pacientov
- Tuhosť aorty zvyšuje centrálny aortový tlak u pacientov s hypertenziou
- Jak definovat osoby s vysokým rizikem pankreatického karcinomu
- Veľkosť LDL lipoproteínových partikúl u pacientov s náhlou mozgovocievnou príhodou
- Trojkombinační léčba chronické hepatitidy C
- Chronický zánět a metabolický syndrom
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Fixní kombinace v léčbě hypertenze
- Farmakoterapie hypertenze po transplantaci srdce
- Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
- Antagonisty aldosterónu v liečbe chronického srdcového zlyhávania
- Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby
- Antiaterogénny účinok HDL subpopulácií u jedincov s novodiagnostikovanou končatinovocievnou artériovou chorobou
- Konečné stadium chronického onemocnění ledvin a metabolická acidóza
- Chronické ochorenie obličiek a vápniková homeostáza bunky
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
- Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
- Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
- Oxidačný stres a antioxidačné systémy u hemodialyzovaných chorých
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Významné životné jubileum profesora MUDr. Miroslava Mydlíka, DrSc.
- Vzťah mikroalbuminúrie a obezity u zdravých mladistvých – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kontrastová nefropatie a možnosti její prevence
- Farmakogenetické aspekty liečby orálnymi antidiabetikami
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Megakaryopoéza a geneze destiček
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



