-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cílená léčiva a jejich přínos pro terapii vnitřních chorob
Targeted therapeuticts and their role in the treatment of internal diseases
Targeted therapy is a conceptual notion that should be used for such a treatment approach that has been developed based upon the known pathophysiology and/or biomarkers of a particular disease, mainly malignancies. Monoclonal antibodies and tyrosine--kinase inhibitors were among the first molecularly targeted agents. Monoclonal antibodies approach is based on targeting a biomarker expressed either on the surface of cancer cells or targeting different cytokines. Tyrosin-kinase inhibitors are directed at the druggable molecule involved in the cancer pathophysiology inhibiting aberrant tyrosin-kinase activity. Classification of targeted drugs and their use in the clinical practice is shortly reviewed.
Key words:
targeted therapy – monoclonal antibodies – tyrosin-kinase inhibitors – classification – clinical use
Autoři: P. Klener
Působiště autorů: I. interní klinika 1. lékařské fakulty UK a VFN a ÚHKT Praha, přednosta prof. MUDr. Marek Trněný, CSc.
Vyšlo v časopise: Vnitř Lék 2013; 59(1): 5-12
Kategorie: Slavnostní přednáška
Předneseno jako slavnostní přednáška na zahájení XIX. kongresu České internistické společnosti České lékařské společnosti J. E. Purkyně v Brně dne 24. října 2012.
Souhrn
Cílená léčba je konceptuální pojem označující léčbu vyvinutou na podkladě znalostí patofyziologie a/nebo biomarkerů choroby, zejména maligních onemocnění. Mezi prvními molekulárně cílenými léčivy byly monoklonální protilátky a inhibitory tyrozinkináz. Účinek monoklonálních protilátek je založen na interakci s biomarkery exprimovanými na povrchu nádorových buněk nebo na interakci s cytokiny. Inhibitory tyrozinkináz blokují cíleně aberantně aktivované signální dráhy. Je uvedena stručná klasifikace cílených léčiv a možnosti jejich využití v klinické praxi.
Klíčová slova:
cílená léčba – monoklonální protilátky – inhibitory tyrozinkináz – klasifikace – klinické použitíÚvod
Pokroky molekulární biologie a genetiky na přelomu století umožnily hlubší poznání patogeneze celé řady onemocnění, které vedlo k identifikaci klíčových struktur podílejících se na vzniku či progresi onemocnění. Tyto objevy významně obohatily naše léčebné možnosti zavedením nových terapeutických modalit a otevřely možnosti individualizované léčby. Snad nejvýznamnějších pokroků bylo docíleno v léčbě nádorových onemocnění. Jednalo se o zavedení tzv. cílené a biologické léčby. Vzhledem k tomu, že označování těchto modalit je používáno často nepřesně, a to nejen v médiích, ale i v odborném tisku, může být užitečné podrobnější vysvětlení mechanizmů účinku zmíněných modalit a upřesnění terminologie.
Rozdíly mezi necílenou a cílenou terapií
Konvenční (necílená) chemoterapie byla zavedena do klinické praxe na základě preklinických a klinických zkušeností s protinádorovou účinností určitého přípravku u různých nádorových onemocnění. Jen zřídka bylo cytostatikum určeno k léčbě jednoho druhu nádoru. Používaná cytostatika lze tedy označit jako „širokospektrá“. To vyplývá z jejich mechanizmu účinku znázorněného na obr. 1. Konvenční cytostatika se vážou na určité buněčné struktury (DNA, RNA, cytoskelet, proteiny) a inhibují jejich funkci [1,2]. Jen nepřímo inhibují apoptózu (druhotně, cestou genetického stresu a zástavy buněčného cyklu). Z jejich obecného antiproliferačního účinku vyplývají četné nežádoucí účinky. Testování klasických cytostatik většinou předcházelo poznatkům o jejich mechanizmu účinku. Tak např. dusíkatý yperit byl zaveden do klinické praxe dříve než byla známa struktura DNA.
Obr. 1. Mechanizmus účinku konvenčních cytostatik. 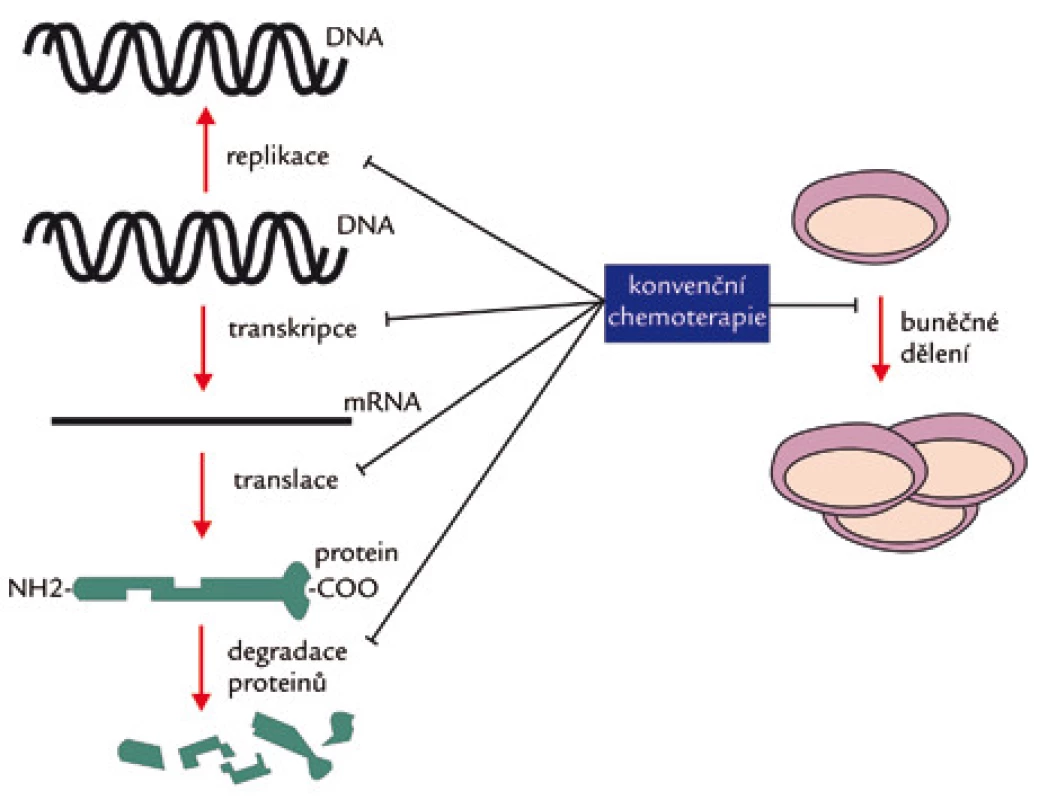
Cílená léčba (cílená chemoterapie) je konceptuální pojem, který byl navržen na základě určení specifických biomarkerů daného onemocnění, kterými jsou buď povrchové znaky exprimované buňkami nádoru popřípadě buňkami mikroprostředí, nebo tzv. „drugable“ molekuly, tj.molekuly podílející se na patologických buněčných interakcích [3,4] (obr. 2). Za historický mezník počátku cílené terapie se zpravidla považuje zavedení imatinibu do léčby chronické myeloidní leukemie (CML) v roce 2000. Imatinib inhibuje chimerický fúzní onkoprotein BCR-ABL, který vzniká následkem chromozomální translokace t(9;22), která je patognomonickým molekulárním markerem CML. Nízkomolekulární inhibitor blokuje aberantní signalizaci tyrozinkinázy ABL a její proliferační signály [5,6]. Podobně i ostatní cílená terapeutika interferují se specifickými proteiny a aberantaně aktivovanými nitrobuněčnými kaskádami na různých úrovních signální dráhy (viz též obr. 3). Mohou přímo indukovat apoptózu (na rozdíl od konvenčních cytostatik), přerušují onkogenní signály, inhibují sebeobnovu, popř. indukují diferenciaci. Interferují s komplexními procesy angiogeneze a metastazování či imunitní odpovědi [7]. Mají úzké spektrum účinnosti více méně na nádorové buňky (on target effect). Často jsou cíleny i na nemaligní buňky mikroprostředí a jejich toxicita na nemaligní buňky je relativně omezená (of target effect) a je obvykle nižší než u konvenčních cytostatik. Přetrvávající toxicita cílených terapeutik vyplývá ze dvou skutečností. Za prvé žádná cílená látka není stoprocentně specifická pro danou molekulu a/nebo signální dráhu, ale ovlivňuje více či méně i jiné buněčné pochody. Za druhé aberantní molekuly nebo signální dráhy typické pro dané maligní onemocnění neplní obvykle výlučně patologickou funkci u tohoto nádorového onemocnění, ale „zkříženě“ inhibují i jiné onkoproteiny (např. imatinib není výlučným inhibitorem BCR-ABL, ale inhibuje celou škálu jiných kináz – PDGFR, KIT).
Obr. 2. Mechanizmus účinku cílených léčiv. 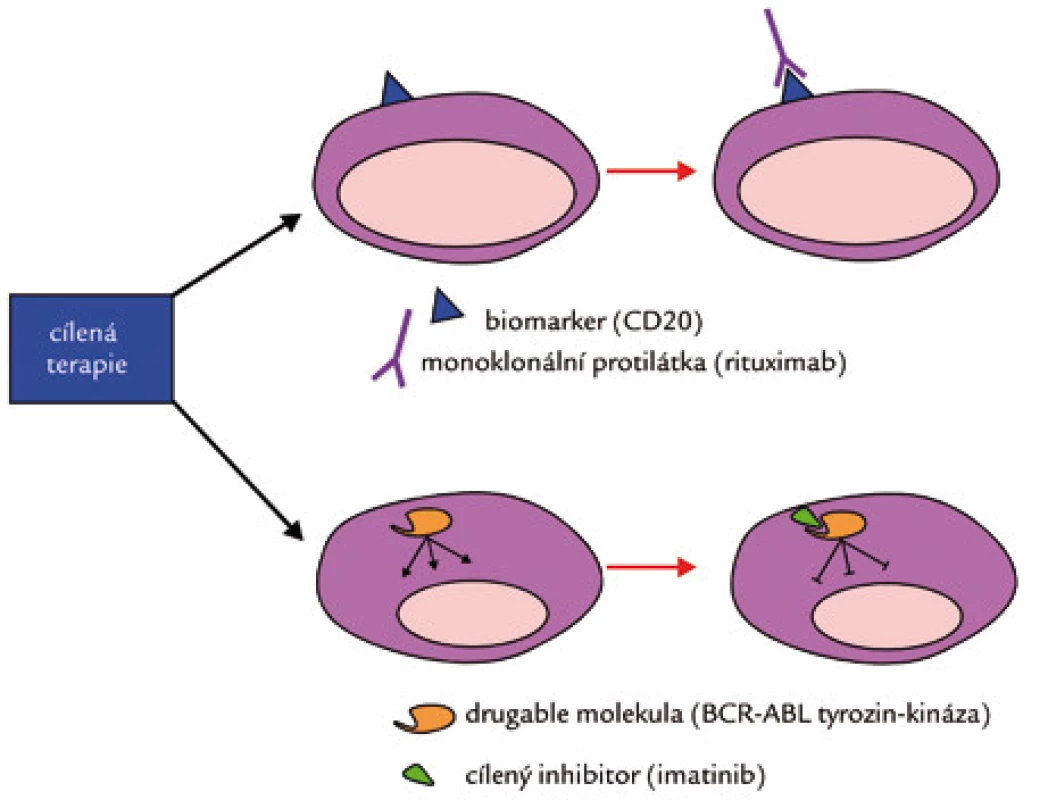
Obr. 3. Obecné schéma přenosu signálu z membránového receptoru do nitra buňky. Různé úrovně možného terapeutického zásahu u aberantně aktivovaných drah. 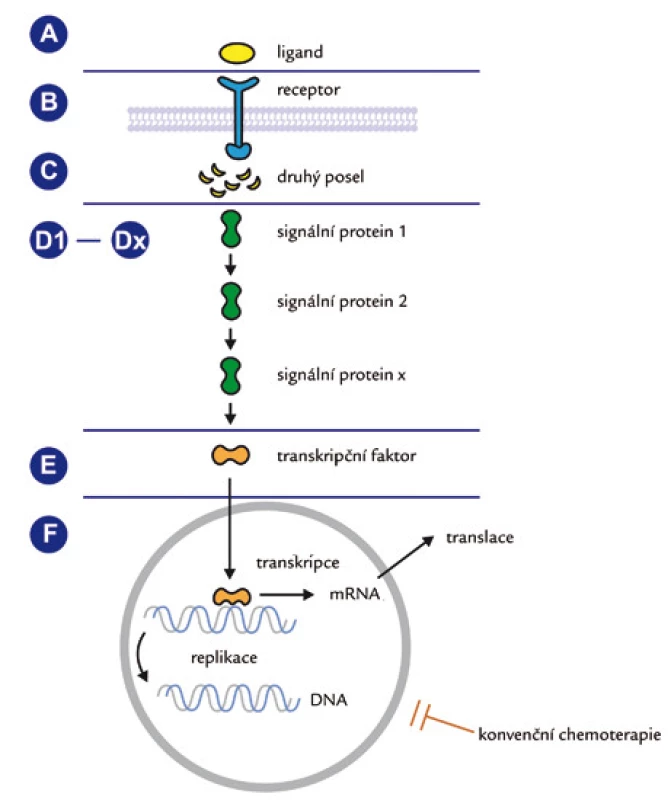
Cílená léčiva jsou většinou nízkomolekulární chemické látky s přesně definovanou strukturou. Přesto termín cílená léčba může zahrnovat léčiva v podobě proteinových makromolekul, což se někdy považuje za důvod k označení biologická léčba. Cíleným mechanizmem účinku působí totiž některé monoklonální protilátky. Cílená a biologická léčba jsou sice dva odlišné pojmy, ale s výrazným překryvem. Ne každé biologické léčivo je cílené, ne každé cílené léčivo může být označeno jako biologické, jak je patrné z tab. 1.
Tab. 1. Příklady cílených a necílených léčiv. 
Cílená léčiva a jejich klasifikace
Klasifikace cílených léčiv většinou vychází z úrovně signální dráhy, na kterou cílený lék působí (ligand – receptor – přenašeč – transkripční faktor) a kterou může v kterémkoliv jejím úseku přerušit. Schematické znázornění je uvedeno na obr. 3.
Inhibice růstového faktoru (ligandu), který po vazbě na specifický membránový receptor spustí sled nitrobuněčných pochodů, označovaných jako transdukční kaskáda [8]. Jedinou v praxi používanou látkou blokující růstový faktor je monoklonální protilátka bevacizumab (Avastin), který je blíže zmíněn v odstavci „monoklonální protilátky“.
Inhibice extracelulárních domén receptorů pro růstové faktory. Zablokování transdukční kaskády lze dosáhnout též inhibicí receptorů pro růstové faktory. K blokádě extracelulárních domén receptorů se používají rovněž monoklonální protilátky.
K blokádě intracelulárních domén se používají inhibitory receptorových tyrozinkináz [9] (tab. 2). Důsledky blokádního účinku by teoreticky měly být nejvíce patrné u nádorů s vysokou expresí příslušných receptorů pro daný růstový faktor (např. EGFR, VEGFR). Tab. 2 shrnuje nejdůležitější a klinicky používané inhibitory TK domény receptorů rodiny EGFR. Erlotinib (Tarceva) se ukázal jako užitečný lék metastazujícího nemalobuněčného bronchogenního karcinomu (NSCLC). Podobné účinky a indikace má též gefitinib (Iressa), kdežto lapatinib (Tyverb) se osvědčil v léčbě metastazujícího karcinomu prsu.
Tab. 2. Inhibitory receptorových tyrozinkináz (TKI) pro různé receptory a signální dráhy. 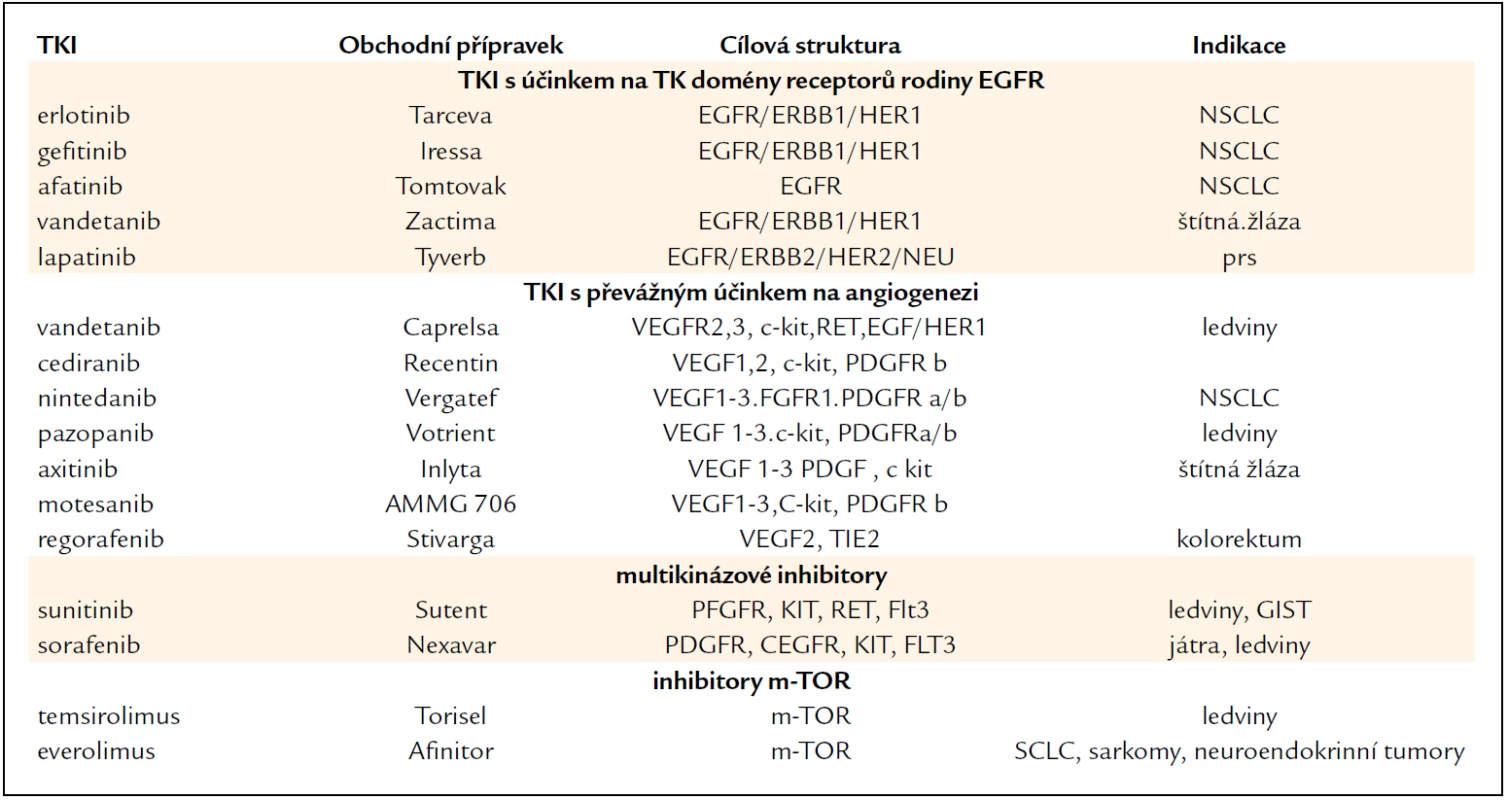
Inhibici receptorových domén VEGFR působí několik látek uvedených v tab. 3. Jsou účinnými inhibitory angiogeneze. Patologická angiogeneze se podílí na progresi, šíření a metastazování nádoru, a proto se možnosti její inhibice staly předmětem intenzivního bádání. Nejúčinnější se zdá výše zmíněná neutralizace VEGF monoklonální protilátkou (bevacizumab – Avastin), která se stala součástí komplexní léčby karcinomu kolorekta nebo karcinomu prsu. Inhibitory receptorových domén uvedených v tab. 3 jsou ještě předmětem klinického testování [11]. Výsledky klinických studií však již prokázaly účinnost u některých solidních nádorů, jako jsou metastazující karcinom ledviny, kolorektální karcinom, NSCLC a karcinom štítné žlázy. Inhibice angiogeneze má význam nejen v omezení kancerogeneze a metastazování, ale může být užitečná i mimo onkologii (např. v očním lékařství k blokádě nitrooční neovaskularizace, u revmatoidní artritidy, při léčbě chronických zánětlivých procesů).
Tab. 3. Inhibitory nereceptorových tyrozinkinázových proteinů. 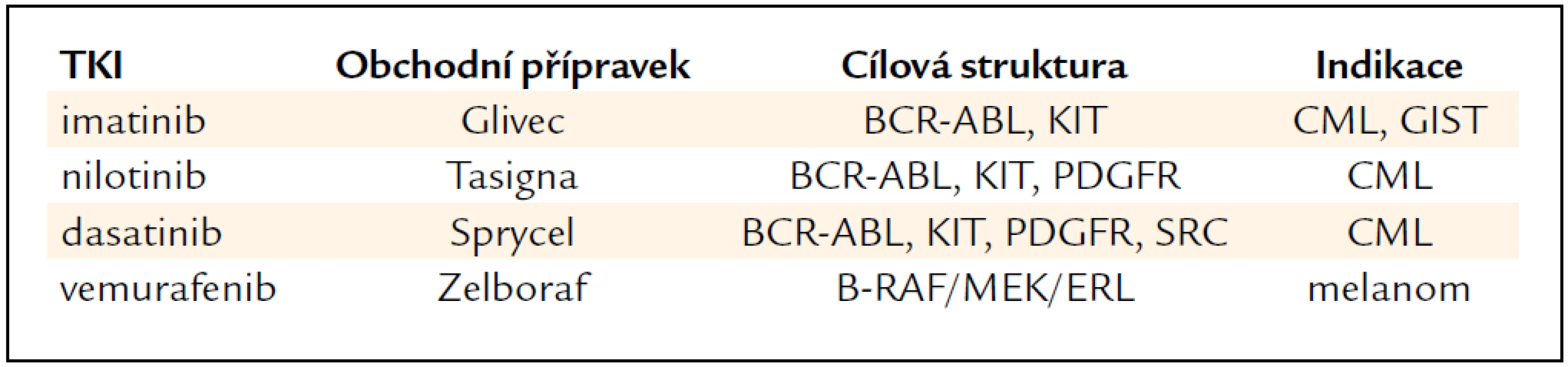
Tzv. multikinázové inhibitory významně zlepšily prognózu metastazujícího karcinomu ledvin a jater. Pro úplnost uvádíme ještě inhibitory m-TOR, které se testují u karcinomu ledviny, nebo u sarkomů, malobuněčného plicního karcinomu a u neuroendokrinních nádorů [12].
TKI s účinkem na nereceptorové tyrozinkinázové proteiny (ABL, SRC) se již staly nepostradatelné především v léčbě CML, gastrointestinálního stromálního tumoru (GIST) a některých dalších onemocnění [13]. Jsou uvedeny v tab. 3. Za zvláštní zmínku stojí nedávno objevený inhibitor kaskády B-Raf/MEK/ERK vemurafenib (Zelboraf) účinný (při mutaci onkogenu B-Raf ) u maligního melanomu. Jak bylo již řečeno, mezi cílená léčiva patří také monoklonální protilátky.
Monoklonální protilátky (MoAb)
Monoklonální protilátky jsou protilátky produkované jedním klonem B-lymfocytů a vykazují tudíž shodnou antigenní specifitu. Dlouhou dobu se používaly hlavně k diagnostickým účelům. Teprve v roce 1997 povolil americký úřad pro kontrolu léčiv (FDA) klinickou aplikaci historicky první monoklonální protilátky antiCD20 (rituximabu) k léčbě nádorového onemocnění. Od té doby jsou do klinické praxe zaváděny každoročně desítky nových MoAb k léčebným účelům (a to nejen v onkologii) a celkový počet klinicky zkoušených MoAB již přesáhl stovku [14,15].
Monospecifické MoAB
V klinické praxi se dosud používají převážně monospecifické MoAb, tj. protilátky obsahující 2 identická vazebná ramena. Patří většinou do třídy IgG. Mají schopnost vázat se na epitopy konkrétních povrchových nádorových antigenů či solubilních proteinů (CD20, CD33, CD40, CD52 atd.), dále na růstové faktory (VEGF), na membránové receptory (EGFR, VEGFR), či na adhezivní molekuly (EpCAM, integriny), cytokiny (TNF, interleukiny). První MoAb zaváděné do klinické praxe byly směrovány na povrchové znaky nádorových, resp. lymfomových či leukemických buněk.
Mechanizmus jejich účinku je znázorněn na obr. 4. Fab fragment (antibody binding) slouží k vazbě antigenu, Fc fragment zprostředkovává vazbu a aktivaci pomocných buněk imunitního systému (makrofágů, NK-buněk). Tento mechanizmus se označuje jako ADCC (antibody dependent celular cytotoxicity). Z cytotoxických buněk se uvolňuje perforin a granzym, které mají význam pro indukci apoptózy. Dalším mechanizmem je aktivace komplementu (CDC – complement dependent cytotoxicity), jehož složky pak penetrují buněčnou membránu a mají cytolytický účinek. Kromě toho mají MoAb i přímý cytotoxický účinek.
Obr. 4. Mechanizmus účinku monospecifických monoklonálních protilátek. 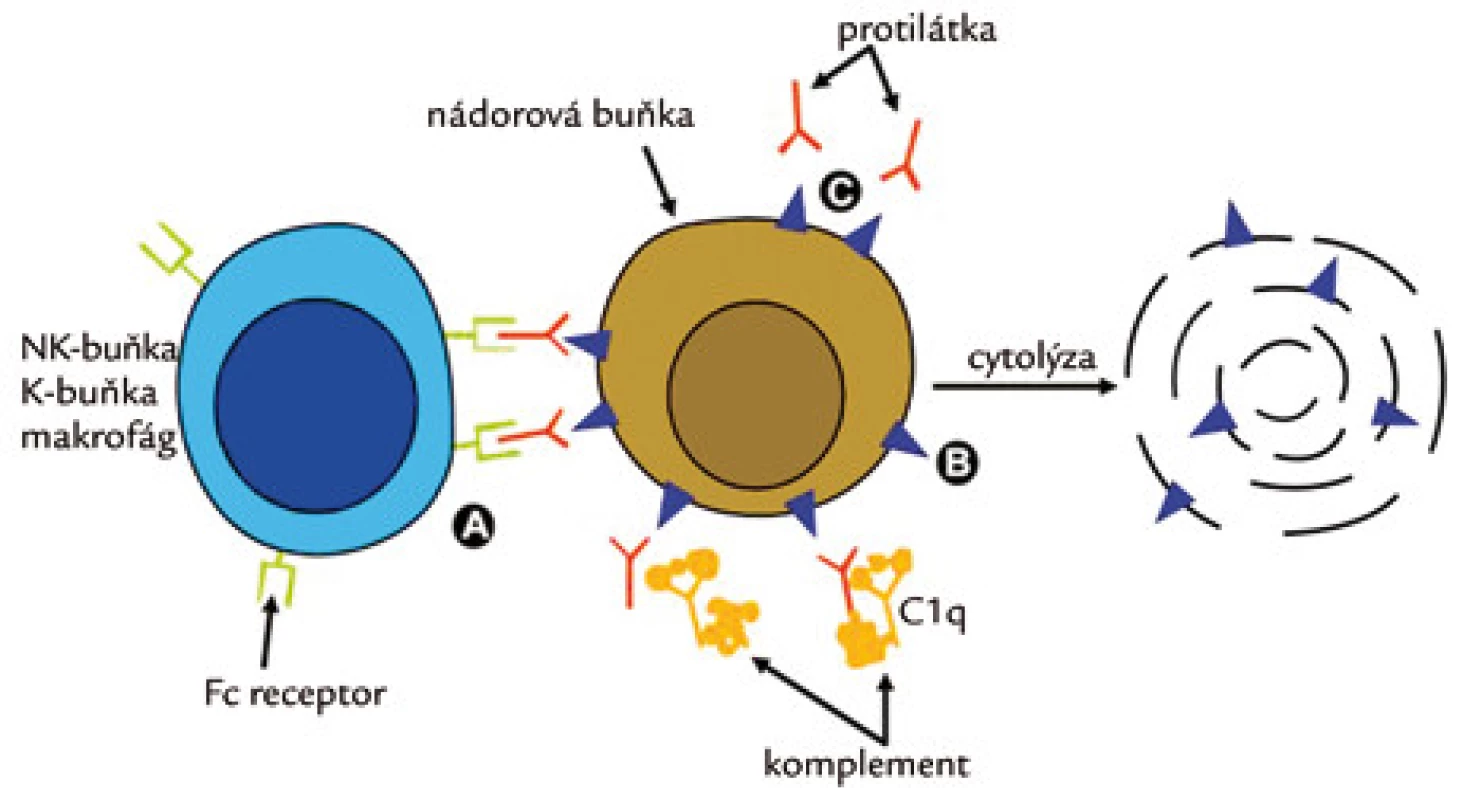
(A) ADCC – antibody dependent celular cytotoxicity, (B) CDC – complement dependent cytotoxocity, (C) – přímý cytotoxický účinek protilátky. Terapeutický účinek MoAb u solidních nádorů může spočívat v blokádě vazby ligandu na specifický receptor buď neutralizací ligandu (bevacizumab), nebo vazbou na extracelulární doménu receptoru (cetuximab, trastuzumab). V obou případech blokuje MoAb aktivaci příslušné signální dráhy (transdukční kaskády), a proto lze léčbu MoAb zahrnout pod širší pojem cílené léčby. Terapeutický účinek u neonkologických onemocnění je způsoben většinou blokádou cytokinů, které hrají důležitou roli v patogenezi příslušného onemocnění (zpravidla inhibice TNF). Kromě onkologie se tedy staly významným léčebným přínosem v dalších disciplinách vnitřního lékařství, především v revmatologii, gastroenterologii, endokrinologii, částečně i v pneumologii, neurologii a dermatologii.
Používané monoklonální protilátky lze rozdělit podle jejich původu a způsobu přípravy na čistě lidské nesoucí koncovku -mumab, čistě myší (-momab), chimerické (-ximab) nebo humanizované (-zumab). Praktičtější je dělení MoAb podle cílové struktury, které uvádíme v tomto sdělení. Uvedeme přehled současně používaných protilátek (1) v hematologické onkologii, (2) u solidních nádorů, (3) v jiných podoborech vnitřního lékařství.
V hematologické onkologii
Protilátky proti membránovým antigenům leukocytů (tab. 4). Nejpoužívanější je chimerická MoAb antiCD20 rituximab (Mabthera). V kombinaci s chemoterapií se stal rituximab zlatým standardem pro léčbu folikulárních lymfomů, chronické lymfocytární leukemie (CLL) i difuzních velkobuněčných lymfomů (DLBCL). Uplatňuje se i v udržovací léčbě folikulárních lymfomů. V současné době probíhá několik set multicentrických studií, které zkoumají možnosti jeho širšího uplatnění. Ofatumumab (Arzerra) je plně lidská protilátka IgG κ (podobně jako rituximab antiCD20), ale rozeznává epitop CD20 na odlišných místech než rituximab, což napovídá, že by mohl být účinný i u nemocných rezistentních na rituximab. Z klinických studií vyplývá jeho účinnost zejména u folikulárních lymfomů, u lymfomů z plášťové zóny (MCL) a u chronické lymfocytární leukemie (CLL). U rezistentních forem CLL se osvědčil alemtuzumab (MacCampath). Je účinný nejen u rezistentních forem CLL, ale používá se též k likvidaci reziduální choroby [16,17].
Tab. 4. Protilátky proti membránovým antigenům leukocytů. 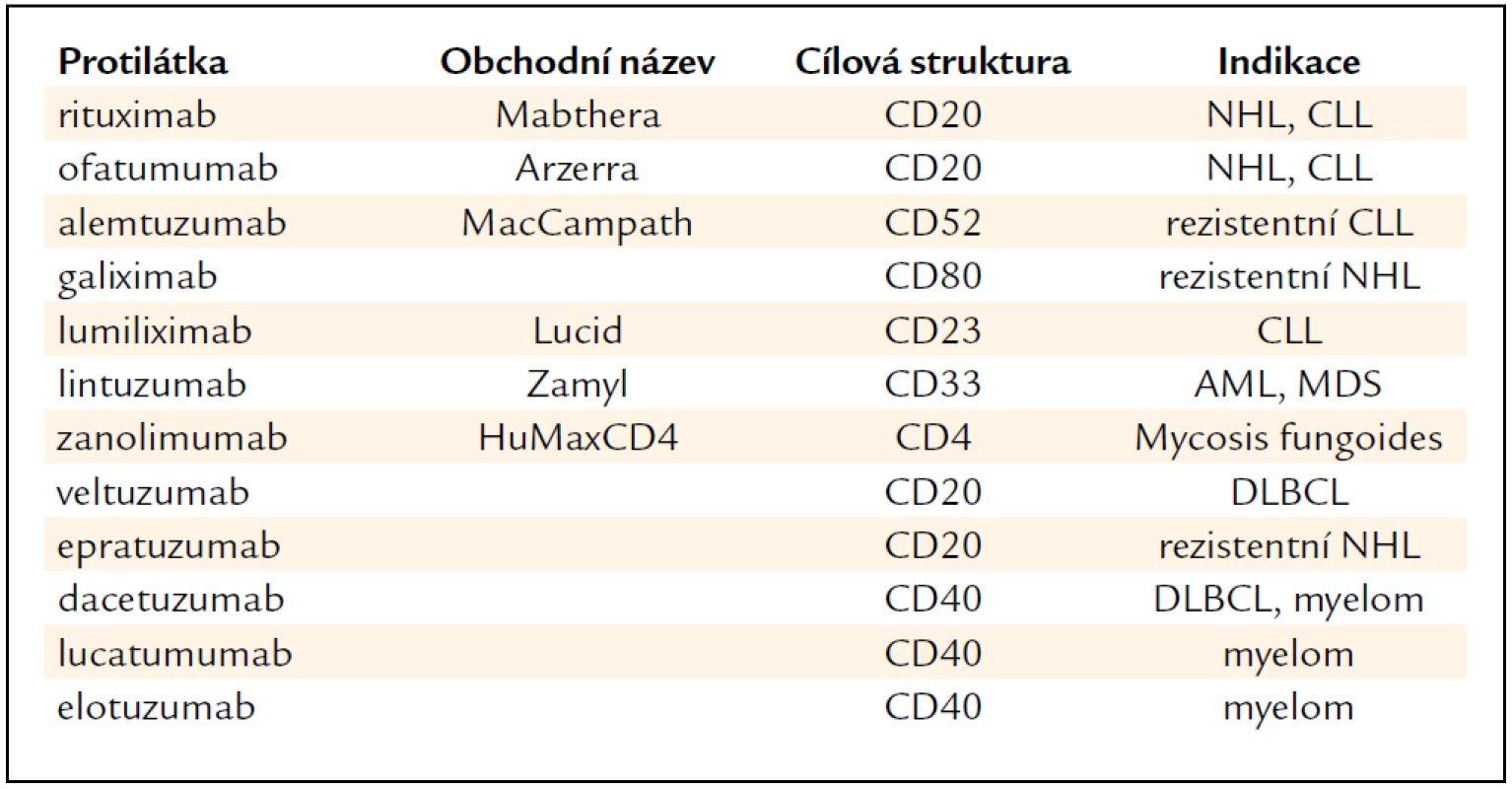
Veltuzumab je další z antiCD20 protilátek s aktivitou u difuzních velkobuněčných lymfomů (DLBCL), epratuzumab u folikulárních NHL rezistentních na rituximab. K léčbě rezistentních NHL se doporučuje též galiximab, chimerická protilátka antiCD80, kterou je možno kombinovat s rituximabem. Dosud však není schválen ke klinickému použití. K léčbě CLL jsou k dispozici 2 protilátky. Lumiliximab (Lucid), antiCD23, se zdá být předurčen k terapii CLL, neboť antigen CD23 je exprimován na všech buňkách CLL. Kromě obvyklých mechanizmů účinku byl prokázán stimulační účinek lumiliximabu na apoptózu, neboť snižuje expresi BCL-2 a aktivuje kaspázy. Jeho účinnost se v současné době prověřuje v klinických studiích. Zanolimu-mab je čistě lidská protilátka, která se zkouší u mycosis fungoides, Sézaryho syndromu a dalších lymfoproliferací exprimujících CD4 (angioimunoblastický lymfom, T-velkobuněčný lymfom). Lintuzumab (Zamyl) (SGN33) je protilátka proti antigenu CD33 exprimovanému na povrchu buněk akutní myeloidní leukemie (AML). Protilátky antiCD40 dacetuzumab a lucatumumab, podobně jako elotuzumab, se zkoušejí v léčbě mnohočetného myelomu, ale jeví účinnost i u dalších lymfoproliferací.
U solidních nádorů
Protilátky proti receptorům rodiny EGFR/ERBB/HER se uplatňují především v léčbě solidních nádorů (tab. 5). Trastuzumab (Herceptin) je protilátka proti receptoru ERB2/HER2/NEU zvýšeně exprimovaného u pacientek s karcinomem prsu, ale zvýšená exprese byla prokázána též u karcinomu prostaty a ovaria [19]. Pertuzumab (Omnitarg) se váže na odlišný epitop než trastuzumab, zdá se, že má synergní účinek s trastuzumabem. Cetuximab (Erbitux) je protilátka proti extracelulární doméně receptoru pro epidermální růstový faktor (EGFR/ERBB/HER1). Vazba na receptor zablokuje aktivaci signálního přenosu kaskády MAPK a pAKT [20]. Indikační podmínkou je nemutovaný stav genu KRAS u buněk nádorové tkáně (asi 60 % nemocných). V případě mutace je signální dráha trvale stimulována bez ohledu na blokádu EGFR, a proto se podávání cetuximabu v těchto případech jeví jako neúčelné. Kromě kolorektálního karcinomu je cetuximab indikován k terapii lokálně pokročilých forem spinocelulárního karcinomu ORL oblasti. Panitumumab je protilátka s vysokou afinitou k receptoru EGFR. Má podobné indikace i podobná indikační omezení jako cetuximab. Nimotuzumab má mít omezenější nežádoucí účinky. V roce 2008 získal status „orphan drug“ (přípravek pro vzácná onemocnění) pro léčbu karcinomu pankreatu.
Tab. 5. Protilátky proti receptorům EGFR/ERBB/HER. 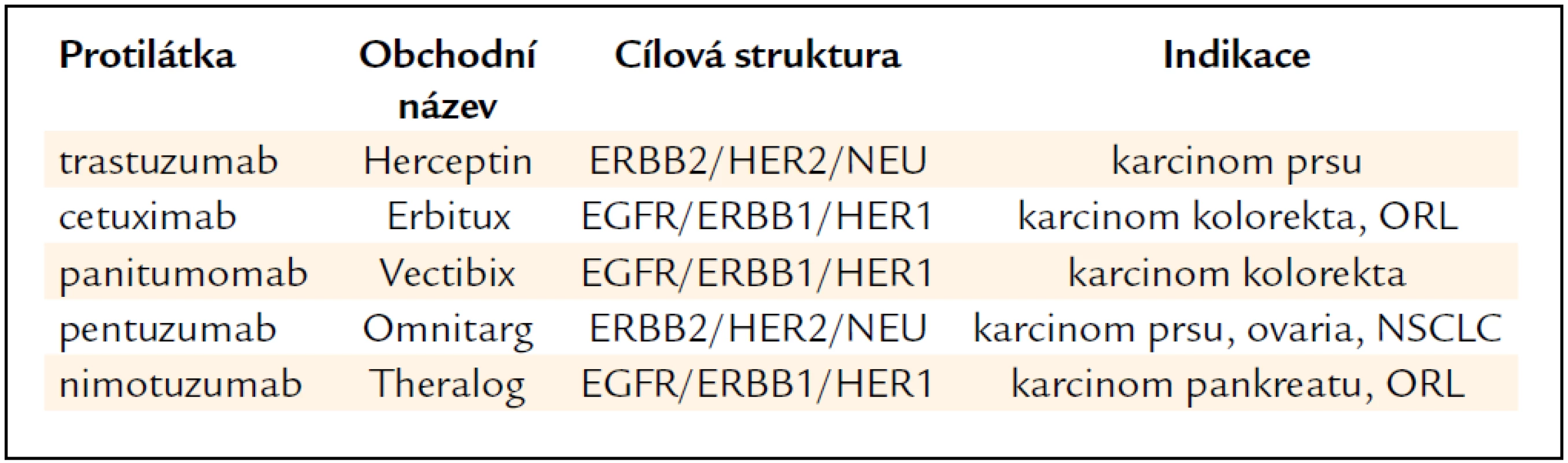
Protilátky s antiangiogenním účinkem jsou v popředí zájmu, neboť inhibice angiogeneze může významně ovlivnit růst nádoru a jeho metastazování [21]. Nejvíce zkušeností je s neutralizační protilátkou proti ligandu VEGF, který se váže na receptory VEGFR1-3, takže jeho neutralizace komplexně blokuje novotvorbu cév v nádoru. Touto protilátkou je bevacizumab (Avastin). V kombinaci s chemoterapií se podává v léčbě kolorektálního karcinomu, karcinomu prsu, karcinomu plic, ledviny i nádorů CNS. Ranibizumab je fragment bevacizumabu pro nitrooční aplikaci. VEGF-trap a volociximab (protilátka proti α5-β1-integrinu) jsou předmětem klinického testování (tab. 6).
Tab. 6. Antiangiogenní protilátky a protilátky indukující imunitní odpověď. 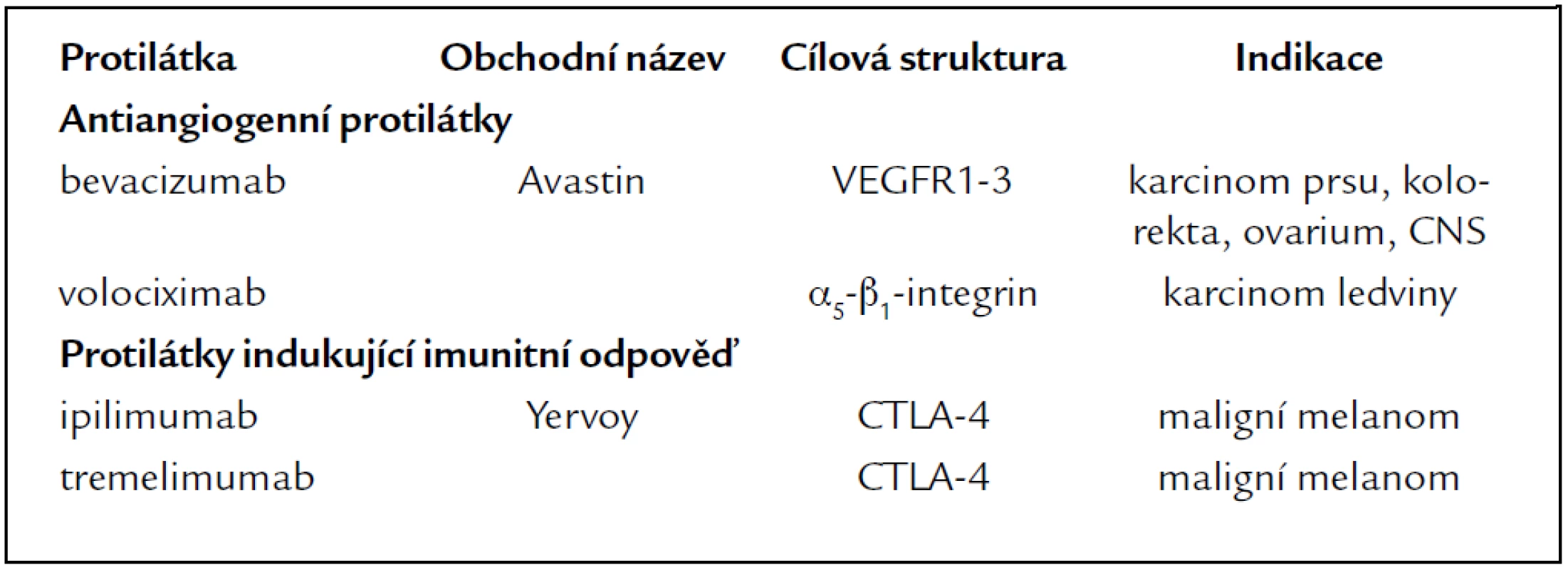
Protilátky indukující imunitní odpověď mohou působit blokádou inhibičních molekul (např. CTLA-4) nebo stimulací kostimulačních molekul (protilátka anti 4-1BB). CTLA-4 se vyskytuje na povrchu T-lymfocytů a patří spolu s antigenem CD28 k hlavním regulátorům imunologické odpovědi. CTLA-4 tlumí imunitní odpověď a jeho blokáda protilátkou umožní dlouhodobou aktivaci a proliferaci T-lymfocytů a v ideálním případě napadení a destrukci nádorových buněk cytotoxickými T-lymfocyty [22]. V současné době se zkoušejí 2 lidské MoAb blokující CTLA-4, a to ipilimumab (IgG1 MoAb) (Yervoy) a tremelimumab (homologní IgG2 protilátka), obě s příznivými efekty u maligního melanomu.
V jiných podoborech vnitřního lékařství
Léčba MoAb se stala přínosem i v léčbě různých onemocnění zejména v revmatologii [23–25], v gastroenterologii [26] i v dalších podoborech vnitřního lékařství [27,28] (tab. 7).
Tab. 7. Monoklonální protilátky v léčbě neonkologických onemocnění. 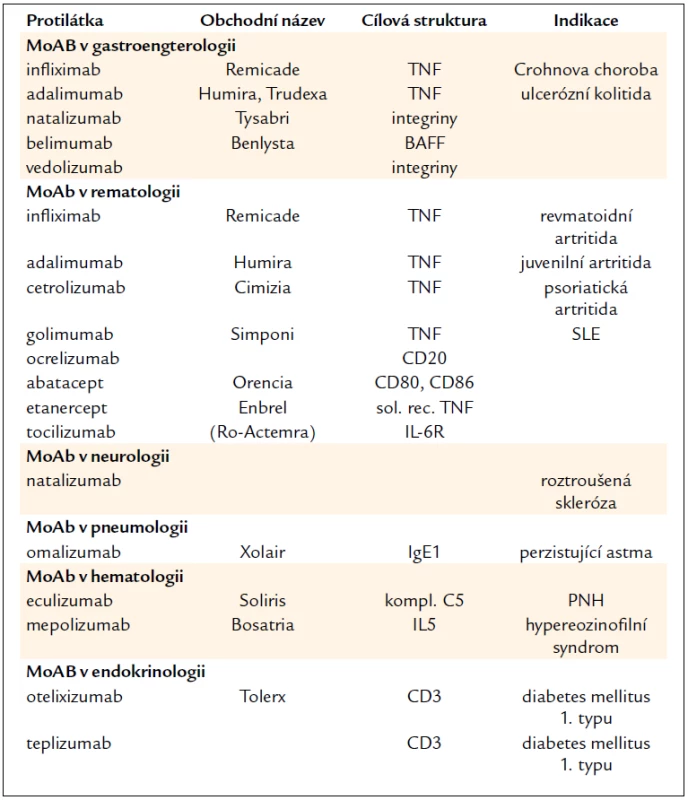
Konjugované protilátky
Konjugované protilátky jsou konstruovány se záměrem posílit protinádorovou účinnost [29]. Nejčastěji se používá konjugace s radionuklidem, s cytostatikem nebo s toxinem. Navázaná látka je protilátkou dopravena do cílové tkáně, kde pak uplatní svůj cytotoxický účinek. V případě navázaného radionuklidu se podle povahy zářiče cytotoxický účinek projeví i na elementech uvnitř nádorové masy (tab. 8).
Tab. 8. Konjugované monoklonální protilátky. 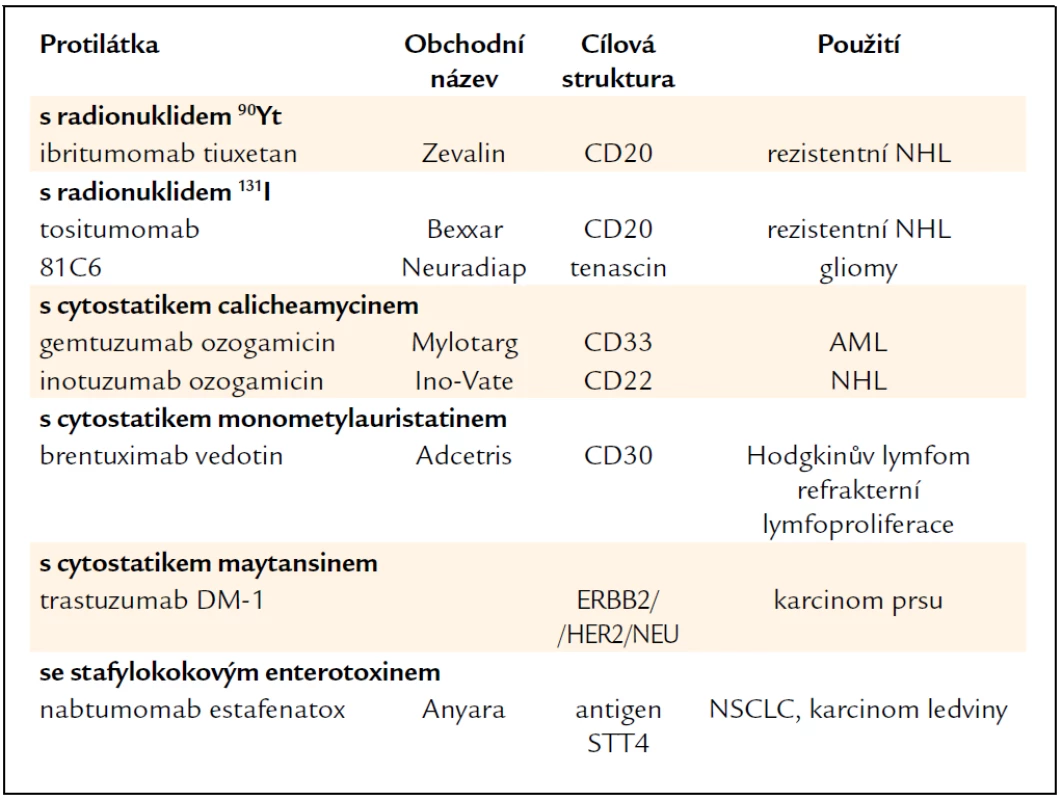
U nás se používá ibritumomab tiuxetan (Zevalin) – protilátka antiCD20 konjugovaná s yttriem 90. 90Y je β zářič s průnikem do vzdálenosti 11,9 mm působící cytolýzu i v omezeně vaskularizovaném nádoru. Efektivní poločas zářiče je 30 hod. Protilátka je indikována k léčbě rezistentních forem NHL. Tositumomab (Bexxar), protilátka s navázaným jodem (131I) u nás není k dispozici. Inotuzumab ozogamicin (Ino-Vate) je antiCD33 protilátka konjugovaná s calicheamycinem, cytostatikem izolovaným z Micromonospora calichensis působícím zlomy DNA. Používá se v léčbě NHL. Brentuximab vedotin (Adcetris) je chimerická protilátka antiCD30 konjugovaná enzymaticky štěpitelnou vazbou s monometylauristatinem E (MMAE). V cirkulaci je přípravek stabilní, po vazbě na cílovou buňku se rychle internalizuje a odštěpený MMAE působí zánik buňky. Testuje se u refrakterních lymfoproliferací a u Hodgkinova lymfomu. Trastuzumab DM1 - je označení trastuzumabu konjugovaného s myatansinem (cytostatikum inhibující mikrotubuly) s předpokládanou účinností u karcinomu prsu, a to i v případech rezistentních na trastuzumab [20]. Nabtumomab estafenatox je protilátka konjugovaná se stafylokokovým enterotoxinem E (estafenatox). Jde v podstatě o fúzní protein – imunotoxin. Látka byla schválena v EU pro karcinom ledviny, testuje se u NSCLC.
Bispecifické/trifunkční monoklonální protilátky
Obsahují dva různé Fab fragmenty a mají proto schopnost vázat dva odlišné antigeny (obr. 5). Při přípravě klasickou hybridomovou technikou vznikají tzv. protilátky trifunkční, které mají kromě dvou odlišných Fab fragmentů též Fc fragment [30]. Tím aktivují pomocné buňky (makrofágy, dendritické buňky, NK-buňky), jinými slovy indukují ADCC [31]. Jedním fragmentem Fab vážou nádorový antigen, kdežto druhým atrahují T-lymfocyty do místa nádoru. Navíc pomocné buňky kostimulují navázané T-lymfocyty, což dále zesiluje protinádorový účinek protilátky. Bispecifické/trifunkční protilátky jsou zatím předmětem klinického testování. Ke klinickému použití byla zatím schválena protilátka catumaxomab (Removab) k léčbě rezistentního maligního ascitu. Protilátka je zaměřena proti EpCAM (epithelial cell adhesion molecule) a antigenu CD3.
Obr. 5. Rozdíl v mechanizmu účinku monospecifické a bispecifické protilátky. Bližší komentář v textu. 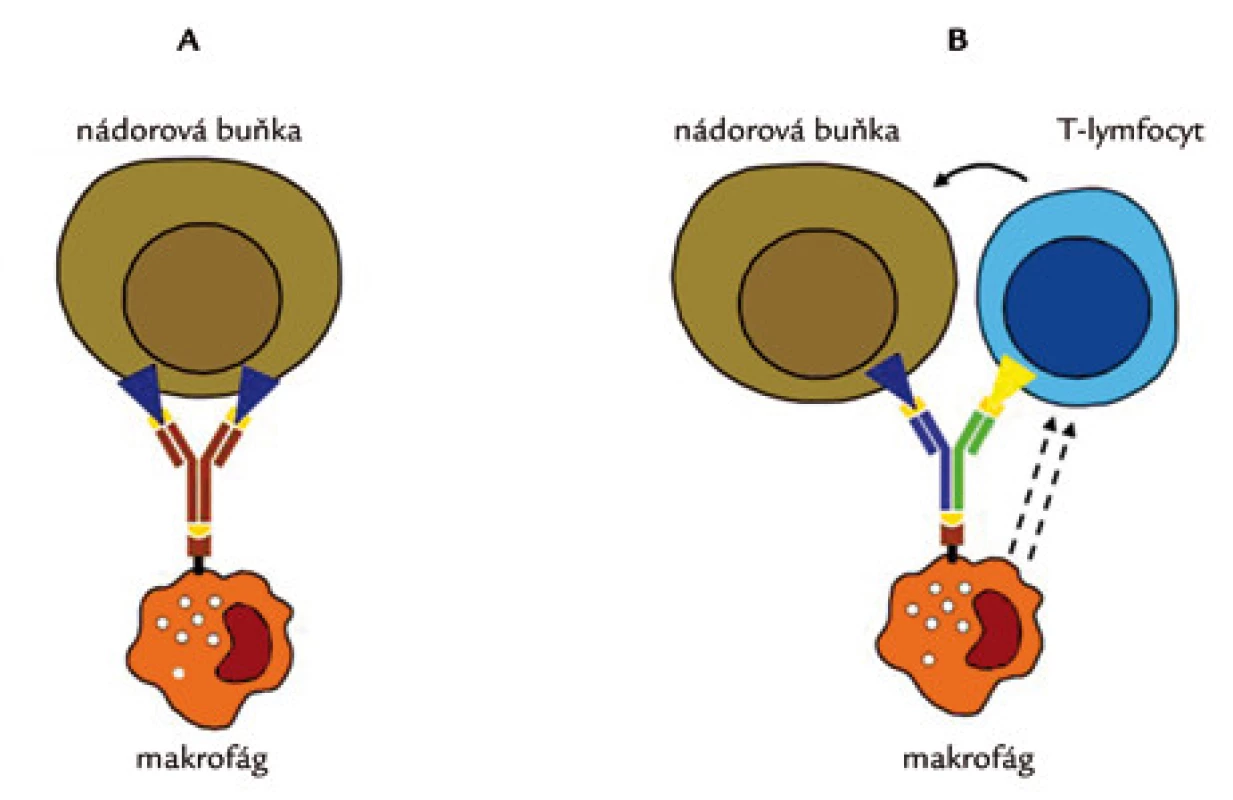
Závěr
Během posledních 10 let pronikla cílená léčba téměř do všech podoborů vnitřního lékařství a její zavedení významně zlepšilo prognózu mnoha onemocnění. Zatímco v onkologii nachází největší uplatnění v kombinaci s konvenční chemoterapií, u neonkologických onemocnění jsou cílená léčiva vysoce efektivní i v samostatném podání. Moderní metody genového inženýrství umožňují syntézu vysokého počtu účinných protilátek a jsou zaváděny i protilátky nové generace. Jsou to tzv. diabodies rekombinantně připravené protilátkové fragmenty [25]. Fv fragment je část Fab fragmentu, která reálně váže antigen, svFV (single chanin fragment variable) je tvořen dvěma Fv fragmenty spojenými rekombinantně do jednoho řetězce. Jinou formou jsou peptibodies rekombinantně připravené fúzní proteiny Fc fragmentů s polypeptidy vykazujícími vazebnou afinitu ke specifickým molekulám (ligandům, receptorům apod.). Mezi peptibodies patří např. romiplostim (Nplate), fúzní protein Fc fragmentu a IgG polypeptidu s vazebnou (stimulační) afinitou k receptoru pro trombopoetin. Podobně jako nativní trombopoetin stimuluje trombocytopoézu. Do jaké míry najdou protilátky nové generace širší uplatnění v klinické praxi, ukáží teprve příští léta.
prof. MUDr. Pavel Klener, DrSc.
www.lf1.cuni.cz
e-mail: Pavel.Klener@ruk.cuni.cz
Doručeno do redakce: 3. 1. 2013
Zdroje
1. Airley R. Cancer chemotherapy. Willey-Blackwell, Oxford 2009.
2. Dorr RT, Von Hoff DD. Cancer chemotherapy handbook. Appleton and Lange, Norwalk, 1994.
3. Klener P. Klinická onkologie.Praha: Galén-Karolinum 2002.
4. Mladosievičová B et al. Molekulové mechanizmy patogenézy nádorov. Bratislava: SAP 2011, 123 s.
5. Estey E. New drugs in acute myeloid leukemia. Semin Oncol 2008; 35 : 439–448.
6. Mayer J, Klamová H, Žáčková D et al. Imatinib v první linii léčby s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi. Transfuze Hematol Dnes 2008; 15 : 150–158.
7. Klener P, Klener jr. P. Nová protinádorová léčiva a léčebné strategie v onkologii. Praha: Grada Publishingh 2010.
8. Moreira IS, Fernandes PA, Ramos MJ. Vascular endothelial growth fractor (VEGF) inhibition - a critical review. Anticancer agents Med Chem 2007; 7 : 223–245.
9. Hartman JT, Haap M, Koop HG et al. Tyrosine kinase inhibitors – a review on pharmacology metabolism and side effects. Curr Drug Metab 2009; 10 : 470–481.
10. Wong MK, Lo AL, Lam B et al. Erlotinib as a salvage treatment after failure of first line gefitinib in non small cell lung cancer. Cancer Chemother Pharmacol 2009; 64 : 656–663.
11. Ferrara N, Kerbel RS. Angiogenesis as a therapeutic target. Nature 2005; 438 : 967–974.
12. Chan S. Targeting the mammalian target of rapamycin (m-TOR): a new approach to treating cancer. Br J Cancer 2004; 25 : 1420–1424.
13. Klener P, Klener jr. P. ABL1, SRC a další nereceptorové proteinkinázy jako nové cíle specifické protinádorové terapie. Klin Onkol 2010; 23 : 203–209.
14. Adams GP, Weiner LM. Monoclonal antibody therapy of cancer. Nature Biotechnol 2005; 23 : 1147–1157.
15. Weiner LM, Surana R, Wang S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Natur Rev 2010; 10 : 317–327.
16. Belada D. Monoklonální protilátky v léčbě lymfomů. Remedia 2008; 6 : 416–423.
17. Tazi L, Nafil H, Mahmal L. Monoclonal antibodies in hematological malignancies: past, present and future. J Cancer Res Ther 2012; 7 : 309–407.
18. Castillo J, Winer E, Quinsberry O. Newer monoclonal antibodies for hematological malignancies. Exp Hematol 2008; 36 : 755–768.
19. Palácová M. Trastuzumab. Remedia 2009; 20 : 4–13.
20. Van Cutsem E. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. New Engl J Med 2009; 369 : 1408–1417.
21. Ellis LM, Hicklin DJ. VEGF-targeted therapy: mechanisms of antitumor activity. Cancer 2008; 8 : 579–591.
22. Weber J. Ipilimumab: controversies in its development, utility and autoimmune adverse events. Cancer Immunol Immunother 2009; 58 : 823–830.
23. Chan AC, Carter PJ. Therapeutic antibodies for autoimmunity and inflammation. Nature rev 2010; 10 : 301–316.
24. Choy EHS, Kingsley GH, Panayi GS. Monoclonal antibody therapy in rheumatoid arthritis. Brit J Rhematol 1998; 37 : 484–490.
25. Yuvienco C, Schwartz S. Monoclonal antibodies in rheumatic diseases. Med Health/Rhode Island 2011; 94 : 320–324.
26. Hanauer SB, Sandborn WJ, Rutgeerts P et al. Human anti-tumor necrosis factor monoclonal antibody (adalimumab) in Crohn´s disease. Gastroenteology 2006; 130 : 323–333.
27. Kelly RJ, Hill A, Arnold LM et al. Long-term treatment with eculimumab in paroxaysmal nocturnal hemoglobinuria. Blood 2011; 117 : 6786–6792.
28. Polman CH, O´Connor PW, Havrdova E et al. A randomized, placebo controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med 2006; 354 : 899–904.
29. Carter PJ, Senter PD. Antibody-drug conjugates for cancer therapy. Cancer J 2008; 14 : 154–169.
30. Kontermann RF. Recombinant bispecific antibodies for cancer. Acta Pharmacol 2005; 26 : 1–9.
31. Goldenberg DM, Cardillo IM, Shi V et al. Bispecific anti CD20/22 antibodies inhibit B-cell lymphoma proliferation by unique mechanism of action. Blood 2008; 111 : 2211–2219.
32. Nelson AI, Reichert JM. Development trends for therapeutic antibody fragments. Nature Biotechnol 2009; 27 : 331–337.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Liečba AL-amyloidózy v roku 2012, prínos nových liekov – editorial
- Výsledky katetrové ablace fibrilace síní u pacientů nad 65 let
- Rizikové faktory rekurentního a těžkého průběhu kolitidy vyvolané infekcí Clostridium difficile
- Existuje závislost mezi hladinou adipocyte fatty acid binding proteinu a kalciovým skóre u asymptomatických příbuzných pacientů s KVO?
- Léčba AL-amyloidózy v roce 2012, přínos nových léků (bortezomibu, thalidomidu a lenalidomidu). Přehled publikovaných klinických studií
- Cílená léčiva a jejich přínos pro terapii vnitřních chorob
- Léky indukovaná osteoporóza
- Zvláštnosti diagnostiky a terapie exokrinní pankreatické nedostatečnosti
- AII antagonisté v léčbě hypertenze a prevenci CMP
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Léky indukovaná osteoporóza
- Rizikové faktory rekurentního a těžkého průběhu kolitidy vyvolané infekcí Clostridium difficile
- Zvláštnosti diagnostiky a terapie exokrinní pankreatické nedostatečnosti
- Výsledky katetrové ablace fibrilace síní u pacientů nad 65 let
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



