Terapeutické monitorování amikacinu a gentamicinu v rutinní klinické praxi
Therapeutic monitoring of amikacin and gentamicin in routine clinical practice
Aminoglycosides constitute one of the oldest classes of antimicrobials. Despite their relative toxicity, mainly nephrotoxicity and ototoxicity, aminoglycosides are valuable in current clinical practice. They are bactericidal agents with activity against aerobic gram-negative infections and against gram-positive cocci when added to a cell wall active antimicrobial-based regimen (e.g. betalactams). Aminoglycosides have a concentration-dependent bactericidal effect and a long post antibiotic effect. There is accumulating evidence to show that large, single, daily doses (or more correctly, extended interval dosing) of aminoglycosides is associated with less nephrotoxicity and ototoxicity and comparable, if not superior clinical outcomes than the same total dose administered in small, multiple doses. The efficacy and toxicity of aminoglycosides show a strong direct positive relationship with blood drug concentrations. A key strategy in minimizing toxicity and optimizing therapy is therapeutic drug monitoring.
Key words:
aminoglycosides – amikacin – gentamicin – therapeutic monitoring
Autoři:
Ivana Kacířová 1,2; Milan Grundmann 1
Působiště autorů:
Ústav klinické farmakologie LF OU Ostrava, přednosta doc. MUDr. Milan Grundmann, CSc.
1; Oddělení klinické farmakologie Ústavu laboratorní diagnostiky FN Ostrava, primářka MUDr. Ivana Kacířová, Ph. D.
2
Vyšlo v časopise:
Vnitř Lék 2015; 61(1): 33-41
Kategorie:
Přehledné referáty
Souhrn
Aminoglykosidy patří mezi nejstarší antibiotika, a i přes své relativně toxické účinky (nefrotoxicita a ototoxicita) jsou v současné klinické praxi cennou léčebnou skupinou. Jsou účinné zejména proti aerobním gramnegativním infekcím a v kombinaci s antibiotiky poškozujícími buněčnou stěnu (např. betalaktamy) také proti grampozitivním kokům. Vyznačují se koncentračně závislým baktericidním účinkem a dlouhým postantibiotickým efektem. Existuje mnoho důkazů o tom, že jedna velká denní dávka (respektive prodloužený dávkovací interval) aminoglykosidů je spojena s nižším rizikem nefrotoxicity a ototoxicity a srovnatelnou, ne-li lepší klinickou účinností v porovnání se stejnou celkovou denní dávkou podanou v několika menších dávkách během dne. Účinnost a toxicita aminoglykosidů vykazuje silný vztah k jejich sérové koncentraci. Klíčovou úlohu v minimalizaci toxicity a optimalizaci dávkování má terapeutické monitorování.
Klíčová slova:
aminoglykosidy – amikacin – gentamicin – terapeutické monitorování
Úvod
Aminoglykosidy patří mezi nejstarší antibiotika a i přes své relativně toxické účinky jsou cennou léčebnou skupinou v současné klinické praxi [1]. Jsou účinné zejména proti aerobním gramnegativním infekcím a v kombinaci s antibiotiky poškozujícími buněčnou stěnu (např. betalaktamy) také proti grampozitivním kokům. Gentamicin a amikacin se vyznačují podobnými farmakokinetickými vlastnostmi s dosažením vrcholové sérové koncentrace za 30–60 min po aplikaci intravenózní infuze a terminálním biologickým poločasem 1,5–3,5 hod u dospělých pacientů s normálními renálními funkcemi. Jsou minimálně vázány na plazmatické proteiny a eliminace probíhá zejména glomerulární filtrací nezměněného léčiva do moči. Malé množství je reabsorbováno v proximálním tubulu, čímž se podílí na nefrotoxicitě aminoglykosidů [2].
Amikacin
Amikacin je semisyntetické aminoglykosidové antibiotikum se širokým spektrem účinku určené k léčbě těžkých infekcí vyvolaných citlivými bakteriemi v případech, v nichž jsou méně toxická antimikrobiální agens neúčinná. Působí převážně proti gramnegativním bakteriím (Pseudomonas sp., Haemophilus influenzae, Escherichia coli, Proteus sp., Klebsiella sp., Enterobacter – Serratia sp., Salmonella sp., Shigella sp., Acinetobacter sp., Citrobacter freundii, Providencia sp.), ze skupiny grampozitivních mikrobů je vůči amikacinu nejcitlivější Staphylococcus sp., a to kmeny jak produkující, tak i neprodukující penicilinázu, i kmeny rezistentní vůči meticilinu. Na amikacin jsou citlivé i četné kmeny rezistentní vůči některým jiným aminoglykosidům; rezistence vůči amikacinu je u prvotně citlivých kmenů velmi vzácná a objevuje se teprve po několikaletém používání a jen v nízkém procentu ve srovnání s jinými aminoglykosidy. Kritické minimální inhibiční koncentrace (MIC) dle EUCAST (European Committee on Antimicrobial Susceptibility Testing) jsou jako senzitivní uváděny ≤ 8 mg/l [3]. Amikacin se řadí také mezi léčiva používaná k terapii tuberkulózy včetně její farmakorezistentní formy (multidrug-resistant tuberculosis – MDR-TB), jejíž incidence celosvětově narůstá [4].
Gentamicin
Gentamicin je určen k léčbě těžkých infekcí vyvolaných bakteriemi citlivými na gentamicin, v případech, v nichž nejsou méně toxická antibiotika účinná. Je účinný proti některým grampozitivním organizmům (Staphylococcus spp.) a proti široké škále gramnegativních mikroorganizmů (většina enterobakterií, jako je Escherichia coli, Enterobacter spp., Klebsiella, Proteus, Salmonella, Shigella, Providencia, Serratia, Citrobacter, Hafnia, Edwardsiella; Pseudomonas aeruginosa, Brucella, Moraxella, Pasteurella multocida, Francisella tularensis, Acinetobacter calcoaceticus, Aeromonas spp, Campylobacter pylori, Campylobacter jejuni). Kritické koncentrace MIC EUCAST jsou jako senzitivní uváděny ≤ 1 mg/l (stafylokoky) až ≤ 4 mg/l (Pseudomonas spp., Acinetobacter spp.) [3].
Nežádoucí účinky
Mezi nežádoucí účinky patří zejména nefrotoxicita a ototoxicita, zřídkavě pak neuromuskulární toxicita. Nefrotoxicita se objevuje u 10–20 % pacientů, vyšší výskyt je popisován v kombinaci s dalšími nefrotoxickými léčivy, jako je např. vankomycin. Akutní renální toxicita může být během léčby kriticky nemocných fatální, většinou je však po vysazení aminoglykosidů reverzibilní, protože renální tubulární buňky mohou proliferovat a nahradit buňky poškozené aminoglykosidovou toxicitou. Běžný postup k omezení nefrotoxicity zahrnuje monitorování sérových koncentrací aminoglykosidů, monitorování sérového kreatininu, omezení souběžné terapie s jinými nefrotoxickými látkami a minimalizace trvání léčby aminoglykosidy. Jestliže však ledviny již nemohou dále kompenzovat toxický efekt aminoglykosidů, dochází ke zvyšování sérových koncentrací kreatininu a urey, což se děje asi po 1 týdnu terapie jako pozdní známka poškození. Zvyšující se údolní koncentrace aminoglykosidů při aplikaci stejné dávky však již může být dřívějším a poměrně silným znamením snížené renální filtrační kapacity. Ototoxicita může vést jak k trvalé ztrátě sluchu, tak k vestibulární dysfunkci. Mezi rizikové faktory zvyšující výskyt ototoxicity patří délka léčby, kumulativní dávka, průměrná denní dávka, vyšší maximální sérová koncentrace aminoglykosidů, souběžné užívání diuretik, základní onemocnění, předchozí expozice aminoglykosidům, preexistující renální onemocnění a genetické predispozice. Trvalá ztráta sluchu a vestibulární dysfunkce jsou obvykle ireverzibilní, jelikož se buňky vnitřního ucha neobnovují. Z důvodu ototoxicity a jejího vztahu ke kumulativní dávce a délce trvání léčby by všichni pacienti měli být léčeni amoniglykosidy co nejkratší dobu. Neuromuskulární blokáda je vzácným, nicméně potenciálně nebezpečným vedlejším účinkem aminoglykosidů. Nejčastěji byla popisována u peritoneálního výplachu roztokem neomycinu, nicméně lze také najít popisy případů u intravenózní aplikace jiných aminoglykosidů. Je proto potřeba opatrně zvažovat poměr rizika a prospěchu při podávání aminoglykosidů u pacientů, kteří současně dostávají léčiva blokující neuromuskulární přenos nebo u pacientů s neuromuskulárním onemocněním, jako je myasthenia gravis nebo parkinsonizmus [1–3,5,6].
Farmakodynamické indikátory účinnosti
Základní farmakodynamické indikátory účinnosti aminoglykosidů jsou dva: poměr plochy pod křivkou za 24 hod a minimální inhibiční koncentrace (AUC0–24/MIC) a poměr maximální sérové koncentrace a minimální inhibiční koncentrace (Cmax/MIC). Poměr Cmax/MIC souvisí výhradně s distribučním objemem, zatímco poměr AUC0–24/MIC je ovlivněn jak distribučním objemem, tak clearance [7]. Aminoglykosidy se vyznačují koncentračně závislým baktericidním účinkem a dlouhým postantibiotickým efektem (PAE). PAE vyjadřuje dlouhodobější kontinuální supresi bakteriálního růstu, i když koncentrace léčiva dosáhne hodnoty pod MIC bakterií [8]. Je uváděno stále více důkazů, že jedna velká denní dávka (nebo přesněji, prodloužený dávkovací interval) aminoglykosidů je spojena s menším rizikem nefrotoxicity a ototoxicity a se srovnatelnými, ne-li lepšími klinickými výsledky v porovnání se stejnou celkovou dávkou podávanou v menších, vícenásobných dávkách. Experimentálně bylo prokázáno, že vysoká maximální koncentrace aminoglykosidů zajišťuje lepší a rychlejší baktericidní efekt u standardního bakteriálního inokula [9]. Moore et al [10] demonstrovali, že vysoké Cmax aminoglykosidů vzhledem k MIC infekčního organizmu je hlavním činitelem klinické odezvy a poměr Cmax/MIC je signifikantně spojen s klinickým výsledkem; Cmax/MIC < 2 souvisel s mírou odezvy 0,55, která se zvýšila na 0,9 při Cmax/MIC 10–12. Na základě těchto a dřívějších dat by měla být cílová maximální koncentrace aminoglykosidů založena na citlivosti přítomného patogenu [10] a je doporučováno individualizované dávkování využívající prodloužený dávkovací interval, který maximalizuje poměr Cmax/MIC [8]. Práce autorů Moore et al [10] také ukázala horší výsledky u pacientů s vyšší údolní koncentrací aminoglykosidů související s fenoménem adaptivní rezistence, což znamená, že gramnegativní organizmy jsou vystaveny sníženému příjmu léčiva po počáteční expozici. Tato redukce příjmu léčiva snižuje usmrcování bakterií. Panuje názor, že adaptivní rezistence by měla být reverzibilní po prodloužení trvání nízké koncentrace léčiva a once-daily (1krát denně) dávkování by mělo adaptivní rezistenci snižovat a zlepšovat usmrcování bakterií [5,10]. Optimální délka tohoto drug-free intervalu dosud nebyla identifikována, na základě modelu na myších by další podání léčiva mělo nastat po významnějším poklesu koncentrace pod MIC, což by při MIC = 1 mg/l mělo znamenat další aplikaci při koncentraci léčiva 0,5 mg/l [10]. V úvahu by mělo být také bráno místo infekce, vysoká once-daily dávka je důležitější v případě pulmonální nebo meningeální infekce, protože do těchto míst je průnik aminoglykosidů snížený. Aplikace ve 2–3 stejných dávkách zůstává indikována při léčbě endokarditidy [11].
Zásady terapeutického monitorování hladin aminoglykosidů
Aminoglykosidy se vyznačují úzkým terapeutickým indexem a jejich účinnost i toxicita úzce souvisí s jejich koncentrací v séru. Subterapeutické hladiny zvyšují riziko rezistence mikroorganizmů a také mortality, monitorování sérových koncentrací aminoglykosidů je nezbytné pro minimalizaci nežádoucích účinků. Interindividuální variabilita kinetických parametrů aminoglykosidů také vyžaduje individualizaci dávkování těchto antibiotik založenou na sérové koncentraci [8,9,12]. Klíčovou strategii v minimalizaci toxicity a optimalizaci terapie představuje terapeutické monitorování. Empirická úprava dávkování vede k „období pokusu a omylu“ s různými dávkovacími režimy, dokud není dosaženo optimální sérové koncentrace. Tento přístup může vést k chybné úpravě dávkování, prodloužení doby k dosažení cílové koncentrace a zbytečnému navyšování nákladů na zdravotní péči. Bylo prokázáno, že pacienti, kteří dosáhli cílové terapeutické sérové koncentrace aminoglykosidů v dřívějším období léčby, měli lepší klinické výsledky [7]. Proaktivní terapeutické monitorování spolu s optimalizovaným počátečním dávkovacím režimem vede k redukci mortality, snížení toxicity a snížení nákladů [13]. El Desoky et al [14] zdokumentovali, že se zvyšujícím se počtem požadavků na terapeutické monitorování se snižuje počet maximálních subterapeutických a také údolních toxických koncentrací souběžně se snižováním neonatální mortality na sepsi. Základní metodou, která by měla být pokud možno používána, je Bayesianský přístup, který umožňuje optimální využití všech informací zahrnutých v populačním modelu (a priori) v kombinaci s nejaktuálnějšími farmakokinetickými daty pacienta (a posteriori) k získání nejpřesnějšího dávkovacího režimu pro daného pacienta. Výhodou Bayesianského procesu je to, že může vypočítat dávku na základě jedné sérové koncentrace a je také schopen predikovat vhodnou startovací dávku, pokud jsou určité pacientské informace vloženy do programu. Tato metoda však vyžaduje erudované zdravotnické pracovníky (klinické farmakology/farmaceuty), kteří mají dostatečné farmakokinetické znalosti. Kromě toho jsou potřebné přesné údaje, jako je dávka antibiotika, odběrové časy, čas aplikace a délka infuze, pacientovo pohlaví, výška, váha, věk a sérový kreatinin, aby se naměřené sérové koncentrace mohly správně interpretovat k získání přesné úpravy dávkování. Software je dobrý pouze tak, jak dobrá jsou vložená data – jestliže je čas aplikace léčiva nebo odběru vzorku nesprávně uveden, pak může dojít k chybnému výsledku [7]. Je třeba mít na zřeteli, že neexistuje obecné terapeutické rozmezí. Každý pacient má svou vlastní optimální cílovou koncentraci vycházející z citlivosti bakterií, současně aplikovaných antibiotik, imunitního stavu a užívaných nefrotoxických nebo ototoxických léčiv [12]. Mnoho kliniků vyžaduje stanovení údolní a maximální koncentrace po 3. nebo 4. dávce, protože byli poučeni, že v této době je dosaženo ustáleného stavu. Při dostupnosti adekvátního farmakokinetického software to není nutné a ani užitečné. Dosažení ustáleného stavu ukazuje na stabilní klinický stav, což často není případ pacientů na jednotce intenzivní péče, jako jsou např. předčasně narození novorozenci. Naštěstí není potřeba při provádění terapeutického monitorování na ustálený čas čekat [12]. Jedním z možných problémů je však to, že čas Cmax zatím nebyl důsledně definován. Někteří klinici navrhují, že tato koncentrace je dosažena za 30–60 min po aplikaci 30minutové až 60minutové infuze. Jiní definují Cmax jako zpětnou extrapolaci sérové koncentrace získané na konci infuze. V již citované práci Moore et al [10] byla Cmax stanovena 1 hod po začátku 30minutové infuze [12]. Na rozdíl od vankomycinu neexistují pro terapeutické monitorování aminoglykosidů jednotné guideline a jsou uváděna různá doporučení [15]. Tradiční dávkování aminoglykosidů využívalo malé dávky podávané několikrát denně, obvykle každých 8–12 hod. U gentamicinu byla požadována cílová maximální sérová koncentrace v rozmezí 8–10 mg/l a údolní koncentrace < 2 mg/l, u amikacinu maximální koncentrace 20–40 mg/l a údolní hladiny < 10 mg/l [2,6]. V současnosti zůstává názor na monitorování Cmax sporný, někteří autoři podporují jeho význam pouze u imunosuprimovaných pacientů, u aplikace aminoglykosidů delší než 10 dní, u MIC v rozmezí 8–16 mg/l nebo pouze po první infuzi u pacientů s těžkou sepsí. Cmax se také různí v navrhovaných hodnotách, pohybuje se v rozmezí od 10–25 mg/l do 30–40 mg/l u gentamicinu a mezi 15–60 mg/l u amikacinu. Dávkování by mělo být dále upraveno dle co nejdříve stanovené MIC, což však bohužel často trvá déle než délka terapie aminoglykosidy. Monitorování údolní koncentrace (Cmin) je akceptováno mnohem více, protože prokazatelně souvisí s nefrotoxicitou. Cmin se uvádí od 0,5 mg/l do 1 nebo 2 mg/l pro gentamicin a od 2,5 mg/l do 5 mg/l pro amikacin [11,16]. Terapeutické monitorování aminoglykosidů je doporučováno jako rutinní proces, nicméně jeho indikace se liší v závislosti na klinickém stavu. Hemodynamicky nestabilní pacienti, pacienti s velkými výkyvy tělních tekutin a pacienti s dynamickými změnami renálních funkcí by měli být monitorováni s větší frekvencí až denně [17,18]. Pacienti středního věku nebo mladí s normálními renálními funkcemi a bez podezření na zvýšený distribuční objem mohou být monitorováni méně často, např. 1–2 krát týdně [6].
Novorozenci se vyznačují velkými interindividuálními a intraindividuálními rozdíly ve farmakokinetice aminoglykosidů vzhledem k vývojovým odlišnostem v raném období života. Dávkovací režim aminoglykosidů se u novorozenců stejně jako u dospělých rozvíjí od vícečetných denních dávek k prodlouženému dávkovacímu intervalu. Nejsou publikovány důkazy o tom, že tento prodloužený dávkovací interval nemůže být aplikován u novorozenců, a také nejsou důkazy o tom, že se toxicita aminoglykosidů u novorozenců liší od dospělých. V současnosti jsou používány 2 hlavní přístupy v dávkování aminoglykosidů u novorozenců. U gentamicinu má první přístup za cíl tradiční maximální koncentraci 6–10 mg/l a údolní koncentraci < 2 mg/l pro vícečetné denní dávkování. Protože je však citlivost bakterií na začátku terapie neznámá a nejvýznamnější mikroorganizmy způsobující neonatální infekce mají MIC okolo 1 mg/l, měla by optimální maximální sérová koncentrace dosahovat 10násobek MIC, což v praxi vede k maximální sérové koncentraci 10 mg/l a údolní koncentraci pod MIC. Druhý přístup má pak za cíl vyšší maximální a nižší údolní koncentraci a pokouší se simulovat once-daily dávkování u dospělých, u nichž je za normálních okolností cílem maximální koncentrace > 10 mg/l a údolní koncentrace < 1 mg/l. Cílová maximální a údolní koncentrace musí vzít v úvahu citlivost bakterií; nicméně, obecně u novorozenců se zdá být opodstatněné dosažení maximální koncentrace v rozmezí 10–12 mg/l a údolní koncentrace 0,5–1 mg/l [12].
Využití prodlouženého dávkovacího intervalu aminoglykosidů v kombinaci s další doporučovanou antibiotickou terapií je účinnou a bezpečnou strategií také pro imunokompromitované pacienty s febrilní neutropenií. V této populaci se klinická účinnost a bezpečnost prodlouženého dávkovacího intervalu nejeví odlišná od standardního dávkování a dostupné důkazy nenaznačují nadřazenost prodlouženého dávkovacího intervalu nad standardním dávkováním, což se týká různorodosti výsledků v účinnosti a bezpečnosti [19] .
Spolehlivá evidence pro použití prodlouženého dávkování aminoglykosidů existuje také u kriticky nemocných pacientů. Protože je antibiotická terapie základním kamenem v léčbě sepse, v důsledku patofyziologických změn během tohoto stavu je pro lepší výsledek akutní péče hlavním úkolem optimální dávkování těchto antibiotik. Vysoká počáteční maximální koncentrace po vysoké úvodní dávce je spojena s lepším výsledkem u akutně nemocných pacientů, ale po úpravě akutní fáze je přehodnocení dávkovacího režimu zásadní pro předejití kumulace léčiv a toxicitě [8,20]. Aplikace aminoglykosidů je u kriticky nemocných pacientů se sepsí komplikováno extrémní interindividuální a intraindividuální variabilitou farmakokinetických/farmakodynamických parametrů: distribuční objem je často zvýšen, zatímco eliminační konstanta může být buď zvýšena, nebo snížena [11]. Užití konvenčních nomogramů pro úpravu dávkování aminoglykosidů k dosažení vhodného dávkovacího režimu je proto u kriticky nemocných pacientů naprosto nevhodné [8]. Navzdory významné variabilitě hodnot MIC u různých bakterií by měla být obvyklá terapie zaměřena na problematické patogeny pacientů jednotek intenzivní péče, jako jsou Enterobacteriaceae a Pseudomonas aeruginosa. Klinický MIC breakpoint je pro tyto patogeny 8 mg/l, což ukazuje, že optimalizovaná antibakteriální aktivita amikacinu by měla dosáhnout maximální koncentrace ≥ 64 mg/l. Tato strategie by umožnila tyto obtížně léčitelné patogeny vystavit baktericidní koncentraci léčiva, i když je terapie zahájena empiricky bez znalostí specifické MIC. Potenciální práh toxicity amikacinu byl určen pro Cmin > 5 mg/l. Optimalizovaná terapie aminoglykosidy by proto měla být dosažena pomocí pevného spojení s monitorováním sérových koncentrací (maximální a údolní) z důvodu široké interindividuální variability farmakokinetických abnormalit a rychlé úpravy dávkování podle MIC příslušného patogenu [21].
V antibiotické léčbě infekčních endokarditid mají aminoglykosidy synergický účinek s inhibitory buněčné stěny (tj. betalaktamy a glykopeptidy) k dosažení baktericidní aktivity a jsou také užitečné ke zkrácení trvání terapie (např. u orálních streptokoků) a eradikaci problematických organizmů (např. Enterococcus spp). Podle Guidelines on the prevention, diagnosis, and treatment of infective endocarditis, new version 2009 se v případě streptokokové endokarditidy aplikuje gentamicin v jedné denní dávce s monitorací renálních funkcí a sérových koncentrací gentamicinu 1krát týdně, údolní koncentrace by měla být < 1 mg/l a koncentrace za 1 hod po aplikaci 10–12 mg/l. U endokarditidy stafylokokové, enterokokové a při počáteční empirické léčbě je doporučován gentamicin ve 2 nebo 3 dávkách s monitorací renální funkce a sérové koncentrace gentamicinu 1krát týdně (2krát týdně v případě renálního selhávání), s údolní koncentrací < 1 mg/l a za 1 hod po aplikaci 3–4 mg/l [22]. V roce 2012 byla doporučení k léčbě infekční endokarditidy aktualizována ve Švédsku, dávkování v jedné denní dávce se doporučuje ve většině případů, s výjimkou dávkování ve 2 denních dávkách u obtížně léčitelných endokarditid, jako je enterokoková endokarditida a endokarditida chlopenní náhrady. V tomto případě (dávkování gentamicinu 2krát denně) by neměla údolní koncentrace přesáhnout 1 mg/l a koncentrace po aplikaci by měla dosahovat minimálně 3–5 mg/l [6].
Jako shrnutí lze konstatovat, že v současnosti existuje dostatek důkazů pro doporučení once-daily dávkování u aminoglykosidů (s výjimkou dávkování ve 2 denních dávkách u obtížně léčitelných případů endokarditidy), které by mělo být vysoké u septického šoku a jen zřídka po dobu delší než 5–6 dní, respektive co nejkratší dobu ke snížení rizika toxicity. Dávka a dávkovací interval musí být řízeny pomocí terapeutického monitorování [6].
Rozmezí podle SPC SÚKL
Potřeba terapeutického monitorování hladin amikacinu a gentamicinu je uváděna také v Souhrnu údajů o přípravku (SPC) Státního ústavu pro kontrolu léčiv (SÚKL) ČR u jednotlivých přípravků obsahujících tato antibiotika u různých výrobců. Uvedená doporučení se však od sebe liší [3] jak citujeme níže.
Amikacin
SPC výrobce 1. Krevní vzorky jsou odebírány na konci dávkovacího intervalu (nejnižší hladina) a ihned po ukončení infuze (maximální hladina). Koncentrace amikacinu v séru mají být sledovány 2. nebo 3. den od začátku léčby a poté 2krát týdně, aby nedošlo k vysokým koncentracím, které jsou potenciálně toxické. Hladina nemá překročit 30–35 mg/l ve 30. min a 90 min po infuzi. Nejnižší hladina nemá být méně než 10 mg/l.
SPC výrobce 2. Je vhodné měřit jak maximální koncentraci amikacinu v séru (30–90 min po injekci), která by neměla přesáhnout 35 mg/l, tak i koncentraci těsně před podáním další dávky, která by neměla být vyšší než 10 mg/l. U pacientů s normální funkcí ledvin je možné i podávání 1krát denně, a v tomto případě může maximální koncentrace amikacinu v séru přesáhnout 35 mg/l [3].
Gentamicin
SPC výrobce 1. Nejnižší hladina nemá přesáhnout 2 mg/l, pokud je gentamicin podáván 2krát denně a 1 mg/l pokud je podáván 1krát denně. Terapeutické maximum sérových koncentrací je v rozmezí 5–10 mg/l pro opakovanou denní dávku a 20–30 mg/l pro denní dávku podávanou 1krát denně. Maximální sérové koncentrace 10–12 mg/l by neměly být při konvenčním podávání v podobě několika dávek denně překročeny.
SPC výrobce 2. Minimální koncentrace by neměla překročit 2 mg/l, pokud je gentamicin podáván 2krát denně a 1 mg/l, pokud je gentamicin podáván 1krát denně. Riziko ototoxicity a nefrotoxicity je zvýšeno, jestliže koncentrace gentamicinu v séru jsou trvale vyšší než 2 mg/l. Sporadický výskyt vysokých koncentrací není pro vývoj poškození významný. Ototoxicita gentamicinu je závislá na koncentraci; objevuje se při koncentracích přesahujících 12 až 15 mg/l. Naproti tomu nefrotoxicita na maximální koncentraci gentamicinu v séru přímo závislá není [3].
Rozmezí podle OKF FN Ostrava
Na našem pracovišti (Oddělení klinické farmakologie Fakultní nemocnice Ostrava) používáme tato rozmezí:
Gentamicin
- před podáním:
- < 2 mg/l (aplikace 2–3krát denně)
- < 1 mg/l (aplikace 1krát denně a infekční endokarditida)
- po podání:
- 3–5 mg/l (infekční endokarditida)
- 5–10 mg/l (aplikace 2–3krát denně)
- 10–30 mg/l (aplikace 1krát denně)
- nebo optimálně 8–10krát MIC (minimální inhibiční koncentrace)
Amikacin
- před podáním:
- < 10 mg/l (aplikace 2–3krát denně)
- < 5 mg/l (aplikace 1krát denně)
- po podání:
- 20–30 mg/l (aplikace 2–3krát denně)
- 30–80 mg/l (aplikace 1krát denně)
- nebo optimálně 8–10krát MIC (minimální inhibiční koncentrace)
Pro správnou interpretaci naměřených koncentrací potřebujeme vyplněnou specializovanou žádanku a vhodný počítačový program pro farmakokinetickou analýzu. Používají se různé software, v ČR je nejužívanější MW-Pharm 3.30 a vyšší. Žádanka by měla obsahovat tyto údaje: dávková anamnéza, trvání terapie, čas podání a časy odběrů, pacientův stav (věk, váha, výška, renální funkce) a celková léková anamnéza. Vzhledem k tomu, že se koncentrace antibiotik v krvi po aplikaci mění v souvislosti s časem, který uplyne od jeho podání, je nezbytné na žádanku uvádět skutečné odběrové časy pro možnost správné interpretace výsledných koncentrací. Pokud je odběr proveden i mimo doporučované odběrové časy a skutečný odběrový čas je na žádance správně uveden, software provede farmakokinetickou analýzu a umožní nalézt optimální dávkování. Odběry nesmí být provedeny ze stejného místa, jako byla antibiotika aplikována (zejména u centrálního žilního katétru), protože u takto chybného odběru jsou naměřené koncentrace falešně vysoké a nehodnotitelné.
Na obr. 1–11 prezentujeme některé případy z rutinní praxe Oddělení klinické farmakologie FN Ostrava, kde je amikacin měřen metodou kapalinové chromatografie s tandemovou hmotností spektrometrií (LC-MS/MS) a gentamicin fluorescenční polarizační imunoanalýzou (FPIA), dávka je upravována pomocí farmakokinetického programu MW-Pharm, verze 3.30.
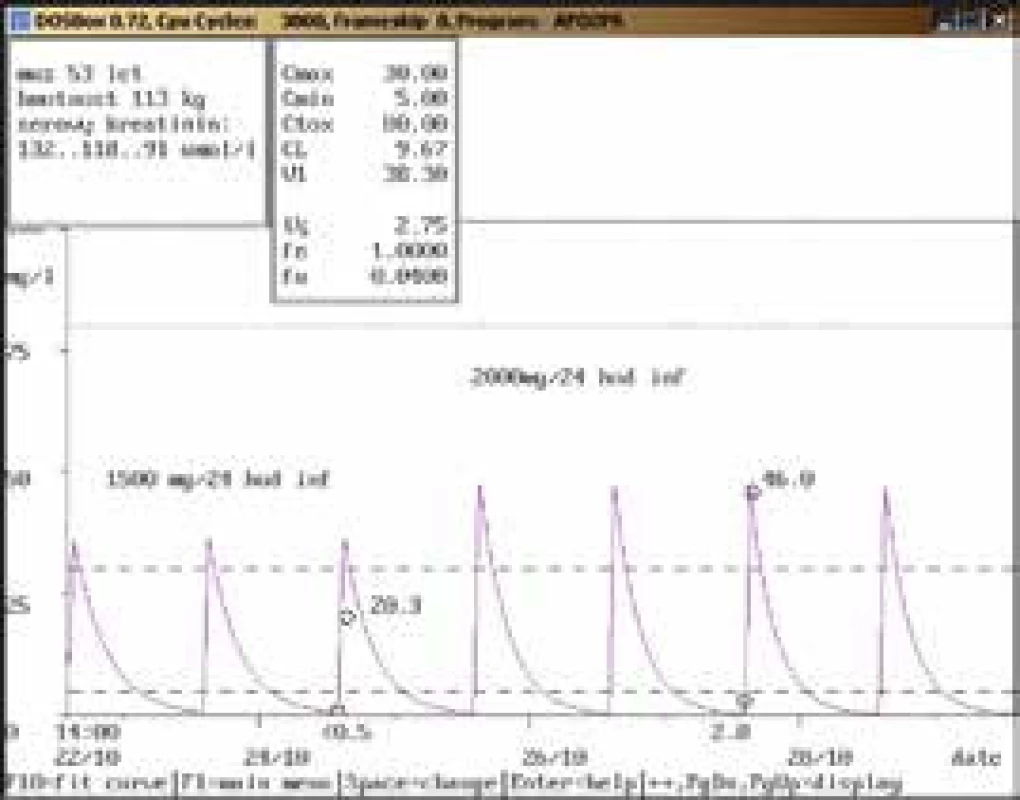
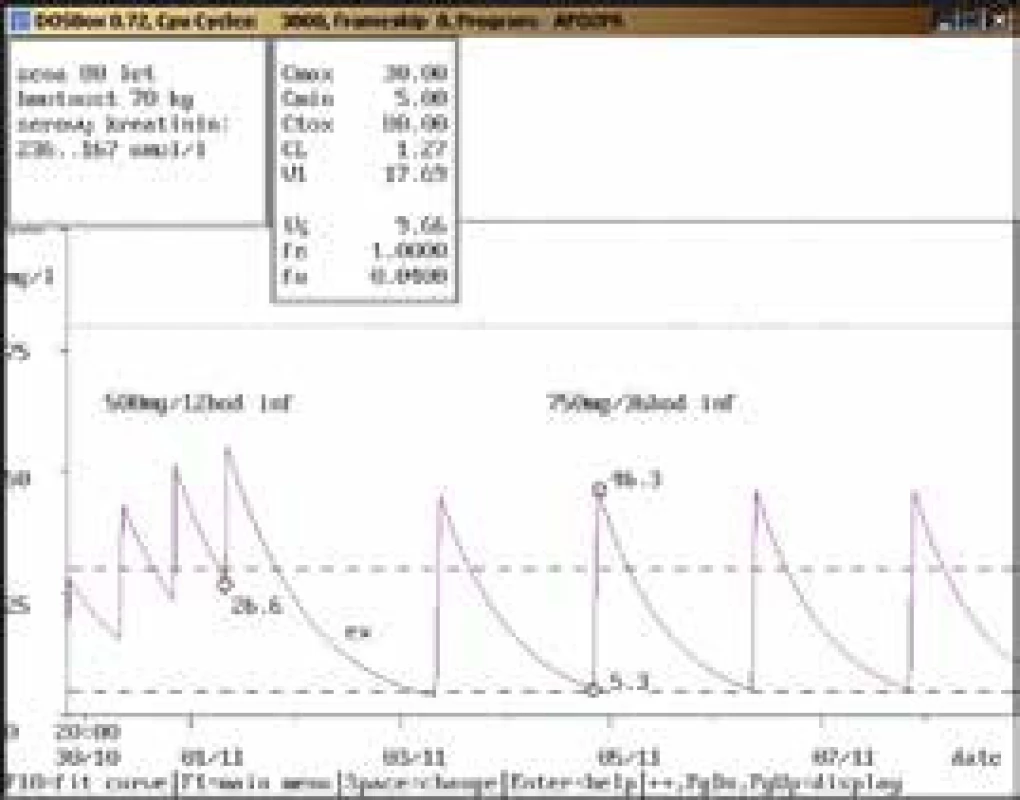
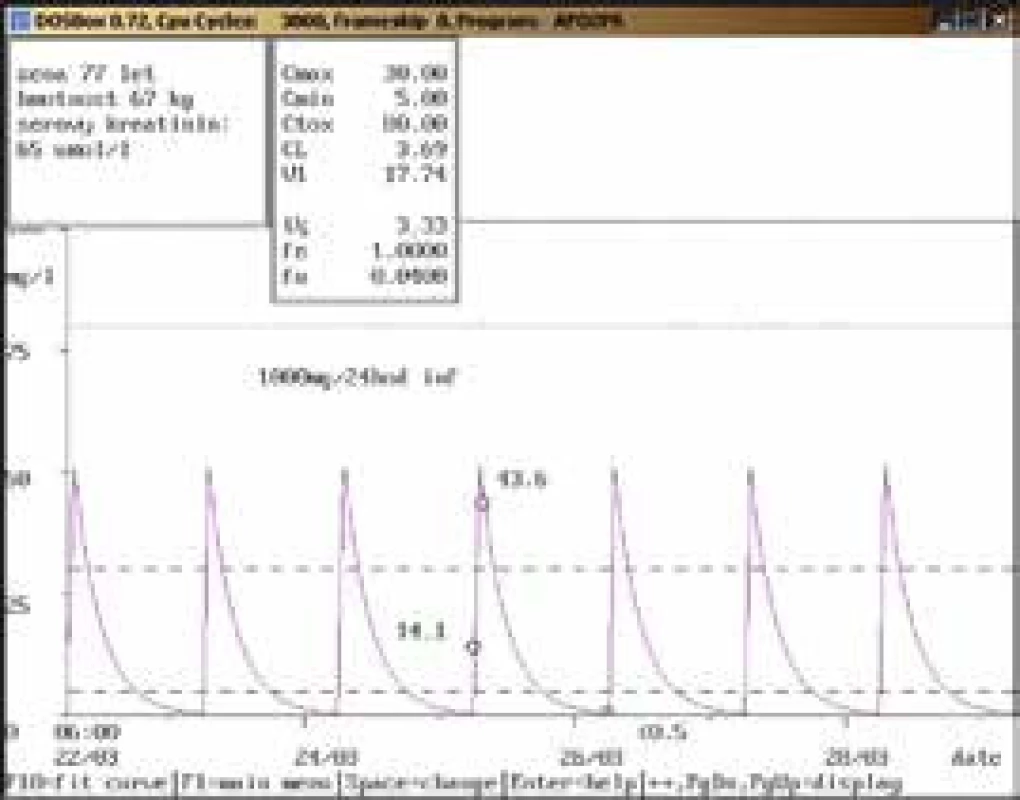
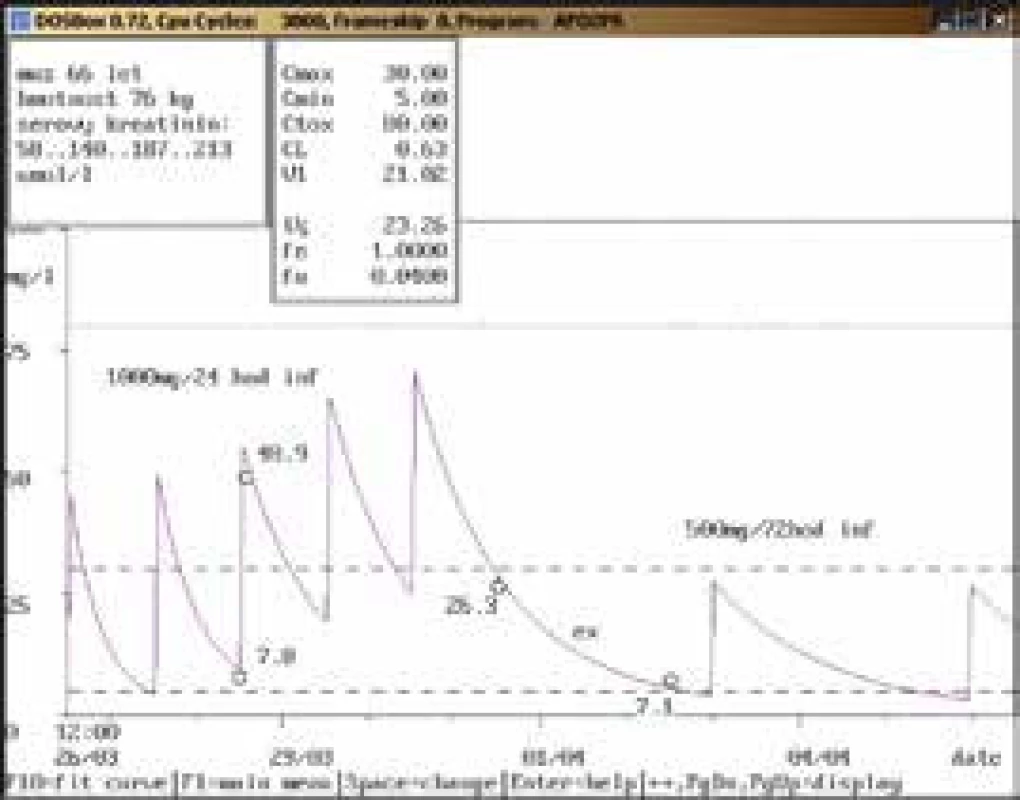
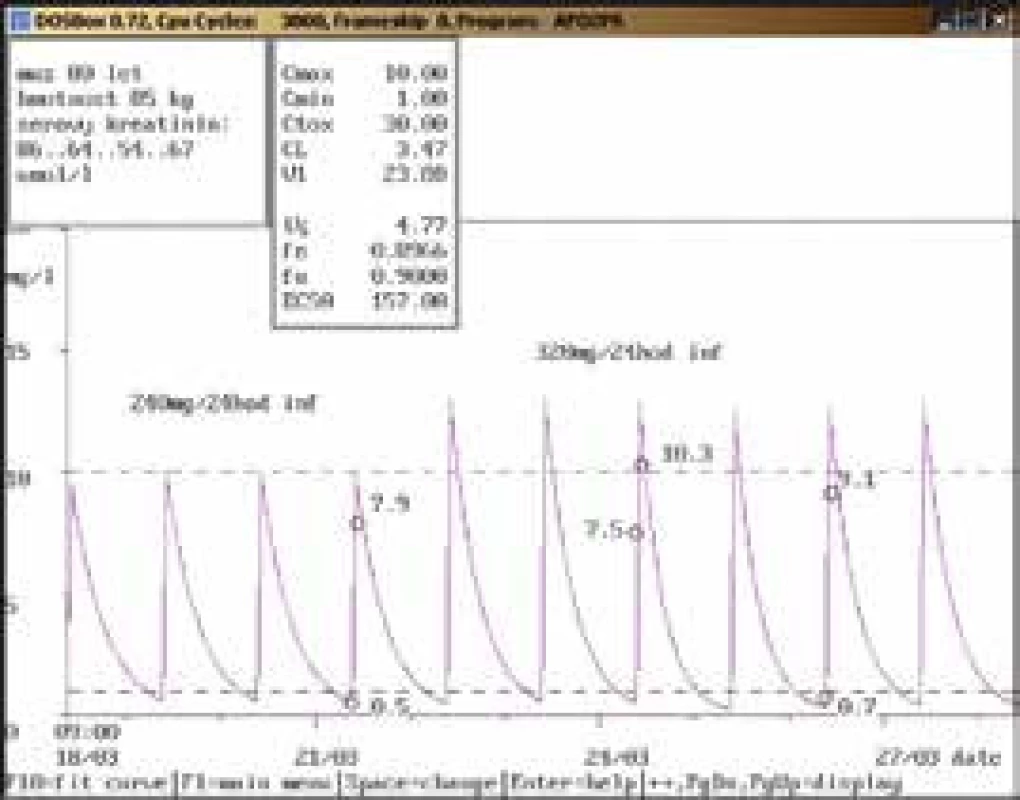
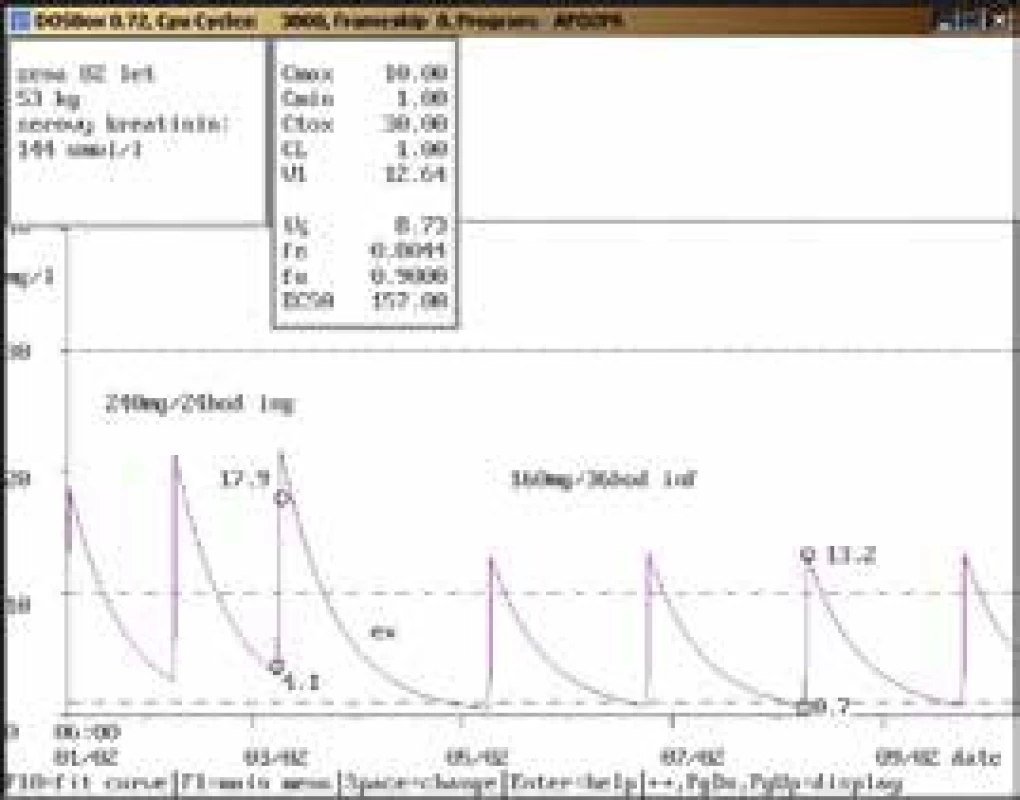
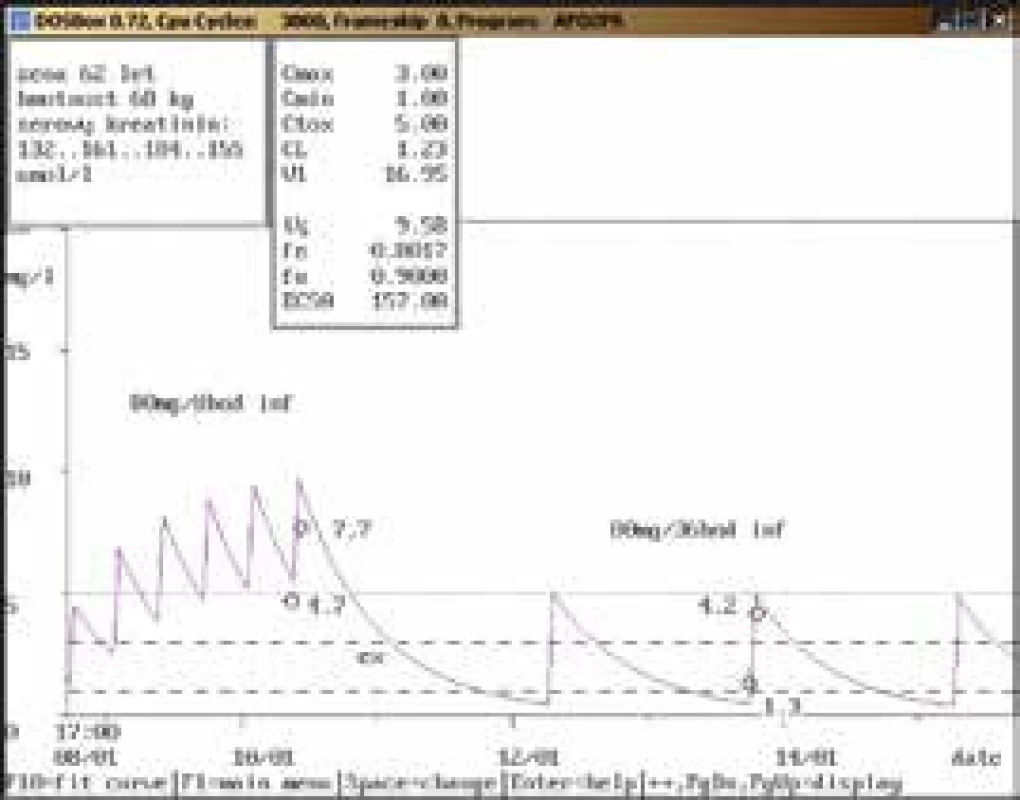
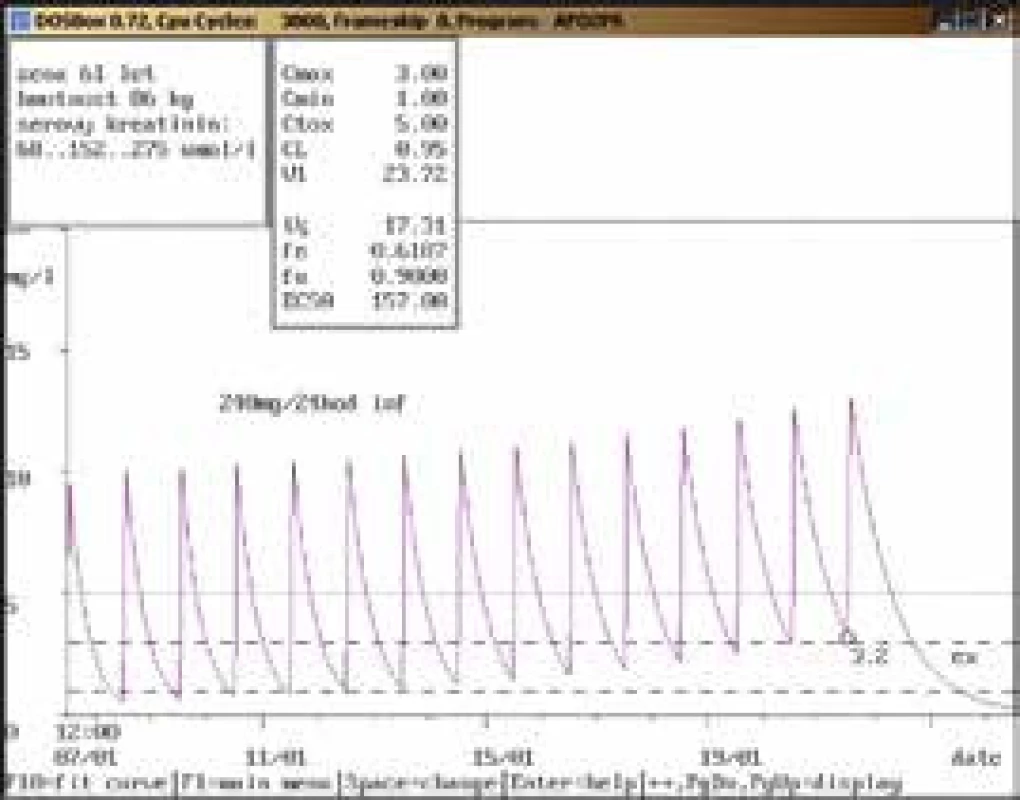
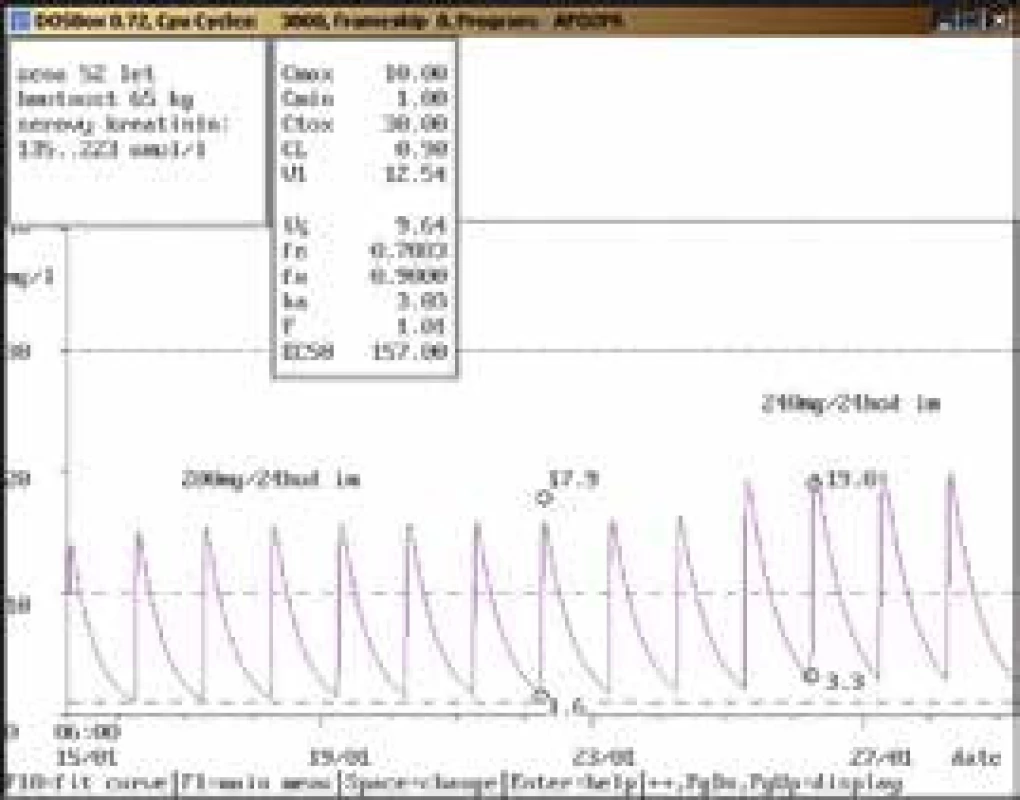
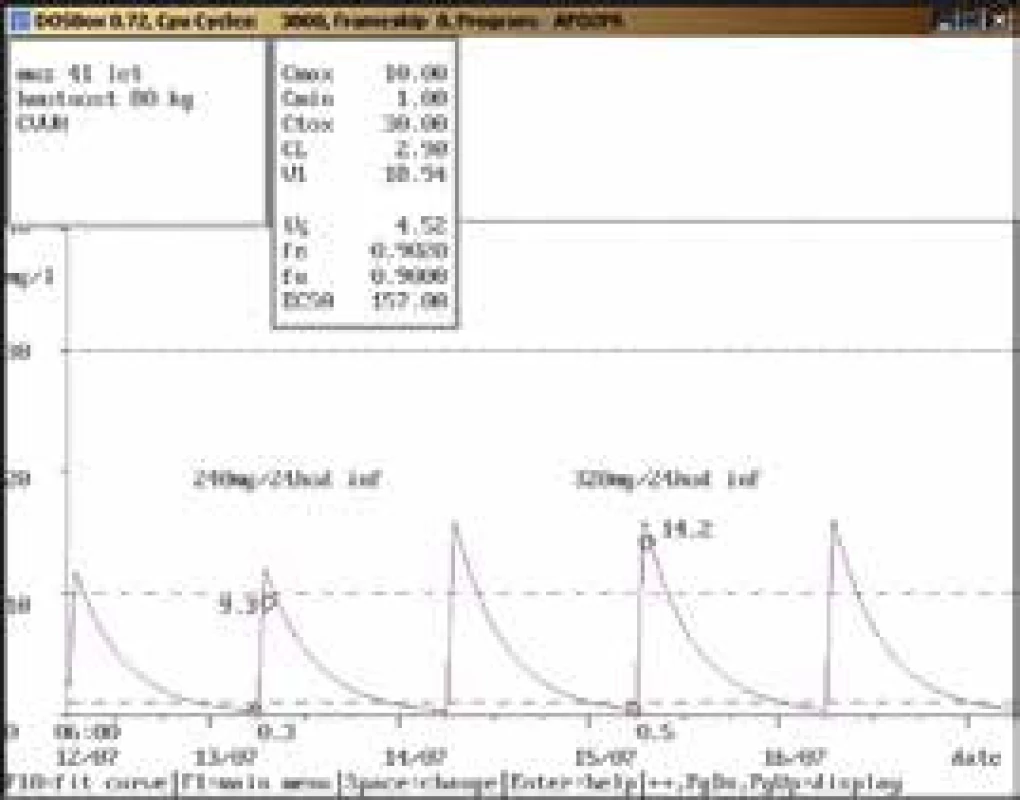
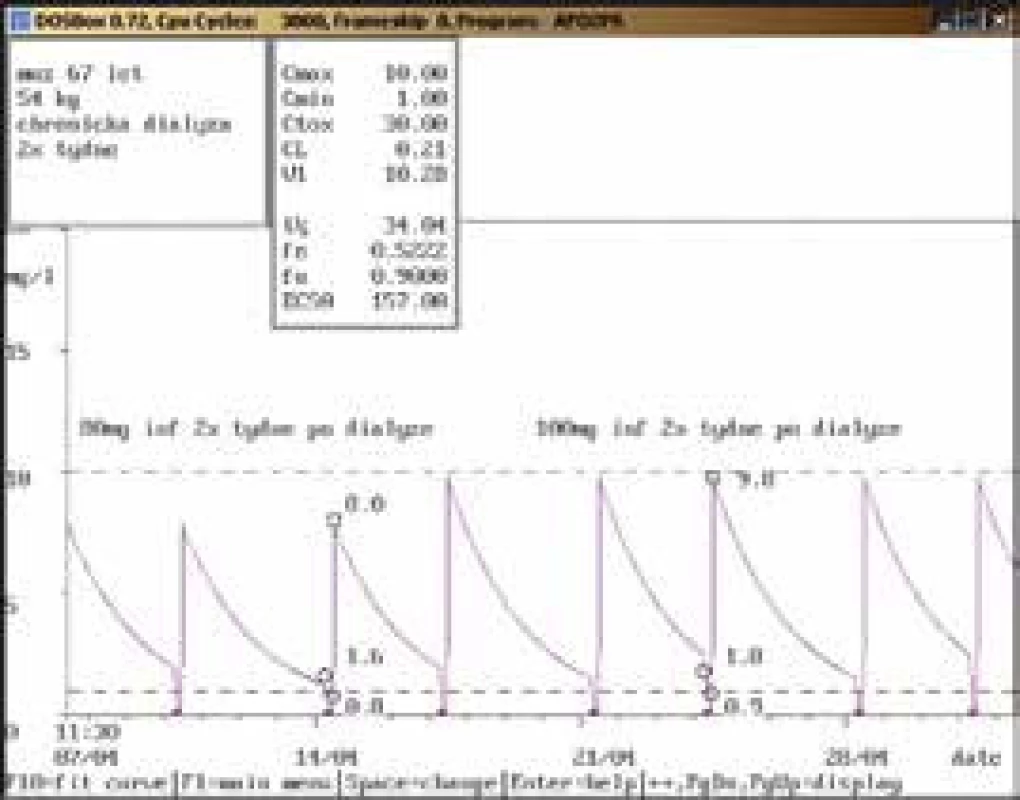
Závěr
Terapeutické monitorování hladin aminoglykosidových antibiotik amikacinu a gentamicinu představuje klíčovou strategii v optimalizaci terapie těchto antibiotik. Rychlá a spolehlivá analýza sérových koncentrací následovaná individualizovanou farmakokinetickou analýzou s využitím populačního modelu umožňuje rychlou a adekvátní úpravu dávkování těchto antibiotik k maximalizaci klinického efektu a minimalizaci toxicity.
prim. MUDr. Ivana Kacířová, Ph.D.
ivana.kacirova@fno.cz
Oddělení klinické farmakologie Ústavu laboratorní diagnostiky FN Ostrava
www.fno.cz
Doručeno do redakce 4. 6. 2014
Přijato po recenzi 11. 7. 2014
Zdroje
1. Pagkalis S, Mantadakis E, Mavros MN et al. Pharmacological considerations for the proper clinical use of aminoglycosides. Drugs 2011; 71(17): 2277–2294.
2. Radigan EA, Gilchrist NA, Miller MA. Management of aminoglycosides in the intensive care unit. J Intensive Care Med 2010; 25(6): 327–342.
3. Informace dostupné z WWW: <http://www.sukl.cz/>.
4. Shim TS, Jo KW. Medical treatment of pulmonary multidrug-resistant tuberculosis. Infect Chemother 2013; 45(4): 367–374.
5. Wassil SK, Fox KM, White JW. Once Daily Dosing of Aminoglycosides in Pediatric Cystic Fibrosis Patients: A Review of the Literature. J Pediatr Pharmacol Ther 2008; 13(2): 68–75.
6. Hanberger H, Edlund C, Furebring M et al. Rational use of aminoglycosides-review and recommendations by the Swedish Reference Group for Antibiotics (SRGA). Scand J Infect Dis 2013; 45(3): 161–175.
7. Avent ML, Rogers BA, Cheng AC et al. Current use of aminoglycosides: indications, pharmacokinetics and monitoring for toxicity. Intern Med J 2011; 41(6): 441–449.
8. Mahmoudi L, Niknam R, Mousavi S et al. Optimal Aminoglycoside Therapy Following the Sepsis: How Much Is Too Much? Iran J Pharm Res 2013; 12(2): 261–269.
9. Roberts JA, Lipman J. Antibacterial Dosing in Intensive Care Pharmacokinetics, Degree of Disease and Pharmacodynamics of Sepsis. Clin Pharmacokinet 2006; 45(8): 755–773.
10. Moore RD, Lietman PS, Smith CR. Clinical response to aminoglycoside therapy: importance of the ratio of peak concentration to minimal inhibitory concentration. J Infect Dis 1987; 155(1): 93–99.
11. Boyer A, Gruson D, Bouchet S et al. Aminoglycosides in septic shock: an overview, with specific consideration given to their nephrotoxic risk. Drug Saf 2013; 36(4): 217–230.
12. Touw DJ, Westerman EM, Sprij AJ. Therapeutic Drug Monitoring of Aminoglycosides in Neonates. Clin Pharmacokinet 2009; 48(2): 71–88.
13. Van Lent-Evers NA, Mathot RA, Geus WP et al. Impact of goaloriented andmodel-based clinical pharmacokinetic dosing of aminoglycosides on clinical outcome: a cost-effectiveness analysis. Ther Drug Monit 1999; 21(1): 63–73.
14. El Desoky ES, Sheikh AA, Al Hammadi AY. Aminoglycoside and vancomycin serum concentration monitoring and mortality due to neonatal sepsis in Saudi Arabia. J Clin Pharm Ther 2003; 28(6): 479–483.
15. Rybak MJ, Lomaestro BM, Rotschafer JC et al. Vancomycin therapeutic guidelines: a summary of consensus recommendations from the infectious diseases Society of America, the American Society of Health-System Pharmacists, and the Society of Infectious Diseases Pharmacists. Clin Infect Dis 2009; 49(3): 325–327.
16. Roberts JA, Field J, Visser A et al. Using population pharmacokinetics to determine gentamicin dosing during extended daily diafiltration in critically ill patients with acute kidney injury. Antimicrob Agents Chemother 2010; 54(9): 3635–3640.
17. Petejova N, Zahalkova J, Duricova J et al. Gentamicin pharmacokinetics during continuous venovenous hemofiltration in critically ill septic patients. J Chemother 2012; 24(2): 107–112.
18. Petejová N, Martínek A, Zahálková J et al. Vliv kontinuální a intermitentní náhrady renálních funkcí na antibiotickou léčbu u kriticky nemocných v sepsi – praktický pohled na léčbu vankomycinem a gentamicinem. Vnitř Lék 2012; 58(6): 448–454.
19. Stabler SN, Ensom MH. Extended-interval aminoglycoside therapy for adult patients with febrile neutropenia: a systematic review. Can J Hosp Pharm 2011; 64(3): 182–191.
20. McKenzie C. Antibiotic dosing in critical illness. J Antimicrob Chemother 2011; 66(Suppl 2): ii 25–31.
21. Taccone FS, Laterre PF, Spapen H et al. Revisiting the loading dose of amikacin for patients with severe sepsis and septic shock. Crit Care 2010; 14(2): R53. Dostupné z DOI: <http://doi: 10.1186/cc8945>.
22. Habib G, Hoen B, Tornos P et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): the Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and the International Society of Chemotherapy (ISC) for Infection and Cancer. Eur Heart J 2009; 30(19): 2369–2413.
Štítky
Diabetológia Endokrinológia Interné lekárstvoČlánok vyšiel v časopise
Vnitřní lékařství

2015 Číslo 1
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Role praktického lékaře v péči o pacienta s familiární hypercholesterolémií
- Nech brouka žít… Ať žije astma!
Najčítanejšie v tomto čísle
- Terapeutické monitorování amikacinu a gentamicinu v rutinní klinické praxi
- Asymptomatická hyperurikémia a metabolický syndróm u mladistvých
- Tachykardií indukovaná kardiomyopatie
- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu u monoklonálních gamapatií
