-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kalcifikující uremická arteriolopatie – editorial
Autori: Sylvie Dusilová Sulková
Pôsobisko autorov: Hemodialyzační středisko FN Hradec Králové, vedoucí lékařka prof. MUDr. Sylvie Dusilová Sulková, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2015; 61(2): 97-100
Kategória: Editorial
Komentář k | Editorial on
Vyskočilová M et al. Kalcifikující uremická arteriolopatie – léčba tiosulfátem sodným. Vnitř Lék 2015; 61(2): 166–172.
Kalcifikující uremická arteriolopatie (calcific uremic arteriolopathy – CUA) je mimořádně závažná a obávaná komplikace vyskytující se zejména (avšak nikoliv výhradně) u chronicky dialyzovaných pacientů. Diagnóza je především klinická.
Iniciálním klinickým projevem je lokalizovaná bolest s erytémem či barevnými nafialovělými skvrnami (livedo reticularis). Během dnů až týdnů se objevuje bolestivé zatuhnutí v podkoží. Postupně se vytvoří kožní a podkožní ulcerace s černými nekrotickými oblastmi [1–4].
I když je její výskyt naštěstí velmi vzácný, naši nefrologové CUA dobře znají: v předatestačním přípravném kurzu na podzim roku 2014 nebyl mezi posluchači nikdo, kdo by se s touto komplikací ve své (krátké!) lékařské praxi nesetkal či o ni neměl podrobné informace z literatury.
Většinu případů CUA diagnostikují a léčí nefrologové. Svými příčinami, projevy a důsledky však CUA (resp. kalcifylaxe) přesahuje do mnoha medicínských oblastí. Kromě asociace se selháním ledvin se může (velmi vzácně) vyskytnout i u primární hyperparatyreózy, některých malignit, po transplantaci ledviny a v jiných situacích [5–8]. Je proto velmi záslužné, že brněnští autoři zpracovali své cenné zkušenosti do publikačního výstupu, který je navíc velmi zdařilý a nepochybně přinese nejednomu čtenáři cenné poučení.
Mikroskopicky je CUA charakterizována fibrinovými tromby v kalcifikovaných malých arteriích a arteriolách (průměr do 600 µm), jejichž stěna je změněna intimální hyperplazií a endovaskulární fibrózou, a též trombózou venul s ischemií a nekrózou okolní tkáně, tj. kůže a podkoží, zejména podkožního tuku. I když je histologické vyšetření některými autory považováno za „zlatý standard“, většina autorů před ním varuje, a to ze 2 důvodů: ani výsledky histologického vyšetření nemusí být pozitivní, a hlavně – bioptovaná oblast se často již nezhojí, a bioptický zákrok naopak vede k rozšíření nekrotických oblastí. Stejného názoru jsou i autoři brněnského pracoviště, a stejný názor po letech zkušeností zastáváme i my.
Pokud má lékař o existenci CUA základní povědomí, diagnózu určí poměrně snadno, je založena na klinickém obraze. Nadto je naděje, že rozpoznání nebude vlivem neznalosti a tápání opožděné a nebude zatěžováno rizikovými vyšetřovacími postupy (viz již výše zmíněná kožní biopsie). Právě včasné upozornění na tuto diagnózu může rozhodnout o prognóze, resp. úspěchu léčby [9].
Autoři dokumentují ve shodě s literárními údaji (většinou se jedná o jednotlivé kazuistiky či série jednotlivých případů), že pro diagnózu postačí typický klinický obraz (vzhled, rozsah a lokalizace nekróz), podepřený přítomností rizikových faktorů (viz dále) a periferními cévními kalcifikacemi (patrnými na nativním RTG snímku), s vyloučením laboratorních známek vaskulitidy [2,10]. Základní orientaci pro diferenciální diagnózu uvádí tab. 1.
Tab. 1. Diferenciální diagnostika kalcifylaxe – základní odlišení ostatních chorob. Upraveno podle [18] ![Diferenciální diagnostika kalcifylaxe – základní odlišení ostatních chorob. Upraveno podle [18]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/81ac48ca1a94ec511020875332fef0c0.jpg)
Výčet příčin, resp. rizikových faktorů (připravený podle literárních zdrojů a uvedený v tab. 2) je dokladem toho, že naše znalosti o etiologii jsou neúplné, jinak by totiž příčiny, resp. rizikové faktory nemohly být tak heterogenní. Zatím se jeví jako jisté, že v pozadí je závažná porucha metabolizmu vápníku a fosforu, často spojená s abnormální funkcí příštítných tělísek. Avšak, zdaleka ne u každého dialyzovaného pacienta, který má hyperparatyreózu s hyperfosfatemií a je např. diabetik, se vyvine tato komplikace. Ovšem, u tohoto pacienta bychom jistě nevolili antikoagulaci warfarinem a pečlivě bychom kontrolovali nutriční stav a samozřejmě hyperfosfatemii s hyperparatyreózou řešili.
Tab. 2. Rizikové faktory kalcifylaxe (CUA). Upraveno podle [1,2,18] ![Rizikové faktory kalcifylaxe (CUA). Upraveno podle [1,2,18]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1975a92c8a2c8cf7ea30e335f36d6be5.jpg)
Heterogenitu příčin, resp. asociovaných laboratorních, klinických a demografických charakteristik kopíruje i heterogenita terapeutických postupů. Ty lze rozdělit na 2 okruhy – lokální léčba a léčba systémová. Základní přehled systémových opatření udává tab. 3.
Tab. 3. Léčebné postupy pro kalcifylaxi (CUA). Upraveno podle [2] ![Léčebné postupy pro kalcifylaxi (CUA). Upraveno podle [2]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5732b65b0c3a7cf6b25ca1d9d0437495.jpg)
Autoři ve své práci oba okruhy terapeutických postupů pečlivě zvažují. Vysvětlují, proč se rozhodli k danému terapeutickému přístupu u svých pacientů. Je patrné, že lokální léčba byla velmi pečlivá a byl na ni kladen odpovídající důraz. Z textu plyne konkrétní užitečné poučení pro ty, kteří se s kalcifylaxí v budoucnu setkají.
Systémovou léčbu lze rozvrhnout do několika oblastí. Vždy pečlivě řešíme metabolizmus vápníku a fosforu.
Nové poznatky varují před podáváním vápníku per os, neboť sérová koncentrace vápníku u dialyzovaných pacientů není vypovídající z hlediska celotělové bilance a hypokalcemie sama o sobě není indikací k suplementaci kalcia, přitom kalciové vazače fosfátů též znamenají určitou zátěž vápníkem.
Fosfatemie, na rozdíl od kalcemie, je ukazatelem spolehlivým. Existují 3 způsoby, jak vysokou koncentraci fosforu při selhání ledvin upravit: snížení přívodu v dietě, podávání vazačů fosfátů v zažívacím traktu a eliminace dialýzou. V praxi se vždy kombinují všechny 3, včetně častých (denních) dialýz.
Dále se vždy kontroluje, zda není v pozadí akcentovaná hyperparatyreóza. I této oblasti věnovali autoři pečlivou pozornost, avšak zvolili konzervativní přístup. Sami však máme zkušenost, že bez radikálního řešení hyperparatyreózy je naděje na zhojení lézí při CUA jen malá a v současné době vyšetřujeme nejen koncentraci parathormonu, ale u všech případů verifikujeme tělíska sonograficky a indikujeme paratyreoidektomii [4]. Literatura však v tomto kontextu není jednoznačná – lze dohledat jak práce vysloveně podporující chirurgickou paratyreoidektomii [11,12], tak práce, které jsou k chirurgickému postupu opatrnější až bez jasného stanoviska [1,5,13]. Podle našeho názoru je to dokladem toho, že v léčbě kalcifylaxe nelze uplatnit obecný postup, ale je nutno pečlivě individuálně zvažovat, zda jednotlivé prvky léčby (tab. 3) jsou, či nejsou u daného pacienta prospěšné. K tomu ovšem je nutná nejen velmi detailní znalost teorie, ale i vlastní praktická zkušenost a její trvalé vyhodnocování.
U všech 3 pacientů, které ve své práci autoři popisují, použili v léčbě CUA tiosulfát sodný. Tiosulfát sodný byl poprvé použit v léčbě kalcifylaxe až v roce 2004. Již předtím byl použit v léčbě kalciové urolitiázy, nefrokalcinózy a tumorálních kalcifikací [14]. Jeden z mechanizmů účinku spočívá v chelaci kationtů (kalcia), která vede ke konverzi dříve nerozpustných kalciových tkáňových depozit na hydrofilní, neboli rozpustný kalciumsulfát [15]. Jeho nízká molekulová hmotnost (tiosulfát sodný má molekulovou hmotnost 248) a hydrofilní vlastnosti znamenají dobrou eliminaci při dialýze. Popisuje se i příznivé ovlivnění mikrozánětu a oxidačního stresu. Je možné, že příznivě působí i v případech, v nichž bylo precipitujícím faktorem parenterálně aplikované železo. Dávkovací schéma není přesně stanoveno, většinou však autoři uvádějí 25 g v infuzi posledních 60 min hemodialýzy [2,14]. Prakticky stejné schéma použili i brněnští autoři a potvrdili jeho schůdnost, účinnost a velmi dobrou toleranci. Celková doba léčby je dlouhá, i více než několik měsíců. Tiosulfát během 2 týdnů výrazně sníží bolesti postižených oblastí. Zhojení lézí však trvá řadu dalších týdnů, či spíše měsíců. Pro ilustraci (a i pro povzbuzení lékařů, kteří léčí pacienta, který trpí kalcifylaxí, a oni se snaží tuto situaci zvládnout, a v literatuře se dočtou, že mortalita je až 80%) připojujeme fotografii našeho pacienta, u kterého byla v červenci roku 2014 klinicky diagnostikována kalcifylaxe. Fotografie zhojené léze je z ledna roku 2015 (obr).
Obr. 1. Plně zhojená kalcifylaxe (muž, narozen roku 1952; v dialyzačním programu od června roku 2014, v dřívějších letech dlouhodobá terapie warfarinem; sekundární hyperparatyreóza; léčba vápníkovými přípravky a aktivátory receptoru pro vitamin D. Plné zhojení při kombinované dlouhodobé léčbě, včetně urgentní totální paratyreoidektomie) 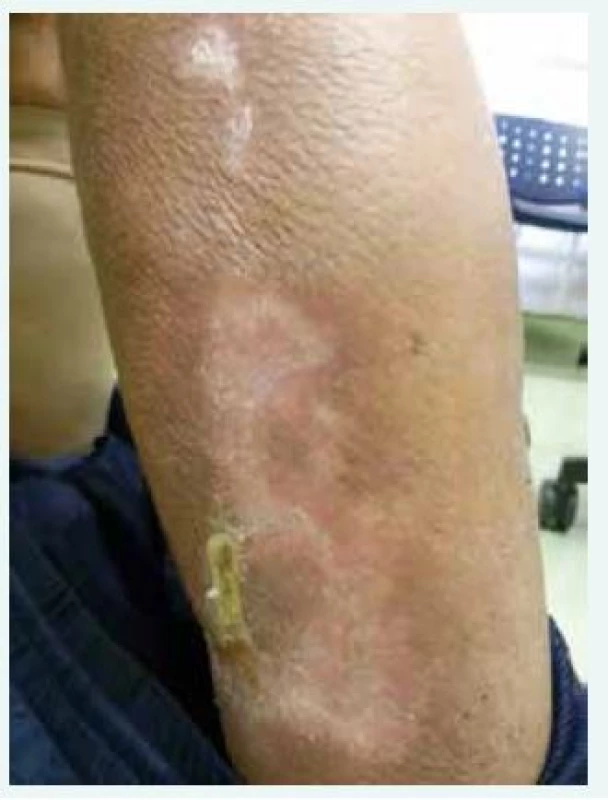
Bisfosfonáty jsou obecně při selhání ledvin kontraindikovány a u hemodialyzovaných pacientů je nepodáváme. Literatura však uvádí, že je možné je podat při kalcifylaxi spojené s vysokým kostním obratem [2]. I pro další terapeutické postupy, uvedené v tab. 3, existují pozitivní literární doklady. Stále však platí, že prognóza onemocnění je velmi závažná.
Neexistují žádné kontrolované studie, které by určily exaktní evidence-based doporučený postup pro léčbu kalcifylaxe, resp. CUA. Podle našeho názoru je i do budoucna velmi obtížné takovéto studie koncipovat, a to vzhledem k vzácnému výskytu a zejména vzhledem k heterogenitě možných rizikových faktorů u jednotlivých nemocných (a neznalosti přesné etiologie i patogeneze) a neschůdnosti měřit řadu parametrů v praxi (např. hladinu fetuinu A, hlavního cirkulujícího kalcifikačního inhibitoru, jehož hladiny jsou při selhání ledvin nízké, a zejména nízké jsou při kalcifylaxi). Proto se terapie opírá o klinické rozhodnutí (clinical judgement), kde individuálně posuzujeme všechny asociovaná rizika a terapeutickou strategii kombinujeme tak, aby postihla všechny rizikové okolnosti. Pokud víme, že v současnosti kalcifylaxi jen velmi těžko vyléčíme (mortalita se udává až v 80 %, většinou je příčinou úmrtí sepse, která má podklad v infekci nekróz), je podle našeho názoru na místě všechny potenciální faktory pokud možno upravit „předem“, tj. nedopustit jejich (dlouhodobý) vliv.
Vlastní zkušenosti nás vedly zejména k těmto krokům: nepodáváme souběžně aktivátory VDR receptoru (a to ani selektivní, tj. parikalcitol) souběžně s kalciovými vazači fosfátů v zažívacím traktu, nepodáváme warfarin pacientům v dialyzačním programu, zejména pokud mají nízké koncentrace albuminu v séru a jsou diabetici, hyperparatyreózu s normokalcemií a hyperfosfatemií neléčíme dlouhodobě konzervativně, setrvale věnujeme pozornost nutričnímu stavu (sipping) a zánětu (hledáme a řešíme příčinu každého zvýšení CRP) a proaktivně detekujeme cévní kalcifikace, zejména u diabetiků a u pacientů, u nichž zamýšlíme podávání vyšších dávek aktivátorů receptoru pro vitamin D. Nově, resp. v návaznosti na dokumentovanou spojitost CUA s podáváním železa u UD pacientů, jsme do těchto opatření zahrnuli i snížení frekvence aplikací parenterálního Fe a volbu jen malých jednorázových dávek [16].
Jak uvedeno, sdělení kolektivu brněnských autorů o svých zkušenostech s diagnostikou a terapií kalcifilaxe, je velmi záslužné. Kalcifikující uremická arteriolopatie je natolik závažná, že je třeba o ní vědět a věnovat jí aktivní pozornost. Ostatně, ERA-EDTA (European Renal Association – European Dialysis and Transplant Association), nedávno avizovala „call for action“ a definovala zkoumání patogeneze i terapie CUA jako extrémně důležitý cíl [17].
Podpořeno MZ ČR RVO (FNHK, 00179906) a programem PRVOUK P37/11
prof. MUDr. Sylvie Dusilová Sulková, DrSc., MBA
sylvie.dusilova@fnhk.cz
Hemodialyzační středisko FN Hradec Králové
www.fnhk.cz
Doručeno do redakce 1. 2. 2015
Zdroje
1. Galperin TA, Cronin AJ, Leslie KS. Cutaneous manifestations of ESRD. Clin J Am Soc Nephrol 2014; 9(1): 201–218.
2. Sprague SM. Painful skin ulcers in a hemodialysis patient. Clin J Am Soc Nephrol 2014; 9(1): 166–173.
3. Sowers KM, Hayden MR Calcific uremic arteriolopathy. Oxidative Medicine and Cellular Longevity 2010; 3(2): 109–121.
4. Sulkova S, Válek M. Skin wounds associated with calciphylaxis in end-stage renal disease patients on dialysis. Nutrition 2010; 26(9): 910–914.
5. Ross EA. Evolution of treatment strategies for calciphylaxis. Am J Nephrol 2011; 34(5): 460–467.
6. Hanvesakul R, Silva MA, Hejmadi R et al. Calciphylaxis following kidney transplantation: a case report. J Med Case Reports 2009; 3 : 92–97. Dostupné z DOI: <http://doi: 10.1186/1752–1947–3-9297>.
7. Bishop J, Brown E, Podesta A et al. Surgical management of calciphylaxis associated with primary hyperparathyroidism: a case report and review of the literature. Int J Endocrin 2010; pii: 823210. Dostupné z DOI: <http://doi: 10.1155/2010/823210>.
8. Nigwekar SU, Wolf M, Sterns RH et al. Calciphylaxis from nonuremic causes: a systemic review. Clin J Am Soc Nephrol 2008; 3(4): 1139–1143.
9. Goel SK, Bellowich K, McCullough PA. Treatment of severe metastatic calcification and calciphylasis in dialysis patients. Int J Nephrol 2011; 2011 : 701603. Dostupné z DOI: <http://doi:10.4061/2011/701603>.
10. Wilmer WA, Magro CM. Calciphylaxis: emerging concepts in prevention, diagnosis, and treatment. Semin Dial 2002; 15(3): 172–186.
11. Girotto JA, Harmon JW, Ratner LE et al. Parathyroidectomy promotes wound healing and prolongs survival in patients with calciphylaxis from secondary hyperparathyroidism. Surgery 2001; 130(4): 645–650.
12. Duffy A, Schurr M, Warner T et al. Long-term outcomes in patients with calciphylaxis from hyperparathyroidism. Ann Surg Oncol 2006; 13(1): 96–102.
13. Weenig R, Sewell LD, Davis MDP et al. Calciphylaxis: natural history, risk factor analysis and outcome. J Am Acad Dermatol 2007; 56(4): 569–579.
14. Schlieper G, Brandengurg V, Ketteler M et al. Sodium thiosulfate in the treatment of calcific uremic arteriolopathy. Nat Rev Nephrol 2009; 5(9): 539–543.
15. Rogers NM, Coates PT. Calcific uraemic arteriolopathy: an update. Curr Opin Nephrol Hypertens 2008; 17(6): 629–634.
16. Farah M, Crawford MR, Levin A et al. Calciphylaxis in the current era: emerging „ironic“ feature? Nephrol Dial Transplant 2011; 26(1): 191–195.
17. Brandengurg VM, Cozzolino M, Mazzaferro S. Calcific uremic arteriolopathy: A call for action. Semin Nephrol 2014; 34(6): 641–647.
18. Pujar T, Spinello EM. A 44year-old lady with chronic renal disease and intractable ulcers: a case report. Int Archives of Medicine, 2009; 2(1): 22.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2015 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Zlepšil se osud gravidit žen s pregestačním diabetes mellitus za deset let?
- Význam transkutánneho monitorovania tkanivového kyslíka u pacienta s diabetes mellitus s jeho komplikáciami
- Autoimunitní pankreatitida – diagnostický konsenzus
- Intersticiální plicní procesy a granulomatózy asociované s běžným variabilním imunodeficitem
- Vyšetření tenkého střeva pomocí magnetické rezonance
- Nový lék je výrazně účinnější nežli inhibitory ACE u chronického srdečního selhání
- Spontánní bakteriální peritonitida
- Co jsou a co nám přinášejí biosimilars?
- Inzulinová analoga u pacientů s diabetem a renální dysfunkcí
- Súčasnosť a budúcnosť v manažmente vénových vaskulárnych chorôb
- Akromegalie a medikamentózní léčba
- Raritní případ mnohočetného myelomu: vícečetný solitární plazmocytom kostí bérců a předloktí
- Kalcifikující uremická arteriolopatie – léčba tiosulfátem sodným
- XXXIV. dny mladých internistů
- Empagliflozin – nový zástupce inhibitorů transportéru SGLT2 pro léčbu pacientů s diabetem 2. typu
- Václav Hána. Endokrinologie pro praxi.
- Hana Papežová a kol. Naléhavé stavy v psychiatrii.
- Peter Gavorník. Angiológia 2 pre všeobecných lekárov – Arteriológia.
- Autoimunitní pankreatitida – diagnostický konsenzus – editorial
- Akromegalie a medikamentózní léčba – editorial
- Kalcifikující uremická arteriolopatie – editorial
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Spontánní bakteriální peritonitida
- Vyšetření tenkého střeva pomocí magnetické rezonance
- Empagliflozin – nový zástupce inhibitorů transportéru SGLT2 pro léčbu pacientů s diabetem 2. typu
- Význam transkutánneho monitorovania tkanivového kyslíka u pacienta s diabetes mellitus s jeho komplikáciami
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



