-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kalcifikující uremická arteriolopatie – léčba tiosulfátem sodným
Calcific uremic arteriolopathy – treatment with sodium thiosulfate
Calcific uremic arteriolopathy or calciphylaxis is a rare disorder characterized by systemic medial calcification of arterioles that leads to ischemia and subcutaneous necrosis. It most commonly occurs in patients with end-stage renal disease who are on haemodialysis or who have received a renal transplant. Calciphylaxis is dangerous by its fast progression into tissue necrosis, difficult healing process and a great risk of secondary infection which is the most common cause of death in this condition. The reported mortality rates are as high as 60–80 % in a couple of months once it is diagnosed. The key to successful treatment of calciphylaxis is fast diagnosing of the disease and appropriate treatment management. On the examples of three patients from our haemodialysis centre we demonstrate typical clinical manifestation of calciphylaxis and its treatment, which requires close patient-medical staff cooperation. The basic principle of treatment of all our patients was normalization of calcium-phosphate metabolism and secondary hyperparathyroidism. Sodium thiosulfate had been administered to all patients at the end of haemodialysis session. The wound care played another major role with gentle debridement and intensive local care. After five to six months the skin defects resolved in the first patient, partially resolved in the second patient and deteriorated in the third patient. We have observed no side effects of sodium thiosulfate application.
Key words:
calcific uremic arteriolopathy – calciphylaxis – haemodialysis – sodium thiosulfate
Autoři: Markéta Vyskočilová; Jan Svojanovský; Jana Blaštíková; Gabriela Dvořáková; Miroslav Souček
Působiště autorů: II. interní klinika LF MU a FN u sv. Anny Brno, přednosta prof. MUDr. Miroslav Souček, CSc.
Vyšlo v časopise: Vnitř Lék 2015; 61(2): 166-172
Kategorie: Kazuistika
Souhrn
Kalcifikující uremická arteriolopatie, neboli kalcifylaxe, je raritní onemocnění vyznačující se systémovou kalcifikací médie arteriol vedoucí k ischemii a podkožním nekrózám. Nejčastěji se vyskytuje u pacientů s konečným selháním ledvin v chronickém hemodialyzačním programu (incidence se udává 1–4 %) a po transplantaci ledviny. Kalcifylaxe je zrádná svou rychlou progresí v nekrózu tkáně, obtížným hojením a vysokým rizikem sekundární infekce, která je nejčastější příčinou úmrtí při tomto onemocnění. Úmrtnost se udává v rozmezí 60–80 % v průběhu několika měsíců od stanovení diagnózy. Základem léčebného úspěchu je včasné stanovení diagnózy a správně a trpělivě vedená léčba. Na příkladu 3 pacientů zařazených v našem chronickém hemodialyzačním programu demonstrujeme typické klinické projevy a léčbu kožních defektů při kalcifylaxi, jež vyžaduje těsnou spolupráci pacienta a ošetřujícího personálu. Základem léčby u všech našich pacientů byla korekce kalciofosfátového metabolizmu a sekundární hyperparatyreózy. Na konci dialýz byl všem aplikován tiosulfát sodný. Další důležitou součástí byla péče o ránu, citlivý debridement a intenzivní lokální péče. Po 5–6 měsících došlo k úplnému zhojení kožních defektů u první pacientky, výraznému zlepšení v případě druhého pacienta a progresi u třetí pacientky. Nebyly pozorovány žádné nežádoucí účinky aplikace tiosulfátu sodného.
Klíčová slova:
hemodialýza – kalcifikující uremická arteriolopatie – kalcifylaxe – tiosulfát sodnýÚvod
Kalcifikující uremická arteriolopatie (CUA), neboli kalcifylaxe, je raritní a často život ohrožující onemocnění charakterizované systémovou kalcifikací médie a proliferací intimy arteriol vedoucí k podkožním nekrózám [1,2]. Termín kalcifylaxe byl poprvé použit začátkem 60. let 20. století, kdy Selye et al popsali kalcifylaxi na zvířecím modelu. Po vystavení krys systémovým prokalcifikačním faktorům, jakými jsou např. vitamin D či parathormon, v tzv. fázi senzitizace pozoroval po aplikaci tzv. spouštěčů, jakým bylo např. trauma, akutní lokální kalcinózu se zánětlivou reakcí a sklerózou. V té době se domníval, že jde o systémovou hypersenzitivní reakci analogickou s alergickou reakcí (anafylaxe) [3]. Několik let poté byl popsán syndrom periferní tkáňové ischemie a ulcerace u uremických pacientů [4], který byl vzhledem k podobnosti kožních lézí se zvířecími modely popsanými Selye et al pojmenován jako kalcifylaxe. Avšak vzhledem k rozdílům v histologických charakteristikách kožního postižení není tento termín přesný. Za vhodnější se u uremických pacientů pokládá označení kalcifikující uremická arteriolopatie. Onemocnění se projevuje bolestivými kožními lézemi, fialové skvrny či podkožní uzly postupně progredují v ulcerace a nekrózy s nafialovělým lemem (obr. 1). Nejčastěji postihuje pacienty s renálním selháním, ale může se vyskytnout i u pacientů s normálními ledvinnými funkcemi, u kterých však nelze použít termín CUA, a tudíž se raději volí označení kalcifylaxe. Klinický obraz CUA je dobře znám, v jeho patofyziologii zůstává však řada nezodpovězených otázek, které znesnadňují vydání jednoznačných léčebných doporučení [5,6]. Za nejdůležitější se zatím považuje normalizace kalciofosfátového metabolizmu a lokální léčba. Jako jeden ze slibných léků se poslední dobou jeví tiosulfát sodný, jehož úspěch coby součásti komplexní léčby kožních defektů při CUA byl publikován v řadě kazuistik [7–10]. V naší práci popisujeme 3 kazuistiky léčby primárně distálních kožních defektů při CUA za použití tiosulfátu sodného s rozdílnými výsledky.
Obr. 1. Bolestivé kožní léze, fialové skvrny či podkožní uzly postupně progredují v ulcerace a nekrózy s nafialovělým lemem 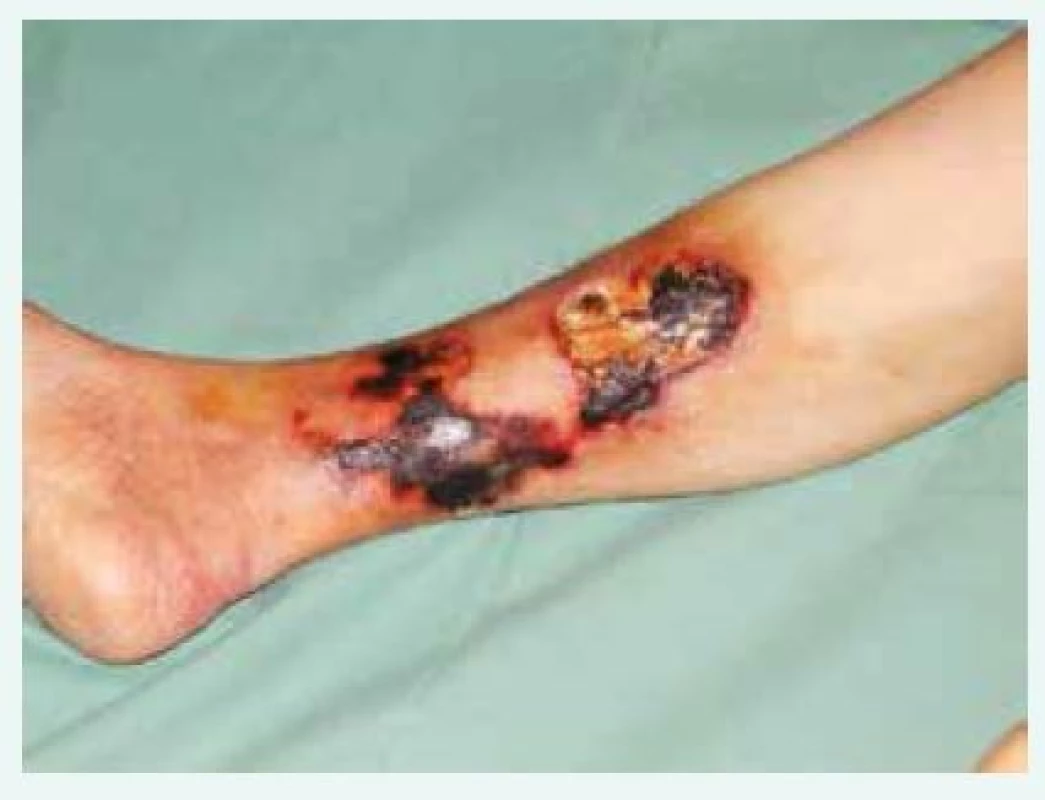
Popis případů
Kazuistika 1
Jako první se po několika letech na našem pracovišti objevil případ 61leté pacientky zařazené již 13 let v chronickém hemodialyzačním programu pro selhání ledvin při chronické glomerulonefritidě [11]. Ta v červnu roku 2011 pozorovala rozvoj palčivých a bolestivých tmavých skvrn na lýtku levé dolní končetiny. Žádného poranění, které by předcházelo jejich vývoji, si nebyla vědoma. Bércové ulcerace nikdy neměla. Při klinickém vyšetření na pravidelné hemodialýze byla v distální oblasti obou dolních končetin nalezena nekrotická ložiska s lividními okraji, vlevo velikosti 12 × 5 cm a vpravo 2 × 2 cm. Laboratorní známky zánětu byly nízké, pacientka byla afebrilní. Mimo vlastní ledvinné onemocnění a s ním související sekundární anémii a obtížně kompenzovatelnou sekundární hyperparatyreózu se léčila s chronickou ischemickou chorobou srdeční, prodělala infarkt myokardu spodní stěny a trpěla mitrální vadou, regurgitací 2.–3. stupně se srdečním selháním. Dále se léčila s arteriální hypertenzí, prediabetem, hypotyreózou při chronické tyreoiditidě, hyperlipoproteinemií a hyperurikemií. Tou dobou byla hemodialyzační léčba vedena 3krát týdně 4 hod při reziduální diuréze 500 ml/den. Kontrola hyperfosfatemie nebyla však i přes intenzivní léčbu vazači fosforu (sevelamer 800 mg 3krát 2 tbl a calcii carbonici 500 mg 3krát 3 tbl) dlouhodobě uspokojivá (2,5–2,8 mmol/l), stejně jako sekundární hyperparatyreóza – přetrvávala hodnota parathormonu (iPTH) > 50 pmol/l při terapii parikalcitolem 10 µg 3krát týdně. V rámci došetřování etiologie defektů dolních končetin bylo provedeno cévní vyšetření, na jehož základě byla potvrzena chronická žilní insuficience, nález na tepnách byl bez významnější stenózy, menší cévy bez známek vaskulitidy. I přes potvrzenou žilní nedostatečnost vzhledem k rizikovým faktorům (dlouhodobá dialyzační léčba, ženské pohlaví, nedostatečná korekce hyperfosfatemie a sekundární hyperparatyreózy) a typickému kožnímu defektu (bolestivý nekrotický střed s lividním okrajem bez známek infekce v ráně) bylo vysloveno podezření na CUA a pacientka byla hospitalizována. Biopsie z defektů nebyla provedena vzhledem k riziku zhoršení průběhu hojení při dalším poškození kožního krytu, typické anamnéze a klinickému nálezu. Ihned byla zahájena léčba, která se skládala z několika složek. Jednou z hlavních byla úprava kalciofosfátového metabolizmu se snahou o snížení kalcemie, korekci hyperfosfatemie a hyperparatyreózy. Kalciové vazače fosforu a parikalcitol byly vysazeny. Sevelamer byl navýšen na 800 mg 3krát 3 tbl a zavedena byla léčba cinakalcetem v dávce 90 mg denně. Dále byl upraven dialyzační režim, hemodialýza probíhala denně a byla prodloužena na 5 hod. Užíván byl dialyzační roztok s nízkou koncentrací vápníku 1,25 mmol/l. Asi po měsíci (prodleva z důvodu mimořádného dovozu léku) byla léčba rozšířena o aplikaci tiosulfátu sodného v dávce 100 ml 25% intravenózně vždy v poslední hodině hemodialýzy. Současně probíhala intenzivní lokální léčba defektů. V první fázi k postupnému odloučení nekróz byl použit hydrogel (Hydrosorb gel), který byl překryt silikonovou mřížkou (Mepitel one), následovala aplikace další vrstvy hydrogelu a vše bylo překryto vrstvou aktivního uhlí (Actisorb plus 25). Oplachy se prováděly vždy jen čistým fyziologickým roztokem a šetrně se prováděl debridement. Ránu po odloučení nekrózy ukazuje obr. 2. Po odloučení nekrózy následovala druhá fáze, ve které bylo použito speciální silikonové krytí s pěnovou poduškou (Mepilex Border). Nedílnou součástí léčby byla též léčba bolesti, k jejímuž tlumení postačovaly slabé opioidy. Doplněn byl ultrazvuk příštítných tělísek, kterým byla potvrzena hyperplazie bez jednoznačného průkazu adenomu. Na zavedené intenzivní kombinované léčbě docházelo ke zlepšení nejen z pohledu hojení kožních defektů, ale též z pohledu vnitřního prostředí. Hladina iPTH klesla < 10 pmol/l, hodnota fosforu kolísala kolem 1 mmol/l. Vzhledem k tomuto uspokojivému výsledku jsme o paratyreoidektomii neuvažovali. Pacientka byla po zaléčení propuštěna do domácího ošetřování s dialyzačním režimem 3krát týdně 5 hod. K úplnému zhojení defektů došlo asi po 5 měsících léčby (obr. 3). Celkem bylo aplikováno 45 dávek tiosulfátu sodného, bez známek nežádoucích účinků. Krátce po zhojení defektů však pacientka zkolabovala před zahájením pravidelné hemodialýzy. Pro dechovou a oběhovou zástavu musela být resuscitována. Příčinou zástavy byla nejspíše maligní arytmie při chronické ischemické chorobě srdeční komplikované akutní ischemií. Pacientka zemřela několik dní poté na Anesteziologicko-resuscitační klinice naší nemocnice v důsledku sekundární bronchopneumonie.
Obr. 2. Kazuistika 1, rána po odloučení nekrózy 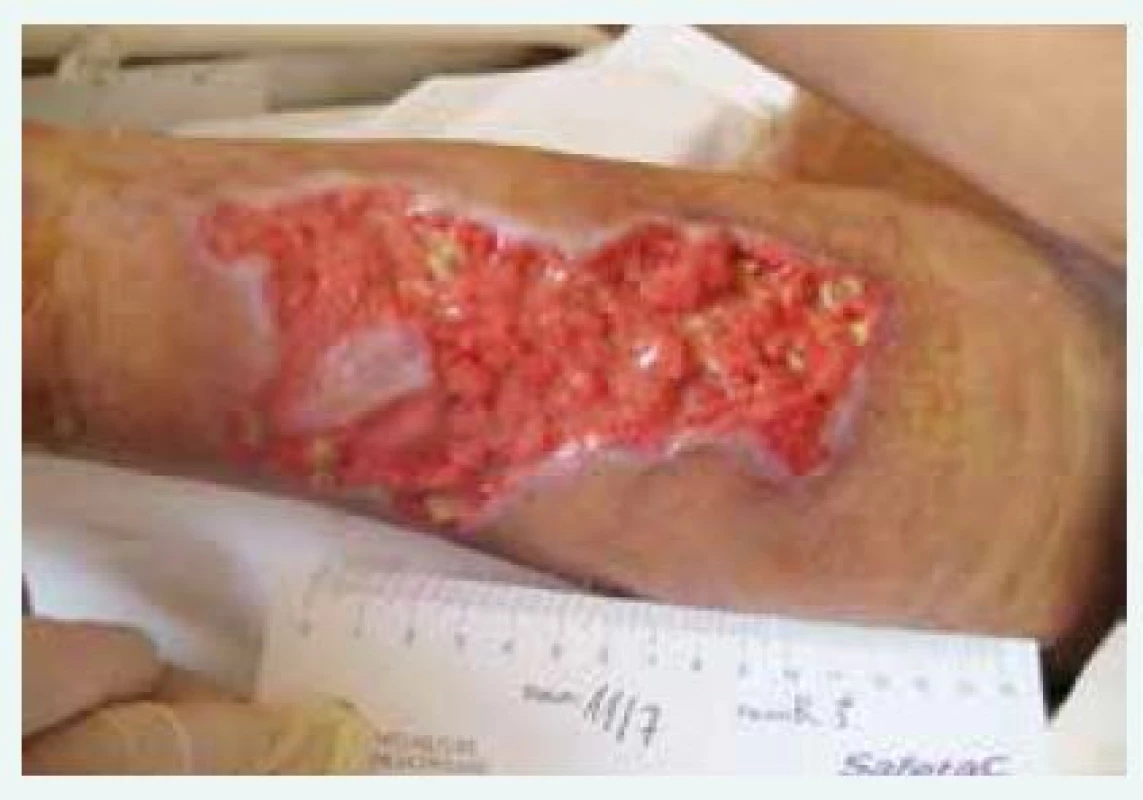
Obr. 3. Kazuistika 1, zhojení defektů asi po 5 měsících léčby 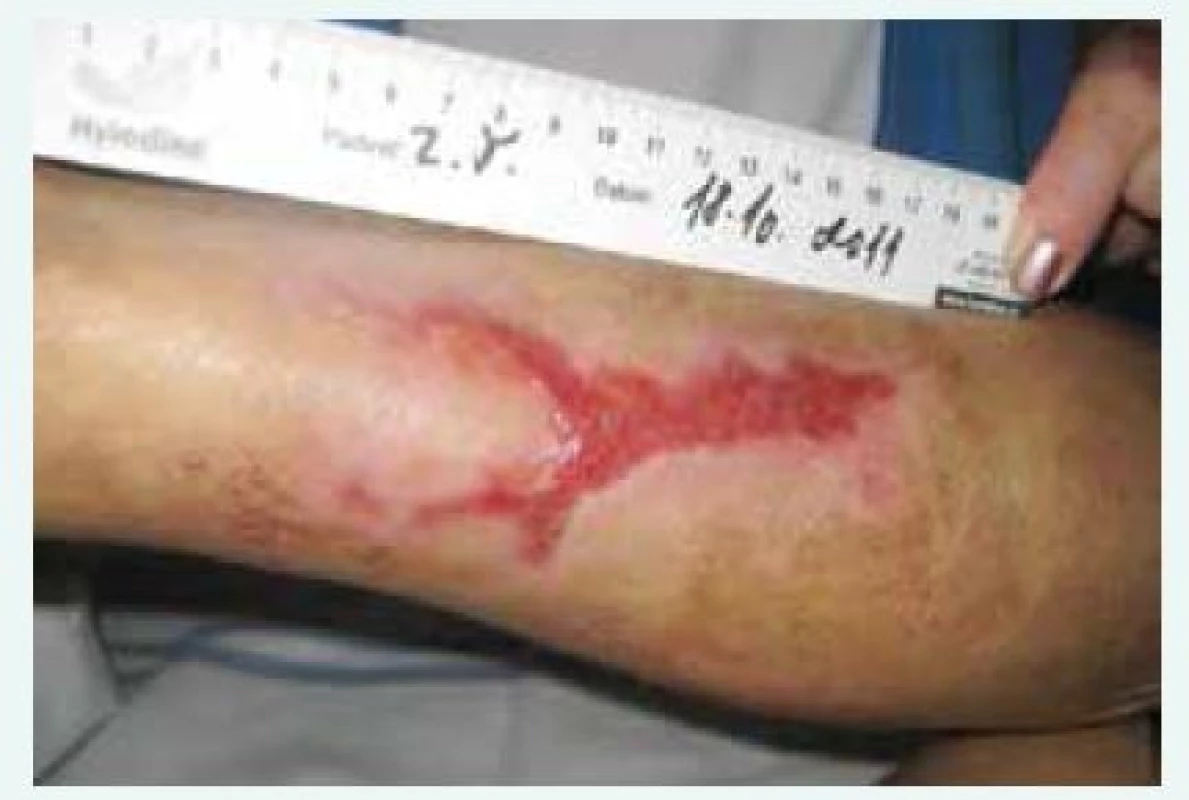
Kazuistika 2
Přibližně o půl roku později se objevil druhý případ. Tentokrát se jednalo o 58letého muže zařazeného 6 let v chronickém hemodialyzačním programu pro selhání ledvin na podkladě hypertenzní nefropatie [12]. Všiml si rychle se rozvíjejících, rozsáhlých, bolestivých defektů na lýtku pravé dolní končetiny. Na pravidelné hemodialýze byly při klinickém vyšetření popsány nekrotické defekty lýtka, největší velikosti asi 14 × 5 cm, další dvě velikosti asi 4 × 5 cm s naznačenými lividními okraji (obr. 4), oboustranně pak prosáknutí lýtek a difuzní kožní trofické změny. Dále se pacient léčil s chronickou ischemickou chorobou srdeční, prodělal anteroextenzivní infarkt myokardu, trpěl mitrální a trikuspidální insuficiencí 2.–3., resp. 3.–4. stupně. Byl to bývalý kuřák. V rámci prevence tromboembolické nemoci při permanentní fibrilaci síní užíval warfarin. Související s vlastním ledvinným onemocněním byla anémie a mírná sekundární hyperparatyreóza, na rozdíl od předchozí pacientky s dlouhodobě uspokojivými laboratorními hodnotami (iPTH 15,5 pmol/l, fosfatemie 1,9 mmol/l). Dále u něj byla zjištěna jaterní cirhóza vs. toxonutritivní etiologie s ascitem a hypoproteinemií, jejíž došetření odmítal. Ihned bylo provedeno cévní vyšetření, kde byla popsána pokročilá ischemická choroba dolních končetin s uzávěrem a. tibialis posterior vpravo a chronická žilní nedostatečnost. Byl objednán k pokusu o PTA (perkutánní transluminální angioplastika). Avšak vzhledem k rizikovým faktorům (dlouhodobá dialyzační léčba, malnutrice, dlouhodobé užívání kumarinů) a typickému vzhledu kožních defektů bylo i přes cévní nález vysloveno podezření (minimálně na podíl) CUA a pacient byl hospitalizován. Biopsie stejně jako u předchozí pacientky nebyla provedena vzhledem k riziku obtížného hojení dalšího defektu po porušení kožního krytu, v tomto případě navíc u pacienta se zhoršeným cévním zásobením dolních končetin. Ihned byla zahájena léčba. Pro dlouhodobě uspokojivé hodnoty fosfatemie a dobrou kompenzaci sekundární hyperparatyreózy byla frekvence dialýz zachována, tedy 3krát týdně, délka byla prodloužena na 4 hod. K omezení přísunu kalcia byla provedena stejná opatření jako u předchozí pacientky, tedy vysazení kalciových vazačů fosforu (záměna za sevelamer), vysazení VDRA (selektivní aktivátor receptoru D vitaminu) parikalcitolu a nahrazení cinakalcetem 30 mg denně, hemodialýza probíhala s roztokem s nízkou koncentrací kalcia. Zahájena byla léčba tiosulfátem sodným ve stejné dávce jako u předchozí pacientky. Jeho podání probíhalo opět v poslední hodině dialýzy. Vzhledem k prokalcifikačnímu efektu byl u pacienta vysazen warfarin a byl nahrazen antiagregační léčbou. Z důvodu rizika obtížného hojení eventuálních defektů po porušení kožního krytu nebyla zahájena jinak indikovaná léčba nízkomolekulárním heparinem (LMWH). Nutriční podpora spočívala ve výběrové dietě s bílkovinnými přídavky a sippingu. Lokální léčba probíhala stejně jako u předchozí pacientky. Pro sekundární infekci rány byla přechodně nutná antibiotická léčba. Vzhledem ke známkám dobrého prokrvení a hojení rány při provádění pravidelných převazů byl podíl ischemické choroby dolních končetin na vzniku defektu zhodnocen jako druhořadý a provedení PTA odloženo. Po zlepšení stavu byl pacient propuštěn do domácího ošetřování. Další péče o defekty probíhala při pravidelných hemodialýzách, avšak vzhledem k nespolupráci pacienta (vynechávání dialýz) a nelepšící se malnutrici nebyl efekt léčby tak dobrý jako u předchozí pacientky. Postupně došlo k progresi malnutrice a kachektizace při jaterní cirhóze a celkovému zhoršení klinického stavu pacienta, který zemřel asi 8 měsíců po stanovení diagnózy CUA na sepsi s nezhojenými defekty. Celkem mu bylo podáno 40 dávek tiosulfátu sodného, též bez známek nežádoucích účinků.
Obr. 4. Kazuistika 2, nekrotické defekty lýtka 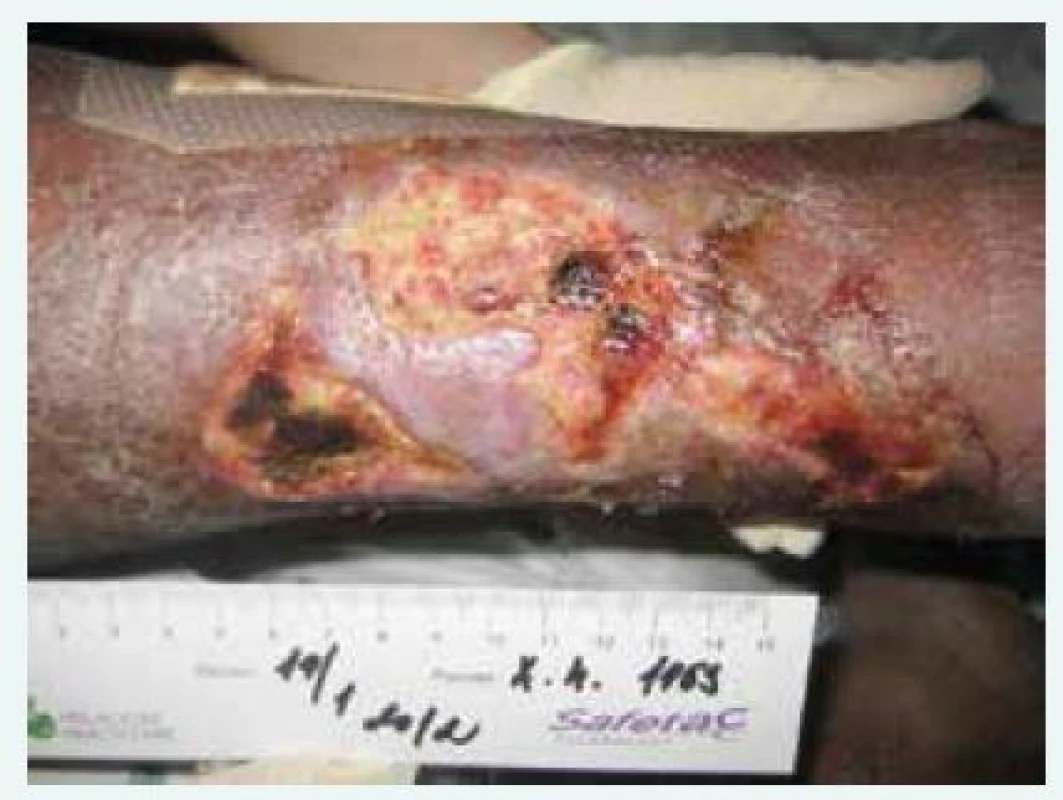
Kazuistika 3
Po 18 měsících se mezi našimi hemodialyzovanými pacienty vyskytl další případ CUA. Jednalo se o 57letou ženu zařazenou 8 let v hemodialyzačním programu pro selhání ledvin při diabetické nefropatii. Rozvinuly se u ní bolestivé defekty dolních končetin typického vzhledu. Při klinickém vyšetření byl popsán nekrotický defekt s nafialovělým lemem velikosti 3 × 3 cm na pravém bérci a defekt obdobného charakteru velikosti 2 × 2 cm v oblasti levého bérce. Na palci a 3. prstu levé dolní končetiny byly popsány drobné nekrózy. Jednalo se o diabetičku 2. typu s metabolickým syndromem na inzulinové terapii v konvenčním režimu. Pacientka se též léčila s chronickou ischemickou chorobou srdeční se srdečním selháním, prodělala opakovaně infarkt myokardu v oblasti přední stěny, posledních asi 5 měsíců před rozvinutím defektů s přetrvávajícím rozsáhlým aneuryzmatem hrotu ke konzervativnímu řešení. Z této indikace užívala warfarin. Dále se léčila s hypotyreózou, gastroezofageálním refluxem, psoriázou a sekundární anémií při selhání ledvin. Měla varixy na obou lýtkách a byla po náhradě kyčelního kloubu vlevo. V anamnéze defekty dolních končetin neměla. Při cévním vyšetření dolních končetin byla popsána uzávěrová choroba periferních tepen s disperzním postižením, převážně vpravo. S ohledem na rizikové faktory (dlouhodobá hemodialyzační léčba, pohlaví, obezita, užívání kumarinů) a typickému vzhledu defektů bylo i přes cévní nález vysloveno podezření dominantně na CUA a zahájena adekvátní léčba. Tuto diagnózu potvrdil i další vývoj stavu pacientky. Biopsie z defektů nebyla provedena z obavy z obtížného hojení dalšího defektu po porušení kožního krytu. Vzhledem k uspokojivým hodnotám fosfatemie (před HD 1,5 mmol/l) a dlouhodobě dobré kompenzaci sekundární hyperparatyreózy (iPTH 22–28 pmol/l) zůstala HD strategie nezměněna (3krát 4 hod týdně). Užíván byl dialyzační roztok s nízkou koncentrací vápníku 1,25 mmol/l. Vazače fosforu žádné neužívala. Cinakalcet byl navýšen z 30 mg na 60 mg na den. Zahájena byla též léčba tiosulfátem sodným a intenzivní lokální léčba jako u předchozích pacientů (Braunol, Hydrosorb, Actisorb, Bactigras, Mepilex Border). Warfarin byl nahrazen LMWH vzhledem k vysokému riziku trombotizace srdečního aneuryzmatu. Po asi 2 měsících však byl nahrazen klopidogrelem z důvodu snížení počtu mikrotraumat a snaze zabránit další progresi CUA. Podkožní aplikace inzulinu byla nenahraditelná. Byla nutná intenzivní analgetická léčba opiáty. I přes intenzivní léčbu však došlo k progresi defektů na bércích, hýždích, podbřišku a nakonec i v oblasti pravé lopatky a jejich bakteriální kolonizaci. Pacientka byla opakovaně přeléčena antibiotiky dle citlivosti bakterií ze stěrů z defektů. Stav pacientky se postupně horšil. Zemřela asi půl roku po rozvoji prvních defektů pod obrazem sepse. Celkem bylo podáno 50 dávek tiosulfátu sodného, opět bez známek nežádoucích účinků.
Diskuse
Kalcifikující uremická arteriolopatie je vzácné onemocnění, údaje o jeho prevalenci se v literatuře liší. Obecně se udává od méně než 1 % až po 4 % hemodialyzovaných pacientů [13,14]. Recentnější studie se kloní spíše k nižším procentům, což může být dáno zlepšením péče o hemodialyzované pacienty v posledních letech, a tedy omezením rizikových faktorů tohoto onemocnění. Ze zkušeností našeho pracoviště, na němž je chronicky dialyzováno přibližně 110 pacientů, bychom se klonili také spíše k hodnotě menší než 1 %. Výše popisované případy se vyskytly během 3 po sobě následujících let, ale to byla spíše výjimka. Obvykle CUA na našem pracovišti nevidíme každý rok. Vzhledem k tomu, že jde o onemocnění s vysokou mortalitou, je dobře, že jeho prevalence je nízká. Mortalita během jednoho roku od stanovení diagnózy se udává od 60 % až po 80 % u ulcerující formy [15]. U nás došlo k úmrtí všech 3 pacientů v tomto časovém horizontu, i když u první pacientky z jiné příčiny než CUA. Hlavní příčinou úmrtí je raná infekce a následná sepse [16,17]. Ta také byla příčinou úmrtí 2 našich pacientů. Vyšší riziko úmrtí pacientů s CUA může být způsobeno též přítomností rizikových faktorů CUA, jakým je např. malnutrice. Popsány byly 2 klinické formy CUA dle lokalizace kožního poškození, proximální a distální [18,19]. Proximální varianta postihuje oblast břišní stěny, sakrální oblast a proximální části končetin a má horší prognózu [16,17,20]. K tomuto typu postižení inklinují zejména obézní pacienti. Distální varianta, která je častější, postihuje distální oblast končetin, nejčastěji dolních (90 %).
Rozpoznáno bylo několik rizikových faktorů CUA u pacientů s konečným selháním ledvin v retrospektivních studiích. Ve Spojených státech amerických proběhlo v roce 1998 srovnání klinických charakteristik 9 pacientů s proximálním typem CUA s údaji 347 hemodialyzovaných pacientů ze stejné zeměpisné oblasti [21]. Z této studie vyšla obezita a nízký sérový albumin jako rizikové faktory CUA. O 3 roky později vyplynuly mimo nízké sérové hladiny albuminu další rizikové faktory z americké retrospektivní studie Mazhara et al [16] s 19 případy CUA, a to ženské pohlaví, hyperfosfatemie a vyšší hladina alkalické fosfatázy. Tato studie též potvrdila již dříve uváděné vyšší riziko CUA u bělochů. Výsledky retrospektivní studie z Kliniky Mayo publikované v roce 2007 [22] prokázaly obezitu, systémové užívání kortikosteroidů, hepatopatii, vyšší hladinu kalciofosfátového produktu a hliníku jako významné rizikové faktory CUA. V multicentrické retrospektivní studii z Japonska uveřejněné v roce 2011 se ukázaly antikoagulační léčba warfarinem a nízká sérová hladina albuminu jako významné rizikové faktory [23]. Role warfarinu je vysvětlována inhibicí aktivace matrix GLA proteinu, který hraje úlohu v inhibici lokální kalcifikace tkání a jehož aktivace je závislá na vitamin K dependentní karboxylaci. Svou roli ve vzniku CUA hraje zřejmě též chronický systémový zánět, jež se podílí na snížení hladiny fetuinu A, který hraje roli v inhibici vaskulární kalcifikace [24]. Identifikace rizikových faktorů je stejně jako hledání optimální léčby tohoto onemocnění limitována jeho nízkou prevalencí. U našich pacientů jsme našli řadu ze zmiňovaných rizikových faktorů. Všichni byli již delší dobu zařazeni v chronickém hemodialyzačním programu. U první pacientky bylo dalším rizikovým faktorem ženské pohlaví, obtížně korigovatelná hyperfosfatemie a sekundární hyperparatyreóza. U druhého pacienta se jednalo o malnutrici, nízkou hladinu sérového albuminu při jaterní cirhóze a antikoagulační léčbu perorálním antagonistou vitaminu K. U poslední pacientky to bylo opět ženské pohlaví, obezita a užívání kumarinů.
Rychlá, razantní a především komplexní léčba CUA je jedinou možností úspěchu [25]. Za nejdůležitější je považována korekce kalciofosfátového metabolizmu, a to zvýšením frekvence hemodialýz na 4–7krát týdně, ev. jejich prodloužením, a užití dialyzačního roztoku s co nejnižší koncentrací kalcia za monitorace jeho sérových hladin. Důležité je i omezení medikamentózního přísunu kalcia, tedy nahrazení kalciových vazačů fosforu nekalciovými (např. sevelamer, uhličitan lanthanu) a vysazení jeho substituce. Dalším důležitým bodem je korekce sekundární hyperparatyreózy zavedením či navýšením cinakalcetu. Význam paratyroidektomie pro další prognózu pacienta zůstává na základě dosud provedených studií nejednoznačný. V některých studiích vychází pozitivně [26], v jiných ne [22]. Proti ní stojí podezření na souvislost mezi CUA a příliš utlumeným kostním metabolizmem. Příliš nízká hladina iPTH je také považována za možný rizikový faktor [27]. Obecně by se o paratyroidektomii mělo uvažovat pouze u pacientů s velmi významnou sekundární hyperparatyreózou s výraznou hyperplazií příštítných tělísek nereagující či špatně reagující na konzervativní léčbu. Významnou a nedílnou součástí léčby CUA je správně a pečlivě vedené lokální ošetřování rány s citlivě prováděným debridement. V posledních letech se významné pozornosti v souvislosti s léčbou CUA těší tiosulfát sodný (STS), dosud užívaný zejména jako antidotum při otravě kyanidem a jako prevence chemoterapií indukované neurotoxicity. Jeho efekt na redukci vaskulární kalcifikace a kalciové nefrolitiázy byl prokázán ve 2 studiích na zvířatech [8,28]. Mechanizmus jeho účinku však zůstává nejasný. Zdálo se, že by se mohlo jednat o souhru více faktorů, zvýšení rozpustnosti kalcia, indukce acidózy, antioxidační děje, avšak ani jeden z těchto faktorů nebyl v americké in vitro studii potvrzen [29]. Nejčastějšími nežádoucími účinky rychlé aplikace STS (infuze podávána méně než hodinu) jsou nevolnost, zvracení, průjem a křečovité bolesti břicha a bolesti hlavy. Dalším nežádoucím účinkem nezávislým na rychlosti aplikace je metabolická acidóza. Při dlouhodobé aplikaci STS se doporučuje kontrola denzity kostní hmoty, vzhledem k průkazu jejího snížení při léčbě STS na krysím modelu [28]. Většina dosud publikovaných prací podporuje intravenózní aplikaci STS v dávce 25 g rozpuštěných ve 100 ml fyziologického roztoku podaných během poslední hodiny hemodialýzy [30–32]. Délka léčby se odvíjí od konkrétních případů, ale v současné době je doporučeno pokračovat v aplikaci STS minimálně ještě 2 měsíce po kompletním zhojení rány [30,33,34]. Bolesti většinou ustupují rychle, asi po dnech až týdnech od zahájení léčby. Hojení kožních defektů však obvykle trvá mnohem déle, od několika týdnů po několik měsíců. Nejrecentnější a zatím jedinou studií na toto téma je americká studie Nigwekar et al [35], která hodnotila výsledky 172 chronicky dialyzovaných pacientů s CUA léčených STS. Ačkoliv nepodala jasný průkaz efektu STS, většina pacientů, která jej dostávala, se klinicky zlepšila. Studie však potvrdila, že ani dlouhodobá aplikace STS u dialyzovaných pacientů (týdny až měsíce) nevedla k významnějším vedlejším účinkům. Vzhledem k vysoké mortalitě CUA, zanedbatelným nežádoucím účinkům STS a přesvědčení mnoha ošetřujících lékařů o jeho analgetickém efektu a pozitivním vlivu na hojení rány a přežití pacienta lze jeho použití v této indikaci ospravedlnit i přesto, že jeho efekt nebyl dosud statisticky signifikantně prokázán [36]. Naše zkušenost s léčbou STS u výše prezentovaných pacientů byla pozitivní. Léčba byla dobře tolerována, nezaznamenali jsme žádné nežádoucí účinky během několikaměsíční léčby. V některých pracích jsou uváděny ještě další léčebné možnosti, které lze využít v komplexní léčbě CUA. Jejich efekt však spíše vzbuzuje otázky. Jednou z nich je např. užití hyperbarické komory ke zlepšení dostupnosti kyslíku postiženým tkáním, zvýšení angiogeneze a proliferace fibroblastů a zvýšení baktericidní aktivity v ráně [37]. Další je užití bisfosfonátů pro jejich protizánětlivý efekt (viz role fetuinu A v rozvoji CUA) a snížení sekrece prozánětlivých cytokinů [30,33,38,39].
Spornou zůstává otázka rutinní verifikace diagnózy CUA kožní biopsií. Obecně je provedení biopsie autory považováno za rizikové, a tedy by mělo být provedeno pouze při diagnostických pochybnostech [15,40]. Nejen že se rána po biopsii špatně hojí, ale často se v horizontu několika týdnů v okolí místa biopsie rozvine další kožní ulcerace. Jednotlivé biopsie mohou být falešně negativní, a tudíž je nutné je opakovat, čímž se opět zvyšuje riziko dalších ulcerací. V souvislosti s těmito zkušenostmi se též při CUA doporučuje minimalizovat porušení kožního krytu jakýmkoliv způsobem, např. i podkožní aplikací léků.
Závěr
Kalcifikující uremická arteriolopatie je vzácná a těžká komplikace postihující dominantně pacienty s chronickým selháním ledvin. Její prevence a terapeutické postupy jsou omezeny nedostatečnými znalostmi patofyziologie tohoto onemocnění a chybějícími prospektivními kontrolovanými klinickými studiemi, které by hodnotily výsledky léčby těchto pacientů. Je velmi sporné, zda se kdy u tak raritního onemocnění podaří takovou studii uskutečnit. Do té doby bude největším přínosem mezinárodní spolupráce lékařů pečujících o pacienty s tímto onemocněním formou sdílení údajů o diagnostice, léčbě a jejích výsledcích v rámci kalcifylaktických registrů. Iniciativa Kidney Disease – Improving Global Outcomes (KDIGO), mezinárodní nezávislá nezisková organizace usilující o zlepšení péče o pacienty s chronickým selháním ledvin, dala podnět k založení online registrů, které mají za cíl shromáždit co nejvíce údajů o případech kalcifylaxe a shromáždit nejen data, ale i vzorky pacientů (sérum, DNA, tkáňové biopsie) k jejich dalšímu vědeckému zkoumání. Tyto byly dosud založeny v Německu (www.calciphylaxie.de), ve Spojeném království (www.calciphylaxis.org.uk) a ve Spojených státech amerických (www2.kumc.edu/calciphylaxisregistry/). Zpracování dat z těchto registrů může být velmi nápomocné v odhalení dalších rizikových faktorů-biomarkerů a ve zlepšování diagnostiky a léčby tohoto onemocnění.
MUDr. Markéta Vyskočilová
marketa.vyskocilova@fnusa.cz
II. interní klinika LF MU a FN u sv. Anny, Brno
www.fnusa.cz
Doručeno do redakce 3. 11. 2014
Přijato po recenzi 5. 1. 2015
Zdroje
1. Herout V, Ryska A, Pohnetalova D et al. Kalcifylaxe u dlouhodobě dialyzované nemocné. Vnitř Lék 1997; 43(11): 753–755.
2. Hájková B. Kalcifylaxe – popis případu a rozbor problematiky. Aktuality v nefrologii 2009; 15(4): 169–171.
3. Selye H, Gentile G, Prioreschi P. Cutaneous molt induced by calciphylaxis in the rat. Science 1961; 134(3493): 1876–1877.
4. Anderson DC, Stewart WK, Piercy DM. Calcifying panniculitis with fat and skin necrosis in a case of uremia with autonomous hyperparathyroidism. Lancet 1968; 2(7563): 323–325.
5. Teplan V et al. Praktická nefrologie. 2nd ed. Grada: Praha 2006 : 102. ISBN 80–247–1122–2.
6. Sulková S (ed). Hemodialýza. Maxdorf: Praha 2000 : 462–463. ISBN 80–85912–22–8.
7. Mason D, Best SD. Calcific uremic arteriolopathy: contemporary pharmacotherapy. Adv Chronic Kidney Dis 2010; 17(5): 428–438.
8. Cinone J, Petronis J, Embert C et al. Successful treatement of calciphylaxis with intravenous sodium thiosulfate. Am J Kidney Dis 2004; 43(6): 1104–1108.
9. Brucculeri M, Cheigh J, Bauer G et al. Long-term intravenous sodium thiosulfate in the treatement of a patient with calciphylaxis. Semin Dial 2005; 18(5): 431–434.
10. Auriemma M, Carbone A, Di Libetaro L. Treatement of cutaneous calciphylaxis with sodium thiosulfate. AM J Clin Dermatol 2011; 12(5): 339–346.
11. Vyskočilová M. Kalcifikující uremická arteriolopatie – kazuistika – zkušenosti našeho pracoviště. In: XXXI. dni mladých internistov s medzinárodnou účasťou. Martin, Slovenská republika, 24.-25.5.2012 (Abstrakta). Dostupné z WWW: <http://www.vnitrnilekarstvi.eu/online/E2012_7>.
12. Blaštíková J, Svojanovský J, Souček M. Kalcifikující uremická arteriolopatie. Poster. 34. Kongres České nefrologické společnosti s mezinárodní účastí. Brno, 14.-16.6.2012.
13. Rogers NM, Coates PT. Calcific uraemic arteriolopathy: an update. Curr Opin Nephrol Hypertens 2008; 17(6): 629–634.
14. Angelis M, Wong LL, Myers SA et al. Calciphylaxis in patients on haemodialysis: a prevalence study. Surgery 1997; 122(6): 1083–1089.
15. Fine A, Zacharias J. Calciphylaxis is usually non-ulcerating: risk factors, outcome and therapy. Kidney Int 2002; 61(6): 2210–2217.
16. Mazhar AR, Johnson RJ, Gillen D et al. Risk factors and mortality associated with calciphylaxis in end-stage renal disease. Kidney Int 2001; 60(1): 324–332.
17. Hafner J, Keusch G, Wahl C et al. Calciphylaxis: A syndrome of skin necrosis and acral gangrene in chronic renal failure. Vasa 1998; 27(3): 137–143.
18. Budisavljevic MN, Cheek D, Ploth DW. Calciphylaxis in chronic renal failure. J Am Soc Nephrol 1996; 7(7): 978–782.
19. Sobotová D. Chronické onemocnění ledvin. In: Souček M, Špinar J, Vorlíček J (eds). Vnitřní lékařství. Grada: Praha 2011. ISBN 978–80–247–2110–1.
20. Hafner J, Keusch G, Wahl C et al. Uremic small-artery disease with medial calcification and intimal hyperplasia (so-called calciphylaxis): A complication of chronic renal failure and benefit from parathyroidectomy. J Am Acad Dermatol 1995; 33(6): 954–962.
21. Bleyer AJ, Choi M, Igwemezie B et al. A case control study of proximal calciphylaxis. Am J Kidney Dis 1998; 32(3): 376–383.
22. Weening RH, Sewell LD, Davis MD et al. Calciphylaxis: natural history, risk factor analysis, and outcome. J Am Acad Dermatol 2007; 56(4): 569–579.
23. Hayashi M, Takamatsu I, Kanno Y et al. A case-control study of calciphylaxis in Japanese end-stage renal dinase patiens. Nephrol Dial Transplant 2012; 27(4): 1580–1584.
24. Lebreton JP, Joisel F, Raoult JP et al. Serum concentration of human alpha 2 HS glykoprotein during the inflammatory process: evidence that alpha 2 HS glykoprotein is a negative acute-phase reactant. J Clin Invest 1979; 64(4): 1118.
25. Šafránek R. Kalcifylaxe. Postgraduální nefrologie 2011; 9(2): 29.
26. Girotto JA, Harmon JW, Ratner LE et al. Parathyroidectomy promotes wound healing and prolongs survival in patients with calciphylaxis from secondary hyperparathyroidism. Surgery 2001; 130(4): 645–650.
27. Risikofaktoren & Therapieansätze: Behandlungsansätze der Calciphylaxie. Dostupné z WWW: <http://www.calciphylaxis.net/index.php?id=325&L=0>.
28. Pasch A, Schaffner T, Huynh-Do U et al. Sodium thiosulfate prevents vascular calcifications in uremic rats. Kidney Int 2008; 74(11): 1444–1453.
29. O´Neil WC, Hardcastle KI. The chemistry of thiosulfate and vascular calcification. Nephrol Dial Transplant 2012; 27(2): 521–526.
30. Hayden MR, Goldsmith D, Sowers JR et al. Calciphylaxis: calcific uremic arteriolopathy and the emerging role of sodium thiosulfate. Int Urol Nephrol 2008; 40(2): 443–451.
31. Cicone JS, Petronis JB, Embert CD et al. Successful management of calciphylaxis with intravenous sodium thiosulfate. Am J Kidney Dis 2004; 43(6): 1104–1108.
32. Brucculeri M, Cheigh J, Bauer G et al. Long-term intravenous sodium thiosulfate in the treatment of a patient with calciphylaxis. Semin Dial 2005; 18(5): 431–434.
33. Hayden MR. Calciphylaxis and the cardiometabolic syndrome: the emerging role of sodium thiosulfate as a novel treatement option. J Cardiometab Syndr 2008; 3(1): 55–59.
34. Hayden MR, Tyagi SC, Kolb L et al. Vascular ossification-calcification in metabolic syndrome, type 2 diabetes mellitus, chronic kidney disease and calciphylaxis-calcific uremic arteriolopathy: the emerging role of sodium thiosulfate. Cardiovasc Diabetol 2005; 4 : 4. Dostupné z DOI: <http:// 10.1186/1475–2840–4-4>.
35. Nigwekar SU, Brunelli SM, Meade D et al. Sodium thiosulfate therapy for calcific uremic arteriolopathy. Clin J Am Soc Nephrol 2013; 8(7): 1162–1170.
36. Brandenburg V. Kommentar zu: Sodium Thiosulfate Therapy for Calcific Uremic Arteriolopathy von Sagar Nigwekar und Kollegen, Massachusetts General Hospital Boston, in CJASN online Mai 2013. Dostupné z WWW: <http://www.calciphylaxie.de>.
37. Sowers KM, Hayden MR Calcific uremic arteriolopathy: pathophysiology, reactive oxygen species and therapeutic approaches. Oxid Med Cell Longev 2010; 3(2): 109–121.
38. Pennanen N, Lapinjoki S, Urtti A et al. Effect of liposomal and free bisphosphonates on IL-1 beta, IL-6 and TNFalpha secretion from RAW 264 cells in vitro. Pharm Res 1995; 12(6): 916–922.
39. Sulková Dusilová S, Válek M. Skin wounds associated with calciphylaxis in end-stage renal disease patients on dialysis. Nutrition 2010; 26(9): 910–914.
40. Brandenburg VM, Kramann R, Specht P et al. Calciphylaxis in CKD and beyond. Nephrol Dial Transplant 2012; 27(4): 1314–1318.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2015 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Zlepšil se osud gravidit žen s pregestačním diabetes mellitus za deset let?
- Význam transkutánneho monitorovania tkanivového kyslíka u pacienta s diabetes mellitus s jeho komplikáciami
- Autoimunitní pankreatitida – diagnostický konsenzus
- Intersticiální plicní procesy a granulomatózy asociované s běžným variabilním imunodeficitem
- Vyšetření tenkého střeva pomocí magnetické rezonance
- Nový lék je výrazně účinnější nežli inhibitory ACE u chronického srdečního selhání
- Spontánní bakteriální peritonitida
- Co jsou a co nám přinášejí biosimilars?
- Inzulinová analoga u pacientů s diabetem a renální dysfunkcí
- Súčasnosť a budúcnosť v manažmente vénových vaskulárnych chorôb
- Akromegalie a medikamentózní léčba
- Raritní případ mnohočetného myelomu: vícečetný solitární plazmocytom kostí bérců a předloktí
- Kalcifikující uremická arteriolopatie – léčba tiosulfátem sodným
- XXXIV. dny mladých internistů
- Empagliflozin – nový zástupce inhibitorů transportéru SGLT2 pro léčbu pacientů s diabetem 2. typu
- Václav Hána. Endokrinologie pro praxi.
- Hana Papežová a kol. Naléhavé stavy v psychiatrii.
- Peter Gavorník. Angiológia 2 pre všeobecných lekárov – Arteriológia.
- Autoimunitní pankreatitida – diagnostický konsenzus – editorial
- Akromegalie a medikamentózní léčba – editorial
- Kalcifikující uremická arteriolopatie – editorial
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Spontánní bakteriální peritonitida
- Vyšetření tenkého střeva pomocí magnetické rezonance
- Empagliflozin – nový zástupce inhibitorů transportéru SGLT2 pro léčbu pacientů s diabetem 2. typu
- Význam transkutánneho monitorovania tkanivového kyslíka u pacienta s diabetes mellitus s jeho komplikáciami
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



