-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv antidiabetické léčby na skelet nemocných s diabetes mellitus 2. typu
The effect of antidiabetic treatment on the bone of patients with type 2 diabetes
Despite a normal or higher bone mass, type 2 diabetes is associated with a higher risk of osteoporotic fractures. Besides a higher falls frequency the lower quality of diabetics bone plays the crucial role in this case. One of the factors affecting their fracture risk is a choice of antidiabetic treatment. So far, professional societies have warned before the thiazolidinediones use only, but gliflozines can be harmful for bone too. Metformin, sulfonylureas, GLP-1 agonists and DPP-4 inhibitors belong to the drugs without a negative effect on the fracture risk. The increased frequency of bone fractures in diabetics treated with insulin lies more in the fact that these patients suffer from diabetes longer, have more diabetic complications and are at a higher risk of hypoglycemia, which is associated with a higher frequency of falls. In individuals with a high fracture risk antidiabetic drugs without a negative effect on bones should be recommended.
Key words:
DPP–4 inhibitors – gliflozines – GLP–1 agonists – insulin – metformin – osteoporosis – sulfonylureas – thiazolidinediones – type 2 diabetes mellitus
Autoři: David Karásek
Působiště autorů: III. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc
Vyšlo v časopise: Vnitř Lék 2016; 62(7-8): 582-587
Kategorie: Přehledné referáty
Souhrn
Diabetes mellitus 2. typu je i přes normální, či vyšší kostní hmotu spojen s rizikem osteoporotických fraktur. Kromě pádů se na tom podílí především horší kvalita kosti diabetiků. Jedním z faktorů ovlivňujících výskyt zlomenin je volba antidiabetické léčby. Odborné společnosti doposud varují pouze před tiazolidindiony, rizikové však mohou být i některé glifloziny. Mezi léky bez negativního efektu na riziko fraktur dnes řadíme metformin, deriváty sulfonylurey, GLP1 agonisty a DPP4 inhibitory. Zvýšený výskyt zlomenin při léčbě inzulinem spočívá nejspíše v tom, že tito nemocni trpí diabetem delší dobu, mají více diabetických komplikací a vyšší riziko hypoglykemie, což je spojeno s četnější incidencí pádů. V případě pacientů s vysokým rizikem kostních fraktur bychom měli volit ta antidiabetika, u nichž není negativní vliv na skelet diabetiků dokumentován.
Klíčová slova:
deriváty sulfonylurey – diabetes mellitus 2. typu – DPP4 inhibitory – glifloziny – GLP1 agonisté – inzulin – metformin – osteoporóza – tiazolidindionyÚvod
Diabetes mellitus (DM) představuje závažné onemocnění se stále rostoucím výskytem. V roce 2013 činila celková prevalence diabetu v ČR 8,2 % a v současné době se dá očekávat její narůst k 9 % [1]. Nejvíce se na ní podílí narůstající počet diabetiků 2. typu, kteří nyní tvoří asi 92 % všech nemocných. Je zajímavé, že podobně vysoká je i prevalence osteoporózy. Podle dostupných údajů trpí touto chorobou 7–8 % obyvatelstva ČR [2,3]. Její výskyt závisí především na věku a pohlaví. Některou z osteoporotických fraktur utrpí v životě každá 3. žena a každý 5. muž. Riziko zlomeniny se po 65. roce věku zvyšuje až na 40 % [2]. Z důvodu stárnutí naší populace lze předpokládat, že i nemocných s osteoporózou bude přibývat. Vysoká prevalence obou onemocnění nabízí tedy otázku jejich společného výskytu. Ukazuje se však, že nejde jen o náhodnou koincidenci, ale o vzájemné působení řady metabolických procesů včetně terapeutických vlivů [3].
Na rozdíl od DM 1. typu (DM1T), který je uznávaným rizikovým faktorem a jehož přítomnost zohledňuje i výpočet pravděpodobnosti rizika osteoporotické fraktury v následujících 10 letech (FRAX) [4], přinášely epidemiologické studie sledující výskyt osteoporózy u DM 2. typu (DM2T) dlouho nejednoznačné výsledky. Až v roce 2007 byly publikovány 2 rozsáhlé metaanalýzy, které ukázaly, že ve srovnání s jedinci bez diabetu existuje u diabetiků 2. typu 1,4–1,7krát vyšší riziko fraktury v oblasti kyčle [5,6]. Asociace s osteoporotickými zlomeninami v ostatních lokalitách je mnohem slabší a ne vždy statisticky významná [6]. Diskrepantní se ukázaly výsledky měření hustoty kostní hmoty (BMD – bone mineral density). Zatímco u nemocných s DM1T byla BMD snížená, u nemocných s DM2T byla jak v oblasti kyčle, tak v oblasti páteře zvýšená [5]. Tento nález se většinou dává do souvislosti s vyšší prevalencí obezity, neboť tělesná hmotnost patří mezi hlavní determinanty BMD [3,7]. Kromě mechanického efektu se může u žen uplatnit zvýšená produkce aromatázy tukovou tkání, díky níž dochází k syntéze estrogenů z androgenních prekurzorů i v postmenopauzálním období a u obou pohlaví také zvýšená produkce leptinu, která vede ke snížení aktivity osteoklastů a zvýšení aktivity osteoblastů, což je provázeno nárůstem BMD [7,8]. Tento vztah je však zřejmě složitější a samotný leptin se může pomocí aktivace sympatiku (přes hypotalamická centra) nepřímo podílet i na ztrátě BMD [8]. Je také zřejmé, že riziko fraktury u nemocných s DM2T je na podkladě BMD hůře predikovatelné a spíše než s kvantitou kosti souvisí s její kvalitou [9].
Vysoká prevalence fraktur u diabetiků má více příčin. Jednou z nich je riziko pádů. To souvisí s věkem, přítomností specifických diabetických komplikací (neuropatie, retinopatie, diabetická noha), nebezpečím iatrogenně navozené hypoglykemie a celkovou polymorbiditou nemocných, která si mnohdy vyžádá další rizikovou léčbu (hypotenziva, hypnotika, sedativa) [9–11]. Deficit vitaminu D může také hrát určitou roli, jeho suplementace však nevede k významné redukci pádů [12]. Ty mají vztah především k frakturám kyčle a proximálního humeru, avšak jejich zvýšená frekvence zcela nevysvětluje riziko osteoporotických fraktur diabetiků [9,11].
Jak již bylo zmíněno výše, diabetici 2. typu mají horší kvalitu kostí, která se neprojeví celkovým poklesem BMD. Jejich kost je fragilnější. Jde především o relativní úbytek kortikální části dlouhých kostí vůči spongióze, která je nejvíce odpovědná za jejich pevnost [9,11]. Tyto změny se při běžném denzitometrickém vyšetření neprojeví, nicméně mohou být detekovány při kvantitativním CT vyšetření s vysokým rozlišením (HRqCT) a ev. při 3D rekonstrukci [13] (obr). Mimo těchto makroskopických změn byly u diabetiků popsány i změny v mikroarchitektuře trabekulární kosti [3,11].
Obr. 1. Kvantitativní CT vyšetření s vysokým rozlišením – HRqCT distální (A, E, I) a proximální části (B, F, J) radia, 3D rekonstrukce (C, G, K) a vizualizace kortikální kosti (D, H, L) 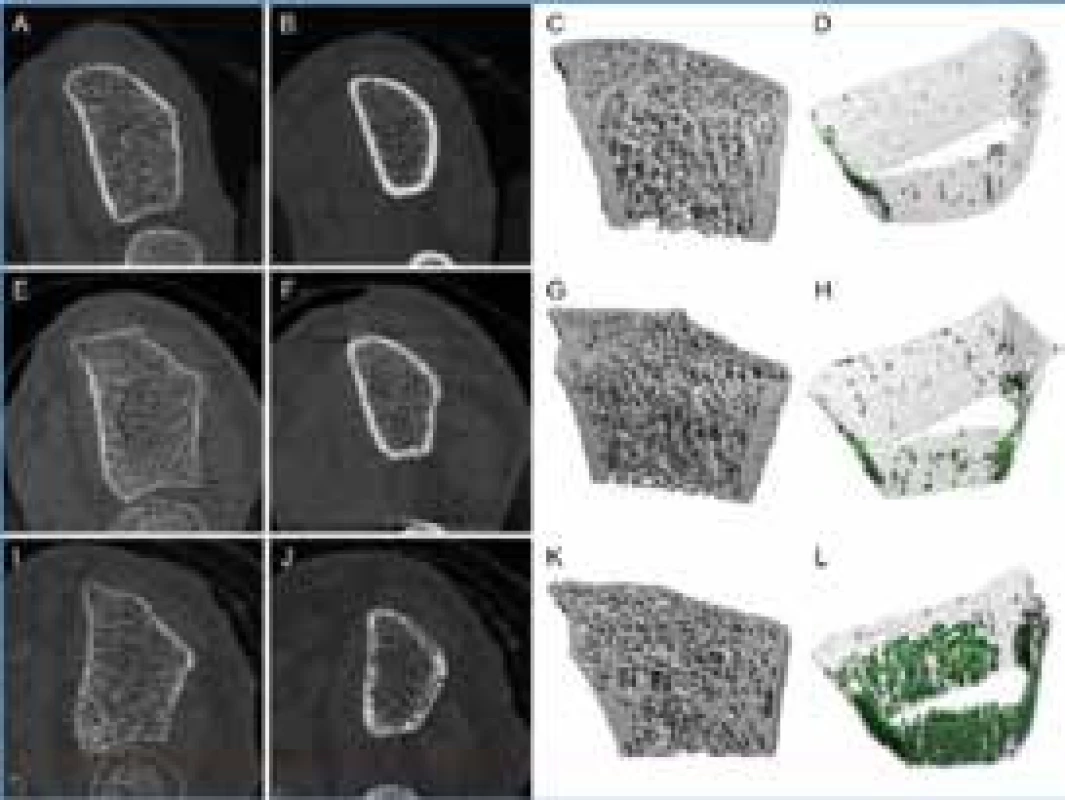
Horní řada (A, B, C, D) patří zdravé kontrole, prostřední (E, F, G, H) diabetikovi 2. typu bez fraktury a dolní řada (I, J, K, L) diabetikovi 2. typu s osteoporotickou frakturou Převzato z [13] se souhlasem autora i Endocrine Society and Copyright Clearance Center Na zvýšené fragilitě kostí diabetiků se zřejmě podílí i metabolické změny. Studie hodnotící vliv diabetu 2. typu na kostní metabolizmus nepřináší vždy konzistentní nálezy. Většina z nich však nalézá sníženou kostní formaci a některé z nich i sníženou resorpci, tedy zpomalený kostní obrat, což může být příčinou zvýšeného rizika osteoporotické fraktury navzdory vyšší BMD [11]. Patogeneze těchto změn je komplexní a v současné době není zcela vyjasněná. U diabetiků 2. typu byla popsána zvýšená koncentrace osteosklerostinu, která koreluje s délkou trvání diabetu a hladinami glykovaného hemoglobinu [9]. Osteosklerostin je produkován osteofyty, tlumí aktivitu osteoblastů (inhibicí Wnt/β-katenin signalizační cesty) a podílí se tak na supresi kostní formace. Jeho zvýšené hladiny byly identifikovány jako na BMD nezávislý prediktor osteoporotických fraktur u nemocných s DM2T [3,9,11]. Chronická hyperglykemie je spojená s tvorbou pokročilých konečných produktů neenzymatické glykace (AGEs). Na povrchu osteoblastů byly nalezeny jejich receptory (RAGEs) a zapojení osy AGE-RAGEs může být dalším mechanizmem inhibujícím kostní formaci [11]. AGEs se spolu s hyperglykovaným kolagenem také podílí na deterioraci kostní matrix, což nadále zvyšuje fragilitu diabetické kosti a přispívá k riziku zlomenin [9,11].
Je možný i nepříznivý vliv již zmíněné tukové tkáně. Především hormonálně aktivní viscerální tuková tkáň se může podílet prostřednictvím některých adipokinů na ovlivnění systému RANK/RANKL a snižovat hladinu osteoprotegerinu, což hraje zásadní roli v aktivaci osteoklastů. Navíc může být snížena produkce jiných adipokinů, které osteoklasty inhibují a aktivují osteoblasty [14]. Vliv adipokinů na formaci a resorpci kosti bývá mnohdy komplexní (tab). Jde zřejmě o výsledek interakcí mnoha faktorů, který proces převáží. Tuková tkáň se může uplatnit i lokálně. U DM2T je nalézána zvýšená adipozita kostní dřeně, přičemž adipocyty mohou přímo inhibovat aktivitu osteoblastů produkcí prozánětlivých cytokinů a volných mastných kyselin [9]. K lokálním faktorům lze přiřadit i vliv diabetické neuropatie [11].
Tab. 1. Vliv vybraných adipokinů na kostní obrat 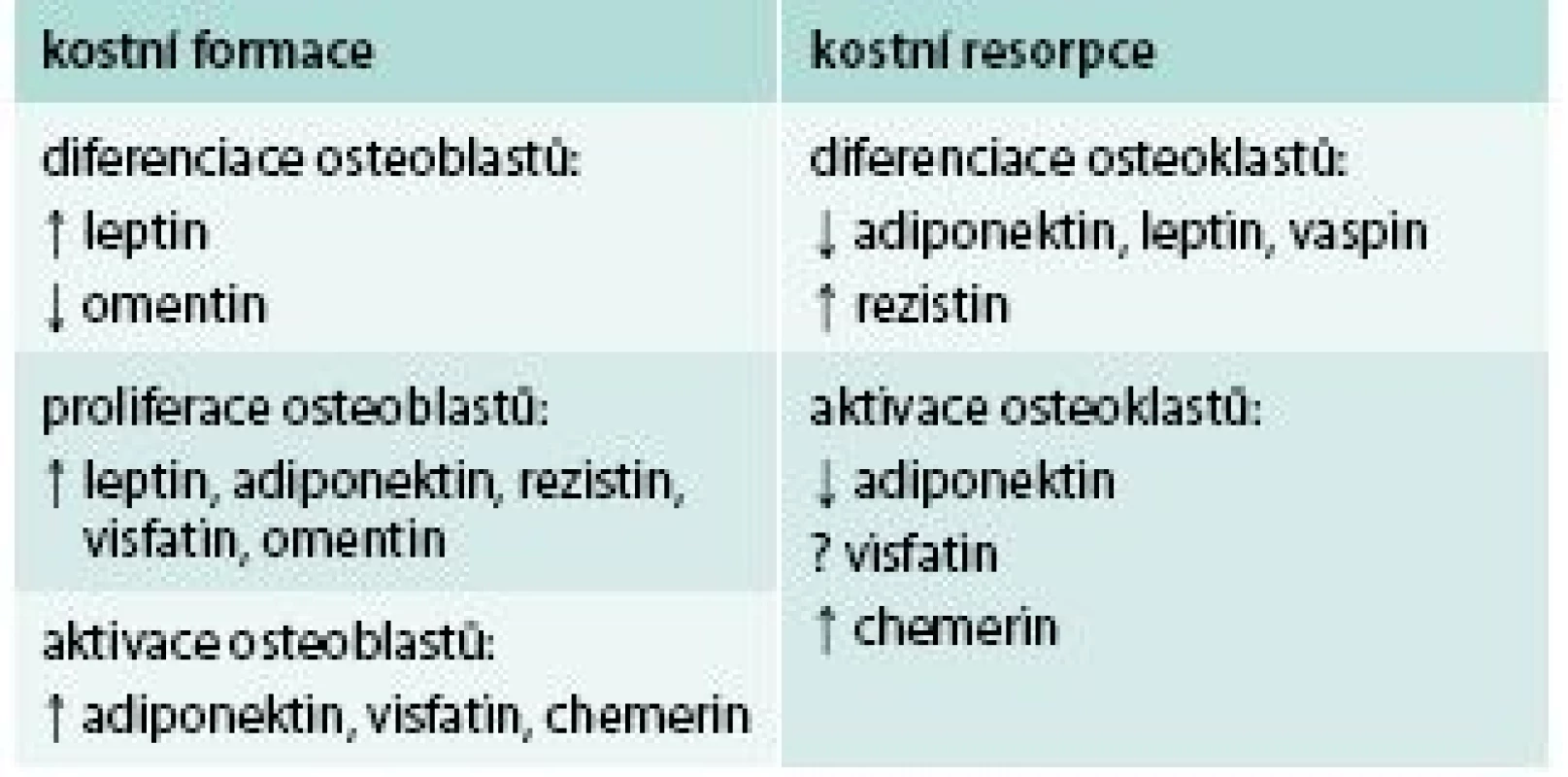
Upraveno podle [14] Metabolizmus kostí je silně ovlivňován případným nedostatkem vitaminu D a kalcia [3], na čemž se často podílí diabetická nefropatie [9]. Jeho hladinu v séru výrazně ovlivňuje také obezita a s ní spojená inzulinová rezistence a hyperinzulinemie. Tuková tkáň váže větší množství vitaminu D a sérová hladina tohoto působku bývá u obézních osob nižší. Zvýšená inzulinová rezistence navíc vede k jeho pevnější vazbě na vazebné proteiny a aktivní forma je pak snížena, a to i při zdánlivě postačující hladině celkového vitaminu D v krevním séru [3]. Inzulin má nepochybně anabolický účinek na kost a hyperinzulinemie bývá spojena nárůstem BMD. Nicméně se stoupající hladinou inzulinu klesá pevnost a odolnost kostní tkáně vůči zátěži, protože osteoblast začne atypicky mezibuněčnou signalizací ovlivňovat osteoklasty a kostní resorpci [3].
Bez ohledu na množství kostního minerálu a BMD hraje u diabetiků tedy rozhodující roli kvalita kostní tkáně. Mezi faktory, které se mohou podílet na kvalitě kostí, a tím ovlivnit výskyt osteoporotických fraktur diabetiků, je nutno jmenovat také účinky antidiabetické léčby.
Metformin
Metformin je dnes lékem první volby DM2T. Z hlediska ovlivnění kostí je jeho podávání bezpečné a pacienti mohou z této léčby zřejmě i profitovat. Bylo zjištěno, že in vitro stimuluje proliferaci a diferenciaci osteoblastů a je schopen je chránit před negativním vlivem produktů pokročilé glykace (advanced glycation end products – AGEs) [9,15]. Existují data svědčící pro přímou inhibici osteoklastů a také pro jeho nepřímý pozitivní vliv na kostní remodelaci prostřednictvím zvýšené endogenní sekrece inkretinů [9]. Klinický dopad tohoto působení byl zaznamenán v některých observačních studiích (např. Rochester cohort study), kde byl popsán mírný pokles osteoporotických fraktur. V jiných klinických pozorováních to prokázáno nebylo [16–18]. V prospektivní studii ADOPT bylo podávání metforminu provázeno nižším rizikem fraktur ve srovnání s léčbou rosiglitazonem [9,16]. Většina autorů přisuzuje metforminu neutrální, či mírně pozitivní efekt na kvalitu kostí diabetiků [16,17,19].
Deriváty sulfonylurey
Také deriváty sulfonylurey vedly in vitro u myších osteoblastů k jejich proliferaci a diferenciaci [16]. Zda se tento účinek uplatňuje i u lidí, není známo. Pozitivní působení může spočívat ve zvýšení endogenní produkce inzulinu a jeho anabolickém efektu. Na druhou stranu jsou deriváty sulfonylurey častou příčinou hypoglykemie, která může být spojena s vyšší frekvencí pádů. Většina studií (např. Rochester cohort study) přes pozitivní změny v ukazatelích kostního obratu (např. studie ADOPT) signifikantní ovlivnění rizika fraktur u diabetiků 2. typu neprokázala a je na ně tedy nahlíženo jako na léky s neutrálním vlivem na riziko osteoporotických fraktur [9,16–18]. Účinek glinidů na skelet diabetiků není znám [16].
Inzulin
Přestože inzulin má pozitivní metabolický vliv na osteoblasty, stimuluje jejich proliferaci i diferenciaci, zvyšuje syntézu kolagenu a jeho podávání je spojeno nárůstem BMD, bývá léčba inzulinem u diabetiků 2. typu zpravidla spojena s vyšším rizikem kostních fraktur [9,16–19]. Většina autorů vysvětluje tento fakt tím, že nemocní léčení inzulinem jsou většinou starší, trpí diabetem delší dobu, mají více diabetických komplikací a především jsou ve vyšším riziku hypoglykemie. Tyto faktory zřejmě přispívají k vyšší frekvenci pádů a podílejí se také na zhoršené kvalitě kosti [17,18]. Nepřímo o negativním vlivu hypoglykemie svědčí i výsledky studie ORIGIN, v níž byla nízká incidence hypoglykemických epizod provázena nezvýšeným rizikem kostních fraktur [19].
Tiazolidindiony
Tiazolidindiony (TZD) jsou zatím jedinými léky, jejichž negativní působení na skelet zmiňují i současná doporučení ADA/EASD pro léčbu diabetu 2. typu [20]. Aktivací PPAR-γ receptorů navodí diferenciaci kmenové mezenchymální buňky v kostní dřeni směrem k adipocytu místo k osteoblastu, čímž vedou ke snížení kostní tvorby a ke zvýšení adipozity kostí. Navíc dochází (přímým působením prostřednictvím PPAR-γ a nepřímo pomocí ovlivnění hladin některých hormonů a adipokinů) k aktivaci osteoklastů [9,16,18].
Je řada studií zabývající se vlivem TZD na ukazatele kostního obratu. Některé ukázaly pokles markerů kostní formace, jiné zvýšení markerů kostní resorpce, ale existují i studie, které nenalezly žádné změny v ukazatelích kostního obratu [9]. Výsledky vyšetření BMD většinou ukazují na její pokles při léčbě rosiglitazonem a pokles nebo žádné změny při podávání pioglitazonu [16]. První, která prokázala zvýšené riziko osteoporotických fraktur při léčbě TZD u žen s DM2T, byla studie ADOPT (A Diabetes Outcome Progression Trial) [17]. Také další klinická hodnocení (RECORD, ProACTIVE) potvrdila zvýšený výskyt fraktur u žen léčených TZD [16]. Ke stejným výsledkům došla i první větší metaanalýza, která zahrnula 10 randomizovaných a 2 observační studie (celkem 46 394 účastníků) [21]. Ženy měly na rozdíl od mužů (OR 1,00, 95% CI 0,73–1,39) signifikantně vyšší riziko fraktur (OR 2,23, 95% CI 1,65–3,01) a jejich BMD byla signifikantně nižší jak v oblasti bederní páteře, tak v oblasti kyčle. Přechodně se spekulovalo, zda je bezpečnější podávání pioglitazonu před rosiglitazonem [3,22]. To však vyvrátila recentní metaanalýza zahrnující 22 randomizovaných kontrolovaných klinických hodnocení (24 554 účastníků), která nalezla podobné riziko při léčbě rosiglitazonem (OR 2,01; 95% CI 1,61–2,51) i pioglitazonem (OR 1,73; 95% CI 1,18–2,55) [23]. Opět byl potvrzen zvýšený výskyt fraktur pouze u žen, které měly signifikantní pokles BMD v oblasti bederní páteře, krčku femoru i kyčle. Riziko fraktur nebylo závislé na věku žen [23]. Na druhou stranu data z retrospektivní studie zahrnující 84 339 diabetiků ukázala na zvýšené riziko fraktur nejen u žen, ale i u mužů léčených TZD. Toto riziko bylo závislé na délce podávání TZD a bylo dokonce více asociované s léčbou pioglitazonem než rosiglizatonem [24]. A další retrospektivní analýza 19 070 nemocných s DM2T nalezla vyšší riziko fraktur u žen starších 65 let ve srovnání s mladšími ženami, které se projevilo až po delším podávání TZD [25].
Lze tedy shrnout, že negativní účinek TZD na kost má charakter class efektu, uplatní se nejvíce u starších žen a zřejmě souvisí s délkou jejich podávání [17]. Preskripce TZD u postmenopauzálních žen se zjištěnou osteoporózou sice nepředstavuje absolutní kontraindikaci léčby, mělo by se však zvážit, zda riziko podávání TZD nepřevýší očekávaný benefit této terapie [19].
Inkretinová léčba
Od léčby, která zvyšuje působení inkretinů (glucagon-like peptidu – GLP), resp. glukózo-dependentního inzulinotropního peptidu (GIP) – se dá očekávat příznivé ovlivnění kvality kostí. Receptory pro GLP i GIP byly prokázány na osteoblastech i osteoklastech [17]. Zdá se, že přímý pozitivní vliv má GLP2, který inhibuje kostní resorpci, a GIP, který kromě suprese osteoklastů působí i anabolickým efektem na osteoblasty a brání jejich apoptóze [9,17,26]. Zatímco GLP1 vede k inhibici kostní resorpce spíše nepřímo pomocí zvýšené produkce kalcitoninu v parafolikulárních C buňkách štítné žlázy [16,17]. Někteří však popisují i jeho přímý efekt na osteoblasty, které stimuluje pomocí jiných receptorů, než jsou receptory přítomné v pankreatu [15,17,26]. Zvýšeného inkretinového efektu lze dosáhnout podáváním inhibitorů dipeptidyldipeptidázy 4 (DPP4), tzn. gliptinů anebo agonistů GLP1 receptorů.
Gliptiny inhibicí DPP4, která inkretiny rozkládá, prodlužují biologický poločas a zvyšují jejich plazmatické koncentrace. Může se tedy po delší dobu uplatnit jejich účinek, včetně pozitivního ovlivnění skeletu. Dosavadní studie zatím neprokázaly větší vliv DPP4 inhibitorů na kostní metabolizmus diabetiků [27,28]. Proto byly poněkud překvapivé výsledky metaanalýzy 28 studií (v nichž 11 880 pacientů užívalo DPP4 inhibitory a 9 175 pacientů užívalo komparátor), která zjistila 40% redukci rizika fraktur (Mantel-Haenszel odds ratio – MH-OR 0,60, 95% CI 0,37–0,99) při jejich podávání [29]. Tato analýza je mnohými kritizovaná, protože zahrnula i studie s krátkou dobou trvání (v průměru byli nemocní sledovaní 35 týdnů), během níž se efekt na skelet ještě nemohl projevit. Bylo také zaznamenáno jen 63 zlomenin, které byly reportované jako vážný nežádoucí účinek, což mohlo vést k podhodnocení jejich počtu. Retrospektivní studie zahrnující > 215 000 diabetických pacientů neprokázala u nemocných, kteří byli léčeni GLP1 agonisty, signifikantní rozdíl v riziku kostních fraktur ve srovnání s nediabetiky (adjustované hazard ratio – HR 0,89, 95% CI 0,71–1,13), i ve srovnání s diabetiky léčenými jinými léky (HR 1,03, 95% CI 0,92–1,15) [30]. Nebyl také prokázán vztah rizika fraktury k denní, či kumulativní dávce anebo typu DPP4 inhibitoru. Ani v delší kardiovaskulárně zaměřené studii se saxagliptinem (SAVOR-TIMI53, průměrná doba sledování 2,1 roku) nebyl zaznamenán rozdíl ve výskytu zlomenin mezi léčenou a placebovou skupinou (2,9 % vs. 2,9 %) [31]. DPP4 inhibitory mají tedy neutrální, či zřejmě pozitivní efekt na výskyt kostních fraktur diabetiků.
GLP1 agonisté díky rezistenci vůči působení DPP4 nebo pomalejšímu subkutánnímu vstřebávání mohou delší dobu stimulovat GLP1 receptory a realizovat tak jeho pozitivní metabolické účinky. Zatím však nebylo zaznamenáno, že by podávání GLP1 agonistů vedlo k nárůstu BMD [32,33]. V metaanalýze 7 studií (4 229 pacientů) nesnížilo podávání GLP1 agonistů (exenatidu či liraglutidu) riziko kostních fraktur (MH OR 0,75, 95% CI 0,28–2,02) [34]. A také retrospektivní sledování více než 215 000 diabetiků bylo spojeno s nálezem stejného rizika kostních fraktur u nemocných léčených GLP1 agonisty (exenatid nebo liraglutid) jako u těch, kteří je nebrali (HR 0,99, 95% CI 0,82–1,19), a nebyl prokázán vztah mezi jejich dávkou a výskytem fraktury [35]. Zajímavé jsou výsledky větší metaanalýzy 16 studií (11 206 účastníků), která celkově také neprokázala změnu rizika při léčbě GLP1 agonisty (MH OR 1,05, 95% CI 0,59–1,87) [36]. Nicméně při rozlišení podle typu agonisty bylo zjištěno, že podávání liraglutidu vedlo k signifikantnímu snížení (MH OR 0,38, 95% CI 0,17–0,87), zatímco podávání exenatidu k signifikantnímu zvýšení (MH OR 2,09, 95% CI 1,03–4,21) kostních fraktur. Tyto rozdíly autoři vysvětlují větší homologií liraglutidu s GLP1 (97% zastoupení stejných aminokyselin, ve srovnání s 54% homologií u exenatidu), což může být spojeno s menší tvorbou autoprotilátek, a také jeho delším biologickým poločasem. Nicméně sami přiznávají, že jde o důvody víceméně spekulativní. O vlivu ostatních GLP1 agonistů (lixisenatidu, albiglutidu, taspoglutidu a dulaglutidu) na kost nejsou zatím žádné informace. Ve studii ELIXA s lixisenatidem se můžeme jen dočíst, že v léčené i neléčené větvi bylo stejné množství muskuloskeletárních příhod [37].
Glifloziny
Selektivní inhibitory renálního kotransportéru 2 pro sodík a glukózu (SGLT2) mohou negativně ovlivnit kostní metabolizmus. Svým tubulárním účinkem zřejmě zvyšují reabsorpci fosfátů, což může vést k jejich zvýšené sérové koncentraci a stimulací příštítných tělísek ke zvýšené sekreci parathormonu (PTH). Tímto způsobem může dojít také ke zvýšené produkci fibroblastového růstového faktoru 23 (FGF-23) v kostech, což má negativní vliv na hladiny 1,25-dihydroxyvitaminu D [38]. Dále se mohou uplatnit chronické ztráty natria močí, které jsou provázeny ztrátami kalcia. Chronická hyponatremie vede také zatím nejasným mechanizmem ke zvýšené aktivitě osteoklastů [39].
V kontrastu s tím první studie na zvířecích modelech prokázaly trabekulární hyperostózu a zvýšení BMD u hlodavců, kterým byl podáván dapagliflozin. Ipragliflozin naopak nevedl k změně BMD [9,39]. U lidí však existují studie potvrzující spíše negativní účinek SGLT2 inhibitorů. Podávání kanagliflozinu bylo spojeno s asi 30% navýšením rizika všech fraktur během 3. fáze klinického hodnocení [40]. Specifickým nálezem byl vyšší výskyt zlomenin horních končetin a obratlů. Roční léčba 300 mg kanagliflozinu byla provázena také signifikantním poklesem BMD v oblasti bederní páteře i kyčle a zvýšením markerů kostního obratu. Patrný rozdíl v incidenci fraktur při podávání kanagliflozinu v denní dávce 300 mg (4,2 %) a 100 mg (2,9 %) byl ve srovnání s placebem (2,1 %) i během 2letého sledování [41]. Také 2letá léčba dapagliflozinem u nemocných se středně významnou renální insuficiencí vedla k vyššímu počtu fraktur ve skupině léčené 10 mg (9,4 %) i ve skupině léčené 5 mg (6,0 %) v kontrastu s léčbou placebem (0 %) [42]. U jedinců s normální funkcí ledvin to pozorováno nebylo [43]. V téměř 4leté studii s empagliflozinem (EMPA-REG OUTCOME) byla incidence fraktur v léčených větvích (denní dávky 10 mg a 25 mg) a větvi placebové v podstatě stejná (3,9 %, 3,7 %, resp. 3,9 %) [44]. Kromě efektu dávky gliflozinů by mohla hrát roli i jejich selektivita k SGLT2 receptoru vůči SGLT1 (u kanagliflozinu > 250násobná, u dapagliflozinu > 1 200násobná a u empagliflozinu > 2 500násobná) [38,45]. Na základě výše uvedených dat vydala FDA v loňském roce varování o zvýšeném riziku fraktur u kanagliflozinu a přidala do informace o léčivu údaje o snížené hustotě kostních minerálů. U dalších gliflozinů (empagliflozinu a dapagliflozinu) pokračuje další sběr a vyhodnocování informací [43].
Závěr
DM2T je i přes normální či vyšší kostní hmotu spojen s vyšším rizikem osteoporotických fraktur. Na patofyziologii kostní nemoci diabetiků se může podílet řada faktorů zhoršující kvalitu kosti. Důležité je také jejich velké riziko pádů a vliv může mít i antidiabetická léčba. Odborné společnosti doposud varují pouze před tiazolidindiony, které zvyšují riziko osteoporotických fraktur především u starších žen. Je však nadále nutné monitorovat dlouhodobou bezpečnost i dalších antidiabetik, zejména gliflozinů. V případě pacientů s vysokým rizikem kostních fraktur bychom měli volit ta antidiabetika, u nichž není negativní vliv na skelet diabetiků dokumentován (schéma).
Schéma. Vliv antidiabetické léčby na riziko kostních fraktur 
Podpořeno grantem IGA_LF_2016_014 a MZ ČR – RVO (FNOL, 00098892).
doc. MUDr. David Karásek, Ph.D.
david.karasek@fnol.cz
II. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc
www.fnol.cz
Doručeno do redakce 26. 6. 2016
Přijato po recenzi 15. 7. 2016
Zdroje
1. Činnost oboru diabetologie, péče o diabetiky v roce 2013. UZIS: Praha 2015; 2. Dostupné z WWW: <http://www.uzis.cz/rychle-informace/cinnost-oboru-diabetologie-pece-diabetiky-roce-2013>.
2. Palička V, Blahoš J, Býma S. [Centrum doporučených postupů pro praktické lékaře]. Osteoporóza – doporučený diagnostický a léčebný postup pro všeobecné praktické lékaře 2011. Společnost všeobecného lékařství ČLS JEP: Praha 2011. ISBN 978–80–86998–44–2.
3. Palička V, Lesná J, Pavlíková L. Změny kostního metabolizmu u diabetiků. Vnitř Lék 2014; 60(9): 742–745.
4. FRAX® WHO Fracture Risk AssessmentTool. Calculation Tool. Dostupné z WWW: <http://www.shef.ac.uk/FRAX/tool.jsp?locationValue=9>.
5. Vestergaard P. Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes – a meta-analysis. Osteoporos Int 2007; 18(4): 427–444.
6. Janghorbani M, Van Dam RM, Willett WC et al. Systematic review of type 1 and type 2 diabetes mellitus and risk of fracture. Am J Epidemiol 2007; 166(5): 495–505.
7. Reid IR. Relationships among body mass, its components, and bone. Bone 2002; 31 : 547–555.
8. Kawai M, de Paula FJ, Rosen CJ New insights into osteoporosis: the bone-fat connection. J Intern Med 2012; 272(4): 317–329.
9. Gilbert MP, Pratley RE. The impact of diabetes and diabetes medications on bone health. Endocr Rev 2015; 36(2): 194–213.
10. Maurer MS, Burcham J, Cheng H. Diabetes mellitus is associated with an increased risk of falls in elderly residents of a long-term care facility. J Gerontol A Biol Sci Med Sci 2005; 60(9): 1157–1162.
11. Yamamoto M. Insights into bone fragility in diabetes: the crucial role of bone quality on skeletal strength. Endocr J 2015; 62(4): 299–308.
12. Bolland MJ, Grey A, Gamble GD et al. Vitamin D supplementation and falls: a trial sequential meta-analysis. Lancet Diabetes Endocrinol 2014; 2(7): 573–580.
13. Burghardt AJ, Issever AS, Schwartz AV et al. High-resolution peripheral quantitative computed tomographic imaging of cortical and trabecular bone microarchitecture in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab 2010; 95(11): 5045–5555.
14. Neumann E, Junker S, Schett G et al. Adipokines in bone disease. Nat Rev Rheumatol 2016; 12(5): 296–302.
15. Montagnani A, Gonnelli S, Alessandri M et al. Osteoporosis and risk of fracture in patients with diabetes: an update. Aging Clin Exp Res 2011; 23(2): 84–90.
16. Maalouf NM. Impact of Anti-hyperglycemic Medications on Bone Health. Clinic Rev Bone Miner Metab 2015; 13(1): 43–52.
17. Lecka-Czernik B. Safety of Antidiabetic Therapies on Bone. Clinic Rev Bone Miner Metab 2013; 11(1): 49–58.
18. Gray A. Diabetes Medications and Bone. Curr Osteoporos Rep 2015; 13(1): 35–40.
19. Mannucci E, Dicembrini I. Drugs for type 2 diabetes: role in the regulation of bone metabolism. Clin Cases Miner Bone Metab 2015; 12(2): 130–134.
20. Inzucchi SE, Bergenstal RM, Buse JB et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2015; 38(1): 140–149.
21. Loke YK, Singh S, Furberg CD. Long-term use of thiazolidinediones and fractures in type 2 diabetes: a meta-analysis. CMAJ 2009; 180(1): 32–39.
22. Toulis KA, Goulis DG, Anastasilakis AD. Thiazolidinedione use and the risk of fractures. CMAJ 2009; 180(8): 841–842.
23. Zhu ZN, Jiang YF, Ding T. Risk of fracture with thiazolidinediones: an updated meta-analysis of randomized clinical trials. Bone 2014; 68 : 115–123. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2014.08.010>.
24. Dormuth CR, Carney G, Carleton B et al. Thiazolidinediones and fractures in men and women. Arch Intern Med 2009; 169(15): 1395–1402.
25. Habib ZA, Havstad SL, Wells K et al. Thiazolidinedione use and the longitudinal risk of fractures in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab 2010; 95(2): 592–600.
26. Ceccarelli E, Guarino EG, Merlotti D et al. Beyond glycemic control in diabetes mellitus: effects of incretin-based therapies on bone metabolism. Front Endocrinol (Lausanne) 2013; 4 : 73. Dostupné z DOI: <http://dx.doi.org/10.3389/fendo.2013.00073>.
27. Hegazy SK. Evaluation of the anti-osteoporotic effects of metformin and sitagliptin in postmenopausal diabetic women. J Bone Miner Metab 2015; 33(2): 207–212.
28. Bunck MC, Poelma M, Eekhoff EM et al. Effects of vildagliptin on postprandial markers of bone resorption and calcium homeostasis in recently diagnosed, well-controlled type 2 diabetes patients. J Diabetes 2012; 4(2): 181–185.
29. Monami M, Dicembrini I, Antenore A et al. Dipeptidyl peptidase-4 inhibitors and bone fractures: a meta-analysis of randomized clinical trials. Diabetes Care 2011; 34(11): 2474–2476. Erratum in: Diabetes Care 2014; 37(1): 312.
30. Driessen JH, van Onzenoort HA, Henry RM et al. Use of dipeptidyl peptidase-4 inhibitors for type 2 diabetes mellitus and risk of fracture. Bone 2014; 68 : 124–130. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2014.07.030>.
31. Scirica BM, Bhatt DL, Braunwald E et al. SAVOR-TIMI 53 Steering Committee and Investigators. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013; 369(14): 1317–1326.
32. Bunck MC, Eliasson B, Cornér A et al. Exenatide treatment did not affect bone mineral density despite body weight reduction in patients with type 2 diabetes. Diabetes Obes Metab 2011; 13(4): 374–377.
33. Gilbert MP, Marre M, Holst JJ et al. Comparison of the long-term effects of liraglutide and glimepiride monotherapy on bone mineral density in patients with type 2 diabetes. Endocr Pract 2016; 22(4): 406–411.
34. Mabilleau G, Mieczkowska A, Chappard D. Use of glucagon-like peptide-1 receptor agonists and bone fractures: a meta-analysis of randomized clinical trials. J Diabetes 2014; 6(3): 260–266.
35. Driessen JH, Henry RM, van Onzenoort HA et al. Bone fracture risk is not associated with the use of glucagon-like peptide-1 receptor agonists: a population-based cohort analysis. Calcif Tissue Int 2015; 97(2): 104–112.
36. Su B, Sheng H, Zhang M et al. Risk of bone fractures associated with glucagon-like peptide-1 receptor agonists’ treatment: a meta-analysis of randomized controlled trials. Endocrine 2015; 48(1): 107–115.
37. Pfeffer MA, Claggett B, Diaz R et al. [ELIXA Investigators]. Lixisenatide in Patients with Type 2 Diabetes and Acute Coronary Syndrome. N Engl J Med 2015; 373(23): 2247–2257.
38. Taylor SI, Blau JE, Rother KI. Possible adverse effects of SGLT2 inhibitors on bone. Lancet Diabetes Endocrinol 2015; 3(1): 8–10.
39. Mabilleau G, Chappard D, Flatt PR et al. Effects of anti-diabetic drugs on bone metabolism. Expert Rev Endocrinol Metab 2015; 10(6): 663–675.
40. Canagliflozin: Clinical Efficacy and Safety Endocrinologic and Metabolic Drugs Advisory Committee Meeting January 10, 2013. Dostupné z WWW: <http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/EndocrinologicandMetabolicDrugsAdvisoryCommittee/UCM336234.pdf>.
41. Bode B, Stenlöf K, Harris S et al. Long-term efficacy and safety of canagliflozin over 104 weeks in patients aged 55–80 years with type 2 diabetes. Diabetes Obes Metab 2015; 17(3): 294–303.
42. Kohan DE, Fioretto P, Tang W et al. Long-term study of patients with type 2 diabetes and moderate renal impairment shows that dapagliflozin reduces weight and blood pressure but does not improve glycemic control. Kidney Int 2014; 85(4): 962–971.
43. FDA Drug Safety Communication: FDA revises label of diabetes drug canagliflozin (Invokana, Invokamet) to include updates on bone fracture risk and new information on decreased bone mineral density. Dostupné z WWW: <http://www.fda.gov/Drugs/DrugSafety/ucm461449.htm>.
44. Zinman B, Wanner C, Lachin JM et al. EMPA-REG OUTCOME Investigators. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015; 373 : 2117–2128.
45. Scheen AJ. Pharmacokinetic and pharmacodynamic profile of empagliflozin, a sodium glucose co-transporter 2 inhibitor. Clin Pharmacokinet 2014; 53(3): 213–225.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 7-8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Milan Kvapil slaví 60!
- Pozdrav jubilantovi prof. MUDr. Milanovi Kvapilovi, CSc.
- Určení prevalence potenciálních lékových interakcí u pacientů léčených 5 a více léčivými přípravky v České a Slovenské republice
-
Autoimunitná inzulítída u pacientov s diabetes mellitus 2. typu.
Randomizovaný klinický prieskum u hospitalizovaných pacientov. - Klinický přínos nových bazálních analog inzulinu
- Posuny v nutričních doporučeních pro zdravé obyvatelstvo a jejich dopad pro diabetickou dietu
- Syndrom porušeného vnímání hypoglykemie u diabetes mellitus
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Vliv antidiabetické léčby na skelet nemocných s diabetes mellitus 2. typu
- Přínos urgentně provedené endoskopické retrográdní cholangiopankreatografie pro terapii akutní pankreatitidy
- Diabetes mellitus 2. typu a srdeční selhání
- Diferenciální diagnostika pleurálních výpotků
- Nežádoucí účinky biologické léčby v revmatologii
-
Možnosti ovlivnění kardiovaskulárního rizika u diabetes mellitus 2. typu antidiabetickou léčbou
Snížení kardiovaskulárního rizika při léčbě liraglutidem – výsledky studie LEADER - Metanol: hrozba intoxikace je stále aktuální
- Diabetická retinopatie: patogeneze a terapeutické implikace
- Diference a poměr sérových koncentrací natria a chloridů u pacientů s hyponatremií
- Cílové hodnoty systolického krevního tlaku
- Klinický význam natriuretických peptidů v diferenciální diagnostice dušnosti
- Srdeční selhání se zachovanou ejekční frakcí
- Blízká budoucnost léčby dyslipidemie u diabetiků 2. typu
- Antagonisté glukagonu otevírají novou cestu v léčbě diabetu 2. typu
- Breviár edukácie diabetika pre internistu
- Prevence a terapie sarkopenie ve stáří
- Granulomatóza s polyangiitidou manifestující se jako diabetes insipidus
-
Kateřina Štěchová (ed), Eva Kravarová, Milan Kvapil, Lenka Lhotská, Pavlína Piťhová, Šárka Slabá.
Technologie v diabetologii -
Jozef Kollár.
Aterotrombóza – patofyziológia a epidemiológia -
Vratislav Sedlák, Petr Vaník.
Ultrazvuk hrudníku v klinické praxi
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Prevence a terapie sarkopenie ve stáří
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



