-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Krátkodobá a dlouhodobá glykemická variabilita a její vztah k mikrovaskulárním komplikacím diabetu
Short-term and long-term glycemic variability and its relationship to microvascular complications of diabetes
Vascular complications of diabetes result from long lasting unsatisfactory glycemic control. We usually assess glycemic control based on the value of glycated hemoglobin HbA1c. The glycated hemoglobin test, however, says nothing about short-term glycemic fluctuations. Recently, continuous monitoring of glycemia has enabled us an in-depth assessment of changes in glucose concentrations, called glycemic variability. In connection with the research into short-term glycemic variability, also the study of long-term fluctuations in glycemic control based on HbA1c variability has now intensified. Glycemic variability may be related to oxidation stress, endothelial dysfunction and inflammation, the factors traditionally associated with vascular damage. Several studies have described the relation of glycemic variability to macrovascular complications of diabetes, still its relation to microvascular complications remains unclear. This overview summarizes the recent findings in the field of glycemic variability and its possible association with retinopathy, nephropathy and neuropathy.
Key words:
type 1 and 2 diabetes mellitus – glycemic variability – microvascular complications – HbA1c – variability
Autoři: Martin Prázný; Jan Škrha; Jan Šoupal; Jan Škrha Jr
Působiště autorů: III. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Vnitř Lék 2016; 62(Suppl 4): 85-93
Kategorie: Přehledné referáty
Souhrn
Cévní komplikace diabetu jsou následkem dlouhodobě neuspokojivé kompenzace diabetu. Kompenzaci diabetu obvykle hodnotíme podle hodnoty glykovaného hemoglobinu HbA1c. Glykovaný hemoglobin však nevypovídá nic o krátkodobém kolísání glykemie. V poslední době máme díky kontinuální monitoraci glykemie možnost podrobně hodnotit změny v koncentraci glukózy, tzv. glykemickou variabilitu. V souvislosti s výzkumem krátkodobé glykemické variability je nyní více zkoumáno i dlouhodobé kolísání kompenzace diabetu podle variability HbA1c. Glykemická variabilita může mít vztah k oxidačnímu stresu, endotelové dysfunkci a zánětu, což jsou faktory, které jsou tradičně spojovány s cévním poškozením. V několika studiích byl popsán vztah glykemické variability k makrovaskulárním komplikacím diabetu, nicméně vztah k mikrovaskulárním komplikacím zůstává nejasný. Tento přehledný článek shrnuje nedávné poznatky na poli glykemické variability a jejího možného vztahu k retinopatii, nefropatii a neuropatii.
Klíčová slova:
diabetes mellitus 1. a 2. typu – glykemická variabilita – mikrovaskulární komplikace – variabilita HbA1cÚvod
Diabetes je spojován s cévním poškozením, které vede k selhání orgánů a předčasné smrti. Obrovský dopad komplikací diabetu spustil rozsáhlý výzkum, který se v posledních letech významně zrychlil s tím, jak narůstá epidemie diabetu. Mikrovaskulární i makrovaskulární komplikace vznikají následkem metabolických změn způsobených hyperglykemií. Nedávná analýza studie DCCT/EDIC potvrdila, že lepší krátkodobá a dlouhodobá kompenzace diabetu je spojena s nižším výskytem mikrovaskulárních komplikací [1].
Průměrná glykemie odhadovaná podle hodnoty HbA1c je v současnosti hlavním parametrem, podle kterého hodnotíme kompenzaci diabetes mellitus (DM) a rovněž ho používáme k odhadu rizika diabetických komplikací. Tento přístup zaměřený na HbA1c se podílel na designu řady studií, které měly za cíl agresivní léčbu diabetu – např. VADT a ACCORD. Tyto studie však ukázaly limitace HbA1c při hodnocení kompenzace diabetu a odhalily, že hypoglykemie mohou mít silně negativní efekt u pacientů s kardiovaskulárními komplikacemi, přičemž tento kritický dopad hypoglykemií byl do té doby podceňován. Zavedení kontinuální monitorace glukózy do klinické praxe přináší nové pohledy na hodnocení kompenzace diabetu a ukazuje, že musíme jít patrně daleko za rámec možností nyní běžně používaných glukometrů a HbA1c. Glykemická variabilita se ukazuje být důležitým dynamickým parametrem kompenzace diabetu, ačkoliv ještě nevíme, do jaké míry klinicky významným. Následující přehled shrnuje výsledky publikací z posledních 2 let, které hodnotily glykemickou variabilitu ve vztahu k mikrovaskulárním komplikacím. Shrnutí týkající se komplikací makrovaskulárních je publikováno jinde [2].
Patogeneze cévních komplikací ve vztahu ke glykemické variabilitě
Vysoká koncentrace glukózy vede k aktivaci oxidačního stresu. V mitochondriích dochází ke zvýšené produkci superoxidového radikálu [3]. Navíc mohou ještě přechodně zvýšené koncentrace glukózy jako následek zvýšeného oxidačního stresu způsobovat epigenetické změny (schéma) [4].
Schéma. Schéma patogenního vlivu glykemické variability na mikrovaskulární poškození 
Centrální úloha oxidačního stresu při rozvoji poškození endotelu byla nedávno hodnocena v přehledném článku Salisbury et al [5]. Endotelová dysfunkce je následkem oxidačního stresu vyvolaného vysokou intracelulární koncentrací glukózy [6,7]. Navíc nad rámec prosté setrvalé hyperglykemie se může na rozvoji endotelové dysfunkce podílet ještě kolísání glykemie [8], a to jak v mikrovaskulárním, tak i makrovaskulárním řečišti [9]. Oscilující hodnoty glukózy indukují vyšší oxidační zátěž a způsobují větší poškození endotelu než pouze setrvalá hyperglykemie [10,11] a ovlivňuje expresi celé řady proteinů [62].
Je zajímavé, že hypoglykemie může mít dokonce silnější vliv na dysfunkci endotelu než variabilní glykemie bez hypoglykemií [12]. Experimentálně navozená hypoglykemie po dobu 2 hodin zvýšila produkci oxidačního stresu a zhoršila endotelovou funkci a toto zhoršení bylo ještě větší, když hypoglykemie následovala po hyperglykemii [13].
Kombinace lipotoxicity a glukotoxicity vedla ke zvýšené redukci reaktivních forem kyslíku v mitochondriích a k dalšímu zhoršení funkce endotelu [14]. Tento nález je klinicky zajímavý a důležitý u pacientů s DM 2. typu (DM2T), u nichž běžně nacházíme vyšší koncentraci volných mastných kyselin. Ty se navíc podílejí i na rozvoji makrovaskulárních komplikací.
Glykemická variabilita má tedy patrně významný přídavný efekt nad rámec působení setrvale vysoké průměrné glykemie, protože vede k vyšší oxidační zátěži organizmu. Je považována za klíčový faktor v rozvoji endotelové dysfunkce a následných morfologických změn cévní stěny. Následně se otevírá otázka, zdali je glykemická variabilita také nezávislým rizikovým faktorem pro rozvoj mikrovaskulárních komplikací.
Ukazatele pro hodnocení glykemické variability
Pro hodnocení dlouhodobé variability glykemie je v současnosti nejlepším parametrem HbA1c. Směrodatná odchylka (standard deviation – SD) nebo variační koeficient (coefficient of variation – CV) určují míru kolísání dlouhodobé kompenzace diabetu, ať už se jedná o sezónní nebo mimosezónní oscilace. Vztah variability HbA1c k cévním komplikacím u pacientů s diabetem byl zkoumán v několika studiích a vyšší dlouhodobá variabilita kompenzace DM byla nalezena u pacientů s progredující aterosklerózou, retinopatií nebo nefropatií [15–17].
K hodnocení krátkodobé glykemické variability (GV) lze užít celou řadu parametrů. Při jejich výběru je nutné zohlednit i zdroj dat a informační význam, který poskytují. Některé parametry (např. MAGE a CONGA) jsou přímo koncipovány pro použití s daty získanými pomocí kontinuální monitorace glukózy (continual glucose monitoring – CGM) [18,19]. Vztah mezi jednotlivými ukazateli glykemické variability (GV) kalkulovaných z hodnot CGM byl nedávno analyzován u pacientů s DM1T i DM2T a byla nalezena silná korelace mezi SD glukózy a hypoglykemií, což poukazuje na užitečnost hodnocení směrodatné odchylky v klinické praxi [20]. Každý z použitých parametrů hodnocení krátkodobé GV však má své výhody i nevýhody. SD a CV, příp. MAGE (Mean Amplitude of Glycemic Excursions) jsou opakovaně používány v klinických studiích, přičemž SD a CV přináší pro běžnou klinickou praxi srozumitelnější informaci, a navíc jsou to parametry, které lze jednoduše implementovat i do běžných glukometrů. Z klinického hlediska je důležité, že vysoká SD a CV spolu s nízkou průměrnou glykemií naznačují vysoké riziko výskytu hypoglykemií. Přehledné články z nedávné doby hodnotící parametry GV lze nalézt zde [18,21].
Kromě matematických parametrů, které charakterizují variabilitu glykemie, můžeme použít i laboratorní parametry jako fruktosamin, glykovaný sérový albumin a 1,5-anhydroglucitol [18]. Nízká koncentrace 1,5-anhydroglucitolu je spojena s výskytem retinopatie, a také s více než 3násobným zvýšením rizika chronického onemocnění ledvin [22]. Mezi koncentrací 1,5-anhydroglucitolu a GV byl popsán inverzní vztah.
Současná data ukazují, že parametry krátkodobé i dlouhodobé GV je nutno dále zkoumat a že tyto parametry mohou být důležité pro výběr optimální léčebné strategie a také pro posouzení rizika chronických komplikací diabetu.
Glykemická variabilita a hypoglykemie
Vysoká GV zvyšuje riziko hypoglykemie zvláště tehdy, je-li průměrná glykemie blízko normálu či v normě. Hypoglykemie stimuluje oxidační stres [23,24], endotelovou dysfunkci [13,25] a zánětlivé reakce [23], které jsou spojovány s rozvojem mikroangiopatie. Pokud je vynikající kompenzace diabetu (vyjádřená hodnotou HbA1c blížící se normě) spojena s vysokou GV, může být pro pacienta nebezpečná z hlediska hypoglykemie. Riziko nespočívá jen v akutních následcích hypoglykemických epizod, ale také na indukci patogenetických mechanizmů, které mohou vést k cévním komplikacím. Hypoglykemie je např. u pacientů s DM1T významně spojená s poruchou variability srdečního rytmu, a to i u pacientů bez kardiovaskulárního onemocnění [26]. Zvýšená glykemická variabilita může být také spojena s autonomní kardiovaskulární neuropatií a opakované hypoglykemické příhody představují důležitý faktor ukazující na zvýšené riziko kardiovaskulárních příhod. V běžné klinické praxi by proto mělo být riziko hypoglykemií posouzeno jako další parametr kompenzace diabetu a v případě, že je vysoké, by se mělo zároveň neodkladně stát i terapeutickým cílem [27,28].
Ačkoliv jsou publikovány práce, které ukazují škodlivý vliv hypoglykemie na kardiovaskulární příhody a jsou také navrženy patogenetické mechanizmy, které vedou k chronickému postižení cév, přímý klinický důkaz, že opakované hypoglykemie způsobují mikrovaskulární komplikace, zatím předložen nebyl.
Významnou terapeutickou výzvu představuje postprandiální hyperglykemie. Názory na postprandiální glykemické fluktuace se různí. Jejich možný podíl na rozvoji chronických komplikací diabetu diskutoval nedávno v článku Ceriello et al [29]. Různé úhly pohledu na GV a další parametry hodnotící riziko komplikací diabetu byly nedávno diskutovány ve 2 publikacích [27,30]. Oba články shodně zmiňují spojení zvýšeného rizika hypoglykemie při zvýšené GV, což má dopad i na oblast klinické praxe a může přispět ke změně dosavadního chápání kompenzace diabetu.
V současné době se ukazuje, že relativně velká část pacientů umírá na následky hypoglykemií [31], a přitom některé studie naznačují, že pokles GV může vést i k poklesu výskytu hypoglykemií [32]. Proto může být rozumné zahrnout krátkodobou glykemickou variabilitu mezi další terapeutické cíle (spolu s rutinně zavedenou glykemií a HbA1c) při běžné péči o pacienty s DM, a to i z toho důvodu, že vysoká glykemická variabilita prakticky znemožňuje dosáhnout optimálního cílového pásma glykemie [33].
Klinická data
Experimentální a klinická data jasně potvrzují spojení mezi hyperglykemií a endotelovou dysfunkcí, která je považována za první krok k rozvoji chronických cévních komplikací. Význam glykemické variability v procesu rozvoje komplikací diabetu je v současnosti předmětem výzkumu. Výsledky tohoto výzkumu se však u pacientů s DM1T a DM2T liší a stejně tak jsou prezentována různá data při výzkumu dlouhodobé variability glykemie (HbA1c) a krátkodobé glykemické variability [34]. Proto jsou tyto výsledky diskutovány zvlášť pro krátkodobou a dlouhodobou GV a také pro DM1T a DM2T. Přehled diskutovaných publikací je uveden v tabulce.
Tab. 1. Publikace potvrzující možný význam krátkodobé a dlouhodobé glykemické variability na rozvoj cévních komplikací 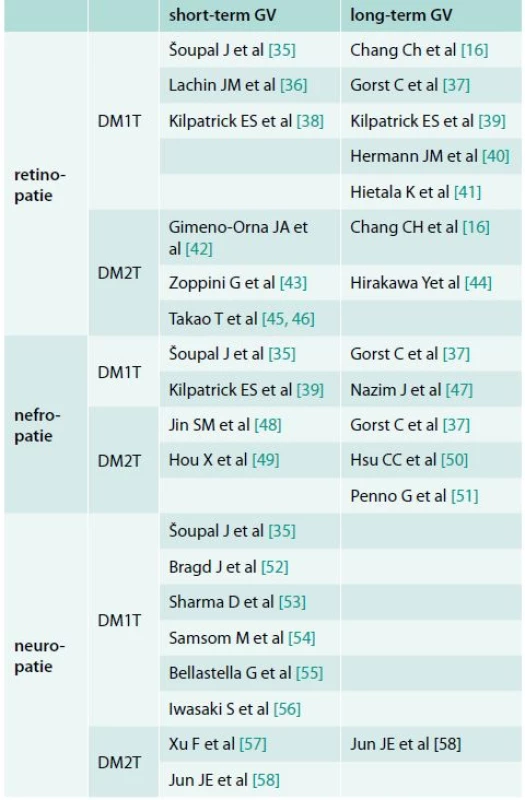
Dlouhodobá glykemická variabilita (variabilita HbA1c)
Nedávno byla publikována metaanalýza, která hodnotila vliv dlouhodobé GV na retinopatii, nefropatii, makrovaskulární příhody a mortalitu [37]. Sedm studií u pacientů s DM1T ukázalo asociaci variability HbA1c s progresí renálního postižení (RR 1,56, 95% CI 1,08–2,25), retinopatií (RR 2,11, CI 1,54–2,89) a kardiovaskulárními příhodami (RR 1,98, CI 1,39–2,82). Analýza 13 studií u pacientů s DM2T [37] ukázala, že variabilita HbA1c je spojená s vyšším výskytem jak renálního postižení (RR 1,34, CI 1,15–1,57), tak i makrovaskulárních příhod (RR 1,21, CI 1,06–1,38).
Podobný vztah (p = 0,02) byl nalezen mezi dlouhodobou GV a makrovaskulárními komplikacemi u pacientů s DM2T ve studii ADVANCE [44], zatímco pro krátkodobou GV byl ve stejné studii nalezen vztah s mikrovaskulárními i makrovaskulárními komplikacemi (p = 0,005).
Diabetická retinopatie a dlouhodobá GV
Diabetes mellitus 1. typu
U pacientů s DM1T ve studii DCCT Kilpatrick et al [39] nalezli významné zvýšení rizika retinopatie nejen s vyšší průměrnou hodnotou HbA1c, ale také s jeho vyšší variabilitou. Pro každé zvýšení směrodatné odchylky HbA1c o jedno absolutní procento poměr rizika pro vývoj a progresi retinopatie stoupl o více než 100 % (HR 2,26 pro každé absolutní % vzestupu SD HbA1c (95% CI 1,63–3,14, p < 0,0001). Velká německo-rakouská multicentrická analýza u 35 891 pacientů ukázala, že variabilita HbA1c je rizikovým faktorem pro diabetickou retinopatii nezávisle na průměrné kompenzaci diabetu [40]. Hietala et al publikovali data ukazující, že riziko rozvoje diabetické retinopatie do stadia, kdy je nutné její laserové ošetření, závisí na variabilitě HbA1c [41]. Ve studii v FinnDiane autoři zjistili, že 5letá kumulativní incidence laserového ošetření byla 19 % v nejvyšším kvartilu dlouhodobé GV, zatímco v nejnižším kvartilu činila jen 10 %, což představuje poměr rizik HR 1,6 (p = 0,02). Podobně měli pacienti v nejvyšším kvartilu dlouhodobé GV zvýšené riziko proliferativní retinopatie ve srovnání s pacienty s nízkou dlouhodobou GV (HR 1,7, p < 0,001).
Diabetes mellitus 2. typu
U pacientů s DM2T jsme nenalezli další publikace ukazující na možné spojení mezi dlouhodobou GV a retinopatií kromě již zmiňované studie ADVANCE [44]. V té byla popsána pouze významná lineární závislost SD HbA1c s kombinovanými mikrovaskulárními a makrovaskulárními příhodami, což jakékoliv hodnocení asociace dlouhodobé GV a retinopatie velmi komplikuje.
Diabetická nefropatie a dlouhodobá GV
Diabetes mellitus 1. typu
Podobně jako u retinopatie byl ve studii DCCT popsán také významně vyšší výskyt nefropatie se stoupající variabilitou HbA1c. Pro každé zvýšení SD HbA1c o jedno absolutní procento riziko nefropatie stoupá o 80 % (HR 1,80, 95% CI 1,37–2,42, p < 0,0001) [39]. U dětských pacientů s DM1T byl v prospektivní studii o délce trvání 9 let nalezen významný vztah mezi rozvojem albuminurie a neuspokojivou a variabilním kompenzací DM hodnocenou podle variačního koeficientu HbA1c [47].
Diabetes mellitus 2. typu
U pacientů s DM2T byla v prospektivní studii trvající 6,2 roku a zahrnující 821 pacientů nalezena progredující albuminurie u pacientů s vyšší dlouhodobou GV [50]. SD HbA1c byla nezávislým rizikovým faktorem spojeným s rozvojem albuminurie již po 2 letech sledování.
Ve velké kohortě pacientů v průřezové studii Penno et al [51] popsali negativní ovlivnění albuminurie vysokou dlouhodobou GV nezávisle na průměrné hodnotě HbA1c. Variabilita HbA1c byla prediktorem rozvoje makroalbuminurie a snížené glomerulární filtrace u pacientů v pokročilých stadiích diabetické nefropatie.
Diabetická neuropatie a dlouhodobá GV
Periferní polyneuropatie a autonomní diabetická neuropatie jsou častými komplikacemi DM a často se objevují již časně v jeho průběhu. Tyto komplikace často zůstávají nerozpoznány, někdy dokonce není ani proveden pokus je diagnostikovat a ani v klinických studiích nebývá obvykle zahrnuta neuropatie jako klinický cíl mezi mikrovaskulární komplikace. Částečně je to dáno subjektivní komponentou hodnocení senzitivní neuropatie a komplikovaným elektromyografickým testem.
Se stoupajícím zájmem o výzkum kardiovaskulární autonomní neuropatie (KAN) jako potenciální komplikace přispívající k náhlé smrti můžeme v budoucnu očekávat více dat o GV a diabetické neuropatii. Pro současný přehled jsme nalezli pouze 1 studii týkající se KAN a variability HbA1c u pacientů s DM2T, pro DM1T nejsou k dispozici žádná data. V této studii byla zkoumána krátkodobá i dlouhodobá GV u 110 pacientů, variabilita HbA1c ze 2 předcházejících let byla posouzena pomocí SD a CV. Multivariační analýza ukázala významnou nezávislou asociaci obou parametrů variability HbA1c s přítomností KAN a byla nezávisle spojená s její závažností [58].
Krátkodobá glykemická variabilita
Na našem pracovišti jsme zkoumali krátkodobou GV u pacientů s DM1T z dat získaných při 2týdenní CGM. Zjistili jsme, že glykemická variabilita hodnocená podle SD, CV a MAGE byla u pacientů s mikroangiopatií vyšší než u pacientů bez cévních změn [35]. Je důležité, že tato asociace nebyla nalezena, pokud byl jako zdroj dat použitý klasický selfmonitoring glykemie pomocí glukometru (graf).
Graf 1. Porovnání krátkodobé glykemické variability u pacientů s DM1T bez komplikací (NO, bílé sloupce) a s mikrovaskulárními komplikacemi (YES, černé sloupce). Upraveno podle [35] ![Porovnání krátkodobé glykemické variability u pacientů s DM1T bez komplikací (NO, bílé sloupce) a s mikrovaskulárními komplikacemi (YES, černé sloupce). Upraveno podle [35]](https://pl-master.mdcdn.cz/media/image/2a2b5fa7be3dac202e1525a7791e1f17.jpg?version=1537793178)
Diabetická retinopatie a krátkodobá GV
Diabetes mellitus 1. typu
U pacientů s DM1T ukazuje analýza studie DCCT, že ačkoliv intenzifikovaná léčba inzulinem snížila riziko rozvoje diabetické retinopatie o 73 % ve srovnání se standardní léčbou, vyšší hodnoty HbA1c a délka trvání DM vysvětluje pouze 11 % rizika diabetické retinopatie. To znamená, že musí existovat ještě další faktory nezávislé na HbA1c, které vysvětlí zbývajících 89 % [36]. Kilpatrick et al [38] nenalezli žádné spojení mezi retinopatií a krátkodobou GV ve studiu DCCT, nicméně GV byla vypočítána z 5–7bodových glykemických profilů, které pacienti prováděli každé 3 měsíce, což je dnes evidentně nedostačující. V naší nedávné observační průřezové studii u pacientů s DM1T [35] měla skupina pacientů s diabetickou retinopatií významně vyšší GV počítanou z dat CGM ve srovnání s pacienty bez retinopatie (p < 0,03), nicméně tento rozdíl nebyl patrný, pokud jsme GV počítali z dat selfmonitoringu pomocí glukometru a 4bodových denních záznamů glykemie. Podobně to platilo i pro ostatní mikrovaskulární komplikace.
Diabetes mellitus 2. typu
U pacientů s DM2T byla variabilita glykemie nalačno prediktorem rozvoje retinopatie ve studii Gimeno-Orna et al [42], zatímco ve studii VERONA nebyla nalezena žádná asociace glykemie nalačno s rozvojem nebo progresí retinopatie [43]. Dvě japonské studie z jednoho pracoviště nicméně potvrdily asociaci mezi variabilitou glykemie nalačno a proliferativní i neproliferativní retinopatie u pacientů s DM2T [45,46].
Diabetická nefropatie a krátkodobá GV
Diabetes mellitus 1. typu
U DM1T neexistuje dostatek dat týkajících se GV a diabetických komplikací. V naší již dříve zmiňované průřezové studii jsme popsali vyšší krátkodobou GV (SD, CV, MAGE) u pacientů s mikroalbuminurií ve srovnání s pacienty s normální exkrecí albuminu, přestože průměrná hodnota HbA1c byla v obou skupinách srovnatelná. GV byla počítána ze záznamu CGM, při výpočtu z hodnot selfmonitoringu se obě skupiny od sebe nelišily [35].
Diabetes mellitus 2. typu
U pacientů s DM2T byla popsána významně zvýšená albuminurie u pacientů s vyšší GV hodnocenou podle SD a MAGE, nicméně při použití CV nebyl nalezen významný rozdíl. V této studii také nebyl prokázán nezávislý vztah mezi GV a albuminurií u pacientů s neuspokojivě kompenzovaným DM [48]. Postprandiální kolísání glykemie a jeho vztah ke glomerulární hyperfiltraci u pacientů s nově zjištěným diabetem převážně 2. typu ve věku nad 40 let zkoumal Hou et al [49]. Autoři nalezli významnou korelaci mezi glomerulární hyperfiltrací a GV pouze u dobře kompenzovaných pacientů s HbA1c < 7 %, ale nikoliv u osob s horší kompenzací.
Diabetická neuropatie a krátkodobá GV
Diabetes mellitus 1. typu
V případě DM1T pozorovali během 11letého sledování Bragd et al [52] v observační studii, že krátkodobá GV hodnocená z dat získaných pomocí selfmonitoringu byla prediktorem prevalence periferní neuropatie. Zároveň byla GV hraničně významným prediktorem incidence neuropatie. V naší průřezové studii u pacientů s DM1T byla vyšší krátkodobá GV ve vztahu s porušeným vibračním čitím (VPT) měřeným pomocí bioteziometru. Ve stejné studii byl nalezen pozitivní vztah mezi porušeným VPT a vyšší GV (r = 0,51, p = 0,0026) [35].
Autonomní diabetická neuropatie je častou a podceňovanou komplikací DM. Je známo, že prodloužené vyprazdňování žaludku může u pacientů s diabetickou gastroparézou zvýšit GV [53]. Ukazuje se, že i naopak akutní kolísání glykemie může u pacientů s DM1T ovlivňovat motilitu žaludku [54]. Zvýšená GV v pásmu hypoglykemie hodnocená podle CGM, rovněž u pacientů s DM1T, byla nezávisle asociovaná s předčasnou ejakulací [55]. Mechanizmus tohoto jevu je nejasný, ale může být spojen se změnami v serotoninergní signalizaci [59]. Jako nepřímý marker kardiovaskulární autonomní neuropatie byla studována variabilita srdečního rytmu u 31 pacientů s DM. Mezi variabilitou R-R intervalu a různými parametry GV byl nalezen významný vztah jak ve dne, tak i v noci [56].
Diabetes mellitus 2. typu
Diabetická neuropatie je velmi častou komplikací DM2T a pacienti mají často porušené vibrační čití již v době diagnózy DM, ačkoliv jejich HbA1c je pouze mírně zvýšený. Krátkodobá GV byla zkoumána u pacientů s dobře kompenzovaným DM2T (HbA1c < 7 %), přičemž pacienti se známou neuropatií měli významně vyšší GV hodnocenou podle SD a MAGE ve srovnání s pacienty bez neuropatie [57]. V této studii byl MAGE pro diabetickou polyneuropatii nezávislým rizikovým faktorem. V jiné studii byla u pacientů s DM2T zkoumána krátkodobá GV ze 3 dnů CGM a dlouhodobá variabilita HbA1c ve vztahu ke KAN. Multivariační analýza ukázala významnou nezávislou asociaci krátkodobé GV s přítomností autonomní neuropatie [58].
Závěr
Riziko mikrovaskulárních komplikací DM souvisí s kompenzací diabetu a je ovlivněno také faktory genetickými, epigenetickými a faktory prostředí. Výsledky experimentálních a klinických studií naznačují, že kolísání glykemie se může na mechanizmech vedoucích k rozvoji cévního poškození rovněž podílet. Prospektivní randomizovaná klinická studie potvrzující GV jako nezávislý rizikový faktor diabetické mikroangiopatie však zatím chybí.
Z námi zpracovaného přehledu vyplývá, že existují poměrně silná data, která potvrzují vztah mezi zvýšenou variabilitou HbA1c a rozvojem a progresí diabetické retinopatie u pacientů s DM1T. U pacientů s DM2T neumožňují dostupná data tento nález potvrdit, na druhou stranu zde některé studie naznačují možné spojení mezi retinopatií a zvýšenou variabilitou glykemie nalačno. Tyto závěry jsou v souladu s přehledným článkem Hsu et al [60].
Několik studií ukazuje na určité spojení mezi variabilitou HbA1c a diabetickou nefropatií u pacientů s DM1T i DM2T, a to již velmi časně v průběhu sledování. U pacientů s DM1T to bylo pozorováním potvrzeno i u pediatrické populace. Data týkající se krátkodobé GV a nefropatie jsou však nedostačující a zejména opět chybí jakákoliv prospektivní studie u pacientů s DM1T.
Nenalezli jsme žádné studie porovnávající dlouhodobou GV a diabetickou neuropatii u pacientů s DM1T. U DM2T byla variabilita HbA1c asociovaná s přítomností a závažností KAN. Naopak krátkodobá glykemická variabilita byla ve vztahu s různými formami diabetické neuropatie u pacientů s DM1T i DM2T, což naznačuje, že nervový systém může být zejména citlivý k rychlému kolísání glykemie a hypoglykemii. Stejně jako v předchozích případech však nejsou k dispozici žádná prospektivní data založená na hodnocení CGM.
Významný přínos ve výzkumu krátkodobé glykemické variability budou mít prospektivní randomizované klinické studie. Studie FLAT-SUGAR je pilotní studií, která měla za cíl porovnání 2 terapeutických strategií ke snížení krátkodobé GV u pacientů s DM2T. Výsledky této pilotní studie ukázaly, že léčba agonistou receptoru pro GLP1 snížila hmotnost a GV. Dalšími cílovými ukazateli byly kardiovaskulární rizikové faktory, albuminurie a změny na EKG [61]. Tyto výsledky by měly pomoci naplánovat rozsáhlejší prospektivní studii zaměřenou na redukci GV a tato studie je z etického hlediska proveditelná, protože extrémně vysoká GV a velmi časté hypoglykemie se u moderně léčených pacientů s DM2T nevyskytují příliš často. Hodnocení krátkodobé GV a jejího možného vztahu k mikrovaskulárním komplikacím je u pacientů s DM1T výrazně komplikovanější. Jakýkoliv dlouhodobý výzkum vlivu krátkodobé GV u pacientů s DM1T by vyžadoval design tvořený 2 větvemi pacientů s podobnou kompenzací, ale odlišnou GV (vysokou a nízkou). Vysoká glykemická variabilita a extrémní kumulace hypoglykemií není u pacientů s DM1 nijak vzácná. Protože je dnes jasné, že následky hypoglykemií mohou být fatální, může být z etických důvodů jen těžko akceptovatelné vysokou GV neintervenovat a nesnažit se snížit výskyt hypoglykemií, i kdyby měla tato intervence proběhnout pouze pomocí cílené edukace a reedukace. Je tedy možné, že tento typ studie nebude nikdy u pacientů s DM1T proveden.
Publikace byla podpořena grantem AZV MZČR č. 15–26705A a výzkumným projektem P25/LF1/2 Univerzity Karlovy v Praze.
doc. MUDr. Martin Prázný, CSc., Ph.D.
mpra@lf1.cuni.cz
III. interní klinika 1. LF UK a VFN v Praze
www.int3.lf1.cuni.cz
Doručeno do redakce 4. 9. 2016
Přijato po recenzi 13. 10. 2016
Zdroje
1. Nathan DM, McGee P, Steffes MW et al. Relationship of glycated albumin to blood glucose and HbA(1c) values and to retinopathy, nephropathy and cardiovascular outcomes in the DCCT/EDIC study. Diabetes 2014; 63(1): 282–290. Dostupné z DOI: <http://dx.doi.org/10.2337/db13–0782>.
2. Saisho Y. Glycemic variability and oxidative stress: a link between diabetes and cardiovascular disease? Int J Mol Sci 2014; 15(10): 18381–18406. Dostupné z DOI: <http://dx.doi.org/10.3390/ijms151018381>.
3. Brownlee M. The pathobiology of diabetic complications – a unifying mechanism. Diabetes 2005; 54(6): 1615–1625.
4. El-Osta A, Brasacchio D, Yao DC et al. Transient high glucose causes persistent epigenetic changes and altered gene expression during subsequent normoglycemia. J Exp Med 2008; 205(10): 2409–2417. Dostupné z DOI: <http://dx.doi.org/10.1084/jem.20081188>. Erratum in J Exp Med 2008; 205(11): 2683.
5. Salisbury D, Bronas U. Reactive oxygen and nitrogen species. Impact on endothelial dysfunction. Nurs Res 2015; 64(1): 53–66. Dostupné z DOI: <http://dx.doi.org/10.1097/NNR.0000000000000068>.
6. Wang L, Wang J, Fang J et al. High glucose induces and activates Toll-like receptor 4 in endothelial cells of diabetic retinopathy. Diabetol Metab Syndr 2015; 7 : 89. Dostupné z DOI: <http://dx.doi.org/10.1186/s13098–015–0086–4>.
7. De NigrisV, Pujadas G, La Sala L et al. Short-term high glucose exposure impairs insulin signaling in endothelial cells. Cardiovasc Diabetol 2015; 14 : 114. Dostupné z DOI: <http://dx.doi.org/10.1186/s12933–015–0278–0>.
8. Monnier L, Mas E, Ginet C et al. Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes. JAMA 2006; 295(14): 1681–1687.
9. Zhang XG, Zhang YQ, Zhao DK et al. Relationship between blood glucose fluctuation and macrovascular endothelial dysfunction in type 2 diabetic patients with coronary heart disease. Eur Rev Med Pharmacol Sc 2014; 18(23): 3593–3600.
10. Ceriello A, Esposito K, Piconi L et al. Oscillating glucose is more deleterious to endothelial function and oxidative stress than mean glucose in normal and type 2 diabetic patients. Diabetes 2008; 57(5): 1349–1354. Dostupné z DOI: <http://dx.doi.org/10.2337/db08–0063>.
11. Schisano B, Tripathi G, McGee K et al. Glucose oscillations, more than constant high glucose, induce p53 activation and a metabolic memory in human endothelial cells. Diabetologia 2011; 54(5): 1219–1226. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–011–2049–0>.
12. Pena AS, Couper JJ, Harrington J et al. Hypoglycemia, but not glucose variability, relates to vascular function in children with type 1 diabetes. Diabetes Technol Ther 2012; 14(6): 457–462. Dostupné z DOI: <http://dx.doi.org/10.1089/dia.2011.0229>.
13. Ceriello A, Novials A, Ortega E et al. Hyperglycemia following recovery from hypoglycemia worsens endothelial damage and thrombosis activation in type 1 diabetes and in healthy controls. Nutr Metab Cardiovasc Dis 2014; 24(2): 116–123. Dostupné z DOI: <http://dx.doi.org/10.1016/j.numecd.2013.05.003>.
14. Kumar B, Kowluru A, Kowluru RA. Lipotoxicity augments glucotoxicity-induced mitochondrial damage in the development of diabetic retinopathy. Invest Ophthalmol Vis Sci 2015; 56(5): 2985–2992. Dostupné z DOI: <http://dx.doi.org/10.1167/iovs.15–16466>.
15. Yang HK, Kang B, Lee SH et al. Association between hemoglobin A1c variability and subclinical coronary atherosclerosis in subjects with type 2 diabetes. J Diabetes Complicat 2015; 29(6): 776–782. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jdiacomp.2015.04.008>.
16. Chang CH, Chuang LM. Glycated hemoglobin variability and retinopathy progression in type 1 diabetes: is month-to-month instability a better predictor? J Diabetes Investig 2014; 5(2): 149–152. Dostupné z DOI: <http://dx.doi.org/10.1111/jdi.12147>.
17. Cheng DS, Fei Y, Liu Y et al. HbA1c variability and the risk of renal status progression in diabetes mellitus: a meta-analysis. PLoS One 2014; 9(12): e115509. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0115509>.
18. Kohnert KD, Heinke P, Vogt L et al. Utility of different glycemic control metrics for optimizing management of diabetes. World J Diabetes 2015; 6(1): 17–29. Dostupné z DOI: <http://dx.doi.org/10.4239/wjd.v6.i1.17>.
19. Service FJ. Glucose variability. Diabetes 2013; 62(5): 1398–1404. Dostupné z DOI: <http://dx.doi.org/10.2337/db12–1396>.
20. Saisho Y, Tanaka C, Tanaka K et al. Relationships among different glycemic variability indices obtainedby continuous glucose monitoring. Primary Care Diabetes 2015; 9(4): 290–296. Dostupné z DOI: <http://dx.doi.org/10.1016/j.pcd.2014.10.001>.
21. Fabris C, Facchinetti A, Sparacino G et al. Glucose variability indices in Type 1 diabetes: parsimonious set of indices revealed by Sparse Principal Component Analysis. Diabetes Technol Ther 2014; 16(10): 644–652. Dostupné z DOI: <http://dx.doi.org/10.1089/dia.2013.0252>.
22. Selvin E, Rawlings AM, Grams M et al. Association of 1,5-anhydroglucitolwith diabetes and microvascular conditions. Clin Chem 2014; 60(11): 1409–1418. Dostupné z DOI: <http://dx.doi.org/10.1373/clinchem.2014.229427>.
23. Ceriello A, Novials A, Ortega E et al. Vitamin C further improves the protective effect of glucagonlike peptide-1 on acute hypoglycemia-induced oxidative stress, inflammation, and endothelial dysfunction in Type 1 diabetes. Diabetes Care 2013; 36(12): 4104–4108. Dostupné z DOI: <http://dx.doi.org/10.2337/dc13–0750>. Erratum in Diabetes Care 2014; 37(7): 2063.
24. Yousetzade G, Nakhaee A. Insulin-induced hypoglycemia and stress oxidative state in healthy people. Acta Diabetol 2012; 49(Suppl 1): S81-S85. Dostupné z DOI: <http://dx.doi.org/10.1007/s00592–011–0311-z>.
25. Wang JL, Alexanian A, Ying R et al. Acute exposure to low glucose rapidly induces endothelial dysfunction and mitochontrial oxidative stress role for AMP kinase. Arterioscler Thromb Vasc Biol 2012; 32(3): 712–720. Dostupné z DOI: <http://dx.doi.org/10.1161/ATVBAHA.111.227389>.
26. Jaiswal M, McKeon K, Comment N et al. Association between impaired cardiovascular autonomic function and hypoglycemia in patients with Type 1 diabetes. Diabetes Care 2014; 37(9): 2616–2621. Dostupné z DOI: <http://dx.doi.org/10.2337/dc14–0445>.
27. Hirsch IB. Glycemic variability and diabetes complications: does it matter? Of course it does! Diabetes Care 2015; 38(8): 1610–1614. Dostupné z DOI: <http://dx.doi.org/10.2337/dc14–2898>.
28. Rodbard D. Evaluating quality of glycemic control: graphical displays of hypo - and hyper-glycemia, time in target range, and mean glucose. J Diabetes Sci Technol 2015; 9(1): 56–62. Dostupné z DOI: <http://dx.doi.org/10.1177/1932296814551046>.
29. Ceriello A, Kilpatrick ES. Glycemic variability: both sides of the story. Diabetes Care 2013; 36(Suppl 2): S272-S275. Dostupné z DOI: <http://dx.doi.org/10.2337/dcS13–2030>.
30. Bergenstal RM. Glycemic variability and diabetes complications: does it matter? Simply put, there are better glycemic markers! Diabetes Care 2015; 38(8): 1615–1621. Dostupné z DOI: <http://dx.doi.org/10.2337/dc15–0099>.
31. Cryer PE. Severe hypoglycemia predicts mortality in diabetes. Diabetes Care 2012; 35(9): 1814–1816. Dostupné z DOI: <http://dx.doi.org/10.2337/dc12–0749>.
32. Niskanen L, Virkamäki A, Hansen JB et al. Fasting plasma glucose variability as a marker of nocturnal hypoglycemia in diabetes: evidence from the PREDICTIVE study. Diabetes Res Clin Pract 2009; 86(2): e15-e18. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2009.08.005>.
33. Cryer PE. Hypoglycemia: still the limiting factor in the glycemic management of diabetes. Endocr Pract 2008; 14(6): 750–756.
34. Smith-Palmer J, Brändle M, Trevisan R et al. Assessment of the association between glycemic variability and diabetes-related complications in type 1 and type 2 diabetes. Diabetes Res Clin Pract 2014; 105(3): 273–284. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2014.06.007>.
35. Šoupal J, Škrha J Jr, Fajmon M et al. Glycemic variability is higher in type 1 diabetes patients with microvascular complications irrespective of glycemic control. Diabetes Technol Ther 2014; 16(4): 198–203. Dostupné z DOI: <http://dx.doi.org/10.1089/dia.2013.0205>.
36. Lachin JM, Genuth S, Nathan DM et al. Effect of glycemic exposure on the risk of microvascular complications in the diabetes control and complications trial revisited. Diabetes 2008; 57(4): 995–1001. Dostupné z DOI: <http://dx.doi.org/10.2337/db07–1618>.
37. Gorst C, Kwak CS, AslamS et al. Long-term glycemic variability and risk of adverse outcomes:a systematic review and meta-analysis. Diabetes Care 2015; 38(12): 2354–2369. Dostupné z DOI: <http://dx.doi.org/10.2337/dc15–1188>.
38. Kilpatrick ES, Rigby AS, Atkin SL. The effect of glucose variability on the risk of microvascular complications in type 1 diabetes. Diabetes Care 2006; 29(7): 1486–1490.
39. Kilpatrick ES, Rigby AS, Atkin SL. A1C variability and the risk of microvascular complications in type 1 diabetes: data from the Diabetes Control and Complications Trial. Diabetes Care 2008; 31(11): 2198–2202. Dostupné z DOI: <http://dx.doi.org/10.2337/dc08–0864>.
40. Hermann JM, Hammes HP, Rami-Mehar B et al. HbA1c variability as an independent risk factor for diabetic retinopathy in Type 1 diabetes: A German/Austrian multicenter analysis on 35,891 patients. PLoS One 2014; 9(3): e91137. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0091137>.
41. Hietala K, Waden J, Forsblom C et al. HbA1c variability is associated with an increased risk of retinopathy requiring laser treatment in type 1 diabetes. Diabetologia 2013; 56(4): 737–745. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–012–2816–6>.
42. Gimeno-Orna JA, Castro-Alonso FJ, Boned-Juliani B et al. Fasting plasma glucose variability as a risk factor of retinopathy in type 2 diabetic patients. J Diabetes Complicat 2003; 17(2): 78–81.
43. Zoppini G, Verlato G, Targher G et al. Is fasting glucose variability a risk factor for retinopathy in people with type 2 diabetes? Nutr Metab Cardiovasc Dis 2009; 19(5): 334–339. Dostupné z DOI: <http://dx.doi.org/10.1016/j.numecd.2008.02.007>.
44. Hirakawa Y, Arima H, Zoungas S et al. Impact of visit-to-visit glycemic variability on the risks of macrovascular and microvascular events and all-cause mortality in type 2 diabetes: the ADVANCE trial. Diabetes Care 2014; 37(8): 2359–2365. Dostupné z DOI: <http://dx.doi.org/10.2337/dc14–0199>.
45. Takao T, Ide T, Yanagisawa H et al. The effect of fasting plasma glucose variability on the risk of retinopathy in type 2 diabetic patients: retrospective long-term follow-up. Diabetes Res Clin Pract 2010; 89(3): 296–302. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2010.03.027>.
46. Takao T, Ide T, Yanagisawa H et al. The effects of fasting plasma glucose variability and time dependent glycemic control on the long-term risk of retinopathy in type 2 diabetic patients. Diabetes Res Clin Pract 2011; 91(2): e40-e42. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2010.10.009>.
47. Nazim J, Fendler W, Starzyk J. Metabolic control and its variability are major risk factors for microalbuminuria in children with type 1 diabetes. Endokrynol Pol 2014; 65(2): 83–89. Dostupné z DOI: <http://dx.doi.org/10.5603/EP.2014.0012>.
48. Jin SM, Kim TH, Baek SOJ et al. Association between the extent of urinary albumin excretion and glycaemic variability indices measured by continuous glucose monitoring. Diabet Med 2015; 32(2): 274–279. Dostupné z DOI: <http://dx.doi.org/10.1111/dme.12607>.
49. Hou X, Wang C, Wang S et al. Fluctuation between fasting and 2-H postload glucose state is associated with glomerular hyperfiltration in newly diagnosed diabetes patients with HbA1c, 7%. PLoS One 2014; 9(10):e111173. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0111173>.
50. Hsu CC, Chang HY, Huang MC et al. HbA1c variability is associated with microalbuminuria development in type 2 diabetes: a 7-year prospective cohort study. Diabetologia 2012; 55(12): 3163–3172. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–012–2700–4>.
51. Penno G, Solini A, Bonora E et al. HbA1c variability as an independent correlate of nephropathy, but not retinopathy, in patients with type 2 diabetes. The Renal Insufficiency And Cardiovascular Events (RIACE) Italian multicenter study. Diabetes Care 2013; 36(8): 2301–2310. Dostupné z DOI: <http://dx.doi.org/10.2337/dc12–2264>.
52. Bragd J, Adamson U, Bäcklund LB et al. Can glycaemic variability, as calculated from blood glucose selfmonitoring,predict the development of complications in type 1 diabetes over a decade? Diabetes Metab 2008; 34(6 Pt 1): 612–616. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabet.2008.04.005>.
53. Sharma D, Morrison G, Joseph F et al. The role of continuous subcutaneous insulin infusion therapy in patients with diabetic gastroparesis. Diabetologia 2011; 54(11): 2768–2770. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–011–2282–6>.
54. Samsom M, Akkermans LM, Jebbink RJ et al. Gastrointestinal motor mechanisms in hyperglycaemia induced delayed gastric emptying in type I diabetes mellitus. Gut 1997; 40(5): 641–646.
55. Bellastella G, Maiorino MI, Olita L et al. Premature ejaculation is associated with glycemic control in Type 1 diabetes. J Sex Med 2015; 12(1): 93–99. Dostupné z DOI: <http://dx.doi.org/10.1111/jsm.12755>.
56. Iwasaki S, Kozawa J, Fukui K et al. Coefficient of variation of R-R interval closely correlates with glycemic variability assessed by continuous glucose monitoring in insulin-depleted patients with type 1 diabetes. Diab Res Clin Pract 2015; 109(2): 397–403. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2015.05.021>.
57. Xu F, Zhao L, Su J et al. The relationship between glycemic variability and diabetic peripheral neuropathy in type 2 diabetes with well-controlled HbA1c. Diabet Metab Syndr 2014; 6(1): 139. Dostupné z DOI: <http://dx.doi.org/10.1186/1758–5996–6-139>.
58. Jun JE, Jin SM, Baek J et al. The association between glycemic variability and diabetic cardiovascular autonomic neuropathy in patients with type 2 diabetes. Cardiovasc Diabetol 2015; 14 : 70. Dostupné z DOI: <http://dx.doi.org/10.1186/s12933–015–0233–0>.
59. Martín-Cora FJ, Fornal CA, Metzler CW et al. Insulin induced hypoglycemia decreases single-unit activity of serotonergic medullary raphe neurons in freely moving cats: relationship to sympathetic and motor output. Eur J Neurosci 2002; 16(4): 722–734.
60. Hsu CR, Chen YT, Sheu WH. Glycemic variability and diabetes retinopathy: a missing link. J Diabetes Complicat 2015; 29(2): 302–306. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jdiacomp.2014.11.013>.
61. Probstfield JL, Hirsch I, O’Brien K et al. [The FLAT-SUGAR Trial investigators]. Design of FLAT-SUGAR: Randomized trial of prandial insulin versus prandial GLP-1 receptor agonist together with basal insulin and metformin for high-risk Type 2 diabetes. Diabetes Care 2015; 38(8): 1558–1566. Dostupné z DOI: <http://dx.doi.org/10.2337/dc14–2689>.
62. Kuricová K, Pácal L, Šoupal J et al. Effect of glucose variability on pathways associated with glucotoxicity in diabetes: Evaluation of a novel in vitro experimental approach. Diabetes Res Clin Pract 2016; 114 : 1–8. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2016.02.006>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo Suppl 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Metabolit živočišné stravy produkovaný střevní mikroflórou zvyšuje riziko závažných kardiovaskulárních příhod
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Je glukóza pouze základní energetický substrát?
- Súčasné trendy v diagnostike a liečbe kongenitálneho hyperinzulinizmu
- Máme uvažovat o nové klasifikaci diabetu ovlivněné terapeutickým rozhodováním?
- Diabetes mellitus ve starším věku z pohledu klinického diabetologa
- Adaptace tukové tkáně na redukční nízkoenergetickou dietu u obézních jedinců
- Heterogenita dětského diabetu a její terapeutické implikace
- Historie diagnostiky a léčby diabetické retinopatie
- Frekvence a načasování jídel a změny v body mass indexu: analýza dat z Adventist Health Study-2
- Edukace pacienta s diabetem – součást komplexní terapie
- Pregestační diabetes mellitus a gravidita
- Michal Anděl slaví sedmdesátku!
- Bariatrické operace u nemocných s diabetem
- Duše jako imunomodulátor
- Syndrom diabetické nohy z pohledu internisty podiatra
- Komplex oxLDL/β2-glykoprotein I jako proaterogenní autoantigen. Je ateroskleróza autoimunitní onemocnění?
- Gestační diabetes mellitus
- Růstový hormon, osa GH-IGF1 a metabolizmus glukózy
- Perspektivní molekuly pro léčbu hyperglykemie u pacientů s diabetem 2. typu
- Vrozený hyperinzulinizmus: když B-buňka ztratí sebekontrolu…
- Obstrukční spánková apnoe a diabetes mellitus 2. typu
- Metabolický syndrom u nemocných s diabetes mellitus 1. typu, prevalence, vliv na morbiditu a mortalitu, komplexní přístup k nemocnému
- Krátkodobá a dlouhodobá glykemická variabilita a její vztah k mikrovaskulárním komplikacím diabetu
- Složení makronutrientů v diabetické dietě
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Vrozený hyperinzulinizmus: když B-buňka ztratí sebekontrolu…
- Gestační diabetes mellitus
- Růstový hormon, osa GH-IGF1 a metabolizmus glukózy
- Edukace pacienta s diabetem – součást komplexní terapie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



